α-TCP、硅酸盐和磷酸化氨基酸的组合物的制作方法
本发明涉及α-tcp、硅酸盐化合物和磷酸化氨基酸的组合物,其中该组合物可用作粘合剂或植入物。本发明还涉及一种治疗组织的方法和试剂盒。
背景技术:
磷酸钙(cap),特别是羟基磷灰石(ca10(po4)6(oh)2,ha),是一种广泛用于医疗应用的矿物,因为它与骨和牙齿的矿物成分及其生物相容性相似。此外,羟基磷灰石是无毒、生物相容和生物活性的。这意味着羟基磷灰石无害并且不会被认为是外来物,另一方面它可能对骨的重塑具有积极作用。因此,羟基磷灰石已被广泛用于骨修复和药物/基因递送载体、催化剂、离子吸附/交换剂、光电试剂等。可再吸收的纳米颗粒(即可在体内溶解的颗粒)对于许多应用是人们特别感兴趣的,例如,骨空隙填料、给药载体、牙本质小管脱敏等。
生物材料领域包括将植入物固定到组织以及组织修复。植入物与粘合剂的组合的有限机械强度仍然是植入物和生物材料领域中的问题。用粘合剂修复软组织或内脏也已大致不成功。
us2012288446(us′446)公开了一种粘合剂,其包含多价金属化合物、含磷酸丝氨酸低聚物或磷酸丝氨酸封端聚合物的化合物,其中后一化合物以10-90wt%存在。us′446公开了例如使用磷酸四钙(ttcp)作为多价金属化合物和磷酸丝氨酸-乙二醇-二缩水甘油基-磷酸丝氨酸的实验数据,并且当粘附到骨上时获得高达3.76mpa的粘合强度。
us20130122057(us′057)公开了一种骨修复组合物,其包含氨基酸磷酸盐物质、多价金属化合物和含有离子官能团的生物活性玻璃材料。us′057公开了使用包含ttcp作为多价金属化合物和磷酸丝氨酸以及各种量的combeite生物活性玻璃(combeitebioactiveglass)和水的组合物并将其粘附到骨上的实施例。获得的剪切强度在0.75-2.13mpa之间变化。
us8765189(us′189)教导了一种粘合剂组合物,其包含10-90wt%的多价金属化合物和磷酸丝氨酸样化合物。us′189公开了当使用ttcp作为多价金属化合物和各种磷酸化化合物对皮质骨(corticalbone)5分钟后的粘附剪切强度为130-880kpa,而当使用α-tcp和磷酸丝氨酸时为650kpa。
尽管目前市场上有几种组织粘合剂,但它们都不是理想的密封剂或粘合剂。氰基丙烯酸酯显示出良好的粘附性,但在降解过程中显示出炎症反应。纤维蛋白胶具有低粘合强度但更具生物相容性。其他粘合剂困于高成本和长固化时间,或者缺乏根据组织和情况调整固化时间。软组织粘合剂通常含有纤维蛋白或明胶等各种多糖。
粘合剂仍然不能承受任何主要的剪切力,并且它们都没有显示或暗示它们也可以在软组织上起作用。因此,需要一种组合物,其可以用作组织粘合剂,特别是用于软组织其也提供高剪切强度。
技术实现要素:
本发明的目的是克服现有技术的缺点。因此,在第一方面,本发明涉及水性组合物,其包含水溶液、硅酸盐化合物、α-tcp和磷酸化氨基酸;其中磷酸化氨基酸的量为固体含量的15-90wt%,并且其中硅酸盐化合物和α-tcp的重量比为1∶0.001-100。
在第二方面,本发明涉及生物组织粘合剂。
在第三方面,本发明涉及骨填料。
在第四方面,本发明涉及牙科植入物。
在第五方面,本发明涉及该水性组合物用于将软组织粘附到硬组织或软组织上的用途。
在第六方面,本发明涉及该水性组合物用于将植入物或支架粘附到组织上的用途,其中植入物或支架由金属、聚合物材料、陶瓷或组织衍生产品(例如胶原、基质胶、自体血、富含血小板的血浆或脱矿质骨)制成。
在第八方面,本发明涉及该水性组合物用于加强密封或修复组织的用途。
在第九方面,本发明涉及使用根据本发明的组织粘合剂将第一组织粘附到第二表面的方法,包括:
a.将根据本发明的组织粘合剂施加到第一组织或第二表面上并任选地将其留置合适的时间段;
b.使第一组织和第二表面彼此接触;
c.任选地在第一和第二组织上施加压力一段合适的时间;和
d.让组织粘合剂固化。
在第十方面,本发明涉及用于制备根据本发明的组合物的试剂盒,其包含至少两个容器,其中试剂盒中的任何一个容器可含有水溶液,磷酸化氨基酸,硅酸盐化合物或α-tcp中的任一者或其组合,但条件是磷酸化氨基酸和α-tcp不能作为水溶液存在于同一容器中;并且其中容器中水溶液,磷酸化氨基酸,硅酸盐化合物和α-tcp的量使得混合时可获得根据本发明的组合物。
在第十一方面,本发明涉及一种注射器,其包括至少两个隔室,其中注射器中的任何一个隔室可包含水溶液、磷酸化氨基酸、硅酸盐化合物或α-tcp中的任一者或其组合,但条件是磷酸化氨基酸和α-tcp不能作为水溶液存在于同一隔室中;并且其中所述隔室中的水溶液、磷酸化氨基酸、硅酸盐化合物和α-tcp的量使得混合时可获得根据本发明的组合物;并且其中注射器还包括混合装置,该混合装置被构造成混合至少两个隔室的组分。
本文提出的所有实施方案涉及本发明的所有方面。
附图说明
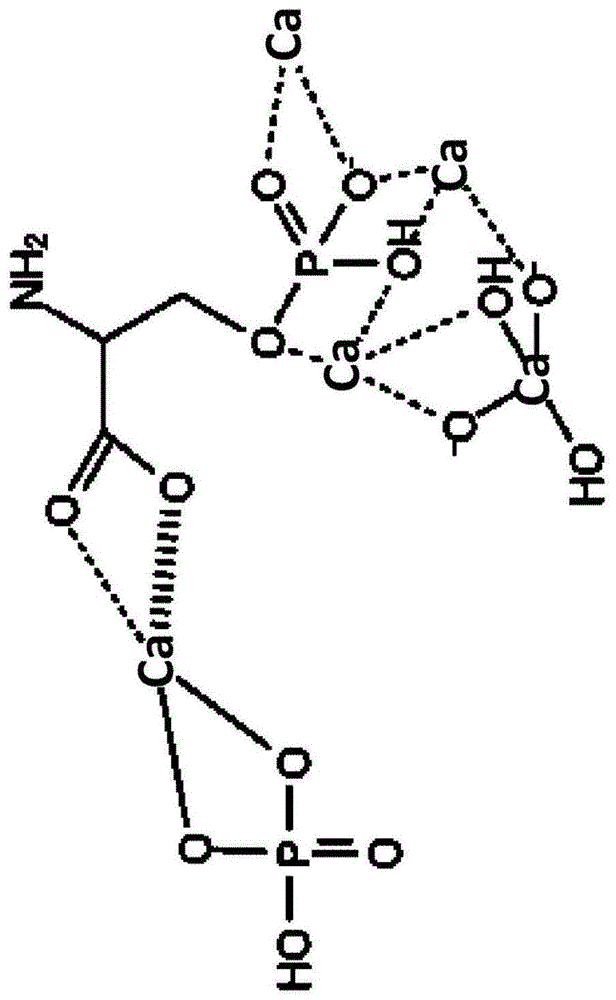
图1为钙-磷酸丝氨酸相互作用的化学结构示意图。
图2为化学成分图表(硬组织)。在磷酸盐缓冲盐水中,37℃下24小时后皮质剪切(用于骨对骨粘附)。
图3a-d为用于骨对骨粘附的图2中所示区域a-d的放大。
图4为化学成分图表(软组织)。在100%湿度,37℃下1.5小时后皮肤搭接剪切(软组织对软组织粘附)。
图5a-c为用于金属对金属粘附的化学成分表,在本案例中是铝。在37℃下在磷酸盐缓冲盐水中固化24小时。这些放大图显示区域的剪切峰值,该区域对应于图3所示的区域b-d用于骨对骨粘附的区域。
图6为混合硅酸盐制剂a(25wt%pser,58wt%α-tcp和17wt%波特兰灰粘固剂(portlandgreycement)(固体含量%)与17%液体(总wt%))的固化时间。皮质剪切固化时间(在21℃的蒸馏水中固化),力被标准化为在24小时的强度。
图7为混合硅酸盐制剂b(56wt%pser,35wt%atcp和9wt%波特兰白粘固剂(portlandwhitecement)(固体含量%)与17%液体(总wt%))(软组织)的固化时间。皮肤剪切固化时间(21℃在100%湿度下固化),力被标准化为在1.5小时的强度。
图8为根据水含量、波特兰灰粘固剂(硅酸二钙和硅酸三钙的混合物,其中主要组分是sio2(19.5%)、al2o3(5.2%)和cao(63.9%))(硬组织)的粘合强度。随增加的水含量的皮质剪切强度(在21℃的蒸馏水中固化),力标准化为在最低水含量下的强度。
图9为根据水含量、波特兰灰粘固剂(软组织)的粘合强度。随增加的水含量的皮质剪切强度(21℃在100%湿度下固化),力标准化为在最低水含量下的强度。
图10为未混合的和波特兰灰粘固剂(硬组织)的粘合强度(剪切)。混合硅酸钙、硅酸三钙或硅酸二钙的皮质剪切强度(24小时,100%湿度,21℃)。
图11为波特兰白粘固剂(硅酸二钙和硅酸三钙的混合物,其中主要成分为sio2(24.5%)、al2o3(2.1%)和cao(69.1%))的自组织粘合强度(搭接剪切)(软组织)。软组织的搭接剪切强度(在37℃下90分钟的固化时间)粘附于自组织类型。粘合强度大于肝脏和心脏的组织粘合力,如“>”符号所示,表明精确度受到组织-器械粘合的失效强度的限制(粘合剂粘合结合失效前固定装置的组织撕裂)。粘合剂配方包括混合硅酸钙。
图12为波特兰灰粘固剂(硬组织)的自组织粘合强度(剪切)。使用混合硅酸钙的硬组织剪切强度(24小时,100%湿度,21℃)。
图13为根据液体/溶剂类型的波特兰灰粘固剂(硬组织)的粘附(剪切)强度。液体类型对皮质骨固化强度的影响(剪切试验,混合硅酸盐制剂,在21℃蒸馏水中24小时固化)。
图14a为在松质骨增强模型(硬组织)中的波特兰灰粘固剂和螺钉的拔出力。来自增强的松质骨矫形螺钉的拔出力(在21℃,100%湿度,24小时固化)。
图14b为波特兰灰粘固剂在松质骨切割剪切(硬组织)中的界面剪切(推出)力(在21℃,100%湿度,2小时固化)。
图15为使用波特兰灰粘固剂(硅酸二钙和硅酸三钙的混合物)(硬组织)的皮质骨与常用生物材料的粘附强度。在20-80%磷酸丝氨酸(wt%)的范围内测试的各种离子盐与磷酸丝氨酸的反应性。
图16为通过柠檬酸钠(sc)或柠檬酸(ca)延迟波特兰灰粘固剂的工作时间。
图17为通过筛分测定的粉末的粒度分布。
图18为暴露于浸出提取物后人成纤维细胞的存活。
具体实施方式
在本申请中,术语“水溶液”还包括水和任何纯度的水。水可以是但不限于自来水、蒸馏水或去离子水。水溶液也可以是缓冲液,例如pbs或任何合适的含盐缓冲液。
组成
根据本发明的组合物是水性组合物,其包含水溶液、α-tcp、硅酸盐化合物和磷酸化氨基酸。
本发明人发现该组合物提供了改进的机械强度并且易于处理。该组合物还显示出不仅适合于将软组织粘附到硬组织或合成植入物或支架上,而且适合于将软组织粘附到软组织上。后者是本领域中长期需要的,并且本发明不仅促进软组织粘附到软组织,而且粘合的机械强度出乎意料地高。
令人惊讶的是,本发明人发现本组合物的改进仅适用于α-tcp而不适用于β-tcp。α-tcp可以以任何形式或形状使用,但优选为平均粒度为5-5000nm的粉末形式,例如20nm或更大、50nm或更大、100nm或更大、或300nm或更大、或500nm或更大、或800nm或更大、或3000nm或更小、或1500nm或更小、或1000nm或更小。颗粒可以是球形或薄片形状。
硅酸盐化合物可以以任何形式或形状使用,但优选为平均粒度为5-5000nm的粉末形式,例如20nm或更大、50nm或更大、100nm或更大、或300nm或更大、或500nm或更大、或800nm或更大、或3000nm或更小、或1500nm或更小、或1000nm或更小。优选地,α-tcp和硅酸盐化合物的尺寸相似,以避免沉降。
不受理论束缚,据信硅酸盐化合物与α-tcp组合增加了所形成材料的机械强度。硅酸盐化合物还使得更容易定制固化时间,因为存在多种形式的硅酸钙,每种形式具有不同的反应速度和处理性质。例如,三钙形式的硅酸钙反应非常快,而二钙形式的反应速度要慢得多,据报道它对长期固化强度的贡献更大。硅酸单钙(偏硅酸盐)反应非常缓慢,以至于不容易辨别反应。每种形式的处理属性也不同。许多硅酸盐形式的混合物可以产生最佳的处理和反应速度,这是使用单一硅酸盐相可能难以或不可能获得的。或者,添加更多水溶液可以减缓反应,部分原因是溶解度的变化。图10显示了不同硅酸钙的剪切强度。
硅酸盐化合物可以是任何合适的包含硅酸盐(即阴离子硅化合物)的化合物。硅化合物可以是诸如[sio4]2-或[si2o7]6-的氧化物或石英、长石、沸石、云母、辉石等。在一个实施方案中,硅酸盐化合物选自硅酸钙、硅酸钠和硅酸铝,硅酸镁、硅酸锶;硅酸锆;或硅酸二钙和硅酸三钙的混合物,优选硅酸钙。硅酸盐可以是粘固剂形式,例如波特兰灰粘固剂(portlandgreycement)或波特兰白粘固剂(portlandwhitecement)。硅酸二钙和硅酸三钙的混合物可包含0-100wt%的硅酸二钙和0-100wt%的硅酸三钙,例如30-70wt%的硅酸二钙和30-70wt%的硅酸三钙。图10中公开了使用不同硅酸盐化合物的测试。图15显示仅α-tcp和硅酸二盐和硅酸三盐与磷酸丝氨酸一起显示任何粘合反应。
硅酸盐化合物和α-tcp的量可以是组合物固体含量的10-85wt%。在一个实施方案中,该量为20-50wt%,例如25-40wt%。在另一个实施方案中,该量为50-85wt%,例如60-80wt%。该量取决于应用和组织。硅酸盐化合物和α-tcp的重量比应为1∶0.001-100(硅酸盐化合物:α-tcp)。本发明人已发现最佳重量比取决于组织或应用。在一个实施方案中,重量比为1∶0.05-15。在另一个实施方案中,重量比为1∶0.05-0.4,例如1∶0.1-0.3。在另一个实施方案中,重量比为1∶5-20,例如1∶9-15。在另一个实施方案中,重量比为1∶1-4,例如1∶1.5-3.5。在另一个实施方案中,重量比为1∶15-25。
磷酸化是向氨基酸或任何其他分子中添加磷酸基团(po43-)。根据本发明的磷酸化氨基酸可以是例如磷酸化的丝氨酸、苏氨酸或酪氨酸,但也可以是其他氨基酸。在一个实施方案中,磷酸化氨基酸是磷酸化丝氨酸,也称为磷酸丝氨酸(pser)。根据本发明的磷酸化氨基酸可以是官能化的或非官能化的。根据本发明的磷酸化氨基酸可以是单体或二聚体或三聚体。
据信磷酸化氨基酸作为固化剂为组合物提供改善的机械强度。磷酸化氨基酸的量应为组合物固体含量的15-90wt%。为了平衡组合物内在组分的不同性质,磷酸化氨基酸的量可取决于硅酸盐化合物和α-tcp之间的比例。在一个实施方案中,优选量的磷酸化氨基酸为15-50wt%,例如22wt%或更多、或25wt%或更多、或30wt%或更多、但45wt%或更少、或40wt%或更少、或35wt%或更少,例如20-40wt%或22-35wt%。在一个实施方案中,当硅酸盐化合物和α-tcp的比例为1∶5-15时,使用该优选量的磷酸化氨基酸。在一个实施方案中,该量为22-30wt%。在另一个实施方案中,优选的量为30-75wt%,例如35wt%或更多、或40wt%或更多、或45wt%或更多,但65wt%或更少、或60wt%或更少、或55wt%或更少。当硅酸盐化合物和α-tcp的比例为1∶0.05-0.4时,可以使用后一种优选量的磷酸化氨基酸。
组合物可包含任何合适量的水溶液,例如组合物总重量的5-95wt%,例如10wt%或更多、或15wt%或更多、或20wt%或更多,或者,或90wt%或更少、或80wt%或更少、或70wt%或更少、或60wt%或更少、或50wt%或更少、或40wt%或更少、或30wt%或更少、或25wt%或更少。水含量的影响如图7和8所示。水可以是蒸馏水或去离子水或任何高纯度的水,但也可以使用自来水,图13。水溶液也可以是水凝胶的形式,例如透明质酸、聚乙烯醇、脱乙酰壳多糖、胶原或其组合。通过使用水凝胶作为水溶液,组合物可以在固化期间更容易地保留在所需位置。
本发明的一个优点是可以调整固化时间,使其在适当的时刻固化。这取决于应用。有时组合物应该非常快速地固化,有时组合物应该混合或成形一段时间,并且当施用时可能需要一些调整,因此应该推迟固化。
对于软组织,可以使用包含水溶液、α-tcp、硅酸盐化合物和磷酸化氨基酸的组合物,其中水溶液的量为组合物总重量的10-30wt%。组合物中硅酸盐化合物与α-tcp之间的重量比为1∶0.1-10并且其中磷酸化氨基酸的量为固体含量的50-85wt%。如图4所示,该组合物对软组织具有良好的粘附性。
对于硬组织,可以使用包含水溶液、α-tcp、硅酸盐化合物和磷酸化氨基酸的组合物,其中水溶液的量为组合物总重量的10-30wt%。硅酸盐化合物与α-tcp之间的重量比为1∶1-50,并且其中磷酸化氨基酸的量为固体含量的20-50wt%。该组合物对硬组织提供良好的粘附性,如图2、图3a-d和表2所示。基于诸如最终粘合强度(剪切强度)、可加工性和骨粘合应用中的固化时间的标准,对于包含以下组成的组合物获得特别好的结果:
28-39wt%磷酸化氨基酸(磷酸丝氨酸)和61-72wt%硅酸盐和α-tcp,并且其中硅酸盐化合物和α-tcp之间的重量比为82-92wt%(图2中的a区域,图3a-d和表2);
40-48wt%磷酸化氨基酸(磷酸丝氨酸)和52-60wt%硅酸盐和α-tcp,并且其中重量比为28-33wt%硅酸盐(图2中标记为b的区域,图3a-d和表2);
22-28wt%磷酸化氨基酸(磷酸丝氨酸)和72-78wt%硅酸盐和α-tcp,并且其中重量比为28-33wt%硅酸盐(图2中标记为c的区域,图3a-d和表2);
23-29%磷酸化氨基酸(磷酸丝氨酸)和71-77wt%硅酸盐和α-tcp,并且其中重量比为2-6wt%硅酸盐(图2中标记为d的区域,图3a-d和表2)。
获得峰值剪切值:
·a:31.6%pser,88.6%硅酸盐/tcp比率
·b:44.7%pser,29.6%硅酸盐/tcp比率
·c:24.8%pser,22.4%硅酸盐/tcp比率
·d:26.7%pser,4.5%硅酸盐/tcp比率。
所有配方可在15-60秒内混合并施用,并在24小时内达到高粘合(剪切)强度。
包含25-50wt%磷酸化氨基酸并且其中硅酸盐化合物和α-tcp之间的重量比为约1∶0.8-4的组合物已显示对软组织和硬组织都有效。当要将软组织粘合或粘附到硬组织上时,例如肌腱到骨,或韧带到骨,这可能是非常令人关注的。
对于金属对金属粘合剂,可在与骨对骨粘合剂相似组分浓度获得最佳剪切值,如在图5a-c中区域b-c中所示。对于区域a,金属对金属的测试并未完全完成,但初步测试表明,在金属对金属的区域a和骨对骨之间也可以看到峰值剪切值和成分之间相同类型的相关性。
所有配方可在15-60秒内混合并施用,并在1小时内达到高粘合(剪切)强度。
可以将诸如柠檬酸钠的阻滞剂添加到反应混合物中,并且其量可以是组合物总重量的1-10wt%(固体含量)或0.8-8wt%。在一个实施方案中,阻滞剂的量为固体含量的3.5-7wt%。阻滞剂可以是但不限于柠檬酸钠或柠檬酸。优选地,阻滞剂是液体形式。在这种情况下,它将取代液体,即不是固体含量的一部分。总质量约为9%及以下。因此,阻滞剂不超过总质量的10%。阻滞剂的量低至2-3%也有效,但4-6%是优选范围。
该组合物可进一步包含添加剂,例如生长因子、营养素、抗氧化剂等。但该组合物在没有阻滞剂和添加剂的情况仍起作用,并且在一个实施方案中,组合物的至少95wt%的固体含量包含α-tcp、磷酸化的氨基酸和硅酸盐化合物,例如至少98wt%,或至少99wt%。
制备和固化组合物
通过将固体组分硅酸盐化合物、α-tcp和磷酸化氨基酸与水溶液混合来形成组合物。
可以通过预混合硅酸盐、磷酸丝氨酸(pser)和α-tcp粉末来制备组合物。可以使用任何合适的方法通过搅拌、捏合或摇动进行混合。然后加入水溶液并混合。具有较高量pser的制剂易于混合,而一些制剂需要机械力以获得良好的混合物。混合在几秒钟内完成,例如10-30秒,然后可以在施用之前设定数秒,5-120秒。
固化可以在任何合适的温度下进行。在一个实施方案中,混合在室温或低于10-25℃下进行,并保持在25℃或更低,例如10-20℃。在施用组合物后,固化温度优选升高至37℃或更高。当将固体组分硅酸盐化合物、α-tcp和磷酸化氨基酸与水溶液混合时,将发生组合物的固化。固化反应将导致形成稠膏并最终形成固体粘固剂。
根据本发明的组合物提供改善的机械强度,并且在在100%湿度和37℃下固化1.5小时后测量时,对皮肤的剪切强度可以为至少20kpa、或至少40kpa、或至少60kpa、或至少80kpa、或至少1000kpa。
当在100%湿度和37℃下固化24小时后测量时,根据本发明的组合物对骨的剪切强度可以为至少1.5mpa、或至少2mpa、或至少2.5mpa、或至少3mpa、或至少3.5mpa。
应用
根据本发明的组合物可用于各种应用。由于施用组合物的简易性和固化组合物的机械强度,该组合物可用作生物组织的粘合剂。通过将组合物施用于软组织,可以粘附另一个软组织或相同的软组织,并在两个软组织之间形成足够的机械强度。软组织可以选自但不限于肌腱、韧带、软骨、筋膜、皮肤、纤维组织、肌肉、脂肪、神经、血管、肝脏、胃、肠、膀胱、脑、眼睛、子宫、肺、食道、心脏、肺、肾、脾和腺体。在一个实施方案中,软组织选自筋膜、皮肤、纤维组织、肌肉、脂肪、神经、血管、肝、胃、肠、膀胱、脑、眼、子宫、肺、食道、心脏、肺、肾、脾和腺体。在一个实施方案中,软组织是软骨或肌腱。在一个实施方案中,软组织是具有细胞外基质、胶原蛋白和弹性蛋白的组织。在另一个实施方案中,软组织是具有上皮的组织。组织也可以是硬组织,例如骨或牙齿。图10和11公开了当本组合物用于不同的软组织和硬组织时的峰值力。
各种植入物和填料可包含根据本发明的组合物。例如,骨填料可包含组合物和任选的其他生物活性材料,例如生长因子。可将组合物施用于任何骨空隙,以填充空隙、固定或锚定植入物或稳定骨折。牙冠植入物例如牙冠、牙桥、假牙、螺钉、牙根填充物或锚固材料也可包含根据本发明的组合物。
还可以通过使用根据本发明的组合物将植入物或支架粘附到组织上。植入物或支架可以由合成材料或生物材料或其组合制成。合成材料可以是金属、聚合物或陶瓷,其中金属可以是钛、铌或其合金或氧化铝、不锈钢,其中聚合物可以是聚氨酯、聚酯(例如聚乳酸、聚乙醇酸、聚己内酯)、聚丙烯酸酯(例如聚甲基丙烯酸甲酯、聚(2-羟基乙基甲基丙烯酸酯))、聚醚(例如聚乙二醇)、聚硅氧烷、水凝胶(例如聚乙烯醇)和聚乙烯基(例如聚乙烯、聚丙烯、聚异丁烯、聚苯乙烯),其中陶瓷可以是磷酸钙(例如羟基磷灰石、三斜磷钙石、四磷酸钙)、金属氧化物(例如氧化铝、氧化锆、氧化钛)或生物玻璃。生物材料可以是但不限于胶原蛋白、透明质酸、壳聚糖、细胞、组织、脱细胞组织、富含血小板的血浆、
在治疗受损组织后的愈合过程中,组织或瘢痕缺乏足够的机械强度,并且修复的组织可能泄漏体液。本发明可用于在愈合或瘢痕形成期间进一步加强组织,甚至可用于密封组织以使体液泄漏最小化。例如,与缝合线组合,可以将本发明的组合物添加到组织切片中以缝合在一起,以提供进一步的强度和密封。
可以通过将根据本发明的组织粘合剂或组合物施加到第一组织来完成第一组织粘附到第二表面。这可以是例如两个或更多个组织或一个组织粘附到例如植入物或支架表面。该组合物也可以施加到第二表面上。在使两个或更多个组织或表面彼此接触之前,可以将粘合剂放置合适的时间段。时间取决于粘合剂的含量和固化时间以及组织或材料,但非限制性实例是10秒或更长、或30秒或更长、或1分钟或更长、或5分钟或更长。在一个实施方案中,将组合物放置20秒至60秒,然后使两种或更多种组织或表面彼此接触。然后使表面彼此接触,并且如果需要,可以施加压力。根据组合物/材料和组合物的固化时间施加压力,但非限制性实例是10秒或更长、或30秒或更长、或1分钟或更长、或5分钟或更长。在一个实施方案中,施加压力1-3分钟。为了使组合物固化,可以将更快的能量施加到组合物或已施用组合物的组织部分。这可以通过施加任何合适类型的uv、热或辐射几秒钟至几分钟来完成。然后使粘合剂或组合物固化成最终的固化组合物。根据组合物和组织或表面,粘合剂可在5分钟至48小时后完全固化。图5和6显示了不同固化时间后的峰值力。
固化时间取决于固有组分的比例,但是由于组合物在混合时就开始固化,因而在使用或施用前合适的时间将组合物混合在一起。在某些应用中,组合物应在施用组合物后快速固化,而在其它应用中,需要较慢的固化。本发明有助于定制固化时间,使得当需要施用时使用者可以预先制备组合物而不需要完全固化的组合物,或制备以获得仍然可成形的组合物或制备几乎瞬间固化的组合物。
该方法可以在体内或体外进行,但是一些步骤可以先在体外进行然后在体内进行。例如,可以使用根据本发明的组合物或粘合剂将骨块彼此粘附并在体内固化之前进行体外固化。需要更换大块骨(>2-20mm)的伤害无法在没有干预的情况下愈合。由于氧气和营养物质不能穿渗透于500μm-2mm,因此目前无法培养如此大的骨块用于植入。该问题的解决方案的一个实例是培养多个较小的骨块并将通过使用根据本发明的组合物在即将体内植入之前将其粘附在一起(体外或离体)。组织工程化构建体,例如骨支架,通常受到尺寸的限制,因为允许氧和营养物适当地渗透到大构建体的血管通道很难打印,雕刻或创建。解决方案的一个实例是打印较小的模块或大构建体的片段,并在通过根据本发明的粘合剂体外组装成更大的构建体之前单独培养它们。然后可以在体外适当的适应和体外生长期后,在体内植入最终的构建体。
当弱化或受伤的骨需要加强时,通常利用金属板、线或其他整形外科固定装置进行螺钉增强。该领域尚未解决的重大挑战是固定质量差的骨骼。骨粘合剂可以增加螺钉-骨粘合强度,尤其是在弱骨(weakbone)中,超过目前可用的增强剂(聚甲基丙烯酸甲酯(pmma)衍生物和磷酸钙),因为它们都不能成功地与骨形成强粘合。
图14a表明,与未处理的骨(未增强的)、磷酸钙处理的骨(增强的)相比,混合的硅酸盐粘合剂可以增加螺旋拔出力,并且甚至可以增加“剥离”模型中的拔出力,其中拉出螺丝后重新插入。该第二模型表明,即使增强孔已经完全“剥离”螺钉和骨之间通常提供拔出阻力的接触区域,通过粘合剂也可以恢复拔出阻力。
磷酸四钙反应过快,特别在量大(1克以上)时,易于应用。在实际的手术室中,医生从开始施用粘合剂至少需要2-5分钟,以避免混合困难、手术并发症等。
工作时间可分为三个阶段:混合和粘性阶段,捏塑团(dough)阶段和最终固化阶段。在混合和粘性阶段期间,混合物易于混合并以较小的阻力流动。优选的施用时间接近粘性阶段结束和捏塑团阶段的开始。捏塑团阶段的特征在于内聚力的增加和粘附性的降低。在捏塑团阶段期间,粘附的组织可以容易地重新排列、对齐或甚至分离并重新附着,对最终粘合强度的影响很小。然而,在捏塑团阶段期间,增稠和粘性更高的混合物的施用可能更困难,因此粘性阶段是优选的施用期,而捏塑团阶段是重新布置的优选时间。最后,在最终固化阶段期间,粘合剂不再容易移动(如果有的话),并且修改可能显著影响最终粘合强度。
图15表明高浓度的柠檬酸钠而非柠檬酸能够延长混合硅酸盐制剂的粘性,生捏塑团和固化时间。当柠檬酸钠混入液体中时,在5%和50%之间,例如20-33%(重量),粘性阶段被延长。该延长使得最终用户在粘性阶段(从40秒到3分钟)期间可以有3-4倍的时间,在捏塑团阶段(从1分钟到7分钟)可以多达7倍的时间。
用于制备组合物的试剂盒
包含组合物的不同组分的试剂盒可用于制备本发明的组合物。该试剂盒可包括至少两个容器,其中容器可以是任何合适类型的容器,例如碗、袋、盘、盘、烧杯、烧瓶、罐、杯或瓶,并且可以具有任何尺寸和形状。试剂盒中的任何一个容器可以含有任何水溶液、磷酸化氨基酸、硅酸盐化合物或α-tcp或其组合,但条件是磷酸化氨基酸和α-tcp不能都存在于与水溶液相同的容器中。换句话说,一个容器可以包含水溶液而第二个或另外的容器可以包含固体组分(磷酸化氨基酸、硅酸盐化合物和α-tcp),或者一个容器可以包含水溶液和一种固体组分而第二容器包括另外两种固体组分,或者一个容器包含水溶液和一种固体组分而第二容器包含水溶液和另外两种组分(条件是其他两种组分不是α-tcp和磷酸化氨基酸)。硅酸盐化合物可以是两种或更多种反应物的形式,该反应物可以反应形成硅酸盐化合物。该两种或更多种反应物可以在同一容器中或可以是分开的容器中。在一个实施方案中,试剂盒包含三个或更多个容器。容器中水溶液、磷酸化氨基酸、硅酸盐化合物和α-tcp的量使得混合时形成根据本发明的组合物。
试剂盒也可以是具有至少两个隔室的注射器的形式。注射器中的隔室可含有任何水溶液、磷酸化氨基酸、硅酸盐化合物或α-tcp或其组合。然而,磷酸化氨基酸和α-tcp不能都与水溶液存在于同一隔室中。换句话说,一个隔室可以包含水溶液而第二个或另外的隔室可以包含固体组分(磷酸化氨基酸、硅酸盐化合物和α-tcp),或者一个隔室可以包含水溶液和一种固体组分而第二隔室包含另外两种固体组分,或者一个隔室包含水溶液和一种固体组分而第二隔室包含水溶液和另外两种组分(条件是其他两种组分不是α-tcp和磷酸化氨基酸)。在一个实施方案中,试剂盒包含三个或更多个隔室。当混合时隔室中水溶液、磷酸化氨基酸、硅酸盐化合物和α-tcp的量使得形成根据本发明的组合物。隔室中水溶液、磷酸化氨基酸、硅酸盐化合物和α-tcp的量使得混合时形成根据本发明的组合物。
注射器还包括混合装置,该混合装置构造成在应用该组分期间混合隔室的组分。混合装置可以布置在注射器的尖端处或隔室内。
实施例
实施例1
通过预混合硅酸盐化合物(0.0216g,含有硅酸二钙和硅酸三钙的波特兰灰粘固剂,90%的粒度分布低于50μm)、pser(0.0318g)和α-tcp粉末(0.075g,90%的粒度分布低于75μm)通过用刮刀搅拌来制备组合物。然后将蒸馏水(0.0266ml,总重量的17.5wt%)加入预混合物中并搅拌混合30秒。
将组合物涂抹在皮质立方体(corticalcube)表面(1cm×1cm)上,用刮刀刮至约0.3-1mm厚度,用手动夹子密封,并在加入液体后60秒内浸入并保持在37℃的蒸馏水中。使用具有trapeziumlitex软件的shimadzuags-x机器以1mm/分钟的十字头速度进行机械测试。在测试之后,用卡尺测量用粘合剂覆盖的每个立方体的表面积,并将记录的峰值力除以表面积以得到每表面积的力(n/cm2)。
结果如图2所示。
实施例2
通过预混合硅酸盐化合物(0.0228g,含有硅酸二钙和硅酸三钙的波特兰白粘固剂,85%的粒度分布低于50μm),pser(0.1439g)和α-tcp粉末(0.0909g,90%的粒度分布低于75μm)通过用刮刀搅拌来制备组合物。然后将蒸馏水(0.0533ml,总重量的17.5wt%)加入预混物中并搅拌混合30秒。
用刮刀将制剂涂在两条猪皮(1cm×1.5cm)上,用手工夹子密封,并在加入液体后60秒内放入保持100%相对湿度的密封容器中。将每个样品固化90分钟。使用具有trapeziumlitex软件的shimadzuags-x机器以5mm/分钟的十字头速度进行机械测试。在测试之后,用卡尺测量用粘合剂覆盖的每个皮肤条的表面积,并将记录的峰值力除以表面积以得到每表面积的力(n/cm2)。
结果如图4所示。
实施例3
通过预混合0.0318g磷酸丝氨酸、0.0216g波特兰灰粘固剂和0.075gα-tcp(总共0.1285g)粉末制备每个样品。加入蒸馏水(总重量的17.5wt%),然后用刮刀混合30秒。将制剂涂抹在皮质立方体表面(1cm×1cm)上,用刮刀刮至约0.3-1mm厚度,用手动夹子密封,并在加入液体后60秒内浸没在保持在21℃的蒸馏水中。将每个样品固化10、60、240或14,400分钟。
结果如图6所示。
实施例4
通过预混合0.1439g磷酸丝氨酸、0.0228g波特兰灰粘固剂和0.0909gα-tcp(总计0.257g)粉末制备每个样品。加入蒸馏水(总重量的17.5wt%),然后用刮刀混合30秒。用刮刀将制剂涂在两条猪皮(1cm×1.5cm)上,用手工夹子密封,并在加入液体后60秒内放入保持100%相对湿度的密封容器中。将每个样品固化10、90或240分钟。
结果如图7所示。
实施例5
通过预混合0.0318g磷酸丝氨酸、0.0216g波特兰灰粘固剂和0.075gα-tcp(总共0.1285g)粉末制备每个样品。加入蒸馏水(总重量的17.5wt%、29.3wt%或45.3wt%),然后用刮刀混合30秒。将制剂涂布在皮质立方体表面上(1cm×1cm),用刮刀刮至约0.3-1mm厚度,用手动夹子密封,并在加入液体的60秒内浸没在保持在21℃的蒸馏水中。将每个样品固化24小时。
结果如图8所示。
实施例6
通过预混合0.1439g磷酸丝氨酸、0.0228g波特兰灰粘固剂和0.0909gα-tcp(总计0.257g)粉末制备每个样品。加入蒸馏水(总重量的17.5wt%、29.3wt%或45.3wt%),然后用刮刀混合30秒。用刮刀将制剂涂布在两条猪皮条上(1cm×1.5cm),用手动夹子密封,并在加入液体后60秒内放入保持100%相对湿度的密封容器中。每个样品在21℃下固化90分钟。
结果在图9中公开。
实施例7
通过预混合0.0318g磷酸丝氨酸、0.0216g波特兰灰粘固剂和0.075gα-tcp(总共0.1285g)粉末制备每个样品。对于随后的样品,波特兰灰色粘固剂部分完全被硅酸二钙或硅酸三钙替代。加入蒸馏水(总重量的17.5wt%),然后用刮刀混合30秒。将制剂涂抹在皮质立方体表面(1cm×1cm)上,用刮刀将厚度刮至约0.3-1mm,用手动夹子密封,并在加入液体后60秒内浸入保持在21℃的蒸馏水中。将每个样品固化24小时。
结果如图10所示。
实施例8
通过预混合0.1439g磷酸丝氨酸、0.0228g波特兰灰粘固剂和0.0909gα-tcp(总计0.257g)粉末制备每个样品。加入蒸馏水(总重量的17.5wt%),然后用刮刀混合30秒。用刮刀将制剂涂抹在两条心脏、肌腱、肝脏或干燥的胶原条(1cm×1.5cm)上,并在加入液体后60秒内放入保持100%相对湿度的密封容器中。将每个样品在37℃下固化90分钟。
结果在图11中公开。
实施例9
通过预混合0.0318g磷酸丝氨酸、0.0216g波特兰灰粘固剂和0.075gα-tcp(总共0.1285g)粉末制备每个样品。加入蒸馏水(总重量的17.5%wt%),然后用刮刀混合30秒。将制剂涂抹在皮质立方体表面(1cm×1cm)上,用刮刀刮至约0.3-1mm厚度,用手动夹子密封,并放入密封容器中,其在加入液体的60秒内在21℃保持100%相对湿度。通过预混合0.636g磷酸丝氨酸、0.432g波特兰灰粘固剂和1.5gα-tcp粉末制备软骨样品。加入蒸馏水(总重量的17.5wt%),然后用刮刀混合30秒。将粘合剂倒入方形模具中(1cm×1cm×0.5cm)将软骨面压入粘合剂中。将每个样品固化24小时。
结果如图12所示。
实施例10
通过预混合0.0318g磷酸丝氨酸、0.0216g波特兰灰粘固剂和0.075gα-tcp(总共0.1285g)粉末制备每个样品。加入蒸馏水或自来水(总重量的17.5wt%),然后用刮刀混合30秒。将制剂涂抹在皮质立方体表面(1cm×lcm)上,用刮刀刮至厚度约0.3-1mm,用手动夹子密封,并在加入液体后60秒内浸入保持在21℃的蒸馏水中。将每个样品固化24小时。
结果如图13所示。
实施例11
通过在5ml注射器中预混合0.636g磷酸丝氨酸、0.432g波特兰灰粘固剂和1.5gα-tcp粉末来制备每个样品。加入柠檬酸钠预先溶解在蒸馏水中的溶液(液体占总重量的17.5wt%,柠檬酸钠占总重量的3.4wt%),然后用刮刀混合20秒。将制剂注入松质骨中的预钻孔(直径6mm,深10mm)中,并将hb6.0松质骨螺钉插入孔中至5mm的深度。对于非增强样品,使用相同的程序,不注射粘合剂。对于剥离的样品,测试未增强的样品以失效,然后如上所述增强样品,之后插入螺杆并重新测试拉出力。将样品放入密封容器中,在加入液体的60秒内,在21℃保持100%相对湿度。将每个样品固化24小时。
结果在图14a中公开。
实施例12
通过预混合0.636g磷酸丝氨酸、0.432g波特兰灰粘固剂和1.5gα-tcp粉末制备每个样品。加入柠檬酸钠预先溶解在蒸馏水中的溶液(液体占总重量的17.5wt%,柠檬酸钠占总重量的3.4wt%),然后用刮刀混合20秒。将制剂手工挤至松质骨立方体和先前用2cm冠状钻头钻出的圆柱形塞子之间的3mm间隙中。将样品放入密封容器中,在加入液体的60秒内,在21℃保持100%相对湿度。将每个样品固化2小时。
结果在图14b中公开。
实施例13
通过预混合0.0318g磷酸丝氨酸、0.0216g波特兰灰粘固剂和0.075gα-tcp(总共0.1285g)粉末制备每个样品。加入蒸馏水(总重量的17.5wt%),然后用刮刀混合30秒。将制剂涂布在皮质立方体表面(1cm×1mm)上,并将相应的材料表面(1cm×1cm)用刮刀涂布至约0.1-0.6mm的厚度,用手动夹子密封,并在加入液体后60秒内浸入保持在21℃的蒸馏水中。将每个样品固化24小时。
各种离子盐与磷酸丝氨酸的反应性在20-80%磷酸丝氨酸(wt%)的范围内测试。
通过预混合0.0318g磷酸丝氨酸、0.0216g波特兰灰粘固剂和0.075gα-tcp(总共0.1285g)粉末制备每个样品。加入蒸馏水(总重量的17.5wt%),然后用刮刀混合30秒。通过目视观察粘性阶段的存在或不存在来测试每种制剂的粘附性和内聚力。在10分钟内或硬化前产生粘性阶段的盐被认为是“反应性的”。
结果在图15中公开。
实施例14
通过预混合0.0318g磷酸丝氨酸、0.0216g波特兰灰粘固剂和0.075gα-tcp(总共0.1285g)粉末制备每个样品。加入含有柠檬酸钠和蒸馏水的预混溶液(液体占总重量的17.5wt%,柠檬酸钠wt%为总重量的0%、0.001%、3.4%或5.7%),然后用刮刀混合10分钟。粘性阶段定义为混合物看起来粘稠,可流动并且可以通过使用刮刀“拉出”原纤维而与块体分离的时期。捏塑团阶段定义为混合物看起来不太粘,不可流动但仍易于与刮刀混合的时期,并且难以抽出原纤维。固化阶段定义为不可能混合配方的时间。
结果如图16所示。
实施例15
使用25μm、50μm、75μm和100μm的截留筛分每种粉末以分离并称重粉末的每个部分。使用retschas200筛振器,以60振幅持续30分钟,两次,以筛分每种粉末。
将每种粉末称重(0.01g)并用刮刀涂在碳带上。使用二次电子检测器在4kev下在as02zeiss1550sem上获得颗粒形态的图像。
结果如图17所示。
实施例16
按照iso标准10993-5、10993-12的推荐,将人真皮成纤维细胞(hdfn)细胞暴露于含有硅酸盐和磷酸三钙的制剂的浸出提取物中。将表3中所描述的粘合剂制剂混合,称重并在120秒的固化时间后暴露于液体中。每0.2g粘合剂加入1ml液体培养基,并在37℃下培养24小时。然后将液体离心以除去碎片,ph中和(仅用于“中性制剂”),并无菌过滤。用1体积(2倍稀释,白色条)或3体积液体培养基(4倍稀释,黑色条)稀释液体培养基,然后暴露于hdfn细胞24小时。由于许多因素可能产生毒性,因此有必要区分由于浸出液中存在的化学元素引起的毒性和由浸出的ph引起的毒性。分别在获得时和中和后(“中性”制剂,图右侧)测试每种制剂。
通过在液体培养基中用10%的阿拉玛蓝(alamarblue)溶液替换液体培养基并孵育1小时来测定细胞活力。从590nm处的强度中减去560nm处的荧光强度,其表示通过细胞活动(包括代谢)降低的阿拉玛蓝的量。还原量与细胞数量直接相关,因此用于指示活细胞的数量。百分比值表示每个处理组中的活细胞量,标准化至未处理组(控制组)。
实验结果如图18所示,表明观察到的细胞毒性是由固化粘合剂的酸性引起的。所有处理组作为获得时(左栏)或中和后(右栏,“中性”)使用。当浓度保持恒定但ph被中和时,细胞毒性消失。
上述组合物的浸出ph值示于下表1中。
*细胞数量增加,表明成纤维细胞增殖略有增加。
表1列出了在人成纤维细胞上测试的每种制剂的物理和化学性质。尽管ph值和组成(wt%)不同,但所有测试配方的粘合剪切强度仍然很高。
实施例17
通过预混合硅酸盐化合物(0.021、0.0216或0.0042g含有硅酸二钙和硅酸三钙的波特兰灰色粘固剂,90%的粒度分布低于50μm,用于组合物b、c或d)、pser(0.0574、0.0318或0.03429g,用于组合物b、c或d)和α-tcp粉末(0.05、0.075或0.09g用于组合物b、c或d,90%的粒度分布小于75μm)通过用刮刀搅拌制备组合物。然后将蒸馏水(0.0266ml,总重量的17.5wt%)加入预混合物中并搅拌混合30秒。将组合物涂布在铝立方体表面(1cm×lm)上,用刮刀刮至约0.3-1mm厚度,用手动夹子密封,并在加入液体后60秒内浸入保持在37℃的蒸馏水中。使用具有trapeziumlitex软件的shimadzuags-x机器以1mm/分钟的十字头速度进行机械测试。在测试之后,用卡尺测量用粘合剂覆盖的每个立方体的表面积,并将记录的峰值力除以表面积以产生每表面积的力(n/cm2)。
结果公开在图5a-c中,显示了用组合物b、c和d进行的试验结果。所述组合物代表了用于与金属粘合的峰值剪切值组合物。
制剂1包含22-28wt%的磷酸化氨基酸(磷酸丝氨酸)和20-24wt%的硅酸盐(硅酸盐指硅酸盐化合物和α-tcp之间的重量比)
制剂2包含23-29wt%的磷酸化氨基酸(磷酸丝氨酸)和2-6wt%的硅酸盐。
制剂3包含40-48wt%的磷酸化氨基酸(磷酸丝氨酸)和28-33wt%的硅酸盐,
下表2列出了图3a-d和5a-c中所示的所有骨对骨和金属对金属粘合剂组合物。
表1图3a-d和5a-c中所示的骨对骨和金属对金属的粘合剂组合物,以及它们各自的剪切强度值。硅酸盐和α-tcp组分为固体含量的剩余部分,即24wt%的磷酸丝氨酸是指硅酸盐和α-tcp组分占固体含量的76wt%。
- 还没有人留言评论。精彩留言会获得点赞!