一种用于降血糖的茶多糖AN蛋白复合物及其应用的制作方法
本发明属于医用配制品领域,具体地说,涉及一种用于降血糖的茶多糖an蛋白复合物及其应用。
背景技术:
糖尿病是最常见的导致心脑肾等重要器官损害的原发病,临床常见ⅰ型糖尿病(胰岛素依赖型)和ⅱ型糖尿病(非胰岛素依赖型)。其中,ⅱ型糖尿病患者约占90%。数据显示,2013年,我国成人糖尿病患病率为10.9%,糖尿病前期流行率为35.7%,我国糖尿病防控形势依然严峻。现有的糖尿病治疗药物众多,但绝大多数化药均有毒副作用。因此,开发安全、无毒副作用、预防和治疗糖尿病及其并发症的天然药物和保健食品显得尤为必要。
茶叶具有多种保健功效,其功能成分主要为茶多酚、茶黄素、茶氨酸、茶多糖等。近年来,有众多学者从动物实验证明茶多糖能降血糖,治疗糖尿病及其并发症,并对其降血糖机制进行了不同层次的探讨。
已有研究发现,茶叶提取物通过减轻氧化应激,抑制α-淀粉酶和α-葡萄糖苷酶的活性,改善血管内皮功能,调节细胞因子的表达,改善胰岛素抵抗,降低血糖,改善糖尿病并发症等来发挥对糖尿病的保护作用。然而,这些研究报道所涉及的实验物质均为茶叶多糖粗提物,成分复杂不清、剂量高、活性差,与现有糖尿病的治疗药物相比缺乏竞争优势和市场前景。
因此,对茶叶多糖粗提物的进一步分离纯化及活性成分的确立对其临床应用尤为重要。
技术实现要素:
为了解决现有技术中存在的问题,本发明的目的是提供一种用于降血糖的茶多糖an蛋白复合物及其应用。
为了实现本发明目的,本发明的技术方案如下:
第一方面,本发明提供了一种茶多糖an蛋白复合物,其分子量为100kd及以上(包括100kd)。
本发明通过对茶叶粗提取物进行精细提取,并比较提取所得的具有不同分子量的茶多糖蛋白复合物的降血糖效果,发现分子量在100kd及以上(包括100kd)的茶多糖an蛋白复合物,相比其他分子量的茶多糖蛋白复合物表现出更为显著的降血糖效果。
经分析,所述茶多糖an蛋白复合物含有的成分及其重量份关系如下:茶多糖30~90份,蛋白质5~30份,微量元素1~10份。
需要说明的是,本发明所述的具有生理活性的茶多糖an蛋白复合物是一种均一多糖,单独的茶多糖和单独的蛋白质均没有生理活性(对α-葡萄糖苷酶的抑制作用研究结果见图1和图2)。
但鉴于上述成分分析结果,含有上述成分并符合上述相对重量份关系的物质,若同时能通过化学键使茶多糖和蛋白质形成具有生理活性的均一多糖,也应当属于本发明的保护范围。
其中,所述茶多糖含有的成分及其重量份关系如下:酸性糖10~60份,中性糖5~60份。
更为具体地,所述茶多糖由以下重量份的单糖组成:核糖2~15份,阿拉伯糖5~25份,甘露糖3~25份,葡萄糖10~40份,半乳糖15~50份。
其中,所述蛋白质的主要成分为丝氨酸、赖氨酸和天冬氨酸,即所述蛋白质以丝氨酸、赖氨酸和天冬氨酸等为主。
其中,所述微量元素的主要成分为钙、镁、锌、铁、锰、钠、钾,即所述微量元素以钙、镁、锌、铁、锰、钠、钾等为主。
进一步地,所述茶多糖an蛋白复合物的制备方法包括如下步骤:
(1)对茶进行水浸提;
(2)对提取液进行处理,得到粗提物;
(3)将粗提物的水溶液用截留分子量为100kd的超滤膜进行截留分离,将截留液进行减压浓缩、干燥,得到茶多糖an蛋白复合物。
更为具体地说,所述步骤(1)将茶置于去离子水中,在50~80℃条件下进行提取。
在该温度条件下进行水浸提,能保证茶多糖an蛋白复合物最佳生理活性。
作为优选,提取(水浸提)过程宜分为多次进行,将多次提取所得的产物合并,得到步骤(2)所述的提取液。
在每次浸提中,以茶的质量为基准,所述去离子水的用量为茶质量的7-10倍,该用量比可使茶中的活性物质更好地溶出。
作为优选,提取(水浸提)过程中,辅助以搅拌操作,促进活性物质的溶出。
可选地,浸提次数可为2次、3次,在本发明的一个具体实施方式中,重复进行3次浸提。
更为具体地说,所述步骤(2)将提取液过滤,并将滤液在50~80℃条件下进行常规方法的浓缩,干燥,得粗提物。
更为具体地说,所述步骤(3)将粗提物的水溶液进行超滤分离,用截留分子量为100kd的超滤膜进行截留分离,超滤时的进出口压力差为0.08~0.12mpa,流速为8~12ml·min-1;将截留液在50~80℃,真空度为-0.1~-0.05mpa的条件下进行减压浓缩、干燥,得到茶多糖an蛋白复合物。
进一步地,本发明所述的茶,包括但不限于铁观音、红茶、黑茶、普洱茶等。在本发明的具体实施方式中,对由不同的茶制备茶多糖an蛋白复合物均进行了示例性说明,且所制备的茶多糖an蛋白复合物均具有良好的降血糖效果。因此,本发明对茶的种类不另做限定。
第二方面,本发明提供了含有所述茶多糖an蛋白复合物的药物组合物。
所述药物组合物中,以所述茶多糖an蛋白复合物作为发挥降血糖作用的核心活性成分。
需要说明的是,当采用茶多糖an蛋白复合物,并利用其发挥降血糖作用,无论是否叠加/配伍其他具有不同作用的活性成分,所述药物组合物均属于本发明的保护范围。
例如,一种兼具降血糖降血脂功能的药物组合物,其活性成分包括本发明所述的茶多糖an蛋白复合物和一种或多种可实现降血脂效果的活性成分,那么该药物组合物也属于本发明的保护范围。
具体地说,所述药物组合物可体现为一种药物或一种药物制剂。
当作为一种药物制剂时,所述药物组合物含有所述茶多糖an蛋白复合物和药学上可接受的载体或稀释剂(统称辅料)。所述制剂的剂型可为片剂、丸剂、胶囊剂、颗粒剂或口服液。
所述药学上可接受的载体或稀释剂是指药学领域常规的药物载体,选自填充剂、粘合剂、崩解剂、润滑剂、助悬剂、润湿剂、溶剂、表面活性剂或矫味剂中的一种或几种。
所述填充剂选自淀粉、蔗糖、乳糖、甘露醇、山梨醇、木糖醇、甜菊苷、抗性糊精、微晶纤维素或葡萄糖等;所述粘合剂选自纤维素衍生物、藻酸盐、明胶或聚乙烯吡咯烷酮等;所述崩解剂选自微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、低取代羟丙基纤维素或交联羧甲基纤维素钠等;所述润滑剂选自硬脂酸、聚乙二醇类、碳酸钙、碳酸氢钠、微粉硅胶、滑石粉或硬脂酸镁等;所述助悬剂选自微粉硅胶、蜂蜡、纤维素、固态聚乙二醇等;所述润湿剂选自甘油、吐温-80、乙氧基氢化蓖麻油或卵磷脂等;所述溶剂选自乙醇、液态聚乙二醇、异丙醇、吐温-80、甘油、丙二醇或植物油,所述植物油选自大豆油、蓖麻油、花生油、调和油等;所述表面活性剂选自十二烷基苯磺酸钠、硬脂酸、聚氧乙烯-聚氧丙烯共聚物、脂肪酸山梨坦或聚山梨酯(吐温)等;所述矫味剂选自阿斯巴甜、蔗糖素、香精、柠檬酸或糖精钠等。
进一步地,本发明还提供了上述制剂的制备方法,所述方法的具体步骤中包括:将茶多糖an蛋白复合物与药学上可接受的载体或稀释剂按照等量递加法混合均匀,制成制剂。
基于其活性成分茶多糖an蛋白复合物的功能和作用机理,优选所述制剂为肠溶制剂,剂型优选为肠溶胶囊或肠溶片。
进一步地,所述药物组合物中,辅料与茶多糖an蛋白复合物按照10-60:1-30的质量比例混合,优选为20-40:3-15,更优选为30:4。
第三方面,本发明提供了所述茶多糖an蛋白复合物或所述药物组合物在制备用于降血糖的药物或保健品中的应用。
其中,所述降血糖指降低机体胰岛素分泌不足导致的高血糖或胰岛素不敏感所致的高血糖,并改善糖尿病并发症。
本发明所述茶多糖an蛋白复合物降血糖的机理为抑制α-葡萄糖苷酶活性和肠道葡萄糖转运蛋白的活性,并维持胰岛素的正常分泌。
进一步地,所述降血糖还可体现为对糖尿病的治疗,所述糖尿病包括:1型糖尿病、2型糖尿病、妊娠糖尿病及其他特殊类型的糖尿病。其中,其他特殊类型的糖尿病包括:①β细胞功能缺陷糖尿病;②胰岛素功能缺陷;③胰腺外分泌病;④内分泌疾病;⑤药物或化学引起的糖尿病;⑥传染病;⑦不常见的免疫介导型糖尿病;⑧其它遗传综合征伴随糖尿病。
本发明涉及到的原料或试剂均为普通市售产品,涉及到的操作如无特殊说明均为本领域常规操作。
在符合本领域常识的基础上,上述各优选条件,可以相互组合,得到具体实施方式。
本发明的有益效果在于:
本发明通过药效学研究,首次发现了分子量大于100kd的茶多糖an蛋白复合物相对其他分子量的茶多糖蛋白复合物,具有更为明显的降血糖作用。对茶叶多糖粗提物的活性成分进行了揭示,并对茶叶多糖粗提物的进一步分离纯化提供了理论依据,具有积极的临床应用意义。
附图说明
图1为单一茶多糖对α-葡萄糖苷酶的抑制作用。
图2为单一蛋白质对α-葡萄糖苷酶的抑制作用。
图3为实施例5大鼠葡萄糖输注率(n=4),注:与正常对照组比较,**p<0.01。
图4为实施例5茶叶提取物的不同组分对α-葡萄糖苷酶抑制实验结果(n=3),注:与正常对照组比较,**p<0.01;与其他组比较,**p<0.01。
图5为实施例5不同浓度的an蛋白对α-葡萄糖苷酶抑制实验结果(n=3),注:与正常对照组比较,**p<0.01。
图6为实施例5大鼠离体小肠翻转模型实验结果(n=3),注:与正常对照组比较,**p<0.01。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1茶多糖an蛋白复合物的制备
取铁观音茶,用7倍量去离子水在65℃下搅拌提取,重复三次。合并提取液,过滤,滤液浓缩,冷冻干燥,得粗提物。用超滤技术对粗提取水溶液进行超滤分离,用截留分子量为100k的超滤膜进行截留分离,超滤时的进出口压力差为0.1mpa,流速为10.0ml·min-1。截留液在65℃,真空度为-0.1~-0.05mpa的条件下进行减压浓缩、干燥,得到茶多糖an蛋白复合物。
实施例2茶多糖an蛋白复合物的制备
取黑茶,用8倍量去离子水在60℃下搅拌提取,重复三次。合并提取液,过滤,滤液浓缩,减压真空干燥,得粗提物。用超滤技术对粗提取水溶液进行超滤分离,用截留分子量为100k的超滤膜进行截留分离,超滤时的进出口压力差为0.1mpa,流速为8.0ml·min-1。截留液在50℃,真空度为-0.1~-0.05mpa的条件下进行减压浓缩、干燥,得到茶多糖an蛋白复合物。
实施例3茶多糖an蛋白复合物的制备
取红茶,用9倍量去离子水在50℃下搅拌提取,重复三次。合并提取液,过滤,滤液浓缩,冷冻干燥,得粗提物。用超滤技术对粗提取水溶液进行超滤分离,用截留分子量为100k的超滤膜进行截留分离,超滤时的进出口压力差为0.1mpa,流速为9.0ml·min-1。截留液在80℃,真空度为-0.1~-0.05mpa的条件下进行减压浓缩、干燥,得到茶多糖an蛋白复合物。
实施例4茶多糖an蛋白复合物的制备
取普洱茶,用8倍量去离子水在80℃下搅拌提取,重复三次。合并提取液,过滤,滤液浓缩,喷雾干燥,得粗提物。用超滤技术对粗提取水溶液进行超滤分离,用截留分子量为100k的超滤膜进行截留分离,超滤时的进出口压力差为0.1mpa,流速为10.0ml·min-1。截留液在70℃,真空度为-0.1~-0.05mpa的条件下进行减压浓缩、干燥,得到茶多糖an蛋白复合物。
实施例5药效实验
1、对α-葡萄糖苷酶的抑制作用
1.1仪器与材料
酶标仪(美国bioteksynergyht),α-1,4-葡萄糖苷酶(g5003,sigma),阿卡波糖(acarbose)(phr1253-500mg,sigma),4-硝基苯-α-d-吡喃葡萄糖苷(pnpg)(seebio),96孔板,其他试剂均为分析纯。
1.2实验方法
首先在板孔里加入样品溶液,加入底物(pnpg),37℃保温5min,加入酶溶液,37℃保温15min,加入na2co3终止酶反应,在酶标仪上405nm处测定吸光度值。实验每板重复三次。计算相对抑制率:相对抑制率(%)=[(a无抑制剂-a抑制剂)/a无抑制剂]x100%。阳性对照样品的相对抑制率计算与受试样品相同。
1.3实验分组
正常对照组(缓冲液+底物+酶液);空白对照组ⅰ(缓冲液+底物);空白对照组ⅱ(样品+缓冲液+底物);受试样品组(受试样品+底物+酶液);阳性样品组(阳性样品+底物+酶液)。
2、对α-葡萄糖苷酶的抑制作用
实验分为正常对照组(缓冲液+底物+酶液);空白对照组ⅰ(缓冲液+底物);空白对照组ⅱ(样品+缓冲液+底物);受试样品组(受试样品+底物+酶液);阳性样品组(阳性样品+底物+酶液)。
首先在板孔里加入样品溶液,加入底物(pnpg),37℃保温5min,加入酶溶液,37℃保温15min,加入na2co3终止酶反应,在酶标仪上405nm处测定吸光度值。实验每板重复三次。计算相对抑制率:相对抑制率(%)=[(a无抑制剂-a抑制剂)/a无抑制剂]x100%。阳性对照样品的相对抑制率计算与受试样品相同。
3、大鼠离体小肠囊翻转模型
翻转离体小肠囊制作:参照陈其才方法(陈其才,严定友,吴政星.生理学实验[m].第1版.北京:科学出版社,1995:110-113.):sd大鼠,自由采食和饮水。断颈处死后,取出小肠,剪去10cm左右的十二指肠,余下的小肠段取长约7cm的小肠段,用眼科镊将其粘膜面翻转出,一端固定于底部膨大的插管上,另一游离端用手术线扎紧,向肠囊内注入1ml无糖krebs液。将肠囊放入预热的25℃无糖富氧的krebs液中温浴10min;转入37℃含有试验样品的krebs液中,立即通入氧气,温浴40min;取出翻转小肠段,剪刀剪小口使囊内krebs液转移至离心管,3000r·min-1,离心1min,取上清液转移至新管。按照试剂盒说明检测小肠囊内溶液的葡萄糖浓度。
实验分为空白对照组:15mmol·l-1葡萄糖的krebs液;阳性对照组:含0.03mg·l-1二甲双胍和15mmol·l-1葡萄糖的krebs液;受试验品组:含0.03mg·l-1茶多糖an蛋白复合物(简称an蛋白)和15mmol·l-1葡萄糖的krebs液。
其中,所述茶多糖an蛋白复合物采用实施例1所制备得到的产品。
4、ⅰ型糖尿病大鼠模型(四氧嘧啶引起的sd大鼠糖尿病模型)
造模实验sd大鼠,购入后饲养一周适应环境,禁食不禁水12h。大鼠腹腔注射新鲜配制的4%四氧嘧啶,剂量为0.05ml·kg-1。正常对照组大鼠腹腔注射等容积的生理盐水,注射后30min给食。注射后72h,尾部取血约20μl检测血糖量,血糖浓度≥16.7mmol·l-1为造模成功的模型动物,造模成功后分组,灌胃给药。
实验方案:
模型动物随机分为模型组(0.5%cmc-na),模型阳性药二甲双胍(300mg·(kg·d)-1)组、模型an蛋白高(450mg·(kg·d)-1)、中(300mg·(kg·d)-1)、低(150mg·(kg·d)-1)剂量组,未造模动物设为正常动物组(0.5%cmc-na),每组10只大鼠,共6组。分别在给药第7、14、21、28天上午开始禁食,称体质量,下午取尾静脉血检测血糖量。
5、ⅱ型糖尿病大鼠模型(高脂饮食合并链脲佐菌素诱导的大鼠糖尿病模型)
实验动物及分组:
wistar大鼠48只,购入后顺应性喂养3天后,进行血糖、体质量、24h尿蛋白基础状态测定,将动物随机分为正常组(n=12)和模型组(n=36),正常组大鼠给予普通饲料,模型组大鼠给予高脂饲料(50%碳水化合物,12%蛋白质及38%脂肪),5周后,正常组和模型组大鼠每组取4只进行胰岛素钳夹实验,模型组大鼠葡萄糖输注率显著低于正常组,表明模型大鼠出现了胰岛素抵抗(p<0.01,见图3)。模型大鼠以25mg·kg-1体质量的剂量给予1%的链脲佐菌素(stz)(以ph4.2-4.5的0.1mol/l柠檬酸缓冲液配制),腹腔注射,1周后以30mg·kg-1的剂量再次注射1%的stz,72h后测定空腹血糖,血糖浓度≥11.1mmol·l-1视为造模成功。将模型组动物随机分为模型组对照组(0.5%cmc-na)、阳性药二甲双胍组(500mg·(kg·d)-1)、an蛋白组(300mg·(kg·d)-1),与正常对照组(0.5%cmc-na)均灌胃给药。
检测指标:
实验期间密切观察动物精神状态、活动、毛发变化及进食饮水情况。每周称重1次,观察动物体质量变化。分别在给药0周、2周、4周、6周和8周用强生倍易血糖仪尾尖采血测定空腹血糖水平,在给药4周和8周测定血清胰岛素水平。
6、计算及统计方法
采用spss13.0统计软件包处理数据,各组数据均以均数加减标准差
7、结果
7.1对α-葡萄糖苷酶的抑制作用研究
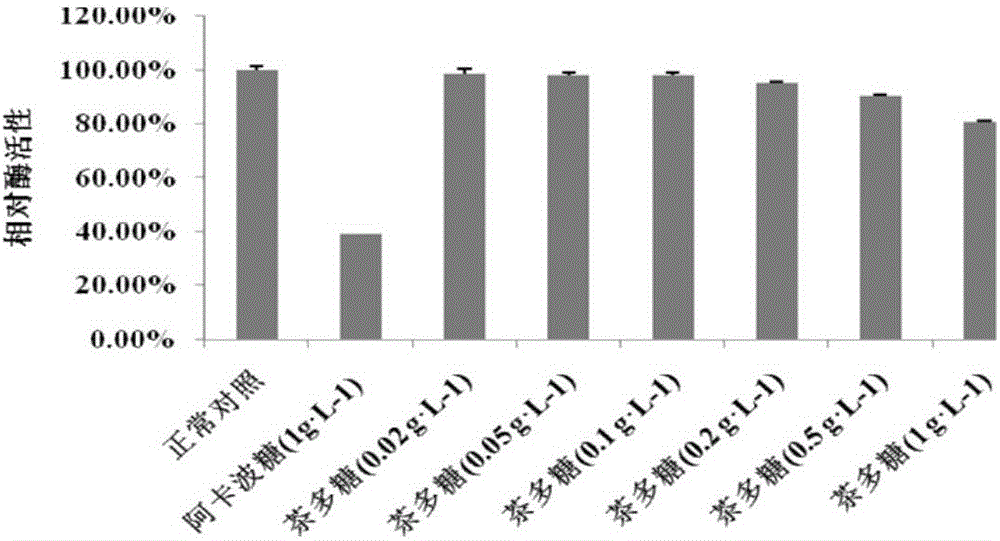
茶叶提取物经过超滤技术截留分离,得到的不同分子量段的各成分对α-葡萄糖苷酶的抑制作用也差异较大,其中an蛋白组分(fractionan)对α-葡萄糖苷酶的抑制作用最强(p<0.01,见图4)。而且an蛋白组分对α-葡萄糖苷酶的抑制作用具有浓度依赖性(p<0.01,见图5)。
7.2大鼠离体小肠囊翻转模型实验研究
结果显示,茶叶提取物的an蛋白组分(0.03mg·l-1)能够显著抑制大鼠离体小肠囊中葡萄糖的转运,与阳性药二甲双胍(0.03mg·l-1)抑制作用类似,与正常对照组比较,有显著统计学意义(p<0.01,见图6)。
7.3an蛋白对ⅰ型糖尿病大鼠的降血糖实验研究(四氧嘧啶引起的sd大鼠糖尿病模型)
大鼠血糖值:
与模型对照组相比,二甲双胍组和an蛋白各剂量组均表现出一定的降血糖效果,二甲双胍组、an蛋白中剂量组和an蛋白高剂量组在实验第二周均表现出了显著的降血糖作用(p<0.01);二甲双胍组和an蛋白中剂量组在实验第三周和第四周有持续的显著降血糖作用(p<0.05),an蛋白低剂量组和高剂量组在实验第三周和第四周仅有降血糖趋势,见表1。
大鼠体质量值:
与正常组相比,模型组动物的体质量有明显降低,但没有统计学意义。与模型组相比,二甲双胍组和an蛋白中剂量组的大鼠体质量从给药第二周开始增长幅度有所增加,从给药第三周开始,an蛋白中剂量组与阳性对照二甲双胍组的大鼠体质量增长幅度几乎相近,大约有10%的增幅,见表2。
表1各实验组大鼠空腹血糖值(单位:mmol·l-1)
注:与模型对照组比,*表示p<0.05,**表示p<0.01。
表2各实验组大鼠空腹体质量值(单位:g)
7.4an蛋白对ⅱ型糖尿病大鼠的降血糖活性研究(高脂饮食合并链脲佐菌素诱导的大鼠糖尿病模型)
大鼠一般状态及体质量与正常对照大鼠相比,模型对照组大鼠毛发发黄散乱,精神状态差,尿量明显增加,垫料明显变湿。与模型对照组比,二甲双胍组及an蛋白组大鼠状态明显好转。高脂饲料喂养5周后(造模前),模型对照组及各给药组大鼠体质量显著高于正常组(p<0.01)。造模后(给药0周),模型对照组及各给药组体质量下降,与正常对照组比无显著性差异。从给药4周起,模型对照组及各给药组体质量显著低于正常对照组(p<0.05,p<0.01),二甲双胍组及an蛋白组与模型对照组相比,体质量无显著性差异,见表3。
表3各实验组大鼠体质量变化(单位:g)
注:与正常对照组比,*p<0.05,**p<0.01
大鼠进食量及饮水量变化:
从给药4周起,模型对照组大鼠饮水量及进食量均显著高于正常对照组,二甲双胍组在给药4、6、8周均能降低模型大鼠进食及饮水量(p<0.05,p<0.01),an蛋白组在第8周能显著降低模型大鼠的饮水量水平(p<0.05);an蛋白组在给药第6周能显著降低模型大鼠的进食量(p<0.05),其余时间点,an蛋白组仅有降低趋势,无显著性差异,见表4。
表4各实验组大鼠饮水量及进食量
注:与模型对照组比,*p<0.05,**p<0.01
大鼠血糖值:
基础状态时各实验组大鼠血糖无显著性差异。造模后(给药0周)模型对照组大鼠血糖显著高于正常组(p<0.01),各给药组血糖水平与模型组比无显著差异。给药2周时,二甲双胍组和an蛋白组表现出了显著降低模型大鼠血糖水平的作用(p<0.05,p<0.01)。给药4周、6周、8周时,二甲双胍组和an蛋白组持续显著降低糖尿病大鼠血糖值(p<0.05,p<0.01),见表5。
表5各实验组大鼠空腹血糖值(单位:mmol·l-1)
注:与模型组比,*p<0.05,**p<0.01
大鼠空腹胰岛素:
给药4周时,模型对照组、二甲双胍组和an蛋白组空腹胰岛素水平显著高于正常对照组(p<0.05),各给药组空腹胰岛素水平与模型对照组比较无显著性差异。给药8周时,模型对照组空腹胰岛素水平与正常对照组比较有降低趋势,而二甲双胍组和an蛋白组大鼠的空腹胰岛素水平则与正常对照组基本一致,推测an蛋白可能对胰岛细胞有保护作用,见表6。
表6各实验组大鼠空腹胰岛素分泌水平(单位:ngl-1)
注:与模型组比,*p<0.05,**p<0.01
经过对实施例2-4所制备的茶多糖an蛋白复合物进行重复实验,实验结果表明,其均具有相同或相似的应用效果。
实施例6降血糖的片剂
称取茶多糖an蛋白复合物250g(实施例1制备的茶多糖an蛋白复合物),加抗性糊精混匀,以70%乙醇为粘合剂,制粒,干燥,加入适量硬脂酸镁,压片,即得片剂。
实施例7降血糖的胶囊剂
称取茶多糖an蛋白复合物200g(实施例2制备的茶多糖an蛋白复合物),加抗性糊精混匀,以70%乙醇为粘合剂,制粒,干燥,装入胶囊,即得胶囊剂。
实施例8降血糖的固体饮料
称取茶多糖an蛋白复合物200g(实施例2制备的茶多糖an蛋白复合物),加抗性糊精混匀,以70%乙醇为粘合剂,制粒,干燥,装入袋中,即得固体饮料。
实施例9降血糖的口服液
乳化剂吐温-80125g,溶于水中,称取茶多糖an蛋白复合物(实施例3制备的茶多糖an蛋白复合物)150g,研磨制成初乳,再加水至5000ml,即得溶液(口服)。
实施例10降血糖的肠溶胶囊
称取茶多糖an蛋白复合物(实施例4制备的茶多糖an蛋白复合物)500g,装入肠溶性胶囊,即得肠溶胶囊。
实施例11降血糖的肠溶片
称取茶多糖an蛋白复合物(实施例3制备的茶多糖an蛋白复合物)500g,加入羧甲基淀粉纳700g,肠溶片包衣配制液800ml,药用硬脂酸镁600g,药用糊精适量,按常规薄膜包衣工艺制作本发明的肠溶片。
应当理解的是,对上述实施例所用试剂或原料的用量进行等比例扩大或者缩小后的技术方案,与上述实施例的实质相同。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!