两亲性壳聚糖-澳洲坚果油纳米微胶囊及其制备方法与应用与流程
本发明属于壳聚糖的改性以及纳米微胶囊制备技术领域,具体涉及两亲性壳聚糖及其制备方法,以及两亲性壳聚糖-澳洲坚果油纳米微胶囊及其制备方法与应用。
背景技术
澳洲坚果又名澳洲胡桃、昆士兰果、夏威夷果等,是一种原产于澳大利亚的树生坚果,其营养价值和药用价值高,素有“干果之王”的誉称。公开号为cn103834470a的中国专利公开了一种利用亚临界萃取技术提取澳洲坚果油的方法,利用亚临界萃取技术,在一定压力和温度下,对干燥粉碎的澳洲坚果进行多次提取,制得高品质的澳洲坚果油。此外,澳洲坚果油还可以通过冷榨、热榨、超临界提取等方法制得。澳洲坚果油富含矿物质、蛋白质和多种不饱和脂肪酸,其脂肪酸组成以油酸、棕榈油酸为主,并含少量的棕榈酸、硬脂酸、亚油酸和花生酸等脂肪酸。澳洲坚果油具有降血压、调节血脂和血糖等功效,还可作为保湿、滋润以及美白祛斑类产品的有效添加剂,在食品、化妆品和药品中均具有广泛应用。但是,澳洲坚果油在常温常压下不稳定,抗氧化能力低且易挥发。在储存、运输和加工过程中,澳洲坚果油易受到光热等因素的影响而氧化变质,且澳洲坚果油直接应用于化妆品,制得的产品涂抹在皮肤表层时,存在皮肤吸收效果较差,留香时间短等问题,上述问题严重限制了澳洲坚果油的应用和发展。
技术实现要素:
本发明的第一个目的在于提供一种两亲性壳聚糖,以解决上述技术问题中的至少一个。
本发明的第二个目的在于提供上述两亲性壳聚糖的制备方法,以解决上述技术问题中的至少一个。
本发明的第三个目的在于提供一种两亲性壳聚糖-澳洲坚果油纳米微胶囊,以解决上述技术问题中的至少一个。
本发明的第四个目的在于提供上述两亲性壳聚糖-澳洲坚果油纳米微胶囊的制备方法,以解决上述技术问题中的至少一个。
本发明的第五个目的在于提供上述两亲性壳聚糖-澳洲坚果油纳米微胶囊在制备含有澳洲坚果油的药品、食品、化妆品中的应用,以解决上述技术问题中的至少一个。
根据本发明的一个方面,提供了一种两亲性壳聚糖,该两亲性壳聚糖为硬脂酸、n-乙酰-l-半胱氨酸接枝壳聚糖,其中,两亲性壳聚糖的分子量为10~300kda。
壳聚糖具有刚性线分子结构,阳离子电荷密度高、生物黏附性好、无毒性且具有良好的抗菌性,可用作纳米微胶囊的壁材。但由于其机械性能差以及在生物溶液和有机溶液中溶解度差,导致壳聚糖的应用受到限制。本发明通过对壳聚糖进行接枝改性,制得两亲性壳聚糖,本发明两亲性壳聚糖用作纳米微胶囊包埋壁材时,既可包埋疏水性物质形成可溶于水的纳米微胶囊固体,也可作为亲水性物质的包埋壁材形成非水溶性纳米微胶囊。本发明两亲性壳聚糖具有良好的生物相容性、生物可降解性和目标特异性,可以解决澳洲坚果油在不同体系中出现互不相溶而应用受到限制等缺陷。
根据本发明的另一个方面,提供了上述两亲性壳聚糖的制备方法,包括如下步骤:
(1)将壳聚糖配置成质量浓度为1.0~3.0%的壳聚糖水溶液,将硬脂酸配置成质量浓度为2.0~5.0%的硬脂酸乙醇溶液;
(2)取等质量的壳聚糖水溶液和硬脂酸乙醇溶液,以1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐作为催化剂,在75~85℃下搅拌反应3~5小时,制得硬脂酸接枝壳聚糖;
(3)步骤(2)反应后加入壳聚糖水溶液质量5~20%的n-乙酰-l-半胱氨酸和壳聚糖水溶液质量1~10%的缩合剂,在75~85℃下搅拌反应3~5小时,加入适量无水乙醇使产物沉淀,洗涤除去未反应的反应物,冷冻干燥即得两亲性壳聚糖;
其中,催化剂1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐的用量为壳聚糖水溶液质量的1~10%,缩合剂为由1-羟基苯并三唑(hbot)和1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐(edc)按质量比1:1混合制得。
本发明优选选用粘度为50~200mpa.s的壳聚糖作为两亲性壳聚糖的制备原料。壳聚糖粘度会影响制得的两亲性壳聚糖用于制备纳米微胶囊时,纳米微胶囊的形成和形态,粘度过大或过小都不利于纳米微胶囊的形成,粘度过小(小于50mpa.s),壳聚糖和制得的两亲性壳聚糖的成膜性能差,不能形成纳米微胶囊,粘度过大(大于200mpa.s),形成的纳米微胶囊容易粘连在一起,分散性不好。本发明制备方法中,优选壳聚糖的粘度在50~200mpa.s时,最有利于纳米微胶囊的形成和均匀分散。
本发明制备方法中,为避免游离巯基氧化,先以1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐(edc)作为催化剂将硬脂酸接枝到壳聚糖氨基上,增加壳聚糖的疏水性;然后再以1-羟基苯并三唑(hobt)和1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐(edc)的混合物作为缩合剂,将n-乙酰-l-半胱氨酸的巯基作为亲水基团与壳聚糖偶联,最终制得两亲性壳聚糖。
在一些实施方式中,上述两亲性壳聚糖的制备方法,步骤(2)和步骤(3)中,搅拌反应中的搅拌速度可以为1000~3000rpm。由此,搅拌效果更好,可以促进反应完成,以及使反应结束后得到的硬脂酸-壳聚糖水溶液或两亲性壳聚糖溶液更加均匀稳定。
在一些实施方式中,上述两亲性壳聚糖的制备方法,硬脂酸的接枝率可以为5~20%,n-乙酰-l-半胱氨酸的接枝率可以为3~20%
当用作纳米微胶囊壁材制备纳米微胶囊时,两亲性壳聚糖中硬脂酸和n-乙酰-l-半胱氨酸接枝率的不同对于纳米微胶囊的形成、包埋率、分散性、缓释效果、生物粘附性以及对皮肤的渗透效果有较大的影响。疏水基硬脂酸的接枝率高,有利于纳米微胶囊自组装,形成的纳米微胶囊稳定性好;亲水基巯基接枝率高,有利于其分散性、生物粘附性增强以及提高对于皮肤的渗透效果。通过调节硬脂酸和n-乙酰-l-半胱氨酸的接枝率,可以提高纳米微胶囊包埋率和分散性。
根据本发明的另一个方面,提供了一种两亲性壳聚糖-澳洲坚果油纳米微胶囊,该两亲性壳聚糖-澳洲坚果油纳米微胶囊由壁材包埋芯材形成,芯材为澳洲坚果油,壁材为本发明提供的两亲性壳聚糖。
本发明采用两亲性壳聚糖作为壁材,对澳洲坚果油进行包埋形成可溶于水的纳米微胶囊颗粒,在不破坏澳洲坚果油生物活性的前提下,降低了澳洲坚果油的挥发性以及对光热不稳定性,有效延缓了澳洲坚果油的挥发速率,延长其留香时间,解决了澳洲坚果油在药品、食品、化妆品等使用中存在的易变质及易受外界环境影响导致其失活的问题,从而有效地保护其活性成分不受外界条件的影响,提高其稳定性,方便其储藏运输及应用。此外,两亲性壳聚糖-澳洲坚果油纳米微胶囊微粒较小,比表面积大,有利于其在皮肤组织的渗透,促进皮肤底层对澳洲坚果油的吸收,从而可有效提高澳洲坚果油的生物活性及利用度,同时具有缓控释的性能,延长了澳洲坚果油的功效时间。
在含水环境中,两亲性壳聚糖可通过分子内或分子间相互作用自组装,将疏水部分从含水环境中分离并组装成最接近澳洲坚果油芯材的部分,且两亲性壳聚糖中的疏水基团可以促进自组装成纳米微胶囊,以及改善与生物有关的脂质结构(如细胞膜)的相互作用,因此,以本发明两亲性壳聚糖作为壁材,可以提高纳米微胶囊对澳洲坚果油的包埋率以及装载量,同时,可以提高纳米微胶囊的皮肤渗透作用和与其他物质的相容性。本发明纳米微胶囊的包埋率可达96.0%~99.5%,装载量可达30.0%~50.0%,粒径大小为100~500nm。
根据本发明的另一个方面,还提供了上述纳米微胶囊的制备方法,包括如下步骤:
(1)将两亲性壳聚糖配置成质量浓度为0.5~2.0%的两亲性壳聚糖水溶液,加入澳洲坚果油进行乳化,得到乳化液;其中,澳洲坚果油与两亲性壳聚糖的质量比为(5~10):1;
(2)在乳化液中加入交联剂,在常温条件下进行交联反应,交联反应完全后,对反应产物进行干燥,即得两亲性壳聚糖-澳洲坚果油纳米微胶囊;
本发明采用乳化自组装交联的方法以两亲性壳聚糖作为壁材对澳洲坚果油进行包埋,利用交联剂对纳米微胶囊进行固化作用,制得了性质稳定的纳米微胶囊悬浮液,经干燥后制得两亲性壳聚糖-澳洲坚果油纳米微胶囊。
在一些实施方式中,上述纳米微胶囊的制备方法,步骤(1)中乳化的条件可以为:室温,搅拌速度为2000rpm~8000rpm。由此,可以使形成的纳米粒子粒径较为均一,均在100~500nm。
在一些实施方式中,上述纳米微胶囊的制备方法,步骤(2)中交联剂可以选自氯化钙和硝酸钙中的至少一种,用量为两亲性壳聚糖用量的30~60%。
在一些实施方式中,上述纳米微胶囊的制备方法,步骤(2)中还可以包括如下步骤:交联反应完全后,用无水乙醇对反应产物进行洗涤,洗涤完成后经抽滤、冷冻干燥,即得两亲性壳聚糖-澳洲坚果油纳米微胶囊。由此,可以降低干燥过程中纳米粒子之间的团聚程度,得到分散性好的纳米颗粒。
根据本发明的另一个方面,还提供了上述纳米微胶囊在制备含有澳洲坚果油的药品、食品、化妆品中的应用。使用本发明两亲性壳聚糖-澳洲坚果油纳米微胶囊替代澳洲坚果油用于制备含有澳洲坚果油的药品、食品、化妆品,可有效解决澳洲坚果油在药品、食品、化妆品等的应用过程中存在的不稳定、易挥发变质等问题,同时,还可以提高澳洲坚果油在皮肤上的渗透效果,促进皮肤底层对澳洲坚果油的吸收,可以有效提高澳洲坚果油在化妆品中的应用效果,从而提高化妆品的保湿、祛斑、美白亮肤等功效作用。
应用于药品时,本发明两亲性壳聚糖-澳洲坚果油纳米微胶囊的用量优选为每升药液中添加5.0~10.0g,可以制备成两亲性壳聚糖-澳洲坚果油纳米微胶囊口服液。
应用于食品时,本发明两亲性壳聚糖-澳洲坚果油纳米微胶囊的用量优选为每升饮料中添加2.0~3.0g,可以制备成两亲性壳聚糖-澳洲坚果油纳米微胶囊饮料或固体饮料。
应用于化妆品时,本发明两亲性壳聚糖-澳洲坚果油纳米微胶囊的用量优选为每公斤精华霜膏体中添加1.0~2.0g,可以制备成美白润肤精华霜;或者优选为每升护肤品添加0.5-2.0g,可以制备成沐浴露。
附图说明
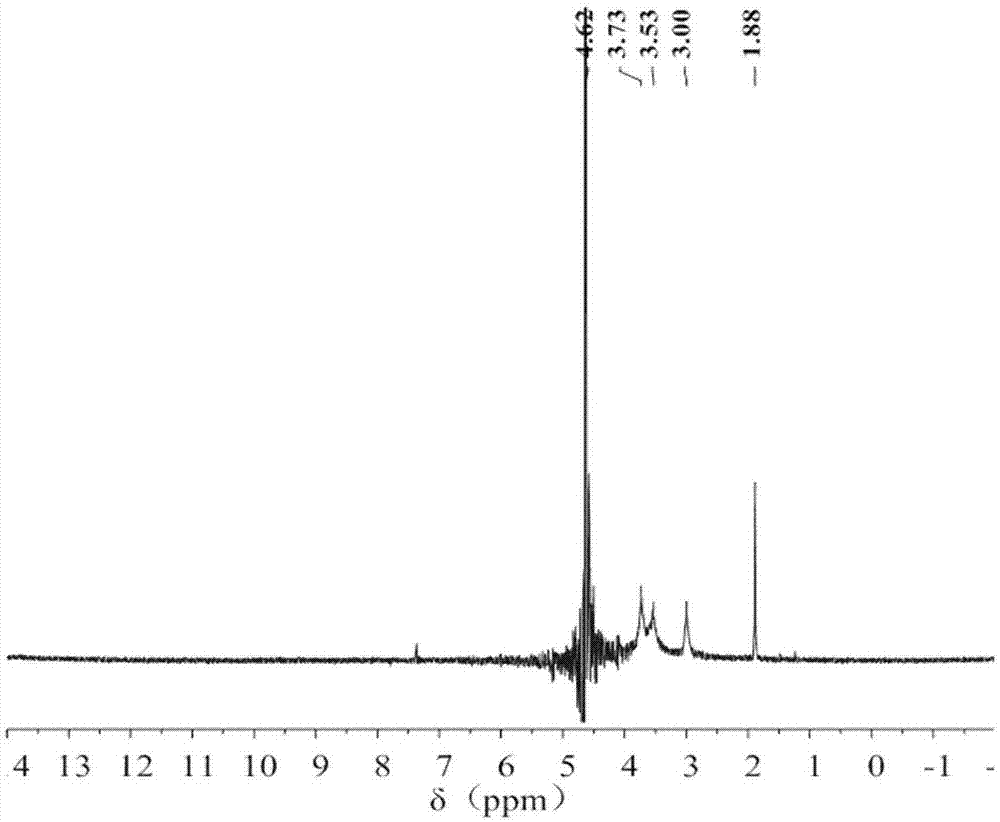
图1是未改性壳聚糖的核磁共振氢谱图;
图2是本发明实施例1制得的两亲性壳聚糖核磁共振氢谱图;
图3是未改性壳聚糖和本发明实施例1制得的两亲性壳聚糖的傅立叶红外光谱图,其中,a代表未改性壳聚糖的傅立叶红外光谱图,b代表本发明实施例1制得的两亲性壳聚糖的傅立叶红外光谱图;
图4为本发明实施例4制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊的扫描电子显微镜(sem)图;
图5为本发明实施例4制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊的激光粒度大小与分布图;
图6为本发明实施例4制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊在不同温度条件下的缓释曲线图。
具体实施方式
下面结合具体实施例对本发明作进一步详细的说明,但本发明的实施方式不限于此。
下述实施例中涉及的物料,除特别注明的物料外,均可从商业渠道获得。对于未特别注明的工艺参数,可参照常规技术进行。
实施例1两亲性壳聚糖的制备
(1)取粘度不大于200mpa.s的壳聚糖,用质量浓度为1.0%的冰醋酸水溶液配置成质量浓度为1.0%的壳聚糖水溶液;取硬脂酸,用无水乙醇配置成质量浓度为2.0%的硬脂酸乙醇溶液;
(2)取1kg上述质量浓度为1.0%的壳聚糖水溶液和1kg上述质量浓度为2.0%的硬脂酸乙醇溶液,混合,搅拌均匀后加入10g的1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐,在温度为80℃、搅拌速度为3000rpm的条件下搅拌反应3h,将硬脂酸作为疏水基团接枝到壳聚糖分子中,得到硬脂酸疏水基团接枝率为5%的硬脂酸接枝壳聚糖;
(3)步骤(2)反应后加入50g的n-乙酰-l-半胱氨酸及10g由1-羟基苯并三唑和1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐按质量比1:1混合制得的缩合剂,在温度为80℃、搅拌速度为3000rpm的条件下搅拌反应3h,将n-乙酰-l-半胱氨酸作为亲水基团接枝到壳聚糖分子中,加入适量无水乙醇使产物沉淀,洗涤除去未反应的反应物,冷冻干燥后得到n-乙酰-l-半胱氨酸接枝率为3%的两亲性壳聚糖。
图1是本实施例所用原料(未改性壳聚糖)的核磁共振氢谱图;图2是本实施例制得的两亲性壳聚糖核磁共振氢谱图。由图1和图2对比可知,图2中化学位移在1.8-2.5之间有明显的巯基特征峰,说明该化合物中含有巯基基团,化学位移在11.98处出现了羧基特征峰,从而证明n-乙酰-l-半胱氨酸和硬脂酸已成功接到壳聚糖分子上。
图3是本实施例所用原料(未改性壳聚糖)和本实施例制得的两亲性壳聚糖的傅立叶红外光谱图。由图3可知,改性后的壳聚糖在1527cm-1附近处出现了一个吸收峰,此为酰胺键的特征性吸收峰,说明n-乙酰-l-半胱氨酸已连接到壳聚糖分子上,形成了新的酰胺键;同时在2923cm-1、2680cm-1附近处也出现了比较微弱的吸收峰,此为羧基和巯基的特征吸收峰,说明n-乙酰-l-半胱氨酸和硬脂酸已成功接到壳聚糖分子上。
实施例2两亲性壳聚糖的制备
(1)取粘度不大于200mpa.s的壳聚糖,用质量浓度为1.0%的冰醋酸水溶液配置成质量浓度为3.0%的壳聚糖水溶液;取硬脂酸,用无水乙醇配置成质量浓度为5.0%的硬脂酸乙醇溶液;
(2)取1kg上述质量浓度为3.0%的壳聚糖水溶液和1kg上述质量浓度为5.0%的硬脂酸乙醇溶液,混合,搅拌均匀后加入100g的1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐,在温度为80℃、搅拌速度为1000rpm的条件下搅拌反应5h,将硬脂酸作为疏水基团接枝到壳聚糖分子中,得到硬脂酸疏水基团接枝率为20%的硬脂酸接枝壳聚糖;
(3)步骤(2)反应后加入60g的n-乙酰-l-半胱氨酸及30g由1-羟基苯并三唑和1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐按质量比1:1混合制得的缩合剂,在温度为80℃、搅拌速度为1000rpm的条件下搅拌反应5h,将n-乙酰-l-半胱氨酸作为亲水基团接枝到壳聚糖分子中,加入适量无水乙醇使产物沉淀,洗涤除去未反应的反应物,冷冻干燥后得到n-乙酰-l-半胱氨酸接枝率为20%的两亲性壳聚糖。
实施例3两亲性壳聚糖的制备
(1)取粘度不大于200mpa.s的壳聚糖,用质量浓度为1.0%的冰醋酸水溶液配置成质量浓度为2.0%的壳聚糖水溶液;取硬脂酸,用无水乙醇配置成质量浓度为3.0%的硬脂酸乙醇溶液;
(2)取1kg上述质量浓度为2.0%的壳聚糖水溶液和1kg上述质量浓度为3.0%的硬脂酸乙醇溶液,混合,搅拌均匀后加入80g的1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐,在温度为80℃、搅拌速度为2000rpm的条件下搅拌反应4h,将硬脂酸作为疏水基团接枝到壳聚糖分子中,得到硬脂酸疏水基团接枝率为10%的硬脂酸接枝壳聚糖;
(3)步骤(2)反应后加入140gn-乙酰-l-半胱氨酸及20g由1-羟基苯并三唑和1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐按质量比1:1混合制得的缩合剂,在温度为80℃、搅拌速度为2000rpm的条件下搅拌反应4h,将n-乙酰-l-半胱氨酸作为亲水基团接枝到壳聚糖分子中,加入适量无水乙醇使产物沉淀,洗涤除去未反应的反应物,冷冻干燥后得到n-乙酰-l-半胱氨酸接枝率为12%的两亲性壳聚糖。
实施例4两亲性壳聚糖-澳洲坚果油纳米微胶囊的制备
(1)取5g实施例1制得的两亲性壳聚糖,加去离子水配置成质量浓度为0.5%的两亲性壳聚糖水溶液,加入25g澳洲坚果油,并在室温条件下以2000rpm的乳化搅拌速度高速搅拌乳化,得到乳白色乳化液;
(2)在上述乳白色乳化液中缓慢滴加1.5g氯化钙,在常温条件下搅拌至交联反应完全,用无水乙醇对反应产物进行洗涤,洗涤完成后经抽滤、冷冻干燥,得两亲性壳聚糖-澳洲坚果油纳米微胶囊。
本实施例制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊,其包埋率为99.5%,装载量为50.0%,粒径大小为100nm。
图4为本实施例制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊的sem图,由图4可知,本实施例两亲性壳聚糖-澳洲坚果油纳米微胶囊表面呈规则球形,具有良好的分散性和均匀性。
图5为本实施例制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊的激光粒度大小与分布图,由图5可知,本实施例两亲性壳聚糖-澳洲坚果油纳米微胶囊的粒径大小在100纳米左右,粒径大小的分布范围较为集中。
图6为本实施例制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊不同温度条件下的缓释曲线图,由图6可知,在25℃条件下,纳米微胶囊释放30天后累积释放量为40%左右;在50℃条件下,纳米微胶囊释放30天后累积释放量为60%左右;在100℃条件下,纳米微胶囊释放30天后累积释放量为80%左右。
由此可知,以本发明两亲性壳聚糖为壁材制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊的包埋率高、分散性和均匀性好,澳洲坚果油经过两亲性壳聚糖包埋后,挥发性降低,稳定性得到显著的提高。
实施例5两亲性壳聚糖-澳洲坚果油纳米微胶囊的制备
(1)取20g实施例2制得的两亲性壳聚糖,加去离子水配置成质量浓度为2.0%的两亲性壳聚糖水溶液,加入200g澳洲坚果油,并在室温条件下以8000rpm的乳化搅拌速度高速搅拌乳化,得到乳白色乳化液;
(2)在上述乳白色乳化液中缓慢滴加12g硝酸钙,在常温条件下搅拌至交联反应完全,用无水乙醇对反应产物进行洗涤,洗涤完成后经抽滤、冷冻干燥,得两亲性壳聚糖-澳洲坚果油纳米微胶囊。
本实施例制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊,其包埋率为96.0%,装载量为30.0%,粒径大小为500nm。
实施例6两亲性壳聚糖-澳洲坚果油纳米微胶囊的制备
(1)取10g实施例3制得的两亲性壳聚糖,加去离子水配置成质量浓度为1.0%的两亲性壳聚糖水溶液,加入100g澳洲坚果油,并在室温条件下以6000rpm的乳化搅拌速度高速搅拌乳化,得到乳白色乳化液;
(2)在上述乳白色乳化液中缓慢滴加8g氯化钙,在常温条件下搅拌至交联反应完全,用无水乙醇对反应产物进行洗涤,洗涤完成后经抽滤、冷冻干燥,得两亲性壳聚糖-澳洲坚果油纳米微胶囊。
本实施例制得的两亲性壳聚糖-澳洲坚果油纳米微胶囊,其包埋率为97.0%,装载量为40.0%,粒径大小为200nm。
以上所述的仅是本发明的一些实施方式。对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!