一种抗体、多肽和核酸组合治疗靶向载体及制法和用途的制作方法
本发明涉及的是一种药物
技术领域:
的生物大分子药物输送技术,特别是一种可用于抗体、多肽和核酸(dna、sirna、microrna以及shrna等)体内系统输送的非病毒载体体系的构建及制备技术,具体涉及一种抗体、多肽和核酸药物组合治疗靶向输送纳米颗粒。
背景技术:
原癌基因人类表皮生长因子受体2(humanepidermalgrowthfactorreceptor-2,her2)基因,即c-erbb-2基因,定位于染色体17q12-21.32上,编码相对分子质量为185000的跨膜受体样蛋白,具有酪氨酸激酶活性。her2是重要的乳腺癌预后判断因子,her2阳性(过表达或扩增)乳腺癌占所有乳腺癌患者20-25%,具侵袭性强、转移性高、生存期短的特点,其临床特点和生物学行为有特殊表现,治疗模式也与其他类型的乳腺癌有很大区别。her2阳性乳腺癌作为预后较差的类型需接受以her2靶向治疗为基础的联合治疗[hernandezba等人,her2阳性转移性乳腺癌的当前和新兴疗法,胸科杂志,2016;29:170-7]。作为第一个靶向her2的人源化单克隆抗体,曲妥珠单抗(赫赛汀herceptin)的问世改变了her2阳性乳腺癌患者的预后,自1998年在美国获批上市治疗晚期乳腺癌后,适应证逐渐扩增至her2阳性早期乳腺癌,影响了乳腺癌的诊治模式。2002年曲妥珠单抗在中国获批上市,2014年陆续进入部分省市医疗保险药物目录范围。乳腺癌术后辅助治疗联合抗her2单抗与单纯手术相比能提高患者dfs与os。对于晚期乳腺癌,化疗基础上加用抗her2治疗同样可使中位os期明显延长约6~8个月。抗her2单克隆抗体赫赛汀(anti-humanher-2mab,herceptin)现已成为her2阳性乳腺癌标准治疗方案,在早期和晚期(转移性)乳腺癌治疗中均显示出疗效。研究显示,在her2阳性乳腺癌妇女中抗her2单克隆抗体单药、联用标准化疗或化疗后使用,均可提高反应率、无病生存期(diseasefreesurvival,dfs)和总生存期(overallsurvival,os),同时提高患者生活质量。her2阳性乳腺癌患者治疗有效的要求是:总生存期延长和毒性反应小。抗her2单抗单药有效率为15%-20%左右,与化疗联合应用有效率提高。目前与抗her2治疗最常用的联用药物包括紫杉类、环磷酰胺、长春瑞滨等。[gianolioda等人,用与曲妥珠单抗缀合的海兔毒素15衍生物靶向her2阳性癌症,新型抗体药物缀合物,癌症化疗和药理学,2012,70,439-449.]通常选择非蒽环类药物与靶向药物联合,紫杉类为最常用组合方案。需注意的是,曲妥珠单抗联合使用中临床要注意心脏安全性。联合用药其他主要毒副反应为中性粒细胞减少(59.5%)、恶性呕吐(40.5%)和肝功能异常(21.6%)。目前为止仍然难以解决这些药物带来的毒副作用,研究热点集中在如何探索应用新型药物提高患者的预后并降低毒性反应。肿瘤的发生是多种因素作用的结果,但最终都要涉及癌基因的表达与调控,目前已发现了很多与肿瘤相关的基因,因此特异地抑制病变基因的sirna药物已成为寻找抗癌药物的新方向。与传统的小分子化疗药物相比,核酸药物具有结构明确、治疗靶点清楚、药效高和副作用低等优点[kierzekr等人,用于鉴定结合位点和探测rna的结构的微阵列,核酸研究,2015,43,1-12.]是生物大分子药物的重要组成部分,但核酸药物需要进入细胞内才能发挥作用,其致命的弱点是易在体内降解,难以到达治疗位点。纳米粒(nanoparticles)作为一种高效的药物载体,具有增加肿瘤细胞内药物溶解度、延长药物在肿瘤部位滞留时间、提高药物生物利用度和具有一定靶向性等特点[limw等人,用于控制细胞内双重药物释放和her-2过表达乳腺癌的双重靶向的氨磷汀结合的ph敏感性磷酸钙包覆的磁性两亲明胶纳米粒子,控释杂志,2015;220,107-18.],成为抗肿瘤药物研发热点。肿瘤部位的生理特征使得纳米粒优先聚积在肿瘤区域,进而使大量药物富集于肿瘤部位,从而提高抗肿瘤药物的疗效和减少化疗非特异性不良反应[tigliaydinrs.等人,用于癌症治疗的药物靶向系统:纳米技术方法。药物化学的迷你评论,脂质体研究杂志,2015,14,1048-54]。发明人经过长时间的研究,研制出利用透明质酸、多肽和无毒磷酸脂质体(dotap/dope)构建的安全高效的肿瘤靶向输送sirna的药用纳米输送体系[谢舫等人,基于模块化策略的内源分子组装的选择性靶向肝癌的核酸纳米载体,分子药剂学,2017,14,1841-1851.],由于这些材料均为fda认证的药用材料,因此我们的制剂在材料方面是可产业化的。为了能够实现在体内长效循环,透明质酸作为具有肿瘤靶向性的体内天然多糖分子,以其良好的生物安全性与相容性被用来屏蔽复合物polyplexes(聚阳离子/sirna)或lipoplexes(阳离子脂质体/sirna)的表面正电荷,由于其能够主动靶向到肿瘤细胞表面的cd44,因此比同类的葡聚糖转染活性高一倍多[torrecillaj等人,一种新的通过自由基转移聚合得到的透明质酸衍生物作为cd44受体肿瘤靶向的sirna载体,大分子生物科学,2015,15,1605-1615.],并能够提高输送系统在血液中的稳定性,防止这些纳米颗粒被血液中的其它蛋白黏附或sirna被核酸酶降解,减少纳米颗粒在血液中的清除并实现主动靶向。我们通过模块组装方式,合理利用静电、疏水以及氢键等非化学共价键构建了由阳离子多肽与sirna形成内核、表面依次覆盖不规则单层脂质膜和透明质酸衍生物的纳米颗粒,由于herceptin的电势在正负10毫伏之间、市场前景及预期效益:近年来乳腺癌的发病率呈逐年上升趋势,其中近35%为her2阳性,her2阳性乳腺癌具侵袭性强、转移性高、生存期短的特点。her2阳性乳腺癌作为预后较差的类型需接受以her2靶向治疗为基础的联合治疗,利用抗her2单抗赫赛汀联合化疗药物如紫衫醇等进行联合治疗的毒性较大,难以安全有效地抑制肿瘤的生长和转移,目前研究已经表明,her2阳性乳腺癌细胞内的抗凋亡基因survivin基因过表达,如果能够抑制该基因,将促进肿瘤细胞的凋亡,从而抑制her2阳性乳腺癌的增大。技术实现要素:本发明的目的在于克服现有生物大分子药物体内输送技术中的不足,利用食品药品监督管理局(fda)允许的生物材料通过合理组装提供一种可以紧密包裹蜂毒素和核酸、表面带负电荷的连接抗体herceptin纳米颗粒,使其在体内长效循环和靶向特定细胞并有效进入细胞内的核酸载体;更具体来说,是一种抗体、多肽和核酸生物大分子组合治疗靶向特定细胞表面的高效安全的生物大分子纳米载体。本发明的目的是通过以下技术方案实现的:第一方面,本发明涉及一种抗体、多肽和核酸组合治疗靶向载体,所述靶向载体是表面带负电荷或电中性的具有靶向基团的生物大分子药物输送纳米颗粒;所述靶向载体的内核是由多肽与核酸组成,所述抗体、多肽和核酸组合治疗靶向载体具有外壳,所述外壳是由不规整的阳离子脂质膜和聚阴离子先后紧密覆盖包裹组成,所述聚阴离子通过静电和氢键作用包裹在所述纳米颗粒的表面。优选的,所述聚阴离子选自透明质酸或透明质酸衍生物,优选透明质酸。优选的,所述阳离子脂质膜是由阳离子脂质与中性脂质或胆固醇或两亲性分子形成的阳离子脂质体或阳离子胶束。优选的,所述阳离子脂质体具有阳离子双层磷脂膜。优选的,所述多肽是阳离子多肽或在水溶液中带正电荷的蛋白质。进一步,所述多肽包含蜂毒素和(klak)n多肽,优选蜂毒素。优选的,所述抗体是抗her2过表达乳腺癌肿瘤的herceptin。优选的,所述核酸选自dna、sirna、microrna或shrna中的一种或几种,更优选为上述四种组合而成。第二方面,本发明还涉及一种抗体、多肽和核酸组合治疗靶向载体的制备方法,所述方法包括如下步骤:a、通过薄膜分散法制备阳离子脂质体或阳离子胶束:阳离子脂质与中性脂质或胆固醇或两亲性分子水合制得阳离子脂质体或阳离子胶束;b、药物输送纳米颗粒的制备:将所述阳离子脂质体稀释到5~10μg/ml,与20~40μg/ml的多肽混合后,加入到核酸中,常温孵育,制得表面带正电荷的纳米颗粒;c、将所述表面带正电荷的纳米颗粒通过酰胺键将抗体赫赛汀(herceptin)与透明质酸(ha)连接的透明质酸-herceptin(ha-her)溶液混合均匀,组装成带负电荷或电中性的纳米颗粒即得所述抗体、多肽和核酸组合治疗靶向载体。优选的,所述阳离子脂质体、多肽、核酸的质量比为(0.5~2):(2~8):1;所述ha-her中的透明质酸与核酸的质量比为10:1~40:1;所述ha与抗体herceptin的摩尔质量比为20:1~5:1。更优选,所述阳离子脂质体、多肽、核酸的质量比为1:(2~8):1;所述透明质酸、核酸的质量比为10:1~30:1。第三方面,本发明还涉及一种抗体、多肽和核酸组合治疗靶向载体在作为体内系统输送抗体、多肽和核酸体系中的用途。本发明通过核酸、阳离子多肽即蜂毒素和(klak)n、阳离子脂质体,以及ha-her通过协同作用自组装构建的纳米载体的组成与功能如下:(1)利用正电荷多肽序列包裹核酸形成纳米复合物;(2)利用脂质膜包裹阳离子多肽/核酸纳米复合物并利用脂质融膜作用使载体突破细胞膜与内涵体膜;(3)利用透明质酸屏蔽载体内部的正电荷和并靶向肿瘤细胞表面受体cd44。本发明的有益效果是:利用蜂毒素和带正电荷并易于插在脂质膜上的性质,将阳离子脂质体、核酸和带正电荷的蜂毒素自组装形成表面带正电荷的纳米复合物,该复合物的特点是蜂毒素和核酸组成纳米颗粒的内核,然后紧裹单层的脂质膜。在此基础上,外层包裹特定靶向肿瘤的聚合物,由于该复合物的各个组成部分不仅通过静电作用形成,而且脂质膜的密闭体系阻碍了蜂毒素的外泄,并且表面的ha-her也与蜂毒素形成氢键,进一步阻止了蜂毒素外泄,形成紧密的外壳。该纳米颗粒在体内实现长效循环,特定靶向her2高表达的乳腺癌细胞,减少细胞表面her2受体的表达,并通过her2受体通道被细胞内吞,然后ha-her与剩余的纳米颗粒分离,暴露出来的阳离子脂质膜通过融膜作用突破内涵体膜,将多肽、核酸,以及二者的复合物释放在细胞浆中,实现了利用hercptin靶向her2高表达的乳腺癌的抗体、多肽和核酸的联合治疗。利用内源性分子构建内核由蜂毒素和核酸组成、外壳依次由不规则脂质膜和透明质酸形成的有效输送sirna的纳米颗粒,并且其表面装载抗体,具有药用载体的潜质。该纳米载体在透明质酸的侧链通过较稳定的酰胺键连接单抗赫赛汀制备透明质酸衍生物(ha-her)将上述“三药合一”的纳米制剂用来治疗her2阳性乳腺癌,开辟一条sirna、蜂毒素与抗体药联合制剂的新道路,为目前单用抗体或化学药制备抗癌制剂开辟更实用高效新剂型和新的治疗途径。相信其具有很强的市场竞争能力,最终成为具有巨大的经济和社会效益的新型药用制剂。因此,本发明与现有的脂质体/聚合物/核酸纳米颗粒(lipopolyplexes)相比,不仅避免了聚阳离子的毒性(多肽是人体内源性分子),而且有效突破了通过peg化实现体内长效循环的弊端。兼顾到达靶细胞之前的稳定性和进入靶细胞之后的生物响应性。附图说明通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:图1为本发明抗体、多肽和核酸组合治疗靶向载体(ahlpr)的构建示意图。图2为本发明抗体、多肽和核酸组合治疗靶向载体ahlpr的透射电镜图。缩写中:a代表单克隆抗体herceptin;h代表透明质酸;l代表阳离子脂质体;p代表多肽;r代表sirna。图3为本发明抗体、多肽和核酸生物大分子组合治疗靶向纳米颗粒ahlpr包裹sirna的凝胶电泳图。marker代表分子量对照组dna,sirna代表裸sirna,lpr代表阳离子多肽、阳离子脂质体和sirna质量比为1:4:1组装的表面带正电荷的纳米颗粒,hlpr代表透明质酸、阳离子多肽、阳离子脂质体和sirna质量比为14:1:4:1组装的表面带正电荷的纳米颗粒,ahlpr代表ha-her、阳离子多肽、阳离子脂质体和sirna质量比为14:1:4:1组装的纳米颗粒。其中a代表单克隆抗体herceptin;h代表透明质酸;l代表阳离子脂质体;p代表多肽,r代表sirna。图4为本发明抗体、多肽和核酸组合治疗靶向载体ahlpr包裹sirna的sk-br-3细胞内吞实验。其中ha-her、阳离子多肽、阳离子脂质体和sirna质量比为14:1:4:1。a代表单克隆抗体herceptin;h代表透明质酸;l代表阳离子脂质体;p代表多肽;r代表sirna。图5为本发明抗体、多肽和核酸组合治疗靶向载体ahlpr和相应的对照组hlpr和lpr的skbr3细胞毒性图。lpr代表阳离子多肽、阳离子脂质体和sirna质量比为1:4:1组装的表面带正电荷的纳米颗粒,hlpr代表透明质酸、阳离子多肽、阳离子脂质体和sirna质量比为14:1:4:1组装的表面带正电荷的纳米颗粒,ahlpr代表ha-her、阳离子多肽、阳离子脂质体和sirna质量比为14:1:4:1组装的纳米颗粒。其中a代表单克隆抗体herceptin;h代表透明质酸;l代表阳离子脂质体;p代表多肽;r代表sirna。图6为本发明抗体、多肽和核酸组合治疗靶向载体的体内肝肾功能检测毒性。图7为本发明抗体、多肽和核酸组合治疗靶向载体的体重。图8为本发明抗体、多肽和核酸组合治疗靶向载体ahlpr的体内皮下肿瘤药效。具体实施方式下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。本发明涉及一种药物
技术领域:
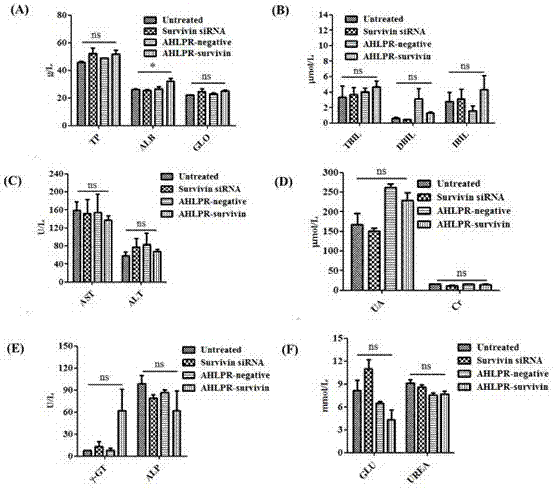
的可用于抗体、多肽和核酸组合治疗靶向载体,是一种通过聚阴离子、阳离子脂质体、多肽和核酸合理组装的核酸输送体系,如其示意图1;具体由四个组份组成,分别是:a、聚阴离子,包括透明质酸、透明质酸衍生物;b、阳离子脂质体,包括可以形成阳离子双层磷脂膜的由阳离子脂质与中性脂质或胆固醇形成的脂质体;c、多肽,包括蜂毒素等阳离子多肽;d、核酸,包括dna,sirna,microrna以及shrna。其中,多肽组分进行核酸的包裹和跨越磷脂膜的作用;进一步的,多肽组分进行核酸的包裹和并靶向细胞表面受体的作用。阳离子脂质体组分主要进行融合细胞膜和内涵体膜作用。聚阴离子组分进行屏蔽电荷的作用。进一步的,聚阴离子组分进行屏蔽电荷与靶向细胞表面受体的作用。多肽是由阳离子多肽序列组成。本发明涉及的用阳离子多肽是一类集包裹核酸与药用为一身的阳离子多肽,以下实施例中所用阳离子多肽为蜂毒素。本发明涉及一种上述的抗体、多肽和核酸组合治疗靶向载体的制备方法,包括如下步骤:a、赫赛汀(herceptin)与透明质酸(ha)的连接反应赫赛汀用的是市售人用注射剂,100k超滤离心管超滤除去其中的赋形剂:l-盐酸组氨酸和l-组氨酸,因为组氨酸也为碱性氨基酸,对反应有干扰。超滤后浓度为17.6mg/ml(9.51×10-5mol/l)。每个赫赛汀分子含44个组氨酸。具体实验步骤如下:羧基的活化,ph6.0的mes缓冲溶液中,ha、n-羟基琥珀酰亚胺(nhs)、+1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)的摩尔浓度分别为0.2mm,5mm,2mm,室温活化反应15min。使用浓缩的pbs和naoh,将活化后的反应液ph调至7.2~7.5,加入herceptin,其中ha和herceptin中组氨酸氨基的摩尔比为50-1:1,室温反应2小时后,纯水透析除盐。生成ha-her,其中ha和抗体herceptin的摩尔质量比分别为20:1,10:1和5:1。b、通过薄膜分散法制备阳离子脂质体:采用阳离子脂质((2,3-二油氧基丙基)三甲基氯化铵(dotap))与中性脂质(1,2-二油酰-sn-甘油-3-磷酸乙醇胺(dope))的质量比为0.5~1:1的氯仿溶液旋转蒸发掉溶剂,然后水合过夜,超声30~60分钟。c、纳米载体的制备:利用上述制备好的阳离子脂质体稀释到5~10μg/ml,与20~40μg/ml的多肽按质量比分别为1:8、1:4和1:2三个比例进行混合,再加到dna和sirna中制备表面带正电荷的纳米颗粒,其中纳米颗粒的阳离子脂质体、多肽和核酸的质量比分别为1:8:1、1:4:1和1:2:1,在常温下孵育25~35分钟。然后对应加入不同比例的ha-her水溶液,其中ha-her中ha与dna或sirna的质量比分别为10:1:8:1、14:1:4:1和30:1:2:1并混合均匀,放置5~25分钟。本发明对抗体、多肽和核酸组合治疗靶向载体的物化性质表征方法包括:凝胶电泳、动态光散射和zeta电位;抗体、多肽和核酸组合治疗靶向载体的细胞毒性实验的sirna是survivinsirna、所用的阳离子多肽是蜂毒素;抗体、多肽和核酸组合治疗靶向载体的细胞内吞实验的sirna是cy5标记的无序sirna、所用的阳离子多肽是蜂毒素;纳米颗粒的毒性和细胞内吞实验的细胞是skbr3细胞;抗体、多肽和核酸生物大分子组合治疗靶向纳米颗粒体内输送抗癌模型实验所构建皮下肿瘤所用细胞为skbr3细胞、sirna是survivinsirna、所用的阳离子多肽是蜂毒素。实施例1、抗体、多肽和核酸组合治疗靶向载体的制备方法如图1所示,抗体、多肽和核酸组合治疗靶向载体的用于测物化性质的体系在水溶液中进行。将上述不同质量比例的阳离子脂质体与多肽混合后加入到核酸水溶液中继续混合均匀。其中具体实验中采用了阳离子脂质体、多肽和核酸的质量比分别为1:8:1、1:4:1和1:2:1在室温下孵育30分钟,然后将不同比例的ha-her加入该混合物中,并充分混合均匀,其中ha-her中ha与dna或sirna的质量比分别为10:1:8:1、14:1:4:1和30:1:2:1静置10~25分钟。用于细胞实验的载体体系用无血清培养基代替超纯水即可。实施例2、抗体、多肽和核酸组合治疗靶向载体的zeta电位采用zetasizer2000测定复合物的表面电荷,样品测定时间设置为自动,每个样品测定3次,取平均值作图。复合物的ζ电位测定结果如表1所示。由表1可知:透明质酸作为外壳屏蔽电荷时纳米颗粒hlpr的电势电位为负电荷-38mv,ha-her作为外壳屏蔽电荷时纳米颗粒ahlpr的电动电位接近中性电荷(-12mv),在此基础上,我们选用了透明质酸与sirna的质量比值为14:1的ha-her为外壳组装纳米载体进行研究。表1表1为抗体、多肽和核酸生组合治疗靶向载体ahlpr和相应的对照组hlpr和lpr的粒径和电动电位;其中,a代表单克隆抗体herceptin;h代表透明质酸;l代表阳离子脂质体;p代表多肽;r代表sirna。实施例3、抗体、多肽和核酸组合治疗靶向载体(纳米颗粒)的粒径室温条件下,用malvernnanozs激光粒度仪测定双靶向纳米颗粒的水化半径,折射介质设置为水,折射率为1.33,粘度为0.8872cp,每个样品测定3次,取平均值作图。复合物的粒径测定结果,如表1所示,抗体、多肽和核酸组合治疗靶向输送纳米颗粒的粒径在160nm左右。比透明质酸作为外壳的粒径稍微大一点。实施例4、通过透射电镜观察抗体、多肽和核酸组合治疗靶向载体的形貌将制备好的lpr、hlpr和ahlpr三个样品滴加到铜网上,然后滴加质量比4%的磷钨酸溶液,用滤纸吸干铜网表面上的液体,然后放置过夜,进行透射电镜拍摄。所得实验结果如图2:胶束呈规整的圆球状。大小在30-60纳米之间。实施例5、抗体、多肽和核酸组合治疗靶向载体的凝胶电泳配置质量比1.0%琼脂糖溶液用于dna检测(质量比3.0%琼脂糖溶液用于dna检测),在微波炉中加热溶解,取40ml溶液,倒入专用的eb污染的烧杯中,加入约4μl的eb溶液,搅匀后倒入模具中,插上梳子,约30min之后,胶就凝固了,电泳槽中加入适量tae缓冲液,将琼脂糖凝胶放入电泳槽等待上样。然后配置不同质量比的复合物溶液,室温孵育30min。上样的marker选用1000-10000kb的质粒maker,上样时先取1μl的上样缓冲液,加入5μl的样品样品,混合均匀后,加入到凝胶孔中。加上电压120伏的电压,蓝色的溴酚蓝会快速的移动到胶的底端之后,约20min,用紫外凝胶成像系统拍照。复合物的凝胶电泳结果,如图3所示;图中各个样品的具体命名见表2。如图3所示,结果显示所有的载体将sirna完全包裹住,故sirna在电泳时无迁移,泳道中没有条带。表2.不同纳米颗粒的组成与名称组分各个组分的质量比lprl:p:r=1:4:1hlprh:l:p:r=14:1:4:1ahlpra:h:l:p:r=10~2:14:1:4:1a代表单克隆抗体herceptin;h代表透明质酸;l代表阳离子脂质体;p代表多肽;r代表sirna。实施例6、抗体、多肽和核酸组合治疗靶向载体(纳米颗粒)细胞毒性实验采用cck8法测定双靶向纳米颗粒的毒性,结果如图4所示。以lipofectamine2000(lipofectamine)和pei25kda作为阳性对照组,不做任何处理的细胞为阴性对照组。在96孔细胞培养板中,加入2.5×104个细胞/0.175ml的细胞悬液,培养过夜。将50μl的多肽opti-mem(无血清培养基)溶液与同体积的阳离子脂质体混合后加入到50μl的荧光素酶质粒opti-mem溶液中(2μg荧光素酶质粒)继续充分混合,在室温静置30分钟,然后分别加入不同比例的ha-her的opti-mem溶液,充分混合后孵育15分钟。然后每个样品的溶液分别用无血清培养基稀释至800μl,然后除去细胞培养基,用pbs洗涤一次,然后将稀释的样品液以200μl/孔(每孔加入sirna的量是200nmol)的量与细胞共孵育4小时。每个质量比做四个复孔。阳性对照组lipofectamine2000、pei25kda以及实验药物制剂lpr、hlpr和ahlpr。然后加入10μlcck8,37℃下孵育1小时,然后通过微孔板吸光度分光光度计读数器在570纳米吸收波长检测。实施例7、抗体、多肽和核酸组合治疗靶向载体的细胞内吞效率首先,在24孔细胞培养板中,加入1.5×105个细胞/0.175ml的细胞悬液,培养过夜。将50μl的多肽opti-mem(无血清培养基)溶液与同体积的阳离子脂质体混合后加入到50μl的cy3-sirna水溶液中,继续充分混合,在室温静置30分钟,然后加入透明质酸与sirna质量比为14:1的ha-her于opti-mem溶液,充分混合后孵育15分钟。然后每个样品的溶液稀释至800μl,然后除去细胞培养基,用pbs洗涤一次,然后将稀释的样品液以500μl/孔(每孔加入sirna的量是1.5μg)的量与细胞共孵育4小时。每个质量比做四个复孔。然后将相应各孔中的细胞消化,轻轻吹打收集离心(4℃,1000rpm,5min),离心后弃去上清,加入1ml的1×pbs,轻轻吹打均匀后离心,重复洗2遍后,每个样品中加入300μl的1×pbs,并将细胞溶液转移到流式管中,流式细胞仪检测(bd)。结果如图5所示,抗体、多肽和核酸生物大分子组合治疗靶向输送纳米颗粒ahlpr均可以被细胞有效内吞。实施例8、抗体、多肽和核酸组合治疗靶向载体的体内输送毒性和效率取对数生长期的skbr-3细胞接种于雌性小鼠胸部为实验动物模型。荷瘤鼠随机分为4组,每组l0只,空白对照组为阴性对照组、survivinsirna和蜂毒素对照组为阳性对照组,另外两组分别为包裹无序sirna的ahlpr组(ahlpr-negative)和包裹survivinsirna的ahlpr组(ahlpr-survivin)。接种后4周静注给药,给药剂量为0.67mg/kg,每2天1次,共给药8次,每天称小鼠体重,瘤体积大小,并实时观察监控各个实验组小鼠的死亡率。在最后给药的第三天称重测量肿瘤大小。并抽取外周血,检测各给药组对裸鼠的心脏、肝脏和肾脏的毒性。并处死荷瘤小鼠。由此可见,我们的载体没有毒性,并且可以很好地抑制肿瘤的生长。本发明抗体、多肽和核酸组合治疗靶向载体的体内肝肾功能检测毒性见图6,untreated代表尾静脉注射质量比5%的葡萄糖,survivinsirna代表尾静脉注射与ahlpr相同量的survivinsirna,ahlpr-negative代表ha-her、阳离子多肽、阳离子脂质体和无序sirna质量比为14:1:4:1组装的纳米颗粒,ahlpr-survivin代表ha-her、阳离子多肽、阳离子脂质体和survivinsirna质量比为14:1:4:1组装的纳米颗粒。a代表单克隆抗体herceptin;h代表透明质酸;l代表阳离子脂质体;p代表多肽;r代表sirna。本发明抗体、多肽和核酸组合治疗靶向载体的体重见图7,untreated代表尾静脉注射质量比5%的葡萄糖,survivinsirna代表尾静脉注射与ahlpr相同量的survivinsirna,peptide代表尾静脉注射与ahlpr相同量的蜂毒素,ahlpr-negative代表ha-her、阳离子多肽、阳离子脂质体和无序sirna质量比为14:1:4:1组装的纳米颗粒,ahlpr-survivin代表ha-her、阳离子多肽、阳离子脂质体和survivinsirna质量比为14:1:4:1组装的纳米颗粒。a代表单克隆抗体herceptin;h代表透明质酸;l代表阳离子脂质体;p代表多肽;r代表sirna。本发明抗体、多肽和核酸组合治疗靶向载体ahlpr的体内皮下肿瘤药效见图8,untreated代表尾静脉注射质量比5%的葡萄糖,survivinsirna代表尾静脉注射与ahlpr相同量的survivinsirna,peptide代表尾静脉注射与ahlpr相同量的蜂毒素,ahlpr-negative代表ha-her、阳离子多肽、阳离子脂质体和无序sirna质量比为14:1:4:1组装的纳米颗粒,ahlpr-survivin代表ha-her、阳离子多肽、阳离子脂质体和survivinsirna质量比为14:1:4:1组装的纳米颗粒。a代表单克隆抗体herceptin;h代表透明质酸l代表阳离子脂质体;p代表多肽;r代表sirna。综上所述,本发明用抗体靶向肿瘤细胞。利用阳离子脂质体突破细胞膜与内涵体膜从而进入细胞浆中,利用药用级透明质酸屏蔽载体内部的正电荷并靶向肿瘤细胞的表面受体。该载体的优势是利用人体安全的生物材料构建出紧密包裹核酸、体内长效循环与高效靶向肿瘤细胞,并顺利进入细胞浆通过解组装和自身降解释放出核酸和多肽药物新型非病毒载体。该载体的具体构建方法:首先将多肽与核酸形成纳米复合物,然后通过静电作用使脂质体与该复合物自组装形成表面为不规则脂质膜的纳米颗粒,然后再加入透明质酸和抗体的连接物,从而通过透明质酸与纳米颗粒的表面正电荷的静电作用,以及与突出的多肽的氢键作用,从而组装成可以在体内长效循环,靶向特定肿瘤细胞表面受体,并通过脂质体融膜作用顺利突破细胞膜与内涵体膜进入细胞质,在微酸性的细胞质内降解释放多肽和核酸,同时自身被及时代谢。由于所用的抗体、多肽、脂质体和多糖类聚阴离子都是人体可接受的药用材料,所以该载体具有药用的潜质。以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1