LIN28/let-7信号通路抑制剂在制备调控PD-L1表达的药物中的应用的制作方法
本发明属于医药领域,具体涉及lin28/let-7信号通路抑制剂在制备调控pd-l1表达的药物中的应用。
背景技术:
随着癌症发生率的升高,以及癌症发生群体的逐渐年轻化,癌症已成为严重威胁国民生命健康的疾病。现代生命科学研究中,如何治疗并治愈癌症已成为亟待突破的研究重点。
在细胞生长过程中,一些重要分子的异常表达和积累往往容易导致癌症的发生发展。其中,rna结合蛋白lin28在肿瘤细胞中多处于高表达水平,并与肿瘤的恶化以及较差的预后效果有相关关系。lin28通过干扰let-7前体的加工成熟从而抑制细胞中let-7的表达水平,而let-7也通过转录后抑制的方式抑制lin28的蛋白表达。let-7家族是一类小非编码rna(mirna)家族,一共包括12个家族成员,具有促进细胞分化、抑制肿瘤细胞增殖等重要作用,被认为是重要的肿瘤抑制分子。let-7在肿瘤细胞中多为低表达水平,其表达水平常能用于指示肿瘤的恶化程度。lin28/let-7直接形成负反馈通路,并参与调控细胞的多方面生理功能,是肿瘤治疗研究的重要靶标之一。
在肿瘤治疗过程中,治疗手段有多种,除了传统的外科手术切除、放射治疗和化学治疗外,还有在近年来由于疗效显著而极受关注的肿瘤免疫治疗。
在肿瘤免疫治疗中,程序死亡配体-1(pd-l1)是极其重要的靶标之一。在肿瘤细胞中,pd-l1多呈过表达状态,并通过在细胞免疫应答过程中与程序死亡受体-1(pd-1)结合,从而抑制t细胞的活性与功能发挥,使肿瘤细胞得以躲避免疫系统的监控与攻击,进一步恶化增长。目前,针对pd-1/pd-l1的单抗治疗虽然在临床试验如肺癌和黑色素瘤等的治疗上取得良好疗效,但其中只有不足40%的患者能对抗体治疗产生应答。低应答率的确切原因仍不得而知,有可能是因为不同患者中pd-l1的表达水平存在个体差异,也有可能是由于肿瘤微环境的复杂性。因此,开发新型治疗方法对于肿瘤治疗显得极为迫切。也正因此,我们急需透彻了解pd-l1在肿瘤细胞中的具体受调控通路。
技术实现要素:
本发明的目的是针对以上要解决的技术问题,提供一种能够有效调控pd-l1表达的技术方案。
为此,本发明提供了lin28/let-7信号通路抑制剂在制备调控pd-l1表达的药物中的应用。
根据本发明所述的应用,所述lin28/let-7信号通路抑制剂意指:可有效抑制和/或阻断lin28/let-7信号通路的任何化合物、复合物、组合物、络合物等。
特别地,本发明通过抑制肿瘤细胞中lin28蛋白的表达,来促进let-7加工成熟,从而进一步抑制pd-l1蛋白表达。
lin28/let-7信号通路抑制剂优选但不限于以下式(i)的[1,2,4]三唑并[4,3-b]哒嗪衍生物或其药学上可接受的盐:
本发明还提供了一种调控pd-l1表达的方法,该方法可通过阻断lin28/let-7信号通路来调控pd-l1的表达,该方法用于非治疗目的和/或非诊断目的。
本发明还提供了一种不限于非治疗目的(和/或不限于非诊断目的)调控pd-l1表达的方法,即一种调控pd-l1表达的方法,该方法可通过阻断lin28/let-7信号通路来调控pd-l1的表达。
在本发明的另一方面,还提供了式(i)的[1,2,4]三唑并[4,3-b]哒嗪衍生物或其药学上可接受的盐在制备通过抑制lin28/let-7信号通路调控pd-l1表达的药物中的应用:
在本发明的另一方面,还提供了一种通过抑制lin28/let-7信号通路调控pd-l1表达的药物,其包括lin28/let-7信号通路抑制剂或其药学上可接受的盐,该lin28/let-7信号通路抑制剂或其药学上可接受的盐优选以治疗有效量存在,并且作为活性成分。在进一步优选的实施例中,本发明还可以包括一种或多种药用载体物质和/或稀释剂。
应当理解的是,所述药物可制成适当的剂型,例如但不限于片剂、丸剂、胶囊剂、液体制剂如注射液等。
根据本发明所述的药物,其中所述lin28/let-7信号通路抑制剂优选但不限于以下式(i)的[1,2,4]三唑并[4,3-b]哒嗪衍生物或其药学上可接受的盐:
以上式(i)化合物为小分子药物,其全称为n-甲基-n-(3-(3-甲基-[1,2,4]三唑并[4,3-b]哒嗪-6-基)苯基)乙酰胺,水溶性高,热稳定性良好,细胞毒性低。
式(i)化合物的合成路线如下:
上述“调控pd-l1表达”尤其是指调控肿瘤细胞的pd-l1水平,特别是抑制肿瘤细胞的pd-l1水平。该肿瘤包括各种肿瘤,包括但不限于骨肉瘤、乳腺癌、宫颈癌、甲状腺癌、食道癌、肝癌、胃癌、肾癌、胰腺癌、头颈部癌、淋巴瘤、神经胶质瘤、子宫内膜癌、胆管癌、骨癌、胆囊癌、直肠癌、肺癌、结肠癌、前列腺癌、皮肤癌、卵巢癌、成神经细胞瘤、黑素瘤、角质形成细胞癌、皮肤癌、鼻咽癌、眼癌等中的任意一种。
附图说明
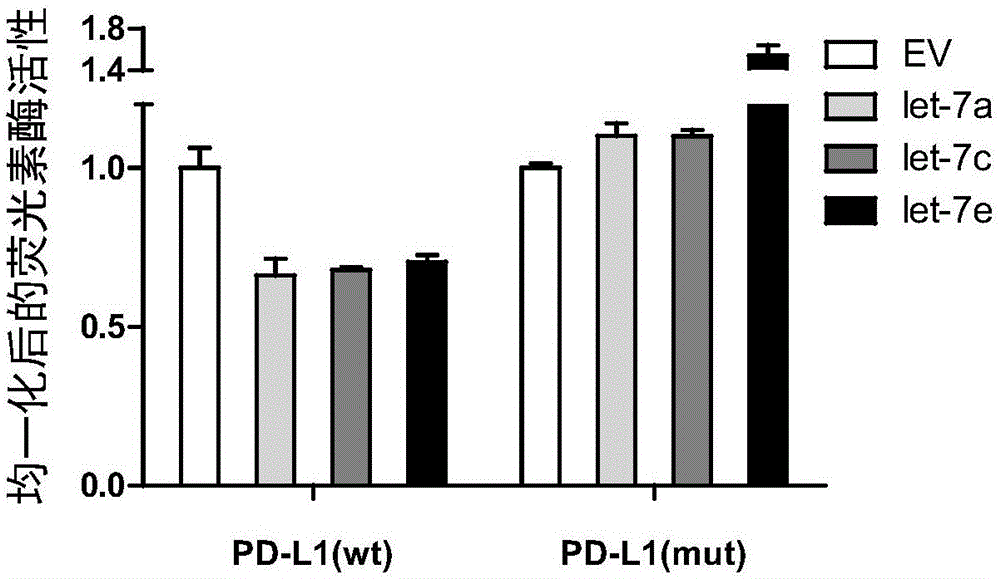
图1为均一化后的荧光素酶活性变化结果。
图2为流式细胞术检测let-7对pd-l1蛋白表达的抑制作用的结果。
图3为流式细胞术检测lin28对pd-l1表达水平的影响的结果。
图4为流式细胞术检测小鼠肿瘤细胞的pd-l1表达水平的结果。
具体实施方式
下面将结合一些具体实施例进一步清楚、完整地阐述本发明。在此说明,这里所描述的实施例仅是本发明中的部分实施例,而且以下所描述的实施例仅用于说明本发明,并不用于限制本发明的应用范围。
如未特别指出,本发明所使用的试剂、材料、仪器均可通过商购获得,常规操作步骤参数等均为本领域技术人员所知晓并可实施。
以下实施例仅以骨肉瘤、乳腺癌、宫颈癌细胞举例进行说明,但考虑到细胞的结构通性,本领域技术人员可理解,本发明的通过抑制lin28/let-7信号通路调控pd-l1亦可适用于其他类型的肿瘤细胞。
1.实验材料:
人肾上皮细胞株293t、骨肉瘤细胞株u2os、人类乳腺癌细胞株mcf-7、宫颈癌细胞株hela以及小鼠乳腺癌细胞株tubo均从中国典型物种保藏中心(ctcc)购买。雌性4-6周龄balb/c小鼠购自中山大学动物实验中心。
实验中所用质粒均从addgene购买。
2.双荧光报告系统实验验证let-7在pd-l1序列上的靶位点:
let-7家族是一类小非编码rna,通过转录后抑制的方式抑制多种蛋白表达。经过序列比对分析,我们发现pd-l1上存在多个潜在的let-7靶位点。为了验证let-7通过靶向pd-l1序列进而调控其蛋白表达,我们利用双荧光报告系统在293t细胞中进行实验。我们把pd-l1中含let-7靶位点的野生型序列(或突变let-7靶位点的突变体序列)克隆进双荧光报告系统的质粒中,构建报告载体。按1×104/孔的细胞密度接种293t细胞于96孔板中,每组实验接种4孔。待细胞贴壁后,把改造后的报告载体和let-7过表达载体(以let-7a、-7c及-7e为代表)或随机对照ev同时进行瞬时过表达,转染6小时后更换培养基。48小时后,使用多功能酶标仪对萤火虫荧光素酶和海肾荧光素酶的荧光值分别进行测定。
均一化后的荧光素酶活性变化如图1所示。与对照组ev相比,let-7显著抑制含野生型pd-l1序列的荧光素酶活性;当pd-l1序列上的let-7靶位点突变后,let-7对荧光素酶的抑制效果解除。实验结果表明,let-7靶向pd-l1序列,从而抑制pd-l1的转录后翻译。
3.流式细胞术检测let-7对pd-l1蛋白表达的抑制作用:
pd-l1位于细胞膜表面时,通过与pd-1结合从而抑制t细胞的功能活性,帮助肿瘤细胞进行免疫逃逸。因此,我们采用流式细胞术的方法检测位于细胞膜表面pd-l1的表达水平。我们将u2os、mcf-7和hela细胞分别接种于6孔板中,接种密度为2×105/孔。待细胞贴壁后,每孔加入含2μg相应质粒(分别为对照载体ev、实验组let-7a、-7b、-7c、-7d、-7e、-7f或-7i的过表达载体)的转染复合物,6小时后更换培养基。在样品收集前24小时,每孔加入ifn-γ使其终浓度为10ng/ml,以增强pd-l1的本底表达水平,便于检测。24小时后终止培养并收集细胞,把细胞样品置于冰上,并与apc(别藻蓝蛋白)标记的pd-l1抗体进行孵育。30分钟后,洗去未标记的抗体,再用流式细胞仪检测pd-l1的表达水平。用flowjo软件对实验数据进行后续处理分析。
如图2所示,过表达不同的let-7家族成员均能显著抑制细胞的pd-l1表达水平,表明let-7对pd-l1的蛋白水平有负调控作用。且在不同种类的细胞中,起主要抑制作用的let-7家族成员不同。
4.流式细胞术检测lin28对pd-l1表达水平的影响:
lin28通过抑制let-7的前体加工从而抑制let-7的表达。在验证let-7对pd-l1的抑制作用后,我们进一步检测lin28对pd-l1蛋白表达的影响。我们将u2os、mcf-7和hela细胞分别接种于6孔板中,接种密度为2×105/孔。待细胞贴壁后,利用sirna对lin28蛋白进行敲降,6小时后更换培养基。在样品收集前24小时,每孔加入ifn-γ使其终浓度为10ng/ml,以增强pd-l1的本底表达水平,便于检测。24小时后终止培养并收集细胞,把细胞样品置于冰上,并与apc标记的pd-l1抗体进行孵育。30分钟后,洗去未标记的抗体,再用流式细胞仪检测pd-l1的表达水平。用flowjo软件对实验数据进行后续处理分析。
如图3所示,利用sirna对lin28a或lin28b进行敲降均能显著抑制细胞的pd-l1表达水平,表明lin28对pd-l1蛋白表达有正调控作用。
5.小鼠肿瘤细胞pd-l1检测实验:
式(i)的[1,2,4]三唑并[4,3-b]哒嗪衍生物通过阻断lin28与let-7相互作用从而提高let-7的表达水平。
为进一步验证lin28/let-7通路在活体中对pd-l1的调控效果,使用式(i)的[1,2,4]三唑并[4,3-b]哒嗪衍生物处理雌性4-6周龄balb/c小鼠,进行实验。实验前,我们将5×105个tubo细胞接种于其右前肢第三对乳腺皮下。待小鼠成瘤后,按处理剂占小鼠体重比例为40mg/kg的剂量通过尾静脉注射100μl含式(i)[1,2,4]三唑并[4,3-b]哒嗪衍生物的pbs(实验组)或等体积的含0.1%dmso(二甲基亚砜)的pbs(对照组)进入小鼠体内。每两天进行一次尾静脉注射,一共注射六次。最后一次注射后24小时,颈椎脱臼处死小鼠,随即剥离肿瘤并用dna酶和胶原酶把肿瘤消化成单细胞,用流式细胞术分析小鼠肿瘤细胞的pd-l1表达水平。实验数据用flowjo软件进行处理分析。
如图4所示,结果表明,式(i)的[1,2,4]三唑并[4,3-b]哒嗪衍生物(实验组)通过阻断lin28与let-7相互作用,从而提高let-7的表达水平,能有效降低小鼠肿瘤细胞pd-l1的相对表达量。
6.式(i)化合物的结构与制备
本发明所称的式(i)化合物为[1,2,4]三唑并[4,3-b]哒嗪衍生物,其全称为n-甲基-n-(3-(3-甲基-[1,2,4]三唑并[4,3-b]哒嗪-6-基)苯基)乙酰胺,分子式为c15h15n5o;相对分子量为281.13,化学结构式如下:
式(i)化合物的合成路线如下:
式(i)化合物的具体合成步骤如下:
将起始原料1(购自j&kchemical公司)(0.65g,3.40mmol)溶解在甲苯(40ml)中,加入3-甲基-4h-1,2,4-三唑-4-胺(购自j&kchemical公司)(0.33g,3.36mmol),反应通过迪安-斯达克分水器将混合物回流过夜(22小时)。冷却至室温后,向混合物中加入适量硅胶,旋干溶剂。使用meoh/ch2cl2(0-10%)进行快速柱层析,得到浅黄色固体化合物3(0.85g,92%)。
将化合物3(0.77g,2.84mmol)溶解在thf(四氢呋喃)(5ml)中,滴加叔丁氧基双(二甲基氨基)甲烷(购自j&kchemical公司)(1.19ml,5.68mmol)。室温搅拌4.5小时后,向反应混合物中加入适量硅胶并旋干溶剂。使用meoh/ch2cl2(0-15%)进行快速柱层析,得到淡黄色固体化合物5(0.95g,定量)。
将化合物5(0.2g,0.61mmol)溶解在acoh(3ml)回流(浴温140℃)过夜(20h)。冷却至室温后,向反应混合物中加入适量硅胶并真空旋干溶剂。使用meoh/ch2cl2(0-15%)进行快速柱层析,得到为浅黄色固体的cl285032(0.122g,71%),即本发明所涉及的式(i)化合物。
经质谱和核磁共振分析化学结构。
- 还没有人留言评论。精彩留言会获得点赞!