一种阿霉素无载体纳米药物的制备及其应用的制作方法
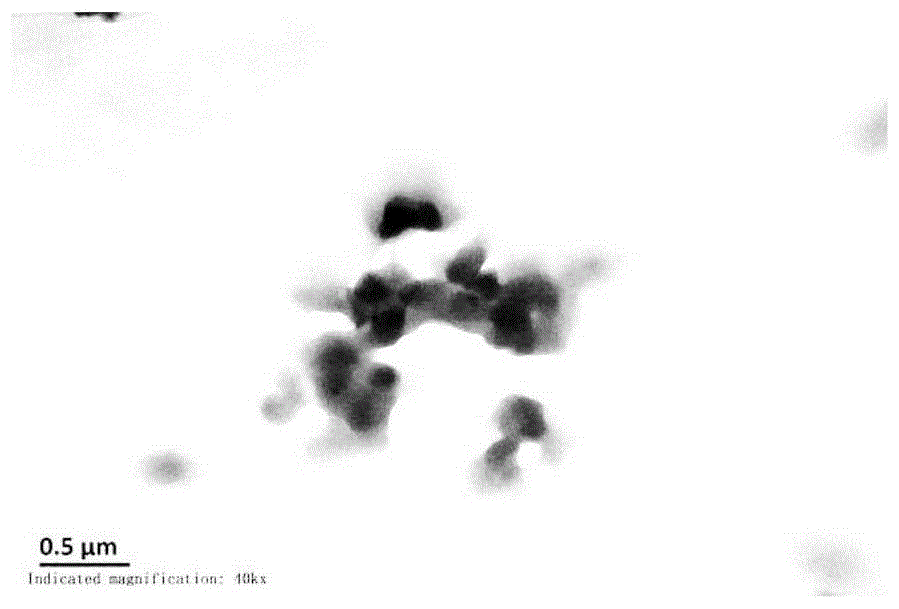
本发明涉及生物医用高分子材料技术领域,具体涉及一种阿霉素无载体纳米药物的制备及其应用。
背景技术:
恶性肿瘤是威胁人类健康的最主要疾病之一,故寻找一种有效的癌症治疗方法已成为目前亟待解决的问题。
传统的化疗是临床上恶性肿瘤治疗的最主要的手段之一。目前化疗多使用小分子药物,存在药物在体内代谢速度快,到达肿瘤部位的有效剂量不足等问题。此外,大部分的化疗药物不溶于水,为增加药物水溶性,需要大量的有机溶剂或者表面活性剂作为助溶剂,最终导致对人体正常组织的副作用。随着纳米技术的发展,出现了各种装载抗癌药物的纳米载体,如脂质体,胶束,树状大分子等。经载体的包裹,增强了药物分子对外界环境的稳定性,但因此引入大量的辅料,导致载药量较低及对人体的副作用等弊端。
随着纳米技术的发展,利用纳米载体负载药物进行肿瘤治疗展现了极大的发展潜力,越来越受研究者的青睐。虽然纳米药物载体以其优异且独特的性质在疾病诊断、治疗和卫生保健方面发挥重要作用,但是能够应用临床的很少。当前的纳米药物载体虽在一定程度上提高了疏水性药物的生物利用度,但是载体本身的生物相容性和细胞毒性不容忽视。最新的研究发现大多数人工合成的纳米载体存在安全性问题,据报道一些纳米载体在临床试验中引起休克、呼吸困难、低血压等十分严重的不良症状,甚至有死亡的现象。纳米载体在体内的代谢机制不明确,对细胞产生毒副作用将成为阻碍纳米载药体系向前发展和进一步应用于临床的棘手问题。与传统的纳米载药体系相比,无载体纳米载药体系解决了纳米载体体系复杂、质控困难、作用机制不明确和代谢不清楚等问题。无载体纳米载药体系消除了引入载体对人体带来的安全问题,同时减轻对人体额外代谢的负担,更解决了载体纳米粒制备过程中批次质量不可控的问题。
阿霉素(doxorubicin,dox)是一种蒽环糖苷类的广谱抗肿瘤药物,阿霉素结构上既有脂溶性蒽环配基和水溶性柔红糖胺,又有酸性酚羟基和碱性氨基,易通过细胞膜进入肿瘤细胞,具有很强的药理活性。临床上用于治疗急性淋巴细胞白血病、急性粒细胞性白血病、霍奇金和非霍奇金淋巴瘤、乳腺癌、肺癌、卵巢癌、软组织肉瘤、成骨肉瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、膀胱瘤、甲状腺瘤、绒毛膜上皮癌、前列腺癌、睾丸癌、胃癌、肝癌等。
阿霉素抗肿瘤作用的主要机制为其本身可插入双链dna,导致dna的重复损伤,另外,其可抑制拓扑异构酶ⅱ的功能,导致dna的结构损伤从而抑制肿瘤细胞增殖,导致肿瘤细胞凋亡。分子态的阿霉素制剂,如各种盐酸阿霉素注射液,其经静脉注射进入体内后分布于全身,由于不能选择性的达到肿瘤部位,在杀伤肿瘤细胞的同时对全身产生毒副作用较大。针对这一问题,各类阿霉素靶向制剂已成为现在的研究热点,如阿霉素靶向胶束,磁性微球阿霉素纳米粒,阿霉素脂质体等。但迄今为止研发出的阿霉素靶向制剂尚不能达到理想标准,只能使阿霉素在肿瘤部位的分布相对提高,并且由于纳米粒中辅料所占比重较大,载药量低,往往需要提高注射剂量以达到理想药物浓度,因此对患者身体带来较大负担。如目前临床上使用的用于治疗乳腺癌的阿霉素脂质体,虽较盐酸阿霉素注射液有较好的疗效,但仍存在引起严重静脉炎等副作用的问题。
针对相关技术中的问题,目前尚未提出有效的解决方案。
技术实现要素:
本发明的目的在于提供一种阿霉素无载体纳米药物的制备及其应用,本发明通过阿霉素与多种小分子羧基药物通过简单的透析法自组装形成的纳米粒,以解决现有技术中载药量低、毒副作用较大的问题。
为解决上述技术问题,本发明提供的技术方案是:
一种阿霉素无载体纳米药物,其是由阿霉素与多种小分子羧基药物通过简单的透析法自组装形成的纳米粒。
优选的,所述小分子羧基药物包括布洛芬、酮洛芬、非诺洛芬、氟比洛芬、奥沙普秦、萘普生、吲哚美辛、舒林酸、依托度酸、双氯芬酸、甲灭酸、甲氯芬那酸、氟芬那酸、托灭酸、利克飞龙、二氟尼柳、阿司匹林、吡哌酸、那氟沙星、甲氨喋呤、4-苯基丁酸、维甲酸、吉非贝齐、氟伐他汀、普伐他汀、阿伐他汀、鹅去氧胆酸、猪去氧胆酸、熊去氧胆酸、石胆酸、脱氧胆酸、甘氨脱氧胆酸中的一种或多种。
一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将阿霉素与小分子羧基药物共溶于水溶性有机溶剂中,使用超声仪辅助使物料充分溶解;超声仪使用的具体时间在此不做限制,以阿霉素溶解为参考,阿霉素溶解完全后,关闭超声仪即可;
b.将该两种药品的混合溶液置于截留分子量为1000-10000da的透析袋中,避光磁力搅拌下在去离子水中透析,其中,透析温度为4-15℃;其中,透析时间为12-48h;
c.透析结束后取出透析袋中的溶液,冷冻干燥即可制得目标产物。
优选的,所述步骤a中阿霉素和小分子羧基药物的质量比为1-4:4-1。
优选的,所述步骤a中的水溶性有机溶剂的浓度为0.1-20mg/ml,容积为0.5ml-5ml。
优选的,所述阿霉素为疏水阿霉素。
优选的,所述水溶性有机溶剂包括甲醇、乙醇、丙酮、乙腈、1,4-二氧六环、四氢呋喃、二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺中的一种或者其组合。
优选的,所述步骤b透析过程中每隔30min-60min要更换一次去离子水。
一种阿霉素无载体纳米药物在抗癌药物中的应用。
与相关技术相比,本发明具有如下技术效果:本发明通过阿霉素与一种或多种小分子羧基药物通过简单的透析法自组装形成的纳米粒,很少引入其他大分子材料,因此本发明的阿霉素无载体纳米药物的载药量高,同时也避免了大分子材料引入造成的代谢问题和毒副作用;其次,本发明的阿霉素无载体纳米药物制剂组分明确,质量易控,制备工艺简单,易于大规模工业化生产,在癌症治疗过程中具有重大的意义。
说明书附图
图1为阿霉素和吲哚美辛在投量比4/1的情况下通过自组装制备得到的纳米晶体的透射电镜图;
图2为阿霉素和吲哚美辛在投量比2/1的情况下通过自组装制备得到的纳米晶体的透射电镜图;
图3为阿霉素和吲哚美辛在投量比1/1的情况下通过自组装制备得到的纳米晶体的透射电镜图;
图4为阿霉素和熊去氧胆酸在投量比2/1的情况下通过自组装制备得到的粒径分布图;
图5为阿霉素和甲灭酸在投量比2/1的情况下通过自组装制备得到的纳米粒溶液图;
图6为阿霉素和克洛芬在投量比2/1的情况下通过自组装制备得到的纳米粒溶液图;
图7为阿霉素和吲哚美辛纳米粒在投量比2/1的情况下对肿瘤细胞的细胞毒性分布图;
图8为hepg2荷瘤小鼠接收不同阿霉素制剂治疗的肿瘤生长曲线;
图9为hepg2荷瘤小鼠接收不同阿霉素制剂治疗21天后的肿瘤质量。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
在本发明中所使用到的阿霉素、小分子羧基药物和水溶性有机溶剂、去离子水均为市售产品,具体厂商在此不做限制。
如图1-9所示,一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将阿霉素与小分子羧基药物共溶于浓度为0.1-20mg/ml,容积为0.5ml-5ml的水溶性有机溶剂中,使用超声仪辅助使物料充分溶解;
b.将该两种药品的混合溶液置于截留分子量为1000-10000da的透析袋中,避光磁力搅拌下在去离子水中透析,其中,透析温度为4-15℃;其中,透析时间为12-48h;透析过程中每隔30min-60min要更换一次去离子水;
c.透析结束后取出透析袋中的溶液,冷冻干燥即可制得目标产物。
实施例1
如图1所示,一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将4mg阿霉素和1mg吲哚美辛共同溶于1ml二甲基亚砜中,其中阿霉素溶液的浓度为4mg/ml,吲哚美辛浓度为1mg/ml,二甲基亚砜浓度为0.5mg/ml;超声波作用2分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为1000da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于24h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
实施例2
如图2所示,一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将10mg阿霉素和5mg吲哚美辛共同溶于1ml乙腈中,其中阿霉素溶液的浓度为10mg/ml,吲哚美辛浓度为5mg/ml,乙腈浓度为0.5mg/ml;超声波作用5分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为5000da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于48h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
实施例3
如图3所示,一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将5mg阿霉素和5mg吲哚美辛共同溶于1ml二甲基亚砜中,其中阿霉素溶液的浓度为5mg/ml,吲哚美辛浓度为5mg/ml,二甲基亚砜浓度为2mg/ml;超声波作用5分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为2000da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于12h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
实施例4
如图4所示,一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将10mg阿霉素和5mg熊去氧胆酸共同溶于1ml甲醇中,其中阿霉素溶液的浓度为10mg/ml,吲哚美辛浓度为5mg/ml,甲醇浓度为1mg/ml;超声波作用2分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为3500da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于24h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
实施例5
如图5所示,一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将8mg阿霉素和4mg甲灭酸共同溶于1ml二甲基亚砜中,其中阿霉素溶液的浓度为8mg/ml,吲哚美辛浓度为4mg/ml,二甲基亚砜浓度为5mg/ml;超声波作用5分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为8500da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于24h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
实施例6
如图6所示,一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将10mg阿霉素和5mg克洛芬共同溶于1ml甲醇中,其中阿霉素溶液的浓度为10mg/ml,吲哚美辛浓度为5mg/ml,甲醇浓度为5mg/ml;超声波作用2分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为3500da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于24h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
实施例7
与上述实施例不同的是,一种阿霉素无载体纳米药物的制备方法,包括以下步骤:
a.将1mg阿霉素和总量为4mg的吲哚美辛和克洛芬混合物共同溶于0.1ml二甲基甲酰胺中,其中阿霉素溶液的浓度为10mg/ml,吲哚美辛和克洛芬混合物的浓度为40mg/ml,甲醇浓度为5mg/ml,二甲基甲酰胺的浓度为2mg/ml;超声波作用2分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为5000da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔40min更换去离子水,于24h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
实施例8
如图7所示,一种阿霉素无载体纳米药物对肿瘤细胞的杀伤能力,包括以下步骤:
a.将5mg阿霉素和2.5mg吲哚美辛共同溶于1ml二甲基亚砜中,其中阿霉素溶液的浓度为5mg/ml,吲哚美辛浓度为2.5mg/ml;超声波作用5分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为5000da的透袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于48h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
c.将人肝癌细胞hepg2细胞系以5000个/每孔的密度接种至96孔板中,分别将阿霉素自组装纳米粒、阿霉素与吲哚美辛混合药、吲哚美辛,三组阿霉素制剂用细胞培养液稀释至阿霉素浓度40μg/ml,20μg/ml,10μg/ml,5μg/ml,2.5μg/ml,1.25μg/ml;吲哚美辛浓度20μg/ml,10μg/ml,5μg/ml,2.5μg/ml,1.25μg/ml,0.63μg/ml,使用这三组阿霉素制剂溶液培养肿瘤细胞于37℃,5%co2条件下48h后,分别测量三组制剂中孔板中活细胞数量得到肿瘤细胞生长曲线。
实施例9
如图8所示,一种阿霉素无载体纳米药物对hepg2荷瘤小鼠接种试验,包括以下步骤:
a.将8mg阿霉素和4mg吲哚美辛共同溶于2ml乙腈中,其中阿霉素溶液的浓度为4mg/ml,吲哚美辛浓度为2mg/ml;超声波作用5分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为3000da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于48h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
c.将人肝癌细胞hepg2以1*107个细胞/只的浓度接种于裸鼠皮下,待移植瘤体积增长至8mm3后,分别将阿霉素自组装纳米粒、阿霉素与吲哚美辛混合药、阿霉素三种制剂使用0.9%生理盐水稀释至阿霉素浓度5mg/ml、吲哚美辛浓度2.5mg/ml,以4天/次的治疗频率,尾静脉注射治疗20天,测量并记录每次治疗时肿瘤体积,得到荷瘤小鼠的肿瘤生长曲线。
实施例10
如图9所示,不同阿霉素无载体纳米药物治疗hepg2荷瘤小鼠,接收21天后的肿瘤质量,包括以下步骤:
a.将8mg阿霉素和4mg吲哚美辛共同溶于2ml乙腈中,其中阿霉素溶液的浓度为4mg/ml,吲哚美辛浓度为2mg/ml;超声波作用5分钟左右至阿霉素溶解即可;
b.将该溶液置于截留分子量为3000da的透析袋中,避光磁力搅拌下在去离子水中透析,温度保持4-15℃左右,每隔30min更换去离子水,于48h后取出透析袋中溶液,冷冻干燥即可得到自组装聚集体。
c.将人肝癌细胞hepg2以1*107个细胞/只的浓度接种于裸鼠皮下,待移植瘤体积增长至8mm3后,使用4组不同阿霉素制剂以4天/次的治疗频率,5mg/ml的阿霉素浓度,尾静脉注射治疗21天后,处死小鼠剥离肿瘤组织,测量并记录其重量。
本发明通过阿霉素与多种小分子羧基药物通过简单的透析法自组装形成的纳米粒,很少引入其他大分子材料,因此本发明的阿霉素无载体纳米药物的载药量高,同时也避免了大分子材料引入造成的代谢问题和毒副作用;其次,本发明的阿霉素无载体纳米药物制剂组分明确,质量易控,制备工艺简单,易于大规模工业化生产,在癌症治疗过程中具有重大的意义。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!