酪氨酸激酶抑制剂作为急性肾损伤治疗药物的应用的制作方法
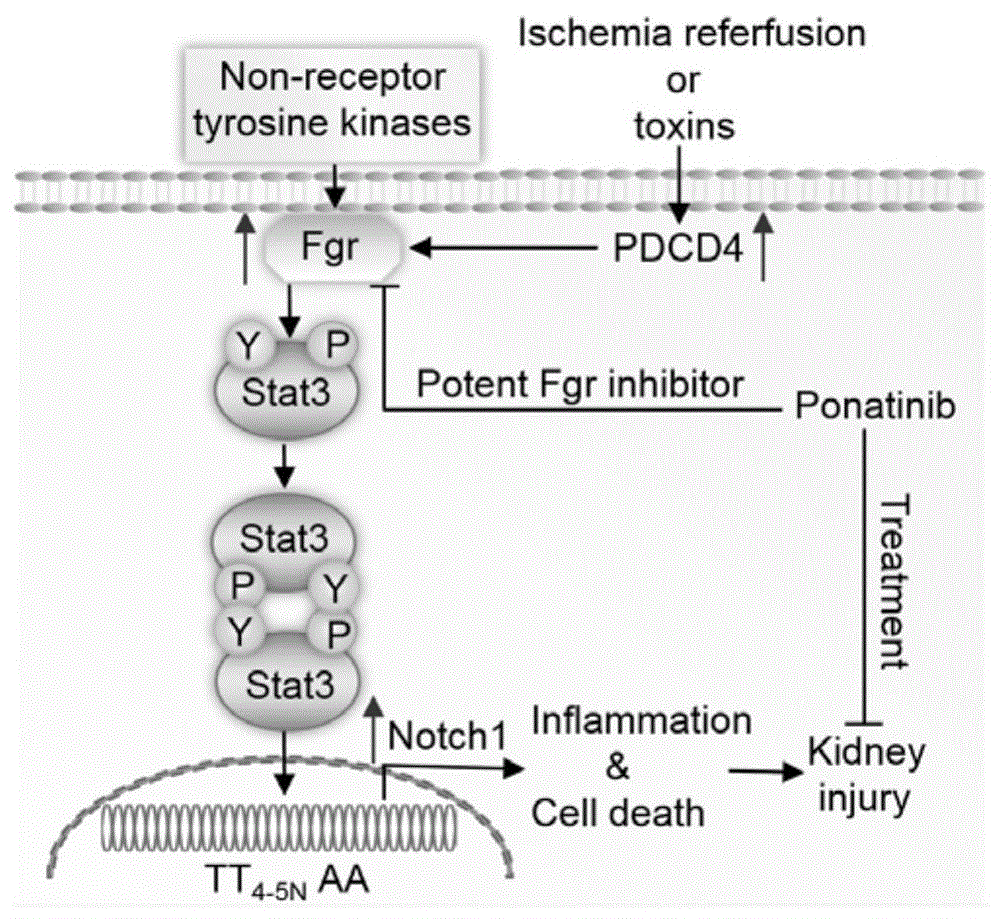
本公开属于急性肾损伤治疗药物技术领域,具体涉及酪氨酸激酶抑制剂作为急性肾损伤药物的应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本公开的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
急性肾损伤(acutekidneyinjury,aki)起病急、进展快,是一种严重的临床并发症,也是引起慢性肾衰的重要原因,严重者可发展成尿毒症等系统性并发症,具有高发病率和高死亡率的特点。临床上通常是由缺血/再灌注损伤(iri)、脓毒症或化疗药物等引起,尽管目前对aki的病理生理学机制研究取得了重大进展,但目前尚无有效治疗或预防aki的药物,仅限于对症治疗,对肾功能的改善有限。
目前用于预防和治疗aki的药物较少。在aki的预防中,临床常用乙酰半胱氨酸预防造影剂引发的aki以及在围手术期注射碳酸氢钠预防心脏手术引发的aki,但上述措施的预防作用目前并不确定。在治疗aki时,目前临床上治疗原则包括去除病因、维持内环境稳定、营养支持、处理并发症和血液净化治疗等。这些措施通过及时补充体液恢复血液循环的复苏以及适度应用强心剂/血管加压素以维持充足的心输出量和灌注压。除此之外,还包括接受肾脏替代治疗/透析。在这些治疗方案中,如利尿剂的应用,在aki的治疗中疗效并不明确;血管扩张剂非诺多泮(fenoldopam),仅在特定人群有效;利钠尿肽在大手术引起的aki中可能有效,但其他情况效果不佳。因此,目前并没有广谱有效的预防治疗aki的药物。针对这一现状,确定参与急性肾损伤的共同关键信号通路,对于aki的预防和治疗具有重要意义。现有研究表明,aki后肾脏pdcd4表达水平显著升高,提示其在aki的病理生理过程中发挥重要作用,但其确切的调节机制并不明确。
技术实现要素:
为了明确急性肾损伤的机制,提供确切有效的急性肾损伤治疗药物,本公开通过pdcd4敲基因鼠进行研究,结果表明pdcd4缺失通过阻断细胞死亡和炎症反应,显著改善aki后肾功能障碍和组织损害。现有技术中有研究报道急性肾损伤与pdcd4的表达存在关联,本公开通过芯片及体内外研究进一步发现,pdcd4通过调控fgr-notch1通路,加重急性肾损伤,阻断该通路上的分子有望改善肾脏损伤。进一步,本公开应用腺相关病毒aav9介导过表达fgr明显对抗pdcd4缺失对aki的保护作用;体内用sirna抑制fgr的表达在wt小鼠可以明显减轻aki引起的肾脏损伤,而在pdcd4敲基因小鼠这一保护作用并未进一步加强,提示pdcd4是通过fgr这一关键分子在急性肾损伤中发挥重要作用。上述研究结果启示,fgr是pdcd4引起aki的关键分子,基因或酪氨酸抑制药物干预有望发展成为预防和治疗aki的药物。
针对上述研究结果,本公开提供以下技术方案:
本公开第一方面,提供pdcd4、pdcd4促进剂作为fgr激动剂的应用,或pdcd4抑制剂作为fgr抑制剂的应用。
本公开第二方面,提供酪氨酸激酶抑制剂作为急性肾损伤治疗药物的应用。
优选的,所述酪氨酸为src;进一步的,所述酪氨酸为fgr。
优选的,所述急性肾损伤治疗药物为notch1抑制剂或stat3抑制剂。
优选的,所述酪氨酸激酶抑制剂为普纳替尼。
普纳替尼(ponatinib,商品名iclusig),是一种口服的酪氨酸激酶抑制剂,主要抑制fgr、src等激酶的活性,已被fda批准进行ⅲ期临床实验的药物,可以用于髓性白血病和费城染色体阳性急性淋巴细胞白血病的治疗。普纳替尼可以抑制fgr的活性,本公开研究结果显示fgr在aki中发挥关键作用,提示其可以用于预防和治疗aki。
同时,有报道称,普纳替尼在治疗肿瘤时有心血管等方面的不良反应,其与应用的剂量和时间密切相关;而普纳替尼治疗aki时剂量小,应用时间短,可避免其长期使用引起的不良反应,因此普纳替尼可开发为预防和治疗aki的潜在药物。
本公开第三方面,提供pdcd4抑制剂作为急性肾损伤治疗药物的应用。
所述急性肾损伤包括造影剂引发的肾损伤或预防心脏手术引发的肾损伤。
本公开第四方面,提供一种急性肾损伤治疗方法,所述治疗方法包括使用酪氨酸酶抑制剂进行治疗,或通过sirna-fgr进行治疗。
与现有技术相比,本公开的有益效果是:
针对现有技术中对急性肾损伤治疗尚没有广谱有效的药物,本公开针对急性肾损伤的机制展开了更为深入的研究,确认了通过fgr介导的notch1信号通路促进肾小管上皮细胞的炎症及死亡。针对上述研究结果,本公开通过sirna-fgr敲低fgr或普纳替尼ponatinib靶向fgr可用于治疗aki,提供了急性肾损伤的发病机制及相应的治疗药物,为急性肾损伤的治疗提供了相应的依据。
附图说明
构成本公开的一部分的说明书附图用来提供对本公开的进一步理解,本公开的示意性实施例及其说明用于解释本公开,并不构成对本公开的不当限定。
图1为基因或普纳替尼抑制pdcd4介导的fgr信号的通路保护急性肾损伤机制图;
图2为实施例1中pdcd4在肾缺血再灌注损伤模型中表达结果图;
其中,图2a为real-timert-pcr结果直方图;
图2b为模型组与对照组(sham)wt小鼠pdcd4表达条带图;
图2c为ihc检测对照与实验组肾脏组织中pdcd4表达情况图;
图2d为ihc检测对照与实验组肾脏组织中pdcd4表达情况直方图;
图2e为对照组(sham)与模型组免疫荧光双标结果。
图3为实施例1急性肾小管坏死病人肾脏中pdcd4染色切片图;
图4为实施例1中敲除pdcd4减轻肾缺血再灌注损伤结果图;
其中,图4a为wt及pdcd4-/-小鼠对照组与缺血再灌注48h模型组血清中肌酐含量直方图;
图4b为wt及pdcd4-/-小鼠对照组与缺血再灌注48h模型组血清中尿素氮含量直方图;
图4c为wt及pdcd4-/-小鼠对照组与缺血再灌注48h模型组he染色图片;
图4d为wt及pdcd4-/-小鼠对照组与缺血再灌注48h模型组肾脏形态学损伤评分统计结果;
图4e为wt与pdcd4-/-小鼠对照组与缺血再灌注48h模型组tunel染色图片;
图4f为wt与pdcd4-/-小鼠对照组与缺血再灌注48h模型组tunel染色统计结果。
图5为实施例1中pdcd4通过炎症介导加重肾缺血再灌注损伤结果图;
其中,图5a为real-timert-pcr检测炎症因子1l-1βmrna的变化图;
图5b为real-timert-pcr检测炎症因子tnf-αmrna的变化图;
图5c为real-timert-pcr检测炎症因子1l-6mrna的变化图;
图5d为real-timert-pcr检测炎症因子mcp-1mrna的变化图;
图5e为if检测炎症细胞(ly6b标记中性粒细胞,cd68标记巨噬细胞)浸润情况;*表示与sham组wt相比p<0.05(n=5),#表示与wt组i/r相比p<0.05(n=8)
图5f为wt与pdcd4-/-小鼠if检测细胞标记蛋白ly6b+标记的中性粒细胞含量直方图;
图5g为wt与pdcd4-/-小鼠if检测细胞标记蛋白cd68+标记的巨噬细胞含量直方图。
图6为实施例1体内验证pdcd4通过fgr参与肾缺血再灌注损伤结果图;
其中,图6a为基因芯片检测wt及pdcd4-/-小鼠组差异表达基因并绘制热图;
图6b为real-timert-pcr检测wt与pdcd4-/-小鼠对照组及模型组fgrmrna水平上的表达变化;
图6c为wb检测wt与pdcd4-/-小鼠对照组及模型组fgr蛋白水平上的表达变化;
图6d为ihc检测wt与pdcd4-/-小鼠对照组及模型组fgr蛋白分布;*表示与假手术组相比p<0.05(n=8),#表示与wt的i/r组相比p<0.05(n=8);
图6e为ihc检测wt与pdcd4-/-小鼠对照组及模型组fgr蛋白含量图。
图7为体外ogd验证pdcd4通过fgr调控肾缺血再灌注损伤结果图;
其中,图7a为real-timert-pcr检测ogd条件下fgrmrna表达水平直方图;
图7b为wb检测ogd条件下fgr蛋白水平表达条带及含量直方图;
图7c为oe-pdcd4过表达条带及含量直方图;
图7d为sirna-fgr干扰fgr表达条带及含量直方图;
图7e为sirna-pdcd4后pdcd4mrna表达含量直方图;
图7f为sirna-pdcd4后wb检测条带图及fgrmrna、pdcd4、fgr含量表达直方图;
图7g为real-timert-pcr检测细胞因子变化直方图,从左到右依次为1l-1βmrna含量直方图、1l-6mrna含量直方图、tnf-αmrna含量直方图、mcp-1mrna含量直方图。
图7h为流式细胞技术检测细胞死亡率直方图;
图7i为不同条件下细胞caspase3活性直方图。
图8为实施例1中pdcd4通过fgr调控notch1信号通路的体内体外验证结果图;
其中,图8a为real-timert-pcr检测wt与pdcd4-/-小鼠对照组与模型组notch1-4mrna水平直方图;
图8b为wb检测wt与pdcd4-/-小鼠对照组与模型组notch1-4蛋白条带图及含量表达直方图;
图8c为wb检测notch1的表达变化条带图及notch1含量直方图;
图8d为wb检测stat3磷酸化水平电泳条带及stat3含量直方图;
图8e为stat3免疫荧光检测图及stat3磷酸化情况直方图;*与ctr组相比p<0.05(n=8),#表示与ogd组ctr相比p<0.05(n=8),&表示与ogdoe-pdcd4组相比p<0.05(n=8)。
图9为实施例1中过表达fgr可逆转pdcd4缺失在肾缺血再灌注损伤中的保护作用验证结果图;
其中,图9a为对照组与肾缺血再灌注损伤模型组小鼠血清中肌酐含量直方图;
图9b为对照组与肾缺血再灌注损伤模型组小鼠血清尿素氮含量直方图;
图9c为各实验组小鼠he染色结果;
图9d为各实验组小鼠肾脏形态学损伤评分统计结果直方图;
图9e为各实验组小鼠tunel染色图片;
图9f为各实验组小鼠tunel染色统计结果直方图;
图9g为各实验组小鼠if检测ly6b标记中性粒细胞浸润情况直方图;
图9h为各实验组小鼠if检测cd68标记巨噬细胞浸润情况直方图;*表示假手术组相比p<0.05,#表示与野生型模型组相比p<0.05,&表示与pdcd4-/-模型组相比。
图10为实施例1中pdcd4通过fgr-notch1通路参与顺铂诱导的急性肾损伤结果图;
其中,图10a为rt-pcr检测pdcd4、fgr及notch1mrna及蛋白表达含量直方图;
图10b为wb检测pdcd4、fgr及notch1电泳条带图;
图10c为各实验组小鼠血清中肌酐含量直方图;
图10d为各实验组小鼠血清中尿素氮含量直方图;
图10e为各实验组小鼠he染色结果图;
图10f为各实验组小鼠肾脏形态学损伤评分统计结果直方图;
图10g为各实验组小鼠tunel染色图片;
图10h为各实验组小鼠tunel染色统计结果直方图;
图10i为wb检测fgr、notch1电泳条带图;
图10j为wb检测fgr含量直方图;
图10k为wb检测notch1含量直方图。
图11为实施例1中sirna-fgr减轻肾缺血再灌注损伤验证实验结果图;
其中,图11a为各实验组小鼠血清中肌酐含量直方图;
图11b为各实验组小鼠血清中尿素氮含量直方图;
图11c为各实验组小鼠he染色结果图;
图11d为各实验组小鼠肾脏形态学损伤评分统计结果直方图;
图11e为各实验组小鼠caspase活性检测结果直方图。
图12为实施例1中普纳替尼减轻肾缺血再灌注损伤结果直方图;
其中,图12a为各实验组小鼠血清中肌酐含量直方图;
图12b为各实验组小鼠血清中尿素氮含量直方图;
图12c为各实验组小鼠he染色图;
图12d为各实验组小鼠肾脏形态学损伤评分统计结果直方图;
图12e为各实验组小鼠tunel染色图片;
图12f为各实验组小鼠tunel染色统计学分析。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本公开提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本公开所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本公开的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
术语解释部分:
aki(acutekidneyinjury,aki急性肾损伤):急性肾损伤是一组临床综合征,是指突发(1-7d内)和持续(>24h)的肾功能突然下降,定义为血清肌酐(scr)至少上升0.5mg/dl,表现为氮质血症、水电解质和酸碱平衡以及全身各系统症状,可伴有少尿(<400ml/24h或17ml/h)或无尿(<100ml/24h);
pdcd4:programmedcelldeath4,程序性细胞死亡因4;
iri:ischemiareperfusioninjury,iri缺血再灌注损伤。
正如背景技术所介绍的,现有技术中针对急性肾损伤的机制尚未明确,目前临床上没有较为有效的治疗药物。为了解决如上的技术问题,本公开针对急性肾损伤的机制进行了研究,并提供了基因治疗及fgr抑制剂在抗急性肾损伤治疗中的应用。
为了使得本领域技术人员能够更加清楚地了解本公开的技术方案,以下将结合具体的实施例与对比例详细说明本公开的技术方案。
实施例1
一、实验步骤
1.pdcd4在肾缺血再灌注损伤中的表达分布及作用
1.1pdcd4在缺血再灌注损伤中的表达变化及作用
1.1.1建立小鼠肾缺血再灌注损伤疾病模型,检测pdcd4的表达变化
选用12周龄c57bl/6j雄性鼠建立急性肾缺血再灌注模型,应用实时荧光定量pcr(real-timert-pcr)、wb、免疫组化染色(immunohistochemical–staining,ihc),分别检测pdcd4在缺血再灌注后不同时间点,即24h、48h、72h时mrna和蛋白水平的表达变化。同时通过免疫荧光(immunofluoresce,if)双标的方法检测pdcd4在肾脏近曲小管、远曲小管、集合管的表达分布情况及肾缺血再灌注损伤时的表达变化。
1.1.2检测pdcd4在急性肾小管坏死病人肾脏中的表达情况
ihc检测临床上肾癌病人癌旁组织切片与急性肾小管坏死病人肾活检切片中pdcd4的表达水平与分布。
1.2pdcd4在肾缺血再灌注损伤中的作用及机制
1.2.1pdcd4在肾缺血再灌注损伤中的作用
将c57bl/6jwt雄性小鼠和pdcd4-/-敲基因小鼠随机分组,构建肾急性缺血再灌注损伤疾病模型。在缺血45min后再灌注不同时间点取材,利用高效液相色谱法(hplc)检测血清中肌酐含量、全自动生化分析仪检测血清中尿素氮含量、苏木素-伊红染色(hematoxylin-eosinstaining,he)、原位末端转移酶标记技术(tunel染色)等方法明确pdcd4在肾脏缺血再灌注损伤中的生物学作用。
1.2.2pdcd4在肾缺血再灌注损伤中的作用机制
real-timert-pcr检测wt和pdcd4-/-小鼠对照组与模型组肾脏组织中代表性炎症因子il-1β,tnf-α,il-6及mcp-1的mrna变化。cd68标记巨噬细胞,ly6b标记中性粒细胞,应用if检测wt与pdcd4-/-小鼠对照组与模型组肾脏组织中的巨噬细胞及中性粒细胞的分布及变化。
2.pdcd4通过调控fgr-notch1信号通路引起肾缺血再灌注损伤
2.1pdcd4通过fgr参与肾缺血再灌注损伤
2.1.1体内验证pdcd4通过fgr调控肾脏缺血再灌注损伤
通过基因芯片技术分析肾缺血再灌注损伤时wt和pdcd4-/-小鼠间的差异表达基因,并绘制差异基因表达变化热图。real-timert-pcr、wb和ihc检测wt和pdcd4-/-小鼠对照组与模型组肾脏组织中fgrmrna及蛋白水平变化。
2.1.2体外ogd验证pdcd4通过fgr调控肾脏缺血再灌注损伤
real-timert-pcr及wb检测ogd后不同时间点fgr的变化,同时沉默pdcd4后fgrmrna及蛋白水平的变化。通过体外过表达pdcd4后沉默fgr,应用real-timert-pcr检测细胞因子的变化,应用流式及caspse3活性检测,明确pdcd4体外对肾小管细胞炎症和凋亡的影响是否通过fgr。
2.2pdcd4通过fgr调控notch1信号通路
2.2.1体内外验证pdcd4通过fgr调控notch1信号通路
real-timert-pcr、wb和ihc检测wt和pdcd4-/-小鼠对照组与模型组肾脏组织中notch1mrna及蛋白水平变化。
体外实验通过wb检测oe-pdcd4后sirna-fgr对nrk-52e细胞中notch1蛋白表达水平的影响,明确pdcd4是否通过fgr调控notch1。
2.2.2小鼠肾脏局部过表达fgr可逆转pdcd4缺失在肾缺血再灌注损伤中的保护作用
将wt和pdcd4-/-敲基因小鼠随机分组,局部注射过表达带gfp标签的fgr腺相关病毒(adeno-associatedvirus,aav)即aav-fgr-gfp,一个月后建立肾缺血再灌注损伤模型。在缺血45min后不同的再灌注时间点取材,hplc检测血清中肌酐含量、全自动生化分析仪检测血清中尿素氮含量、he染色、tunel染色等方法明确过表达fgr是否可以逆转pdcd4缺失在急性缺血再灌注损伤中的保护作用。real-timert-pcr检测细胞因子的表达,wb检测下游基因notch1的表达。
3.pdcd4通过fgr-notch1通路参与顺铂诱导的急性肾损伤
3.1体内实验检测pdcd4、fgr及notch1在顺铂诱导的急性肾损伤中的表达变化
c57bl/6j野生型雄性小鼠腹腔注射顺铂(30mg/kg)建立顺铂诱导的急性缺血再灌注模型。在注射顺铂后3d,5d,10d不同时间点取材,检测小鼠肾脏组织中pdcd4、fgr及notch1mrna蛋白表达变化。
3.2pdcd4在顺铂诱导的急性肾损伤中的作用及机制
c57bl/6j野生型雄性小鼠和pdcd4-/-敲基因小鼠随机分组,腹腔注射顺铂(30mg/kg)建立顺铂诱导的急性缺血再灌注模型,利用高效液相色谱法(hplc)检测血清中肌酐含量、全自动生化分析仪检测血清中尿素氮含量、苏木素-伊红染色(hematoxylin-eosinstaining,he)、原位末端转移酶标记技术(tunel染色)等方法明确pdcd4在顺铂诱导的急性肾损伤中的生物学作用。同时wb检测wt与pdcd4-/-小鼠对照组与模型组肾脏中fgr、notch1的蛋白表达变化。4.基因或普纳替尼干预pdcd4-fgr通路有效预防、治疗急性肾损伤
4.1sirna-fgr对肾缺血再灌注损伤的保护作用。
c57bl/6jwt雄性小鼠和pdcd4-/-敲基因小鼠随机分组,应用aav9腺相关病毒肾脏局部注射sirna-fgr,sirna-fgr序列为5‘-gacaugggcggcuacuaca-3’,一个月后构建肾急性肾损伤疾病模型。利用高效液相色谱法(hplc)检测血清中肌酐含量、全自动生化分析仪检测血清中尿素氮含量、苏木素-伊红染色(hematoxylin-eosinstaining,he)、原位末端转移酶标记技术(tunel染色)等方法验证基因干预fgr对急性肾损伤的预防和治疗作用。
4.2普纳替尼对肾缺血再灌注损伤的保护作用
将c57bl/6jwt雄性小鼠和pdcd4-/-敲基因小鼠随机分组,构建肾急性肾损伤疾病模型。在缺血前6h腹腔注射普纳替尼15mg/kg(selleckchem,houston,tx,usa),利用高效液相色谱法(hplc)检测血清中肌酐含量、全自动生化分析仪检测血清中尿素氮含量、苏木素-伊红染色(hematoxylin-eosinstaining,he)、原位末端转移酶标记技术(tunel染色)等方法验证普纳替尼对急性肾损伤的预防和治疗作用。
二、实验结果
1.pdcd4在急性肾缺血再灌注损伤中的表达分布及作用
1.1pdcd4在肾缺血再灌注损伤组织中表达显著升高
1.1.1小鼠肾缺血再灌注损伤后pdcd4在近曲小管和集合管中表达显著升高
real-timert-pcr结果显示在缺血再灌注损伤后48h,72hpdcd4在mrna水平显著升高,同时wb以及ihc结果显示与wt组相比pdcd4蛋白表达显著升高。免疫荧光双标结果显示,在肾缺血再灌注损伤时pdcd4主要在近曲小管和集合管中蛋白表达显著升高。
1.1.2pdcd4在急性肾小管坏死病人肾活检标本中的表达显著升高
ihc结果显示,与肾癌癌旁组织相比急性肾小管坏死病人肾活检切片中pdcd4表达显著升高。real-timert-pcr结果显示(图2a),模型组与对照组(sham)相比,wt小鼠pdcd4在mrna水平上表达明显升高,且在缺血再灌注48h时升高最明显;wb结果显示(图2b),pdcd4在缺血后肾脏组织蛋白水平表达与mrna水平一致;同时ihc检测结果显示(图2c),模型组与对照组(sham)相比,pdcd4在缺血再灌注48h时主要在肾小管中表达升高。if进一步验证了pdcd4在肾脏中的表达变化,并且通过与肾小管不同部位标记蛋白aqp1、calbindind28k、aqp3进行免疫荧光双标,其中pdcd4显示绿色,标记蛋白显示红色。结果显示,发生缺血再灌损伤时,pdcd4在远曲小管与集合管中表达升高明显(图2e)。
ihc检测急性肾小管坏死病人肾活检切片中pdcd4蛋白表达分布情况。如图2e显示,与肾癌癌旁正常组织相比,pdcd4在急性肾小管坏死病人肾组织中表达显著升高,且升高主要集中在肾小管中。
1.2pdcd4在肾缺血再灌注损伤中的作用及机制
1.2.1pdcd4的缺失显著减轻肾缺血再灌注损伤
he染色结果显示,pdcd4缺失后肾脏形态学损伤减轻,主要表现为肾小管上皮细胞空泡样变性减少,肾小管扩张程度减轻,管型形成减少;tunel染色结果显示,pdcd4缺失后肾小管上皮细胞的死亡显著减少。
为了验证pdcd4在肾缺血再灌注损伤中的作用,本实施例应用pdcd4敲基因鼠构建缺血45min再灌注48h的肾脏缺血再灌注模型,血清肌酐、尿素氮检测结果显示(图4a-b),与wt小鼠相比,缺血再灌注模型组与对照组相比血清肌酐、尿素氮值明显升高,而敲除pdcd4后血清肌酐、尿素氮值明显降低,提示pdcd4敲除后肾缺血再灌注损伤明显减轻。使用小鼠肾脏石蜡切片进行he染色,结果显示(图4c),肾缺血再灌注模型组肾脏形态学损伤严重,表现为肾小管损伤严重、近曲小管顶端刷状缘缺失、微绒毛脱落,对各组肾脏形态学损伤进行评分,结果如图4d显示,pdcd4缺失可显著减轻肾脏形态学损伤。tunel染色的结果显示(图4e),肾缺血再灌注组肾组织与对照组相比tunel染色阳性显著增加,与wt相比,pdcd4缺失导致tunel染色阳性显著降低,提示肾小管上皮细胞的损伤明显减轻。以上结果提示pdcd4缺失保护肾缺血再灌注损伤。
1.2.2pdcd4通过介导炎症反应加重肾缺血再灌注损伤
real-timert-pcr结果显示,pdcd4缺失后,肾缺血再灌注组肾脏组织中炎症因子mrna表达显著减少;if结果显示,pdcd4缺失后,肾脏组织中中性粒细胞、巨噬细胞的浸润显著减少。
为了进一步明确pdcd4加重肾缺血再灌注损伤的机制,我们应用real-timert-pcr检测wt和pdcd4-/-小鼠对照组与模型组炎症因子il-1β、tnf-α、il-6、mcp-1的变化,结果显示(图5a),在模型组中pdcd4缺失可显著降低缺血再灌注引起的炎症因子的表达升高;if检测各组小鼠肾脏组织中性粒细胞以及巨噬细细胞标记蛋白ly6b、cd68的变化,结果显示(图5e),模型组中pdcd4缺失后肾脏中中性粒细胞和巨噬细胞浸润显著减少。以上结果提示,pdcd4缺失可能通过抑制炎症反应减轻肾缺血再灌注损伤。
2.pdcd4通过调控fgr-notch1信号通路引起肾缺血再灌注损伤
2.1pdcd4通过fgr调控肾缺血再灌注损伤
2.1.1体内实验结果显示pdcd4通过fgr调控肾缺血再灌注损伤
基因芯片结果分析显示,在肾缺血再灌注损伤时,fgr显著升高,而pdcd4的缺失可以显著下调fgr,提示pdcd4加重肾缺血再灌注损伤可能是通过fgr发挥作用。进一步通过real-timert-pcr、wb和ihc验证,得出了与基因芯片一致的结论。
全基因芯片检测wt与pdcd4-/-小鼠对照组与缺血再灌注48h模型组肾脏组织中基因的表达情况,并绘制差异基因在肾缺血再灌注损伤时变化热图,结果显示(图6a),wt小鼠模型组与对照组相比,小鼠肾脏组织中src家族fgr的表达在mrna水平显著升高。在模型组中,敲除pdcd4下调肾缺血再灌注时fgr的mrna表达水平。通过real-timert-pcr(图6b)wb(图7c)以及ihc(图7d)分别检测wt与pdcd4-/-小鼠对照组与缺血再灌注48h模型组肾脏组织中fgr在mrna和蛋白水平的表达情况,得出了与基因芯片一致的结论,pdcd4缺失明显降低肾缺血再灌注损伤时fgr的表达升高。
2.1.2体外ogd实验表明pdcd4通过fgr调控肾小管细胞的炎症和死亡
ogd后不同时间点,real-timert-pcr及wb结果显示,fgr在mrna及蛋白表达显著升高,同时沉默pdcd4后fgr在mrna及蛋白水平上显著下降。体外过表达pdcd4后沉默fgr,在ogd条件下real-timert-pcr检测细胞因子的结果提示沉默fgr可显著抑制pdcd4引起的nrk-52e细胞炎症因子的表达,流式及caspse3活性检测结果表明沉默fgr可显著抑制过表达pdcd4对nrk-52e细胞凋亡诱导。
real-timert-pcr以及wb结果显示,nrk-52e细胞分别ogd24h、48h、72h时fgr表达明显升高(图7a-b);体外实验从炎症和凋亡两方面验证pdcd4通过fgr调控肾缺血再灌注损伤,wb结果显示,oe-pdcd4以及sirna-fgr均有较高的效率(7c-d),sirna-pdcd4后fgr在mrna和蛋白水平上表达均显著减少(图7e-f);sifgr可明显降低oe-pdcd4引起的细胞因子的表达升高(图7g),流式细胞技术(图7h)及caspase3活性检测(图7i)结果提示sifgr可明显降低oe-pdcd4引起的细胞死亡(图7g-h)进一步从体外验证pdcd4通过fgr调控肾缺血再灌注损伤。
2.2pdcd4通过fgr调控notch1信号通路
2.2.1体内外实验结果显示pdcd4通过fgr调控notch1信号通路
基因芯片结果分析显示,在肾缺血再灌注损伤时,notch1表达显著升高,pdcd4的缺失显著抑制了缺血再灌注损伤诱导的notch1表达。体内进一步用real-timert-pcr、wb和ihc进行验证得到了与芯片一致的结果。体外实验结果显示,odg条件下notch1在mrna和蛋白表达水平上均显著升高,sirna-fgr可显著下调notch1表达。体内外实验结果提示,pdcd4可能通过fgr调控notch1信号通路。进一步实验验证fgr通过磷酸化stat3活化stat3促进nothch1表达。
全基因芯片检测wt与pdcd4-/-小鼠对照组与缺血再灌注48h模型组肾脏组织中基因的表达情况,并绘制差异基因在肾缺血再灌注损伤时变化热图(图8a),结果显示,wt小鼠模型组与对照组相比,小鼠肾脏组织中notch1的表达在mrna水平显著升高。通过real-timert-pcrwb以及ihc分别检测wt与pdcd4-/-小鼠对照组与缺血再灌注48h模型组肾脏组织中notch1在mrna和蛋白水平的表达情况,结果显示(图8a-b),发生缺血再灌注损伤时notch1在mrna及蛋白水平上表达均明显升高,敲除pdcd4后再灌注损伤引起的notch1表达升高显著减弱。体外ogd条件下通过wb检测结果显示(图8c),降低fgr表达可以明显抑制过表达pdcd4引起的notch1的表达上调,提示pdcd4可能通过fgr调控notch1,进一步研究发现fgr通过磷酸化stat3活化stat3促进其入核发挥转录因子的活性,进而增加notch1表达。
2.2.2小鼠肾脏局部过表达fgr可逆转pdcd4缺失在肾缺血再灌注损伤中的保护作用
局部注射过表达带gfp标签的fgr腺相关病毒(adeno-associatedvirus,aav)即aav-fgr-gfp,wb结果显示,一个月后与对照组相比aav-fgr-gfp组fgr表达显著升高。血清肌酐、尿素氮、he染色、tunel染色、炎症因子检测等结果显示,过表达fgr可逆转pdcd4缺失在肾脏缺血再灌注损伤中的保护作用。
将wt和pdcd4-/-小鼠随机分组,肾脏局部注射过表达fgraav,一个月后建立急性肾缺血再灌注损伤模型。血清尿素氮、肌酐结果显示(图9a-b),在肾缺血再灌注损伤时aav-fgr-gfp小鼠尿素氮水平比wt小鼠明显升高,同时过表达fgr部分升高了敲除pdcd4引起的尿素氮、肌酐水平降低。he染色结果显示(图9c-d),肾缺血再灌注损伤时,局部注射aav-fgr-gfp导致肾脏形态学损伤进一步加重,且过表达fgr部分逆转了敲除pdcd4引起的肾脏形态学损伤减轻。tunel染色结果进一步提示(图9e-f),肾缺血再灌注损伤时,局部注射aav-fgr-gfp导致肾脏细胞凋亡增加,且过表达fgr在一定程度上抵消敲除pdcd4对细胞凋亡的抑制作用。real-timert-pcr结果显示(图9g),在肾缺血再灌注损伤模型中,局部注射fgr-gfp-aav导致肾脏组织中炎症因子表达、炎症细胞的浸润明显增加,且过表达fgr在一定程度上抵消敲除pdcd4对炎症因子表达及炎症细胞浸润的抑制作用(图9g-h)。以上结果从肾脏形态学结构功能损伤、细胞凋亡以及炎症浸润等方面共同提示,小鼠肾脏局部过表达fgr可逆转pdcd4缺失在肾缺血再灌注损伤中的保护作用。
3.pdcd4通过fgr-notch1通路参与顺铂诱导的急性肾损伤
3.1通过体内实验检测pdcd4在顺铂诱导的急性肾损伤中的表达变化
c57bl/6j野生型雄性小鼠腹腔注射顺铂(30mg/kg)后3d,5d,10d,结果显示小鼠肾脏组织中pdcd4、fgr及notch1mrna、蛋白表达显著升高。c57bl/6j野生型雄性小鼠(wildtipe,wt)腹腔注射顺铂(30mg/kg)后3d,5d,10d,结果显示小鼠肾脏组织中pdcd4、fgr及notch1mrna蛋白表达显著升高(图10a-b)。与wt小鼠相比,pdcd4-/-小鼠在腹腔注射顺铂后3d,血清中肌酐、尿素氮含量明显降低(图10c-d);he染色结果显示,pdcd4缺失后肾脏形态学损伤减轻,主要表现为肾小管上皮细胞空泡样变性减少,肾小管扩张程度减轻,管型形成减少(图10e-f);tunel染色结果显示,pdcd4缺失后肾小管上皮细胞的死亡显著减少(图10g-h);wb结果显示fgr显著升高,而pdcd4的缺失可以显著下调fgr,提示pdcd4参与顺铂诱导的急性肾损伤可能是通过fgr发挥作用(图10i)。
3.2pdcd4在顺铂诱导的急性肾损伤中的作用及机制
与wt小鼠相比,pdcd4-/-小鼠在腹腔注射顺铂后3d,血清中肌酐、尿素氮含量明显降低;he染色结果显示,pdcd4缺失后肾脏形态学损伤减轻,主要表现为肾小管上皮细胞空泡样变性减少,肾小管扩张程度减轻,管型形成减少;tunel染色结果显示,pdcd4缺失后肾小管上皮细胞的死亡显著减少;wb结果显示fgr显著升高,而pdcd4的缺失可以显著下调fgr,提示pdcd4参与顺铂诱导的急性肾损伤可能是通过fgr发挥作用。
第四部分基因或普纳替尼干预pdcd4-fgr通路有效预防、治疗急性肾损伤
4.1sirna-fgr对肾缺血再灌注损伤的保护作用。
与wt小鼠相比,肾脏局部注射aav9sirna-fgr组,血清中肌酐、尿素氮含量明显降低;he染色结果显示,肾脏形态学损伤减轻,主要表现为肾小管上皮细胞空泡样变性减少,肾小管扩张程度减轻,管型形成减少;capase3活性检测结果显示肾小管上皮细胞的死亡显著减少。而肾脏局部注射aav9sirna-fgrpdcd4敲基因组与未注射组相比损伤没有进一步减轻,组提示pdcd4通过fgr参与急性肾损伤,抑制fgr表达可预防及治疗急性肾损伤。
与wt小鼠相比,肾脏局部注射aav9sirna-fgr组,血清中肌酐、尿素氮含量明显降低(图11a-b);he染色结果显示,肾脏形态学损伤减轻,主要表现为肾小管上皮细胞空泡样变性减少,肾小管扩张程度减轻,管型形成减少(图11c-d);capase3活性检测结果显示肾小管上皮细胞的死亡显著减少(图11e)。而肾脏局部注射aav9sirna-fgrpdcd4敲基因组与未注射组相比损伤没有进一步减轻,组提示pdcd4通过fgr参与急性肾损伤,抑制fgr表达可预防及治疗急性肾损伤。
4.2普纳替尼对肾缺血再灌注损伤的保护作用
与wt小鼠相比,腹腔注射普纳替尼组,血清中肌酐、尿素氮含量明显降低;he染色结果显示,肾脏形态学损伤减轻,主要表现为肾小管上皮细胞空泡样变性减少,肾小管扩张程度减轻,管型形成减少;tunel结果显示肾小管上皮细胞的死亡显著减少。而普纳替尼并未进一步减轻pdcd4敲基因组肾脏损伤,提示pdcd4通过fgr参与急性肾损伤,药物干预fgr可预防及治疗急性肾损伤。
与wt小鼠相比,腹腔注射普纳替尼组,血清中肌酐、尿素氮含量明显降低(图12a-b);he染色结果显示,肾脏形态学损伤减轻,主要表现为肾小管上皮细胞空泡样变性减少,肾小管扩张程度减轻,管型形成减少(图12c-d);tunel结果显示肾小管上皮细胞的死亡显著减少(图12e)。而普纳替尼并未进一步减轻pdcd4桥基因组肾脏损伤,提示pdcd4通过fgr参与急性肾损伤,抑制fgr可预防及治疗急性肾损伤。
以上所述仅为本公开的优选实施例而已,并不用于限制本公开,对于本领域的技术人员来说,本公开可以有各种更改和变化。凡在本公开的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速检测BCR/ABL基因融合的探针组、试剂盒及方法与流程
- 酪氨酸激酶抑制剂的制造方法与工艺
- 芳香族酰胺类衍生物、其制备方法及其在医药上的应用与制造工艺
- 包含5α‑还原酶抑制剂的药物组合物的制造方法与工艺
- 作为脾酪氨酸激酶抑制剂的二氮杂螺烷酮取代的噁唑衍生物的制造方法与工艺
- 包含热弹性感觉剂和TRPA1受体抑制剂的皮肤接合剃刮助剂的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 5‑溴‑7‑氮杂吲哚啉‑2‑酮类化合物及其制备方法与制造工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种抗癌药物的晶体化合物及其制备方法与制造工艺