高车前苷及其衍生物在作为Nrf-2激活剂中的用途的制作方法
本发明涉高车前苷及其衍生物的医药用途技术领域,具体涉及高车前苷及其衍生物作为nrf-2激活剂在制备治疗与nrf2信号通路相关疾病的药物中的应用。
背景技术:
转录因子nrf2属于cnc-bzip(capncollarsubfamilyofbasicleucine-zipper),即cnc亮氨酸拉链转录激活因子家族,是调控细胞氧化应激反应的重要转录因子,同时也是维持细胞内氧化还原稳态的中枢调节者。nrf2通过诱导调控一系列抗氧化蛋白的组成型和诱导型表达,可以减轻活性氧和亲电体引起的细胞损伤,使细胞处于稳定状态,维持机体氧化还原动态平衡,因此成为细胞抗氧化应激的重要通路。大量研究表明nrf2与炎症、慢性肾病、糖尿病、心血管疾病、神经退行性疾病和肿瘤等多种疾病的发生有关。
nrf2信号通路的适当的激活可以增强细胞的抗氧化应激能力,维持细胞内的氧化还原平衡,减少自由基和化学致癌原对细胞的损伤,从而维持细胞正常的生理功能。因此寻找安全有效的nrf2激活剂,已成为药物研发的新方向。
高车前苷(homoplantaginin)属黄酮类化合物,主要存在于荔枝草中,其结构式如下:
药理研究表明:高车前苷具有治疗肝损伤,改善内皮胰岛素耐受性和抑制肿瘤生长、抗骨质疏松,诱使癌细胞凋亡。另有实验表明,高车前苷具有降血糖,调血脂作用,能明显改善no的生成,并能改善游离脂肪酸所致的血管内皮胰岛素抵抗。但目前还未见有关于高车前苷及其衍生物在调节nrf2活性方面的报道。
技术实现要素:
本发明首次发现,高车前苷及其衍生物可以作为nrf2激活剂,具有潜在的抗氧化应激活性,可用于制备与nrf2信号通路相关疾病的健康食品或药品中。基于此,本发明提出了下述技术方案:
本发明的第一方面,提供高车前苷和/或高车前苷衍生物在制备nrf2激活剂中的应用。
上述应用中,所述高车前苷衍生物为二氢高车前苷,其结构式如下:
上述应用中,所述高车前苷以及高车前苷衍生物可以通过商业途径购买获得;也可从荔枝草(salviaplebeiar·brown)中提取获得。其中:
所述高车前苷以及高车前苷衍生物可以由如下方法制备而成:
将荔枝草原料粉碎,加入体积分数为95%的乙醇进行回流提取,提取液浓缩,得浓缩液;将浓缩液采用乙酸乙酯/正丁醇-水作为两相溶剂系统进行萃取,取上层的乙酸乙酯/正丁醇相进行浓缩,得浸膏;将浸膏采用大孔树脂进行梯度洗脱,薄层监测,收集高车前苷流分,浓缩,调节浓缩后的溶液至酸性,滤出沉淀物,洗涤,干燥,得到淡黄色粉末;再利用高效液相色谱仪进行分离,得到高车前苷和高车前苷衍生物。
优选的,所述体积分数为95%的乙醇的加入量为荔枝草原料重量的8-12倍。
优选的,依次用体积分数为30%、50%、85%和95%的乙醇水溶液进行梯度洗脱。
本发明的第二方面,提供高车前苷和/或高车前苷衍生物作为nrf-2激活剂在制备抗氧化应激药物中的应用。
本发明的第三方面,提供高车前苷和/或高车前苷衍生物作为nrf-2激活剂在制备抑制细胞内皮细胞凋亡的药物中的应用。
上述应用中,所述细胞凋亡是由氧化性低密度脂蛋白诱导的。
本发明的第四方面,提供一种nrf2激活剂,所述nrf2激活剂以高车前苷和/或高车前苷衍生物为有效成分。
本发明的有益效果:
内皮细胞的凋亡、脂代谢的紊乱、炎症的发生是导致疾病发生发展的主要原因。高车前苷及其衍生物能够有效的抑制氧化性低密度脂蛋白引起内皮细胞的凋亡,通过激活nrf2,起到抗氧化保护内皮细胞的作用,高车前苷能够有效抑制apoe-/-小鼠中动脉硬化的发生发展、稳定斑块通过激活nrf2,降低斑块中ros表达,提高ho-1的表达。高车前苷以及衍生物可能通过降低作用,因此本发明为研究高车前苷及其衍生物作为nrf2的激活剂,保护内皮细胞损伤提供了理论和实验依据,本发明涉及的高车前苷及其衍生物可以作为一种有效nrf2激活剂的工具,用于发明研发有关疾病奠定了基础。
附图说明:
图1:高车前苷及其衍生物能够激活nrf2。
图2:高车前及其衍生物能够促进nrf2入核。
图3:高车前苷及其衍生物能够促进nrf2下游蛋白ho-1表达。
图4:高车前苷及其衍生物能够抑制内皮细胞中ros的表达。
图5:敲低nrf2高车前苷不能保护内皮细胞炎症反应。
图6:小鼠体重注射图。
图7:小鼠主动脉切片中ho-1表达量。
图8:小鼠主动脉切片中ros表达量。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
正如背景技术部分介绍的,转录因子nrf2属于cnc-bzip(capncollarsubfamilyofbasicleucine-zipper),即cnc亮氨酸拉链转录激活因子家族,是调控细胞氧化应激反应的重要转录因子,同时也是维持细胞内氧化还原稳态的中枢调节者。nrf2通过诱导调控一系列抗氧化蛋白的组成型和诱导型表达,可以减轻活性氧和亲电体引起的细胞损伤,使细胞处于稳定状态,维持机体氧化还原动态平衡,因此成为细胞抗氧化应激的重要通路。nrf2信号通路的适当的激活可以增强细胞的抗氧化应激能力,维持细胞内的氧化还原平衡,减少自由基和化学致癌原对细胞的损伤,从而维持细胞正常的生理功能。目前已有许多关于nrf2激活剂的报道,例如儿茶素酸酯、菜菔硫烷、姜黄素、白藜芦醇、奥替普拉、叔丁基对苯二酚等。不同种类的nrf2激活剂可能以不同的机制激活nrf2,因而其作用也有所不同。
高车前苷具有降血糖,调血脂作用,能明显改善no的生成,并能改善游离脂肪酸所致的血管内皮胰岛素抵抗。但目前还未见有关于高车前苷及其衍生物在调节nrf2活性方面的报道。
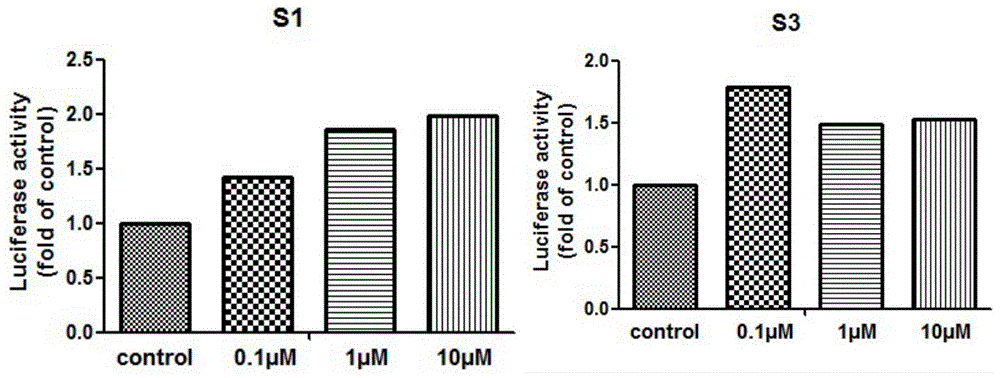
为研究高车前苷(s3)及高车前苷衍生物(s1)与nrf2的作用关系,本发明首先通过luci-hela转染细胞系看高车前苷及其衍生物能否激活nrf2,通过酶标仪在540nm处测得高车前苷(s3)及其衍生物(s1)能够激活nrf2,由此确定高车前苷及其衍生物可以作为nrf2的激活剂。
本发明所采用的luci-hela转染细胞系,它能稳定表达萤火虫荧光素酶,使用萤火虫荧光素酶报告基因试剂盒处理,是一种将nrf2的转录调控元件或5启动子区克隆在lucifersae的上游,或把3-utr区克隆在luciferase的下游,构成报告质粒,然后转染细胞,用s1、s3处理细胞后裂解细胞,测定荧光素酶活性,通过荧光素酶活性的高低来判断药物处理对nrf2的转录调控能否激活nrf2,通过酶标仪在540nm处测得高车前苷(s3)及其衍生物(s1)能够激活nrf2。(见图1)。
在正常生理状态下,nrf2通过n端与kelch样ech联合蛋白1(kelch-likeech-associatedprotein1,keap1)特异性结合于细胞质中,此时nrf2的活性受到抑制,细胞内ⅱ相酶类和抗氧化物处于基础表达水平,细胞处于稳定状态。当受到活性氧(reactiveoxygenspecies,ros)或其他亲电试剂刺激时,nrf2与keap1解偶联,并使得nrf2转移进入细胞核,在核内与小maf蛋白结合成异二聚体,进而识别并结合抗氧化反应元件(antioxidantresponseelement,are),启动下游抗氧化保护性基因和ⅱ相解毒酶基因的转录。我们利用内皮细胞接种于2cm的培养皿中,通过免疫荧光染色,发现高车前苷及其衍生物能够激活nrf2的入核(见图2)。
本发明还对高车前苷及其衍生物对nrf2下游蛋白ho-1表达、氧化应激的反应进行了研究。nrf2通过诱导调控一系列抗氧化蛋白的组成型和诱导型表达,可以减轻活性氧和亲电体引起的细胞损伤,使细胞处于稳定状态,维持机体氧化还原动态平衡。因此成为细胞抗氧化应激的重要通路。其下游信号通路的ho-1蛋白的表达,说明高车前苷及其衍生物能够激活nrf2起到抗氧化保护内皮细胞的作用。通过westernbloting检测氧化性低密度脂蛋白诱导的内皮细胞中ho-1蛋白的表达。
结果表明:与对照组ox-ldl组相比,加入化合物高车前苷衍生物(s10.1μm、1μm、10μm)同时加入ox-ldl,ho-1的表达量明显要比对照组ox-ldl的高,于此同时与对照组ox-ldl组相比,加入化合物高车前苷(s30.1μm、1μm、10μm)同时加入ox-ldl,ho-1的表达量明显要比对照组ox-ldl的高,说明高车前苷及其衍生物能够激活nrf2下游信号通路的抗氧化蛋白ho-1。(见图3),通过促进nrf2下游蛋白ho-1表达抑制氧化应激反应。
本发明还研究了高车前苷及其衍生物对ros的表达的影响,nrf2属于cnc调节蛋白家族,是具有碱性亮氨酸拉链结构的转录因子,广泛存在与机体各个器官,是细胞氧化还原反应的主要调控因子。正常生理情况下,nrf2主要与抑制剂keap1结合,以期非活性状态存在与胞浆中,在泛素蛋白酶体途径下迅速降解,以保持在生理状态下nrf2的低转录活性。当细胞受到活性氧(ros)或其他亲核剂刺激后,nrf2与keap1解偶联,活化的nrf2转运进入细胞核,与maf蛋白结合成异质二聚体与are结合,激活靶基因表达,调控ii相代谢酶、抗氧化酶或药物转运体的转录活性,从而发挥抗氧化损伤作用。通过dcfh-da探针法检测内皮细胞中ros的表达量,表明高车前苷及其衍生物能通过激活nrf2降低ros的表达水平。(见图4)
结果表明:与对照组ox-ldl组相比,加入化合物高车前苷衍生物(s10.1μm、1μm、10μm)同时加入ox-ldl,ros的表达量明显要比对照组ox-ldl的低,于此同时与对照组ox-ldl组相比,加入化合物高车前苷(s30.1μm、1μm、10μm)同时加入ox-ldl,ros的表达量明显要比对照组ox-ldl的高,说明高车前苷及其衍生物能够激活nrf2减少细胞内活性氧ros的表达。
本发明还研究了敲除nrf2后高车前苷对内皮细胞损伤保护作用的影响,nrf2驱动自由基阳离子通道是重要的内源性稳态机制,在抗炎症、抗凋亡、抗肿瘤、抗动脉粥样硬化、神经保护等方面起着重要的作用。核因子kb(nf-kb)体系主要涉及机体防御反应、组织损伤和应激、细胞分化和调亡以及肿瘤生长抑制过程的信息传递。在多数细胞类型,nf-kb在胞浆与抑制性蛋白质结合形成无活性的复合物。当肿瘤坏死因子等作用于相应受体后,可通过第二信使cer等激活此系统,而病毒感染、脂多糖、活性氧中间体、佛波酯、双链rna以及前述信息传递途径中活化的rkc、pka等则可直接激活nf-kb。活化的nf-kb进入细胞核,与dna接触,并启动或抑制有关基因的转录。敲低nrf2后,在ox-ldl的刺激下,高车前苷起不到保护内皮细胞的作用。(见图5)。
实验结果:与对照组随机干扰rna组相比,sinrf2干扰组加入化合物高车前苷并不能抑制nf-kb的入核,表明高车前苷是通过激活nrf2来保护内皮细胞免受损伤。
本发明还研究了高车前苷及其衍生物对apoe-/-小鼠心脏切片中nrf2下游抗氧化蛋白ho-1的影响。以评价抗动脉粥样硬化药物药效的经典动物模型apoe-/-小鼠为模型。对apoe-/-小鼠进行随机分组,包括对照组(control),高车前苷衍生物低剂量组(s15mg/kg)、高车前苷衍生物高剂量组(s110mg/kg)和高车前苷低剂量组(s35mg/kg)、高车前苷高剂量组(s310mg/kg),control组注射相应溶剂量的pbs。具体注射方式见图6。
采取腹腔注射方式,每24h注射一次,连续注射6周,注射期间随时跟踪小鼠体重变化。观察主动脉切片中ho-1。对数据统计分析,总结高车前苷及其衍生物对主动脉斑块中nrf2下游信号的表达。
结果表明:在注射期间,各组之间体重没有明显的差异,说明s1和s3注射剂量在小鼠的正常承受范围之内,对小鼠没有毒性作用。s1高剂量组(10mg/kg)与s1低剂量组(5mg/kg)或者对照组相比主动脉斑块ho-1蛋白含量显著增多,s3高剂量组(10mg/kg)与s3低剂量组(5mg/kg)或者对照组相比ho-1蛋白含量显著增多.(见图7)。
本发明还研究了高车前苷及其衍生物对apoe-/-小鼠主动脉中ros表达的影响。氧化应激是由于外界环境的刺激使机体内的氧化/抗氧化动态平衡遭到了破坏,导致机体内产生的一种应激反应。在正常的状态下,机体内参与ros的产生和清除的系统处于一种动态平衡状态。由于外界环境的刺激或者机体自身的变化等原因,使得机体内的ros产生增多或机体对ros的清除能力下降,机体就会出现氧化应激。nrf2-keap1-are信号通路系统在细胞抵抗内源性或者外源性氧化应激的机制中具有重要地位,是细胞防御系统的重要成员。氧化应激反应的减弱也能表明nrf2的激活。(见图8)
结果表明:与对照组相比,s1低剂量组(5mg/kg)、s1高剂量组(10mg/kg)和s3低剂量组(5mg/kg)、s3高剂量组(10mg/kg)与对照组相比,ros表达水平明显降低,说明高车前苷及其衍生物能够有效的抑制主动脉中ros的产生,激活nrf2。
由上述实验及其结果,可以得出如下结论:
内皮细胞的凋亡,脂代谢的紊乱,炎症的发生是导致疾病发生发展的主要原因。高车前苷及其衍生物能够有效的抑制氧化性低密度脂蛋白引起内皮细胞的凋亡,通过激活nrf2,起到抗氧化保护内皮细胞的作用,高车前苷能够有效抑制apoe-/-小鼠中动脉硬化的发生发展、稳定斑块通过激活nrf2,降低斑块中ros表达,提高ho-1的表达。因此本发明为研究高车前苷及其衍生物作为nrf2的激活剂,保护内皮细胞损伤提供了理论和实验依据,本发明涉及的高车前苷及其衍生物可以作为一种有效nrf2激活剂的工具,用于发明研发有关疾病奠定了基础。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
实施例1:高车前苷及其衍生物的制备
具体操作如下:
1)将荔枝草原料粉碎,加入10倍量95%乙醇液加热回流提取2次,每次4小时,合并提取液,减压回收乙醇,得浓缩液;
2)萃取及柱分离:以乙酸乙酯/正丁醇-水作为两相溶剂系统,取上层为乙酸乙酰/正丁醇相,下层为水相,取上层乙酸乙酰/正丁醇相浓缩成浸膏,将上述浓缩液适量水稀释滤过,上大孔树脂柱,用30%、50%、85%、95%乙醇水溶液洗脱,薄层监测,收集高车前苷流分,浓缩洗脱液;
3)除杂:将上述浓缩液调节至酸性,滤出沉淀物,用丙酮洗涤,真空干燥得淡黄色粉末;
4)高效液相分离纯化:采用体积分数为60%的色谱甲醇-水通过高效液相色谱仪分离,得到纯品高车前苷衍生物s1、高车前苷s3。
实施例2:高车前苷激活nrf2
1.实验方法
将内皮细胞接种于96孔的培养皿中,待细胞平铺面积达80%后,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为0.1μm、1μm和10μm的高车前苷s3及其衍生物s1,培养24h后,用10%的tca固定一小时,去离子水冲洗5遍,自然晾干后,每孔加入50μl的srb染料,摇床混匀10min后,去离子水冲洗5遍,自然晾干后,每孔加入100μltrisbase溶解,酶标仪540nm测得吸光值。将luci-hela细胞(购买与atcc)种于96孔板,待细胞平铺面积达80%后,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为0.1μm、1μm和10μm的高车前苷s3及其衍生物s1,培养24h后,吸去上清加入100μl裂解液后转入ep管中,4℃,15000g离心5min后,加入80μl荧光素酶,酶标仪测量数据。nrf2的值=荧光值/srb值(荧光值=每个孔的值-blank裂解的值,然后每组求均值后/con组,srb值=每个孔的值-空白孔,然后每组的均值/con)。
将内皮细胞接种于2ml的培养皿中,待细胞平铺面积达80%后,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为0.1μm、1μm和10μm的高车前苷及其衍生物(s3和s1)培养24h后加药处理。37℃,co2孵箱内培养6小时之后,弃去旧培养液,用0.1mpbs轻轻冲洗细胞2次;弃掉0.1mpbs,室温下用4%多聚甲醛固定细胞15min;弃掉4%多聚甲醛,用0.1mpbs冲洗3次,每次5min;弃掉pbs,加入配制好的30%正常血清封闭液,室温下封闭20-40min;弃掉封闭液,加入nrf2一抗(1:100抗体稀释液稀释),置于湿盒中4℃孵育过夜(18h以上);恢复到室温,弃掉一抗,用0.1mpbs冲洗3次,每次5min;弃掉pbs,加入荧光基团标记的兔-488二抗(抗体稀释液1:200稀释),37℃下孵育50min;恢复到室温,弃掉二抗,用0.1mpbs缓冲液洗3次,每次5min;用激光扫描共聚焦显微镜观察,拍照。免疫荧光检测内皮细胞中nrf2的入核情况。
2.实验结果:
实验结果分别如图1和图2所示,由图1可以看出,高车前苷(s3)及其衍生物(s1)能够激活nrf2;由图2可以看出,高车前苷(s3)及其衍生物(s1)能够激活nrf2的入核。
实施例3:高车前苷及其衍生物能够激活nrf2下游抗氧化蛋白ho-1
1.实验方法
将内皮细胞接种于直径6cm的培养皿中,正常组:去血清的正常条件下加入低密度脂蛋白(ldl)培养;设置对照组:去血清的正常条件下加入氧化型低密度脂蛋白(ox-ldl)培养;实验组:在去血清条件下加入浓度分别为0.1μm、1μm和10μm的s1、s3培养。37℃,co2孵箱内培养6小时之后裂解细胞,收集细胞裂解液,4℃12000g离心15min,取上清,westernblot检测内皮细胞中ho-1的表达水平。
2.实验结果
实验结果如图3所示,结果表明:与对照组ox-ldl组相比,加入化合物高车前苷衍生物(s10.1μm、1μm、10μm)同时加入ox-ldl,ho-1的表达量明显要比对照组ox-ldl的高,于此同时,与对照组ox-ldl组相比,加入化合物高车前苷(s30.1μm、1μm、10μm)同时加入ox-ldl,ho-1的表达量明显要比对照组ox-ldl的高,说明高车前苷及其衍生物能够激活nrf2下游信号通路的抗氧化蛋白ho-1。
实施例4:高车前苷及其衍生物能通过激活nrf2抑制ros
1.实验方法
将内皮细胞接种于直径2cm的培养皿中,去血清的正常条件下加入ldl培养;设置对照组:去血清的正常条件下加入ox-ldl培养;实验组:在去血清条件下加入浓度分别为0.1μm、1μm和10μm的s1、s3培养。37℃,co2孵箱内培养6小时之后,用pbs洗两遍,加入dcfh染料,37℃赋予30min,用原液洗三遍,于倒置荧光显微镜下拍照。
2.实验结果
实验结果如图4所示,结果表明:与对照组ox-ldl组相比,加入化合物高车前苷衍生物(s10.1μm、1μm、10μm)同时加入ox-ldl,ros的表达量明显要比对照组ox-ldl的低,于此同时与对照组ox-ldl组相比,加入化合物高车前苷(s30.1μm、1μm、10μm)同时加入ox-ldl,ros的表达量明显要比对照组ox-ldl的高,说明高车前苷及其衍生物能够激活nrf2减少细胞内活性氧ros的表达。
实施例5:敲除nrf2后高车前苷不能抑制nfkb的入核
1.实验方法
nrf2的sirna的设计由上海吉玛生物公司完成,lipofectamine2000转染技术转染细胞。将内皮细胞接种于直径2cm的培养皿中,细胞转染后无血清培养6h,更换完全培养基,继续培养至24h,加药处理。设置对照组:阴性干扰去血清的正常条件下培养;阴性干扰实验组分为ldl组,ox-ldl组,ox-ldl+10μm的s1组;实验组:nrf2sirna干扰在去血清条件下培养,分为ldl组,ox-ldl组,ox-ldl+10μm的s1组,37℃,co2孵箱内培养6小时之后,弃去旧培养液,用0.1mpbs轻轻冲洗细胞2次;弃掉0.1mpbs,室温下用4%多聚甲醛固定细胞15min;弃掉4%多聚甲醛,用0.1mpbs冲洗3次,每次5min;弃掉pbs,加入配制好的30%正常血清封闭液,室温下封闭20-40min;弃掉封闭液,加入p65一抗(1:100抗体稀释液稀释),置于湿盒中4℃孵育过夜(18h以上);恢复到室温,弃掉一抗,用0.1mpbs冲洗3次,每次5min;弃掉pbs,加入荧光基团标记的兔-488二抗(抗体稀释液1:200稀释),37℃下孵育50min;恢复到室温,弃掉二抗,用0.1mpbs缓冲液洗3次,每次5min;用激光扫描共聚焦显微镜观察,拍照。免疫荧光检测内皮细胞中nfkb的入核情况。
2.实验结果
实验结果如图5所示,结果表明:与阴性干扰组相比,加入化合物高车前苷衍生物(s110μm)同时加入ox-ldl,干扰掉nrf2组,加入化合物高车前苷衍生物(s110μm)同时加入ox-ldl,nfkb入核,表明高车前苷及其衍生物抑制炎反应通过激活nrf2,干扰掉nrf2后,高车前苷起不到抑制内皮细胞凋亡。
实施例6:高车前苷及其衍生物对apoe-/-小鼠心脏切片中nrf2下游抗氧化蛋白ho-1的影响。
1.实验方法
对apoe-/-小鼠进行随机分组,包括对照组(control),高车前苷衍生物低剂量组(s15mg/kg)、高车前苷衍生物高剂量组(s110mg/kg)和高车前苷低剂量组(s35mg/kg)、高车前苷高剂量组(s310mg/kg),control组注射相应溶剂量的pbs。注射期间随时跟踪小鼠体重的变化,给药6周后解剖。将主动脉根的冷冻切片置于冷丙酮4℃固定10min,对apoe-/-小鼠血管切片进行ho-1进行免疫荧光染色,观察斑块中ho-1的表达量。使用leicadmi8荧光显微镜观察染色结果,拍照。
2.实验结果
实验结果如图7所示,结果表明:s1高剂量组(10mg/kg)与s1低剂量组(5mg/kg)或者对照组相比主动脉斑块ho-1蛋白含量显著增多,s3高剂量组(10mg/kg)与s3低剂量组(5mg/kg)或者对照组相比ho-1蛋白含量显著增多。
实施例7:高车前苷及其衍生物能够激活nrf2降低apoe-/-小鼠主动脉中ros的表达
1.实验方法
我们将主动脉根进行冷冻包埋并切片备用,pbs冲洗后,加入dcfh-da进行染色30分钟,再用pbs洗三遍,倒置显微镜下观察拍照。
2.实验结果
实验结果如图8所示,结果表明:与对照组相比,s1低剂量组(5mg/kg)、s1高剂量组(10mg/kg)和s3低剂量组(5mg/kg)、s3高剂量组(10mg/kg)与对照组相比,ros表达水平明显降低,说明高车前苷及其衍生物能够有效的抑制主动脉中ros的产生,激活nrf2。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种1‑(4‑氯苯基)‑2‑吡啶‑1‑基‑1‑基乙酮溴化物的制备方法与制造工艺
- 一种1‑(4‑溴苯基)‑2‑吡啶‑1‑基‑1‑基乙酮溴化物的制备方法与制造工艺
- 一类噁唑并香豆素衍生物在农药方面的应用
- 一种香豆素衍生物、其制备方法以及由其制得的水凝胶的制作方法
- 3-(2-芳基-1h-吲哚-3-基)-4-羟基香豆素衍生物及其合成方法
- 一种羟甲香豆素的药物组合物及其医药用图
- 含卤素或苯并咪唑类功能基团的香豆素类衍生物及其制备方法和应用
- 一种有机叠氮与香豆素合成3-氨基苯并吡喃-2-酮类衍生物的新方法
- 香豆素-3-羧酸/1-辛烷磺酸/LGdH复合体及其合成方法
- 香豆素-3-羧酸/1-辛烷磺酸/LGdH复合体及其合成方法