一种磷酸镁骨水泥的制作方法与工艺
本发明属于医用生物材料领域,特别是涉及一种磷酸镁骨水泥。
背景技术:
据民政部报道,我国每年骨缺损及骨损伤者近300万,对骨修复材料的需求量巨大。目前,临床上应用于骨科领域的骨修复材料主要有硫酸钙、磷酸钙、聚甲基丙烯酸甲酯(PMMA)等生物医用材料。磷酸钙虽然具有良好的生物相容性和生物活性,但由于钙磷比偏高,在体内降解非常缓慢。例如,中国专利200810092798.1公开了一种磷酸钙基骨水泥,具有良好的生物相容性,但降解速度偏慢,且粘合力较差。近年来,对磷酸钙基复合生物材料的研究非常多。例如,美国专利6331312公开了可用作骨填料和粘合剂的可注射磷酸钙基复合材料,虽然可以降解吸收,但强度较低、粘合力仍不适用于韧带与骨组织的链接。中国专利201010534490.5公开了一种可注射可降解硫酸钙和磷酸钙复合材料,具有良好的骨传导性和生物相容性,但存在粘合力差等缺点。PMMA骨水泥由于易成型及好的粘结性常被用于人工关节假体的固定。例如美国专利5968999描述了可用于矫形的骨粘合剂PMMA,但是PMMA在固化过程中释放出大量的热,导致组织坏死,且凝固时收缩;另外PMMA不可降解吸收,生物相容性较差。在现有技术中,部分学者对镁基骨水泥进行了一些研究。例如,中国专利201010205094.8公开了一种用于形成可注射钙镁骨水泥的产品,包括:由复合磷酸钙盐与磷酸镁粉末均匀混合得到的固相粉末;以及由糊精、磷酸氢盐溶于水中得到的固化液。中国专利01105373.9公开了一种无机骨粘合剂,该无机骨粘合剂包括碱性化合物、磷酸盐、磷酸钙骨水泥和缓凝剂,用于人工关节固定、螺钉固定及破碎骨片的粘接固定。现有骨水泥在实际应用过程中仍存在一些问题:1.在作为骨粘合剂开发时,材料如何在保证连接稳定的情况下,仍落后于骨折的正常愈合速度,对骨折的愈合有阻碍作用。2.如何进一步提高材料的生物相容性。从现有的研究结果来看,这些材料仍存在一定程度的炎症反应,对组织愈合产生不利影响。如钾盐型MPC在机体降解会引起局部体液钾、镁等离子的异常增多和pH升高带来的碱性化;这种降解结果存在着导致机体局部酸碱平衡失调和电解质紊乱的趋势,从而对组织愈合带来不利的影响。
技术实现要素:
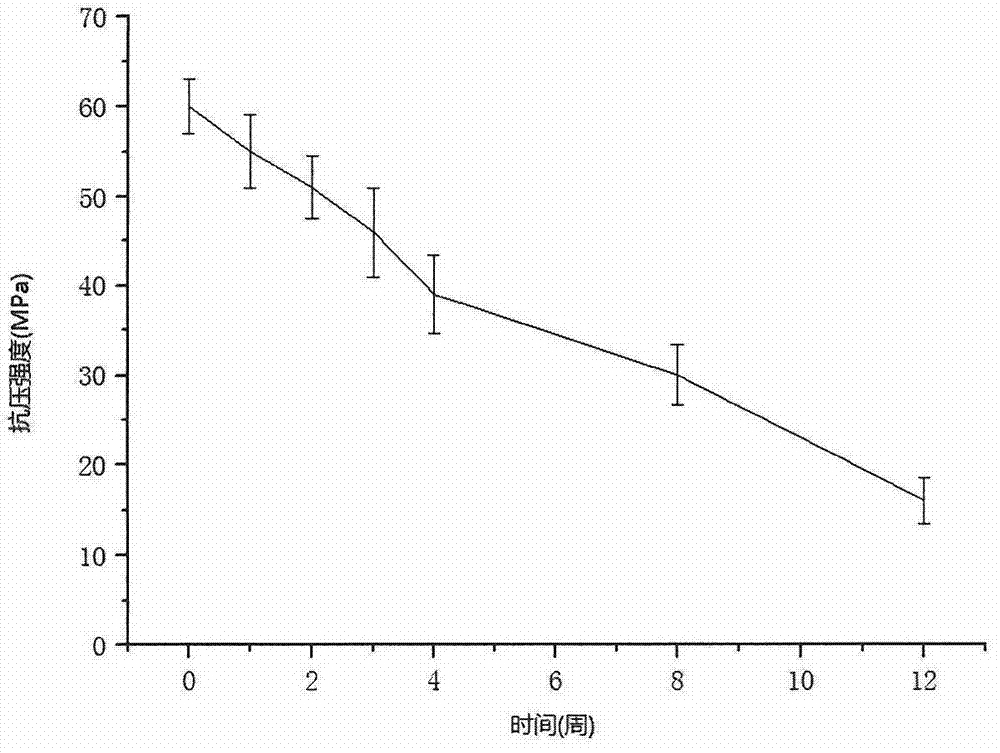
本发明的目的在于提供一种生物相容性良好的磷酸镁骨水泥。为实现这一目的,本发明的磷酸镁骨水泥中添加了含硅化合物,在降解过程中,骨水泥表面会产生富Si-O-Si的多孔凝胶层。在硅凝胶层表面会产生大量带负电荷的Si-OH,与不同种类的蛋白质通过氢键和离子胺键(-Si-O-H3N+-)结合形成高密度的蛋白吸附,硅凝胶层和在其表面形成的羟基磷灰石层具有高表面积,适合吸附大量的生物分子,从而促进细胞外响应。此外,硅凝胶层能够与镁离子等金属离子产生螯合作用,降低金属离子在体液中的游离度,减轻这些离子异常增多产生的毒性,从而提高生物相容性。本发明的另一个目的在于提供一种降解速率与新骨生长相匹配的骨水泥。通过调节磷酸盐中磷酸二氢铵的比例,控制反应产生的氨气量,获得不同孔隙率和孔大小的磷酸镁骨水泥。这些孔隙可以提高磷酸镁骨水泥与体液接触面积,加快降解速率,同时也利于细胞爬行,促进细胞粘附、增殖和分化,具备有一定的骨诱导性。本发明解决其技术问题所采用的技术方案是:一种磷酸镁骨水泥,包括粉剂和液剂,所述液剂与粉剂的液固比为0.1-0.5ml/g,所述粉剂由以下组分组成:32-70wt%的磷酸盐、28-65wt%氧化镁和1-15wt%的含硅化合物。本发明的目的还可以通过以下的技术方案来进一步实现:优选的,所述磷酸盐包括磷酸二氢钾、磷酸二氢钠、磷酸二氢钙的一种或其混合物。优选的,所述磷酸盐包括磷酸二氢铵,所述磷酸二氢铵占磷酸盐总量的5-30wt%。优选的,所述磷酸盐还包括磷酸钙,所述的磷酸钙包括α-磷酸三钙、β-磷酸三钙的一种或其混合物。优选的,所述氧化镁是氢氧化镁和/或碱式碳酸镁经过煅烧后获得,所述煅烧工艺中煅烧温度为1200℃-1600℃、煅烧时间为1-6h。不同的煅烧工艺影响氧化镁的活性,进而影响骨水泥的强度和凝固时间。更优选的,所述煅烧工艺中煅烧温度为1400℃-1500℃,时间为3-4小时。另外,本发明的磷酸镁骨水泥中添加了适量的可降解促粘接材料,可使骨水泥的粘接性能进一步提升。优选的,所述可降解促粘接材料包括糖类或其衍生物。不同糖类的水溶速度不一样,对骨水泥粘接性能的提升也有所差异。更优选的,所述糖类为二糖,所述二糖为蔗糖。优选的,所述可降解促粘接材料包括蜂蜡、透明质酸钠、骨胶。优选的,所述含硅化合物包括二氧化硅和/或硅酸盐。优选的,所述硅酸盐包括硅酸盐玻璃,所述的硅酸盐玻璃包括45S5、45S5.4F、52S4.6、55S4.3、60S3.8、42SF、46SF、49SF、52SF、55SF、60SF的一种或其混合物。为了便于实际应用和临床操作,在骨水泥中添加了适量缓凝剂。优选的,所述缓凝剂包括硼酸、硼酸盐、柠檬酸、柠檬酸盐的一种或其混合物。优选的,所述液剂包括去离子水、氯化钠溶液、磷酸溶液的一种或其混合物。优选的,所述粉剂中90%以上的颗粒粒径分布在1-75μm范围内,大于100μm的颗粒在3%以内。同现有技术相比,本发明的有益效果主要体现在:1.本发明的磷酸镁骨水泥可降解吸收,在降解过程中,骨水泥表面会产生富Si-O-Si的多孔凝胶层,并形成高密度的蛋白吸附,促进细胞外响应,并且能够与镁离子等金属离子产生螯合作用,降低金属离子在体液中的游离度,减轻这些离子异常增多产生的毒性,从而提高磷酸镁骨水泥的生物相容性,可广泛用于临床骨修复等。2.本发明的磷酸镁骨水泥可降解促粘结材料,如蜂蜡、透明质酸钠等,使本发明粘接力增强,并且在凝固过程放热温度低,凝固后体积微膨胀并与骨组织镶嵌,使得两者之间的结合更强,可用于骨粘接或者强化钢板、螺钉固定等。3.本发明的磷酸镁骨水泥凝固后具有一定孔隙率,且孔隙率可调,有利于细胞爬行,促进细胞粘附、增殖和分化,具备有一定的骨诱导性。同时,加快了磷酸镁骨水泥的降解速率,使之更好地匹配骨组织生长速度。4.本发明的磷酸镁骨水泥具有早高强特性,在降解过程中,可长期维持高于松质骨的强度,可用于成长因子等药物的运输,并控制其释放速度。附图说明图1为本发明骨水泥在SBF模拟体液中浸泡后表面有大量类骨质羟基磷灰石沉积。图2为本发明骨水泥在SBF模拟体液中浸泡不同时间后的抗压强度变化。图3为本发明骨水泥在SBF模拟体液中浸泡后表面产生的硅凝胶层。图4为本发明骨水泥用于骨折粘接术后1个月的Micro-CT图。图5为本发明骨水泥用于骨折粘接术后3个月的Micro-CT图。图6为本发明骨水泥用于骨折粘接术后6个月的Micro-CT图。具体实施方式为使本发明的目的、技术方案及优点更加清楚明白,以下参照附图并举实施例,对本发明进一步详细说明。本发明所述的氧化镁是氢氧化镁和/或碱式碳酸镁经过煅烧后获得,所述煅烧工艺中煅烧温度为1200℃-1600℃、煅烧时间为1-6小时,优选的,煅烧温度为1400℃-1500℃,煅烧时间为3-4小时。不同的煅烧工艺影响氧化镁的活性,进而影响骨水泥的强度和凝固时间。本发明的骨水泥示例性配方如下:配方a:按以下重量百分比(wt%)配制粉剂:液剂为去离子水,粉剂和液剂的液固比为0.2ml/g。配方b:按以下重量百分比(wt%)配制粉剂:液剂为生理盐水,粉剂和液剂的液固比为0.22ml/g。配方c:按以下重量百分比(wt%)配制粉剂:液剂为磷酸溶液,粉剂和液剂的液固比为0.25ml/g。配方d:按以下重量百分比(wt%)配制粉剂:液剂为去离子水,粉剂和液剂的液固比为0.16ml/g。配方e:按以下重量百分比(wt%)配制粉剂:液剂为生理盐水,粉剂和液剂的液固比为0.32ml/g。配方f:按以下重量百分比(wt%)配制粉剂:液剂为去离子水,粉剂和液剂的液固比为0.19ml/g。配方g:按以下重量百分比(wt%)配制粉剂:液剂为生理盐水,粉剂和液剂的液固比为0.23ml/g。配方h:按以下重量百分比(wt%)配制粉剂:液剂为磷酸溶液,粉剂和液剂的液固比为0.28ml/g。配方i:按以下重量百分比(wt%)配制粉剂:液剂为去离子水,粉剂和液剂的液固比为0.16ml/g。配方j:按以下重量百分比(wt%)配制粉剂:液剂为生理盐水,粉剂和液剂的液固比为0.3ml/g。以上示例性配方为本发明的一些优选配方比例,并不用于限制本发明。在本方明的一个实施例中,按配方a将粉剂与液剂共混,搅拌3min后倒入模具,半小时后脱模,并置于37℃、100%湿度环境下24h,测得平均抗压强度达到60MPa。将凝固后的骨水泥颗粒浸泡于SBF模拟体液中,一天后发现表面有大量类骨质羟基磷灰石沉积,如图1所示,说明骨水泥的生物活性良好。如图2所示,浸泡12周后,测得平均抗压强度为16MPa,仍维持在人体松质骨强度以上。在本发明的另外一个实施例中,按配方d将粉剂与液剂共混,搅拌2min后倒入模具,半小时后脱模,并置于37℃、100%湿度环境下24h。将凝固后的骨水泥浸泡于SBF模拟体液中,一周后表面产生了一层多孔硅凝胶层,如图3所示。骨水泥作为可降解粘接及对粉碎性骨折进行固定和修复在本发明的另外一个实施例中,按配方h将粉剂与液剂共混,搅拌3min后待用。试验模型为猪胫骨骨折,将60只新鲜猪胫骨编号后采用CHISS软件随机分为A、B、C、D、E、F六组,每组10只。用骨凿于猪胫骨平台下约3cm处,造成胫骨内侧方形骨折断面,并将表面积修整为1cm2大小,以方便测量后粘接强度的计算。将调配好的骨水泥均匀涂抹于骨折断面,加压固定15min后,将A、B、C组和D、E、F组分别在室温下23℃和37℃、模拟体液条件下固化0.5h、2h、24h后,分别测试其抗拉强度,结果如下:表1不同条件下固化相同时间后平均抗拉强度比较(N/cm2)对比结果可以看出,在室温和模拟体内环境条件下固化0.5h、2h、24h后平均抗拉强度并无显著性差异,且在室温23℃条件下固化2h即可达到较好粘接强度,与临床手术完成时间基本相同,因此有望应用于临床实践,用于骨折的直接粘接固定。在本发明的另外一个实施例中,我们选用15头成年健康猪作为实验组进行体内骨粘接试验,对照组采用松质骨4.0mm×4.0cm螺钉内固定。如图4至6所示,于术后1个月、3个月、6个月拍摄动物两膝关节正侧位X线片、CT,并作微计算机断层扫描(Micro-CT),所有家猪实验组和对照组都未出现骨折再移位。1个月后实验侧与对照侧骨折对位对线均良好,骨折线清晰可见,骨痂正常增生,钙化形成桥梁骨痂,可见部分骨小梁穿过骨水泥。术后3个月的图片与术后1个月比较,未发现骨折再移位,骨折线模糊,骨水泥逐渐被吸收降解,骨折已愈合。术后6个月图片显示,骨折线完全消失,MPC完全吸收降解,骨折完全愈合。采用方差分析的统计学方法对实验组术前、术后三个时间点家猪血磷、血镁、血钙浓度进行分析,其结果如下:表2不同时期血磷、血镁、血钙浓度方差分析(mmol/L)血镁浓度等在术前和术后的1个月、3个月和6个月相比并未出现显著变化,说明骨水泥植入家猪体内在其骨折愈合过程中,对血清电解质离子浓度未产生不良影响,其溶解吸收在家猪正常新陈代谢过程中完全可以平衡,实验过程中家猪未出现任何炎症等异常反应,且未因植入骨水泥而死亡,因此可以认为本发明的骨水泥可降解吸收、生物安全性高、生物相容性好。骨水泥用于强化螺钉固定。在本发明的另外一个实施例中,按配方i将粉剂与液剂共混,搅拌3min后待用。本发明骨水泥作为实验组,对照组采用PMMA骨水泥。试验方法:将18头50±2kg长白猪随机平均分为两组,在肱骨内上髁处,平行肱骨滑车长轴制作钉道,直径为8毫米,置入直径6毫米、长度为40毫米的松质骨螺钉,其余部分采用搅拌好的骨水泥填充粘接。于术后1个月、3个月、6个月拍摄X线、CT片,大体观察骨水泥吸收情况及新生骨质生长情况。分别在术后1个月、3个月、6个月三个时间点处死动物,进行取材,一部分标本做钉道直径分析,另一部分标本留作生物力学测定。X线、CT片等影像学显示:术后1个月、3个月、6个月三个时间点实验组螺钉周围骨水泥厚度逐渐变薄,骨水泥周围被新生骨质紧密包绕,即随着时间的推移,骨水泥逐渐吸收,被新生骨质替代;对照组螺钉周围聚甲基丙烯酸甲酯骨水泥厚度无明显变化,即不能被机体分解吸收。组织学分析显示:术后1个月、3个月、6个月实验组钉道直径分别为8.20±0.10mm、7.10±0.20mm、6.13±0.06mm,三个时间点间钉道直径有明显差异性(P<0.05);对照组钉道直径分别为8.23±0.05mm、8.10±0.04mm、8.13±0.06mm,无明显统计学差异(P>0.05)。术后1个月实验组、对照组钉道直径无统计学差异(P>0.05),3个月和6个月这两个时间点实验组的钉道直径小于对照组的钉道直径,有明显统计学差异(P<0.05)。测试1个月、3个月、6个月后的拔出力,实验组的最大拔出力分别为4.96±0.43kN、3.97±0.26kN、2.53±0.15kN,三个时间点最大拔出力有统计学差异(P<0.05);对照组的最大拔出力分别为2.80±0.36kN、2.62±0.24kN、3.06±0.38kN,三个时间点间无明显统计学意义(P>0.05)。术后1个月、3个月两个时间点实验组最大拔出力大于对照组最大拔出力,有明显统计学差异(P<0.05);6个月实验组最大拔出力与对照组最大拔出力无明显统计学差异(P>0.05)。实验结果表明,本发明骨水泥有较好的生物安全性,可以有效增强内固定强度,植入后3个月内对螺钉的强化固定优于PMMA,并在6个月内可基本吸收分解完毕,并被自体骨替代。最后应当说明的是,以上所述仅为本发明的较佳的实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1