一种Mn2+激活的白光玻璃及其制备方法与流程
本发明涉及白光玻璃,特别是涉及由一种Mn2+激活的能覆盖全波长的白光玻璃材料及其制备方法;具体涉及一种激发波长位于紫光区域,发射波长位于覆盖蓝光、绿光、与橙光区域的Mn2+激活的白光玻璃材料及其制备方法;属于发光材料技术领域。
背景技术:
传统照明用白光通常利用紫外光源同时激发红光、绿光、蓝光材料,通过三基色材料按一定比例配色,得到白光。如在节能灯灯罩表面,涂覆红光材料Y2O3:Eu3+、绿光材料LaPO4:Ce,Tb与蓝光材料BAM:Eu,用同一波长的紫外光激发,则可得白光,原理是三种发光材料在同一波长(如254nm)均有较强吸收。另一种用于路灯的白光材料则是由Dy3+激活的白光材料,由于Dy3+能同时发射478nm蓝光与579nm橙光,从而得到白光。最近几年新兴的白光LED是黄色荧光粉YAG:Ce与蓝光芯片组成的白光。通常的照明装置均需要将荧光粉与胶按一定比例混合,再涂覆于激发源之上。荧光粉颗粒因对LED发射的光及其自身的荧光产生强烈的360度方向上的散射,对白光LED发光没有贡献的方向上的散射即为反向散射,而反向散射导致大比例的能量消失在照明装置结构中,而丢失的能量最终转化成热,使体系温度升高,而体系温度的升高不仅使发光材料与芯片的发射波长产生温度位移与温度猝灭,进一步降低照明装置的总功效,而且加速环氧树脂的老化及缩短照明装置的使用寿命。
为了避免多种荧光粉的配色工艺,及减少不同荧光粉之间的自吸收问题,单基质多发射的白光材料引起了重视。如在氯磷酸盐基质中同时引入Eu2+、Tb3+与Mn2+三种发光中心,通过调整掺杂浓度从而控制三种发光中心的浓度,利用400nm LED芯片激发,可得色坐标位于(0.32,0.33)的白光【X.Chen,P.P.Dai,X.T.Zhang,C.Li,S.Lu,X.L.Wang,Y.Jia,Y.C.Liu,Phosphor via Dual Energy Transfers for White Light-Emitting Diodes A Highly Efficient White Light(Sr3,Ca,Ba)(PO4)3Cl:Eu2+,Tb3+,Mn2+,Inorg.Chem.2014,53,3441-3448.】。在基质Ba1.3Ca0.7SiO4中存在两种碱金属离子格位,当同时引入Eu2+与Mn2+做为发光中心,并调控发光中心的浓度,得色坐标位于(0.345,0.375)的白光【W.Z.Lv,M.M.Jiao,Q.Zhao,B.Q.Shao,W.Lü,H.P.You,Ba1.3Ca0.7SiO4:Eu2+,Mn2+:A Promising Single-Phase,Color-Tunable Phosphor for Near-Ultraviolet White-Light-Emitting Diodes,Inorg.Chem.,2014,53(20),11007-11014.】。这些产品均有一个共同的特点:在同一种基质中,引入不同元素的发光中心,即发光中心来自不同的原料,发光中心各自发光,该类产品往往导致不同元素的发光中心间产生无辐射弛豫,使发光效率下降,而且不同原料混料与比例控制工艺复杂。
技术实现要素:
本发明的目的在于克服现有技术的缺点,提供一种无色透明并在紫外灯下发出明亮白光的单基质单掺杂离子发光玻璃,即一种Mn2+激活的白光玻璃。
本发明发现,单基质单掺杂离子发光玻璃的基质中存在BO4与PO4正四面体,锰离子在高温条件下未被氧化成四价,而保持二价,由于玻璃中形成不同的Zn2+离子格位,当Mn2+取代Zn2+,可同时发蓝光与橙光。而现有技术报道在粉末材料中Mn2+分别取代四配位与六配位的格位时可分别发出宽带的绿光与红光,相对于粉末材料,本发明中Mn2+在玻璃材料中的发光发生蓝移,即位于四配位的Mn2+从绿光蓝移至蓝光,六配位的Mn2+从红光蓝移至橙光。同时,利用透明发光玻璃可具有与单晶相似的光学性质。用真空热压法制备的YAG:Nd透明陶瓷的透明度、折射光及激光性质均与YAG:Nd单晶接近,但制备发光玻璃的周期远比生长单晶的短,而且,发光玻璃的尺寸可比单晶的大许多,且形状多变,将能发出白光的透明发光玻璃安装于照明装置中,可大福度减少反向散射,提高白光效率及解决其温度猝灭与散射问题。
本发明的目的通过如下技术方案实现:
一种Mn2+激活的白光玻璃:以xZnO-(60-x)B2O3-40P2O5为基质,以Mn2+作为发光中心,化学组成为xZnO-(60-x)B2O3-40P2O5:yMn2+,其中x=10~50,y=0.1~5;玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光;在350nm紫外光激发下,其发射光谱由两个分别位于443nm的蓝光与574nm的橙光发射带组成,其色坐标位于(x=0.3234,y=0.3261)。
为进一步实现本发明目的,优选地,所述x=20~40;所述y=1~3。Mn2+的摩尔掺杂浓度为玻璃基质总物质的量的1%~3%。进一步优选所述ZnO与B2O3的物质的量的比例为1:1。
所述Mn2+激活的白光玻璃的制备方法:将固体原料ZnO、H3BO3、NH4H2PO4及MnCO3准确称量,按化学组成计量比混合均匀,在1100~1300℃加热0.5~3小时至熔融状态,迅速转移至500~600℃的马弗炉中退火,冷却至室温,得Mn2+激活的白光玻璃产品。
优选地,所述至熔融状态的加热温度为1150~1250℃。
优选地,所述至熔融状态的加热时间为2~3小时。
优选地,所述退火的温度为540~580℃。
本发明产品在可见光下呈无色透明,在紫外灯下发出明亮白光。在350nm激发下,其发射光谱由两个分别位于443nm的蓝光与574nm的橙光宽发射带组成,分别来自于Mn2+处于不同配位环境中的发光,其色坐标位于(x=0.3234,y=0.3261),正好处于理想白光区域。
本发明忽略掺杂Mn2+的物质的量,即0.1%~5%,基质中ZnO与B2O3的物质的量之和始终占40%,P2O5的物质的量占60%。
相对于现有技术,本发明具有如下优点和效果:
(1)本发明与已知的单基质发发光粉末相比,由于是发光玻璃,无需要混胶,透明发光,形状多变。
(2)本发明与已知的发光玻璃相比,可发射从蓝光至橙光的全波长白光,其色坐标位于(x=0.3234,y=0.3261),正好处于理想白光区域,无需要配色混粉工艺,避免荧光粉散射问题。
(3)与已研发的Mn2+掺杂的发光材料相比,本发明因材料不含稀土,制备过程无需避水避氧,大大降低生产成本。
附图说明
图1为实施例1制备的白光玻璃在可见光下的照片图。
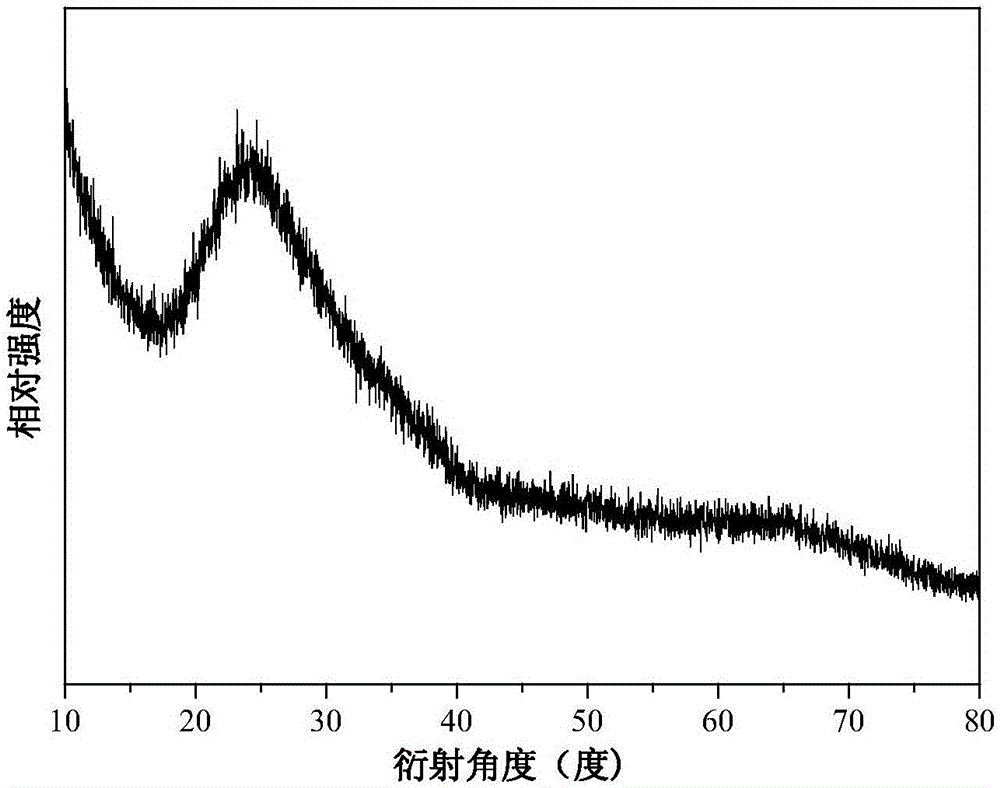
图2为实施例1制备的白光玻璃磨碎后的XRD图。
图3为实施例1制备的白光玻璃的激发光谱(监测波长分别为574与443nm)。
图4为实施例1制备的白光玻璃的发射光谱(激发波长为350nm)。
图5为实施例1制备的白光玻璃的色坐标位置。
具体实施方式
为更好地理解本发明,下面结合实施例和附图对本发明作进一步的描述,但本发明要求保护的范围并不局限于实施例表示的范围。
实施例1
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.05mol(4.069g)ZnO、0.02mol(1.236g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.001mol(0.1149g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1250℃加热3小时至熔融状态,迅速转移至预热至550℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。如图1所示,白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。产品XRD(Bruker D8 Advance X射线衍射仪检测)如图2所示,图中只一个无定型峰,说明产品为玻璃态。利用Fluoromax-4荧光光谱仪(HORIBA Jobin Yvon Inc.),在室温条件下检测产品的发光性能,如图3所示,该白光玻璃产品以442nm为监测波长时,激发光谱为350nm宽带,以574nm监测波长时,激发光谱由350nm宽带与410nm左右的宽带组成,图中350nm宽带来自于基质吸收,而410nm左右属于Mn2+的特征峰。从图4可见,本实施例白光玻璃产品发射光谱由两个分别位于蓝光与橙光的发射带组成,最大发射波长分别为442nm与574nm。从图5可见,本实施例白光玻璃产品发的白光的色坐标位于(x=0.3234,y=0.3261),正好处于理想白光区域。产品不含稀土,制备方法简单,适于工业生产。
实施例2
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.04mol(3.256g)ZnO、0.04mol(2.473g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.002mol(0.229g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1150℃加热2小时至熔融状态,迅速转移至预热至540℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例3
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.03mol(2.441g)ZnO、0.06mol(3.701g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.003mol(0.3447g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1100℃加热3小时至熔融状态,迅速转移至预热至580℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例4
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.051mol(4.150g)ZnO、0.018mol(1.112g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.004mol(0.459g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1300℃加热0.5小时至熔融状态,迅速转移至预热至500℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例5
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.048mol(3.906g)ZnO、0.024mol(1.483g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.005mol(0.5745g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1258℃加热1小时至熔融状态,迅速转移至预热至520℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例6
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.045mol(3.662g)ZnO、0.03mol(1.854g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.0005mol(0.0574g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1150℃加热3小时至熔融状态,迅速转移至预热至570℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例7
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.02mol(1.627g)ZnO、0.08mol(3.055g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.0001mol(0.0114g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1180℃加热2小时至熔融状态,迅速转移至预热至600℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例8
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.01mol(0.814g)ZnO、0.1mol(3.819g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.0003mol(0.0344g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1200℃加热1小时至熔融状态,迅速转移至预热至510℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例9
将固体原料0.015mol(0.122g)ZnO、0.09mol(3.437g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.0035mol(0.402g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1280℃加热2小时至熔融状态,迅速转移至预热至590℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例10
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.025mol(0.374g)ZnO、0.05mol(2.673g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.0045mol(0.172g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1250℃加热3小时至熔融状态,迅速转移至预热至590℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
实施例11
一种Mn2+激活的白光玻璃的制备方法:将固体原料0.035mol(2.849g)ZnO、0.03mol(0.763g)H3BO3、0.08mol(9.202g)NH4H2PO4及0.0045mol(0.172g)MnCO3准确称量,通过研磨,按计量比混合均匀,在1180℃加热2小时至熔融状态,迅速转移至预热至600℃的马弗炉中退火,冷却至室温,即得白光玻璃产品。白光玻璃产品在可见光下呈无色透明,在紫外灯下发出明亮白光。该白光玻璃的外观、XRD图及荧光光谱与实施例1的基本相似。
从上述实施例可见,本发明是以xZnO-(60-x)B2O3-40P2O5为基质,以Mn2+作为发光中心的白光玻璃,其中x=10~50,即基质中ZnO与B2O3的物质的量之和始终占40%,P2O5的物质的量占60%;其中y=0.1~5,即Mn2+的摩尔掺杂浓度为玻璃基质总物质的量的0.1%~5%。由于基质中存在BO4与PO4正四面体,锰离子在高温条件下未被氧化成四价,而保持二价,由于玻璃中形成不同的Zn2+离子格位,当Mn2+取代Zn2+,使同时发蓝光与橙光。
本发明为单基质白光玻璃,发光中心来自同一原料,即同一锰源在合成过程中,自动产生不同配位环境中的Mn2+发光,光谱由两个分别位于443nm的蓝光与574nm的橙光宽发射带组成。避免混胶,无需要配色混粉工艺,透明发光,形状多变。与已知的发光玻璃相比,可发射从蓝光至橙光的全波长白光,其色坐标位于(x=0.3234,y=0.3261),正好处于理想白光区域。与已研发的Mn2+掺杂的发光材料相比,本发明因材料不含稀土,制备过程无需避水避氧,大大降低生产成本。
- 还没有人留言评论。精彩留言会获得点赞!