磷酸转酮酶和磷酸转乙酰酶生产乙酰-辅酶A衍生化合物的用途的制作方法
1.发明领域
本发明涉及在工程化宿主细胞中用于生产乙酰辅酶A衍生化合物的组合物和方法。
2.发明背景
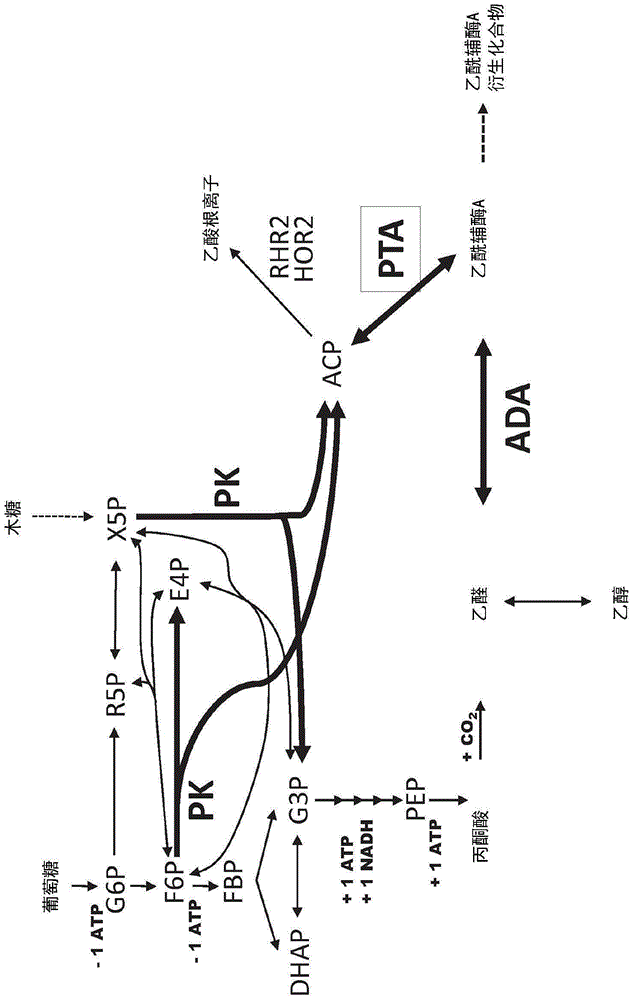
乙酰辅酶A(乙酰-CoA)是合成必要的生物化合物的关键中间体,所述必要的生物化合物包括聚酮化合物,脂肪酸,类异戊二烯,酚类,生物碱,维生素和氨基酸。来源于乙酰辅酶A的代谢产物为初级和次级代谢物,其包括工业效用的化合物。在酵母中,乙酰辅酶A通过丙酮酸盐代谢进行生物合成(图1)。然而,在这种生物合成途径中,所述反应通过丙酮酸羧化酶和/或丙酮酸脱氢酶催化而失去CO2。在工业发酵的设置中,提供对丙酮酸代谢和下游糖酵解的替换物的益处是在丙酮酸盐脱羧反应中产生更少的CO2,从而在终产物中可以捕获更多的碳,因此增加最大理论产量。第二个益处是产生更少的NADH,因此需要明显更少的氧气对它再氧化。这可以通过表达磷酸转酮酶(PK;EC 4.1.2.9)连同磷酸转乙酰酶(PTA;EC 2.3.1.8)来完成。
PK和PTA催化反应将果糖-6-磷酸(F6P)或木酮糖-5-磷酸(X5P)转换为乙酰辅酶A。如图1所示,PK从戊糖磷酸的中间体木酮糖-5-磷酸中,或从上游糖酵解的中间物D-果糖6-磷酸(F6P)中得到。PK将X5P分裂为3-磷酸甘油醛(G3P)和乙酰磷酸,或将F6P分裂为赤藓糖4-磷酸(E4P)和乙酰磷酸。然后PTA将乙酰磷酸转换成乙酰辅酶A。由循环通过转醛醇酶和转酮醇酶的非氧化磷酸戊糖途径网络,G3P可以重新进入下游糖酵解,并且E4P可重新进入磷酸戊糖途径或糖酵解。
本申请人之前已经描述了引入PK和PTA酶,可提高异源类异戊二烯的生产效率。参见于2012年11月9日提交的美国专利申请号13/673,819(现为美国专利号8,415,136),其整体内容通过引用并入本文。特别地,当细胞溶质的乙酰辅酶A仅使用在天然酵母的代谢网络中发生的化学反应来通过葡萄糖合成时,经甲羟戊酸途径将葡萄糖转换为类异戊二烯法呢烯的最大可能化学计量产率为23.6wt%。通过在用于甲羟戊酸生产的代谢网络中包括由乙酰化乙醛脱氢酶(acetaldehyde dehydrogenase,acetylating)(ADA;EC 1.2.1.10)和利用NADH的HMG-CoA还原酶催化的反应,最大理论化学计量产率提高到25.2wt%。随着PK和PTA的进一步引入,最佳的反应网络的最大理论产率显著增加,能够达到29.8wt%的质量收率或更大。
Sondregger等人也描述了PK和PTA在关于酵母菌株利用木糖生产乙醇中的益处。参见Sondregger等人,Applied and Environmental Microbiology70(5):2892-2897(2004),其整体内容通过引用并入本文。异源磷酸转酮酶途径(PK,PTA和ADA)被引入至酿酒酵母(S.cerevisiae)中以解决乙醇的低产量,所述乙醇低产量由来源于树干毕赤酵母(Pichia stipitis)的NAD(P)H依赖性木糖还酶和NAD+依赖性木糖醇脱氢酶的过表达导致。在两种氧化还原酶反应中的不同辅因子偏好导致了厌氧氧化还原平衡问题,所述问题表现在还原反应中间体木糖醇的大量积累,因此,导致了乙醇的低产量。通过引入磷酸转酮酶途径使得氧化还原代谢平衡,其使得转化为乙醇每木糖一个NADH的净再氧化,并使得乙醇产量提高25%。然而,PK的过表达也导致乙酸根离子(acetate)积累的增多和发酵速率的降低。尽管可以通过将磷酸转酮酶途径与ALD6突变(将乙醛转换为乙酸根离子)相结合而使得一些乙酸根离子积累减少,但是通过重组磷酸转酮酶途径的流量大约是最佳流量的30%,所述最佳流量需要完全消除木糖醇和甘油的积累。作者认为较高活性的磷酸转乙酰酶和/或乙醛脱氢酶可能对阻止基于磷酸转酮酶途径的乙酸根离子形成来说是必要的。
因此,尽管引入异源PK途径可使得乙酰辅酶A的衍生化合物产率得到实质性改善,但似乎需要实现该途径的进一步改进,以达到通过PK和PTA的最佳的碳流量(flux)。本文提供的组合物和方法解决了这个需求并且也提供了相关的优势。
3.
技术实现要素:
本发明提供了改进利用磷酸转酮酶(PK)和磷酸转乙酰酶(PTA)的组合物和方法,用于生产工业上有用的化合物。这些组合物和方法基于以下惊人发现:基于磷酸转酮酶途径的乙酸根离子累积起因于为PK催化产物的乙酰磷酸的酶催化水解。乙酰磷酸水解是不需要的副反应,其通过消耗碳,可对来自乙酰辅酶A的任何类型产物的生产产生负面影响,所述衍生自乙酰辅酶A的任何类型产物包括类异戊二烯化合物,聚酮化合物和脂肪酸。在宿主细胞中,通过功能性地扰乱天然酶催化乙酰磷酸水解,而减少乙酸根离子的积累和增加朝向生产乙酰辅酶A的通过PK/PTA途径的碳流量增加。
本文提供的组合物和方法进一步以天然酶(即GPP1/RHR2,以及其密切相关的同源物GPP2/HOR2)在酵母中催化乙酰磷酸水解为乙酸根离子的意外发现为基础。这两种酶以前仅仅以具有甘油-1-磷酸酶(EC 3.1.3.21;或者被称为“甘油-3-磷酸酶”)活性为特点,因此,这些酶混杂的乙酰-磷酸酶活性是出人意料的。在异源表达PK和PTA的细胞中,编码RHR2和HOR2的基因的一种或两种的缺失导致乙酸根离子的积累减少,其中编码RHR2的基因的单独缺失导致乙酸根离子浓度的实质减少。此外,在工程化为包括PK、PTA和甲羟戊酸途径的细胞中的RHR2基因的缺失使得为乙酰辅酶A衍生的类异戊二烯的法呢烯的产量实质增加。
因此,本文提供了经遗传修饰的宿主细胞和它们生产工业上有用的化合物的使用方法。在一方面,本文提供的经遗传修饰的宿主细胞包括:编码磷酸转酮酶(PK;EC 4.1.2.9)的异源核酸;和内源酶的功能性破坏(functional disruption),所述内源酶将乙酰磷酸转换为乙酸根离子。在一些实施方案中,经遗传修饰的宿主细胞进一步包括编码磷酸转乙酰酶(PTA;EC 2.3.1.8)的异源核酸。
在另一方面,本文提供经遗传修饰的宿主细胞,其包括:编码磷酸转乙酰酶(PTA;EC 2.3.1.8)的异源核酸;和内源酶的功能性破坏,所述内源酶将乙酰磷酸转换为乙酸根离子。在一些实施方案中,经遗传修饰的宿主细胞进一步包括编码磷酸转酮酶(PK;EC 4.1.2.9)的异源核酸。
在一些实施方案中,所述将乙酰磷酸转换为乙酸根离子的酶是甘油-1-磷酸酶(EC 3.1.3.21)。在一些实施方案中,所述甘油-1-磷酸酶选自由GPP1/RHR2,GPP2/HOR2,及其同源物和变异体组成的组。在一些实施方案中,所述经遗传修饰的宿主细胞包括GPP1/RHR2的功能性破坏。在一些实施方案中,所述经遗传修饰的宿主细胞包括GPP2/HOR2的功能性破坏。在一些实施方案中,所述经遗传修饰的宿主细胞包括GPP1/RHR2和GPP2/HOR2两者的功能性破坏。
在一些实施方案中,所述经遗传修饰的宿主细胞进一步包括编码酰化乙醛脱氢酶(ADA;EC 1.2.1.10)的异源核酸。在一些实施方案中,所述经遗传修饰的宿主细胞进一步包括天然丙酮酸脱氢酶(PDH)-支路的一种或多种酶的功能性破坏。在一些实施方案中,PDH-支路的一种或多种酶选自乙酰辅酶A合成酶1(ACS1),乙酰辅酶A合成酶2(ACS2)和乙醛脱氢酶6(ALD6)。
在一些实施方案中,所述经遗传修饰的宿主细胞能够产生异源乙酰辅酶A衍生化合物。在一些实施方案中,所述异源乙酰辅酶A衍生化合物选自类异戊二烯,聚酮化合物和脂肪酸组成的组。在特定的实施方案中,所述经遗传修饰的宿主细胞能够产生类异戊二烯。
在一些实施方案中,所述经遗传修饰的宿主细胞包含编码形成异戊烯焦磷酸的甲羟戊酸(MEV)途径中的一种或多种酶的一种或多种异源核酸。在一些实施方案中,所述MEV途径中的一种或多种酶包括利用NADH的HMG-CoA还原酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括使两分子乙酰辅酶A缩合形成乙酰乙酰辅酶A的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括使乙酰乙酰辅酶A与乙酰辅酶A缩合形成HMG-CoA。在一些实施方案中,所述MEV途径中的一种或多种酶包括将HMG-CoA转换为甲羟戊酸的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括使得甲羟戊酸磷酸化为5-磷酸甲羟戊酸的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括将5-磷酸甲羟戊酸转换为5-焦磷酸甲羟戊酸的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括将5-焦磷酸甲羟戊酸转换为异戊烯焦磷酸的酶。在一些实施方案中,所述MEV途径中的一种或多种酶选自HMG-CoA合成酶、甲羟戊酸激酶、磷酸甲羟戊酸激酶和甲羟戊酸焦磷酸脱羧酶。在一些实施方案中,所述宿主细胞包括编码MEV途径的全部酶的多种异源核酸。在一些实施方案中,所述编码MEV途径的一种或多种酶的一种或多种异源核酸在单一转录调节因子的控制下。在一些实施方案中,所述编码MEV途径的一种或多种酶的一种或多种异源核酸在多个异源转录调节因子的控制下。在一些实施方案中,所述经遗传修饰的宿主细胞进一步包括编码酶的异源核酸,所述酶可以将异戊烯焦磷酸(IPP)转换为二甲基烯丙基焦磷酸(DMAPP)。在一些实施方案中,所述经遗传修饰的宿主细胞进一步包括编码酶的异源核酸,所述酶能使得IPP和/或DMAPP分子缩合形成聚异戊二烯化合物(polyprenyl compound)。在一些实施方案中,所述经遗传修饰的宿主细胞进一步包括编码酶的异源核酸,所述酶可以修饰IPP或聚异戊二烯(polyprenyl)以形成类异戊二烯化合物。
在一些实施方案中,所述可以修饰IPP或聚异戊二烯以形成类异戊二烯化合物的酶选自以下酶所构成的组:蒈烯合成酶,香叶醇合成酶,芳樟醇合成酶,柠檬烯合成酶,月桂烯合成酶,罗勒烯合成酶,α-蒎烯合成酶,β-蒎烯合成酶,γ-萜品烯合成酶,异松油烯合成酶,紫穗槐二烯(amorphadiene)合成酶,α-法呢烯合成酶,β-法呢烯合成酶,法呢醇合成酶,橙花叔醇合成酶,广藿香醇合成酶,诺卡酮合成酶和松香二烯(abietadiene)合成酶。
在一些实施方案中,所述类异戊二烯选自由下述所构成的组:半萜,单萜,二萜,三萜,三萜,四萜,倍半萜和多萜。在一些实施方案中,所述类异戊二烯是倍半萜。在一些实施方案中,所述类异戊二烯是C5-C20的类异戊二烯。在一些实施方案中,所述类异戊二烯选自由下述所构成的组:松香二烯,紫穗槐二烯,蒈烯,α-法呢烯,β-法呢烯,法呢醇,香叶醇,香叶基香叶醇,异戊二烯,芳樟醇,柠檬烯,月桂烯,橙花叔醇,罗勒烯,广藿香醇,β-蒎烯,桧烯,γ-萜品烯,异松油烯和朱栾倍半萜。
在另一方面,本文提供了能够产生类异戊二烯的经遗传修饰的宿主细胞,所述细胞包含:编码形成异戊烯焦磷酸的甲羟戊酸(MEV)途径中的一种或多种酶的一种或多种异源核酸;编码磷酸转酮酶(PK)的异源核酸;编码磷酸转乙酰酶(PTA)的异源核酸;和甘油-1-磷酸酶(EC 3.1.3.21)的功能性破坏。在一些实施方案中,所述甘油-1-磷酸酶是GPP1/RHR2,或其同源物或变异体。在一些实施方案中,所述甘油-1-磷酸酶是GPP2/HOR2,或其同源物或变异体。
另一方面,本文提供了能够产生类异戊二烯的经遗传修饰的宿主细胞,所述细胞包含:编码形成异戊烯焦磷酸的甲羟戊酸(MEV)途径中的一种或多种酶的一种或多种异源核酸;编码乙酰化乙醛脱氢酶(ADA)的异源核酸;编码磷酸转酮酶(PK)的异源核酸;编码磷酸转乙酰酶(PTA)的异源核酸;和甘油-1-磷酸酶(EC 3.1.3.21)的功能性破坏。在一些实施方案中,所述甘油-1-磷酸酶是GPP1/RHR2,或其同源物或变异体。在一些实施方案中,所述甘油-1-磷酸酶是GPP2/HOR2,或其同源物或变异体。
另一方面,本文提供了能够产生类异戊二烯的经遗传修饰的宿主细胞,所述细胞包含:编码形成异戊烯焦磷酸的甲羟戊酸(MEV)途径中的一种或多种酶的一种或多种异源核酸;编码乙酰化乙醛脱氢酶(ADA)的异源核酸;天然PDH-支路的至少一种酶的功能性破坏,所述天然PDH-支路的酶选自由下述所构成的组:乙酰辅酶A合成酶1(ACS1),乙酰辅酶A合成酶2(ACS2)和乙醛脱氢酶6(ALD6);编码磷酸转酮酶(PK)的异源核酸;编码磷酸转乙酰酶(PTA)的异源核酸;和甘油-1-磷酸酶(EC 3.1.3.21)的功能性破坏。在一些实施方案中,所述甘油-1-磷酸酶是GPP1/RHR2,或其同源物或变异体。在一些实施方案中,所述甘油-1-磷酸酶是GPP2/HOR2,或其同源物或变异体。
另一方面,本文提供了能够产生类异戊二烯的经遗传修饰的宿主细胞,所述细胞包含:编码形成异戊烯焦磷酸的甲羟戊酸(MEV)途径中的一种或多种酶的一种或多种异源核酸,其中所述一种或多种酶包括利用NADH的HMG-CoA还原酶;编码乙酰化乙醛脱氢酶(ADA)的异源核酸;天然PDH-支路的至少一种酶的功能性破坏,所述天然PDH-支路的酶选自由下述所构成的组:乙酰辅酶A合成酶1(ACS1),乙酰辅酶A合成酶2(ACS2)和乙醛脱氢酶6(ALD6);编码磷酸转酮酶(PK)的异源核酸;编码磷酸转乙酰酶(PTA)的异源核酸;和甘油-1-磷酸酶(EC 3.1.3.21)的功能性破坏。在一些实施方案中,所述甘油-1-磷酸酶是GPP1/RHR2,或其同源物或变异体。在一些实施方案中,所述甘油-1-磷酸酶是GPP2/HOR2,或其同源物或变异体。
另一方面,本文提供了能够产生类异戊二烯的经遗传修饰的宿主细胞,所述细胞包含:编码形成异戊烯焦磷酸的甲羟戊酸(MEV)途径中的多种酶的一种或多种异源核酸,其中所述多种酶包括乙酰辅酶A:丙二酰辅酶A酰基转移酶;编码乙酰化乙醛脱氢酶(acetylaldehyde dehydrogenase,acetylating)(ADA)的的异源核酸;天然PDH-支路的至少一种酶的功能性破坏,所述天然PDH-支路的酶选自由下述所构成的组:乙酰辅酶A合成酶1(ACS1),乙酰辅酶A合成酶2(ACS2)和乙醛脱氢酶6(ALD6);编码磷酸转酮酶(PK)的异源核酸;编码磷酸转乙酰酶(PTA)的异源核酸;和甘油-1-磷酸酶(EC 3.1.3.21)的功能性破坏。在一些实施方案中,所述甘油-1-磷酸酶是GPP1/RHR2,或其同源物或变异体。在一些实施方案中,所述甘油-1-磷酸酶是GPP2/HOR2,或其同源物或变异体。
另一方面,本文提供了能够产生聚酮化合物的经遗传修饰的宿主细胞,所述细胞包含:编码聚酮化合物生物合成途径中的一种或多种酶的一种或多种异源核酸;编码磷酸转酮酶(PK)的异源核酸;编码磷酸转乙酰酶(PTA)的异源核酸;和甘油-1-磷酸酶(EC 3.1.3.21)的功能性破坏。在一些实施方案中,所述甘油-1-磷酸酶是GPP1/RHR2,或其同源物或变异体。在一些实施方案中,所述甘油-1-磷酸酶是GPP2/HOR2,或其同源物或变异体。
在另一方面,本文提供了能够产生脂肪酸的经遗传修饰的宿主细胞,所述细胞包含:编码脂肪酸生物合成途径中的一种或多种酶的一种或多种异源核酸;编码磷酸转酮酶(PK)的异源核酸;编码磷酸转乙酰酶(PTA)的异源核酸;和甘油-1-磷酸酶(EC 3.1.3.21)的功能性破坏。在一些实施方案中,所述甘油-1-磷酸酶是GPP1/RHR2,或其同源物或变异体。在一些实施方案中,所述甘油-1-磷酸酶是GPP2/HOR2,或其同源物或变异体。
在一些实施方案中,本文提供的经遗传修饰的宿主细胞选自由下述所构成的组:细菌细胞,真菌细胞,藻类细胞,昆虫细胞和植物细胞。在一些实施方案中,所述细胞是酵母细胞。在一些实施方案中,所述酵母是酿酒酵母。
在一些实施方案中,与不包含将乙酰磷酸转换为乙酸根离子的内源酶的功能性破坏的酵母细胞相比,所述经遗传修饰的宿主细胞产生数量增加的乙酰辅酶A衍生化合物(例如,类异戊二烯,聚酮化合物或脂肪酸)。
在另一方面,本文提供了生产异源乙酰辅酶A衍生化合物的方法,所述方法包括:在适合于形成所述异源乙酰辅酶A衍生化合物的条件下,在含有碳源的培养基中培养能够产生本文描述的异源乙酰辅酶A衍生化合物的经遗传修饰的宿主细胞种群;并回收来自培养基的所述异源乙酰辅酶A衍生化合物。在一些实施方案中,异源乙酰辅酶A衍生化合物选自由类异戊二烯,聚酮化合物和脂肪酸构成的组。
另一方面,本文提供了增加宿主细胞内乙酰辅酶A或乙酰辅酶A衍生化合物产量的方法,所述方法包括:在宿主细胞中表达编码磷酸转酮酶(PK;EC 4.1.2.9)的异源核酸;和功能性破坏将乙酰磷酸转换为乙酸根离子的内源酶。在一些实施方案中,所述方法还包括在宿主细胞中表达编码磷酸转乙酰酶(PTA;EC 2.3.1.8)的异源核酸。
另一方面,本文提供了增加宿主细胞内乙酰辅酶A产量的方法,所述方法包括:在宿主细胞中表达编码磷酸转乙酰酶(PTA;EC 2.3.1.8)的异源核酸;和功能性破坏将乙酰磷酸转换为乙酸根离子的内源酶。在一些实施方案中,所述方法还包括在宿主细胞中表达编码磷酸转酮酶(PK;EC 4.1.2.9)的异源核酸。
在一些实施方案中,所述将乙酰磷酸转换为乙酸根离子的酶是甘油-1-磷酸酶(EC 3.1.3.21)。在一些实施方案中,所述甘油-1-磷酸酶选自GPP1/RHR2,GPP2/HOR2,和其同源物及变异体。在一些实施方案中,所述GPP1/RHR2或其同源物或变异体被功能性破坏。在一些实施方案中,所述GPP2/HOR2或其同源物或变异体被功能性破坏。在一些实施方案中,所述GPP1/RHR2和GPP2/HOR2,或GPP1/RHR2的同源物或变异体和GPP2/HOR2的同源物或变异体都被功能性破坏。在一些实施方案中,所述宿主细胞选自由下述所构成的组:细菌细胞,真菌细胞,藻类细胞,昆虫细胞和植物细胞。在一些实施方案中,所述宿主细胞是酵母细胞。在一些实施方案中,所述酵母是酿酒酵母。在一些实施方案中,与不包含将乙酰磷酸转换为乙酸根离子的内源酶的功能性破坏的酵母细胞相比,所述宿主细胞产生数量增加的乙酰辅酶A或乙酰辅酶A衍生化合物。
4.附图说明
图1提供了在酵母宿主细胞内将糖(葡萄糖和木糖)转换为乙酰辅酶A和乙酰辅酶A衍生化合物中所涉及的途径的示意图。粗体箭头指出重组磷酸转酮酶的途径。乙酰磷酸是乙酰辅酶A的磷酸转酮酶(PK)/磷酸转乙酰酶(PTA)途径的中间体,其被RHR2和HOR2水解为乙酸根离子。缩写:G6P,葡萄糖-6-磷酸;R5P,核酮糖-5-磷酸;X5P,木酮糖-5-磷酸;F6P,果糖-6-磷酸;E4P,赤藓糖-4-磷酸(eryhtrose-4-phosphate);FBP,果糖-1,6-二磷酸;DHAP,二羟丙酮磷酸;G3P,甘油醛-3-磷酸;PEP,磷酸烯醇丙酮酸;ADA,乙醛脱氢酶,乙酰化;ACP,乙酰磷酸。
图2提供了生产类异戊二烯的甲羟戊酸途径中典型的酶。缩写:AcCoA,乙酰辅酶A;AcAcCoA,乙酰乙酰辅酶A;HMGCoA,3-羟基-3-甲基戊二酰-辅酶A;Mev5P,甲羟戊酸-5-磷酸;Mev5DP,甲羟戊酸-5-二磷酸;IPP,异戊烯基二磷酸;DMAPP,二甲基烯丙基焦磷酸;Erg10,乙酰辅酶A硫解酶;ACC1,乙酰辅酶A羧化酶;AACS,乙酰乙酰辅酶A合成酶;Erg13,3-羟基-3-甲基戊二酰-辅酶A合成酶;HMGr,3-羟基-3-甲基戊二酰-辅酶A还原酶;Erg12,甲羟戊酸激酶;Erg8,磷酸甲羟戊酸激酶;Erg19,甲羟戊酸焦磷酸脱羧酶。
图3A-3B提供了野生型(菌株Y967,左)以及重组酵母细胞(中间,右)的糖消耗(A)和乙酸根离子产量(B),所述重组酵母细胞包括:异源乙醛脱氢酶的酰化(Dz.eutE)和天然PDH-支路的缺失(acs1Δ acs2Δ ald6Δ)(菌株Y12869;中间);还包括异源磷酸转酮酶(Lm.PK)和磷酸转乙酰酶(Ck.PTA)(菌株Y12746;右)。
图3C-3D提供了重组酵母细胞的糖消耗(C)和乙酸根离子产量(D),所述重组酵母细胞包括:异源乙醛脱氢酶的酰化(Dz.eutE)和天然PDH-支路的缺失(acs1Δ acs2Δ ald6Δ)(菌株Y12869;左);还包括异源磷酸转酮酶(Lm.PK)(Y19390菌株;中)或磷酸转乙酰酶(Ck.PTA)(菌株Y19391;右)。
图4提供了在120分钟的时间过程中野生型酿酒酵母菌株Y967的无细胞提取物(CFE)中的乙酰磷酸水解的演示。显示了:仅CFE(左);CFE加30nM的广谱磷酸酶抑制剂氟化钠(中间);和已被加热灭活的CFE(右)。
图5提供了对菌株Y967的无细胞提取物的阴离子交换层析结果。蛋白质用30倍的柱体积的0-100%梯度的缓冲液B(20mM Tris-Cl pH 7,1M NaCl,10%甘油)以0.5mL/分钟的流速洗脱,并收集1mL的级分,通过蛋白质凝胶电泳进行分析(图5B),并测定乙酰磷酸酶活性(图5A)。ACP,乙酰磷酸。
图6A提供了关于Y967的级分10的阴离子交换层析的结果。通过质谱分析来自该纯化的最具有活性的级分#14,以确定级分中蛋白质的身份(图6B)。活性级分中的RHR2被鉴定为磷酸酶。
图7提供了对野生型酵母菌株(Y968)或重组酵母菌株的CFE的乙酰磷酸酶活性测试结果,所述重组酵母菌株包含RHR2或HOR2缺失或RHR2和HOR2二者都缺失。
图8A-8C提供了重组酵母菌株种群的乙酸根离子浓度(A),甘油浓度(B)和光密度(C)。菌株Y12746.ms63909.ms64472包含PDH-支路缺失(acs1Δ acs2Δ ald6Δ),并异源表达乙醛脱氢酶乙酰化(aceylating)(Dz.eutE),磷酸转酮酶(Lm.PK),磷酸转乙酰酶(Ck.PTA),和法呢烯生产途径中的基因。菌株Y12746.ms63909.ms64472rhr2^与菌株Y12746.ms63909.ms64472同基因,但还包含RHR2(rhr2^)缺失。
图8D-8E提供了重组酵母菌株种群的乙酸根离子浓度(D)和光密度(E)。菌株Y12745包含PDH-支路缺失(acs1Δ acs2Δ ald6Δ),并异源表达乙醛脱氢酶乙酰化(Dz.eutE),磷酸转酮酶(Lm.PK)和磷酸转乙酰酶(Ck.PTA)。菌株Y12746 rhr2^与菌株Y12746同基因,但还包含RHR2(rhr2^)缺失。
图9提供了重组酵母菌株种群的相对法呢烯浓度(顶部)和相对光密度(底部),其中RHR2基因是完整的(RHR2+)或缺失的(rhr2–)。Y968(右面板)是野生型酵母菌株。Y12869.ms63907.ms64472(“Y12869”;自右面板起第二个)包含PDH-支路缺失(acs1Δ acs2Δ ald6Δ),并异源表达乙醛脱氢酶乙酰化(Dz.eutE)和法呢烯生产途径中的基因,但不表达磷酸转酮酶或磷酸转乙酰酶。Y12746.ms63907.ms64472(“Y12746”;自左面板起第二个)包含PDH-支路缺失(acs1Δ acs2Δ ald6Δ),并异源表达乙醛脱氢酶乙酰化(Dz.eutE)和法呢烯生产途径中的基因,并使用磷酸转酮酶和磷酸转乙酰酶作为生产细胞溶质的乙酰辅酶A的途径,其用于法呢烯的合成。Y12745.ms63907.ms64472(“Y12745”;左面板)包含PDH-支路缺失(acs1Δ acs2Δ ald6Δ)和法呢烯生产途径中的基因,并使用磷酸转酮酶和磷酸转乙酰酶作为生产细胞溶质的乙酰辅酶A的途径,其用于法呢烯的合成。
5.具体实施方式
5.1术语
如本文所使用的术语“异源的”是指自然界中通常没有发现的东西。术语“异源核苷酸序列”是指在自然界中的给定的细胞中通常不会被发现的核苷酸序列。同样地,异源核苷酸序列可以是:(a)对其宿主细胞而言是外来的(即,对所述细胞而言是“外源性”的),(b)在宿主细胞中天然存在的(即,“内源性”),但在细胞中呈现不自然的数量(即,比在宿主细胞中自然发现的数量更多或更少);或(c)天然存在于宿主细胞中但位于其天然基因座外。术语“异源酶”是指在自然界中的给定的细胞中通常不会被发现的酶。所述术语包含如下的酶:(a)对给定的细胞而言外源的(即,被宿主细胞中非天然存在的核苷酸序列,或宿主细胞中的给定的环境中非自然存在的核苷酸序列编码);和(b)在宿主细胞中天然被发现(例如,所述酶由对细胞而言是内源性的核苷酸序列编码),但在宿主细胞中以非天然的量(例如,大于或小于自然发现的量)产生。
在另一方面,本文使用的关于分子、特别是酶和核酸的术语“天然的”或“内源的”,表示在它们所起源的生物体中或在它们所天然存在于的生物体中表达的分子与表达水平无关,表达水平可低于,等于或高于在天然微生物中的分子的表达水平。应理解,在重组微生物中天然酶或多核苷酸的表达可被修饰。
如本文所用的,对例如靶基因(例如,PDH-支路的一个或多个基因)的“功能性破坏”(“functionally disrupt”或“functional disruption”),这意味着以减少宿主细胞中被靶基因编码的蛋白质的活性这样的方式来改变靶基因。在一些实施方案中,所述靶基因的功能性破坏使得其相对于没有被功能性破坏时的靶基因的表达水平减少了至少5%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%,95%or 100%。类似地,对例如靶蛋白(例如,具有乙酰磷酸酶活性的蛋白质)的“功能性破坏”(“functionally disrupt”或“functional disruption”),这意味着以减少宿主细胞中的蛋白质活性这样的方式来改变靶蛋白。在一些实施方案中,所述靶蛋白的功能性破坏使得其相对于没有被功能性破坏时的靶蛋白的活性或表达水平减少了至少5%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%,95%或100%。在一些实施方案中,宿主细胞中被靶基因编码的靶蛋白的活性被消除。在其他实施方案中,宿主细胞中被靶基因编码的靶蛋白的活性减少。可通过删除所有的或部分的基因而实现靶基因的功能性破坏,使得基因表达被消除或减少,或使得消除或减少基因产物的活性。靶基因的功能性破坏也可通过突变基因的调节元件(例如,基因的启动子)来实现,使得表达消除或减少,或通过突变基因的编码序列,使基因产物的活性消除或减少。在一些实施方案中,靶基因的功能性破坏使得去除靶基因的完整开放阅读框。
本文所用的术语“亲本细胞”是指除了不包含工程化到经修饰的宿主细胞中的一个或多个特定的基因修饰外,与本文公开的经遗传修饰的宿主细胞具有相同的遗传背景的细胞,例如,所述一个或多个修饰选自由下述所构成的组:ADA的异源表达,利用NADH的HMG-CoA还原酶的异源表达,AACS的异源表达,磷酸转酮酶的异源表达,磷酸转乙酰酶的异源表达和甲羟戊酸途径的一种或多种酶的异源表达。
如本文所使用的术语“产量”一般是指由本文所提供的经遗传修饰的宿主细胞产生的类异戊二烯的量。在一些实施方案中,产量表示为宿主细胞的类异戊二烯产率。在其它实施方案中,产量表示为宿主细胞生产类异戊二烯的生产力。
如本文所使用的术语“生产力”是指宿主细胞的类异戊二烯产量,表示为随时间的推移(每小时)每份量的培养宿主细胞的发酵液(以体积计)所产生的类异戊二烯的量(以重量计)。
如本文所使用的术语“产量”是指宿主细胞的类异戊二烯产量,表示为宿主细胞消耗的每份量的碳源量产生的类异戊二烯的量,以重量计。
如本文所使用的短语“乙酰辅酶A衍生化合物”是指在其生物合成中使用乙酰辅酶A作为底物的化合物。典型的乙酰辅酶A衍生化合物包括,但不限于,类异戊二烯化合物,聚酮化合物,脂肪酸和醇类。在一些实施方案中,所述乙酰辅酶A衍生化合物是乙醇,例如,由戊糖底物生产的生物乙醇,如美国专利号7,253,001中所描述的,其整体内容通过引用并入本文。
如本文所使用的术语“变异体”是指通过氨基酸插入,缺失,突变和置换而与特定叙述的“参照”多肽(例如,野生型序列)不同的多肽,但是所述多肽保持与参照多肽实质相似的活性。在一些实施方案中,所述变异体通过DNA重组技术创建,诸如突变形成。在一些实施方案中,通过用一个碱性残基置换另一个(即,Arg置换Lys)、用一个疏水残基置换另一个(即,Leu置换Ile)、或用一个芳香残基置换另一个(即,Phe置换Tyr)等,而使得变异体多肽不同于其参考多肽。在一些实施方案中,所述变异体包括类似物,其中产生参考序列的实质的结构类似的保守性置换被获得。这种保守性置换的例子包括,不限制于,谷氨酸替换天冬氨酸,且反之亦然;谷氨酰胺替换天冬酰胺,且反之亦然;丝氨酸替换苏氨酸,且反之亦然;赖氨酸替换精氨酸,且反之亦然;或任一异亮氨酸、缬氨酸或亮氨酸彼此替换。
5.2宿主细胞
可用于本文提供的组合物和方法的宿主细胞包括古细菌,原核或真核细胞。
合适的原核宿主包括,但不限制于,多种革兰氏阳性菌,革兰氏阴性菌,或革兰氏不定菌中的任一种。其例子包括,但不限制于,属于如下属的细胞:农杆菌属,脂环酸芽孢杆菌,鱼腥藻属,组囊藻属,节细菌属,固氮菌属,芽孢杆菌属,短杆菌属,着色菌属,梭菌属,棒状杆菌属,肠杆菌属,欧文氏菌属,埃希氏杆菌属,乳杆菌属,乳球菌属,根瘤菌属,甲基杆菌属,细杆菌属,席藻属,假单胞菌属,红杆菌属,红假单胞菌属,红螺菌属,红球菌属,沙门氏菌属,栅藻属(Scenedesmun),沙雷氏菌属,志贺氏菌属,葡萄球菌属,链霉菌属(Streptomyces),聚球蓝细菌属(Synnecoccus)和单胞发酵菌属。原核菌株的实例包括,但不限制于:枯草芽孢杆菌,淀粉液化芽孢杆菌(Bacillus amyloliquefaciens),产氨短杆菌,嗜氨短杆菌(Brevibacterium immariophilum),拜氏梭菌(Clostridium beigerinckii),阪崎肠杆菌,大肠杆菌,乳酸乳球菌,中慢生型百脉根根瘤菌,绿脓杆菌,迈氏假单胞菌(Pseudomonas mevalonii),恶臭假单胞菌,荚膜红细菌,类球红细菌,深红红螺菌,肠道沙门氏菌,伤寒杆菌,鼠伤寒沙门氏菌,痢疾志贺氏菌,弗氏志贺菌,宋内志贺菌疾和金黄色葡萄球菌。在具体的实施方案中,所述宿主细胞是大肠杆菌细胞。
合适的古细菌宿主包括,但不限制于,属于如下属的细胞:气火菌属,古生球菌属(Archaeoglobus),盐杆菌属,产甲烷球菌属、甲烷细菌属,火球菌属,硫化叶菌属和热原体属。古细菌菌株的实例包括,但不限制于:闪烁古生球菌(Archaeoglobus fulgidus),极端嗜盐菌(Halobacterium sp),詹氏甲烷球菌,嗜热自养甲烷杆菌,嗜酸热原体,火山热原体,极端嗜热古菌(Pyrococcus horikoshii),激烈火球菌(Pyrococcus abyssi)和以嗜热泉生古细菌(Aeropyrum pernix)。
合适的真核宿主包括,但不限制于,真菌细胞,藻类细胞,昆虫细胞和植物细胞。在一些实施方案中,用于本方法的酵母包括已经在微生物保藏单位(例如IFO,ATCC等)进行保藏且属于以下属的酵母:芽孢酵母属,神食酵母属,节束酵母属,阿克斯酵母属(Arxiozyma),阿舒囊霉属,Babjevia,本森顿酵母属,葡状子囊菌属,Botryozyma,酒香酵母属,布勒掷孢酵母属,布勒担孢酵母属,念珠菌属,固囊酵母属,棒孢酵母属,隐球菌属,Cystofilobasidium,德巴利氏酵母属,德克酵母属,拟双足囊菌属(Dipodascopsis),双足囊菌属(Dipodascus),爱尼拉酵母属(Eeniella),拟内孢霉属(Endomycopsella),单囊霉属(Eremascus),假囊酵母属,担孢酵母属,Fellomyces,线黑粉菌属(Filobasidium),半乳糖霉菌,地霉属,四季酵母属,有孢汉逊酵母属,汉逊酵母属,Hasegawaea,胶珊瑚属,连锁酵母(Hormoascus),生丝毕赤酵母属,伊萨酵母属,克勒克酵母属,克勒克氏孢属,克鲁维酵母菌属,Kondoa,Kuraishia,克氏担孢酵母属,白冬孢酵母属,油脂酵母属,娄德酵母属,马拉色菌属,梅奇酵母属,木拉克酵母属,Myxozyma,拿逊酵母属,Nakazawaea,针孢酵母属,Ogataea,卵孢酵母属,管囊酵母属,厚壁孢酵母属,范菲亚酵母属,毕赤酵母属,红冬孢酵母属,红酵母属,酵母属,类酵母属,覆膜孢酵母属,齐藤酵母属(Saitoella),Sakaguchia,Saturnospora,裂芽酵母孢子菌属,裂殖酵母属,许旺酵母属,锁掷酵母属,掷孢酵母属,原孢酵母属,冠孢酵母属,梗孢酵母属,拟梗孢酵母(Sterigmatosporidium),Symbiotaphrina,合轴酵母属,Sympodiomycopsis,有孢圆酵母属,Trichosporiella,毛孢子菌属,三角酵母属,Tsuchiyaea,Udeniomyces,Waltomyces,威克酵母属,拟威克酵母属,拟威尔酵母属,Yamadazyma,耶氏酵母属,接合囊酵母属,接合酵母属,拟接合魏立氏酵母属(Zygowilliopsis)和配合酵母属(Zygozyma),等等。
在一些实施方案中,宿主微生物是酿酒酵母,毕赤酵母,粟酒裂殖酵母,布鲁塞尔德克酵母,乳酸克鲁维酵母(以前称为乳酸酵母),马克斯克鲁维酵母菌,Arxula adeninivorans,或多形汉逊酵母(现称为安格斯毕赤酵母)。在一些实施方案中,所述宿主微生物是念珠菌属的菌株,如解脂假丝酵母,吉利蒙念珠菌,克柔念珠菌,伪热带念珠菌,或产朊假丝酵母。
在具体的实施方案中,所述宿主微生物是酿酒酵母。在一些实施方案中,所述宿主是酿酒酵母菌株,其选自由下述所组成的组:面包酵母,CBS 7959,CBS 7960,CBS 7961,CBS 7962,CBS 7963,CBS 7964,IZ-1904,TA,BG-1,CR-1,SA-1,M-26,Y-904,PE-2,PE-5,VR-1,BR-1,BR-2,ME-2,VR-2,MA-3,MA-4,CAT-1,CB-1,NR-1,BT-1和AL-1。在一些实施方案中,所述宿主微生物是酿酒酵母菌株,其选自PE-2,CAT-1,VR-1,BG-1,CR-1和SA-1组成的组。在具体实施方案中,所述酿酒酵母菌株是PE-2。在另外的具体实施方案中,所述酿酒酵母菌株是CAT-1,在另外的具体实施方案中,所述酿酒酵母菌株是BG-1。
在一些实施方案中,所述宿主微生物是适合于工业发酵的微生物。在具体的实施方案中,使所述微生物适应在高溶剂浓度,高温,扩大的底物利用,营养限制,糖和盐造成的渗透压力,酸性,亚硫酸盐和细菌污染,或它们的组合等条件下生存,所述条件是公认的工业发酵环境的胁迫条件。
5.3磷酸转酮酶(PK)/磷酸转乙酰酶(PTA)途径至乙酰辅酶A
在一些实施方案中,在本文所提供的经遗传修饰的宿主细胞中,通过改造细胞以表达编码磷酸转酮酶和磷酸转乙酰酶(可选择)的多核苷酸和/或多肽,而使得磷酸转酮酶途径被激活。因此,在一些实施方案中,本文所提供的经遗传修饰的宿主细胞包含编码具有磷酸转酮酶活性的多肽的异源多核苷酸。在其它实施方案中,特别是其中乙酰磷酸可被提供为不依赖于磷酸转酮酶活性的代谢中间体时,本文提供的经遗传修饰的宿主细胞包含编码具有磷酸转乙酰酶活性的多肽的异源多核苷酸。在其它实施方案中,本文提供的经遗传修饰的宿主细胞包含编码具有磷酸转酮酶活性的多肽的异源多核苷酸和编码具有磷酸转乙酰酶活性的多肽的异源多核苷酸。
5.3.1磷酸转酮酶(PK)
磷酸转酮酶(EC 4.1.2.9)催化将木酮糖5-磷酸转换为甘油醛3-磷酸和乙酰磷酸;和/或将果糖-6-磷酸转换为赤藓糖4-磷酸和乙酰磷酸。在几株以木糖作为唯一碳源生长的酵母菌株中、而不是以葡萄糖作为碳源生长的酵母菌株中,鉴定了磷酸转酮酶的活性(Evans和Ratledge,Arch.Microbiol.139:48-52;1984)。磷酸转酮酶的抑制剂包括,但不限制于,赤藓糖4-磷酸和甘油醛3-磷酸。
编码磷酸转酮酶活性的多核苷酸,基因和多肽的许多例子是本领域已知的并且其可用于本文提供的经遗传修饰的宿主细胞。在一些实施方案中,这些多核苷酸,基因和/或多肽是戊糖乳杆菌MD363的木酮糖5-磷酸转酮酶(phosphoketolase)(XpkA)(Posthuma等,Appl.Environ.Microbiol.68:831-7;2002)。XpkA是乳酸菌中磷酸转酮酶途径(PKP)主要的酶,并表现出为4.455μmol/min/mg的特定的活性(Posthuma等,Appl.Environ.Microbiol.68:831-7;2002)。在其它实施方案中,这些多核苷酸,基因和/或多肽是肠系膜明串珠菌的磷酸转酮酶(Lee等,Biotechnol Lett.27(12);853-858(2005)),其表现出为9.9μmol/min/mg的特定的活性并且在pH值为高于4.5时是稳定的(Goldberg等,Methods Enzymol.9:515-520;1966)。所述磷酸转酮酶对D-木酮糖5-磷酸表现出4.7mM的Km,并且对果糖6-磷酸表现出29mM的Km(Goldberg等,Methods Enzymol.9:515-520;1966)。肠系膜明串珠菌的典型的磷酸转酮酶核苷酸序列包括登记号AY804190和本文所提供的SEQ ID NO:1。肠系膜明串珠菌的典型的磷酸转酮酶蛋白质序列包括登记号YP_819405,AAV66077.1和本文所提供的SEQ ID NO:2。在其它实施方案中,这些多核苷酸,基因和/或多肽是来自所描述的乳双歧杆菌的D-木酮糖-5-磷酸/D-果糖6-磷酸磷酸转酮酶基因xfp,例如,在Sonderegger等人的戊糖代谢的酿酒酵母菌株中(Appl.Environ.Microbiol.70:2892-7;2004)。
其它有用的磷酸转酮酶包括,但不限制于,来自齿双歧杆菌ATCC 27678(ABIX02000002.1:2350400..2352877;EDT46356.1);动物双歧杆菌(NC_017834.1:1127580..1130057;YP_006280131.1);和假长双歧杆菌(AY518216.1:988..3465;AAR98788.1);构巢曲霉FGSC A4(CBF76492.1);长双歧杆菌(AAR98787.1);两岐双岐杆菌NCIMB 41171(ZP 03646196.1);动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.Lactis)HN019(ZP 02962870.1);植物乳杆菌WCFS1(NP_786060.1);短乳杆菌格雷夫斯亚种(Lactobacillus brevis subsp.Gravesensis)ATCC 27305(ZP_03940142.1);罗伊氏乳杆菌100-23(ZP_03073172.1);和肠膜明串珠菌肠膜亚种(Leuconostoc mesenteroides subsp.Mesenteroides)ATCC 8293(YP_818922.1)。
其它有用的磷酸转酮酶包括在国际公开号WO 2011/15985中所描述的,其整体内容通过引用并入本文。这些磷酸转酮酶包括:(YP_001601863.1;固氮醋杆菌Pal 5),(YP_00109322l.1;光伏希瓦氏菌PV-4),(YP_926792.1;腐败希瓦氏菌SB2B),(YP_735093.1;希瓦氏菌(Shewanella sp).MR-4),(YP_001049439.1;希瓦氏菌(Shewanella baltica)OS155),(ZP_02157884.1;海底希瓦氏菌KT99),(YP_001472925.1;Shewanella sediminis HAW-EB3),(YP_001759669.1;武氏希瓦氏菌ATCC 51908),(YP_001673352.1;哈里法克斯希瓦氏菌(Shewanella halifaxensis)HA W-EB4),(YP_563733.1;反硝化希瓦氏菌OS217),(ZP_05111697.1;姜氏军团菌LLAP 12),(EEQ84307.1;阿耶罗皮炎菌(Ajellomyces dermatitidis)ER-3),(XP_002626734.1;阿耶罗皮炎菌(Ajellomyces dermatitidis)SLH14081),(XP_001539009.1;荚膜组织胞浆菌NAm1),(EEH04133.1;荚膜组织胞浆菌G186AR),(EEH20258.1;巴西副球孢子菌Pb03),(EEH44652.1;巴西副球孢子菌Pb 18),(XP_002582752.1;Uncinocarpus reesii 1704),(EER26377.1;非加利福尼亚粗球孢子菌(Coccidioides posadasii)C735 delta SOWgp),(EEQ28085.1;犬小孢子菌CBS 113480),(XP_001819785.1;米曲霉RIB40),(XP_001399780.1;黑曲霉),(XP_001263382.1;费希新萨托菌NRRL 181),(XP_001271080.1;棒曲霉NRRL 1),(XP_001213784.1;土曲霉NIH2624),(CBF76492.1;构巢曲霉FGSCA4),(XP_002561913.1;产黄青霉(Penicillium chrysogenum)威斯康星州54-1255),(XP_002480391.1;柄篮状菌ATCC 10500),(XP_002144014.1;Penicillium stipitatus ATCC 10500),(XP_002144014.1;病原体马尔尼菲青霉ATCC 18224),(XP_754543.1;烟曲霉菌Af293),(XP_001556635.1;灰葡萄孢霉B05.1 0),(XP_001592549.1;核盘菌1980),(XP_386729.1;玉米赤霉PH-1),(EEU47171.1;红球丛赤壳菌(Nectria haematococca mp)VI 77-13-4),(EEY16637.1;黑白轮枝菌VaMs.l 02),(XP_956649.1;粗糙脉孢菌OR74A),(XP_364271.2;稻瘟病菌70-15),(XP_001904585.1;鹅掌柄孢壳),(XP_001836159.1;灰盖鬼伞菌(Coprinopsis cinerea)okayama7#130),(NP_595963.1;粟酒裂殖酵母(Schizosaccharomyc es pombe)),(XP_002173441.1;日本裂殖酵母(Schizosaccharomyc es japonicus)yFS275),(XP_570860.1;新型隐球菌(Cryptococcus neoformans var.neoformans)JEC21),(XP_759561.1;玉蜀黍黑粉菌521),(ZP_05027078.1;微鞘藻PCC 7420),(YP_003101114.1;放线菌DSM 43827),(ZP_03568244.1;龈裂陌生物菌ATCC 49626),(YP_003180237.1;短小奇异菌DSM 20469),(ZP_03946928.1;阴道阿托波氏菌DSM 15829),(ZP_03296299.1;柯林斯氏菌(Collinsella stercoris)DSM 13279),(AAR98787.1;长双歧杆菌),(ZP_03618909.1;短双岐杆菌DSM 20213),(ZP_03646196.1;两岐双岐杆菌NCIMB 41171),(ZP_04448101.1;角双歧杆菌DSM 20098),(ZP_03324204.1;链状双歧杆菌DSM 16992),(AAR98790.1;双岐杆菌CFAR 172),(AAR98789.1;小鸡双歧杆菌),(ZP_03937610.1;阴道加德菌ATCC 14019),(ZP_05965201.1;没食子双歧杆菌DSM 20093),(ZP_02962870.1;动物双歧杆菌乳亚种(Bifidobacterium animalis subsp.Lactis)HNO19),(AAR98788.1;假长双歧杆菌球状亚种(Bifidobacterium pseudolongum subsp.Globosum)),(ZP_03946518.1;阴道阿托波氏菌DSM 15829),(YP_001511171.1;弗兰克氏菌EANlpec),(YP_713678.1;弗兰克氏菌ACN14a),(YP_002778395.1;混浊红球菌B4),(YP_701466.1;Rhodococcus jostii RHA1),(ZP_04383880.1;红串红球菌SK121),(YP 947598.1;金黄节杆菌TC 1),(CAD48946.1;费氏丙酸杆菌谢氏亚种(Propionibacterium freudenreichii subsp.Shermanii)),(NP_791495.1;丁香假单胞菌番茄致病变种(Pseudomonas syringae pv.Tomato str.)DC3000),(YP_003125992.1;松噬几丁质菌DSM 2588),(ABX56639.1;疣微菌门细菌(Verrucomicrobiae bacterium)V4),(YP_002371883.1;蓝杆藻PCC 8801),(YP_001806596.1;蓝杆藻ATCC 51142),(ZP_01730652.1;蓝杆藻CCY0110),(CAQ48286.1;浮游生物NIVA-CYA 98),(ZP_03276298.1;节旋藻CS-328),(ZP_03157277.1;蓝杆藻PCC 7822),(YP_002379031.1;蓝杆藻PCC 7424),(YP_001658501.1;铜绿微囊藻NIES-843),(ZP_01621774.1;鞘丝藻PCC 8106),(NP_485524.1;念珠藻PCC 7120),(ZP_05036350.1;聚球藻PCC 7335),(YP_001514813.1;深海单细胞蓝细菌MBIC 11 017),(ZP_05039537.1;聚球藻PCC 7335),(ZP_02886235.1;草根围伯克霍尔德氏菌(Burkho1deria graminis)C4 DIM),(ZP_03264503.1;洋葱伯克霍尔德氏菌H160),(ZP_01085819.1;聚球藻WH 5701),(ZP_05045603.1;双色藻PCC 7001),(ZP_01123645.1;聚球藻WH 7805),(YP_001223932.1;聚球藻WH 7803),(ZP_01079038.1;聚球藻RS9917),(YP_001889002.1;植物令伯克霍尔德氏菌(Burkho1deria phytofirmans)PsJN),(YP_553967.1;Burkholderia xenovorans LB400),(ZP_02881709.1;草根围伯克霍尔德氏菌C4DIM),(ZP_03270532.1;伯克霍尔德氏菌H160),(YP_001861620.1;类鼻疽伯克氏菌STM815),(YP_002755285.1;荚膜酸杆菌(Acidobacterium capsulatum)ATCC 51196),(EDZ38884.1;钩端螺旋菌属(Leptospirillum sp.)Group II′5-way CO′),(EES53204.1;固氮铁氧化钩端螺旋菌(Leptospirillum ferrodiazotrophum)),(YP_172723.1;细长聚球藻PCC 6301),(NP_681976.1;蓝细菌BP-1),(YP_114037.1;荚膜甲基球菌Bath菌株(Methylococcus capsulatus str.Bath)),(YP_002482577.1;蓝杆藻PCC 7425),(NP_442996.1;集胞藻PCC 6803),(YP_002482735.1;蓝杆藻PCC 7425),(ZP_04774866.1;酒色异着色菌DSM 180),(ZP_01453148.1;氧化亚铁深海铁杆菌PV-l),(ZP_04830548.1;铁锈色披毛菌ES-2),(XP_001273863.1;棒曲霉NRRL 1),(XP_001258643.1;费希新萨托菌NRRL 181),(XP_001727680.1;米曲霉RIB40),(XP_001396306.1;黑曲霉),(XP_001216075.1;土曲霉NIH2624),(XP_002567130.1;产黄青霉(Penicillium chrysogenum)Wisconsin 54-1255),(XP_002143851.1;马尔尼菲青霉ATCC 18224),(XP_002480216.1;柄篮状菌ATCC 10500),(XP_001559949.1;灰葡萄孢霉B05.10),(XP_001593100.1;核盘菌1980),(XP_001932192.1;小麦黄斑叶枯病菌Pt-lC-BFP),(XP_001793729.1;颖枯壳针孢SN 15),(XP_567776.1;Cryptococcus neoforrnans var.neoforrnans JEC21),(XP_386504.1;玉蜀黍赤霉菌(Oibberella zeae)PH-1),(EEU46265.1;红球丛赤壳菌(Nectria haematococca)mp VI 77-13-4),(AC024516.1;绿僵菌),(XP_959985.1;粗糙脉孢菌OR74A),(XP_001904686.1;鹅掌柄孢壳),(YP_002220141.1;嗜酸氧化亚铁硫杆菌ATCC 53993),(YP_001220128.1;隐藏嗜酸菌JF-5),(YP_001471202.1;莱廷格热袍菌(Thermotoga lettingae)TMO),(YP_002352287.1;嗜热网球菌(Dictyoglomus turgidum)DSM 6724),(YP_571790.1;汉氏硝化细菌X14),(ZP_01092401.1;海洋芽殖小梨形菌(Blastopirellula marina)DSM 3645),(YP_001340809.1;南极嗜冷菌.MWYLI),(NP_866384.1;波罗的海红小梨形菌(Rhodopirellula baltica)SH 1),(ZP_05108502.1;姜氏军团菌LLAP 12),(ZP_04995817.1;链霉菌属(Streptomyces sp.)Mg1),(ZP_04023055.1;罗伊氏乳杆菌SD2112),(ZP_03960060.1;阴道乳杆菌ATCC 49540),(ZP_03073172.1;罗伊氏乳杆菌100-23),(ZP_05553031.1;粘膜乳杆菌101-4-CHN),(ZP_05863347.1;发酵乳杆菌28-3-CHN),(ZP_04021289.1;嗜酸乳杆菌ATCC 4796),(ZP_03995194.1;卷曲乳杆菌lV-VOl),(ZP_04010922.1;Lactobacillus ultunensis DSM 16047),(ZP_05549961.1;卷曲乳杆菌125-2-CRN),(ZP_03951361.1;加氏乳杆菌lV-V03),(ZP_05744515.1;惰性乳杆菌DSM 13335),(YP_618635.1;德氏乳杆菌保加利亚亚种ATCC 11842),(ZP_03955917.1;詹氏乳杆菌lV-VI6),(ZP_03942415.1;布氏乳杆菌ATCC 11577),(ZP_01544800.1;酒酒球菌ATCC BAA-1163),(NP_786060.1;植物乳杆菌WCFSI),(Q937F6;XPKA_LACPE),(YP_394903.1;清酒乳杆菌清酒亚种23K),(YP_803891.1;戊糖片球菌ATCC 25745),(BAI40727.1;鼠李糖乳杆菌GG),(ZP_03940142.1;短乳杆菌格雷夫斯亚种(Lactobacillus brevis subsp.Gravesensis)ATCC 27305),(ZP_04009273.1;唾液乳杆菌ATCC 11741),(ZP_03958643.1;瘤胃乳酸杆菌ATCC 25644),(ZP_04431433.1;凝结芽孢杆菌36D1),(ZP_04601906.1;口金杆菌ATCC 51147),(ZP_05736927.1;毗邻颗粒链菌ATCC 49175),(YP_001449631.1;戈登链球菌(Streptococcus gordonii str.Challis substr.)CHI),(NP_736274.1;无乳链球菌NEM316),(ZP_04442854.1;格氏利斯特菌DSM 20601),(ZP_05646360.1;酪黄肠球菌EC30),(ZP_05650322.1;鹑鸡肠球菌EG2),(ZP_05675307.1;屎肠球菌Com12),(BAH69929.1;发酵支原体PG 18),(YP_002000006.1;炎支原体15 8L3-1),(YP_001256266.1;无乳支原体PG2),(YP_001988835.1;干酪乳杆菌BL23),(NP_786753.1;植物乳杆菌WCFS 1),(ZP_04009976.1;唾液乳杆菌ATCC 11741),(YP_818922.1;肠膜明串珠菌肠膜亚种ATCC 8293),(YP_794669.1;短乳杆菌ATCC 367),(ZP_04782553.l;类肠膜魏斯氏菌ATCC 33313),(YP_001727454.1;柠檬明串珠菌KM20),(YP_819405.1;肠膜明串珠菌肠膜亚种ATCC 8293),(ABX75772.l;乳酸乳球菌乳酸亚种),(YP_811314.1;酒酒球菌PSU-1),(ZP_02951191.1;丁酸梭菌5521),(ZP_05390294.1;食一氧化碳梭菌P7),(NP_347971.1;丙酮丁醇梭菌ATCC 824),(ZP_03800296.1;陪伴粪球菌ATCC 27758),(ZP_04857624.1;瘤胃菌5_1_39B FAA),(ZP_04743029.2;肠道罗斯拜瑞氏菌L 1-82),(ZP_02038271.1;多毛拟杆菌ATCC 29799),(XP_002180542.1;三角褐指藻CCAP 1055/1),(YP_568630.1;沼泽红假单胞菌BisB5),(YP_487462.1;沼泽红假单胞菌HaA2),(NP_947019.1;沼泽红假单胞菌CGA009),(YP_533660.1;沼泽红假单胞菌BisB18),(YP_973512.1;萘降角早极地单胞菌(Polaromonas naphthalenivorans)CJ2),(ZP_01464191.1;橙色标桩菌DW4/3-1),(YP_001267778.1;恶臭假单胞菌Fl),(YP_829644.1;节杆菌FB24),(YP_002486392.1;氯酚节杆菌A6),(ZP_05816651.1;科氏血杆菌DSM 10542),(YP_002883053.1;Beutenbergia cavemae DSM 12333),(YP_003161540.1;反硝化琼斯氏菌DSM 20603),(ZP_03911482.1;解纤维素木聚糖单胞菌DSM 15894),(CAJ57850.1;产黄纤维单胞菌),(YP_001134605.1;黄分枝杆菌PYR-GCK),(YP 953877.1;范巴伦分枝杆菌(Mycobacterium vanbaalenii)PYR-l),(YP_003155611.1;Brachybacterium faecium DSM 4810),(YP_003148127.1;坐皮肤球菌DSM 20547),(YP_001221168.1;番茄溃疡病菌NCPPB 382),(YP_001158426.1;热带盐水孢菌(Sa1inispora tropica)CNB-440),(YP_001536420.1;栖沙盐水孢菌(Sa1inispora arenico1a)CNS-205),(ZP_04608302.1;小单孢菌属(Micromonospora sp.)ATCC 39149),(YP_887914.1;耻垢分枝杆菌(Mycobacterium smegmatis str.)MC2 155),(YP_639956.1;分枝杆菌MCS),(ZP_04749157.1;堪萨斯分枝杆菌ATCC 12478),(YP_001851039.1;海鱼分枝杆菌M),(NP_960507.1;鸟分枝杆菌副结核亚种(Mycobacterium avium subsp.Paratuberculosis)K-10),(ZP_05224330.1;细胞内分枝杆菌ATCC 13950),(YP_001703240.1;脓肿分枝杆菌),(ZP_00995133.1;两面神菌HTCC2649),(YP_291026.1;嗜热裂孢菌YX),(ZP_04031845.1;弯曲高温单孢菌DSM 43183),(ZP_04475514.1;链孢囊菌DSM 43021),(ZP_04335641.1;达松维尔拟诺卡氏菌达松维尔亚种DSM 43111),(ZP_04482201.1;Stackebrandtia nassauensis DSM 44728),(YP_003099712.1;奇迹束丝放线菌DSM 43827),(NP_733508.1;天蓝色链霉菌A3(2)),(CAJ88379.1;生二素链霉菌ATCC 23877),(ZP_05536883.1;灰黄链霉菌Tu4000),(ZP_05020421.1;吸水链霉菌ATCC 29083),(CBG67625.1;阿氟曼链霉菌87.22),(NP_822448.1;链霉菌MA-4680),(ZP_04689547.1;加纳链霉菌ATCC 14672),(ZP_05530021.1;绿色产色链霉菌DSM 40736),(ZP_05512501.1;吸水链霉菌ATCC 53653),(ZP_05800927.1;灰黄链霉菌(Streptomyces flayogriseus)ATCC 33331),(YP_001828275.1;灰色链霉菌亚种(Streptomyces griseus subsp.Griseus)NBRC 13350),(ZP_04705493.1;白色链霉菌JI074),(ZP_04996963.1;链霉菌Mgl),(ZP_05485309.1;链霉菌SPB78),(ZP_03860882.1;黄色韩国生工菌(Kribbella flayida)DSM 17836),(YP_117539.1;皮诺卡氏菌IFM 10152),(YP_001505556.1;弗兰克氏菌EANlpec),(YP_482627.1;弗兰克氏菌CcI3),(YP_003116893.1;嗜酸细小链孢菌(Catenulispora acidiphila)DSM 44928),(YP_872280.1;Acidothermus lolyticus lIB),(YP_924807.1;类诺卡氏菌JS614),(YP_001104157.1;红色糖多孢菌NRRL 2338),(YP_002282673.1;根瘤菌三叶草生物型(Rhizobium leguminosarum by.Trifolii)WSM2304),(YP_002977256.1;Rhizobium leguminosarum by.trifolii WSM1325),(YP_001979796.1;根瘤菌CIAT 652),(YP_470926.1;根瘤菌CFN 42),(YP_002540633.1;放射形土壤杆菌K84),(ZP_05182366.1;布鲁氏杆菌83/13),(ZP_04683384.1;中间苍白杆菌LMG 3301),(YP_001373254.1;人苍白杆菌ATCC 49188),(YP_001204109.1;慢生花生根瘤菌ORS278),(YP_001238418.l;慢生花生根瘤菌BTAil),(NP_769158.1;慢生型大豆根瘤菌USDA 110),(YP_577164.1;汉氏硝化细菌X14),(YP_002961612.1;扭脱甲基杆菌AM 1),(YP_674792.1;中慢生根瘤菌BNCI),(ZP_05813617.1;Mesorhizobium opportunistum WSM2075),(YP_318559.1;维氏硝酸杆菌Nb-255),(YP_001755280.1;耐福射甲基杆菌JCM 2831),(YP_001753119.l;耐福射甲基杆菌JCM 2831),(YP_003066011.1;甲基扭曲杆菌DM4),(YP_002964777.1;甲基扭曲杆菌AM 1),(YP_002501292.1;结瘤甲基杆菌ORS 2060),(YP_002495265.1;结瘤甲基杆菌ORS 2060),(YP_001770387.1;甲基杆菌4-46),(YP_002944712.1;争论贪噬菌S110),(ZP_01156757.1;Oceanicola granulosus HTCC2516),(ZP_01628787.1;去除节球藻(Nodu1aria spumlgena)CCY9414),(YP_001865546.1;念珠藻PCC 73102),(YP_321015.1;鱼腥藻ATCC 29413),(ZP_03769140.1;Nostoc azollae′0708),(NP_923943.1;无类囊体蓝藻PCC 7421),(YP_477385.1;聚球藻JA-2-3B′a(2-13)),(YP_001328659.1;苜蓿中华根瘤菌WSM419),(YP_765670.1;豌豆根瘤菌(Rhizobium leguminosarum bv.Viciae)3841),(NP_384212.2;苜蓿中华根瘤菌1021),(ZP_02928455.1;多刺疣微菌(Verrucomicrobium spinosum)DSM 4136),(YP_001637539.1;扭脱甲基杆菌Pal),(ZP_01045825.1;硝酸菌Nb-311A),(ZP_02736602.1;隐球出芽菌(Gemmata obscuriglobus)UQM 2246),(YP_003157871.1;杆状脱硫微菌DSM 4028),(ZP_03631304.1;bacterium Ellin514),(ZP_04577558.1;产甲酸草酸杆菌HOxBLS),(ZP_04579712.1;产甲酸草酸杆菌OXCC13),(YP_826169.1;Solibacter usitatus Ellin6076),(YP_002018753.1;Pelodictyon phaeoclathratiforme BU-1),(YP_002016285.1;江口突柄绿菌DSM 271),(YP_001943369.1;泥生绿菌DSM 245),(NP_662409.1;绿硫细菌TLS),(ZP_01386179.1;Chlorobium ferrooxidans DSM 13031),(YP_375422.1;绿硫杆菌(Chlorobium luteolum)DSM 273),(YP_285277.1;芳香脱氯单胞菌(Dechloromonas aromatic)RCB),(YP_314589.1;脱氮硫杆菌ATCC 25259),(YP_545002.1;鞭毛甲基杆菌KT(Methy1obacillus flagellatus KT)),(NP_842139.1;亚硝酸单胞菌ATCC 19718),(YP_748274.1;亚硝化单胞菌C91),(YP_411688.1;多形亚硝化螺旋菌ATCC 25196),(YP_344700.1;海洋亚硝化球菌(Nitrosococcus ocean)i ATCC 19707),(YP_007004.1;变形虫原厚垣假丝酵母(Candidatus Protochlamydia amoebophi1a)UWE25),(NP_435833.1;苜蓿中华根瘤菌1021),(ZP_04421874.1;硫螺菌DSM 6946),(NP_107054.1;中慢生型百脉根根瘤菌MAFF303099),(YP_002289797.1;食羧假单胞菌OM5),(YP_001833312.l;印度拜耶林克氏菌印度亚种ATCC 9039)。
磷酸转酮酶也在本文所提供的组合物和方法中有效,其包括被称为是本文所描述的任意磷酸转酮酶的“衍生物”的那些分子。这样的“衍生物”具有以下特点:(1)它与本文所描述的任意磷酸转酮酶享有实质同源性;和(2)能够催化将X5P转化为甘油醛3-磷酸(G3P)和乙酰磷酸;或将F6P转换为赤藓糖4-磷酸(E4P)和乙酰磷酸。如果磷酸转酮酶的衍生物的氨基酸序列与磷酸转酮酶的氨基酸序列至少80%,更优选至少90%,最优选至少95%相同,则可以说磷酸转酮酶的衍生物与磷酸转酮酶享有“实质同源性”。
5.3.2磷酸转乙酰酶(PTA)
在一些实施方案中,本文所提供的经遗传修饰的宿主细胞包含编码磷酸转乙酰酶的异源核苷酸序列。所述磷酸转乙酰酶(EC2.3.1.8)将乙酰磷酸转换为乙酰辅酶A。
编码磷酸转乙酰酶活性的多核苷酸,基因和多肽的许多例子是本领域已知的并且其可用于本文提供的经遗传修饰的宿主细胞。在一些实施方案中,这样的多核苷酸,基因和/或多肽是来自克氏梭菌的磷酸转乙酰酶。克氏梭菌的典型磷酸转乙酰酶核苷酸序列包括登记号NC_009706.1:1428554..1429555和本文所提供的SEQ ID NO:3。克氏梭菌的典型磷酸转乙酰酶蛋白质序列包括登记号YP_001394780和本文所提供的SEQ ID NO:4。其它有用的磷酸转乙酰酶包括,但不限制于,来自于罗伊氏乳杆菌(Lactobacillus reuteri)(NC_010609.1:460303..461277;YP_001841389.10);枯草芽孢杆菌(Bacillus subtilis)(NC_014479.1:3671865..3672836;YP_003868063.1);Methanosarcina thermophile(L23147.1:207..1208;AAA72041.1);旧金山乳杆菌(Lactobacillus sanfranciscensis)(BAB19267.1);植物乳杆菌(Lactobacillus plantarum)WCFS1(NP_784550.1);发酵乳杆菌(Lactobacillus fermentum)ATCC 14931(ZP 03944466.1);枯草芽孢杆菌枯草亚种(Bacillus subtilis subsp.subtilis str.)168(NP_391646.1);嗜热甲烷八叠球菌(Methanosarcina thermophila)(AAA72041.1);电转化热纤梭菌(Clostridium thermocellum)DSM 4150(ZP 03152606.1);丙酮丁醇梭菌(Clostridium acetobutylicum)ATCC 824(NP_348368.1);科氏梭菌(Clostridium kluyveri)DSM 555(YP 001394780.1);小韦荣氏球菌(Veillonella parvula)DSM 2008(ZP 03855267.1);和甲型副伤寒肠道沙门氏菌肠道亚种(Salmonella enterica subsp.enterica serovar Paratyphi A)str.ATCC 9150(YP_149725.1).
其它有用的磷酸转乙酰酶包括那些在国际公开号WO 2011/15985中所描述的,其整体内容通过引用并入本文。这些磷酸转乙酰酶包括:(ZP_05427766.1;隐藏真杆菌ATCC 49989),(ZP_03627696.1;bacterium Ellin514),),(ZP_03131770.1;Chthonio bacter flavus Ellin428),(YP_001878031.1;某种肠道细菌TCCBAA-835),(ZP_04562924.1;柠檬酸杆菌30_2),(YP_001451936.1;柯氏柠檬酸杆菌ATCC BAA-895),(YP_149725.1;沙门氏菌沙门甲型副伤寒亚种菌ATCC 9150),(YP_001569496.1;肠道沙门氏菌亚种Salmonella enterica subsp.anzonae serovar 62:z4,z23:--),(NP_416953.1;大肠杆菌Escherichia coli str.K-12substr.MG1655),(YP_002920654.1;克雷伯氏肺炎菌NTUH-K2044),(ZP_04637797.1;中间型耶尔森氏菌ATCC 29909),(ZP_01222604.1;深海发光杆菌3TCK),(ZP_02156855.1;海底希瓦氏菌KT99),(YP_958508.1;水油海杆菌VT8),(YP_066771.1;Desulfotalea psychrophila LSv54),(YP_002780531.1;混浊红球菌B4),(YP_703506.1;Rhodococcus jostii RHA1),(ZP_05479963.1;链霉菌AA4),(YP_002761398.1;Gemmatimonas aurantiaca T-27),(ZP_04670189.1;梭菌1_7_47FAA),(ZP_05493958.1;溶纸莎草梭状芽胞杆菌DSM 2782),(YP_003143506.1;Slackia heliotrinireducens DSM 20476),(ZP_05090822.1;鲁杰氏菌R11),(ZP_01748021.1;星箭头菌E-37),(NP_604069.1;具核梭杆菌具核亚种ATCC 25586),(ZP_05814734.1;Fusobacterium sp.3_1_33),(ZP_06026613.1;牙周梭杆菌ATCC 33693),(ZP_05617632.1;Fusobacterium sp.3_1_5R),(ZP_05628030.1;Fusobacterium sp.D12),(ZP_04860946.1;FusobacteriumvanumATCC 27725),(ZP_04567444.1;死亡梭杆菌ATCC 9817),(YP_001489437.1;布氏弓形菌RM4018),(YP_003163236.1;口腔纤毛菌C-1013-b),(ZP_05902420.1;Leptotrichia hofstadiiF0254),(ZP_06011308.1;Leptotrichia goodfellowii F0264),(ZP_04479548.1;念珠状链杆菌DSM 12112),(ZP_03855267.1;小韦荣氏球菌DSM 2008),(ZP_03928523.1;发酵氨基酸球菌D21),(NP_970659.1;齿垢密螺旋体ATCC 35405),(ZP_05621510.1;文氏密螺旋体ATCC 35580),(NP_218534.1;梅毒螺旋体苍白亚种(Treponema pallidum subsp.pallidum str.)Nichols),(ZP_04047318.1;Brachyspira murdochii DSM 12563),(YP_002720478.1;猪痢疾短螺旋体WAl),(YP_001740706.1;Candidatus Cloacamonas acidaminovorans),(EER05013.1;Perkinsus mannus ATCC 50983),(YP_945582.1;墨西哥包柔氏螺旋体91E135),(YP_001884013.1;伯氏赫氏疏螺旋体DAH),(YP_002222233.1;并以达氏螺旋体),(ZP_03675306.1;重组伯氏疏螺旋体A14S),(ZP_03435394.1;阿弗西尼疏螺旋体ACA-l),(ZP_03540018.1;伽氏疏螺旋体Far04),(ZP_03672928.1;法雷斯疏螺旋体VS116),(NP_212723.1;博氏疏螺旋体B31),(YP_001956287.1;uncultured Termite group 1 bacterium phylotype Rs-D17),(NP_975268.1;Mycoplasma mycoides subsp.mycoides SC str.PGl),(YP_424216.1;Mycoplasmacapricolum subsp.capricolum ATCC 27343),(YP_053283.1;花中间原体Ll),(CAK99540.1;柑桔螺原体),(NP_072966.1;生殖道支原体G37),(NP_110116.1;肺炎支原体M129),(NP_853403.1;鸡毒支原体R),(NP_757889.1;穿通支原体HF-2),(YP_116016.1;Mycoplasma hyopneumoniea 232),(YP_002960607.1;结膜支原体),(YP_001256282.1;无乳支原体PG2),(BAH69503.1;发酵支原体PG18),(YP_278771.1;鸡滑液囊支原体53),(NP_326068.1;肺支原体UAB CTIP),(YP_015865.1;运动支原体163K),(YP_001256630.1;无乳支原体PG2),(YP_802685.1;Buchnera aphidicola str.Cc(Cinara cedri)),(YP_001885432.1;B型肉毒杆菌埃克隆德菌株17B),(YP_001308302.1;拜氏梭菌NClMB 8052),(ZP_05131280.1;梭狀芽孢桿菌7_2_43FAA),(ZP_02948604.1;酪酸梭状芽孢杆菌5521),(NP_562641.1;产气荚膜梭菌str.13),(ZP_05391232.1;定植菌P7),(YP_001394780.1;科氏梭菌DSM 555),(ZP_02995419.1;产芽胞梭状芽胞杆菌ATCC 15579),(NP_781870.1;破伤风梭菌E88),(ZP_04862192.1;D型肉毒梭菌str.1873),(YP_878298.1;诺维氏梭状芽胞杆菌NT),(ZP_04804960.1;嗜纤维杆菌743B),(NP_348368.1;丙酮丁醇梭菌ATCC 824),(ACA51668.1;嗜热厌氧解糖杆菌Thermoanaero bacterium saccharolyticum),(ZP_05336886.1;戊糖发酵产氢菌Thermoanaero bacterium thermosaccharolyticum SM 571),(NP_623097.1;Thermoanaero bacter tengcongensis MB4),(YP_001663354.1;Thermoanaero bacter sp.X514),(YP_002508771.1;奥氏嗜热盐丝菌H 168),(YP_003190679.1;乙酸氧化脱硫肠状菌DSM 771),(YP_001917776.1;Natranaerobius thermophiles JWINM-WN-LF),(YP_360288.1;生氢氧化碳嗜热菌Z-2901),(EY83551.1;拟杆菌2_1_33B),(ZP_02033408.1;Parabacteroides merdae ATCC 43184),(NP_905297.1;牙龈卟啉单胞菌W83),(ZP_04056000.1;Porphyromonas uenonis 60-3),(ZP_04389884.1;牙髓卟啉单胞菌ATCC 35406),(ZP_02068815.1;单形类杆菌ATCC 8492),(ZP_03460749.1;埃氏拟杆菌DSM 20697),(ZP_03676944.1;解纤维素拟杆菌DSM 14838),(YP_097761.1;厌氧性肠内细菌YCH46),(ZP_04545825.1;Bacteroides sp.D1),(ZP_03643544.1;Bacteroides coprophilus DSM 18228),(ZP_03207078.1;Bacteroides plebeius DSM 17135),(YP_001297855.1;普通拟杆菌ATCC 8482),(ZP_05736702.1;坦纳氏普雷沃氏菌ATCC 51259),(ZP_06007587.1;卑尔根普雷沃菌DSM 17361),(ZP_05858935.1;真口普氏菌F0319),(ZP_05916997.1;Prevotella sp.oral taxon 472 str.F0295),(YP_002308782.1;Candidatus Azo bacteroides pseudotrichon ymphae genomovar.CFP2),(YP_753459.1;Syntrophomonas wolfei subsp.wolfei str.Goettingen),(ZP_01771389.1;产气柯林斯菌ATCC 25986),(ZP_03296849.1;粪便柯林斯氏菌DSM 13279),(ZP_04445308.1;Collinsella ntestinalis DSM 13280),(ZP_03567515.1;牙缝奇异菌ATCC 49626),(YP_003179667.1;极小阿托波氏菌DSM 20469),(ZP_03946133.1;阴道阿托波菌DSM 15829),(ZP_03990654.1;Oribacterium sinus F0268),(ZP_04450849.1;软弱贫养菌ATCC 49176),(ZP_05797601.1;Oribacterium sp.oral taxon 078 str.F0262),(ZP_03730247.1;Clostridium sp.M62/1),(ZP_04856252.1;瘤胃菌5_1_39BFAA),(ZP_01966332.1;卵形瘤胃球菌ATCC 29174),(ZP_05345616.1;Bryantella formatexigens DSM 14469),(ZP_03780829.1;Blautia hydrogenotro phica DSM 10507),(ZP_03289360.1;系结梭菌DSM 1787),(ZP_02042092.1;活泼瘤胃球菌ATCC 29149),(ZP_03168112.1;酸奶瘤胃球菌ATCC 29176),(ZP_01968837.1;瘤胃球菌属扭矩ATCC 27756),(ZP_02430426.1;闪烁梭菌ATCC 35704),(ZP_03779744.1;Clostridium hylemonae DSM 15053),(ZP_02234595.1;Dorea formicigenerans ATCC 27755),(ZP_01994673.1;Dorea longicatena DSM 13814),(YP_001558442.1;丙酮丁醇梭菌ISDg),(ZP_04667085.1;梭菌杆菌1_7_47FAA),(ZP_02085391.1;鲍氏梭菌ATCC BAA-613),(ZP_05790853.1;穗状丁酸弧菌DSM 2876),(ZP_02026034.1;凸腹真杆菌ATCC 27560),(YP_002930513.1;挑剔真杆菌ATCC 27750),(ZP_04808213.1;肠胃炎螺杆菌MIT 98-5489),(ZP_03656120.1;加拿大螺杆菌MIT 98-5491),(ZP_04583217.1;温哈门螺杆菌ATCCBAA-430),(NP_860840.1;肝螺杆菌ATCC 51449),(ZP_03657896.1;同性恋螺杆菌CCUG 18818),(ZP_02417779.1;Anaerostipes caccae DSM 14662),(ZP_02437622.1;Clostridium sp.SS211),(ZP_02205430.1;一致粪球菌ATCC 27759),(ZP_02692616.1;Epulopiscium sp.′N.t.morphotype B′),(YP_003182082.1;迟缓埃格特菌DSM 2243),(YP_003151027.1;变短隐藏杆菌DSM 15641),(YP_003143601.1;Slackia heliotrinireducens DSM 20476),(ZP_05498135.1;溶纸莎草梭菌DSM 2782),(ZP_03152606.1;热纤梭菌JW20),(YP_001180817.1;Caldicellulosiruptor saccharolyticus DSM 8903),(AAA72041.1;喜温甲烷八叠球菌),(NP_618482.1;乙酸甲烷八叠球菌C2A),(YP_305342.1;巴氏甲烷八叠球菌),(ZP_02142278.1;Roseobacter litoralis Och 149),(YP_681184.1;Roseobacter denitrificans OCh 114),(YP_001533168.1;玫瑰杆菌DFL 12),(ZP_05124935.1;Rhodobacteraceae bacterium KLH11),(ZP_05786337.1;Silicibacter lacuscaerulensis ITI-1157),(YP_001313586.1;苜蓿中华根瘤菌WSM419),(NP_437512.1;苜蓿中华根瘤菌1021),(ZP_04682129.1;中间苍白杆菌LMG 3301),(YP_001372036.1;人苍白杆菌ATCC 49188),(YP_001888115.1;Burkholderia phytofirmans PsJN),(YP_554613.1;Burkholderia xenovorans LB400),(YP_001862297.1;类鼻疽伯克氏菌STM815),(YP_297974.1;真养罗氏菌JMP134),(YP_002008219.1;台湾嗜铜菌),(YP_001584488.1;多噬伯克霍尔德氏菌),(YP_002233797.1;洋葱伯克氏细菌J2315),(ZP_01220235.1;Photobacterium profundum 3TCK),(ZP_03698361.1;Lutiella nitroferrum2002),(ZP_01811515.1;弧菌细菌SWAT-3),(ZP_00988349.1;灿烂弧菌12B01),(ZP_01866234.1;施罗氏弧菌AK1),(ZP_05885163.1;溶珊瑚弧菌ATCCBAA-450),(AAS78789.1;脱氮副球菌),(YP_345196.1;类球红细菌2.4.1),(AAN08490.1;Castellaniella defragrans),(ZP_00961345.1;抑云玫瑰变色菌ISM),(YP_168755.1;Ruegeria pomeroyi DSS-3),(ZP_01901193.1;Roseobacter sp.AzwK-3b),(ZP_01752570.1;Roseobacter sp.SK209-2-6),(ZP_02140073.1;Roseobacter litoralis Och 149),(YP_510789.1;简纳西氏菌CCS1),(ZP_05073153.1;Rhodobacteral es bacterium HTCC2083),(YP_822367.1;Candidatus Solibacter usitatus Ellin6076),(ZP_01313101.1;氧化乙酸脱硫单胞菌DSM 684),(YP_357950.1;Pelobacter carbinolicus DSM 2380),(YP_002537084.1;Geobacter sp.FRC-32),(YP_001232124.1;Geobacter uraniireducens Rf4),(NP_953751.1;硫还原地杆菌PCA),(YP_384000.1;硫还原泥土杆菌GS-15),(YP_900968.1;产丙酸居泥杆菌DSM 2379),(YP_001951452.1;Geobacter lovleyi SZ),(ZP_05311922.1;Geobacter sp.M18),(YP_003021758.1;Geobacter sp.M21),(YP_358255.1;Pelobacter carbinolicus DSM 2380),(ZP_03906856.1;Denitrovibrio acetiphilus DSM 12809),(YP_001997093.1;海洋绿滑菌ATCC 35110),(ZP_01924858.1;Victivallis vadensis ATCCBAA-548),(ZP_03439825.1;幽门螺杆菌98-10),(YP_003057614.1;幽门螺杆菌B38),(YP_001910417.1;幽门螺杆菌Shi470),(NP_223559.1;幽门螺杆菌J99),(YP_665033.1;Helicobacter acinonychis str.Sheeba),(ZP_01810337.1;空肠弯曲菌空肠亚种CG8486),(ZP_00366840.1;结肠弯曲菌RM2228),(ZP_00370527.1;乌普萨拉弯曲杆菌RM3195),(YP_002575219.1;红嘴鸥弯曲杆菌RM2100),(YP_001406718.1;曲狀桿菌ATCCBAA-381),(ZP_05624820.1;纤细弯曲菌RM3268),(YP_891988.1;胎儿弯曲杆菌胚胎亚种82-40),(YP_001466901.1;简明弯曲菌13826),(YP_001408221.1;曲形弯曲菌525.92),(ZP_05363348.1;昭和弯曲菌RM3277),(ZP_03742933.1;假小链双歧杆菌DSM 20438),(ZP_02918887.1;齿双岐杆菌ATCC 27678),(ZP_02028883.1;青春双岐杆菌L2-32),(ZP_04448100.1;角双歧杆菌DSM 20098),(ZP_03618886.1;短双岐杆菌DSM 20213),(ZP_03976084.1;长双歧杆菌婴儿亚种ATCC 55813),(YP_002323183.1;长双歧杆菌婴儿亚种ATCC 15697),(ZP_03646187.1;两岐双岐杆菌NClMB 41171),(ZP_03937611.1;阴道加德菌ATCC 14019),(ZP_02962869.1;Bifidobacterium animalis subsp.lactis HN019),(ZP_05965185.1;没食子双歧杆菌DSM 20093),(ZP_02043408.1;Actinomyces odontolyticus ATCC 17982),(ZP_03925176.1;Actinomyces coleocanis DSM 15436),(NP_601948.1;谷氨酸棒状杆菌ATCC 13032),(NP_739201.1;Corynebacteriurn efficiens YS-314),(NP_940379.1;白喉棒状杆菌NCTC 13129),(ZP_04835255.1;谷氨酸棒状杆菌Corynebacteriurn glucuronolyticumATCC 51867),(ZP_05708623.1;Corynebacteriurn genitalium ATCC 33030),(ZP_03977910.1;Corynebacterium lipophiloflavum DSM 44291),(ZP_03932064.1;拥挤棒杆菌ATCC 49725),(ZP_05366890.1;结核硬脂酸杆菌SK141),(YP_002835817.1;Corynebacterium aunmucosum ATCC 700975),(YP_250020.1;Corynebacterium jeikeium K411),(YP_001801132.1;解脲棒状杆菌DSM 7109),(YP_002906954.1;Corynebacterium kroppenstedtii DSM 44385),(ZP_03393297.1;无枝菌酸棒杆菌SK46),(ZP_03718987.1;浅黄奈瑟球菌NRL30031/H 210),(ZP_05318956.1;干燥奈瑟球菌ATCC 29256),(YP_001598731.1;脑膜炎奈瑟菌053442),(ZP_04602977.1;口金杆菌ATCC 51147),(YP_426466.1;深红红螺菌ATCC 11170),(NP_871183.1;Wigglesworthia glossinidia endosymbiont of Glossina brevipalpis),(NP_777793.1;Buchnera aphidicola str.Bp(Baizongia pistaciae)),(YP_003249406.1;Fibrobacter succmogenes subsp.succmogenes S85),(ZP_03535302.1;结核杆菌T17),(ZP_04056438.1;牙龈二氧化碳嗜纤维菌ATCC 33624),(YP_003108500.1;Candidatus Sulcia muelleri SMDSEM),(P77844;谷氨酸棒状杆菌),(ZP_03994160.1;羞怯动弯杆菌ATCC 35243),(ZP_03922640.1;克氏动弯杆菌ATCC 43063),(ZP_03716209.1;霍氏真杆菌DSM 3353),(ZP_03718143.1;霍氏真杆菌DSM 3353),(ZP_05614434.1;Faecalibacteri um prausnitzii A2-165),(ZP_02034852.1;多毛拟杆菌ATCC 29799),(ZP_03753543.1;食葡糖罗斯拜瑞氏菌DSM 16841),(ZP_04745275.2;肠道罗斯拜瑞氏菌Ll-82),(YP_002937332.1;直肠真杆菌ATCC 33656),(ZP_02074244.1;Clostridium sp.L2-50),(ZP_04455374.1;Shuttleworthia satelles DSM 14600),(ZP_03488480.1;两形真杆菌DSM 3989),(ZP_02078327.1;细长真杆菌DSM 3991),(ZP_02077559.1;细长真杆菌DSM 3991),(ZP_03305532.1;Anaerococcus hydrogenalis DSM 7454),(ZP_05473291.1;Anaerococcus vaginalis ATCC 51170),(ZP_03931050.1;四联厌氧球菌ATCC 35098),(YP_003153463.1;普氏厌氧球菌DSM 20548),(ZP_03916048.1;气球菌ATCC 51172),(NP_607213.1;化脓性链球菌MGAS8232),(AAK34003.1;化脓性链球菌M1GAS),(YP_002562185.1;乳房链球菌01401),(YP_002744451.1;马链球菌兽疫亚种),(BAH88016.1;变异链球菌NN2025),(ZP_02920305.1;链球菌婴儿亚种ATCCBAA-102),(YP_329798.1;无乳链球菌A909),(ZP_04061789.1;唾液链球菌SK126),(YP_139881.1;嗜热链球菌LMG 18311),(ZP_04525024.1;肺炎链球菌CCRI 1974),(ZP_06060573.1;Streptococcus sp.2_1_36FAA),(YP_001198423.1;猪链球菌05ZYH33),(NP_964739.1;约氏乳杆菌NCC 533),(YP_193610.1;嗜酸乳酸杆菌NCFM),(ZP_04011019.1;Lactobacillus ultunensis DSM 16047),(ZP_03995297.1;卷曲乳杆菌JV-VOl),(ZP_05752753.1;瑞士乳杆菌DSM 20075),(ZP_03956024.1;詹氏乳杆菌JV-V16),(ZP_04645187.1;詹氏乳杆菌269-3),(YP_618719.1;德氏乳杆菌保加利亚亚种ATCC 11842),(ZP_05744366.1;惰性乳杆菌DSM 13335),(NP_391646.1;Bacillus subtilis subsp.subtilis str.168),(YP_001423045.1;解淀粉芽孢杆菌FZB42),(YP_081073.1;地衣芽孢杆菌ATCC 14580),(ZP_03055101.1;短小芽胞杆菌ATCC 7061),(YP_002317098.1;好热黄无氧芽孢菌WKI),(YP_002951270.1;Geobacillus sp.WCH70),(YP_001127443.1;芽孢杆菌NG80-2),(YP_149268.1;嗜热地芽孢杆菌HTA426),(ZP_01861251.1;Bacillus sp.SG-l),(ZP_03228176.1;Bacillus coahuilensis m4-4),(ZP_01173945.1;Bacillus sp.NRRLB-14911),(NP_693944.1;伊平屋海岭海洋芽孢杆菌HTE831),(ZP_04314753.1;蜡样芽胞杆菌BGSC 6E1),(YP_014727.1;Listeria monocytogen es str.4b F2365),(ZP_04443757.1;格氏李斯特氏菌DSM 20601),(NP_244690.1;嗜碱芽孢杆菌C-125),(YP_177402.1;克劳氏芽孢杆菌KSM-K16),(YP_002885816.1;Exiguo bacteriumsp.AT1b),(YP_001812721.1;Exiguo bacterium sibiricum255-15),(ZP_02169346.1;Bacillus selenitireducens MLS10),(ZP_04818386.1;表皮葡萄球菌M23864:W1),(ZP_03612973.1;头状葡萄球菌SK14),(ZP_04677798.1;沃氏葡萄球菌L37603),(NP_763914.1;表皮葡萄球菌ATCC 12228),(ZP_05685678.1;金黄葡萄球菌A9635),(YP_254319.1;溶血葡萄球菌JCSC1435),(ZP_04059818.1;人葡萄球菌SKl19),(ABR57177.1;木糖葡萄球菌),(YP_302214.1;Staphylococcus saprophyticus subsp.saprophyticus ATCC 15305),(YP_002633340.1;肉葡萄球菌肉亚种TM300),(YP_002561236.1;溶酪大球菌JCSC5402),(ZP_03944466.1;发酵乳杆菌ATCC 14931),(ZP_05553502.1;Lactobacillus coleohominis 101-4-CHN),(ZP_03959629.1;阴道乳杆菌ATCC 49540),(YP_001271004.1;罗伊氏乳杆菌DSM 20016),(ZP_05745668.1;Lactobacillus antri DSM 16041),(YP_818931.1;肠膜明串珠菌肠膜亚种ATCC 8293),(YP_001727831.1;柠檬明串珠菌KM20),(ZP_04782044.1;类肠膜魏斯氏菌ATCC 33313),(ZP_01544468.1;Oenococcus oeniATCC BAA-1163),(ZP_05737294.1;毗邻颗粒链菌ATCC 49175),(ZP_05851915.1;苛养颗粒链菌ATCC 700633),(ZP_02183965.1;Camobacterium sp.AT7),(ZP_05649755.1;鹑鸡肠球菌EG2),(ZP_03947918.1;粪肠球菌TX0104),(ZP_03982224.1;屎肠球菌TX1330),(YP_395954.1;清酒乳杆菌清酒亚种23K),(ZP_04449762.1;疾卡氏菌ATCC 51271),(YP_001032100.1;乳酸乳球菌乳脂亚种MG1363),(YP_806234.1;干酪乳杆菌ATCC 334),(NP_784550.1;植物乳杆菌WCFS1),(YP_794848.1;短乳杆菌ATCC 367),(ZP_03954831.1;希氏乳杆菌ATCC 8290),(BABI9267.1;旧金山乳杆菌),(ZP_03958288.1;瘤胃乳酸杆菌ATCC 25644),(YP_536042.1;唾液乳杆菌UCC118),(ZP_05747635.1;猪红斑丹毒丝菌ATCC 19414),(YP_803875.1;戊糖片球菌ATCC 25745),(ZP_02093784.1;Parvimonas micraATCC 33270),(YP_001692923.1;大芬戈尔德菌ATCC 29328),(ZP_04431499.1;凝结芽孢杆菌36Dl),(ZP_04775813.1;溶血孪生球菌ATCC 10379),(YP_001360609.1;Kineococcus radiotolerans SRS30216),(ZP_01115869.1;Reinekea blandensis MED297),(YP_003074238.1;Teredinibac turnterrae T7901),(YP_958411.1;Marinobacter quaeolei VT8),(YP_435580.1;哈赫拉菌KCTC 2396),(YP_001189125.1;门多萨假单胞菌),(YP_792443.1;铜绿色假单胞菌UCBPP-PA14),(NP_791001.1;丁香假单胞菌DC3000),(YP_258069.1;荧光假单胞菌Pf-5),(YP_606637.1;假单胞菌L48),(YP_002800579.1;棕色固氮菌DJ),(YP_001171663.1;施氏假单胞菌A1501),(NP_840385.1;亚硝酸单胞菌ATCC 19718),(YP_002801221.1;棕色固氮菌DJ),(YP_002787111.1;沙漠奇异球菌VCDl15),(YP_603523.1;Deinococcus geothermalis DSM 11300),(NP_293799.1;耐辐射奇球菌R1),(YP_521550.1;Rhodoferax ferrireducens T118),(YP_530962.1;沼泽红假单胞菌BisB18),(YP_531882.1;沼泽红假单胞菌BisA53),(ZP_02367347.1;Burkholderia oklahomensis C6786),(YP_428079.1;深红红螺菌ATCC 11170),(YP_530535.1;沼泽红假单胞菌BisB18),(NP_901200.1;青紫色素杆菌ATCC 12472),(ZP_03698345.1;Lutiella nitroferrum 2002),(YP_001279250.1;Psychrobacter sp.PRwf-1),(YP_579484.1;Psychrobacter cryohalolentis K5),(ZP_05618978.1;气囊栖水菌SK60),(ZP_05362319.1;抗辐射不动杆菌SK82),(YP_045288.1;不动杆菌ADP1),(ZP_05823314.1;不动杆菌RUH2624),(ZP_03824416.1;不动杆菌ATCC 27244),(YP_001380280.1;粘球菌Fw109-5),(YP_466103.1;Anaeromyxobacter dehalogenans 2CP-C),(YP_088190.1;酸曼氏杆菌MBEL55E),(YP_001344949.1;产琥珀酸放线杆菌130Z),(YP_003007411.1;Aggregatibacter aphrophilus NJ8700),(ZP_01788798.1;流感嗜血杆菌3655),(YP_719012.1;睡眠嗜血杆菌129PT),(NP_245642.1;Pasteurella multocida subsp.multocida str.Pm70),(ZP_05920444.1;达可马巴斯德菌ATCC 43325),(ZP_00133992.2;Actinobacillus pleuropneumoniae serovar 1str.4074),(ZP_04753547.1;小放线杆菌NM305),(NP_873873.1;杜克雷嗜血杆菌35000HP),(ZP_04978908.1;溶血曼海姆菌PHL213),(YP_002475022.1;副猪嗜血杆菌SH0165),(ZP_05730581.1;潘朵拉益生菌At-9b),(YP_001907133.1;塔斯曼尼亚欧文氏菌Et1/99),(YP_455287.1;志贺氏菌),(ZP_05723922.1;达旦提狄克氏菌Ech586),(YP_003258889.1;胡萝卜软腐果胶杆菌WPP163),(YP_002988159.1;达旦提狄克氏菌Ech703),(NP_668938.1;鼠疫耶尔森菌KIM 10),(YP_001479543.1;变形斑沙雷菌568),(YP_002934098.1;爱德华氏菌93-146),(YP_002151502.1;奇异变形杆菌HI4320),(NP_930328.1;Photorhabdus luminescens subsp.laumondii TTO1),(YP_002920553.1;克雷伯氏肺炎菌NTUH-K2044),(YP_001177557.1;肠杆菌638),(YP_003211286.1;苏黎世克洛诺斯氏菌),(BAA04663.1;大肠杆菌),(YP_002924403.1;Candidatus Hamiltonella defensa 5AT(Acyrthosiphon pisum)),(ZP_03827735.1;Pectobacterium carotovorum subsp.brasiliensis PBR1692),(ZP_01159282.1;发光杆菌SKA34),(YP_130973.1;Photobacterium profundum SS9),(ZP_06052481.1;霍利斯格里蒙菌CIP 101886),(ZP_05877035.1;弗尼斯弧菌CIP 102972),(ZP_05881960.1;梅氏弧菌CIP 69.14),(ZP_05881960.1;梅氏弧菌CIP 69.14),(ZP_02196748.1;以弧菌AND4),(NP_934927.1;创伤弧菌YJ016),(ZP_01866446.1;施罗氏弧菌AKI),(YP_002416612.1;灿烂弧菌LGP32),(YP_002263486.1;杀蛙气单胞菌LFI1238),(ZP_04415114.1;霍乱弧菌易北河型VL426),(YP_001143125.1;杀鲑气单胞菌杀鲑亚种A449),(YP_002892091.1;Tolumonas auensis DSM 9187),(ZP_01215350.1;Psychromonas sp.CNPT3),(YP_944598.1;Psychromonas ingrahamii 37),(YP_001473443.1;沉积盐希瓦氏菌HAW-EB3),(YP_001761257.1;武氏希瓦氏菌ATCC 51908),(YP_001094519.1;光伏希瓦氏菌PV-4),(YP_001674811.1;腐败希瓦菌HAW-EB4),(YP_869191.1;希瓦氏菌ANA-3),(YP_927371.1;腐敗希瓦菌SB2B),(YP_751160.1;冷海希瓦氏菌NClMB 400),(YP_563413.1;Shewanella denitrificans OS217),(YP_001475272.1;Shewanella sediminis HAW-EB3),(YP_001674949.1;Shewanella halifaxensis HAW-EB4),(ZP_04716660.1;麦氏交替单胞菌ATCC 27126),(YP_662160.1;假别单胞菌T6c),(ZP_01612225.1;Alteromonadales bacterium TW-7),(ZP_01134640.1;Pseudoalteromonas tunicate D2),(YP_269873.1;冷红科尔韦尔氏菌34H),(YP_001341167.1;Marinomonas sp.MWYL1),(ZP_01077352.1;Marinomonas sp.MEDl21),(YP_001209362.1;瘤形梭形菌VCS1703A),(ZP_05705193.1;人心杆菌ATCC 15826),(EEY62817.1;致病疫霉菌T30-4),(EEY62816.1;致病疫霉菌T30-4),(XP 001694504.1;莱茵衣藻),(XP 001753120.1;小立碗藓),(YP_001804510.1;蓝杆藻ATCC 51142),(ZP_01729220.1;蓝杆藻CCY0110),(YP_003138337.1;蓝杆藻PCC 8802),(YP_002380034.1;蓝杆藻PCC 7424),(YP_001661110.1;铜绿微囊藻NIES-843),(YP_002485151.1;蓝杆藻PCC 7425),(NP_441027.1;单细胞集胞藻PCC 6803),(ZP_01061171.1;Leeuwenhoeki ella blandensis MED217),(YP_001195862.1;约氏黄杆菌UW101),(YP_003194927.1;Robiginitalea biformata HTCC2501),(ZP_01107792.1;黄杆菌HTCC2170),(ZP_01051731.1;石油烃降解菌MED152),(ZP_01119204.1;Polaribacter irgensii 23-P),(ZP_03390929.1;生痰二氧化碳嗜纤维菌ATCC 33612),(YP_003141977.1;黄褐二氧化碳嗜纤维菌DSM 7271),(YP_012240.1;Desulfovibrio vulgaris str.Hildenborough),(YP_002436276.1;Desulfovibrio vulgaris str.′Miyazaki F′),(YP_389730.1;脱硫脱硫弧菌脱硫亚种G20),(YP_002992165.1;需盐脱硫弧菌DSM 2638),(YP_003197901.1;Desulfohalobium retbaense DSM 5692),(YP_003157577.1;杆状脱硫微菌DSM 4028),(ZP_03737911.1;Desulfonatronospira thiodismutans AS03-1),(YP_002990332.1;需盐脱硫弧菌DSM 2638),(ZP_03312237.1;Desulfovibrio piger ATCC 29098),(YP_002478890.1;脱硫脱硫弧菌脱硫亚种ATCC 27774),(YP_064294.1;Desulfotalea psychrophila LSv54),(YP_594656.1;细胞内劳森菌PHE/MN1-00),(ZP_01621820.1;Lyngbya sp.PCC 8106),(ZP_03272899.1;螺旋藻CS-328),(YP_845596.1;丙酸氧化菌MPOB),(ZP_04773932.1;Allochromatium vinosum DSM 180),(NP_869002.1;Rhodopirellula baltica SH 1),(YP_392571.1;Sulfurimonas denitrificans DSM 1251),(ZP_05071717.1;Campylobacterales bacterium GD 1),(ZP_04421899.1;Sulfurospirillum deleyianum DSM 6946),(YP_001359295.1;Sulfurovum sp.NBC37-1),(YP_951544.1;Mycobacterium vanbaalenii PYR-1),(YP_001131488.1;黄分枝杆菌PYR-GCK),(YP_637714.1;分枝杆菌MCS),(YP_885188.1;Mycobacterium smegmatis str.MC2155),(YP_001704953.1;脓肿分枝杆菌),(ZP_04747529.1;堪萨斯分支杆菌ATCC 12478),(YP_001849024.1;海鱼分枝杆菌M),(NP_214922.1;结核分支杆菌H37Rv),(NP_962819.1;鸟分枝杆菌副结核亚种K-10),(ZP_05223872.1;胞内分枝杆菌ATCC 13950),(YP_002764919.1;红串红球菌PR4),(YP_702162.1;Rhodococcus jostii RHAI),(YP_121562.1;皮诺卡氏菌IFM 10152),(ZP_04025361.1;微变冢村氏菌DSM 20162),(YP_003275431.1;支气管戈登菌DSM 43247),(YP_003160610.1;反硝化琼斯氏菌DSM 20603),(ZP_05816650.1;科氏血杆菌DSM 10542),(ZP_04368027.1;产黄纤维单胞菌DSM 20109),(YP_002883054.1;Beutenbergia cavemae DSM 12333),(ZP_03911481.1;解纤维素木聚糖单胞菌DSM 15894),(YP_924143.1;类诺卡氏菌1S614),(ZP_03864789.1;Kribbella flavida DSM 17836),(ZP_01131057.1;海洋放线菌PHSC20C1),(YP_001708941.1;马铃薯环腐病菌),(YP_061462.1;木质部赖氏菌木质部亚种CTCB07),(YP_748183.1;亚硝化单胞菌C91),(YP_003116892.1;Catenulispora acidiphila DSM 44928),(YP_003199983.1;Nakamurella muitipartita DSM 44233),(YP_003154321.1;粪短状杆菌DSM 4810),(ZP_03927492.1;Actinomyces urogenitalis DSM 15434),(YP_003148931.1;坐皮肤球菌DSM 20547),(ZP_05803950.1;灰黄链霉菌ATCC 33331),(YP_001823623.1;灰色链霉菌NBRC 13350),(ZP_05002693.1;棒状链霉菌ATCC 27064),(ZP_05015493.1;吸水链霉菌ATCC 29083),(ZP_05538660.1;灰黄链霉菌Tu4000),(ZP_04685789.1;加纳链霉菌ATCC 14672),(ZP_05534308.1;绿产色链霉菌DSM 40736),(ZP_05523554.1;变铅青链霉菌TK24),(NP_823999.1;阿维链霉菌MA-4680),(CBG69921.1;阿氟曼链霉菌87.22),(ZP_04704905.1;白色链霉菌11074),(ZP_04997745.1;海洋放线菌Mgl),(ZP_05509147.1;海洋放线菌C),(ZP_05514718.1;吸水链霉菌ATCC 53653),(ZP_04994290.1;海洋放线菌SPB74),(ZP_04474082.1;链孢囊菌DSM 43021),(YP_001160501.1;Salinispora tropica CNB-440),(YP_001538853.1;栖沙盐水孢菌(Salinispora arenicola)CNS-205),(ZP_04605575.1;Micromonospora sp.ATCC 39149),(YP_832716.1;阿特拉津降解菌FB24),(ABR13603.1;氧化节杆菌),(YP_002956296.1;滕黄微球菌NCTC 2665),(ZP_05367249.1;粘滑罗斯菌ATCC 25296),(YP_001854004.1;嗜根考克氏菌DC2201),(ZP_04984463.1;B型土拉菌FSC022),(YP_001677422.1;蜃楼弗朗西斯菌ATCC 25017),(YP_588827.1;Baumannia cicadellinicola str.Hc(Homalodisca oagulata)),(NP_240007.1;Buchnera aphidicola str.APS(Acyrthosiphonpisum)),(ZP_05057494.1;Verrucomicrobiae bacterium DG1235),(ZP_02930252.1;Verrucomicrobium spinosum DSM 4136),(ZP_01452386.1;Mariprofundus ferrooxydans PV-l),and(ZP_01307392.1;Bermanella marisrubri)。
磷酸转乙酰酶也在本文所提供的组合物和方法中有效,其包括被称为是本文所描述的任意磷酸转乙酰酶的“衍生物”的那些分子。这样的“衍生物”具有以下特点:(1)它与本文所描述的任意磷酸转乙酰酶享有实质同源性;和(2)能够催化将乙酰磷酸转化为乙酰辅酶A。如果磷酸转乙酰酶衍生物的氨基酸序列与磷酸转乙酰酶的氨基酸序列至少80%,且更优选至少90%,以及最优选至少95%相同,则可以说磷酸转乙酰酶的衍生物与磷酸转乙酰酶享有“实质同源性”。
5.4乙酰磷酸酶活性的功能性破坏
在一些实施方案中,本文所提供的经遗传修饰的宿主细胞包括将乙酰磷酸转换为乙酸根离子的酶的功能性破坏。在一些实施方案中,所述酶原产于宿主细胞。
在一些实施方案中,将乙酰磷酸转换为乙酸根离子的酶是甘油-1-磷酸酶(EC 3.1.3.21)。在一些实施方案中,具有甘油-1-磷酸酶活性的酶是RHR2(GPP1/RHR2;学名:YIL053W),或其同源物或变异体。GPP1/RHR2是甘油生物合成中所涉及的结构性表达的甘油-1-磷酸酶,并且被诱导以响应厌氧和渗透压力。参见,例如,Norbeck等人,J Biol Chem 271(23):13875-13881(1996);Norbeck等人,J Biol Chem 272(9):13875-13881(1996);Pahlman等人,J Biol Chem 276(5):3555-3563(2001);Nevoigt和Stahl,FEMS Microbiol Rev 21(3):231-41(1997);Byrne和Wolf,Genome Res 15(10):1456-61;以及Hirayama等人,Mol Gen Genet 249(2):127-38,其各自的整体内容通过引用并入本文。酿酒酵母的GPP1/RHR2基因的序列之前已经描述。参见,例如,Norbeck等人,J Biol Chem 271(23):13875-13881(1996);和Pahlman等人,J Biol Chem 276(5):3555-3563(2001).Gpp1/Rhr2之前已描述为催化下述反应:
酿酒酵母的典型GPP1/RHR2核苷酸序列包括登记号NM_001179403.1和本文所提供的SEQ ID NO:5。酿酒酵母的典型Gpp1/Rhr2蛋白质序列包括登记号NP_012211,和本文所提供的SEQ ID NO:6。
GPP1/RHR2的密切相关的同源物是HOR2(GPP2/HOR2;学名:YER062C),其也可催化乙酰磷酸的水解为乙酸根离子。GPP2/HOR2之前也被描述为甘油-1-磷酸酶,其能够催化下述反应:因此,GPP2/HOR2的功能性破坏也发现用于本文所提供的组合物和方法。酿酒酵母的GPP2/HOR2基因的序列在之前已经描述。参见,例如,Norbeck等人,J.of Biological Chemistry 271(23):13875-13881(1996);和Pahlman等人,J.of Biological Chemistry 276(5):3555-3563(2001)。酿酒酵母的典型GPP2/HOR2核苷酸序列包括登记号NM_001178953.3,和本文所提供的SEQ ID NO:7。酿酒酵母的典型Gpp1/Rhr2蛋白质序列包括登记号NP_010984,和本文所提供的SEQ ID NO:8。
如在本领域中可以理解的,除了酿酒酵母,在酵母中自然存在的GPP1/RHR2和/或GPP2/HOR2的同源物使用本文所述的方法可同样地失活。此外,编码乙酰磷酸酶活性(例如,RHR2和/或HOR2)的多核苷酸,基因和/或多肽可被用于识别其它多核苷酸,基因和/或多肽序列或用于识别在其它宿主细胞中具有乙酰磷酸酶活性的同源物。例如,在本领域技术人员熟知的文献中和/或生物信息学数据库中,这样的序列可以被识别。例如,利用生物信息学,在其它细胞类型中,编码乙酰磷酸酶活性的序列的识别可通过利用编码乙酰磷酸酶和/或甘油-1-磷酸酶活性的已知的DNA和多肽序列来BLAST(如上所述)搜索可公开获得的数据库来完成,所述已知的DNA和多肽序列例如本文提供的那些。使用空位罚分(GAP PENALTY)=10,(空位长度罚分)GAP LENGTH PENALTY=0.1,和Gonnet 250系列蛋白质权重矩阵等默认参数,鉴别可建立在Clustal W比对法基础上。
在一些实施方案中,将乙酰磷酸转换为乙酸根离子的内源酶(例如,RHR2或HOR2)的活性或表达被降低至少约50%。在另一个实施方案中,相对于不包括内源酶(将乙酰磷酸转换为乙酸根离子)的活性或表达的降低或缺失的重组微生物,将乙酰磷酸转换为乙酸根离子的内源酶的活性或表达被降低至少约60%,至少约65%,至少约70%,至少约75%,至少约80%,至少约85%,至少约90%,至少约95%,或至少约99%。在一些实施方案中,所述将乙酰磷酸转换为乙酸根离子的内源酶是RHR2,或其同源物。在一些实施方案中,所述将乙酰磷酸转换为乙酸根离子的内源酶是HOR2,或其同源物。
如本领域的技术人员所理解的,存在可用于减少或破坏蛋白质(将乙酰磷酸转换为乙酸根离子的蛋白质)的活性的几种机制,诸如甘油-1-磷酸酶(例如,RHR2和/或HOR2),包括但不限于,使用经调节的启动子,使用弱组成型启动子,在二倍体酵母中破坏编码蛋白质的两个基因副本之一,在二倍体酵母中破坏两个基因副本,反义核酸的表达,siRNA的表达,内源启动子的负调节因子的过表达,改变内源或异源基因的活性,使用具有较低比活性的异源基因等,或它们的组合。
在一些实施方案中,经遗传修饰的宿主细胞包括至少一个编码乙酰磷酸酶活性(例如,RHR2,HOR2或其同源物或变异体)的基因的突变,其使得被所述基因编码的多肽的活性减少。在另一个实施方案中,经遗传修饰的宿主细胞包括编码乙酰磷酸酶活性的基因的部分缺失(例如,RHR2,HOR2或其同源物或变异体),其使得被所述基因编码的多肽的活性减少。在另一个实施方案中,经遗传修饰的宿主细胞包括编码乙酰磷酸酶活性的基因(例如,RHR2,HOR2或其同源物或变异体)的完全缺失,其使得被所述基因编码的多肽的活性减少。在又一个实施方案中,经遗传修饰的宿主细胞包括与编码乙酰磷酸酶活性的基因(例如,RHR2,HOR2或其同源物或变异体)相关的调节区的修饰,其使得被所述基因编码的多肽的表达减少。在又一个实施方案中,经遗传修饰的宿主细胞包括修饰转录调控因子,从而使得编码乙酰磷酸酶活性的基因(例如,RHR2,HOR2或其同源物或变异体)的转录减少。
在一些实施方案中,通过使用“破坏构建体”以实现破坏编码能够催化乙酰磷酸转换为乙酸根离子的蛋白质的一个或多个基因,从而使得经破坏的基因是非功能性的,在引入构建体至微生物细胞时,所述“破坏构建体”能够特异性破坏这样的基因(例如,RHR2或HOR2)。在一些实施方案中,靶基因的破坏防止功能蛋白的表达。在一些实施方案中,靶基因的破坏导致来自破坏基因的非功能性蛋白的表达。在一些实施方案中,通过同源重组整合靶基因位点中的“破坏序列”,以实现破坏编码能够将乙酰磷酸转换为乙酸根离子的蛋白质的基因。在这些实施方案中,所述破坏构建体包含两侧是一对核苷酸序列的破坏序列,所述一对核苷酸序列与靶基因位点的一对核苷酸序列同源(同源序列)。经破坏构建体替换靶基因的靶部位,所述破坏序列防止功能性蛋白的表达,或使得来自靶基因的非功能性蛋白的表达。
能够破坏基因的破坏构建体可使用本领域熟知的标准分子生物学技术来构建。参见,例如,Sambrook等人,2001,Molecular Cloning--A Laboratory Manual,第3版,冷泉港实验室,冷泉港,NY和Ausubel等人编.,现行版,Current Protocols in Molecular Biology,Greene出版协会和Wiley Interscience,NY。破坏构建体的参数可以在本方法的实践中改变,所述参数包括但不限于,同源序列的长度;同源序列的核苷酸序列;破坏序列的长度;破坏序列的核苷酸序列;和靶基因的核苷酸序列。在一些实施方案中,每个同源序列的长度的有效范围为50至5000个碱基对。在具体实施方案中,每个同源序列的长度约为500个碱基对。对于基因靶向所需的同源性的长度的讨论,请参见Hasty等,Mol Cell Biol 11:5586-91(1991)。在一些实施方案中,所述同源序列包含靶基因的编码序列。在其他实施方案中,所述同源序列包含靶基因的上游或下游序列。在一些实施方案中,一种同源序列包括与靶基因的编码序列的5’位核苷酸序列同源的核苷酸序列,且另一种同源序列包括与靶基因的编码序列的3’位核苷酸序列同源的核苷酸序列。在一些实施方案中,所述破坏序列包括编码可选择标记的核苷酸序列,所述可选择标记使得能够选择包含破坏序列的微生物细胞。因此,在这些实施方案中,所述破坏构建体具有双重功能,即,功能性破坏靶基因并为细胞识别提供可选择的标记,在所述细胞中,所述靶基因被功能性破坏。在一些实施方案中,终止密码子与编码可选择标记的核苷酸序列位于读码框中并是该编码可选择标记的核苷酸序列的下游,以防止转译通读(translational read-through),所述转译通读可能产生具有靶基因编码的野生型蛋白质的某种程度活性的融合蛋白。在一些实施方案中,所述破坏序列的长度是一个碱基对。单个碱基对的插入可以足以破坏靶基因,因为在编码序列中插入单碱基对可以构成阅读框移码突变,其可以防止功能性蛋白的表达。在一些实施方案中,所述破坏序列的序列通过单个碱基对而不同于位于同源序列之间的靶基因的核苷酸序列。在破坏序列更换靶基因内的核苷酸序列后,引入的单个碱基对置换可导致在蛋白质的关键位点的单个氨基酸的置换以及非功能性蛋白的表达。然而,应当认识到,使用非常短的破坏序列造成的破坏容易通过自发突变而回复到野生型序列,从而导致对宿主菌株恢复乙酰磷酸酶功能。因此,在具体实施方案中,所述破坏序列长于一至数个碱基对。在另一个极端,超长的破坏序列不大可能赋予优于中等长度的破坏序列的任何优势,并可能减少转染或标靶的效率。在这种情况中,所述超长的长度比靶基因中所选择的同源序列之间的距离长出许多倍。因此,在某些实施方案中,所述破坏序列的长度可以从2至2000个碱基对。在其他实施方案中,所述破坏序列的长度大约相当于靶基因位点的区域之间的距离,所述靶基因位点的区域与破坏构建体中的同源序列匹配。
在一些实施方案中,所述破坏构建体是线性DNA分子。在其他实施方案中,所述破坏构建体是环状DNA分子。在一些实施方案中,环状破坏构建体包括一对由破坏序列隔开的同源序列,如上所述。在一些实施例中,所述环状破坏构建体包含单个同源序列。当在靶基因位点整合时,这种环状破坏构建体将成为线性的,其中同源序列的部分位于各端并且破坏构建体的剩余片段插入并破坏靶基因而不替换任何靶基因核苷酸序列。在具体的实施方案中,所述环状破坏构建体的单个同源序列与位于靶基因的编码序列中的序列是同源的。
通过本领域技术人员已知的不受限制的任何方法,可以在微生物细胞中引入破坏构建体。这样的方法包括,但不限制于,细胞直接从溶液中摄取分子,或使用如下通过脂质转染促进摄取,例如,脂质体或免疫脂质体;粒子介导的转染;等。参见,例如,美国专利号5,272,065;Goeddel等人,编,1990,Methods in Enzymology,vol.185,Academic Press,Inc.,CA;Krieger,1990,Gene Transfer and Expression--A Laboratory Manual,Stockton Press,NY;Sambrook等人,1989,Molecular Cloning--A Laboratory Manual,冷泉港实验室,NY;和Ausubel等人,编,现行版,Current Protocols in Molecular Biology,Greene出版协会和Wiley Interscience,NY。用于转化酵母细胞的具体方法是本领域熟知的。参见Hinnen等人,Proc.Natl.Acad.Sci.USA 75:1292-3(1978);Cregg等人,Mol.Cell.Biol.5:3376-3385(1985)。典型的技术包括但不限于,原生质球,电穿孔,PEG 1000介导的转化,和乙酸锂或氯化锂介导的转化。
5.5提高乙酰辅酶A产量的其它修饰
5.5.1 ADA
在一些实施方案中,本文提供的经遗传修饰的宿主细胞还包含编码酰化乙醛脱氢酶(又称为“乙醛脱氢酶,乙酰化”,“乙醛脱氢酶,酰化,”或ADA(EC 1.2.1.10))的一种或多种异源核苷酸序列。
可用于本文所提供的组合物和方法的能够催化该反应的蛋白质,包括以下四种类型的蛋白质:
(1)催化乙酰辅酶A可逆转化成乙醛,并且随后将乙醛可逆转化为乙醇的双功能的蛋白质。这种类型的蛋白质的例子是大肠杆菌中AdhE蛋白(基因库号:NP_415757)。AdhE似乎是基因融合的进化产物。所述AdhE蛋白质的NH2-末端区域与醛高度同源:NAD+氧化还原酶,然而COOH-末端区域与Fe2+依赖的性乙醇族同源:NAD+氧化还原酶(Membrillo-Hernandez等人,(2000)J.Biol.Chem.275:33869-33875)。大肠杆菌AdhE受金属催化的氧化,因此对氧敏感(Tamarit等人(1998)J.Biol.Chem.273:3027-32)。
(2)在严格或兼性厌氧微生物中催化乙酰辅酶A可逆转化成乙醛但并不具备醇脱氢酶活性的蛋白质。这种类型的蛋白质的例子已经在克氏梭菌(Smith等人(1980)Arch.Biochem.Biophys.203:663-675)中报道。ADA已经在克氏梭菌DSM 555(登记号:EDK33116)的基因组中注释。同源蛋白质AcdH在植物乳杆菌的基因组(登记号:NP_784141)中被鉴定。这种类型的蛋白质的另一例子是在拜氏梭菌NRRL B593的ald基因产物(Toth等人(1999)Appl.Environ.Microbiol.65:4973-4980,登记号:AAD31841)。
(3)参与乙醇胺分解代谢的蛋白质。乙醇胺可以被同时用作许多肠道菌的碳源和氮源(Stojiljkovic等人(1995)J.Bacteriol.177:1357-1366)。乙醇胺首先由乙醇胺氨裂解酶转换为氨和乙醛,随后乙醛被ADA转换为乙酰辅酶A。这种类型的ADA的例子是鼠伤寒沙门氏菌中EutE蛋白(Stojiljkovic等人(1995)J.Bacteriol.177:1357-1366,登记号:AAL21357;还参见U18560.1)。大肠杆菌也能够利用乙醇胺(Scarlett等人(1976)J.Gen.Microbiol.95:173-176)并具有EutE蛋白(登记号:AAG57564;还参见EU897722.1),所述EutE蛋白与鼠伤寒沙门氏菌中的EutE蛋白同源。
(4)为参与4-羟基-2-酮戊酸分解代谢的双功能醛缩酶脱氢酶复合物的部分的蛋白质。这些双功能酶催化邻苯二酚间位裂解途径的最后两个步骤,邻苯二酚是在许多细菌物种中降解酚类,甲苯酸盐,萘,联苯和其它芳香族化合物的中间体(Powlowski和Shingler(1994)Biodegradation 5,219-236)。4-羟基-2-酮异戊酸首先被4-羟基-2-酮异戊酸醛缩酶转换为丙酮酸和乙醛,随后乙醛被ADA转换为乙酰辅酶A。这种类型的ADA的例子是假单孢菌CF600中的DmpF蛋白质(登记号:CAA43226)(Shingler等人(1992)J.Bacteriol.174:71 1-24)。大肠杆菌具有与假单孢菌CF600中的DmpF蛋白质同源的MphF蛋白(Ferrandez等人(1997)J.Bacteriol.179:2573-2581,登记号:NP_414885)。
在一些实施方案中,用于本文所描述的组合物和方法的ADA(或编码这些活性的核酸序列)选自由下述所构成的组:大肠杆菌adhE,溶组织内阿米巴adh2,金黄色葡萄球菌adhE,梨囊鞭菌属(Piromyces sp.)E2 adhE,克氏梭菌(EDK33116),植物乳杆菌acdH和恶臭假单胞菌(YP 001268189),如在国际公开号WO 2009/013159中描述的,其整体内容通过引用并入本文。在一些实施方案中,所述ADA选自由下述所构成的组:肉毒梭菌eutE(FR745875.1),Desulfotalea psychrophila eutE(CR522870.1),不动杆菌HBS-2 eutE(ABQ44511.2),深海耐热丝杆菌(Caldithrix abyssi)eutE(ZP_09549576)和湖渊盐红菌(Halorubrum lacusprofundi)ATCC 49239(YP_002565337.1)。
在具体实施方案中,用于本文所提供的组合物和方法的ADA是来自玉米狄克氏细菌(Dickeya zeae)的eutE。玉米狄克氏细菌的典型的eutE核苷酸序列包括登记号NC_012912.1:1110476..1111855,和本文所提供的SEQ ID NO:9。玉米狄克氏细菌的典型的eutE蛋白质序列包括登记号YP_003003316,和本文所提供的SEQ ID NO:10。
用于本文所提供的组合物和方法的ADA也包括那些被称为是本文所述的任意ADA的“衍生物”的分子。这样的“衍生物”具有以下特点:(1)它与本文所述的任意ADA享有实质同源性;和(2)能够催化将乙醛转换为乙酰辅酶A。如果衍生物的氨基酸序列与本文所述的任意ADA至少80%、至少85%、和更优选至少90%、和最优选至少95%相同,则可以说ADA的衍生物与ADA享有“实质同源性”。
5.5.2 PDH-支路的功能性破坏
通过由PDH复合物催化的丙酮酸氧化脱羧而可在线粒体内形成乙酰辅酶A。然而,由于酿酒酵母无法将乙酰辅酶A输送出线粒体,PDH支路在胞质区室中提供乙酰辅酶A方面具有必不可少的作用,并为将丙酮酸酯转换为乙酰辅酶A的PDH反应提供了替代途径。PDH支路涉及的酶有丙酮酸脱羧酶(PDC;EC 4.1.1.1),乙醛脱氢酶(ACDH;EC 1.2.1.5和EC 1.2.1.4),和乙酰辅酶A合成酶(ACS;EC 6.2.1.1)。丙酮酸脱羧酶催化丙酮酸脱羧形成乙醛和二氧化碳。乙醛脱氢酶氧化乙醛形成乙酸根离子。在酿酒酵母中,醛脱氢酶的家族包含五个成员。ALD2(YMR170c),ALD3(YMR169c)和ALD6(YPL061w)相当于细胞溶质亚型(cytosolic isoforms),而ALD4(YOR374w)和ALD5(YER073w)编码线粒体酶。主要的细胞溶质乙醛脱氢酶亚型由ALD6编码。乙酰辅酶A由乙酸根离子经ACS催化形成并且涉及ATP的水解。两个结构基因,ACS1和ACS2编码ACS。
在一些实施方案中,本文提供的经遗传修饰的宿主细胞进一步包含在PDH支路途径的一种或多种基因的功能性破坏。在一些实施方案中,宿主细胞的PDH支路的一种或多种基因的破坏产生遗传修饰的微生物细胞,所述遗传修饰的微生物细胞催化一种或多种下述反应的能力受损:(1)通过丙酮酸脱羧酶将丙酮酸脱羧形成乙醛;(2)通过乙醛脱氢酶将乙醛转化成乙酸根离子;和(3)通过乙酰辅酶A合成酶由乙酸根离子以及辅酶A合成乙酰辅酶A。
在一些实施方案中,相比于亲本细胞,宿主细胞包含在PDH支路途径的一种或多种基因中的功能性破坏,其中减少功能或无功能的PDH支路途径的活性单独或与弱ADA组合是不足以支持宿主细胞生长,生存和/或健康。
在一些实施方案中,PDH支路的一种或多种内源性蛋白的活性或表达降低了至少约50%。在另一个实施方案中,相对于不包含PDH支路的一种或多种内源性蛋白的活性或表达的减少或缺失的重组微生物,PDH支路的一种或多种内源性蛋白的活性或表达降低了至少约60%,至少约65%,至少约70%,至少约75%,至少约80%,至少约85%,至少约90%,至少约95%,或至少约99%。
5.5.2.1 ALD4和ALD6
在一些实施方案中,宿主细胞中编码乙醛脱氢酶(ACDH)活性的一种或多种基因被功能性破坏。在一些实施方案中,所述醛脱氢酶由选自如下组的基因编码:ALD2,ALD3,ALD4,ALD5,ALD6,和其同源物和变异体组成。
在一些实施方案中,所述经遗传修饰的宿主细胞包括ALD4的功能性破坏。酿酒酵母的典型ALD4核苷酸序列包括登记号NM_001183794,和本文所提供的SEQ ID NO:11。酿酒酵母的典型Ald4蛋白质序列包括登记号NP_015019.1,和本文所提供的SEQ ID NO:12。
在一些实施方案中,所述经遗传修饰的宿主细胞包括细胞溶质醛脱氢酶(ALD6)的功能性破坏。在天然PDH支路中,Ald6p起到将乙醛转化成乙酸根离子的作用。酿酒酵母的典型ALD6核苷酸序列包括登记号SCU56604,和本文所提供的SEQ ID NO:13。酿酒酵母的典型Ald6蛋白质序列包括登记号AAB01219,和本文所提供的SEQ ID NO:14。
如在本领域中可以理解的,除了酿酒酵母外,酵母菌中天然存在的醛脱氢酶的同源物可以同样地使用本文所述的方法而失活。
正如将被本领域技术人员所理解的,多于一种的醛脱氢酶的活性或表达可被减少或消除。在一个具体的实施方案中,ALD4和ALD6或其同源物或变异体的活性或表达被减少或消除。在另一具体实施方案中,ALD5和ALD6或其同源物或变异体的活性或表达被减少或消除。在又一个具体实施方案中,ALD4,ALD5和ALD6或其同源物或变异体的活性或表达被减少或消除。在又一个具体的实施方案中,胞质定位的醛脱氢酶ALD2,ALD3和ALD6或其同源物或变异体的活性或表达被减少或消除。在又一个具体的实施方案中,线粒体定位的醛脱氢酶ALD4和ALD5或其同源物或变异体的活性或表达被减少或消除。
5.5.2.2 ACS1和ACS2
在一些实施方案中,宿主细胞中编码乙酰辅酶A合成酶(ACS)活性的一种或多种基因被功能性破坏。在一些实施方案中,所述乙酰辅酶A合成酶由基因编码,且选自如下组:ACS1,ACS2,和其同源物和变异体。
在一些实施方案中,宿主细胞中编码乙酰辅酶A合成酶(ACS)活性的一种或多种基因被功能性破坏。ACS1和ACS2均为乙酰辅酶A合成酶,其可以将乙酸根离子转换为乙酰辅酶A。ACS1仅在呼吸条件下被表达,而ACS2被结构性地表达。当ACS2被敲除,菌株能够在呼吸条件(如乙醇,甘油或乙酸根离子介质)上生长,但是在可发酵碳源(例如蔗糖,葡萄糖)上死亡。
在一些实施方案中,经遗传修饰的宿主细胞包括ACS1的功能性破坏。酿酒酵母的ACS1基因的序列之前已经描述。参见,例如,Nagasu等人,Gene37(1-3):247-253(1985)。酿酒酵母的典型ACS1核苷酸序列包括登记号X66425,和本文所提供的SEQ ID NO:15。酿酒酵母的典型Acs1蛋白质序列包括登记号AAC04979,和本文所提供的SEQ ID NO:16。
在一些实施方案中,所述经遗传修饰的宿主细胞包括ACS2的功能性破坏。酿酒酵母的ACS2基因的序列之前已经描述。参见,例如,Van den Berg等人,Eur.J.Biochem.231(3):704-713(1995)。酿酒酵母的典型ACS2核苷酸序列包括登记号S79456,和本文所提供的SEQ ID NO:17。酿酒酵母的典型Acs2蛋白质序列包括登记号CAA97725,和本文所提供的SEQ ID NO:18。
如本领域可以理解的,除在酿酒酵母中外,在酵母中自然存在的乙酰辅酶A合成酶同源物使用本文所述的方法可同样地失活。
在一些实施方案中,所述宿主细胞包含细胞溶质乙酰辅酶A合成酶活性,在呼吸条件下(即,当宿主细胞在例如乙醇,甘油或乙酸根离子的存在下生长),其可以将乙酸根离子转换为乙酰辅酶A。在一些这样的实施方案中,所述宿主细胞是包括ACS1活性的酵母细胞。在其他实施方案中,相比于亲本细胞,在呼吸条件下所述宿主细胞不包含或包含减少的内源乙酰辅酶A合成酶活性。在一些这样的实施方案中,相比于亲本细胞,所述宿主细胞是不包括或包括减少的ACS1活性的酵亲本细胞。
在一些实施方案中,所述宿主细胞包含细胞溶质乙酰辅酶A合成酶活性,在非呼吸条件下(即,当宿主细胞在可发酵碳源(例如,蔗糖,葡萄糖)的存在下生长),其可以将乙酸根离子转换为乙酰辅酶A。在一些这样的实施方案中,所述宿主细胞是包括ACS2活性的酵亲本细胞。在其他实施方案中,相比于亲本细胞,在非呼吸条件下所述宿主细胞不包含或包含减少的内源乙酰辅酶A合成酶活性。在一些这样的实施方案中,相比于亲本细胞,所述宿主细胞是不包括或包括减少的ACS2活性的酵亲本细胞。
在一些实施方案中,所述宿主细胞包含异源PK和细胞溶质乙酰辅酶A合成酶活性(例如,ACS1和/或ACS2)。在这样的实施方案中,PK在宿主细胞中产生乙酰磷酸。完整的细胞溶质ACS活性可以将乙酸根离子转化成乙酰辅酶A,所述乙酸根离子由于RHR2和/或HOR2催化乙酰磷酸水解而累积。
5.6生产类异戊二烯的MEV途径
在一些实施方案中,本文所提供的经遗传修饰的宿主细胞包含MEV途径的一种或多种异源酶。在一些实施方案中,所述MEV途径的一种或多种酶包括缩合乙酰辅酶A与丙二酰辅酶A以形成乙酰乙酰辅酶A的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括使两分子乙酰辅酶A缩合形成乙酰乙酰辅酶A的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括使乙酰乙酰辅酶A与乙酰辅酶A缩合形成HMG-CoA的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括将HMG-CoA转换为甲羟戊酸的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括使得甲羟戊酸磷酸化为5-磷酸甲羟戊酸的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括将5-磷酸甲羟戊酸转换为5-焦磷酸甲羟戊酸的酶。在一些实施方案中,所述MEV途径中的一种或多种酶包括将5-焦磷酸甲羟戊酸转换为异戊烯焦磷酸的酶。
在一些实施方案中,所述MEV途径中的一种或多种酶选自由下述所构成的组:乙酰辅酶A硫解酶,乙酰乙酰辅酶A合成酶,HMG-CoA合成酶,HMG-CoA还原酶,甲羟戊酸激酶,磷酸甲羟戊酸激酶和甲羟戊酸焦磷酸脱羧酶。在一些实施方案中,关于能够催化乙酰乙酰辅酶A的形成的MEV途径中的酶,所述经遗传修饰的宿主细胞包含使两分子乙酰辅酶A缩合形成乙酰乙酰辅酶A的酶,例如,乙酰辅酶A硫解酶;或者包含缩合乙酰辅酶A和与丙二酰辅酶A以形成乙酰乙酰辅酶A的酶,例如,乙酰乙酰辅酶A合酶。在一些实施方案中,所述基因修饰的宿主细胞既包含使两分子乙酰辅酶A缩合形成乙酰乙酰辅酶A的酶,例如,乙酰辅酶A硫解酶;也包含缩合乙酰辅酶A和与丙二酰辅酶A以形成乙酰乙酰辅酶A的酶,例如,乙酰乙酰辅酶A合成酶。
在一些实施方案中,所述宿主细胞包含编码所述MEV途径的多于一种酶的一种或多种异源核苷酸序列。在一些实施方案中,所述宿主细胞包含编码所述MEV途径的两种酶的一种或多种异源核苷酸序列。在一些实施方案中,所述宿主细胞包含编码可以将HMG-CoA转换为甲羟戊酸的酶和将甲羟戊酸转换为5-磷酸甲羟戊酸的酶的一种或多种异源核苷酸序列,所。在一些实施方案中,所述宿主细胞包含编码所述MEV途径的三种酶的一种或多种异源核苷酸序列。在一些实施方案中,所述宿主细胞包含编码所述MEV途径的四种酶的一种或多种异源核苷酸序列。在一些实施方案中,所述宿主细胞包含编码所述MEV途径的五种酶的一种或多种异源核苷酸序列。在一些实施方案中,所述宿主细胞包含编码所述MEV途径的六种酶的一种或多种异源核苷酸序列。在一些实施方案中,所述宿主细胞包含编码所述MEV途径的七种酶的一种或多种异源核苷酸序列。在一些实施方案中,所述宿主细胞包括编码所述MEV途径的全部酶的多种异源核苷酸序列。
在一些实施方案中,所述经遗传修饰的宿主细胞进一步包括编码酶的异源核酸,所述酶可以将异戊烯焦磷酸(IPP)转换为二甲基烯丙基焦磷酸(DMAPP)。在一些实施方案中,所述经遗传修饰的宿主细胞进一步包括编码酶的异源核酸,所述酶能使得IPP和/或DMAPP分子缩合形成聚异戊二烯化合物。在一些实施方案中,所述经遗传修饰的宿主细胞进一步包括编码酶的异源核酸,所述酶可以修饰IPP或聚异戊二烯以形成类异戊二烯化合物。
5.6.1乙酰辅酶A转换为乙酰乙酰辅酶A
在一些实施方案中,所述经遗传修饰的宿主细胞包含编码酶的异源核苷酸序列,所述酶使两分子乙酰辅酶A缩合形成乙酰乙酰辅酶A,例如,乙酰辅酶A硫解酶。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(NC_000913区域:2324131.2325315;大肠杆菌),(D49362;脱氮副球菌)和(L20428;酿酒酵母)。
乙酰辅酶A硫解酶催化两分子乙酰辅酶A可逆缩合得到乙酰乙酰辅酶A,但该反应在热力学上是不利的;相比乙酰乙酰辅酶A合成,乙酰乙酰辅酶A硫解更有利。乙酰乙酰辅酶A合酶(AACS)(也称为乙酰辅酶A:丙二酰辅酶A酰基转移酶;EC 2.3.1.194)使乙酰辅酶A与丙二酰辅酶A缩合以形成乙酰乙酰辅酶A。与乙酰辅酶A硫解酶对比,由于丙二酰辅酶A的相关脱羧,AACS催化的乙酰乙酰辅酶A合成实质上是能量有利的反应。此外,AACS对乙酰乙酰辅酶A表现出无硫解活性,因此所述反应是不可逆的。
在包括乙酰辅酶A硫解酶和异源ADA和/或磷酸转乙酰酶(PTA)的宿主细胞中,X由利于乙酰乙酰辅酶A硫解D乙酰辅酶A硫解酶催化的可逆反应,可能导致大的乙酰辅酶A聚集(pool)。鉴于ADA的可逆活性的,所述乙酰辅酶A聚集可反过朝着将乙酰辅酶A转换为乙醛的逆反应来驱动ADA,从而减少了ADA提供的朝着乙酰辅酶的生产的好处。同样地,PTA的活性是可逆的,因此,大的乙酰辅酶A池可驱动PTA朝向逆反应,其将乙酰辅酶A转换为乙酰磷酸。因此,在一些实施方案中,为了对乙酰辅酶A提供强大的拉力来驱动ADA和PTA的正反应,本文所提供经遗传修饰的宿主细胞的MEV途径利用乙酰乙酰辅酶A合酶来从乙酰辅酶A和丙二酰辅酶A形成乙酰乙酰辅酶A。
在一些实施方案中,所述AACS来自链霉菌菌株CL190(Okamura等人,Proc Natl Acad Sci USA 107(25):11265-70(2010)。链霉菌菌株CL190典型的AACS核苷酸序列包括登记号:AB540131.1、和本文所提供的SEQ ID NO:19。链霉菌菌株CL190典型的AACS蛋白质序列包括登记号:D7URV0,BAJ10048,和本文所提供的SEQ ID NO:20。用于本文所提供的组合物和方法的其它乙酰乙酰辅酶A包括,但不限制于,链霉菌(AB183750;KO-3988BAD86806);环状链霉菌菌株9663(FN178498;CAX48662);链霉菌KO-3988(AB212624;BAE78983);游动放线菌属A40644(AB113568;BAD07381);链霉菌C(NZ_ACEW010000640;ZP_05511702);达松威尔拟诺卡氏菌DSM 43111(NZ_ABUI01000023;ZP_04335288);溃疡分枝杆菌Agy99(NC_008611;YP_907152);海洋分支杆菌M(NC_010612;YP_001851502);链霉菌Mg1(NZ_DS570501;ZP_05002626);链霉菌AA4(NZ_ACEV01000037;ZP_05478992);玫瑰孢链霉菌NRRL 15998(NZ_ABYB01000295;ZP_04696763);链霉菌ACTE(NZ_ADFD01000030;ZP_06275834);绿色产色链霉菌DSM 40736(NZ_ACEZ01000031;ZP_05529691);弗兰克氏菌CcI3(NC_007777;YP_480101);巴西诺卡菌(NC_018681;YP_006812440.1);和Austwickia chelonae(NZ_BAGZ01000005;ZP_10950493.1)。其它适合的乙酰乙酰辅酶A合酶包括那些在美国专利申请(公开号2010/0285549和2011/0281315)中所描述的,其整体内容通过引用并入本文。
乙酰乙酰辅酶A合酶也在本文所提供的组合物和方法中有效,其包括被称为是本文所描述的任意乙酰乙酰辅酶A合酶的“衍生物”的那些分子。这样的“衍生物”具有以下特点:(1)它与本文所描述的任意乙酰乙酰辅酶A合酶享有实质同源性;和(2)能够催化使得乙酰辅酶A和丙二酰辅酶A不可逆缩合以形成乙酰乙酰辅酶A。如果乙酰乙酰辅酶A合酶衍生物的氨基酸序列与乙酰乙酰辅酶A合酶的氨基酸序列至少80%,更优选至少90%,最优选至少95%相同,则可以说乙酰乙酰辅酶A合酶的衍生物与乙酰乙酰辅酶A合酶享有“实质同源性”。
5.6.2乙酰乙酰辅酶A转换为HMG-CoA
在一些实施方案中,所述宿主细胞包含编码酶的异源核苷酸序列,所述酶能够使乙酰乙酰辅酶A与另一分子乙酰辅酶A缩合形成3-羟基-3-甲基戊二酰-辅酶A(HMG-CoA),例如HMG-CoA合成酶。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(NC_001145.补体19061.20536;酿酒酵母),(X96617;酿酒酵母),(X83882;拟南芥),(AB037907;灰色北里孢菌),(BT007302;智人)和(NC_002758,基因座标记SAV2546,GeneID1122571;金黄色葡萄球菌)。
5.6.3 HMG-CoA转换为甲羟戊酸
在一些实施方案中,所述宿主细胞包含编码酶的异源核苷酸序列,所述酶可以将HMG-CoA转换为甲羟戊酸,例如,HMG-CoA还原酶。在一些实施方案中,HMG-CoA还原酶是使用NADH的羟甲基戊二酰辅酶A还原酶辅酶A还原酶。HMG-CoA还原酶(EC 1.1.1.34;EC 1.1.1.88)催化(S)-HMG-CoA还原脱酰化为(R)-甲羟戊酸,并且可分为两类,I类和II类HMGrs。第I类包括来自真核生物和大部分古细菌的酶,并且II类包括某些原核生物和古细菌的的HMG-CoA还原酶。除了序列上的差异之外,这两类的酶在其辅因子特异性方面也不同。不像I类酶仅利用NADPH,II类的HMG-CoA还原酶在区别NADPH和NADH的能力方面有差异。参见,例如,Hedl等人,Journal of Bacteriology 186(7):1927-1932(2004)。下面提供了精选的II类HMG-CoA还原酶的辅因助子特异性。
表1.精选的II类HMG-CoA还原酶的辅因助子特异性
对本文所提供的组合物和方法有用的HMG-CoA还原酶包括能够利用NADH作为辅助因子的HMG-CoA还原酶,例如,来自甲羟戊酸假单胞菌,超嗜热古菌或金黄色葡萄球菌的HMG-CoA还原酶。在具体的实施方案中,HMG-CoA还原酶仅能够利用NADH作为辅助因子,例如,来自甲羟戊酸假单胞菌,S.pomeroyi或食酸戴尔福特菌的HMG-CoA还原酶。
在一些实施方案中,使用NADH的HMG-CoA还原酶来自甲羟戊酸假单胞菌。之前已描述编码HMG-CoA还原酶(EC 1.1.1.88)的甲羟戊酸假单胞菌的野生型mvaA基因序列,参见Beach和Rodwell,J.Bacteriol.171:2994-3001(1989)。甲羟戊酸假单胞菌的典型的mvaA核苷酸序列包括登记号M24015,和本文所提供的SEQ ID NO:21。甲羟戊酸假单胞菌的典型的HMG-CoA还原酶蛋白质序列包括登记号AAA25837,P13702,MVAA_PSEMV,和本文所提供的SEQ ID NO:22。
在一些实施方案中,所述使用NADH的HMG-CoA还原酶来自Silicibacter pomeroyi。Silicibacter pomeroyi的典型的HMG-CoA还原酶核苷酸序列包括登记号NC_006569.1,和本文所提供的SEQ ID NO:23。Silicibacter pomeroyi典型的HMG-CoA还原酶蛋白质序列包括登记号YP_164994,和本文所提供的SEQ ID NO:24。
在一些实施方案中,所述使用NADH的HMG-CoA还原酶来自食酸戴尔福特菌。食酸戴尔福特菌典型的HMG-CoA还原酶核苷酸序列包括NC_010002区域:补体(319980..321269),和本文所提供SEQ ID NO:25。食酸戴尔福特菌典型的HMG-CoA还原酶蛋白质序列包括登记号YP_001561318,和本文所提供的SEQ ID NO:26。
在一些实施方案中,所述使用NADH的HMG-CoA还原酶来自马铃薯(Crane等人,J.Plant Physiol.159:1301-1307(2002))。
所述使用NADH的HMG-CoA还原酶也在本文所提供的组合物和方法中有效,其包括被称为是本文所描述的任意使用NADH的HMG-CoA还原酶的“衍生物”的那些分子,所述使用NADH的HMG-CoA还原酶例如,来自甲羟戊酸假单胞菌,S.pomeroyi和食酸戴尔福特菌。这样的“衍生物”具有以下特点:(1)它与本文所描述的任意使用NADH的HMG-CoA还原酶享有实质同源性;和(2)能够催化(S)-HMG-CoA还原脱酰化为(R)-甲羟戊酸,同时优先利用NADH作为辅助因子。如果所述使用NADH的HMG-CoA还原酶衍生物的氨基酸序列与使用NADH的HMG-CoA还原酶的氨基酸序列至少80%,更优选至少90%,最优选至少95%相同,则可以说使用NADH的HMG-CoA还原酶的衍生物与使用NADH的HMG-CoA还原酶享有“实质同源性”。
如本文所使用的短语“使用NADH的”是指使用NADH的HMG-CoA还原酶对NADH作为辅助因子的选择性胜过对NADPH作为辅助因子的选择性,例如,对NADH比对NADPH表现了更高的比活性。在一些实施方案中,将对NADH作为辅助因子的选择性表示为kcat(NADH)/kcat(NADPH)比率。在一些实施方案中,使用NADH的HMG-CoA还原酶具有至少5,10,15,20,25或大于25的kcat(NADH)/kcat(NADPH)比率。在一些实施方案中,使用NADH的HMG-CoA还原酶仅仅使用NADH。例如,利用作为体外唯一辅助因子提供的NADH,仅仅使用NADH的使用NADH的HMG-CoA还原酶表现出一些活性,并且当NADPH作为唯一辅助因子提供时,没有表现出可检测的活性。可利用本领域已知的用于测定辅助因子特异性的任何方法来确定具有NADH作为辅助因子偏好的HMG-CoA还原酶,包括那些由Kim等人,Protein Science 9:1226-1234(2000)和Wilding等人,J.Bacteriol.182(18):5147-52(2000)所描述的,其整体内容并入本文。
在一些实施方案中,使用NADH的HMG-CoA还原酶被工程化改造成对NADH的选择性超过NAPDH,例如,通过辅助因子结合口袋的定点诱变。设计NADH选择性的方法在Watanabe等人,Microbiology153:3044-3054(2007)中进行了描述,并且用于测定HMG-CoA还原酶的辅助因子特异性的方法在Kim等人,Protein Sci.9:1226-1234(2000)中有描述,其整体内容通过引用并入本文。
在一些实施方案中,使用NADH的HMG-CoA还原酶来源于宿主物种,所述宿主物种天然地包括甲羟戊酸降解途径,例如宿主物种使甲羟戊酸分解代谢作为其唯一的碳源。在这些实施方案中,所述在其天然的宿主细胞中通常催化内在化的(R)-甲羟戊酸氧化酰化为(S)-HMG-CoA的使用NADH的HMG-CoA还原酶,在包含甲羟戊酸生物合成途径的经遗传修饰的宿主细胞中,被用来催化(S)-HMG-CoA还原脱酰化为(R)-甲羟戊酸这样的逆反应。能够在作为原核细胞唯一的碳源的甲羟戊酸上生长的原核细胞已由Anderson等人,J.Bacteriol,171(12):6468-6472(1989);Beach等人,J.Bacteriol.171:2994-3001(1989);Bensch等人,J.Biol.Chem.245:3755-3762;Fimongnari等人,Biochemistry 4:2086-2090(1965);Siddiqi等人,Biochem.Biophys.Res.Commun.8:110-113(1962);Siddiqi等人,J.Bacteriol.93:207-214(1967);和Takatsuji等人,Biochem.Biophys.Res.Commun.110:187-193(1983)所描述,其整体内容通过引用并入本文。
在本文所提供的组合物和方法的一些实施方案中,所述宿主细胞既包含使用NADH的HMGr又包含使用NADPH的HMG-CoA还原酶。编码使用NADPH的HMG-CoA还原酶的核苷酸序列的示例性实例包括,但不限制于:(NM_206548;黑腹果蝇),(NC_002758,基因座标记SAV2545,GeneID 1122570;金黄色葡萄球菌),(AB015627;链霉菌KO 3988),(AX128213,提供编码截短的HMG-CoA还原酶的序列;酿酒酵母)和(NC_001145:补体(115734.118898;酿酒酵母)。
5.6.4甲羟戊酸转换为甲羟戊酸-5-磷酸
在一些实施方案中,所述宿主细胞包含编码酶的异源核苷酸序列,所述酶可以将甲羟戊酸转换为甲羟戊酸5-磷酸,例如,甲羟戊酸激酶。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(L77688;拟南芥)和(X55875;酿酒酵母)。
5.6.5甲羟戊酸-5-磷酸转换为甲羟戊酸-5-焦磷酸
在一些实施方案中,所述宿主细胞包含编码酶的异源核苷酸序列,所述酶可以将甲羟戊酸5-磷酸转换为甲羟戊酸5-焦磷酸,例如,磷酸甲羟戊酸激酶。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(AF429385;橡胶树),(NM_006556;智人)和(NC_001145.补体712315.713670;酿酒酵母)。
5.6.6甲羟戊酸-5-焦磷酸转换为IPP
在一些实施方案中,所述宿主细胞包含编码酶的异源核苷酸序列,所述酶可以将甲羟戊酸5-焦磷酸转换为异戊烯二磷酸(IPP),例如,甲羟戊酸焦磷酸脱羧酶。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(X97557;酿酒酵母),(AF290095;屎肠球菌)和(U49260;智人)。
5.6.7 IPP转换为DMAPP
在一些实施方案中,所述宿主细胞还包含编码酶的异源核苷酸序列,所述酶可以通过MEV途径将生成的IPP转换为二甲基烯丙基焦磷酸(DMAPP),例如,IPP异构酶。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(NC_000913,3031087.3031635;大肠杆菌)和(AF082326;雨生红球藻)。
5.6.8聚异戊二烯合成酶
在一些实施方案中,所述宿主细胞还包含编码聚异戊二烯合成酶的异源核苷酸序列,所述酶可以使IPP和/或DMAPP的分子缩合形成含有超过5个碳的聚异戊二烯类化合物。
在一些实施方案中,所述宿主细胞包含编码酶的异源核苷酸序列,所述酶可以使一分子IPP和一分子DMAPP缩合形成一分子的香叶基焦磷酸(“GPP”),例如,GPP合成酶。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(AF513111;北美冷杉(Abies grandis)),(AF513112;北美冷杉),(AF513113;北美冷杉),(AY534686;金鱼草),(AY534687;金鱼草),(Y17376;拟南芥),(AE016877,基因座AP11092;蜡样芽胞杆菌;ATCC 14579),(AJ243739;甜橙),(AY534745;仙女扇(Clarkia breweri)),(AY953508;松小蠹(Ips pini)),(DQ286930;西红柿),(AF182828;胡椒薄荷),(AF182827;胡椒薄荷),(MPI249453;胡椒薄荷),(PZE431697,基因座CAD24425;Paracoccus zeaxanthinifaciens),(AY866498;库洛胡黄连),(AY351862;葡萄)和(AF203881,基因座AAF12843;运动发酵单胞菌)。
在一些实施方案中,所述宿主细胞包含编码酶的异源核苷酸序列,所述酶可以使两分子IPP和一分子DMAPP缩合,或在GPP分子中添加IPP分子,以缩合形成法尼基焦磷酸(“FPP”),例如,FPP合成酶。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(ATU80605;拟南芥),(ATHFPS2R;拟南芥),(AAU36376;黄花蒿),(AF461050;普通牛(Bos taurus)),(D00694;大肠埃希氏杆菌K-12),(AE009951,基因座AAL95523;具核梭杆菌多核亚种ATCC 25586),(GFFPPSGEN;藤仓赤霉),(CP000009,基因座AAW60034;氧化葡糖杆菌621H),(AF019892;向日葵),(HUMFAPS;智人),(KLPFPSQCR;乳酸克鲁维酵母),(LAU15777;白羽扇豆),(LAU20771;白羽扇豆),(AF309508;小家鼠),(NCFPPSGEN;粗糙脉孢菌),(PAFPS1;灰白银胶菊(Parthenium argentatum)),(PAFPS2;灰白银胶菊),(RATFAPS;褐家鼠),(YSCFPP;酿酒酵母),(D89104;粟酒裂殖酵母),(CP000003,基因座AAT87386;酿脓链球菌),(CP000017,基因座AAZ51849;酿脓链球菌),(NC_008022,基因座YP_598856;酿脓链球菌MGAS10270),(NC_008023,基因座YP_600845;酿脓链球菌MGAS2096),(NC_008024,基因座YP_602832;酿脓链球菌MGAS10750),(MZEFPS;玉米),(AE000657,基因座AAC06913;超嗜热菌(Aquifex aeolicus)VF5),(NM_202836;拟南芥),(D84432,基因座BAA12575;枯草芽孢杆菌),(U12678,基因座AAC28894;慢生型大豆根瘤菌USDA 110),(BACFDPS;嗜热脂肪土芽孢杆菌),(NC_002940,基因座NP_873754;杜克雷嗜血杆菌35000HP),(L42023,基因座AAC23087;流感嗜血杆菌Rd KW20),(J05262;智人),(YP_395294;清酒乳杆菌清酒亚种23K),(NC_005823,基因座YP_000273;Leptospira interrogans serovar Copenhageni str.Fiocruz L1-130),(AB003187;藤黄微球菌),(NC_002946,基因座YP_208768;淋病奈瑟氏菌FA 1090),(U00090,基因座AAB91752;根瘤菌NGR234),(J05091;酿酒酵母),(CP000031,基因座AAV93568;Silicibacter pomeroyi DSS-3),(AE008481,基因座AAK99890;肺炎链球菌R6)和(NC_004556,基因座NP 779706;叶缘焦枯病菌Temecula1(Xylella fastidiosa Temeculal))。
在一些实施方案中,所述宿主细胞还包含编码酶的异源核苷酸序列,所述酶可以结合IPP和DMAPP,或IPP和FPP,以形成香叶基香叶基焦磷酸(“GGPP”)。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:(ATHGERPYRS;拟南芥),(BT005328;拟南芥),(NM_119845;拟南芥),(NZ_AAJM01000380,基因座ZP_00743052;苏云金芽孢杆菌以色列血清型(Bacillus thuringiensis serovar israelensis),ATCC 35646 sq1563),(CRGGPPS;长春花),(NZ_AABF02000074,基因座ZP_00144509;具核梭杆菌文氏亚种,ATCC 49256),(GFGGPPSGN;藤仓赤霉),(AY371321;银杏),(AB055496;橡胶树),(AB017971;智人),(MCI276129;Mucor circinelloides f.lusitanicus),(AB016044;小家鼠),(AABX01000298,基因座NCU01427;粗糙脉孢菌),(NCU20940;粗糙脉孢菌),(NZ_AAKL01000008,基因座ZP_00943566;青枯雷尔氏菌UW551)(AB118238;褐家鼠),(SCU31632;酿酒酵母),(AB016095;细长聚球藻),(SAGGPS;白芥子),(SSOGDS;嗜酸热硫化叶菌),(NC_007759,基因座YP_461832;酸养互营菌(Syntrophus aciditrophicus)SB),(NC_006840,基因座YP_204095;费氏弧菌ES114),(NM_112315;拟南芥),(ERWCRTE;成团泛菌),(D90087,基因座BAA14124;菠萝泛菌),(X52291,基因座CAA36538;荚膜红细菌),(AF195122,基因座AAF24294;球形红细菌)和(NC_004350,基因座NP_721015;变形链球菌UA159)。
5.6.9萜类合成酶
在一些实施方案中,所述宿主细胞还包含编码酶的异源核苷酸序列,所述酶可以修饰聚异戊二烯以形成半萜,单萜,倍半萜烯,二萜,三萜,四萜,多萜,类固醇化合物,类胡萝卜素,或改性的类异戊二烯化合物。
在一些实施方案中,异源核苷酸编码蒈烯合酶。合适的苷酸序列的示例性实例包括,但不限制于:(AF461460,区域43.1926;欧洲云杉)和(AF527416,区域:78.1871;狭长叶鼠尾草)。
在一些实施方案中,异源核苷酸编码香叶醇合酶。合适的核苷酸序列的示例性实例包括,但不限制于:(AJ457070;细毛樟),(AY362553;罗勒),(DQ234300;紫苏菌株1864),(DQ234299;紫苏柠檬桉(Perilla citriodora)菌株1861),(DQ234298;紫苏柠檬桉(Perilla citriodora)菌株4935),和(DQ088667;紫苏柠檬桉(Perilla citriodora))。
在一些实施方案中,异源核苷酸编码芳樟醇合酶。合适的核苷酸序列的示例性实例包括,但不限制于:(AF497485;拟南芥),(AC002294,基因座AAB71482;拟南芥),(AY059757;拟南芥),(NM_104793;拟南芥),(AF154124;黄花蒿),(AF067603;仙女扇),(AF067602;优雅春再来),(AF067601;仙女扇),(U58314;仙女扇),(AY840091;番茄),(DQ263741;薰衣草),(AY083653;柠檬薄荷),(AY693647;罗勒),(XM_463918;水稻),(AP004078,基因座BAD07605;水稻),(XM_463918,基因座XP_463918;水稻),(AY917193;紫苏柠檬桉),(AF271259;紫苏)(AY473623;欧洲云杉),(DQ195274;北美云杉)和(AF444798;皱紫苏栽培变种(Perilla frutescens var.crispa cultivar)No.79)。
在一些实施方案中,异源核苷酸编码柠檬烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:(+)-柠檬烯合酶(AF514287,区域:47.1867;柠檬)和(AY055214,区域:48.1889;藿香)和(-)-柠檬烯合酶(DQ195275,地区:1.1905;北美云杉),(AF006193,地区:73.1986;北美冷杉),和(MHC4SLSP,地区:29.1828;留兰香)。
在一些实施方案中,异源核苷酸编码月桂烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:(U87908;北美冷杉),(AY195609;金鱼草),(AY195608;金鱼草),(NM_127982;拟南芥TPS10),(NM_113485;拟南芥ATTPS-CIN),(NM_113483;拟南芥ATTPS-CIN),(AF271259;紫苏),(AY473626;欧洲云杉),(AF369919;欧洲云杉),和(AJ304839;冬青栎)。
在一些实施方案中,异源核苷酸编码罗勒烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:(AY195607;金鱼草),(AY195609;金鱼草),(AY195608;金鱼草),(AK221024;拟南芥),(NM_113485;拟南芥ATTPS-CIN),(NM_113483;拟南芥ATTPS-CIN),(NM_117775;拟南芥ATTPS03),(NM_001036574;拟南芥ATTPS03),(NM_127982;拟南芥TPS10),(AB110642;蜜柑CitMTSL4)和(AY575970;光叶百脉根(Lotus corniculatus var.japonicus))。
在一些实施方案中,异源核苷酸编码α-蒎烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:(+)α-蒎烯合酶(AF543530,区域:1.1887;火炬松),(-)α-蒎烯合酶(AF543527,区域:32.1921;火炬松),和(+)/(-)α-蒎烯合酶(AGU87909,区域:6111892;北美冷杉)。
在一些实施方案中,异源核苷酸编码β-蒎烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:(-)β-蒎烯合酶(AF276072,区域:1.1749;黄花蒿)和(AF514288,区域:26.1834;柠檬)。
在一些实施方案中,异源核苷酸编码桧烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:AF051901,区域:26.1798,来自鼠尾草。
在一些实施方案中,异源核苷酸编码γ-萜品烯合酶。合适的核苷酸序列的示例性实例包括:(AF514286,区域:30.183来自柠檬)和(AB110640,区域1.1803,来自蜜柑)。
在一些实施方案中,异源核苷酸编码萜品油烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:(AY693650来自罗勒)和(AY906866,区域:10.1887,来自花旗松)。
在一些实施方案中,异源核苷酸编码紫穗槐二烯合酶。合适的核苷酸序列的示例性实例是美国专利公开号2004/0005678的SEQ ID NO.37。
在一些实施方案中,异源核苷酸编码α-法呢烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:DQ309034,来自西洋梨品种安久梨(Pyrus communis cultivar d′Anjou)(梨;基因名AFS1),和AY182241,来自苹果(苹果;基因AFS1)。Pechouus等人,Planta 219(1):84-94(2004)。
在一些实施方案中,异源核苷酸编码β-法呢烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于:来自胡椒薄荷(薄荷;基因Tspa11)的登记号AF024615,和来自黄花蒿的AY835398。Picaud等人,Phytochemistry66(9):961-967(2005)。
在一些实施方案中,异源核苷酸编码法尼醇合酶。合适的核苷酸序列的示例性实例包括,但不限制于:来自玉米的登记号AF529266和来自酿酒酵母(基因Pho8)的YDR481C。Song,L.,Applied Biochemistry and Biotechnology 128:149-158(2006)。
在一些实施方案中,异源核苷酸编码橙花叔醇合酶。合适的核苷酸序列的示例性实例包括,但不限制于来自玉米(玉米;基因tps1)的AF529266。
在一些实施方案中,异源核苷酸编码广藿香醇合酶。合适的核苷酸序列的示例性实例包括,但不限制于来自广藿香的AY508730区域:1.1659。
在一些实施方案中,异源核苷酸编码诺卡酮合酶。合适的核苷酸序列的示例性实例包括,但不限制于来自甜橙的AF441124区域:1.1647和来自紫苏的AY917195区域:1.1653。
在一些实施方案中,异源核苷酸编码松香二烯合酶。合适的核苷酸序列的示例性实例包括,但不限制于(U50768;北美冷杉)和(AY473621;欧洲云杉)。
在一些实施方案中,宿主细胞产生C5类异戊二烯。这些化合物衍生自一个异戊二烯单元,也被称为半萜。半萜的示例性实例是异戊二烯。在其它实施方案中,所述类异戊二烯是C10类异戊二烯。这些化合物物衍生自2个异戊二烯单元,也被称为单萜。单萜示例性实例是柠檬烯,香茅醇(citranellol),香叶醇,薄荷醇,紫苏醇,芳樟醇,侧柏酮和月桂烯。在其它实施方案中,所述的类异戊二烯是C15类异戊二烯。这些化合物物衍生自3个异戊二烯单元,也被称为倍半萜烯。倍半萜烯的示例性实例是蜚蠊酮B,内酯B(gingkolide B),紫穗槐二烯,青蒿素,青蒿酸,朱栾倍半萜,诺卡酮,epi-雪松醇,epi-马兜铃烯,法尼醇,棉酚,蛔蒿素(sanonin),蜚蠊酮,毛喉素和广藿香(patchoulol)(其也被称为百秋李醇(patchouli alcohol))。在其它实施方案中,所述类异戊二烯是C20的类异戊二烯。这些化合物物衍生自4个异戊二烯单元,也称为二萜。二萜的示例性实例是蓖麻烯,五加素,紫杉醇(paclitaxel),蔓生素(prostratin),伪蕨素(pseudopterosin)和紫杉烯(taxadiene)。在其它实施方案中,所述类异戊二烯是C20+类异戊二烯。这些化合物衍生自多于四个的异戊二烯单元,且包括:三萜类化合物(源自于6个异戊二烯单元的C30类异戊二烯化合物),诸如阿布糖苷E(arbrusideE),鸦胆丁,睾酮,黄体酮,可的松,洋地黄毒苷和角鲨烯;四萜烯(源自于8个类异戊二烯的C40类异戊二烯化合物)诸如β-胡萝卜素;和多萜(源自于多于8个的异戊二烯单元的C40+类异戊二烯化合物)诸如聚异戊二烯。在一些实施方案中,所述类异戊二烯选自包含以下的组:松香二烯,紫穗槐二烯,蒈烯,α-法呢烯,β-法呢烯,金合欢醇,香叶醇,香叶基香叶醇,异戊二烯,芳樟醇,柠檬烯,月桂烯,橙花叔醇,罗勒烯,广藿香醇,β-蒎烯,桧烯,γ-萜品烯,萜品油烯和朱栾倍半萜。所述类异戊二烯化合物还包括,但不限于,类胡萝卜素(如番茄红素,α-和β胡萝卜素,α-和β-隐黄质,胭脂素,玉米黄质,虾青素和叶黄素),类固醇化合物,以及由经其它化学基团修饰的类异戊二烯组成的化合物,诸如混合的萜烯-生物碱和辅酶Q-10。
5.6.10生产类异戊二烯的方法
在另一个方面,本文中提供了用于生产类异戊二烯的方法,所述方法包括以下步骤:(a)培养任意本文所述经遗传修饰的宿主细胞的种群,在适合于制造类异戊二烯化合物的条件下,所述经遗传修饰的宿主细胞能够在具有碳源的培养基中产生在类异戊二烯;和(b)从培养基中回收所述的类异戊二烯化合物。
在一些实施方案中,所述经遗传修饰的宿主细胞包含选自下述所构成的组中的一种或多种修饰:磷酸转酮酶的异源表达,磷酸转乙酰酶的异源表达,甲羟戊酸途径的一种或多种酶的异源表达;以及可选择地,ADA的异源表达,使用NADH的HMG-CoA还原酶的异源表达,和AACS的异源表达;并且经遗传修饰的宿主细胞与不含有一种或多种修饰的亲本细胞或者仅包含所述遗传修饰的宿主细胞的一种或多种修饰的子集的亲本细胞(但是其它基因相同)相比,产生更多量的类异戊二烯化合物。在一些实施方案中,增加的量为至少1%,5%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%,95%,100%或大于100%,例如,在产率,产量,生产力方面,以克每升细胞培养物,毫克每克干细胞重,以每单位体积的细胞培养物计,以每单位干细胞重计,以每单位体积细胞培养物每单位时间计,或以每单位干细胞重每单位时间计所测量的。
在一些实施方案中,所述宿主细胞产生类异戊二烯的水平升高,其大于约10克每升发酵培养基。在一些这样的实施方案中,每升细胞培养物产生所述类异戊二烯的量从约10至约50克,大于约15克,大于约20克,大于约25克,或大于约30克。
在一些实施方案中,所述宿主细胞产生类异戊二烯的水平升高,其大于约50毫克每克干细胞重。在一些这样的实施方案中,每克干细胞重产生所述类异戊二烯的量从约50至约1500毫克,大于约100毫克,大于约150毫克,大于约200毫克,大于约250毫克,大于约500毫克,大于约750毫克,或大于约1000毫克。
在一些实施方案中,所述宿主细胞产生类异戊二烯的水平升高,其以每单位体积细胞培养物计,比亲本细胞产生类异戊二烯的水平高至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约60%,至少约70%,至少约80%,至少约90%,至少约2倍,至少约2.5倍,至少约5倍,至少约10倍,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约75倍,至少约100倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍,或至少约1000倍,或更多。
在一些实施方案中,所述宿主细胞产生类异戊二烯的水平升高,其以每单位重量干细胞计,比亲本细胞产生类异戊二烯的水平高至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约60%,至少约70%,至少约80%,至少约90%,至少约2倍,至少约2.5倍,至少约5倍,至少约10倍,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约75倍,至少约100倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍,或至少约1000倍,或更多。
在一些实施方案中,所述宿主细胞产生类异戊二烯的水平升高,其以每单位体积细胞培养物每单位时间计,比亲本细胞产生类异戊二烯的水平高至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约60%,至少约70%,至少约80%,至少约90%,至少约2倍,至少约2.5倍,至少约5倍,至少约10倍,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约75倍,至少约100倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍,或至少约1000倍,或更多。
在一些实施方案中,所述宿主细胞产生类异戊二烯的水平升高,其以每单位干细胞重量每单位时间计,比亲本细胞产生类异戊二烯的水平高至至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约60%,至少约70%,至少约80%,至少约90%,至少约2倍,至少约2.5倍,至少约5倍,至少约10倍,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约75倍,至少约100倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍,或至少约1000倍,或更多。
在大多数实施方案中,所述宿主细胞产生的类异戊二烯的水平升高,这是通过诱导化合物引起的。在不存在诱导化合物的情况下可轻松操作这样的宿主细胞。然后加入所述诱导化合物以诱导宿主细胞产生的类异戊二烯的水平升高。在其它实施方案中,通过改变培养条件(例如,诸如生长温度,培养基成分等等)使得宿主细胞产生的类异戊二烯的水平升高。
5.6.11培养基和条件
用于微生物培养物的维护和生长的材料及方法是微生物学或发酵科学领域中的技术人员熟知的(参见,例如,Bailey等人,Biochemical Engineering Fundamentals,second edition,McGraw Hill,纽约,1986)。必须考虑合适的培养基,pH,温度,和对需氧,微需氧,或厌氧条件的要求,这取决于宿主细胞,发酵和该过程的具体要求。
本文所提供的制备类异戊二烯的方法可以在适宜容器中合适的培养基(例如,有或没有泛酸盐补充)中执行,所述容器包括但不限于细胞培养板,烧瓶,或发酵罐。此外,所述方法可以在本领域已知的任何发酵规模下执行,以支持微生物产品的工业生产。可使用的任何合适的发酵罐,包括搅拌釜发酵罐,气升式发酵罐,鼓泡式发酵罐,或它们的任意组合。在利用酿酒酵母作为宿主细胞的具体实施方案中,菌株可在发酵罐中生长,如Kosaric等人(Kosaric等人,in Ullmann′s Encyclopedia of Industrial Chemistry,Sixth Edition,Volume 12,pages 398-473,Wiley-VCH Verlag GmbH&Co.KDaA,Weinheim,Germany)详细描述的。
在一些实施方案中,所述培养基是能够产生类异戊二烯的遗传修饰的微生物在其中可以生存的任何培养基,所述生存即维持生长和活力。在一些实施方案中,所述培养基是含有可吸收碳,氮和磷源的水性培养基。这种培养基还可包括适当的盐,矿物质,金属和其他营养物质。在一些实施方案中,递增地或连续地添加碳源和每种必要的细胞营养物到发酵培养基中,并且每种所需的营养物基本上被维持在生长细胞的有效吸收所需的最低水平,例如,根据基于细胞将碳源转化为生物量(biomass)的代谢或呼吸功能的预先确定的细胞生长曲线。
用于培养微生物的适宜条件和适用培养基是本领域所熟知的。在一些实施方案中,在适用的培养基中添加一种或多种附加的试剂,例如,诸如诱导剂(例如,当编码基因产物的一种或多种核苷酸序列在诱导型启动子的控制之下时),阻遏剂(例如,当编码基因产物的一种或多种核苷酸序列在阻抑型启动子的控制之下时),或选择剂(例如,用于选择包含遗传修饰的微生物的抗生素)。
在一些实施方案中,所述碳源是单糖(简单糖),二糖,多糖,非发酵的碳源,或它们的一个或多个组合。合适的单糖的非限制性实例包括葡萄糖,半乳糖,甘露糖,果糖,木糖,核糖,以及它们的组合。合适的二糖的非限制性实例包括蔗糖,乳糖,麦芽糖,海藻糖,纤维二糖,以及它们的组合。合适的多糖的非限制性实例包括淀粉,糖原,纤维素,壳多糖,以及它们的组合。合适的非发酵碳源的非限制性实例包括乙酸根离子和甘油。
在培养基中的碳源浓度(如葡萄糖)应当促进细胞生长,但不应高到抑制所使用的微生物的生长。通常,以实现期望水平的生长和生物质的水平、但以不可检测的水平(检测限为约<0.1g/l)添加碳源(诸如葡萄糖)来运行培养物。在其它施方案中,在培养基中的碳源浓度(如葡萄糖)大于约1g/L,优选大于约2g/L,且更优选大于约5g/L。此外,培养基中的碳源(如葡萄糖)浓度通常小于约100g/L,优选小于约50g/L,且更优选小于约20g/L。需要注意的是,提及的培养物组分浓度可以指最初的和/或进行中的组分浓度。在某些情况下,可能需要在培养期间让培养基中的碳源耗尽。
可以用于适用的培养基中的可吸收氮源包括,但不限制于,简单氮源,有机氮源和复合氮源。这些氮源包括无水氨,铵盐和动物、植物和/或微生物来源的物质。合适的氮源包括,但不限制于,蛋白质水解物,微生物量(microbial biomass)水解物,蛋白胨,酵母提取物,硫酸铵,尿素,和氨基酸。通常情况下,在培养基中的氮源浓度大于约0.1g/L,优选大于约0.25g/L,且更优选大于约1.0g/L。然而超过一定的浓度,向培养基中添加氮源不利于微生物的生长。因此,培养基中的氮源浓度小于约20g/L,优选小于约10g/L,且更优选小于约5g/L。此外,在某些情况下,可能需要在培养期间让培养基中的氮源耗尽。
有效的培养基可含有其它化合物,诸如无机盐,维生素,微量金属或生长促进剂。这样的其它化合物也可以存在于所述有效培养基的碳、氮或矿物质源中或者可以特定地加入到培养基中。
所述培养基还可以含有适当的磷酸(phosphate)源。这样的磷酸源包括无机和有机磷酸源。优选的磷酸源包括,但不限制于,磷酸盐,例如磷酸二氢钠或磷酸氢二钠、磷酸二氢钾或磷酸氢二钾、磷酸铵及其混合物。通常情况下,在培养基中的磷酸盐浓度大于约1.0g/L,优选大于约2.0g/L,且更优选大于约5.0g/L。然而超过一定的浓度,向培养基中添加磷酸盐不利于微生物的生长。因此,培养基中的磷酸盐浓度通常小于约20g/L,优选小于约15g/L,且更优选小于约10g/L。
合适的培养基中也可以包含镁源,,优选以生理学上可接受的盐的形式,如七水硫酸镁,尽管可以以提供类似量的镁的浓度使用其它镁源。通常情况下,在培养基中的镁浓度大于约0.5g/L,优选大于约1.0g/L,且更优选大于约2.0g/L。然而超过一定的浓度,向培养基中添加镁不利于微生物的生长。因此,培养基中的镁浓度通常小于约10g/L,优选小于约5g/L,且更优选小于约3g/L。此外,在某些情况下,可能需要在培养期间让培养基中的镁源耗尽。
在一些实施方案中,所述培养基还可以包含生物学上可接受的螯合剂,如柠檬酸三钠二水合物。在这样的情况下,培养基中的螯合剂浓度大于约0.2g/L,优选大于约0.5g/L,且更优选大于约1g/L。然而超过一定的浓度,向培养基中添加螯合剂不利于微生物的生长。因此,培养基中的螯合剂浓度通常小于约10g/L,优选小于约5g/L,且更优选小于约2g/L。
所述培养基最初还可以包含生物学上可接受的酸或碱,以维持培养基的所需的pH值。生物学上可接受的酸包括但不限制于,盐酸,硫酸,硝酸,磷酸和它们的混合物。生物学上可接受的碱包括但不限制于,氢氧化铵,氢氧化钠,氢氧化钾和它们的混合物。在一些实施方案中,所用的碱是氢氧化铵。
所述培养基还可以包含生物学上可接受的钙源,包括但不限制于,氯化钙。通常情况下,培养基中的钙源(如氯化钙二水合物)浓度在约5mg/L至约2000mg/L的范围内,优选从约20mg/L至约1000mg/L的范围内,且更优选从约50mg/L至约500mg/L的范围内。
所述培养基也可以包含氯化钠。通常情况下,培养基中的氯化钠的浓度在约0.1g/L至约5g/L的范围内,优选从约1g/L至约4g/L的范围内,且更优选从约2g/L至约4g/L的范围内。
在一些实施方案中,所述培养基还可以包含微量金属。这样的微量金属可以作为储备溶液添加到培养基中,为了方便起见,所述储备溶液可以与培养基的其余组分分开配制。通常情况下,添加到培养基中的该微量金属溶液的量大于约1ml/L,优选大于约5ml/L,且更优选大于约10ml/L。然而超过一定的浓度,向培养基中添加微量金属不利于微生物的生长。因此,添加到培养基中的该微量金属溶液的量通常小于约100ml/L,优选小于约50ml/L,且更优选小于约30ml/L。需要注意的是,除以储备溶液中添加微量金属之外,各个组分可以单独添加,每个组分在各自所对应组分的量的范围内,所述组分的量由微量金属溶液的上述范围指示。
所述培养基可以包含其它维生素,如泛酸盐,生物素,钙,纤维醇,吡哆醇-HCl和硫胺素-HCl。这样的维生素可以作为储备溶液添加到培养基中,为了方便起见,所述储备溶液可以与培养基的其余组分分开配制。然而超过一定的浓度,向培养基中添加维生素不利于微生物的生长。
本文所述的发酵方法可以在常规的培养模式下执行,其包括但不限制于,分批培养,流加培养(fed-batch),细胞再循环,连续和半连续培养。在一些实施方案中,所述发酵以流加培养模式执行。在这样的情况下,培养基中的一些组分在培养过程中被耗尽,包括在发酵生产阶段的泛酸盐。在一些实施方案中,在开始时可以在培养物中添加相对高浓度的这些组分,例如,在生产阶段,在需要添加之前以便于支持一段时间的生长和/或类异戊二烯的生产。在整个培养中,这些组分的优选范围通过以培养物消耗的水平进行添加来维持。培养基中的组分水平可以通过以下监测,例如,周期性地对培养基采样并测定其浓度。或者,一旦开发出标准培养过程,在整个培养中,可以在特定时间的已知水平所对应的时间间隔进行添加。如将由本领域技术人员所公认的,在培养过程中随着培养基的细胞密度增加,营养消耗的速率增加。此外,为避免在培养基中引入外来的微生物,使用本领域已知的无菌添加方法进行添加。另外,在培养过程中可添加少量的消泡剂。
所述培养基的温度可以是适合于遗传修饰的细胞生长和/或类异戊二烯生产的任何温度。例如,在培养基中接种接种物之前,培养基可采用并维持在约从20℃至约45℃的温度范围内,优选的温度范围为从约25℃至约40℃,且更优选的温度范围为从约28℃至约32℃。
培养基的pH值可通过向培养基中添加酸或碱来控制。在这样的情况下,当使用氨控制pH时,它也在培养基中便利地用作氮源。优选地,所述pH值维持在约3.0至约8.0,更优选从约3.5至约7.0,且最优选从约4.0至约6.5。
在一些实施方案中,培养基的碳源浓度(如葡萄糖浓度)在培养过程中被监测。可以使用已知技术监测培养基中的葡萄糖浓度,例如,使用葡萄糖氧化酶酶试验或高压液相色谱法,所述技术可以用于监测上层清液中的葡萄糖浓度,例如,培养基中的无细胞成分。如上所述,所述碳源浓度应保持在低于细胞生长抑制发生的水平。虽然这样的浓度可以随微生物的不同而不同,但是对于葡萄糖作为碳源时,细胞生长抑制发生在大于约60g/L的葡萄糖浓度,并通过试验可以容易确定。因此,当使用葡萄糖用作碳源时,所述葡萄糖优选供给到发酵罐并保持低于检测限。或者,在培养基中的葡萄糖浓度保持在约1g/L至约100g/L的范围内,更优选从约2g/L至约50g/L的范围内,然而更优选从约5g/L至约20g/L的范围内。虽然通过添加例如基本纯的葡萄糖溶液可使碳源浓度维持在期望的水平之内,但可以接受的、并且可能是优选的是通过添加原始培养基的等分试样以维持培养基中的碳源浓度。使用原始培养基的等分试样可能是可取的,因为培养基中其它营养素的浓度(如氮和磷源)可以同时被维持。同样地,通过添加微量金属溶液的等分试样可以维持培养基中微量金属的浓度。
5.6.12类异戊二烯的回收
一旦由宿主细胞产生类异戊二烯,可以使用本领域已知的任何适合的分离和纯化方法来回收或分离类异戊二烯以便随后使用。在一些实施方案中,通过离心分离将包含类异戊二烯的有机相从发酵中分离。在其它实施方案中,包含类异戊二烯的有机相从发酵中自发分离。在其它实施方案中,通过添加破乳剂和/或成核剂到发酵反应中将包含类异戊二烯的有机相从发酵中分离。所述破乳剂的示例性实例包括絮凝剂和凝结剂。所述成核剂的示例性实例包括类异戊二烯本身的液滴和有机溶剂,诸如十二烷,肉豆蔻酸异丙酯(isopropyl myristrate)和油酸甲酯。
这些细胞产生的类异戊二烯可以存在于培养物上清液和/或与宿主细胞相关联。在类异戊二烯是与宿主细胞相关的实施方案中,回收类异戊二烯的方法可包括透化或裂解细胞。二者选一或同时地,培养基中的类异戊二烯可使用回收工艺来回收,所述回收工艺包括,但不限制于,色谱法,萃取,溶剂萃取,膜分离,电渗析,反渗透,蒸馏,化学衍生法和结晶。
在一些实施方案中,从其它可存在于有机相的产物中分离出类异戊二烯。在一些实施方案中,使用吸附,蒸馏,气-液萃取(汽提(stripping)),液-液萃取(溶剂萃取),超滤,和标准色谱技术实现分离。
5.7聚酮化合物
在一些实施方案中,本文所提供的经遗传修饰的宿主细胞能够从乙酰辅酶A产生聚酮化合物。聚酮化合物通过酶活性(被称为聚酮合酶(PKSs))的聚集所催化的连续反应合成,所述聚酮合酶是包含活性位点的协调基团的大型多酶蛋白复合物。聚酮化合物的生物合成逐步进行,从简单的2-,3-,4-碳构建模块(如乙酰辅酶A,丙酰辅酶A,丁酰辅酶A和它们的活性衍生物,丙二酰辅酶A,甲基丙二酰辅酶A和乙基丙二酰辅酶A)开始,主要经克莱森缩合反应通过丙二酰辅酶A衍生单元的脱羧缩合。PKS基因通常被安排在细菌的一个操纵子以及真核细胞的基因簇中。三种类型的聚酮合酶被表征:I型聚酮合酶是大型高度模块化的蛋白质,其被细分为两类:1)迭代型PKS,其以循环方式重复使用结构域和2)模块化PKS,其包含单独的模块序列并且不重复结构域。II型聚酮合酶是单功能蛋白质的聚合物,和III型聚酮合酶不使用酰基载体蛋白结构域。
不同于如下所述的脂肪酸的生物合成,其中的每个连续的链延伸步骤之后接着是按固定顺序的酮基还原(ketoreduction),脱水和烯酰还原,,而聚酮化合物生物合成的单个链延伸中间体经受所有、部分或没有官能团修饰,从而产生大量化学性质不同的产品。额外的复杂程度由使用不同的起始物单元和链延伸单元以及生成新的立体异构体造成。
完整的聚酮化合物合成的顺序由聚酮合酶进行如下引导(以N-末端至C-末端的顺序):启动或装载初始碳构建模块到酰基载体蛋白上,延伸催化增长的大环内酯链的伸长的模块和终端模块延伸,所述终端模块催化合成的大环内酯的释放。成分结构域或独立的酶功能在该生物合成中活跃,所述生物合成包括用于负载启动器、扩充器和中间酰基单元的酰基-转移酶;酰基载体蛋白保持增长的大环内酯物作为硫酯;β-酮-酰基合酶催化链延伸;β-酮还原酶负责第一还原为醇功能;脱水酶去除水得到的不饱和硫酯;烯酰还原酶催化最终还原到完全饱和;且巯基酯酶催化大环内酯物的释放和环化。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可使乙酰辅酶A和丙二酰辅酶A中的至少一个与酰基载体蛋白缩合,所述酶例如,酰基-转移酶。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可使选自由下述构成的组的第一反应物:乙酰辅酶A和丙二酰辅酶A,与选自由下述构成的组的第二反应物:丙二酰辅酶A或甲基丙二酰辅酶A缩合,以形成聚酮化合物产物,所述酶例如为,β-酮-酰基合酶。
在一些实施方案中,本文所公开的遗传修饰的微生物包含编码酶的异源核苷酸序列,所述酶可还原聚酮化合物上的β-酮化学基团以形成β-羟基基团,所述酶例如,β-酮还原酶。
在一些实施方案中,本文所公开的遗传修饰的微生物包含编码酶的异源核苷酸序列,所述酶可以使聚酮化合物的烷烃化学基团脱水以产生的α-β-不饱和烯烃,所述酶例如,脱水酶。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可以还原聚酮化合物的α-β-双键以产生饱和烷烃,所述酶例如,烯酰-还原酶。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可以使来自酰基载体蛋白的聚酮化合物水解,所述酶例如,硫酯酶。
在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含KS催化区域。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含AT催化区域。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的多于一种的异源核苷酸序列,所述酶包含AT催化区域。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含CLF催化区域。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含ACP活性。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的多于一种的异源核苷酸序列,所述酶包含ACP活性。
在具体的实施方案中,所述产生聚酮化合物的细胞包含最小的芳香族PKS系统,例如,异源核苷酸序列,所述异源核苷酸序列分别编码包含KS催化区域的酶,包含AT催化区域的酶,包含CLF催化区域的酶,和包含ACP活性的酶。在具体的实施方案中,所述产生聚酮化合物的细胞包含最小模块化的PKS系统,例如,异源核苷酸序列,所述异源核苷酸序列分别编码包含KS催化区域的酶,包含AT催化区域的酶,和包含ACP活性的酶。在另一个具体实施方案中,,所述产生聚酮化合物的细胞包含用于从头合成聚酮化合物的模块化芳香族PKS系统,例如,异源核苷酸序列,所述异源核苷酸序列分别编码包含KS催化区域的酶,包含AT催化区域的一种或多种酶,和包含ACP活性的一种或多种酶。
在一些实施方案中,所述产生聚酮化合物的细胞包含最小的PKS系统,例如,最小芳香族PKS系统或最小模块化PKS系统,还包括有助于最终产物聚酮化合物生产的附加催化活性。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含环化酶(CYC)催化区域,这有利于初生聚酮化合物主链的环化。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含酮还原酶(KR)催化区域。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含芳香化酶(ARO)催化区域。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含烯酰还原酶(ER)催化区域。在一些实施方案中,所述产生聚酮化合物的细胞包含编码酶的一种或多种异源核苷酸序列,所述酶包含硫酯酶(TE)催化区域。在一些实施方案中,所述产生聚酮化合物的细胞还包含编码酶的一种或多种异源核苷酸序列,所述酶包含完全ACP合酶活性,其产生ACP的泛酰巯基乙胺化(pantetheinylation)。
在一些实施方案中,所述产生聚酮化合物的细胞还包含赋予后合成聚酮化合物改性活性的一种或多种异源核苷酸序列。在一些实施方案中,所述产生聚酮化合物的细胞还包含编码酶的一种或多种异源核苷酸序列,所述酶包含糖基化酶活性,其产生聚酮化合物的后合成改性,例如,当期望得到具有抗菌活性的聚酮化合物时。在一些实施方案中,所述产生聚酮化合物的细胞还包含编码酶的一种或多种异源核苷酸序列,所述酶包含羟化酶活性。在一些实施方案中,所述产生聚酮化合物的细胞还包含编码酶的一种或多种异源核苷酸序列,所述酶包含环氧酶活性。在一些实施方案中,所述产生聚酮化合物的细胞还包含编码酶的一种或多种异源核苷酸序列,所述酶包含甲基化酶活性。
在一些实施方案中,所述产生聚酮化合物的细胞还包含编码生物合成酶的一种或多种异源核苷酸序列,所述酶包括,但不限制于,至少一种聚酮化合物合成途径酶,和可以改性乙酰辅酶A化合物以形成聚酮化合物产物的酶,所述聚酮化合物产物诸如大环内酯物,抗生素,抗真菌剂,细胞生长抑制化合物,抗胆甾醇血的化合物(anticholesterolemic),抗寄生虫化合物,抗球虫化合物,动物生长促进剂或杀虫剂。在一些实施方案中,HACD化合物是多烯。在一些实施方案中,所述HACD化合物是环状内酯。在一些实施方案中,所述HACD化合物包含14,15,或16元内酯环。在一些实施方案中,所述HACD化合物选自由下述构成的组的组:聚酮化合物大环内酯类,抗生素,抗真菌剂,细胞生长抑制剂,抗胆甾醇血剂,抗寄生虫药,抗球虫剂,动物生长促进剂和杀虫剂。
在一些实施方案中,所述产生聚酮化合物的细胞包含异源核苷酸序列,例如编码PKS酶和聚酮化合物改性酶的序列,其能够产生的聚酮化合物选自,但不限制于如下聚酮化合物:阿维菌素(参见,例如,U.S.Pat.No.5,252,474;U.S.Pat.No.4,703,009;EP Pub.No.118,367;MacNeil等人,1993,“Industrial Microorganisms:Basic and Applied Molecular Genetics”;Baltz,Hegeman,&Skatrud,eds.(ASM),pp.245-256,“A Comparison of the Genes Encoding the Polyketide Synthases for Avermectin,Erythromycin,and Nemadectin”;MacNeil等人,1992,Gene 115:119-125;和Ikeda and Omura,1997,Chem.Res.97:2599-2609);杀念珠菌素(FR008)(参见,例如,Hu等人,1994,Mol.Microbiol.14:163-172);碳霉素,居拉霉素(参见,例如,Bergh等人,Biotechnol Appl Biochem.1992 Feb;15(1):80-9);道诺霉素(参见,例如,J Bacteriol.1994 Oct;176(20):6270-80);埃博霉素(参见,例如,PCT Pub.No.99/66028;和PCT Pub.No.00/031247);红霉素(参见,例如,PCT Pub.No.93/13663;U.S.Pat.No.6,004,787;U.S.Pat.No.5,824,513;Donadio等人,1991,Science 252:675-9;和Cortes等人,Nov.8,1990,Nature 348:176-8);FK-506(参见,例如,Motamedi等人,1998;Eur.J Biochem.256:528-534;和Motamedi等人,1997,Eur.J Biochem.244:74-80);FK-520(参见,例如,PCT Pub.No.00/020601;和Nielsen等人,1991,Biochem.30:5789-96);灰霉素(Griseusin)(参见,例如,Yu等人,J Bacteriol.1994May;176(9):2627-34);洛伐他汀(参见,例如,U.S.Pat.No.5,744,350);富伦菌素(Frenolycin)(参见,例如,Khosla等人,Bacteriol.1993Apr;175(8):2197-204;和Bibb等人,Gene1994May 3;142(1):31-9);榴菌素(参见,例如,Sherman等人,EMBO J.1989Sep;8(9):2717-25;和Bechtold等人,Mol Gen Genet.1995 Sep20;248(5):610-20);曼得尔霉素(参见,例如,Ichinose等人,Microbiology2003Jul;149(Pt 7):1633-45);莫能菌素(参见,例如,Arrowsmith等人,Mol Gen Genet.1992 Aug;234(2):254-64);无活菌素(参见,例如,FEMS Microbiol Lett.2000 Feb 1;183(1):171-5);七尾霉素(参见,例如,Kitao等人,J Antibiot(Tokyo).1980 Jul;33(7):711-6);奈马克丁(参见,例如,MacNeil等人,1993,supra);尼达霉素(参见,例如,PCT Pub.No.98/51695;和Kakavas等人,1997,J.Bacteriol.179:7515-7522);竹桃霉素(参见,例如,Swan等人,1994,Mol.Gen.Genet.242:358-362;PCT Pub.No.00/026349;Olano等人,1998,Mol.Gen.Genet.259(3):299-308;和PCT Pat.App.Pub.No.WO 99/05283);氧四环素(参见,例如,Kim等人,Gene.1994 Apr 8;141(1):141-2);苦霉素(参见,例如,PCT Pub.No.99/61599;PCT Pub.No.00/00620;Xue等人,1998,Chemistry&Biology 5(11):661-667;Xue等人,October 1998,Proc.Natl.Acad.Sci.USA 95:12111 12116);普拉特诺内酯(参见,例如,EP Pub.No.791,656;和U.S.Pat.No.5,945,320);雷帕霉素(参见,例如,Schwecke等人,August 1995,Proc.Natl.Acad.Sci.USA 92:7839-7843;和Aparicio等人,1996,Gene 169:9-16);利福霉素(参见,例如,PCT Pub.No.WO 98/07868;和August等人,Feb.13,1998,Chemistry&Biology,5(2):69-79);纤维堆囊菌(Sorangium)(参见,例如,U.S.Pat.No.6,090,601);Soraphen(参见,例如,U.S.Pat.No.5,716,849;Schupp等人,1995,J.Bacteriology 177:3673-3679);多杀菌素(Spinocyn)(参见,例如,PCT Pub.No.99/46387);螺旋霉素(参见,例如,U.S.Pat.No.5,098,837);特曲霉素(参见,例如,Summers等人,J Bacteriol.1992 Mar;174(6):1810-20;和Shen等人,J Bacteriol.1992 Jun;174(11):3818-21);四环素(参见,例如,J Am Chem Soc.2009 Dec 9;131(48):17677-89);泰乐菌素(参见,例如,U.S.Pat.No.5,876,991;U.S.Pat.No.5,672,497;U.S.Pat.No.5,149,638;EP Pub.No.791,655;EP Pub.No.238,323;Kuhstoss等人,1996,Gene 183:231-6;和Merson-Davies and Cundliffe,1994,Mol.Microbiol.13:349-355);和6-水杨酸甲酯(参见,例如,Richardson等人,Metab Eng.1999 Apr;1(2):180-7;和Shao等人,Biochem Biophys Res Commun.2006 Jun 23;345(1):133-9)。
5.8脂肪酸
在一些实施方案中,本文所提供的经遗传修饰的宿主细胞能够从乙酰辅酶A产生脂肪酸。所述脂肪酸由乙酰辅酶A和丙二酰辅酶A通过脂肪酸合酶催化的一系列的脱羧克莱森缩合反应合成。类似于聚酮合酶,脂肪酸合酶不是单一的酶,而是包括272kDa多功能多肽的酶系统,在所述酶系统中的底物从一个功能域移交到下一个功能域。对所述脂肪酸合酶的两个主要类别进行了表征:I型脂肪酸合酶是哺乳动物和真菌(虽然真菌和哺乳动物合酶的结构布置不同)和细菌(棒状杆菌,分枝杆菌和诺卡氏菌)的CMN组共有的单一的、多功能多肽。II型合酶,发现于古菌和真细菌中,是参与脂肪酸合成的一系列离散的、单功能酶。脂肪酸延伸和减少的机制在这两类合酶中是相同的,因为负责这些催化活动的酶结构域,在这两类合酶间很大程度上是同源的。
在脱羧克莱森缩合反应中的每一轮脂肪酸链延伸之后,通过酮还原酶,脱水酶,和烯醇还原酶的连续作用将β-酮基还原为完全饱和的碳链。不断增长的脂肪酸链的移动到附着于酰基载体蛋白的这些活性部位之间,并且在接近达到16(棕榈酸)的碳链长度时通过硫酯酶作用最终释放由。
在一些实施方案中,本文所公开的基因改造的微生物包含编码生物合成酶的异源核苷酸序列,所述酶包括但不限制于,至少一种脂肪酸合成途径的酶,和可以修饰乙酰辅酶A化合物以形成脂肪酸产物的酶,所述脂肪酸产物如棕榈酸,棕榈酰辅酶A,棕榈油酸,6顺-十六碳烯酸(sapienic acid),油酸,亚油酸,α-亚麻酸,花生四烯酸,二十碳五烯酸,芥酸和二十二碳六烯酸。在一些实施方案中,HACD化合物选自包含如下脂肪酸的组:棕榈酸,棕榈酰辅酶A,棕榈油酸,6顺-十六碳烯酸(sapienic acid),油酸,亚油酸,α-亚麻酸,花生四烯酸,二十碳五烯酸,芥酸和二十二碳六烯酸。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可以共价连接至少一个乙酰辅酶A、丙二酰辅酶A和酰基载体蛋白,例如,酰基转移酶。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可以缩合乙酰化学部分和丙二酰化学部分,其各自与酰基载体蛋白(ACP)结合以形成乙酰乙酰基-ACP,所述酶例如:β-酮乙基-ACP合酶。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可以与NADPH还原乙酰乙酰基-ACP的双键以形成D-3-羟基丁酸酰基羟化酶-ACP中的羟基,所述酶例如,β-酮乙基-ACP还原酶。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可以使D-3-羟基丁酸酰基羟化酶-ACP脱水以创建β-和γ-碳之间的双键,形成巴豆酰基-ACP,所述酶例如:β-羟酰基-ACP脱水酶。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可以与NADPH还原巴豆酰基-ACP以形成丁酰-ACP,所述酶例如,烯酰ACP还原酶。
在一些实施方案中,本文所公开的基因改造的微生物包含编码酶的异源核苷酸序列,所述酶可以水解来自酰基载体蛋白的C 16酰基化合物,以形成棕榈酸,所述酶例如,硫酯酶。
在一些实施方案中,产生脂肪酸的细胞包含编码乙酰辅酶A合酶和/或丙二酰辅酶A合酶的一种或多种异源核苷酸序列,相比于基因未改造的亲本细胞,其导致一种或多种脂肪酸的产量增加。
例如,为了增加乙酰辅酶A的产量,在细胞中可表达一种或多种如下基因:pdh,panK,aceEF(编码丙酮酸酯和2-氧化戊二酸脱氢酶复合物的EIp脱氢酶组分和E2p二氢硫辛酰胺酰基转移酶成分),fabH,fabD,fabG,acpP,和fabF。编码这些酶的核苷酸序列的示例性实例包括,但不限制于:pdh(BAB34380,AAC73227,AAC73226),panK(又称为coaA,AAC76952),aceEF(AAC73227,AAC73226),fabH(AAC74175),fabD(AAC74176),fabG(AAC74177),acpP(AAC74178),fabF(AAC74179)。
在一些实施方案中,通过衰减或敲除编码蛋白质(涉及脂肪酸降解)的基因,可影响细胞中的脂肪酸水平增加。例如,在设计的宿主细胞中,使用本领域已知的技术可以衰减或敲除fadE,gpsA,idhA,pflb,adhE,pta,poxB,ackA和/或ackB的表达水平。编码这些蛋白质的核苷酸序列的示例性实例包括,但不限制于:fadE(AAC73325),gspA(AAC76632),IdhA(AAC74462),pflb(AAC73989),adhE(AAC74323),pta(AAC75357),poxB(AAC73958),ackA(AAC75356),和ackB(BAB81430)。当在适当的环境中生长,所得的宿主细胞将增加乙酰辅酶A的生产水平。
在一些实施方案中,所述产生脂肪酸的细胞包含编码酶的异源核苷酸序列,所述酶可以将乙酰辅酶A转换为丙二酰丙二酰辅酶A,所述酶例如,多亚基AccABCD蛋白。编码AccABCD的适合的核苷酸序列的示例性实例包括,但不限制于登记号AAC73296,EC 6.4.1.2。
在一些实施方案中,所述产生脂肪酸的细胞包含编码脂肪酶的异源核苷酸序列。编码脂酶的适合的核苷酸序列的示例性实例包括,但不限制于登记号CAA89087和CAA98876。
在一些实施方案中,通过抑制PlsB可影响细胞中的脂肪酸水平增加,抑制PlsB导致长链酰基-ACP的水平增加,从而将抑制脂肪酸生物合成途径的早期步骤(例如,accABCD,fabH,and fabl)。在设计的宿主细胞中,使用本领域已知的技术可以衰减或敲除PLSB的表达水平。编码PlsB的适合的核苷酸序列的示例性实例包括,但不限制于登记号AAC77011。在具体的实施方案中,plsB D31 IE突变可用于增加细胞中可用酰基辅酶A的量。
在一些实施方案中,通过过表达sfa基因可影响细胞中的单不饱和脂肪酸的产量增加,过表达sfa基因将导致抑制fabA。编码sfa的适合的核苷酸序列的示例性实例包括,但不限制于登记号AAN79592。
在一些实施方案中,通过调制酶的表达可影响细胞中的脂肪酸水平增加,所述酶控制脂肪酸底物的链长,例如,硫酯酶。在一些实施方案中,产生脂肪酸的细胞经过改性后过表达tes或fat基因。适合的tes核苷酸序列的示例性实例包括但不限于登记号:(tesA:AAC73596,来自大肠杆菌,能够产生C18:1脂肪酸)和(tesB:AAC73555来自大肠杆菌)。适合的fat核苷酸序列的示例性实例包括但不限于:(fatB:Q41635和AAA34215,来自加州月桂,能够产生C12:0脂肪酸),(fatB2:Q39513和AAC49269,来自萼距花,能够产生C8:0–C10:0脂肪酸),(fatB3:AAC49269和AAC72881,来自萼距花,能够产生C14:0–C16:0脂肪酸),(fatB:Q39473和AAC49151,来自香樟(Cinnamonum camphorum),能够产生C14:0脂肪酸),(fatB[M141T]:CAA85388,来自拟南芥,能够产生C16:1脂肪酸),(fatA:NP 189147和NP 193041,来自拟南芥,能够产生C18:1脂肪酸),(fatA:CAC39106,来自慢生型大豆根瘤菌,能够优先产生C18:1脂肪酸),(fatA:AAC72883,来自萼距花,能够产生C18:1脂肪酸),和(fatA1,AAL79361来自向日葵)。
在一些实施方案中,通过使用本领域已知的技术衰减硫酯酶C18的表达或活性,可影响细胞中的C10脂肪酸水平升高。编码硫酯酶C18的适合的核苷酸序列的示例性实例包括,但不限于登记号AAC73596和P0ADA1。在其它实施方案中,通过使用本领域已知的技术增加硫酯酶C10的表达或活性,可影响细胞中的C10脂肪酸水平升高。编码硫酯酶C10的适合的核苷酸序列的示例性实例包括,但不限制于登记号Q39513。
在一些实施方案中,通过使用本领域已知的技术衰减产生非C14脂肪酸的内源硫酯酶的表达或活性,可影响细胞中的C14脂肪酸水平升高。在其它实施方案中,通过使用本领域已知的技术增加使用基质C14-ACP的硫酯酶的表达或活性,可影响细胞中的C14脂肪酸水平升高。编码这些硫酯酶的适合的核苷酸序列的示例性实例包括,但不限制于登记号Q39473。
在一些实施方案中,通过使用本领域已知的技术衰减产生非C12脂肪酸的内源硫酯酶的表达或活性,可影响细胞中的C12脂肪酸水平升高。在其它实施方案中,通过使用本领域已知的技术增加使用基质C12-ACP的硫酯酶的表达或活性,可影响细胞中的C12脂肪酸水平升高。编码这些硫酯酶的适合的核苷酸序列的示例性实例包括,但不限制于登记号Q41635。
5.9用于其它化合物生产的PK/PTA
在一些实施方案中,本文所提供的经遗传修饰的宿主细胞(例如,包含如下的宿主细胞:PK/PTA和编码乙酰磷酸酶活性的多肽的功能性破坏,例如,RHR2,HOR2或其同源物)被设计用于生物合成途径的表达,如在美国专利申请(公开号20120156735)中所描述,所述生物合成途径与细胞丙酮酸一同开始生产,例如,2,3-丁二醇,2-丁醇,2-丁酮,缬氨酸,亮氨酸,乳酸,苹果酸,异戊醇和异丁醇。破坏被设计为表达丙酮酸-利用生物合成途径的重组宿主细胞中的丙酮酸脱羧化酶(PDC),用于通过生物合成途径增加用于产物形成的丙酮酸的有效性。而PDC-KO重组宿主细胞可用于产生的丙酮酸-利用的生物合成途径的产物,PDC-KO重组宿主细胞需要补充外源碳源物(例如,乙醇或乙酸根离子)用于其生长。尤其需要两种外源碳源物:其中一种转换为目的产物,另一种通过重组宿主细胞需要这种补充用于生长全部或部分地转换为乙酰辅酶A。然而,相比于不异源PK/PTA的PDC-KO细胞,异源磷酸转酮酶途径的表达减少或消除了对提供这些外源碳源物用于其生长的需求。因此,RHR2,HOR2或其同源物的其它功能性破坏能够催化乙酰磷酸水解为乙酸根离子,可望进一步改善PK/PTA的性能以增加有效乙酰辅酶A的供给,所述有效地乙酰辅酶A可作为这些细胞中用于细胞生长的底物。
5.10形成基因改造细胞的方法
本文还提供了用于产生经过基因设计的宿主细胞的方法,所述宿主细胞包含一种或多种如上所述的修饰,例如,编码PK、PTA的一种或多种异源核酸,和/或生物合成途径的酶,例如,用于乙酰辅酶A衍生化合物。在宿主细胞中异源酶的表达可通过引入核酸到宿主细胞中来完成,所述核酸包含在宿主细胞内允许表达的调节因子的控制下,编码所述酶的核苷酸序列。在一些实施方案中,所述核酸是染色体外的质粒。在其它实施方案中,所述核酸是染色体整合载体,其可以整合核苷酸序列到宿主细胞的染色体中。
编码这些蛋白质的核酸可以通过但不限制于本领域技术人员已知的任何方法引入宿主细胞中(参见,例如,Hinnen等人(1978)Proc.Natl.Acad.Sci.USA 75:1292-3;Cregg等人(1985)Mol.Cell.Biol.5:3376-3385;Goeddel等人eds,1990,Methods in Enzymology,vol.185,Academic Press,Inc.,CA;Krieger,1990,Gene Transfer and Expression--A Laboratory Manual,Stockton Press,NY;Sambrook等人,1989,Molecular Cloning--A Laboratory Manual,Cold Spring Harbor Laboratory,NY;和Ausubel等人,eds.,Current Edition,Current Protocols in Molecular Biology,Greene Publishing Associates and Wiley Interscience,NY)。示例性技术包括但不限制于,原生质球,电穿孔,PEG 1000介导转化,和乙酸锂或氯化锂介导的转化。
宿主细胞中酶的拷贝数可通过修饰编码酶的基因的转录来改变。这可以通过如下实现:例如,修饰编码酶(例如,通过使用较高或较低的拷贝数的包含核苷酸序列的表达载体,或通过引入核苷酸序列的其它拷贝到宿主细胞的基因组中,或者通过删除或破坏宿主细胞的基因组中的核苷酸序列),通过改变操纵子的多顺反子mRNA上的编码序列顺序或将操纵子破碎成各自具有自己的调控因子的单个基因,或通过增加启动子或操作子与核苷酸序列可操作连接的强度。二者选一或另外地,宿主细胞中酶的拷贝数可通过修饰编码酶的mRNA的翻译水平来改变。这可以通过如下实现:例如修饰mRNA的稳定性,修饰核糖体结合位点的序列,修饰所述核糖体结合位点和酶编码序列的起始密码子之间的距离或序列,修饰整个顺反子区间处于酶编码区的起始密码子的“上游“或邻近5′侧面,使用发夹型和专门的序列使mRNA转录物的3′末端稳定,修饰酶的密码子选择,改变用于酶生物合成的稀有密码子tRNA的表达,和/或增加酶的稳定性,例如,通过其编码序列突变。
宿主细胞中的酶的活性可以以多种方式改变,包括,但不限于,表达在宿主细胞中表现为溶解度升高或降低的修饰形式的酶,表达缺乏域的改变形式的酶,通过所述域酶的活性被抑制,表达对底物具有更高或更低Kcat或更低或更高Km的修饰形式的酶,或表达或多或少受该途径中其它分子的反馈或前馈调节影响的改变形式的酶。
在一些实施方案中,用于经遗传修饰的宿主细胞的核酸包含一个或多个可选标记,其用于转化宿主细胞的选择和在宿主细胞上放置选择压力以维护不相关的DNA。
在一些实施方案中,所述可选标记是抗生素抗性标记。抗生素抗性标记的示例性实例包括,但不限制于,BLA,NAT1,PAT,AUR1-C,PDR4,SMR1,CAT,老鼠dhfr,HPH,DSDA,KANR,和SH BLE基因产物。来自大肠杆菌的BLA基因产物赋予对β-内酰胺类抗生素(例如,窄谱头孢菌素,头霉素,碳青霉烯类抗生素(厄他培南),头孢羟唑,和头孢哌酮)和对所有抵抗革兰阴性细菌盘尼西林(除替莫西林)的耐药性;来自诺尔斯氏链霉菌(S.nourse)i的NAT1基因产物赋予对诺尔丝菌素的耐药性;来自绿色产色链霉菌Tu94的PAT基因产物赋予对双丙氨膦(bialophos)的耐药性;来自酿酒酵母的AUR1-C基因产物赋予对AuerobasidinA(AbA)的耐药性;PDR4基因产物赋予对浅蓝菌素的耐药性;SMR1基因产物赋予对嘧磺隆的耐药性;来自Tn9转位子的CAT基因产物赋予对氯霉素的耐药性;小鼠dhfr基因产物赋予对甲氨喋呤的耐药性;肺炎克雷伯菌的HPH基因产物赋予对潮霉素B的耐药性;大肠杆菌的DSDA基因产物允许细胞在具有D-丝氨酸作为唯一氮源的平板上生长;所述Tn903转位子的KANR的基因赋予对G418的耐药性;并且来自印度斯坦链异壁菌的SH BLE基因产物赋予对博来霉素的耐药性。在一些实施方案中,所述抗生素抗性标记在本文所公开的经遗传修饰的宿主细胞分离后被删除。
在一些实施方案中,可选标记标志拯救经基因改造的微生物中的营养缺陷体(例如,营养的营养缺陷型)。在这样的实施方案中,亲本微生物包含在一个或多个基因产物的功能性破坏,并且当非功能性破坏时,呈现不能在不补充一种或多种营养物的培养基中生长的亲本细胞,所述基因产物在氨基酸或核苷酸的生物合成途径中作用。这样的基因产物包括,但不限制于,在酵母中的HIS3,LEU2,LYS1,LYS2,MET15,TRP1,ADE2和URA3基因产物。营养缺陷体表现型可随后用编码被破坏的基因产物的功能性拷贝的表达载体或染色体集成构造通过转化亲本细胞救出,并且为了基于亲本细胞的营养缺陷体表现型的损失,可选择所产生的经遗传修饰的宿主细胞。利用URA3,TRP1和LYS2基因作为可选标记具有显著的优势,这是因为正和负选择都是可能的。正选择通过URA3,TRP1和LYS2突变的营养缺陷型互补来进行,而负选择基于特异性抑制剂(即,分别为5-氟-乳清酸(FOA),5-氟邻氨基苯甲酸和氨基己二酸(aAA))防止原养型菌株的生长,但分别允许URA3,TRP1和LYS2突变体生长。在其它实施方案中,可选标记标志拯救其它非致命性的缺陷或表现型,所述其它非致命性的缺陷或表现型可以通过已知的选择方法鉴定。
本文描述了特定的基因和用于本公开的方法,组合物和生物体的蛋白质;然而应当认识到,对这些基因来说绝对同一性是没有必要的。例如,可执行对具体基因和多核苷酸(包含编码多肽或酶的序列)的改变并筛选活性。通常这样的改变包括保守突变和沉默突变。可使用本领域已知的方法筛选这种改性的或突变的多核苷酸和多肽的功能性酶的表达。
由于遗传密码的固有退化,实质上编码相同或功能上等同的多肽的其它多核苷酸也可以用于克隆和表达编码这些酶的多核苷酸。
正如本领域的技术人员将理解的,修饰编码序列以提高其在特定宿主中的表达是有利的。具有64个可能的密码子的遗传密码是冗余的,但是大多数生物体通常使用这些密码子的子集。最经常在被称为最优密码子的物种中利用所述密码子,并且那些没有经常利用的密码子被归类为稀有或利用率低的密码子。在有时被称为“密码子优化”或“控制物种密码子偏倚”的过程中,所述密码子可被取代以反映宿主的优先密码子选择。
可制备原核或真核宿主(Murray等人,1989,Nucl Acids Res.17:477-508)优选的包含密码子的优化编码序列,例如,与从非优化序列产生的转录物相比,增加翻译速率或产生具有所需性能(如更长的半衰期)的重组RNA转录物。翻译终止密码子也可以被修饰以反映宿主偏好。例如,酿酒酵母和哺乳动物的典型终止密码子分别是UAA和UGA。对于单子叶植物的典型终止密码子是UGA,而昆虫和大肠杆菌通常使用UAA作为终止密码子(Dalphin等人,1996,Nucl Acids Res.24:216-8)。
本领域的技术人员将认识到,由于遗传密码的退化本性,在其核苷酸序列存在不同的多种DNA分子可用于编码本发明给定的酶。编码上述生物合成酶的天然DNA序列仅仅被本文引用来说明本发明的实施方案,并且本发明包括任何序列的DNA分子,所述DNA分子编码本发明的方法所利用的酶的多肽和蛋白质的氨基酸序列。在类似的方式中,多肽通常可以允许其氨基酸序列中一个或多个氨基酸置换、缺失以及插入,而不造成期望的活性损失或重大损失。本发明包括的这些多肽比本文所描述的特异蛋白具有不同的氨基酸序列,只要所述修饰的或变化的多肽具有参照多肽的酶促合成代谢或分解代谢活性。此外,被本文所示DNA序列编码的氨基酸序列仅仅阐明了本发明的实施方案。
此外,用于本文所提供的组合物和方法的酶的同源物被本发明涵盖。在一些实施方案中,当氨基酸序列具有至少约30%,40%,50%,60%,65%,70%,75%,80%,85%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%的同一性时,两种蛋白质(或蛋白质区域)是实质同源的。为了确定两种氨基酸序列,或两种核酸序列的相同度,将所述序列进行比对以达最佳对照目的(例如,为达最优比对和非同源序列可以忽略不计的对照目的,在一个或两个第一和第二氨基酸或核酸序列中可引入空位)。在一个实施方案中,为达对照目的,比对的参考序列长度为参考序列长度的至少30%,典型地至少40%,更典型地至少50%,甚至更典型地至少60%,并且甚至更典型地至少70%,80%,90%,100%。然后将氨基酸残基或核苷酸基在相对应的氨基酸位置或核苷酸位置上进行比较。当在第一序列的位置被第二序列中相对应位置的相同氨基酸残基或核苷酸占据时,那么这些分子在所述位置是相同的(如本文所用的氨基酸或核酸“同一性”等同于氨基酸酸或核酸“同源性”)。两个序列之间的相同度是序列共有的相同位置数量的函数,考虑到空位数和每个空位的长度,为了两个序列的最优比对其需要被引入。
当“同源”用于指蛋白质或多肽时,人们认识到残基位置是不相同的,其往往因保守氨基酸置换而不同。“保守氨基酸置换”是其中的氨基酸残基被具有侧链(R基团)的另一氨基酸残基(具有相似化学性质(如,电荷或疏水性))所取代。一般情况下,保守氨基酸置换实质上不会改变蛋白质的功能性质。在通过保守置换使得两个或更多个氨基酸序列彼此不同的情况下,百分比序列一致性或同源性的程度可以向上调整以校正置换的保守性。进行上述调整的方法本领域技术人员熟知的(参见,例如,Pearson W.R.,1994,Methods in Mol Biol 25:365-89)。
下面6组中各自包含的氨基酸彼此保守置换:1)丝氨酸(S),苏氨酸(T);2)天冬氨酸(D),谷氨酸(E);3)天冬酰胺(N),谷氨酰胺(Q);4)精氨酸(R),赖氨酸(K);5)异亮氨酸(I),亮氨酸(L),丙氨酸(A),缬氨酸(V),和6)苯丙氨酸(F),酪氨酸(Y),色氨酸(W)。
多肽的序列同源性也被称为百分比序列一致性,其通常使用序列分析软件测定。用来将分子序列与数据库(含有来自不同生物体的大量序列)进行比较的典型算法是计算机程序BLAST。当搜索含有来自不同生物体的大量序列的数据库时,它通常比较氨基酸序列。
此外,编码上述酶(或本文中提到的任何其它(或任何其它控制或调节其表达的调控因子))的任何基因可以通过基因/蛋白质工程技术(诸如,定向进化或理性诱变,这是本领域普通技术人员已知的)进行优化。这种操作允许本领域普通技术人员优化酵母中的酶的表达和活性。
此外,编码这些酶的基因可以从其它真菌和细菌物种进行鉴定,并且可为该途径的调制进行表达。多种生物体可以作为这些酶的来源,包括但不限制于,酵母菌,包括酿酒酵母和葡萄汁酵母,克鲁维酵母菌,包括K.Kluyveromyces,乳酸克鲁维酵母和马克斯克鲁维酵母菌,毕赤酵母菌,汉逊酵母菌,包括多形汉逊酵母,念珠菌,毛孢子菌,Yamadazyma spp.,包括Y.spp.stipitis,球有孢圆酵母,东方伊萨酵母,裂殖酵母菌,包括粟酒裂殖酵母,隐球菌,曲霉,脉孢菌,或黑粉菌。来自厌氧真菌的基因来源包括,但不限制于,梨囊鞭菌,根囊鞭菌,或新美鞭菌。原核生物有用的酶来源包括,但不限制于,大肠埃希杆菌,运动发酵单胞菌,金黄色葡萄球菌,芽孢杆菌,梭状芽孢杆菌属,棒状杆菌,假单胞菌,乳球菌,肠杆菌,和沙门氏菌。
对本领域技术人员来说已知的技术可适用于鉴定更多的同源基因和同源酶。通常,类似基因和/或类似酶可以通过功能分析进行鉴定并且将具有功能相似性。对本领域技术人员来说已知的技术可适用于鉴定类似基因和类似酶。例如,为了鉴定同源的或类似的PK,PTA,RHR2或HOR2基因,蛋白质,或酶,采用的技术可以包括,但不限制于,通过使用基于已公开的有益基因/酶的序列作为引物来PCR克隆基因,或通过使用被设计以在有益基因中扩增保守区的简并引物来简并PCR。此外,本领域的技术人员可以使用技术来鉴定具有功能同源性或相似性的同源的或类似的基因,蛋白质,或酶。所述技术包括通过体外酶测定所述活性(例如,本文所述或Kiritani,K.,Branched-Chain Amino Acids Methods Enzymology,1970中所述的)来检验细胞或细胞培养物以确定酶的催化活性,然后通过纯化分离具有所述活性的酶,通过诸如埃德曼降解,PCR引物设计到可能的核酸序列,通过PCR扩增所述的DNA序列,以及克隆所述的核酸序列等技术来测定所述酶的蛋白质序列。为了鉴定同源或相似的基因和/或同源或相似的酶,类似基因和/或类似酶或蛋白质,所述技术还包括对照有关的候选基因或酶的数据(具有的数据库如BRENDA,KEGG,或MetaCYC)。所述候选基因或酶可以按照本文的技术在上述数据库内鉴定。
6.实施例
6.1实施例1
在表达PK和PTA的宿主细胞中的乙酸根离子产量
本实施例描述了在异源表达磷酸转酮酶和磷酸转乙酰酶的酵母菌株内乙酸根离子的产量。
6.1.1材料和方法
6.1.1.1菌株工程改造(Strain Engineering)
6.1.1.1.1 Y967和Y968
Y967和Y968是野生型原养型酿酒酵母CEN.PK2,Y967是MatA,且Y968是Matalpha。Y12869、Y12746和它们所有的衍生物的出发菌株是酿酒酵母菌株Y003(CEN.PK2,Matalpha,ura3-52,trp1-289,leu2-3,122,his3^1)。使用标准乙酸锂步骤(如Gietz RW和Woods RA,Guide to Yeast Genetics and Molecular and Cell Biology.Part B.San Diego,CA:Academic Press Inc.pp.87–96(2002)所描述的)来进行所有的DNA介导转化成酿酒酵母,并在所有情况下,构建体的整合经基因组DNA的PCR扩增来确认。
6.1.1.1.2 Y12689
Y12869通过在Y003中的三个连续的整合而产生。首先,通过引入由天然酿酒酵母的LEU2基因组成的整合构建体(i2235;SEQ ID NO:27)而使得基因ACS2被删除,所述整合构建体两侧是由ACS2基因座的上游和下游核苷酸序列组成的序列。经引入酿酒酵母宿主细胞,该构建体可以通过同源重组整合到基因组的ACS2基因座中,从而通过将其整合序列替换ACS2编码序列而在功能上破坏ACS2。将转化体接种在含2%乙醇作为唯一碳源的CSM-leu板上并通过PCR扩增确认。所得的菌株为Y4940。
下一步,将ALD6删除并且利用如下图的整合构建体(i74804;SEQ ID NO:28)在Y4940中引入玉米狄克氏细菌(Dickeya zeae)eutE。
这种整合构建体包含可选标记(TRP1)以及酵母-密码子-优化序列的两个副本,在TDH3启动子(天然酿酒酵母TDH3编码区的840个上游碱基对)和TEF2终止子(天然酿酒酵母TEF2编码区的508个下游碱基对)的控制下,所述酵母-密码子-优化序列编码来自玉米狄克氏细菌(NCBI参考序列:YP_003003316.1)的基因eutE。这些组件两侧是ALD6基因座的上游和下游核苷酸序列。经引入宿主细胞,该构建体可以通过同源重组整合到宿主细胞基因组中,从而通过将其整合序列替换ALD6编码序列而在功能上破坏ALD6。使用在美国专利号8,221,982中所描述的方法组装构建体。将所述构建体转化到Y4940,并且在含2%葡萄糖的CSM-TRP板上选择转化体并通过PCR扩增确认。所得的菌株为y12602。
下一步,在Y12602中通过引入由ACS1的上游和下游核苷酸序列组成的整合构建体(i76220;SEQ ID NO:29)将ACS1删除,所述ACS1的上游和下游核苷酸序列在其自身的启动子和终止子下位于天然酿酒酵母的HIS3基因的两侧。将转化体接种在含2%葡萄糖作为唯一碳源的CSM-his板上并通过PCR扩增确认。所得的菌株为Y12747。
接下来,由天然URA3序列扩增的PCR产物转化所述Y12747。该序列复原了ura3-52突变。参见Rose和Winston,Mol Gen Genet 193:557-560(1984)。将转化体接种在含2%葡萄糖作为唯一碳源的CSM-ura板上,并通过PCR扩增确认。所得的菌株为Y12869。
6.1.1.1.3 Y12745
Y12745通过三个在Y4940里的连续整合而产生。首先,由如下图的整合构建体(i73830;SEQ ID NO:30)转化Y4940。
这种整合构建体包含可选标记(URA3);来自肠系膜明串珠菌(Leuconostoc mesenteroides)(NCBI参考序列YP_819405.1)的磷酸转酮酶的酵母密码子-优化版本,其在TDH3启动子(TDH3编码序列的上游870bp)和TDH3终止子(TDH3编码序列的下游259bp)下;克氏梭菌的磷酸转乙酰酶(NCBI参考序列:YP_001394780.1)的酵母密码子-优化版本,其在TDH3启动子(TDH3编码序列的上游870bp)和PGK1终止子(PGK1编码序列的下游259bp)的控制下;其两侧是由酿酒酵母BUD9基因座的上游和下游核苷酸序列组成的同源序列。经引入宿主细胞,该构建体通过同源重组整合到宿主细胞基因组中,从而通过将其整合序列替换BUD9编码序列而在功能上破坏BUD9。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体。所得的菌株由构建体(i74810;SEQ ID NO:31)转化,如下所示。
这种构建体包含可选标记(TRP1);来自肠系膜明串珠菌的磷酸转酮酶的两个副本,其在TDH3启动子(TDH3编码序列的上游870bp)和TDH3终止子(TDH3编码序列的下游259bp)下;两侧是ALD6基因座的上游和下游核苷酸序列组成的同源序列。经引入宿主细胞,该构建体通过同源重组整合到宿主细胞基因组中,通过将其整合序列替换ALD6编码序列而在功能上破坏ALD6。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体并通过PCR扩增确认。
下一步,通过引入由ACS1的上游和下游核苷酸序列组成的整合构建体(i76220;SEQ ID NO:29)将ACS1删除,所述ACS1的上游和下游核苷酸序列在其自身的启动子和终止子下位于天然酿酒酵母的HIS3基因的两侧。将转化体接种在含2%葡萄糖作为唯一碳源的CSM-his板上并通过PCR扩增确认。
6.1.1.1.4 Y12746
Y12746通过在Y4940里的三个连续整合而产生。首先,由整合构建体(i73830;SEQ ID NO:30)转化Y4940,如下图。
这种整合构建体包含可选标记(URA3);来自肠系膜明串珠菌的磷酸转酮酶的酵母密码子-优化版本(NCBI参考序列YP_819405.1)在TDH3启动子(TDH3编码序列的上游870bp)和TDH3终止子(TDH3编码序列的下游259bp)下;克氏梭菌的磷酸转乙酰酶的酵母密码子-优化版本,在TDH3启动子(TDH3编码序列的上游870bp)和PGK1终止子(PGK1编码序列的下游259bp)的控制下;其两侧是由酿酒酵母BUD9基因座的上游和下游核苷酸序列组成的同源序列。经引入宿主细胞,该构建体通过同源重组整合到宿主细胞基因组中,通过将其整合序列替换BUD9编码序列而在功能上破坏BUD9。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体。
所得的菌株由构建体(i74810;SEQ ID NO:31)转化,如下所示。
这种构建体包含可选标记(TRP1);来自肠系膜明串珠菌的磷酸转酮酶的两个副本在TDH3启动子(TDH3编码序列的上游870bp)和TDH3终止子(TDH3编码序列的下游259bp)下;两侧是ALD6基因座的上游和下游核苷酸序列组成的同源序列。经引入宿主细胞,该构建体通过同源重组整合到宿主细胞基因组中,而通过将其整合序列替换ALD6编码序列在功能上破坏ALD6。使用在美国专利号8,221,982中所描述的方法来组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体并通过PCR扩增确认。
最后,所得的菌株由构建体(i76221;SEQ ID NO:32)转化,如下所示。
这种整合构建体包含可选标记(HIS3);以及酵母-密码子-优化序列的两个副本,在DH3启动子(天然酿酒酵母TDH3编码区的840个上游碱基对)和TEF2终止子(天然酿酒酵母TEF2编码区的508个下游碱基对)的控制下,所述酵母-密码子-优化序列编码来自玉米狄克氏细菌的基因eutE(NCBI参考序列:YP_003003316.1)。这些组件两侧是ACS1基因座的上游和下游核苷酸序列。经引入宿主细胞,该构建体可以通过同源重组整合到宿主细胞基因组中,从而通过将其整合序列替换ACS1编码序列而在功能上破坏ACS1。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-HIS板上选择转化体并通过PCR扩增确认。所得的菌株为Y12746。
6.1.1.1.5 Y19390
Y19390是Y12869的直接后代。Y12869的ura-营养缺陷型衍生物由如下所示的整合构建体MS49253(SEQ ID NO:36)转化:
这种整合构建体包含可选标记(URA3);来自肠系膜明串珠菌的磷酸转酮酶的酵母密码子-优化版本的两个副本(NCBI参考序列YP_819405.1),其在TDH3启动子(TDH3编码序列的上游870bp)和TDH3终止子(TDH3编码序列的下游259bp)下;其两侧是由酿酒酵母BUD9基因座的上游和下游核苷酸序列组成的同源序列。经引入宿主细胞,该构建体通过同源重组整合到宿主细胞基因组中,从而通过将其整合序列替换BUD9编码序列而在功能上破坏BUD9。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体。
6.1.1.1.6 Y19391
Y19391是Y12869的直接后代。Y12869的ura-营养缺陷型衍生物由如下所示的整合构建体MS49298(SEQ ID NO:37)转化:
这种整合构建体包含可选标记(URA3);来自克氏梭菌的磷酸转乙酰酶的酵母密码子-优化版本(NCBI参考序列:YP_001394780.1),其在TDH3启动子(TDH3编码序列的上游870bp)和PGK1终止子(PGK1编码序列的下游259bp)的控制下;其两侧是由酿酒酵母BUD9基因座的上游和下游核苷酸序列组成的同源序列。经引入宿主细胞,该构建体通过同源重组而整合到宿主细胞基因组中,从而通过将其整合序列替换BUD9编码序列在功能上破坏BUD9。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体。
6.1.1.2培养条件
在30℃和200rpm条件下,使Y967,Y12869,Y12745,Y12746,Y19390和Y19391的接种体培养物在5ml种子培养基(seed media)中由单个菌落过夜生长(15g/L硫酸铵,8g/L磷酸钾,6.1g/L的硫酸镁,150mg/LEDTA,57.5mg/L的硫酸锌,4.8mg/L氯化钴,3.24mg/L氯化锰,5mg/L硫酸铜,29.4mg/L氯化钙,27.8mg/L硫酸铁,4.8mg/L钼酸钠,0.6mg/L生物素,12mg/L泛酸钙,12mg/L烟酸,30mg/L肌醇,12mg/L盐酸硫胺素,12mg/L盐酸吡哆醇,0.24mg/L对氨基苯甲酸,以及pH 5.0的50mM琥珀酸盐和20g/L蔗糖)。然后将该预培养物接种到125ml的烧瓶中至0.1的初始OD600,并在30℃和200rpm下生长,所述烧瓶载有25ml的种子培养基(具有pH 5.0的50mM琥珀酸盐和40g/L蔗糖)。
6.1.1.3乙酸根离子,果糖,葡萄糖和蔗糖的定量
通过将1ml的全细胞培养液转移到1.5ml微量离心管(eppendorf tube)中而对乙酸根离子和糖(果糖,葡萄糖,蔗糖)进行定量,并使用台式离心机在13,000rpm下旋转1分钟以澄清上清液。然后将上清液以8mM硫酸稀释(1:1v/v),涡旋,然后再次离心再转移到1.8ml小瓶。样品利用BioRad Aminex HPX-87H 300mm x7.8mm柱,经过具有可变波长和折射率检测的Agilent 1200HPLC进行分析。流动相是4mM的硫酸,柱温为40℃,且流速为0.5ml/min。
6.1.1.4结果
图3B表明野生型Cen.PK2和Y967在分批限定的蔗糖摇瓶培养物中的生长过程中产生乙酸根离子。包含PDH-支路的缺失(acs1Δ acs2Δ ald6Δ)和异源表达的乙醛脱氢酶酰化(Dz.eutE)的Y12869产生的乙酸根离子远远少于使用该PDH-支路的野生型对照,这可能是由于为将乙醛转化为乙酸根离子的细胞溶质的乙醛脱氢酶的ALD6缺失。在包含PDH-支路的缺失(acs1Δ acs2Δ ald6Δ)和异源表达的乙醛脱氢酶酰化(Dz.eutE)以及磷酸转酮酶(Lm.PK)和磷酸转乙酰酶(Ck.PTA)菌株Y12746中,观察到乙酸根离子的大量增加,其超过由野生型Y967产生的量。在是acs1Δ acs2Δ ald6Δ且使用ADA携带通量(flux)到细胞溶质的乙酰辅酶A的菌株中,Y12869的结果表明乙酸根离子的基线水平是极低的。在所有的情况下,糖消耗速率是可比较的(此处糖被定义为培养基中蔗糖,葡萄糖和果糖的总和),说明乙酸根离子水平的差异不是由于原料差别消耗造成(图3A)。这些结果表明,在Y12746中乙酸根离子的增加可归因于磷酸转酮酶和/或磷酸转乙酰酶的存在。磷酸转酮酶和磷酸转乙酰酶的催化活性都产生乙酰磷酸。因此,乙酸根离子的累积可起因于Y12746中乙酰磷酸的自发或催化水解。
为了确定在表达ADA,PK和PTA(Y12746)的菌株中乙酸根离子的来源,我们使用下述整合构建体转化了只使用ADA来提供细胞溶质AcCoA的菌株(Y12869,其包含PDH-支路的缺失(acs1Δ acs2Δ ald6Δ)和异源表达乙醛脱氢酶酰化(Dz.eutE)):(1)编码由强启动子PTDH3驱动的PK的两个过表达副本的整合构建体,从而产生Y19390,或(2)编码由强启动子PTDH3驱动的PTA的两个过表达副本的整合构建体,从而产生Y19391。如图3D所示,相对于亲本菌株,我们观察到在表达PK或PTA的菌株内的乙酸根离子的累积增加。糖消耗如图3C所示,其说明了乙酸根离子水平不归因于差别的糖消耗。PK将X5P转换为乙酰磷酸和G3P,而PTA可以将乙酰辅酶A+Pi与乙酰磷酸+辅酶A相互转换。这些观察结果表明,无论是通过PK来自X5P,或是通过PTA来自于AcCoA的乙酰磷酸,都可水解为如图1所示的乙酸根离子。
6.2实施例2
酿酒酵母中主要乙酰磷酸酶的鉴定
本实施例描述了能够在酵母中水解乙酰磷酸的酶的鉴定。
6.2.1材料和方法
6.2.1.1细胞培养
将给定的酵母菌株的单菌落在5mL具有2%葡萄糖的酵母提取物蛋白胨培养基(YPD)中培养,其作为过夜起始培养物。第二天,在50ml的YPD中接种所述起始培养物至OD600为0.2。将烧瓶在30℃下培养,以200RPM震荡24小时,除非另作说明。
6.2.1.2制备无细胞提取物
将细胞培养物分在三个15mL的Falcon管中,并以4000xg离心5分钟后获得。然后将上层清液弃去并且细胞通过重悬浮于10mL冰冷的缓冲液W(100mM Tris-HCl pH 8.0,150mM NaCl,10%甘油)中洗涤,然后以4000xg离心5分钟。弃去上层清液并且将细胞重悬浮于1mL裂解缓冲液中(100mM Tris-HCl pH 8.0,150mM NaCl,10%甘油,1mM DTT,每10mL的1EDTA无蛋白酶抑制剂片剂(Roche))。然后将细胞转移至2mL的具有O形环盖的塑料螺帽微量离心管中(Fisher Brand 520-GRD),并使用破坏珠(破坏珠,0.5Mm,Fisher)和珠磨器以6M/S工作1分钟裂解细胞。将管子立即置于冰水浴中至少5分钟。然后将管子放回珠磨器中再次以6M/S工作1分钟,并再回到冰浴5分钟。管子以16000xg的最低限度旋转20分钟以团化细胞碎片。然后将上层清液转移到新的冷轧管中。使用蛋白质经典的Bradford试验(Bradford MM A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal.Biochem 72,248-254(1976))测量蛋白质浓度。
6.2.1.3乙酰磷酸酶反应和乙酰磷酸的定量
在30℃下,乙酰磷酸酶活性测定在由100mM Tris-HCl(pH 7.5),150mM NaCl,和1mM MgCl2+组成的反应缓冲液中进行。如所指示的,乙酰磷酸的起始浓度增添加到5mM或10mM。通过加入所指示量的无细胞提取物使得反应开始。为了测试磷酸酶的抑制作用,以30mM的浓度将氟化钠加入至选择的孔。该反应在密封的96孔板中进行且总反应体积为250μl。乙酰磷酸的浓度通过由Lipmann和Tuttle(Lipmann F,Tuttle LC,J.Biol.Chem.159,21-28(1945))研制的方法进行测定。将50μl的反应混合物加入到pH为6.8的50μl的2M的羟胺中,充分混合并在室温下培养至少10分钟。然后加入34μl 15%的三氯乙酸并混合,随后是34μl 4N HCl和34μl的5%FeCl3,在每次加入后充分混合。然后将板在具有浮桶式转头JS-5.3的Beckman离心机J-E中以3000rpm离心5分钟使沉淀的蛋白质团化。然后将150μl上层清液转移至新的96孔透明平底平板(Greiner Bio-One Cat.-No.:655161)。板子在505nm波长下通过Molecular Devices SpectraMax读板器读出。
6.2.1.4活性磷酸酶级分的纯化
将给定的酵母菌株的单菌落在5mL具有2%葡萄糖的酵母提取物蛋白胨培养基(YPD)中培养,其作为过夜起始培养物。第二天,在具有500mlYPD的2个2.8L Fermbach烧瓶中接种所述起始培养物至OD600为0.2。将烧瓶在30℃下培养,以160RPM震荡24小时。培养物以4000xg离心5分钟后获得。细胞团经过500mL无菌水洗涤并且以4000xg离心5分钟。然后将细胞团重悬浮在50mL冰冷的裂解缓冲液中(100mM Tris-HCl pH 8.0,150mM NaCl,10%甘油,1mM DTT,每10mL的1EDTA无蛋白酶抑制剂片剂(Roche))。将细胞悬液分装在六个装有5mL破坏珠(破坏珠,0.5Mm,Fisher)的15mLFalcon管中。然后将管子置于珠磨器中以6M/S工作45秒,再将管子立即置于冰水浴中至少5分钟。在冰水浴中,各破坏片段之间再额外反复珠磨3次,每次至少5分钟。管子以16,000rpm(30,966xg)在冷却至4℃的JA-20转子Beckman离心机J-E中旋转30分钟以团化细胞碎片。此外,细胞裂解产物通过Salt等人(Selective flocculation of cellular contaminants from soluble proteins using polyethyleneimine:Astudy of several organisms and polymer molecular weights.Enzyme and Microbial Technology17,107-113(1995))所描述的选择性絮凝法澄清。如下:通过加入5mM NaOH储备溶液将无细胞裂解物调节到pH 7.4。然后在细胞裂解产物中加入等体积的PEI/Borax溶液(0.5M NaCl 0.25%PEI,100mM Borax)并充分混合。然后在4℃下将混合物以2,500xg离心30分钟。随后通过缓慢加入硫酸铵并不断搅拌直至达到80%饱和浓度以沉淀蛋白质。继续搅拌10分钟以上,然后在4℃下以15,000rpm在Beckman JA-20转子中离心10分钟获得沉淀的蛋白质。除去上层清液并将蛋白轻轻地重悬在缓冲液A中(20mM Tris-Cl,pH 7,10%甘油)。然后把蛋白质加入到0.5-3mL 3500Da分子量截留值的透析盒(Pierce#66300),并在1.5L缓冲液A中4℃过夜透析。将透析样品以16000xg离心10分钟以团化沉淀的蛋白质。使用蛋白质经典的Bradford试验(Bradford MM A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal.Biochem 72,248-254(1976))测量蛋白质浓度。将20mg蛋白质装载到explorer FPLC的Source 15Q 4.6/100PE阴离子交换柱上。蛋白质经30倍柱体积的0-100%梯度的缓冲液B(20mM Tris-Cl pH 7,1M NaCl,10%甘油)洗脱,流速为0.5mL/分钟,并且收集到1mL样品。为了测定每个级分的活性,在含有100mM Tris-Cl(pH 7),150mM NaCl,1mM MgCl2的250μL反应中将各级分75μL加入到8mM的ACP中,并如上所述进行测定。从该分离得到的活性级分再次对缓冲液A过夜透析。然后将整个样品装载到相同的Source 15Q 4.6/100PE阴离子交换柱上,用30倍柱体积的0-45%梯度的缓冲液B洗脱,流速0.5mL/分钟,且收集到1mL样品。如上进行了样品活性的测定。
6.2.1.5蛋白质凝胶电泳
使用标准凝胶电泳系统对蛋白质级分进行分析。将10μL级分加入到10μL的具有5%v/v 2-巯基乙醇的2X Laemmli样品缓冲液中(BioRad Cat#161-0737)并煮沸10分钟。然后样品短暂离心并将15μl装载在26孔4–15%CriterionTM TGXTM预制凝胶中且在1X Tris-Glycine-SDS缓冲液(由BioRad10x Tris/甘氨酸/SDS#161-0732制备而得)在130伏运行50分钟。凝胶经200mL的去离子水冲洗三次,每次5分钟。随后将SimplyBlueTM SafeStain(Life Technologies Cat#LC6060)加入到凝胶中以完全覆盖凝胶,然后在室温下轻微震荡培养1小时。之后弃掉SafeStain并且凝胶在震荡下经200ml的去离子水洗涤1小时。
6.2.1.6活性磷酸酶级分中蛋白质的鉴定
蛋白水解消化和多肽的分离
100μg的总蛋白通过胰蛋白酶进行蛋白质水解用于后续的LC-MS/MS鉴定。在37℃下100μg总蛋白经三羧乙基膦(4mM)还原30分钟,然后在黑暗中RT下经过碘乙酰胺(15mM)烷基化30分钟。将5μg胰蛋白酶加入到该消化混合物中,且在37℃下允许整个消化进行12小时。该反应经0.1%甲酸淬灭并注射到Ascentis Peptide express柱(5cmx2.1mm ID,2.1um粒度)上,然后从低乙腈到高乙腈梯度(0.1%甲酸作为改性剂)分离超过90分钟。该LC泵是由Shimadzu CBM20A LC控制器操作的两个Shimadzu LC20AD。
质谱参数
QTRAP 4000混合三重四极杆线性离子阱(ion trap)质谱仪用于鉴定从柱中被洗脱的多肽。IDA参数如下:选择离子从350到1300da;用于电荷状态测定的ER扫描;1+排斥离子(ions rejected),未知允许;滚动冲击能量:是(用于qtrap 4000的AB SCIEX标准);每个MS/MS最大填充时间:950ms。
通过Mascot多肽识别
Matrix Science的Mascot用于鉴定具有下列参数的来自CENPK2序列数据库的多肽。固定修饰:尿甲基化。变量修饰:脱酰胺作用(NQ),氧化(MW)。前体质量公差:0.5da。产品质量公差:1.0da。允许未酶切位点:1。
6.2.1.7菌株设计
缺乏功能性URA3基因的Y968版本由ms59858转化,以敲除RHR2或由ms59971转化以敲除HOR2。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体并通过PCR扩增确认。该结构体中的URA3标记两侧是同向重复(direct repeats),促进其回收。为了回收URA3标记,细胞在YPD上过夜生长,然后接种在5′FOA上。URA3的环出序列通过PCR扩增确认且不能在CSM-URA板上生长。然后Y968.ms59858的ura-版本由ms59971转化以产生RHR2和HOR2双敲除的菌株Y968.ms59858.ms59971。
6.2.2结果
6.2.2.1酶催化和通过加热及广谱磷酸酶抑制剂抑制乙酰磷酸水解
如图4所示,来自野生型酿酒酵母菌株Y967无细胞提取物的添加催化乙酰磷酸的水解,且水解速率取决于无细胞提取物的添加量。增加的无细胞提取物的量增加了水解速率。当煮沸无细胞提取物后,加入增加量的无细胞提取物不再对乙酰磷酸的水解速率造成影响,这表明起作用的成分已被加热灭活。同样地,加入30mM的广谱磷酸酶抑制剂氟化钠,使该无细胞提取物在水解乙酰磷酸方面无效。这些结果表明磷酸酶很可能是催化乙酰磷酸水解的原因。
6.2.2.2蛋白质分馏法分离单一浓缩的活性级分
阴离子交换层析用于分离无细胞提取物中可溶性蛋白。图5A显示几乎所有的磷酸酶活性都集中在一个级分中,且其余的活性在相邻的级分中。这表明造成无细胞提取物中该活性的酶是单一蛋白或经阴离子交换层析分离时具有相似离子相互作用的共洗脱的蛋白质。
从FPLC阴离子交换纯化得到的活性级分#10使用更浅的梯度0-45%缓冲液B进行第二次纯化,通过这次纯化得到的最有活性级分#14(如图6A所示)通过质谱法进行分析,以确定在所述级分中蛋白质的身份。活性级分中已鉴定的蛋白质中(图6B),Rhr2和其同源物Hor2是SGD数据库中被认定为磷酸酶的列表中唯一的蛋白质,由于它们具有显著的序列相似性不能通过质谱法进行区分。Rhr2是以高水平结构性表达的甘油-1-磷酸酶。Hor2催化相同的反应但在正常条件下仅以低水平表达并由渗透压力诱导(Norbeck等人,Purification and Characterization of Two Isoenzymes of DL-Glycerol-3-phosphatase from Saccharomyces cerevisiae,J.Biol.Chem.,271,13875-13881(1996))。乙酰磷酸并不是原产于酵母中的非代谢产物,因此可以预期水解是由靶向相似底物的酶的混杂反应引起的。对于该反应Rhr2/Hor2是第一候选物,这是因为它们的天然底物甘油-1-磷酸也是类似于乙酰磷酸的低分子量磷酸化的化合物,如下所示。
Glycerol 3-phosphate:甘油3-磷酸
Acetyl phosphate 乙酰磷酸
6.2.2.3 RHR2和/或HOR2的缺失降低磷酸酶活性
为了确定Rhr2和/或Hor2是否造成酿酒酵母中观察到的磷酸酶活性,使所创建的新菌株缺少RHR2或HOR2且一菌株同时缺少RHR2和HOR2。将这些菌株如前所述进行培养,制备无细胞提取物并测试乙酰磷酸酶活性。如图7所示,RHR2的缺失显着降低了磷酸酶活性,而HOR2的缺失对乙酰磷酸的水解速率没有影响。然而HOR2的缺失减少了已经有RHR2缺失的菌株中的乙酰磷酸水解。这与已发表的工作一致,其指出Hor2的表达在RHR2缺失后上调(DeLuna等人,Need-Based Up-Regulation of Protein Levels in Response to Deletion of Their Duplicate Genes,PLOS Biol.,8,e10000347(2010))。这两种磷酸酶的消除导致乙酰磷酸水解接近背景水平,如图7所示。这些结果证实了甘油-1-磷酸酶Rhr2和Hor2负责酿酒酵母中的绝大部分的乙酰磷酸酶活性。
6.3实施例3
乙酰磷酸磷酸酶的缺失降低了乙酸根离子分泌
并提高了衍生自乙酰辅酶A的化合物的产量
6.3.1材料和方法
6.3.1.1菌株构建
缺乏功能性URA3基因的Y968、Y12869和Y12746的版本由ms63907或ms63909以及ms64472转化,将它们转换为法呢烯生产者。
所述ms63907整合构建体(i84022;SEQ ID NO:33)如下所示。
该构建体包含编码可选标记(URA3)的核苷酸序列;在其自身的启动子下的天然酵母GAL4转录因子的副本;甲羟戊酸途径的两个天然酵母酶(编码乙酰乙酰辅酶A硫解酶的ERG10,和编码的HMG-CoA合酶的ERG13),以及Silicibacter pomeroyi HMG-CoA还原酶的酵母密码子-优化版本的两个副本,都在半乳糖诱导型启动子下(酿酒酵母基因GAL1和GAL10的启动子,其两侧是由酿酒酵母HO核酸内切酶基因座的上游和下游核苷酸序列组成的同源序列。经引入到宿主细胞,ms63907构建体通过同源整合而整合到宿主细胞基因组中,从而通过将其整合序列替换HO编码序列而在功能上破坏HO。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体并通过PCR扩增确认。该构建体中的URA3标记两侧是同向重复,促进其回收。为了回收URA3标记,细胞在YPD上过夜生长,然后接种在5′FOA上。URA3的环出序列通过PCR扩增确认且不能在CSM-URA板上生长。所述ms63909整合构建体(i84026;SEQ ID NO:34)与ms63907相同,但有一个例外:编码S.pomeroyi HMG-CoA还原酶的序列由tHMGr替换,所述tHMGr是编码天然酿酒酵母HMG-CoA还原酶的截短HMG1编码序列。
所述ms64472整合构建体(i85207;SEQ ID NO:35)如下所示。
该构建体包含编码可选标记(URA3)的核苷酸序列;麦角固醇途径的5种天然酵母酶(编码甲羟戊酸激酶的ERG12,编码磷酸甲羟戊酸激酶的ERG8,编码甲羟戊酸焦磷酸脱羧酶的ERG19,编码二甲基烯丙基二磷酸异构酶的IDI1和编码法尼焦磷酸合酶的ERG20),以及逐步形成的黄花蒿法呢烯合酶的酵母密码子-优化版本,都在半乳糖诱导型启动子下(酿酒酵母基因GAL1、GAL10和GAL7的启动子)。这些序列两侧是由GAL80的上游和下游核苷酸序列组成的同源序列。经引入到宿主细胞,ms64472构建体通过同源整合而整合到宿主细胞基因组中,通过将其整合序列替换GAL80编码序列在功能上破坏GAL80。使用在美国专利号8,221,982中所描述的方法组装构建体。在含2%葡萄糖的CSM-URA板上选择转化体并通过PCR扩增确认。该构建体中的URA3标记两侧是同向重复,促进其回收。为了回收URA3标记,细胞在YPD上过夜生长,然后接种在5′FOA上。URA3的环出序列通过PCR扩增确认且不能在CSM-URA板上生长。
下一步,Y968.ms63907.ms64472,Y12869.ms63907.ms64472和Y12747.ms63907.ms64472的ura-版本由ms59858转化,以敲除RHR2ORF。该整合构建体由RHR2的上游和下游核苷酸序列组成,RHR2的上游和下游核苷酸序列在其自身的启动子和终止子下位于天然酿酒酵母的URA3基因的两侧。将转化体接种在含2%葡萄糖作为唯一碳源的CSM-his板上并通过PCR扩增确认。
6.3.1.2培养条件
将单个菌落接种于96孔板的孔中(360μl种子培养基(实施例1中所述)),并于34℃以1000rpm震荡生长三天。然后,将14.4μl培养物在具有50mM琥珀酸盐(pH 5.0)和40g/L半乳糖的360μl种子培养基中作再次培养,并于34℃以1000rpm震荡生长两天。
6.3.1.3乙酸根离子和甘油的定量
通过将1ml全细胞培养液转移至1.5ml微量离心管中,并使用台式离心机以13,000rpm旋转1分钟以澄清上层清液来对乙酸根离子和甘油定量。然后将上清液以8mM硫酸稀释(1:1v/v),涡旋,然后在转移到1.8ml小瓶之前再次离心。样品使用BioRad Aminex HPX-87H 300mm x7.8mm柱,经过具有可变波长和折射率检测的Agilent 1200HPLC进行分析。流动相是4mM的硫酸,柱温为40℃,且流速为0.5ml/min。
6.3.1.4法呢烯定量
在34℃下培养两天结束时,将98μl全细胞培养液与2μl的尼罗红溶液(在DMSO中为100μg/ml)在平底96孔测定板(Costar 3916)中混合,并在96孔板摇床上混合30秒。然后以500nm的激发和550nm的发射通过Beckman M5读板器读出板子。
6.3.1.5光密度定量
在96孔测定板中,将8μl培养物与92μl稀释剂(20%PEG 200,20%乙醇,2%Triton X-114)混合,并在室温下培养30分钟。所述测定板在Beckman M5读板器上测量OD600之前先进行涡旋。
6.3.2结果
图8A示出了包含PDH-支路的缺失(acs1Δ acs2Δ ald6Δ)、异源表达乙醛脱氢酶酰化(Dz.eutE)以及磷酸转酮酶(Lm.PK)和磷酸转乙酰酶(Ck.PTA)、和过表达在法呢烯生产途径中的基因的菌株Y12746.ms63909.ms64472,比缺失RHR2基因的Y12746.ms63909.ms64472版本分泌更多的乙酸根离子。如图8B所示,RHR2的缺失不会影响甘油的产量,因为相比Y12746.ms63909.ms64472,Y12746.ms63909.ms64472rhr2^的甘油水平基本维持不变。如图8C所示,在Y12746.ms63909.ms64472rhr2^中乙酸根离子水平的大幅降低不归因于细胞生长减少,因为对RHR2+和rhr2^两个种群细胞密度是相似的。这些结果表明,是无细胞提取物中乙酰磷酸磷酸酶活性的起因的Rhr2,也是体内乙酰磷酸水解为乙酸根离子背后的主要原因。
为了确定在RHR2缺失时观察到的乙酸根离子减少是否不受法呢烯产量影响而发生,在具有完整或缺失RHR2基因但不表达在法呢烯生产途径中的基因的菌株12746版本中测量乙酸根离子产量。图8D示出了包含PDH-支路的缺失(acs1Δ acs2Δ ald6Δ)、异源表达乙醛脱氢酶酰化(Dz.eutE)以及磷酸转酮酶(Lm.PK)和磷酸转乙酰酶(Ck.PTA)的菌株Y12746,比缺失RHR2基因的Y12746版本分泌更多的乙酸根离子。如图8E所示,在Y12746.ms63909.ms64472 rhr2^中乙酸根离子水平的大幅降低不归因于细胞生长减少,因为对RHR2+和rhr2^两个种群细胞密度是相似的。这些数据表明,无论过表达的法呢烯生产途径是否存在,都发生乙酸根离子减少。
图9示出rhr2的缺失使Y12746.ms63907.ms64472中法呢烯产量提高了2.1倍,并在Y12745.ms63907.ms64472中提高了1.4倍(在每种菌株背景中,RHR2+亲本被标准化为1)。此外,rhr2的缺失提高了在碳源用尽时Y12746.ms63907.ms6447的最终光密度。Y12745.ms63907.64472和Y12746.ms63907.ms64472都使用磷酸转酮酶和磷酸转乙酰酶,并因此使用乙酰磷酸作为途径中间体,来产生细胞溶质的乙酰辅酶A,所述乙酰辅酶A用于合成法呢烯。菌株Y968.ms63907.ms64472和Y12869.ms63907.ms64472不表达磷酸转酮酶或磷酸转乙酰酶,并且不使用乙酰磷酸作为途径中间物。在这些背景菌株中rhr2的缺失不影响法呢烯产量或任一背景菌株的光密度。这表明敲除rhr2的益处特别适用于使用乙酰磷酸作为中间代谢物的菌株,例如,包含异源PK和/或PTA的菌株。
本说明书中所引用的所有出版物,专利和专利申请在此通过引用并入本文,如同各单独的出版物或专利申请具体而单独指明通过引用予以并入一样。为达清楚理解的目的,虽然通过说明和举例对上述发明进行了相当详细地描述,但是对本领域的普通技术人员将显而易见的是,根据本发明的教导可另外做出某些变化和修改而不脱离所附权利要求的精神或范围。
- 还没有人留言评论。精彩留言会获得点赞!