TRAIL受体结合剂及其用途的制作方法
发明领域
本公开一般涉及trail受体结合剂的治疗用途。特别地,本公开涉及包括ctb006,即一种抗trail-r2(dr5)抗体的方法和组合物,及其单独或与各种化学治疗剂组合时在体外和体内的肿瘤抑制的治疗效果。
发明背景
trail在上世纪90年代被鉴定,并且已知在肿瘤细胞的免疫监视中起重要作用。活化的t淋巴细胞和nk细胞表达高水平的trail,其使这些有免疫活性的细胞具备杀死肿瘤细胞的能力。动物研究表明,trail的敲除导致随着年龄增长而增高的肿瘤发病率。因此,trail缺陷或表达不足可能是肿瘤发生的一个因素。
在trail被发现后不久,人们注意到了它作为抗癌剂用于癌症治疗的潜力。这是基于trail选择性地杀死肿瘤细胞而不杀死正常细胞的能力。trail的抗肿瘤效力可以通过许多当前的癌症疗法(例如,化学疗法和放射疗法)来显著地增强。此外,trail可以致敏肿瘤细胞并提高肿瘤细胞对化学疗法和放射疗法的敏感性。因此,trail与化学疗法和放射疗法的组合有希望成为一种非常有效的抗肿瘤治疗方法。
trail是tnf蛋白质家族的成员。这个家族的一些蛋白质的特征是它们诱导细胞凋亡的能力,例如tnf-α和fas配体。然而,由于它们的毒副作用,tnf-α和fas的临床应用价值有限。相比之下,因为trail展现出对肿瘤细胞的选择性杀伤,它的临床价值是明显的。迄今为止,已经鉴定了trail的五种受体,其中的两种dr4(trail-r1)和dr5(trail-r2)能够转导细胞凋亡信号,而其他三种dcr1(trail-r3)、dcr2(trail-r4)和护骨蛋白(osteoprotegerin,opg)不转导细胞凋亡信号。trail的所有五种受体在它们的细胞外配体结合结构域中有显著的同源性。dr4和dr5的细胞内片段含有保守的功能结构域,即所谓的“死亡结构域”,其负责转导细胞凋亡信号。
发明概述
本技术涉及在有需要的受试者中治疗癌症的方法。在一些实施方式中,所述方法包括(a)向受试者施用包含单克隆抗体的组合物,所述单克隆抗体具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性;和(b)同时地、依序地或分别地向受试者施用化学治疗剂。
在一些实施方式中,所述抗体包含重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd,以及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw。在一些实施方式中,所述抗体是人嵌合抗体。在一些实施方式中,所述人嵌合抗体包含如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列。在一些实施方式中,所述癌症包括肝癌、结肠癌、乳腺癌、卵巢癌和白血病中的一种或多种。
在一些实施方式中,所述化学治疗剂包括5-氟尿嘧啶和紫杉醇中的一种或多种。在一些实施方式中,所述化学治疗剂是5-氟尿嘧啶。在一些实施方式中,所述化学治疗剂是紫杉醇。
在另一个方面,本文公开的是选择性诱导表达trail-r2多肽的细胞凋亡的方法。在一些实施方式中,所述方法包括(a)鉴定表达trail-r2多肽的细胞;和(b)使所述细胞与单克隆抗体相接触,所述单克隆抗体具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性。
在一些实施方式中,所述抗体包含重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd,以及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw。在一些实施方式中,所述抗体是人嵌合抗体。在一些实施方式中,所述人嵌合抗体包含如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列。在一些实施方式中,所述表达trail-r2多肽的细胞是癌细胞。在一些实施方式中,所述癌细胞包括肝癌细胞、结肠癌细胞、乳腺癌细胞、卵巢癌细胞和白血病细胞中的一种或多种。
在一些实施方式中,所述方法包括使所述细胞与化学治疗剂接触。在一些实施方式中,所述化学治疗剂包括5-氟尿嘧啶和紫杉醇中的一种或多种。在一些实施方式中,所述化学治疗剂是5-氟尿嘧啶。在一些实施方式中,所述化学治疗剂是紫杉醇。
在另一个方面,本文提供的是在有需要的受试者中治疗癌症的方法。在一些实施方式中,所述方法包括向受试者施用包含单克隆抗体的组合物,所述单克隆抗体具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性,其中所述受试者被鉴定为患有表达trail-r2的肿瘤。
在一些实施方式中,所述抗体包含重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd,以及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw。在一些实施方式中,所述抗体是人嵌合抗体。在一些实施方式中,所述人嵌合抗体包含如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列。在一些实施方式中,所述癌症包括肝癌、结肠癌、乳腺癌、卵巢癌和白血病中的一种或多种。
在一些实施方式中,所述方法还包括同时地、依序地或分别地向受试者施用化学治疗剂。在一些实施方式中,所述化学治疗剂是5-氟尿嘧啶。在一些实施方式中,所述化学治疗剂是紫杉醇。
在另一个方面,本公开提供了鉴定适合癌症治疗进行改善的受试者的体外方法,其中所述癌症治疗包括(a)向受试者施用包含单克隆抗体的组合物,所述单克隆抗体具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性;和(b)同时地、依序地或分别地向受试者施用化学治疗剂。在一些实施方式中,鉴定受试者的方法包括使来自受试者的肿瘤样品与单克隆抗体相接触,所述单克隆抗体具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性。在一些实施方式中,该抗体包含重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd,以及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw。在一些实施方式中,所述抗体是人嵌合抗体。在一些实施方式中,所述人嵌合抗体包含如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列。在一些实施方式中,所述癌症包括肝癌、结肠癌、乳腺癌、卵巢癌和白血病中的一种或多种。
在另一个方面,本公开提供了用于确定受试者是否适合癌症治疗进行改善的诊断试剂盒,其中所述癌症治疗包括(a)向受试者施用包含单克隆抗体的组合物,所述单克隆抗体具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性;和(b)同时地、依序地或分别地对受试者施用化学治疗剂。在一些实施方式中,所述试剂盒包括具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体。
在一些实施方式中,所述抗体包含重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd,以及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw。在一些实施方式中,所述抗体是人嵌合抗体。在一些实施方式中,所述人嵌合抗体包含如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列。在一些实施方式中,所述癌症包括肝癌、结肠癌、乳腺癌、卵巢癌和白血病中的一种或多种。
在另一个方面,本公开提供了抗体在制备用于在被鉴定为患有表达trail-r2的肿瘤的受试者中治疗癌症的药物中的用途。在一些实施方式中,所述抗体包括具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体。
在一些实施方式中,所述抗体包含重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd,以及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw。在一些实施方式中,所述抗体是人嵌合抗体。在一些实施方式中,所述人嵌合抗体包含如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列。在一些实施方式中,所述癌症包括肝癌、结肠癌、乳腺癌、卵巢癌和白血病中的一种或多种。在一些实施方式中,所述药物还包含一种或多种化学治疗剂。在一些实施方式中,所述化学治疗剂是5-氟尿嘧啶。在一些实施方式中,所述化学治疗剂是紫杉醇。
在另一个方面,本公开提供了抗体在制备用于选择性诱导表达trail-r2多肽的细胞凋亡的药物中的用途。在一些实施方式中,所述抗体包括具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体。
在一些实施方式中,所述抗体包含重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd,以及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw。在一些实施方式中,所述抗体是人嵌合抗体。在一些实施方式中,所述人嵌合抗体包含如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列。在一些实施方式中,所述表达trail-r2多肽的细胞是癌细胞。在一些实施方式中,所述癌细胞包括肝癌细胞、结肠癌细胞、乳腺癌细胞、卵巢癌细胞和白血病细胞中的一种或多种。在一些实施方式中,所述药物还包含一种或多种化学治疗剂。在一些实施方式中,所述化学治疗剂是5-氟尿嘧啶。在一些实施方式中,所述化学治疗剂是紫杉醇。
简要附图说明
附图描述了本文公开的技术的非限制性示例性实施方式,用以帮助读者理解本公开。在附图和附图描述中,人嵌合抗体huctb006被称为“ctb006”。
图1a和1b是显示通过化学发光酶免疫检测(chemiluminescentenzymeimmunoassay,cleia)测定的鼠ctb006,mctb006(图1a)和人ctb006(图1b)的结合特异性的图。测试了5种trail受体:dr5、dr4、dcr1、dcr2和opg中每一种的结合亲和力。
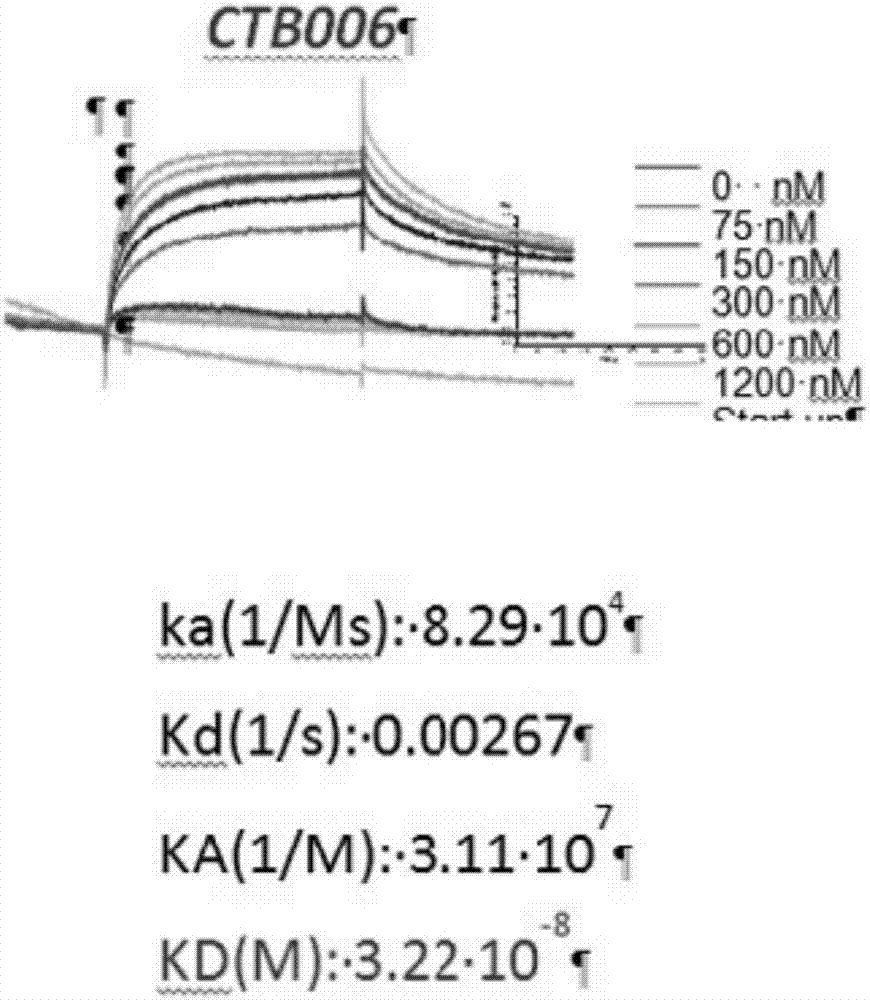
图2是表示通过表面等离子体共振(surfaceplasmonresonance,spr)测定的ctb006的亲和性的图。
图3a和3b是显示ctb006或奥沙利铂(oxaliplatin)对人正常组织细胞系wi-38(图3a)和hfl-1(图3b)的细胞毒性的图。
图4a和b是显示ctb006或奥沙利铂对人正常组织细胞系huv-ec-c(图4a)和肝分化细胞(图4b)的细胞毒性的图
图5a和5b是显示ctb006或奥沙利铂对人肝癌细胞系sk-hep-1(图5a)和hepg2(图5b)的细胞毒性的图。
图6a和6b是显示ctb006或伊立替康(irinotecan)对人结肠直肠癌细胞系colo205(图6a)和hct116(图6b)的细胞毒性的图。
图7a和7b是显示ctb006或伊立替康对人结肠直肠癌细胞系sw480(图7a)和widr(图7b)的细胞毒性的图。
图8a、8b和8c是显示ctb006或奥沙利铂对人胰腺癌细胞系bxpc3(图8a)、mia-paca-2(图8b)和panc2.03(图8c)的细胞毒性的图。
图9a和9b是显示ctb006或紫杉醇对人肺癌细胞系h2122(图9a)和sk-mes-1(图9b)的细胞毒性的图。
图10a和10b是显示ctb006或伊立替康对人乳腺癌细胞系mda-mb-231(图10a)和dy36t2(图10b)的细胞毒性的图。
图11a和11b是显示ctb006或伊立替康对人乳腺癌细胞系2-lmp(图11a)和sum102(图11b)的细胞毒性的图。
图12是显示ctb006或顺铂对人卵巢癌细胞系ovcar3的细胞毒性的图。
图13a和13b是显示ctb006或甲氨蝶呤(methotrexate)对人急性t淋巴细胞白血病细胞系molt-4(图13a)和jurkat(图13b)的细胞毒性的图。
图14是显示ctb006或5-fu对bgc823胃癌细胞的细胞毒性作用以及ctb006和5-fu组合对bgc823胃癌细胞的协同细胞毒性作用的图。
图15是显示ctb006或5-fu对panc2.03胰腺癌细胞的细胞毒性作用以及ctb006和5-fu组合对panc2.03胰腺癌细胞的协同细胞毒性作用的图。
图16是显示ctb006或紫杉醇对a549肺癌细胞的细胞毒性作用以及ctb006和紫杉醇组合对a549肺癌细胞的协同细胞毒性作用的图。
图17是显示ctb006或紫杉醇对h460肺癌细胞的细胞毒性作用以及ctb006和紫杉醇组合对h460肺癌细胞的协同细胞毒性作用的图。
图18是显示ctb006或5-fu对huh-7肝癌细胞的细胞毒性作用以及ctb006和5-fu组合对huh-7肝癌细胞的协同细胞毒性作用的图。
图19是显示ctb006或吉西他滨(gemcitabine)对7402肝癌细胞的细胞毒性作以及ctb006与吉西他滨组合对7402肝癌细胞的协同细胞毒性作用的图。
图20a和20b是显示ctb006、索拉非尼(sorafenib)、拉帕替尼(lapatinib)或厄洛替尼(erlotinib)中每一个单独对sw480结肠直肠癌细胞的细胞毒性作用,以及ctb006与索拉非尼、拉帕替尼或厄洛替尼组合对sw480结肠直肠癌细胞的协同细胞毒性作用的图。细胞用62.5、125、250、500或1000ng/ml的ctb006处理。索拉非尼、拉帕替尼和厄洛替尼分别以10μm(图20a)或5μm(图20b)使用。
图21a-21d。图21a和21b是显示ctb006、索拉非尼、拉帕替尼或厄洛替尼中每一个单独对widr结肠直肠癌细胞的细胞毒性作用,以及ctb006与索拉非尼、拉帕替尼或厄洛替尼组合对widr结肠直肠癌细胞的协同细胞毒性作用的图。21c和21d是显示ctb006、爱必妥(erbitux)或赫赛汀(herceptin)中每一个单独对widr结肠直肠癌细胞的细胞毒性作用,以及ctb006与爱必妥或赫赛汀组合对widr结肠直肠癌细胞的协同细胞毒性作用的图。细胞用62.5、125、250、500或1000ng/ml的ctb006以及10μm(图21a)或5μm(图21b)的索拉非尼、拉帕替尼和厄洛替尼,1μg/ml(图21c)或0.1μg/ml(图21d)的爱必妥或赫赛汀处理。
图22a-22c。图22a和图22b是显示ctb006、索拉非尼、拉帕替尼或厄洛替尼中每一个单独对bgc823胃癌细胞的细胞毒性作用,以及ctb006与索拉非尼、拉帕替尼或厄洛替尼组合对bgc823胃癌细胞的协同细胞毒性作用的图。图22c是显示ctb006、爱必妥或赫赛汀中每一个单独对bgc823胃癌细胞的细胞毒性作用,以及ctb006与爱必妥或赫赛汀组合对bgc823胃癌细胞的协同细胞毒性作用的图。细胞用62.5、125、250、500或1000ng/ml的ctb006以及10μm(图22a)或5μm(图22b)的索拉非尼、拉帕替尼和厄洛替尼,10μg/ml或1μg/ml的爱必妥或赫赛汀(图22c)处理。
图23a-23c。图23a和图23b是显示ctb006、索拉非尼、拉帕替尼或厄洛替尼中每一个单独对nugc3胃癌细胞的细胞毒性作用,以及ctb006与索拉非尼、拉帕替尼或厄洛替尼组合对nugc3胃癌细胞的协同细胞毒性作用的图。图23c是显示ctb006、爱必妥或赫赛汀中每一个单独对nugc3胃癌细胞的细胞毒性作用,以及ctb006与爱必妥或赫赛汀组合对nugc3胃癌细胞的细胞毒性作用的图。细胞用62.5、125、250、500或1000ng/ml的ctb006以及10μm(图23a)或5μm(图23b)的索拉非尼、拉帕替尼和厄洛替尼,10μg/ml或1μg/ml的爱必妥或赫赛汀(图23c)处理。
图24a和图24b是显示ctb006、索拉非尼、拉帕替尼或厄洛替尼中每一个单独对h460肺癌细胞的细胞毒性作用,以及ctb006与索拉非尼、拉帕替尼或厄洛替尼组合对h460肺癌细胞的协同细胞毒性作用的图。细胞用62.5、125、250、500或1000ng/ml的ctb006以及10μm(图24a)或5μm(图24b)的索拉非尼、拉帕替尼和厄洛替尼处理。
图25a和图25b是显示ctb006、索拉非尼、拉帕替尼或厄洛替尼中每一个单独对sk-br3乳腺癌细胞的细胞毒性作用,以及ctb006与索拉非尼、拉帕替尼或厄洛替尼组合对sk-br3乳腺癌细胞的协同细胞毒性作用的图。细胞用62.5、125、250、500或1000ng/ml的ctb006以及7μm(图25a)或3.5μm(图25b)的索拉非尼、拉帕替尼和厄洛替尼处理。
图26a和图26b是显示ctb006、索拉非尼、拉帕替尼或厄洛替尼中每一个单独对sum102乳腺癌细胞的细胞毒性作用,以及ctb006与索拉非尼、拉帕替尼或厄洛替尼组合对sum102乳腺癌细胞的协同细胞毒性作用的图。细胞用62.5、125、250、500或1000ng/ml的ctb006以及7μm(图26a)或3.5μm(图26b)的索拉非尼、拉帕替尼和厄洛替尼处理。
图27a和图27b是显示ctb006、索拉非尼、拉帕替尼或厄洛替尼中每一个单独对dy36t2乳腺癌细胞的细胞毒性作用,以及ctb006与索拉非尼、拉帕替尼或厄洛替尼组合对dy36t2乳腺癌细胞的协同细胞毒性作用的图。细胞用62.5、125、250、500或1000ng/ml的ctb006以及7μm(图27a)或3.5μm(图27b)的索拉非尼、拉帕替尼和厄洛替尼处理。
图28a和28b是显示ctb006或吉西他滨治疗对使用mia-paca-2(胰腺癌细胞)皮下模型的小鼠肿瘤进展的影响的图。图28a显示了ctb006或吉西他滨治疗对肿瘤体积的影响,图28b显示了ctb006或吉西他滨治疗对肿瘤重量的影响。图28a底部的“+”标志表示在当天处理了的小鼠。
图29是显示在mia-paca-2(胰腺癌细胞)皮下模型中ctb006或吉西他滨治疗对小鼠体重的影响的图。
图30a-30c是显示ctb006或伊立替康治疗对使用colo205皮下模型的小鼠肿瘤进展的影响的图。图30a显示了ctb006或伊立替康治疗对肿瘤体积的影响。图30b显示了ctb006或伊立替康治疗对肿瘤重量的影响,30c显示ctb006或伊立替康治疗对肿瘤携带率的影响。
图31是显示ctb006或伊立替康治疗对使用colo205皮下模型的小鼠体重的影响的图。
图32a和32b是显示ctb006或伊立替康治疗对使用widr皮下模型的小鼠肿瘤进展的影响的图。图32a显示了ctb006或伊立替康治疗对肿瘤体积的影响,32b显示了ctb006或伊立替康治疗对widr皮下模型肿瘤重量的影响。
图33是显示ctb006或伊立替康治疗对使用widr皮下模型的小鼠体重的影响的图。
图34a-34c是显示ctb006或紫杉醇治疗对使用h2122皮下模型的小鼠肿瘤进展的影响的图。图34a显示了ctb006或紫杉醇治疗对肿瘤体积的影响,图34b显示了ctb006或紫杉醇治疗对肿瘤重量的影响,图34c显示了ctb006或分类治疗对肿瘤携带率的影响。
图35是显示ctb006或紫杉醇治疗对使用h2122皮下模型的小鼠体重的影响的图。
图36a-36c。图36a是显示ctb006单独、5-fu单独以及ctb006与5-fu组合协同对皮下的小鼠模型中患体原发性肿瘤组织(结肠癌,cs146,2#)的肿瘤生长的影响的图。图36a显示ctb006和5-fu组合对肿瘤体积的协同作用。图36b显示单独用ctb006处理的肿瘤组织切片,和患体原发肿瘤组织cs146,he,200×的病理切片。图36c显示了用ctb006和5-fu处理的一部分肿瘤组织,和cs146,0#,he,200×的病理切片。
图37a-37c。图37a和37b是显示ctb006单独、伊立替康单独以及ctb006与伊立替康组合协同对皮下的小鼠模型中患体原发性肿瘤组织(结肠癌,cs182,5#)的肿瘤生长的影响的图。图37a显示了ctb006和伊立替康的组合对肿瘤体积的协同作用。图37b显示了ctb006和伊立替康组合对肿瘤重量的协同作用,图37c显示cs182,0#,he,200×的病理切片。
图38a-38e。图38a和38b是显示ctb006单独、伊立替康单独以及ctb006与伊立替康组合协同对皮下的小鼠模型中患者原发性肿瘤组织(结肠癌,cs263,1#)的肿瘤生长的影响的图。图38a显示了ctb006和伊立替康组合对肿瘤体积的协同作用。图38b显示了ctb006和伊立替康组合对肿瘤重量的协同作用。38c显示cs263,0#,he,200×的病理切片;图38d显示cs263,1#,he,200×的病理切片;图38e显示cs263,he,200×的病理检查结果,其中a)对照,b)组合组,c)未显示肿瘤细胞的组合组。
图39a-d。图39a和39b是显示ctb006单独、紫杉醇加卡铂(carboplatin)以及ctb006与紫杉醇加卡铂组合协同对皮下的小鼠模型中患者原发性肿瘤组织(肺癌,cs113,3#)的肿瘤生长的影响的图。图39a显示了ctb006与紫杉醇加卡铂组合对肿瘤体积的协同作用。图39b显示ctb006与紫杉醇加卡铂组合对肿瘤携带率的协同作用。图39c显示cs113,0#,he,200×的病理切片;图39d显示cs113,1#,he,200×的病理切片。
图40a-d。图40a和40b是显示ctb006单独、顺铂单独和ctb006与顺铂组合协同对皮下的小鼠模型中患者原发性肿瘤组织(肺癌,cs225,1#)的肿瘤生长的影响的图。图40a显示了ctb006与顺铂对肿瘤体积的协同作用。图40b显示ctb006与顺铂对肿瘤携带率的协同作用。图40c显示cs225,0#,he,200×的病理切片;图40d显示cs225,1#,he,200×的病理切片。
图41是表示人肿瘤细胞裂解液中的dr5浓度与ctb006的体外细胞毒敏感性之间的关系的图,显示了人肿瘤细胞裂解液中dr5浓度与ctb006的体外细胞毒性敏感性之间的相关性。具有较高dr5浓度的细胞在体外显示更有效的杀伤作用。“应答者(responder)”的阈值为0.208ng/ml,“部分应答者(partialresponder)”为0.109ng/ml。检测限为0.0256ng/ml。
图42a-i。图42a、b、d、e、g和h是组织切片。该图显示了cleiakit(cleia试剂盒)和ihc检测到的dr5表达的相容性(用一些结肠癌组织和相对邻近组织作为实例)。在该图中,左侧病理图(即图42a、42d和42g)是肿瘤的病理切片,右侧病理图(即图42b、42e和42h)是相对邻近组织。cleia试剂盒的结果表明了dr5的表达。从所有图中,clela试剂盒检测到的肿瘤较高的dr5表达对应于肿瘤的病理区域,其显示为
具体实施方式
i.概述
应当理解,本文公开的技术的某些方面、模式、实施方式、变型和特征在下面以各种详细程度进行描述,以便提供实质的理解技术。
本技术提供了可用于诱导表达trail-r2多肽的细胞凋亡的和用于治疗癌症的trail受体结合剂(例如抗体)。
由于trail的细胞凋亡诱导功能是由其受体介导的,所以trail受体系统已经被广泛的研究。早期研究表明,许多正常细胞可能在转录水平上表达trail的死亡受体(trail-r1和trail-r2)。随着抗死亡受体抗体可供使用,据信正常细胞和组织表达非常低水平的细胞表面trail-r1和trail-r2。相比之下,正常细胞和组织可能表达高水平的trail-r3和trail-r4。正常细胞中不同trail受体的差异表达可能是正常细胞逃避trail杀伤的保护机制。与正常细胞不同,大多数转化的肿瘤细胞表达高水平的trail-r1和trail-r2,而trail-r3和trail-r4的表达水平非常低。因此,大多数肿瘤细胞易受trail介导的杀伤。正常和肿瘤细胞之间差异表达的trail受体解释了trail的选择性。
许多临床前研究已经证实trail是治疗癌症的安全有效的治疗剂。已经显示,三聚可溶性trail的全身给药在实验动物中没有引起毒性,但还是能够诱导植入的肿瘤消退。更令人鼓舞的是,当trail与化学疗法或放射治疗结合使用时,其抗肿瘤功效显著提高。许多体外和体内实验已经证明这种协同作用。此外,trail可以增加肿瘤细胞对化学治疗和放射治疗的敏感性。由于肿瘤细胞对化学治疗和放射治疗的抵抗一直是治疗癌症的主要障碍,因此trail防止或逆转化疗或放疗的抵抗可能是未来癌症治疗的重大进展。
然而作为治疗剂,trail具有几个缺点。首先,trail具有至少五种受体,包括死亡受体和诱饵受体,因此缺乏对受体的选择性。特别是当癌细胞表达分化的死亡受体和诱饵受体时,难以预测trail诱导细胞凋亡的能力。第二,重组trail具有非常短的体内半衰期,这限制了trail在体内的有效剂量和抗癌功效。患者通常不方便接受重复和大剂量的trail。第三,某些形式的重组trail具有潜在的肝细胞毒性令人顾虑。
trail作为治疗剂的这些限制导致了trail替代品的开发。单克隆抗体可以选择性地靶向trail的死亡受体,这可能是更有效和安全的癌症治疗策略。
在从第一个单克隆抗体产生开始的25年中,单克隆抗体已经在癌症治疗中表现出巨大影响。大多数这些临床有效的单克隆抗体靶向癌细胞表面高度表达的抗原或受体,并阻断肿瘤生长所需的生长信号。这些抗体通过激活补体和抗体依赖性细胞毒性(antibody-dependentcytotoxicity,adcc)来杀死肿瘤细胞。此外,当与放射性同位素、毒素和药物结合时,单克隆抗体可以用作追踪分子,以将这些治疗剂带到癌组织并增强抗癌功效。
用以取代trail的trail-r1或trail-r2特异性单克隆抗体已经成功产生。已经有几种这样的抗体进入临床试验。初步结果表明,与trail相比,这些抗体不仅具有很强的抗癌功效,而且是安全的。
日本制药公司sankyo首先开发了抗trail-r2抗体tra-8。ichikawa等人使用trail-r2-fc融合蛋白作为免疫原来免疫balb/c小鼠。tra-8不诱导正常细胞凋亡,但是许多肿瘤细胞对tra-8诱导的凋亡高度敏感。虽然trail-r2的mrna在正常组织中广泛分布,但trail-r2蛋白在包括肝、肺、乳腺、肾、脾、卵巢、耳和胰腺的正常组织中无法检测到。然而,这些组织中的癌细胞表达高水平的trail-r2蛋白。另外,正常神经胶质细胞和外周血细胞表达trail-r2水平很低,对tra-8诱导的细胞凋亡不敏感,而胶质瘤细胞和白血病细胞表达高水平,对tra-8诱导的细胞凋亡非常敏感。tra-8在诱导肿瘤细胞凋亡中也表现出比trail高几倍的细胞凋亡诱导能力。重要的是,tra-8没有诱导正常肝细胞凋亡。当结合化疗或放射治疗时,tra-8的抗癌功效显著增强。tra-8目前正在进行i期临床试验。
人类基因科学公司进行了抗trail-r1抗体的i期试验。初步数据表明患者耐受化合物良好,在几例患者中观察到阳性反应表明抗trail-r1是安全有效的治疗剂。
本技术的trail受体结合剂(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)可单独或与其它活性剂(例如化学治疗药物)组合用于调节trail受体介导的功能。特别地,本技术的trail受体结合剂在与杀死癌细胞的化学治疗剂(例如5-氟尿嘧啶和/或紫杉醇)组合时显示出显著和意想不到的协同作用水平。此外,本技术的trail受体结合剂可用于检测测试样品(例如患者样品)中的trail受体多肽(即目标多肽)。trail受体结合剂可用于在有需要的受试者中诊断、预防和/或治疗trail受体相关的医疗状况。本技术的trail受体结合剂(例如抗体)提供了独特的生物功能和抗癌活性。尽管可溶性trail已经显示出在体内有效诱导肿瘤细胞的凋亡,但由于其半衰期短,杀伤活性似乎非常低,并且通常需要大量(和重复)的剂量。根据本技术的结合剂与trail和其它单特异性抗trail-r2抗体相比具有更强的药效。
本技术的各个方面另外涉及诊断方法和试剂盒,它们使用本技术的trail受体结合剂鉴定易患医学病症的个体,或者针对药物反应性、副作用或最佳药物剂量对个体进行分类。在其他方面,该技术提供了使用trail受体结合剂预防或治疗trail受体介导的病症,各种癌症以及筛选和/或验证配体(例如结合trail受体多肽的小分子)的方法。相应的,说明这些方面的各种具体实施方式如下。
在以下附随的说明中将阐述本技术的一个或多个实施方式的细节。本领域技术人员将认识到与本文所述类似或等同的方法和材料可用于本技术的实践或测试。该技术的其它特征、目的和优点将由说明书和权利要求书而变得显而易见。一般地,酶促反应和纯化步骤是根据制造商的说明书来进行的。本文中的技术和程序通常根据本领域的常规方法和各种一般参考文献(大体参考sambrook等人,molecularcloning:alaboratorymanual,2ded.(coldspringharborlaboratorypress,coldspringharbor,newyork,1989)进行,其在本申请文件全文中均有提供。
ii.定义和缩写
除非另外定义,此处使用的所有技术和科学术语的含义一般与本技术所属领域的普通技术人员通常所理解的相同。除非文章内容明确地另有所指,在本说明书和附随的权利要求中使用的单数形式“一种/个(a,an)”和“该(the)”包括了复数的所指。例如,提及“细胞(acell)”时,包括两个或更多细胞的组合等等。一般地,在此使用的命名法和本文所描述的细胞培养、分子遗传学、有机化学、分析化学和核酸化学及杂交中的实验方法是本领域公知和常用的。核酸和肽合成使用标准的技术。化学合成和化学分析使用标准的技术或其修改方案。本文引用的所有参考文献通过整体并且出于所有目的引用并入本文,其程度如同每个单独的出版物、专利或专利申请都具体及分别的出于所有目的被引用。
选用的生物化学和血液学术语的缩写分别总结在下面的表a和表b中
以下提供了在本说明书中使用的某些术语的定义。其他术语的定义可以在illustrateddictionaryofimmunology,2ndedition(cruse,j.m.和lewis,r.e.,eds.,bocaraton,fl;crcpress,1995)中找到。
术语对“dr4”和“trail-r1”、“dr5”和“trail-r2”、“dcr1”和“trail-r3”以及“dcr2”和“trail-r4”可以互换使用。除非另外表明,在本文中使用这些术语时是指人类蛋白质和基因。鼠类版本的分子之前可加有“m”。
如本文所用,本技术的trail受体结合剂(例如抗体)或其变体或片段的术语“生物活性”是指试剂(1)特异性结合trail-r2(dr5);(2)在体外和体内诱导癌细胞死亡;和(3)表现出与化疗药物如紫杉醇和5-氟尿嘧啶在体外和体内诱导癌细胞死亡的协同作用的能力。
如本文所用,术语“协同作用”或“协同剂”是指在两种或更多种试剂、实体、因子或物质之间产生的作用大于其各自作用的总和的效果。在一些实施方式中,生物活性剂如本技术的trail受体结合剂(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)与化学治疗剂之间的协同作用是通过药物相互作用系数(coefficientofdruginteraction,即cdi)确定的(参考caoss等人,potentiationofantimetaboliteantitumoractivityinvivobydipyridamoleandamphotericinb.cancerchemotherpharmacol1989;24:181-186)。在一些实施方式中,cdi计算如下:cdi=ab/a×b。根据每组的化学发光,ab是合用组与对照组的比例;a或b是单一药剂组与对照组的比例。当cdi值小于1时,药物组合是协同的。在确定两种或更多种组分之间的协同相互作用时,在一些实施方式中,可以通过给需要治疗的患者在不同的w/w比例范围和/或不同剂量下施用该组分,来测量效果的最佳范围和每种组分对于该效果的绝对剂量范围。在一种物种中观察到的协同作用可以预测其他物种中的效果,这些研究的结果可用于预测有效剂量。
如本文所用,术语“显著的协同作用”或“显著协同的”是指在两种或更多种试剂、实体、因子或物质之间产生的作用在统计学上显著大于其各自作用的总和效果。作为实例而不是限制,当cdi值小于0.7时,药物组合是显著协同的。
如本文所用,术语“加和的”是指在两种或更多种试剂、实体、因子或物质之间产生的作用等于其各自作用的总和的效果。作为实例而不是限制,当cdi值等于1时,药物组合是加和的。
如本文所用,术语“拮抗”或“拮抗的”是指在两种或更多种试剂、实体、因子或物质之间产生的作用小于其各自作用的总和的效果。作为实例而不是限制,当cdi值大于1时,药物组合是拮抗的。
如本文所用,术语“trail受体”是指tnf受体家族的成员。人trail受体是trail(ap02配体)的细胞表面受体。迄今为止,已经鉴定了trail的五个受体,其中两个dr4(trail-r1;cd261或死亡受体4)和dr5(trail-r2;cd262或死亡受体5)能够转导凋亡信号,而其他三个dcr1(trail-r3;cd263或诱饵受体1)、dcr2(trail-r4;cd264或诱饵受体2)和骨保护素(opg)不转导细胞凋亡信号。三聚trail与trailr1或trailr2的结合通过这些受体的低聚诱导细胞凋亡。trailr1和trailr2由胞外富含半胱氨酸的结构域、跨膜结构域和细胞质死亡结构域组成。trailr3和trailr4也具有细胞外富含半胱氨酸的结构域,但trailr3缺少细胞质死亡结构域,trailr4具有截短的结构域。trail的所有五个受体在其细胞外配体结合结构域中具有显著的同源性。dr4和dr5的细胞内段含有保守的功能结构域,即所谓的“死亡结构域”,其负责转导凋亡信号。
如本文所用,试剂或药物对受试者的施用包括自我施用和由他人施用。还应当理解,所描述的医疗状况的各种治疗模式或预防措施旨在表示“实质性的”,其包括总体但也包括少于总体的治疗或预防,并且其中实现了一些生物学或医学上相关的结果。
如本文所用,术语“氨基酸”包括天然存在的氨基酸和合成氨基酸,以及以与天然存在的氨基酸类似的方式起作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的氨基酸,以及随后被修饰的那些氨基酸,例如羟脯氨酸、γ-羧基谷氨酸和o-磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构的化合物,即与氢、羧基、氨基和r基团结合的α-碳,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。这样的类似物具有修饰的r基团(例如正亮氨酸)或修饰的肽主链,但保留了与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物是指具有与氨基酸的一般化学结构不同的结构,但是以与天然存在的氨基酸类似的方式起作用的化合物。氨基酸在此可以通过它们公知的三字母符号或通过iupac-iub生物化学术语委员会推荐的单字母符号来指代。同样地,核苷酸可以通过它们公认的单字母代码来指代。
如本文所用,术语“抗体”是指包含特异性结合并识别抗原例如trail受体多肽的免疫球蛋白基因或其片段的框架区的多肽。术语“抗体”的使用意图包括完整抗体、包括单链的完整抗体,以及其抗原结合片段。术语“抗体”包括双特异性抗体和多特异性抗体,只要它们展现了期望的生物学活性或功能。
如本文所用,术语“抗体相关的多肽”是指抗原结合性抗体片段,包括单链抗体,其可以包含单独的可变区或与所有或部分的以下多肽元件组合的可变区:抗体分子的绞链区、ch1、ch2和ch3结构域。本公开还包括可变区与绞链区、ch1、ch2和ch3结构域的任何组合。可用作本技术的结合剂的抗体相关分子包括但不限于fab、fab'和f(ab')2、fd、单链fvs(scfv)、单链抗体、二硫键连接的fvs(sdfv)和包含vl或vh结构域的片段。实例包括:(i)fab片段,由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab')2片段,包含在铰链区通过二硫桥连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的vl和vh结构域组成的fv片段;(v)由vh结构域组成的dab片段(ward等人,nature341:544-546,1989);和(vi)分离的互补决定区(cdr)。因而,“抗体片段”可以包含全长抗体的一部分,通常是抗原结合区或其可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;双价抗体;线性抗体;单链抗体分子;和由抗体片段形成的多特异性抗体。单链抗体分子可以包含具有多个单独分子的聚合物,例如,二聚体、三聚体或其它聚合物。
如本文所用,术语“生物样品”是指源自于活细胞或被活细胞接触过的样品材料。术语“生物样品”意图包括从受试者分离的组织、细胞和生物液体,以及存在于受试者体内的组织、细胞和液体。本技术的生物样品包括,例如但不限于,全血、血浆、精液、唾液、泪液、尿液、粪便材料、汗液、口腔的(buccal)、皮肤、脑脊液和毛发。生物样品也可以从内脏的活检或从癌症获得。生物样品可以从用于诊断或研究的受试者获得,或者可以从未患病的个体获得,作为对照或用于基础研究。
如本文所用,术语“cdr-移植的抗体”是指其中至少一个“受体”抗体的cdr被来自具有所需抗原特异性的“供体”抗体的cdr“接枝”替代的抗体。
如本文所用,术语“嵌合抗体”是指使用重组dna技术将来自一个物种(例如,小鼠fc恒定区)的单克隆抗体的fc恒定区用另一个物种fc恒定区(例如,人fc恒定区)替换的抗体。一般地参见,robinson等人,pct/us86/02269;akira等人,欧洲专利申请184,187;taniguchi,欧洲专利申请171,496;morrison等人,欧洲专利申请173,494;neuberger等人,wo86/01533;cabilly等人美国专利no.4,816,567;cabilly等人,欧洲专利申请125,023;better等人,science240:1041-1043,1988;liu等人,procnatlacadsciusa84:3439-3443,1987;liu等人,jimmunol139:3521-3526,1987;sun等人,procnatlacadsciusa84:214-218,1987;nishimura等人,cancerres47:999-1005,1987;wood等人,nature314:446-449,1885;和shaw等人,jnatlcancerinst80:1553-1559,1988。
如本文所用,术语“比较窗口”(comparisonwindow)是指具有选自20至600个,通常为约50至约200个,更通常为约100至约150个氨基酸或核苷酸的任一个连续位置数的片段,其中序列可以与具有相同连续位置数的参考序列在两个序列以最优方式对齐以后进行比较。
如本文所用,术语“共有fr”是指共有免疫球蛋白序列中的框架(fr)抗体区域。抗体的fr区域不接触抗原。
如本文所用,术语“共有序列”是指由在相关序列的家族中最经常出现的氨基酸(或核苷酸)所形成的序列(参见,例如,winnaker,fromgenestoclones(verlagsgesellschaft,weinheim,germany1987)。也就是说,在蛋白质的家族中,共有序列中的每个位置均被家族中在该位置上最常出现的氨基酸所占据。如果两个氨基酸出现频度相等,则其中任一个均可以被包括在共有序列中。
如本文所用,术语“接触”用于细胞时是指这样一种过程,通过该过程本技术中的trail受体结合剂、抗体、抗体组合物、细胞毒性剂或部分、基因、蛋白质和/或反义序列,被递送到目标细胞或被放置在与靶细胞直接接近的位置。该递送可以在体外或体内,并且可以涉及使用重组载体系统。
如本文所用,术语“细胞毒性部分”(“cytotoxicmoiety”)是指当接近细胞或被细胞吸收时抑制细胞生长或促进细胞死亡的部分。在这方面,合适的细胞毒素部分包括放射性试剂或同位素(放射性核素)、化学毒物如分化诱导剂、抑制剂和小的化学毒性药物、毒素蛋白质及其衍生物以及核苷酸序列(或其反义序列)。因此,作为非限制性实例,细胞毒性部分可以是化学治疗剂、光活化毒素或放射性试剂。
如本文所用,术语“双价抗体”是指具有两个抗原结合位点的小抗体片段,该片段在相同的多肽链(vhvl)中含有相互连接的轻链可变域(vl)和重链可变域(vh)。通过使用过短而不容许在同一链上两个结构域之间配对的接头,结构域被迫与另一链的互补结构域配对,并产生两个抗原结合位点。双价抗体在例如ep404,097;wo93/11161和30hollinger等人,proc.natl.acad.sci.usa,90:6444-6448(1993)中有更详细的描述。
如本文所用,术语“效应物细胞”是指免疫应答的效应物阶段——与免疫反应的认知和活化阶段相对——中涉及的免疫细胞。示例性的免疫细胞包括骨髓或淋巴来源的细胞,例如,淋巴细胞(例如,b细胞和t细胞,包括细胞溶解性t细胞(ctl))、杀伤细胞、天然杀伤细胞、巨噬细胞、单核细胞、嗜酸细胞、嗜中性细胞、多形核细胞、粒细胞、肥大细胞和嗜碱性细胞。效应物细胞表达特定的fc受体并进行特定的免疫功能。效应物细胞可以诱导抗体依赖性细胞介导的细胞毒性(antibody-dependentcell-mediatedcytotoxicity,adcc),例如,能够诱导adcc的嗜中性细胞。例如,表达fcαr的单核细胞、巨噬细胞、嗜中性细胞、嗜酸细胞和淋巴细胞参与目标细胞的特异性杀伤,并向免疫系统的其他成分呈递抗原,或结合呈递抗原的细胞。效应细胞也可以吞噬目标抗原、目标细胞、转移性癌细胞或微生物。
如本文所用,术语“表位”是指能够特异性结合抗体的蛋白质决定簇。表位通常由化学活性的表面分子群集(grouping)例如氨基酸或糖类侧链组成,并且通常具有特定的三维结构特性,以及特定的电荷特征。构象表位和非构象表位的区别在于在变性溶剂的存在下与前者的结合会丧失,而与后者的结合不会丧失。
为了筛选特异性结合表位的trail受体结合剂,可以进行常规的交叉阻断(cross-blocking)测定,例如在antibodies,alaboratorymanual,coldspringharborlaboratory,edharlow和davidlane(1988)中描述的。这种分析可以用于确定测试的trail受体结合剂是否结合与本技术的trail-r1和/或trail-r2抗体相同的位点或表位。另外一种方式,或者附加的,可以通过本领域已知的方法进行表位作图(epitopemapping)。例如,抗体序列可以被例如通过丙氨酸扫描诱变,以鉴定接触残基。在另一种方法中,与trail-r1和trail-r2的不同区域相应的肽可以用于与测试抗体,或者与测试抗体及具有已被表征的或已知的表位的抗体进行竞争测定。
如本文所用,术语组合物的“有效量”是足以实现所需治疗和/或预防效果的量,例如,导致与正在治疗的疾病(例如与靶多肽相关的疾病)相关的症状的预防或减少。施用给受试者的本技术的组合物的量将取决于疾病的类型和严重度,以及取决于个体的特征,例如一般健康状态、年龄、性别、体重和对药物的耐受性。还将取决于疾病的程度、严重度和类型。技术人员将能够取决于这些和其他因素确定合适的剂量。本技术的组合物也可以相互组合、或与一种或多种其他的治疗化合物组合施用。
如本文所用,“表达”包括但不限于下面的一项或多项:基因转录成前体mrna;前体mrna的剪接和其他处理来产生成熟mrna;mrna稳定性;成熟mrna翻译成为蛋白质(包括密码子利用(codonusage)和可供使用的trna(trnaavailability));以及翻译产物的糖基化和/或其他修饰,如果对于适合的表达和功能是必需的。
如本文所用,“融合多肽”包含与如下所述的多肽有效连接的trail受体多肽,所述多肽具有对应于与trail受体多肽基本上不同源的多肽的氨基酸序列,例如不同于trail受体多肽,并且衍生自相同或不同的生物体的多肽。
如本文所用,术语“基因”是指包含调节rna产物的生物合成的所有信息的dna片段,包括启动子、外显子、内含子和其他控制表达的非翻译区。
如本文所用,术语“基因型”是指在个体中一对同源染色体上的基因座中的一个或多个多态性或突变位点处发现的无序的(unphased)5'至3'核苷酸对序列。如本文所用,基因型包括全基因型和/或亚基因型(sub-genotype)。
如本文所用,术语“人类序列抗体”包括具有来自人类种系(humangermline)免疫球蛋白序列的可变区和恒定区(如果存在)的抗体。本技术的人类序列抗体可以包括不被人类种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外的随机或定点诱变或通过体内的体细胞突变而引入的突变)。这些抗体可以在非人类转基因动物中产生,例如,如pct公开文本wo01/14424和wo00/37504中所描述的。然而,如本文所用,术语“人类序列抗体”并不意图包括其中源自另一哺乳动物物种(例如小鼠)的cdr序列已经被移植到人框架序列(例如人源化抗体)上的抗体。
如本文所用,术语非人类(例如鼠)抗体的“人源化”形式,是含有最少的来自非人免疫球蛋白的序列的嵌合抗体。大体上,人源化的抗体是人免疫球蛋白,在其中受体的高变区残基被来自非人物种(供体抗体),例如小鼠、大鼠、兔或非人灵长类的,并具有期望的特异性、亲和性和能力(capacity)的高变区残基所替代。在有些情况下,人免疫球蛋白的fv骨架区(fr)残基被相应的非人残基替代。此外,人源化抗体可以包含既不在受体抗体中存在也不在供体抗体中存在的残基。进行这些修饰以进一步改善抗体性能,例如结合亲和力。通常,人源化抗体将包含至少一个,通常为两个可变结构域的基本全部(substantiallyall),其中全部或基本上全部的高变环与非人免疫球蛋白的那些高变环相对应,并且所有或基本上所有fr区均为人类免疫球蛋白序列的那些fr区,尽管fr区可以包括提高结合亲和力的一个或多个氨基酸取代。在fr区域中这些氨基酸替换的数目一般是在h链中不超过6个,在l链中不超过3个。人源化抗体任选地还包含至少一部分免疫球蛋白恒定区(fc),通常为人免疫球蛋白的恒定区。进一步的细节参见jones等人,nature321:522-525(1986);reichmann等人,nature332:323-329(1988);和presta,curr.op.struct.biol.2:593-596(1992)。
本文考虑了在此所述的trail-r2结合剂的氨基酸序列修饰。例如,可能需要改善抗体的结合亲和力和/或其他生物学性质。通过向抗体核酸中导入合适的核苷酸变化或通过肽合成来制备trail-r2结合剂的氨基酸序列变体。这样的修饰包括,例如,删除、和/或插入和/或替换trail-r2结合剂的氨基酸序列内的残基。只要获得的抗体具有希望的性质,例如,生物活性,可进行删除、插入和替换的任何组合来获得感兴趣的抗体。修饰还包括蛋白质的糖基化模式的改变。一种有用的鉴定优选的诱变位置方法称为“丙氨酸扫描诱变”,如cunningham和wells在science,244:1081-1085(1989)中所描述的。然后针对所希望的活性筛选突变抗体。本技术包括具有cgmcc登录号1691的杂交瘤ctb006所定义的氨基酸序列中添加、删除和/或替换了一个或多个氨基酸的抗体变体,只要所述抗体变体具有希望的性质,例如,生物活性。
如本文所用,术语“高变区”是指抗体中负责抗原结合的氨基酸残基。高变区一般包含来自“互补决定区(complementaritydeterminingregion)”或“cdr”的氨基酸残基(例如,vl中的残基23-34(l1)、50-56(l2)和89-97(l3)左右,和vh中的残基31-35b(h1)、50-65(h2)和95-102(h3)左右)(kabat等人,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991));和/或来自“高变环”的那些残基(例如,vl中的残基26-32(li)、50-52(l2)和91-96(l3)和vh中的26-32(h1)、52a-55(h2)和96-101(h3)(chothia和leskj.mol.biol.196:901-917(1987))。
如本文所用,当在两个或多个核酸或多肽序列的上下文中使用时,术语“相同”或百分比“同一性”是指,如使用具有如下所述默认参数的blast或blast2.0序列比较算法,或通过人工比对或目视检查(参见例如ncbi网站),所测定的两个或更多个序列或亚序列相同或指定百分比的氨基酸的残基或核苷酸相同(即当以比较窗口或指定区域上的最大对应度来进行比较和比对时,在指定的区域(例如,编码本文所述抗体的核苷酸序列,或本文所述抗体的氨基酸序列)上有约60%同一性、优选地65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的同一性)。然后这些序列被称为“基本上相同的”。该术语还指,或者说可以用于,测试序列的互补序列(complement)。该术语还包括具有删除和/或添加的序列,以及那些具有替换的序列。如下所述,优选的算法可以考虑缺口等等。在一些实施方式中,同一性存在于长度为至少约25个氨基酸或核苷酸的区域上;附加或替代地,在一些实施方式中,同一性存在于长度为50-100个氨基酸或核苷酸的区域上。
“分离的”或“纯化的”多肽或其生物学活性部分基本上不含来自该trail受体结合剂所来源的细胞或组织的细胞材料或其他污染多肽,或者,当它们为化学合成时,基本上不含化学药品前体或其他化学药品。例如,作为分离的trail受体结合剂的抗trail受体抗体将不含有干扰该试剂的诊断或治疗用途的材料。这样的干扰材料可以包括酶、激素和其他蛋白质性的或非蛋白质性的溶质。
如本文所用,短语“诱导细胞死亡”或“能够诱导细胞死亡”是指本技术的trail受体结合剂使有活力的细胞变得没有活力的能力。细胞死亡和细胞活力可以通过本领域的各种方法,例如锥虫蓝排除测定和其他细胞活力分析来测定。在本技术中,细胞死亡特别地是由“凋亡”或称为“程序性细胞死亡”诱导的,其通过膜联蛋白v的结合、dna片段、细胞收缩、内质网扩张、细胞破碎和/或膜囊泡(称为凋亡体)的形成来判定。有很多方法可用于评估与凋亡相关的细胞事件。例如,磷脂酰丝氨酸(phosphatidylserine,ps)转位可以通过膜联蛋白结合来测量;dna片段化可以通过dna梯状化(laddering)来评估;核/染色质缩合以及dna片段化可以通过亚二倍体细胞的任何提高来评估。目标细胞是表达trail-r2的细胞,优选地,所述细胞是肿瘤细胞,例如,乳腺、结肠、卵巢、胃、子宫内膜、唾液腺、肺、肾脏、甲状腺、胰腺或膀胱细胞。
如本文所用,术语“完整抗体”是指具有由二硫键互连的至少两个重(h)链多肽和两个轻(l)链多肽的抗体。每个重链由一个重链可变区(在此缩写为hcvr或vh)和一个重链恒定区构成。重链恒定区由三个结构域,ch1、ch2和ch3构成。每个轻链由一个轻链可变区(在此缩写为lcvr或vl)和一个轻链恒定区构成。轻链恒定区由一个结构域cl构成。vh和vl区域可以进一步分成高可变性的区域,称为互补决定区(complementaritydeterminingregions,cdr),这些互补决定区中间间隔着更为保守的区域,称为框架区域(frameworkregions,fr)。每个vh和vl由三个cdr和四个fr组成,它们从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白对宿主组织或因子的结合,包括免疫系统的各种细胞(例如效应物细胞)和经典补体系统的第一成分(c1q)。
如本文所用,术语“免疫应答”是指淋巴细胞、抗原呈递细胞、吞噬细胞、粒细胞和上述细胞或肝脏产生的可溶大分子(包括抗体、细胞因子和补体)的协同动作,引起人体的癌性细胞、转移性肿瘤细胞、恶性黑色素瘤、侵入的病原体、病原体感染的细胞或组织的选择性的损害、破坏或消灭;或者,在自体免疫或病理性炎症的情况下,正常的人类细胞或组织的选择性的损害、破坏或消灭。
如本文所用,术语“免疫交叉反应性”和“免疫反应性”可互换地使用,是指与抗体特异性地反应的抗原,所述抗体是利用相同的(“免疫反应性”)或不同的(“免疫交叉反应性”)抗原产生的。一般地,抗原是trail受体多肽,其变体或子序列。
如本文所用,术语“免疫反应条件”是指使针对抗原的特定表位而产生的抗体结合该表位,其结合的程度可检测地大于(detectablygreaterthan)该抗体与基本上所有其他表位结合程度的条件,其结合的程度一般至少高于背景结合至少两倍。免疫反应条件取决于抗体结合反应的模式,一般是在免疫分析方案中利用的那些模式。免疫分析模式和条件的描述可参见,harlow和lane,antibodies,alaboratorymanual(coldspringharborpublications,newyork,1988)。
如本文所用,术语“淋巴细胞”是指血液、淋巴和淋巴组织中存在的任何单核的、非巨噬细胞的白细胞,例如,b淋巴细胞和t淋巴细胞。
本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即除了可能以少量存在的可能自然发生的突变之外,构成所述群体的抗体个体是相同的。单克隆抗体是高度特异的,针对单个的抗原性位点。此外,与常规的(多克隆的)抗体制品——它们通常包含对不同决定簇(表位)的不同抗体——形成对照的是,每种单克隆抗体针对的是抗原上的单个决定簇。修饰语“单克隆”表明了抗体是从实质上同质的抗体群体获得的,并不能解释为要求通过任何特别的方法生产抗体。例如,根据本技术使用的单克隆抗体可以通过首先由kohler等人,nature256:495(1975)描述的杂交瘤方法制备,或可以通过重组dna方法制备(参见,例如,美国专利no.4,816,567)。“单克隆抗体”也可以利用,例如,clackson等人,nature352:624-628(1991)和marks等人,j.mol.biol.222:581-597(1991)中描述的技术从噬菌体抗体库中分离。
如本文所用,术语“医学状况”包括但不限于,希望对其治疗和/或预防的、表现为一种或多种生理和/或心理学的症状的任何状况或疾病,包括早先和新近鉴定的疾病和其他病症。
如本文所用,术语“调节物”包括抑制剂和活化剂。抑制剂是,例如,结合于、部分地或全部地阻断刺激、降低、阻止、延迟活化、灭活、去致敏或下调trail受体多肽的活性的试剂,例如拮抗剂。活化物是,例如,结合于、刺激、提高、开放、活化、易化、增强活化、致敏或上调trail受体多肽的活性的试剂,例如激动剂。调节物包括,例如,改变trail受体多肽与下列物质的相互作用的试剂:结合活化剂或抑制剂的蛋白质、受体,包括蛋白质、肽、脂质、碳水化合物、多糖或上述物质的组合,例如脂蛋白、糖蛋白等等。调节物包括天然存在的trail受体多肽的遗传修饰的型式,例如,活性改变的遗传修饰型式,以及天然存在的和合成的配体、拮抗剂、激动剂、小化学分子等等。
如本文所用,术语“中和抗体”是指能够消除或显著地降低trail受体多肽或trail受体样多肽的至少一种(1种)生物学功能的抗体分子。
如本文所用,术语“核苷酸对”是指在两条核苷酸链之间相互结合的两个核苷酸。
如本文所用,术语“药学上可接受的载体”意图包括与药物施用相容的任何和所有的溶剂、分散介质、包衣、抗细菌和抗真菌化合物、等渗和吸收延迟化合物等等。
如本文所用,术语“多克隆抗体”是指衍生于至少两种(2种)不同的抗体生产细胞系的抗体的制品。该术语的使用包括至少两种(2种)抗体的制品,其含有特异性结合抗原的不同表位或区域的抗体。如本文所用,术语“多核苷酸”是指任何rna或dna,其可以是未修饰或修饰的rna或dna。多核苷酸包括但不限于单链和双链dna,单链和双链区域混合物的dna;单链和双链rna,单链和双链区域的混合物的rna;以及包含dna和rna的杂交分子,其可以是单链,或更一般地是双链或是单链和双链区域的混合物。此外,多核苷酸指包含rna或dna或rna与dna两者的三链区域。术语多核苷酸还包括含有一个或多个修饰的碱基的dna或rna,以及具有为了稳定性或其他理由修饰了骨架的dna或rna。在特定的实施方式中,多核苷酸含有来自trail受体基因的多核苷酸序列。
如本文所用,术语“多肽”、“肽”和“蛋白质”在此可互换地用来指包含通过肽键或修饰的肽键(即肽电子等排体)连接在一起的两个或更多个氨基酸的聚合物。多肽既指短的链,通常称为肽、糖肽或寡聚体;也指较长的链,一般称作蛋白质。多肽可以含有20种基因编码的氨基酸之外的氨基酸。多肽包括通过翻译后加工等自然过程所修饰的,或通过本领域公知的化学修饰技术所修饰的氨基酸序列。这些修饰在基础教科书以及在更详细的专著中,以及在大量研究文献中有详尽的记载。在特定的实施方式中,多肽含有来自trail受体蛋白的多肽序列。
如本文所用,术语“重组”当用来指例如细胞、或核酸、蛋白质或载体时,表明该细胞、核酸、蛋白质或载体已经通过异源核酸或蛋白质的导入或天然核酸或蛋白质的改变而被修饰,或者所述材料来自这样修饰的细胞。因而,例如,重组细胞表达在该细胞的天然(非重组)形式中不存在的基因,或表达本应异常表达、少量表达或根本不表达的天然基因。
如本文所用,短语“救助受体结合表位(salvagereceptorbindingepitope)”是指igg分子(例如,igg1、igg2、igg3或igg4)的fc区域的一种表位,其负责提高igg分子的体内血清半衰期。为了提高抗体的血清半衰期,可以像例如美国专利5,739,277所描述的那样向抗体(特别是抗体片段)中引入救助受体结合表位。
如本文所用,术语“单链抗体”或“单链fv(scfv)”是指fv片段的两个结构域vl和vh的抗体融合分子。虽然fv片段的两个结构域vl和vh由不同的基因编码,但可以使用重组方法通过合成接头来连接它们,所述接头允许它们作为单一蛋白链产生,在该链中vl和vh区域配对形成单价的分子(称为单链fv(scfv))。参见,例如,bird等人,science242:423-426,1988;和huston等人,proc.natl.acad.sci.usa,85:5879-5883,1988)。对术语“抗体”片段的提述包括了这样一种单链抗体,其可以通过重组技术或完整抗体的酶学或化学切割来制备。
如本文所用,术语“小分子”是指具有低于约5kda,更优选低于约2kda的分子量的一种成分(composition)。小分子可以是,例如,核酸、肽、多肽、糖肽、拟肽、碳水化合物、脂质、脂多糖、这些物质的组合,或其他有机或无机分子。
如本文所用,术语“特异性结合”是指trail受体结合剂和抗原之间结合亲和力为至少10-6m的接触。优选的结合剂以至少约10-7m、优选10-8m到10-9m、10-10m、10-11m或10-12m的亲和力结合。
如本文所用,短语“严格杂交条件”是指这样的条件,在该条件下,探针将与其目标子序列(其一般处于复杂的核酸混合物中)杂交,而不与其他的序列杂交。严格条件是依赖于序列的,在不同的情况下会有所不同。较长的序列在较高的温度下特异性杂交。对于核酸杂交的广泛的指导可以在tijssen,techniquesinbiochemistryandmolecularbiology-hybridizationwithnucleicprobes,“overviewofprinciplesofhybridizationandthestrategyofnucleicacidassays”(1993)中找到。一般地,严格条件选择为比在确定的离子强度ph下特定序列的热熔点(tm)低约5-10℃。tm是(在确定的离子强度、ph和核酸浓度下)在平衡状态时,与目标互补的探针有50%与目标序列杂交的温度(由于目标序列过量存在,在tm时,平衡状态下有50%的探针被占据)。严格条件也可以通过添加去稳定剂例如甲酰胺来达到。对于选择性或特异性杂交,阳性信号可以是至少两倍于背景的杂交,优选为10倍于背景的杂交。示例性的严格杂交条件可以是如下:50%甲酰胺、5xssc和1%sds,在42℃温育,或5xssc、1%sds,在65℃温育,在0.2xssc和0.1%sds中在65℃洗涤。
如本文所用,术语“受试者”是指动物,优选地是哺乳动物,例如人类,但也可以是其他哺乳动物,例如家养动物(例如,狗、猫等等)、农畜(例如,牛、羊、猪、马等等)以及实验动物(例如,猴、大鼠、小鼠、兔、豚鼠等等)。
如本文所用,术语“替换”是指在本领域中通用的突变之一。示例性的替换变体在trail-r2结合剂(例如,抗体)分子中至少一个氨基酸残基被不同的氨基酸残基所取代。替换突变的最感兴趣的位点包括高变区,但也考虑fr改变。在以下表格中“优选替换”的标题下列出了“保守性替换”。如果这种替换引起生物学活性的变化,则可以引入更为实质性的改变(如表c中称为“示例替换”的那些,或者如下文按氨基酸类型进一步描述的),并筛选产物。
在一些实施方式中,替换变体包括对亲本抗体的一个或多个高变区残基的替换。一种方便地产生这种替换变体的方法包括利用噬菌体展示的亲和成熟(affinitymaturation)。具体地,突变了几个高变区位点(例如,6-7个位点)来在每个位点产生所有可能的氨基酸替换。由此产生的抗体变体作为与封装在每个颗粒中的与m13的基因iii产物的融合物,以单价形式展示在丝状噬菌体颗粒上。然后筛选噬菌体展示的变体的生物活性(例如结合亲和力)。为了鉴定用于修饰的候选高变区位点,可以进行丙氨酸扫描诱变以鉴定对结合trail-r2受体有显著贡献的高变区残基。另外一种方式或附加地,分析抗原抗体复合物的晶体结构来鉴定抗体和trail-r1和/或-r2受体之间的接触点可能是有益的。这样的接触残基和相邻的残基是根据本文详述的技术进行取代的候选物。一旦产生了这类变体,则对一组变体如本文所述进行筛选,在一种或多种相关的测定中具有相似或更优性质的抗体可以被选择用于进一步的开发。本技术包括具有对cgmcc登录号1691的杂交瘤ctb006所定义的免疫球蛋白重链或轻链的高变结构域的一个或多个氨基酸替换、特别是保守性替换的抗体变体,只要该抗体变体具有希望的性质(例如,生物活性)。
如本文所用,术语“目标细胞”是指受试者(例如,人类或动物)中可以被本技术的trail受体结合剂所靶向的任何细胞。
如本文所用,术语“治疗剂”是指当以有效量存在时,对有需要的受试者产生期望的治疗效果的化合物。
如本文所用,术语“进行治疗(treating)”或“治疗(treatment)”或“缓解”(alleviation)是指治疗处理(therapeutictreatment)。如果受试者在根据本文所公开的方法接受治疗量的本技术的trail-r2结合抗体之后,该受试者显示特定疾病的一种或多种体征和症状的可观察的和/或可测量的降低或不存在,则称受试者被成功地“治疗”了表达trail-r2的癌症。例如,对于癌症,癌细胞的数目的降低或癌细胞的不存在;肿瘤尺寸、肿瘤重量、肿瘤体积、肿瘤携带率的降低;肿瘤转移的抑制(即一定程度上的慢,优选停止);肿瘤生长在一定程度上的抑制;增加缓解时长和/或在某种程度上缓解与该特定癌症相关的一个或多个症状;发病率和死亡率的降低;体重的增加,以及生活质量问题的改善。“预防(prevention)”或“进行预防(preventing)”疾病或病症是指预防(prophylactic)或预防(preventative)措施,其目的是预防或减缓(减轻)目标病理状况或病症。
如本文所用,术语“可变”是指在抗体之中可变区的某些片段在序列上广泛地不同的事实。v结构域介导抗原结合,并决定特定抗体对其特定抗原的特异性。然而,可变性在可变区的整个氨基酸跨度上(acrosstheaminoacidspan)不是均匀分布的。相反,v区由相对不变的15-30个氨基酸的称为框架区(fr)序列段组成,其被称为“高变区”的长度为9-12个氨基酸的可变性极高的较短区域分隔开。天然重链和轻链的每个可变区都包含四个fr,这些fr主要采取β-片层结构,通过三个高变区相互连接,这些高变区形成环,所述环连接所述β-片层结构,在某些情况下形成所述β-片层结构的部分。每个链中的高变区被fr紧密维系在一起,并且与来自另一个链的高变区一起对抗体的抗原结合位点的形成做出贡献(参见kabat等人,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))。恒定域不直接涉及抗体与抗原的结合,但是显示出各种效应物功能,例如对抗体依赖细胞毒性(antibodydependentcellularcytotoxicity,adcc)的参与。
iii.组合物
trail受体结合剂。在一个方面,本技术提供了trail受体结合剂组合物(“结合剂”)。在一些实施方式中,本技术的结合剂是针对trail受体多肽、其同源物或衍生物的完整抗体。感兴趣的结合剂可以是特异性结合trail-r2的结合剂,但不能“实质地”(或“基本上”)结合其它trail受体如trail-r1、trail-r3或trail-r4。也就是说,感兴趣的抗体可能不与其它trail受体如trail-r1、trail-r3或trail-r4显著地交叉反应。在这样的实施方式中,如通过例如荧光活化的细胞分选(facs)分析、elisa、化学发光酶免疫测定(cleia)或放射免疫沉淀(ria)测定,本技术的结合剂与这些蛋白质的结合程度将低于约10%,优选地低于5%,低于1%。
对于本技术的结合剂,可以就其所识别或特异性结合的本技术的多肽的表位或部分,例如trail受体多肽的位于多肽表面的区域(例如亲水性区域),来对其进行描述或规定。在一个实施方式中,本技术提供trail-r2受体结合剂,例如针对trail-r2受体多肽(即目标多肽)的抗体或抗体相关多肽。所述结合剂在体内和体外选择性地诱导表达trail-r2的肿瘤细胞的凋亡。此外,当与一种或多种化学治疗剂组合施用时,结合剂具有意想不到的和显著的协同作用。基于其抗癌活性,trail-r2结合剂可用作凋亡信号传导研究的试剂,以及针对表达trail-r2受体的细胞的治疗剂,其示例性地包括广泛类型的癌细胞。
在一些实施方式中,本技术提供了表d中概述的trail受体结合剂。
在表d(上文)中总结的与trail受体结合剂相关的生物材料保藏于中国普通微生物菌种保藏管理中心(cgmcc),中国微生物菌种保藏管理委员会,北京邮政信箱2714,10080,中华人民共和国。详见下面的表e。
在另一个实施方式中,本技术提供了阐明trail-r2的表位的方法,其可用于通过结合trail-r2产生凋亡诱导抗体。被称为trail受体2或trail-r2的tnf相关凋亡诱导配体受体2(uniprotkb/swiss-prot数据库登录号no.o14763)具有以下序列:
本技术的结合剂也可以基于它们的交叉反应性来描述或具体指定。本技术包括不结合本技术的目标多肽的任何其他类似物、直系同源物(ortholog)或同源物的结合剂。不结合与本技术的多肽具有低于95%、低于90%、低于85%、低于80%、低于75%、低于70%、低于65%、低于60%、低于55%以及低于50%的同一性(利用本领域已知的和在此描述的方法计算的)的多肽的结合剂也被包括在本技术内。本技术进一步包括这样的结合剂,其仅结合在严格杂交条件下(如在此描述的)与本技术的多核苷酸杂交的多核苷酸所编码的多肽。本技术的结合剂也可以就它们的结合亲和力来描述或具体指定。优选的结合亲和力包括具有低于5×10-6m、10-6m、5×10-7m、10-7m、5×10-8m、10-8m、5×10-9m、10-9m、5×10-10m、10-10m、5×10-11m、10-11m、5×10-12m、10-12m、5×10-13m、10-13m、5×10-14m、10-14m、5×10-15m和10-15m的离解常数或kd的那些结合亲和力。在一些实施方式中,本技术提供结合人trail-r2的trail受体结合剂,其kd值不高于1×10-8,优选kd值不高于约1×10-9。
本技术范围内的trail受体结合剂包括,例如但不限于,特异性结合目标多肽、其同源物、衍生物或片段的单克隆抗体、多克隆抗体、嵌合抗体、人源化抗体、双价抗体,以及人类单克隆抗体和人类多克隆抗体。如本文所用,“trail受体样多肽”是指不同于trail受体多肽但与本技术的trail受体结合剂具有免疫反应性的多肽。如本文所用,“trail受体样多肽”是指不同于trail受体多肽但与本技术的trail受体结合剂具有免疫反应性的多肽。trail受体样多肽可以来自与trail受体多肽相同的生物体或不同的生物体。trail受体样多肽可以由与trail受体多肽相同的基因或不同的基因编码。可用作本技术的结合剂的抗体包括,例如但不限于,igg(包括igg1、igg2、igg3和igg4)、iga(包括iga1和iga2)、igd、ige或igm,以及igy。
在另一个实施方式中,本技术的结合剂是针对trail受体多肽、其同源物或衍生物的抗体相关的多肽。一般地,结合剂的抗原结合区域,例如抗trail受体结合区域,是结合剂的结合特异性和亲和力中最关键的。在一些实施方式中,trail受体结合剂是抗trail受体多肽抗体,例如抗trail受体多肽单克隆抗体、抗trail受体多肽嵌合抗体和抗trail受体多肽人源化抗体,它们已经,例如,通过删除、添加或替换抗体的一部分,而被修饰。例如,可以修饰抗trail受体多肽抗体以增加抗体的半衰期(例如血清半衰期)、稳定性或亲和力。
在一些实施方式中,通过产生杂交瘤来便利化对trail受体多肽(例如,trail-r2受体)的特定结构域特异性的抗体的选择,所述杂交瘤结合具有这种结构域的trail受体多肽的片段。因而,在一些实施方式中,trail受体结合剂是对trail受体多肽或其衍生物、片段、类似物或同源物内期望的结构域具有特异性的抗体。
本技术进一步包括针对本技术的结合剂的抗独特型的抗体。本技术的结合剂可以是单特异性、双特异性、三特异性或更多特异性的。多特异性结合剂可以特异于本技术的trail受体多肽的不同的表位,或可以既特异于本技术的trail受体多肽,又特异于异源组分(heterologouscompositions),例如异源多肽或固相支持材料。参见,例如,wo93/17715;wo92/08802;wo91/00360;wo92/05793;tutt等人,j.immunol.147:60-69(1991);美国专利no.5,573,920、4,474,893、5,601,819、4,714,681、4,925,648;6,106,835;kostelny等人,j.immunol.148:1547-1553(1992)。本技术的结合剂可以来自任何动物来源,包括鸟类和哺乳动物。在一些实施方式中,结合剂是人类、鼠、兔、山羊、豚鼠、骆驼、马或鸡的。
本技术的结合剂适合于在有需要的场合(例如,用于调节trail受体多肽功能)向受试者施用。因而,本技术的进一步的目的是提供trail受体结合剂组合物(compositions),它们是trail受体调节物,例如trail受体多肽的功能拮抗剂或功能激动剂。本技术的目的还在于提供这样的trail受体结合剂成分,它们是trail受体多肽的部分拮抗剂(partialantagonist)或部分激动剂(partialagonist)。同样地,本技术包括结合trail受体多肽的抗trail受体中和抗体。在一些实施方式中,本技术的结合剂将纯化至:(a)如lowry方法(lowry等人,j.biol.chem.193:265.1951)所测定的超过95%重量的抗体,最优选大于99%重量;(2)达到通过使用旋转杯测序仪足以获得n-末端的或内部氨基酸序列的至少15个残基的程度,或(3)达到利用考马斯蓝或优选的银染色在还原或非还原条件下sds-page的均一。因为抗体的天然环境的至少一种成分将不会存在,所以分离的结合剂包括原位存在于重组细胞内的多肽。然而通常地,trail受体结合剂,例如分离的抗trail受体抗体,将通过至少一个纯化步骤来制备。
iv.组合治疗
本技术的结合剂可以单独使用或与其它组合物(compositions)或活性剂组合使用。本技术的trail受体结合剂可以进一步在n-或c-末端重组地融合到异源多肽,或化学地缀合(包括共价和非共价地缀合)到多肽或其他组合物(compositions)或活性剂。例如,本技术的trail受体结合剂可以重组地融合或缀合到可在检测分析中作为标记的分子和效应分子,例如异源多肽、药物或毒素。参见,例如,wo92/08495;wo91/14438;wo89/12624;美国专利no.5,314,995;和ep0396387。
在某些实施方式中,本技术的trail受体结合剂是抗trail受体抗体或抗trail受体抗体相关多肽,它们偶联或缀合到一种或多种治疗性或细胞毒性模块来产生trail受体结合剂缀合蛋白质。本技术的trail受体结合剂缀合蛋白质可以用于修饰给定的生物应答或产生生物应答(例如,募集效应物细胞)。治疗性部分不应被限于经典的化学治疗剂。例如,治疗性部分可以是具有期望的生物学活性的蛋白质或多肽。这些蛋白质可以包括,例如,酶活性毒素,或其活性片段,如相思豆毒蛋白、篦麻毒蛋白a、假单胞菌外毒素或白喉毒素;蛋白质,例如肿瘤坏死因子或干扰素-α;或生物应答修饰物,例如,淋巴因子、白细胞介素-1(“il-1”)、白细胞介素-2(“il-2”)、白细胞介素-6(“il-6”)、粒细胞巨噬细胞集落刺激因子(“gm-csf”)、粒细胞集落刺激因子(“g-csf”)、或其他生长因子。
在一些实施方式中,本技术的trail受体结合剂(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih、wiypgnvntkysekfkg和geagyfd及轻链cdr氨基酸序列kasqdvstava、wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)与化学治疗剂同时地、依序地或分别地施用于受试者。
本文提供了化学治疗剂的示例性和非限制性列表。合适的化学治疗药物包括例如但不限于:长春花生物碱(vincaalkaloids)、破坏微管形成的药剂(如秋水仙碱(colchicines)及其衍生物)、抗血管生成剂、治疗性抗体、egfr靶向剂、酪氨酸激酶靶向剂(如酪氨酸激酶抑制剂)、过渡金属络合物、蛋白酶体抑制剂、抗代谢药(如核苷类似物)、烷基化剂、铂基试剂、蒽环类抗生素、拓扑异构酶抑制剂、大环内酯类、治疗性抗体、类视色素(如全反式维甲酸或其衍生物);格尔德霉素或其衍生物(例如17-aag)和本领域公认的其它标准化学治疗剂。
在一些实施方式中,所述化学治疗剂包括阿霉素(adriamycin)、秋水仙碱(colchicine)、环磷酰胺(cyclophosphamide)、放线菌素(actinomycin)、博来霉素(bleomycin)、正定霉素(duanorubicin)、多柔比星(doxorubicin)、表柔比星(epirubicin)、丝裂霉素(mitomycin)、甲氨蝶呤(methotrexate)、米托蒽醌(mitoxantrone)、氟尿嘧啶(fluorouracil)、卡铂(carboplatin)、卡莫司汀(carmustine,bcnu)、甲基-ccnu、顺铂(cisplatin)、依托泊苷(etoposide)、干扰素(interferons)、喜树碱(camptothecin)及其衍生物、苯芥胆甾醇(phenesterine)、紫杉烷(taxanes)及其衍生物(例如,紫杉醇(taxol)、紫杉醇(paclitaxel)及其衍生物,泰索帝(taxotere)及其衍生物等)、托泊替康(topetecan)、长春花碱(vinblastine)、长春新碱(vincristine)、他莫昔芬(tamoxifen)、白消安(piposulfan)、nab-5404、nab-5800、nab-5801、伊立替康(irinotecan)、hkp、沃塔紫杉醇(ortataxel)、吉西他滨(gemcitabine)、奥沙利铂(oxaliplatin)、
在一些实施方式中,所述化学治疗剂是抗肿瘤剂,包括但不限于卡铂、
本文中涉及的化学治疗剂适用于化学治疗剂或其衍生物,因此本技术包括这些实施例(试剂;试剂或衍生物)中的任一个。化学治疗剂或其他化学部分的“衍生物”或“类似物”包括但不限于在结构上类似于化学治疗剂或部分或与化学治疗剂或部分在相同的一般化学类别里的化合物。在一些实施方式中,化学治疗剂或部分的衍生物或类似物保留与化学治疗剂或部分类似的化学和/或物理性质(包括例如功能性)。
v.制备trail受体结合剂及其组合物的方法
一般概述。首先,选择可以引出(raise)本技术的结合剂(例如抗trail受体抗体)的目标多肽。用于产生靶向目标多肽的结合剂的技术是本领域技术人员公知的。这样的技术的实例包括,例如但不限于,涉及展示库、人体抗体转基因或人单抗转基因小鼠(xenoorhumabmice)、杂交瘤等等的技术。在本技术范围内的目标多肽包括能显示抗原性的任何多肽或多肽衍生物。实例包括但不限于,蛋白质(例如,受体、酶、激素、生长因子)、肽、糖蛋白、脂蛋白、trail受体多肽等等。示范性的目标多肽还包括引起人类疾病的细菌、真菌和病毒病原体,例如hiv、肝炎(甲型、乙型和丙型)、流感、疱疹、贾第鞭毛虫、疟疾、利什曼虫(leishmania)、金黄色葡萄球菌(staphylococcusaureus)、铜绿假单胞菌(pseudomonasaeruginosa)。其他目标多肽是表达水平或组成与人类疾病或其他表型相关的人类蛋白质。感兴趣的其他目标多肽包括肿瘤细胞抗原和病毒颗粒抗原。
要理解的是,不仅天然存在的抗体适合作为结合剂根据本文的公开来使用,重组工程化的抗体和抗体片段,例如,针对trail受体多肽的抗体相关的多肽也是适合的。
可以适用于本文所述技术的结合剂,例如抗trail受体抗体,包括单克隆和多克隆抗体,以及抗体片段如fab、fab'、f(ab')2、fd、scfv、双价抗体、抗体轻链、抗体重链和/或抗体片段。已经描述了可用于高产量产生含抗体fv的多肽(例如fab'和f(ab')2抗体片段)的方法。参见美国专利no.5,648,237。
一般地,结合剂从来源物种获得。更特别地,获得了对目标多肽抗原具有特异性的来源物种抗体的轻链、重链或两者的可变部分的核酸或氨基酸序列。来源物种是任何对于产生本技术的结合剂或结合剂的库有用的物种,例如大鼠、小鼠、兔、鸡、猴、人类等等。
在一些实施方式中,trail受体结合剂是抗trail受体抗体。噬菌体或噬菌粒展示技术是得到本技术的结合剂的有用的技术。在本技术中有用的抗trail受体抗体是“人类抗体”(例如,分离自人类的抗体)或“人类序列抗体”。人类抗体可以通过本领域已知的多种方法包括噬菌体展示方法来产生。也参见,美国专利no.4,444,887、4,716,111、5,545,806和5,814,318;以及wo98/46645、wo98/50433、wo98/24893、wo98/16654、wo96/34096、wo96/33735和wo91/10741。已经描述了通过筛选多聚噬菌体(polyphage)颗粒来鉴定编码多聚体多肽复合物中的成员的核酸序列的方法。rudert等人,美国专利6,667,150。另外,可以产生重组免疫球蛋白。cabilly,美国专利4,816,567;cabilly等人,u.s.6,331,415和queen等人,proc.nat'lacad.sci.usa86:10029-10033,1989。产生和克隆单克隆抗体的技术是本领域技术人员公知的。本技术的trail受体结合剂优选具有高免疫反应性,也就是正确折叠从而能特异性结合目标抗原的抗体分子的百分比。结合剂(例如本技术的抗体)的编码序列的表达,可以如下所述在大肠杆菌中进行。这样的表达通常产生至少80%、90%、95%或99%的免疫反应性。
这些蛋白质或基因的特定截短物能行使完整序列蛋白质或基因的调节功能或酶功能。例如,可以通过能提供功能上等同的蛋白质或基因的替换、添加、删除或多聚体表达来改变编码它们的核酸序列。由于核酸编码序列的简并性,编码与天然存在的蛋白质的序列基本上相同的氨基酸序列的其他序列可以在本技术的实践中使用。这些序列包括但不限于:包括编码上述多肽的核酸序列的全部或部分的核酸序列,这样的核酸序列的改变是通过用编码序列内的功能等同氨基酸残基的不同密码子进行替换,由此产生沉默改变(silentchange)。要理解的是,按照通过标准方法("currentmethodsinsequencecomparisonandanalysis,"macromoleculesequencingandsynthesis,selectedmethodsandapplications,pp.127-149,1998,alanr.liss,inc.)所计算,根据本技术的免疫球蛋白的核苷酸序列可以容忍最多达25%的序列同源性变异,只要这种变体形成识别trail-r1和trail-r2的可操作的抗体。例如,多肽序列内的一个或多个氨基酸残基可以被作为功能等同物的、具有类似极性的其他氨基酸替换,从而产生沉默的改变。序列内氨基酸的替换物可以从被替换的氨基酸所属的类别的其他成员中选择。例如,非极性的(疏水的)氨基酸包括丙氨酸、亮氨酸、异亮氨酸、缬氨酸、脯氨酸、苯丙氨酸、色氨酸和甲硫氨酸。极性的中性氨基酸包括甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺和谷氨酰胺。带正电的(碱性的)氨基酸包括精氨酸、赖氨酸和组氨酸。带负电的(酸性的)氨基酸包括天冬氨酸和谷氨酸。本技术的范围还包括在翻译期间或之后被差异地修饰,例如通过糖基化、蛋白酶切割、与抗体分子或其他细胞配体连接等方式进行修饰的蛋白质或其片段或衍生物。另外,可以对抑制剂的编码核酸序列进行体外或体内突变来产生和/或破坏翻译、起始和/或终止序列,或在编码区域中产生变化,和/或形成新的限制性内切酶位点,或破坏先前存在的限制性内切酶位点,来促进进一步的体外修饰。可以使用本领域已知的用于诱变的任何技术,包括但不限于体外定点诱变,j.biol.chem.253:6551,tab接头(pharmacia)的使用等等。
多克隆抗血清和免疫原的制备。产生本技术的抗体或抗体片段的方法一般包括用纯化的trail受体多肽或用表达trail受体多肽的细胞免疫受试者(一般是非人类受试者,例如小鼠或兔)。trail受体多肽的任何免疫原性部分都可以被采用作为免疫原。合适的免疫原性制备物可以含有,例如,重组表达的trail受体多肽或化学合成的trail受体多肽。可以使用分离的trail受体多肽或其部分或片段作免疫原,利用多克隆和单克隆抗体制备的标准技术来产生结合trail受体多肽或其部分或片段的trail受体结合剂。可以使用全长trail受体多肽,或者作为另外一种选择,本技术提供了trail受体多肽片段作为免疫原的用途。trail受体多肽包含如seqidno:17所示氨基酸序列的至少四个氨基酸残基,并包括trail受体多肽的表位,从而针对所述肽产生的抗体与所述trail受体多肽形成特异性免疫复合物。优选地,抗原肽包含至少5、8、10、15、20或30个氨基酸残基。取决于用途并根据本领域技术人员公知的方法,更长的抗原肽有时比较短的抗原肽是更优选的。一般地,免疫原将是长度至少约8个氨基酰残基,优选长度至少约10个酰基残基。给定表位的多聚体有时比单体更有效。
如果需要,trail受体多肽(或其片段)的免疫原性可以通过融合于或缀合于半抗原,例如钥孔血蓝蛋白(keyholelimpethemocyanin,klh)或卵清蛋白(ovalbumin,ova)来提高。许多这类半抗原是本领域已知的。人们也可以组合trail受体多肽和常规的佐剂,例如弗氏完全或不完全佐剂来提高受试者对所述多肽的免疫反应。用于提高免疫反应的各种佐剂包括,但不限于弗氏(完全和不完全的)、矿物质凝胶(例如,氢氧化铝)、表面活性物质(例如,溶血卵磷脂、普流尼克(pluronic)多元醇、聚阴离子、肽、油乳液、二硝基苯酚等等)、人类佐剂例如卡介苗和短小棒状杆菌(corynebacteriumparvum),或相似的免疫刺激性化合物。这些技术是本领域标准的。
为了方便起见,在本技术中免疫应答常常被描述为“初次”或“二次”免疫应答。初次免疫应答,其也被描述为“保护性”免疫应答,是指作为对于特定抗原(例如trail受体多肽)的某种初次暴露(例如初次“免疫”)的结果,在个体中产生的免疫反应。这种免疫可以,例如,作为对抗原(例如,来自某些展现或呈递该抗原的病原体的初次感染)的某种天然的暴露的结果而发生,也可以来自个体中某些肿瘤(例如恶性黑色素瘤)的癌细胞所呈递的抗原。另外一种方式,免疫的发生可以是用含有抗原的疫苗接种个体的结果。例如,疫苗可以是包含来自trail受体多肽或trail受体样多肽的一种或多种抗原的trail受体疫苗。
初次免疫应答可以随着时间减弱或衰减,甚至可以消失或至少变得太衰弱而不能被检测。因而,本技术还涉及“二次”免疫反应,其在此还被描述为“记忆免疫反应”。术语二次免疫反应是指在已经产生初次免疫应答之后在个体中引发的免疫反应。
因而,可以引发二次或免疫应答,例如,来增强已经变得减弱或衰减的现有免疫应答,或来重建消失的或不能再被检测的早先的免疫应答。作为实例而不是为了限制,二次免疫应答可以通过向个体重新导入(例如,通过重新施用疫苗)引发初次免疫应答的抗原,例如trail受体多肽或trail受体样多肽,来引发。然而,针对抗原的二次免疫应答也可以通过施用不含有实际的抗原的其他试剂来引发。例如,本技术提供了通过向个体施用trail受体结合剂来强化二次免疫应答的方法。在这样的方法中,实际的抗原不必与trail受体结合剂一起施用,含有trail受体结合剂的组合物不必含有抗原。二次或记忆免疫应答可以是体液(抗体)应答或细胞应答。二次或记忆体液应答在抗原的初次呈递时产生的记忆b细胞受到刺激时发生。延迟型超敏反应(delayedtypehypersensitivity,dth)反应是一种细胞的二次或记忆免疫应答,其由cd4+细胞介导。对于抗原的第一次暴露致敏免疫系统,附加的暴露引起dth。
在合适的免疫之后,可以从受试者的血清制备trail受体结合剂,例如,抗trail受体多克隆抗体。如果需要,可以从哺乳动物(例如,从血液)分离针对trail受体多肽的抗体分子,并进一步通过公知的技术,例如多肽a层析来进一步纯化,以获得igg收份。
单克隆抗体。在本技术的一个实施方式中,所述结合剂是抗trail受体单克隆抗体。在本技术的一个实施方式中,所述抗trail受体单克隆抗体是人类抗trail受体单克隆抗体。对于针对特定的trail受体多肽或其衍生物、片段、类似物或同源物的单克隆抗体的制备,可以利用任何通过连续细胞系培养来提供抗体分子的产生的技术。这些技术包括,但不限于杂交瘤技术(参见,例如kohler和milstein,1975,nature256:495-497);三源杂交瘤(trioma)技术;人类b细胞杂交瘤技术(参见,例如kozbor等人,1983.immunol.today4:72)和ebv杂交瘤技术,来产生人类单克隆抗体(参见,例如cole等人,1985.monoclonalantibodiesandcancertherapy,alanr.liss,inc.,pp.77-96)。人类单克隆抗体可以在本技术的实践中利用,可以通过使用人类杂交瘤(参见例如cote等人,1983.procnatlacadsciusa80:2026-2030)或通过用eb(epsteinbarr)病毒体外转化人类b细胞(参见例如cole等人,1985.monoclonalantibodiesandcancertherapy,alanr.liss,inc.,pp.77-96)来产生。例如,可以分离编码抗体的区域的核酸的群体。使用源自编码抗体保守区域的序列的引物进行pcr,用于从群体扩增编码抗体部分的序列,然后从扩增的序列重建编码抗体或其片段(例如可变结构域)的dna。这样的扩增序列还可以与编码其它蛋白质的dna(例如噬菌体外壳,或细菌细胞表面蛋白)融合,用于在噬菌体或细菌上表达和展示融合多肽。然后可以将扩增的序列加以表达,并根据,例如,所表达的抗体或其片段对trail受体多肽上呈现的抗原或表位的亲和力来加以进一步选择或分离。另外一种方式,表达抗trail受体单克隆抗体的杂交瘤可以通过免疫受试者,然后使用常规方法从受试者的脾脏分离杂交瘤来制备。参见,例如milstein等人(galfre和milstein,methodsenzymol(1981)73:3-46)。利用标准方法筛选杂交瘤将产生具有不同的特异性(即针对不同的表位)和亲和力的单克隆抗体。具有期望的性质(例如trail受体结合)的选定的单克隆抗体可以如杂交瘤所表达的来使用,可以将它结合到聚乙二醇(peg)等分子来改变它的性质,或可以分离编码它的cdna,对其加以测序并以各种方式操作。可以向合成的树型体(dendromeric)树添加反应性的氨基酸侧链,例如赖氨酸,来增强trail受体多肽的免疫原性性质。并且,cpg二核苷酸技术可以用于增强trail受体多肽的免疫原性性质。其他操作包括替换或删除对于保存期间或在向受试者施用之后的抗体不稳定性有贡献的特定氨基酰基残基,以及亲和成熟技术来改善trail受体多肽的抗体的亲和力。
杂交瘤技术。在一个实施方式中,本技术的结合剂是通过杂交瘤产生的抗trail受体单克隆抗体,所述杂交瘤包括从转基因非人动物,例如转基因小鼠获得的,具有包含人类重链转基因和轻链转基因的基因组,融合到永生细胞的b细胞。杂交瘤技术包括本领域已知的那些技术,和在harlow等人,antibodies:alaboratorymanualcoldspringharborlaboratory,coldspringharbor,ny,349(1988);hammerling等人,monoclonalantibodiesandt-cellhybridomas,563-681(1981)中所教导的。其他产生杂交瘤和单克隆抗体的方法是本领域技术人员公知的。
噬菌体展示技术。如上所述,本技术的结合剂可以通过应用重组dna和噬菌体展示技术来产生。例如,本技术的结合剂,例如,抗trail受体抗体,可以使用本领域已知的各种噬菌体展示方法来制备。在噬菌体展示方法中,功能性抗体结构域被展示在噬菌体颗粒的表面,噬菌体颗粒携带编码它们的多核苷酸序列。通过直接用抗原(一般是结合或被捕获到固体表面或颗粒上的抗原)进行选择,可以从抗体库或组合抗体库(例如,人类或鼠的)选择具有希望的结合性质的噬菌体。这些方法中使用的噬菌体一般是丝状噬菌体,包括fd和m13,且fab、fv或二硫化键稳定化的fv抗体结构域重组融合于噬菌体基因iii或基因viii蛋白质。此外,方法可以加以调适以用于构建fab表达库(参见,例如huse等人,science,246:1275-1281,1989)来容许快速而有效地鉴定对trail受体多肽(例如,多肽或其衍生物、片段、类似物或同源物)具有期望的特异性的单克隆fab片段。可以用来产生本技术的结合剂的噬菌体展示方法的其他实例包括在huston等人,proc.natl.acad.sciu.s.a.,85:5879-5883,1988;chaudhary等人,proc.natl.acad.sciu.s.a.,87:1066-1070,1990;brinkman等人,j.immunol.methods182:41-50,1995;ames等人,j.immunol.methods184:177-186,1995;kettleborough等人,eur.j.immunol.24:952-958,1994;persic等人,gene187:9-18,1997;burton等人,advancesinimmunology57:191-280,1994;pct/gb91/01134;wo90/02809;wo91/10737;wo92/01047;wo92/18619;wo93/11236;wo95/15982;wo95/20401;wo96/06213;wo92/01047(medicalresearchcouncil等人);wo97/08320(morphosys);wo92/01047(cat/mrc);wo91/17271(affymax);和美国专利no.5,698,426、5,223,409、5,403,484、5,580,717、5,427,908、5,750,753、5,821,047、5,571,698、5,427,908、5,516,637、5,780,225、5,658,727和5,733,743中公开的那些。通过用二硫键连接多肽而在噬菌体颗粒的表面上展示多肽的方法已经在lohning,美国专利no.6,753,136中有所描述。如在上述参考文献中描述的,在噬菌体选择之后,可以从噬菌体分离抗体编码区并用于产生完整的抗体,包括人类抗体,或任何其他期望的抗原结合片段,并在任何期望的宿主包括哺乳动物细胞、昆虫细胞、植物细胞、酵母和细菌中表达。例如,也可以利用重组产生fab、fab'和f(ab')2片段的技术,这些技术利用本领域已知的方法,例如在wo92/22324;mullinax等人,biotechniques12:864-869,1992;和sawai等人,ajri34:26-34,1995;和better等人,science240:1041-1043,1988中公开的那些。
一般地,为了鉴定出维持了良好的结合活性的变体,可以将克隆到展示载体中的杂交抗体或杂交抗体片段针对合适的抗原来进行选择,因为抗体或抗体片段将存在于噬菌体或噬菌粒颗粒的表面上。参见,例如,barbasiii等人,phagedisplay,alaboratorymanual(coldspringharborlaboratorypress,coldspringharbor,n.y.,2001)。然而,这个过程可以使用其他载体模式,例如,将抗体片段文库克隆到裂解性噬菌体载体(修饰的t7或lambdazap系统)中用于选择和/或筛选。
重组的trail受体结合剂的表达。如上所述,本技术的结合剂可以通过重组dna技术的应用来产生。编码本技术的trail受体结合剂的重组多核苷酸构建体一般包括与抗trail受体抗体链的编码序列可操作地连接的表达控制序列,包括天然相关的或异源的启动子区域。因而,本技术的另一个方面包括含有一个或多个编码本技术的trail受体结合剂的核酸序列的载体。对于本技术的一种或多种多肽的重组表达,通过本领域公知的重组dna技术,并如以下详述的,将含有编码trail受体结合剂的核苷酸序列的全部或一部分的核酸插入合适的克隆载体或表达载体(即含有用于转录和翻译所插入的多肽编码序列的必需元件的载体)中。产生多样性的载体群体的方法已经由lerner等人,美国专利no.6,291,160;6,680,192描述了。
一般地,在重组dna技术中有用的表达载体通常是质粒的形式。在本说明书中,“质粒”和“载体”可互换地使用,因为质粒是最常用的载体形式。然而,本技术意图包括行使等同功能的,从技术上说不属质粒的其他形式的表达载体,例如病毒载体(例如,复制缺陷性逆转录病毒、腺病毒和腺相关病毒)。这种病毒载体可用于感染受试者和在受试者中表达化合物。优选地,表达控制序列是能够转化或转染真核宿主细胞的载体中的真核启动子系统。一旦载体被并入到合适的宿主中,宿主维持在适合于编码trail受体结合剂的核苷酸序列的高水平表达,以及trail受体结合剂(例如交叉反应性抗trail受体抗体)的收集和纯化的条件下。参见,一般地,美国申请no.20020199213。这些表达载体一般能够在宿主生物体中作为游离体或作为宿主染色体dna的组成部分进行复制。通常,表达载体含有选择标记物,例如,氨苄青霉素抗性或潮霉素抗性,以允许检测被期望的dna序列转化了的那些细胞。载体还可以编码对于指导细胞外抗体片段的分泌有用的信号肽,例如果胶酸裂合酶。参见美国专利no.5,576,195。
本技术的重组表达载体包含编码具有trail受体结合性质的化合物的核酸,该核酸处于适合于该核酸在宿主细胞中表达的形式,这意味着所述重组表达载体包括一种或多种基于表达用宿主细胞而被选择的,与要表达的核酸序列可操作连接的调节序列。在重组表达载体内,“可操作连接的”意指感兴趣的核苷酸序列以允许所述核苷酸序列表达的方式与调节序列连接(例如,在体外转录/翻译系统中,或者,当载体导入宿主细胞中时,在宿主细胞中)。术语“调节序列”意图包括启动子、增强子和其他表达控制元件(例如,多聚腺苷酸信号)。例如,在goeddel,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.(1990)中描述了这些调节序列。调节序列包括那些在许多种类的宿主细胞中指导核苷酸序列的组成型表达的调节序列,和那些仅在某些宿主细胞中指导核苷酸序列表达的调节序列(例如,组织特异性调节序列)。本领域技术人员要理解的是,表达载体的设计可能取决于一些因素,例如要转化的宿主细胞的选择,希望的多肽表达水平等等。作为重组多肽(例如,trail受体结合剂)表达的启动子有用的典型的调节序列包括,例如但不限于3-磷酸甘油酸激酶和其他糖酵解酶。诱导型的酵母启动子包括,尤其是,来自乙醇脱氢酶、异细胞色素c和负责麦芽糖和半乳糖利用的酶的启动子。在一个实施方式中,编码本技术的trail受体结合剂的多核苷酸与arab启动子可操作地连接,并可以在宿主细胞中表达。参见美国专利no.5,028,530。本技术的表达载体可以被导入宿主细胞,从而产生多肽或肽,包括由在此描述的核酸编码的融合多肽(例如,trail受体结合剂等等)。
本技术的另一个方面涉及表达trail受体结合剂的宿主细胞,其含有编码一种或多种trail受体结合剂的核酸。本技术的重组表达载体可以被设计用于trail受体结合剂在原核或真核细胞中的表达。例如,trail受体结合剂可以在细菌细胞例如大肠杆菌,昆虫细胞(利用杆状病毒表达载体),真菌细胞例如酵母、酵母细胞或哺乳动物细胞中表达。在goeddel,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.(1990)中进一步讨论了适合的宿主细胞。另外一种选择,重组表达载体可以体外转录和翻译,例如,使用t7启动子调节序列和t7聚合酶。已经描述了通过随机地产生的多核苷酸序列的表达,对制备筛选具有预定性质的多肽(例如trail受体结合剂)有用的方法。参见美国专利no.5,763,192、5,723,323、5,814,476、5,817,483、5,824,514、5,976,862、6,492,107、6,569,641。
原核生物中的多肽表达最常见地在带有载体的大肠杆菌中进行,所述载体含有指导融合或非融合多肽表达的组成型或可诱导启动子。融合载体向其中编码的多肽添加许多氨基酸,通常添加到重组多肽的氨基末端。这些融合载体一般服务于三个目的:(i)提高重组多肽的表达,(ii)提高重组多肽的溶解度,以及(iii)通过作为亲和纯化中的配体来帮助重组多肽的纯化。通常,在融合物表达载体中,将蛋白酶水解位点添加到融合模块和重组多肽的连接处,以允许在融合多肽的纯化之后从融合模块分离重组多肽。这些酶和它们的同源识别序列包括因子xa、凝血酶和肠激酶。典型的融合表达载体包括pgex(pharmaciabiotechinc;smithandjohnson,1988.gene67:31-40)、pmal(newenglandbiolabs,beverly,mass.)和prit5(pharmacia,piscataway,n.j.),其分别将谷胱甘肽s-转移酶(glutathiones-transferase,gst)、麦芽糖e结合多肽或多肽a融合到目标重组多肽。
适合的诱导型非融合大肠杆菌表达载体的实例包括ptrc(amrann等人,(1988)gene69:301-315)和pet11d(studier等人,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.(1990)60-89)。通过多肽融合来靶向组装具有不同活性的肽或蛋白质结构域以产生多功能多肽的方法已经由pack等人,美国专利no.6,294,353;6,692,935所描述。一种使大肠杆菌中的重组多肽(例如trail受体结合剂)的表达最大化的策略是在蛋白水解该重组多肽的能力受损的宿主细菌中表达该重组多肽。参见,例如,gottesman,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.(1990)119-128。另一个策略是改变要插入表达载体中的核酸的核酸序列,从而每个氨基酸的各自密码子是在表达宿主(例如大肠杆菌)中优先被利用的密码子(参见,例如,wada等人,1992.nucl.acidsres.20:2111-2118)。本技术的这种核酸序列的改变可以通过标准的dna合成技术来进行。
在另一个实施方式中,trail受体结合剂表达载体是酵母表达载体。用在酵母酿酒酵母i(saccharomycescerivisae)中表达的载体的实例包括pyepsec1(baldari等人,1987.emboj.6:229-234)、pmfa(kurjan和herskowitz,cell30:933-943,1982)、pjry88(schultz等人,gene54:113-123,1987)、pyes2(invitrogencorporation,sandiego,calif.)和picz(invitrogencorp,sandiego,calif.)。另外一种选择,trail受体结合剂可以使用杆状病毒表达载体在昆虫细胞中表达。可用于在培养的昆虫细胞(例如,sf9细胞)中表达多肽(例如trail受体结合剂)的杆状病毒载体包括pac系列(smith等人,mol.cell.biol.3:2156-2165,1983)和pvl系列(lucklowandsummers,1989.virology170:31-39)。
在又一个实施方式中,编码本技术的trail受体结合剂的核酸使用哺乳动物表达载体在哺乳动物细胞中表达。哺乳动物表达载体的实例包括但不限于,pcdm8(seed,.nature329:840,1987)和pmt2pc(kaufman等人,emboj.6:187-195,1987)。当在哺乳动物细胞中使用时,通常由病毒调节元件来提供表达载体的控制功能。例如,常用的启动子来源于多瘤病毒(polyoma)、腺病毒2、巨细胞病毒和猿猴病毒40。对于本技术的trail受体结合剂的表达有用的原核和真核细胞的其他适合的表达系统。参见,例如,sambrook等人,molecularcloning:alaboratorymanual2nded.,coldspringharborlaboratory,第16和17章,coldspringharborlaboratorypress,coldspringharbor,n.y.,1989。
在另一个实施方式中,重组哺乳动物表达载体能够指导核酸优先地在特定细胞类型中表达(例如,使用组织特异性调节元件来表达核酸)。组织特异性调节元件是本领域已知的。适合的组织特异性启动子的非限制性实例包括白蛋白启动子(肝脏特异;pinkert等人,genesdev.1:268-277,1987)、淋巴特异启动子(calame和eaton,adv.immunol.43:235-275,1988)、特别是t细胞受体的启动子(winoto和baltimore,emboj.8:729-733,1989)和免疫球蛋白的启动子(banerji等人,1983.cell33:729-740;queen和baltimore,cell33:741-748,1983.)、神经元特异启动子(例如,神经丝启动子;byrne和ruddle,proc.natl.acad.sci.usa86:5473-5477,1989)、胰腺特异启动子(edlund等人,1985.science230:912-916),和乳腺特异启动子(例如,乳清启动子;美国专利no.4,873,316和欧洲申请公开264,166)。还包括发育性调节的启动子,例如鼠hox启动子(kessel和gruss,science249:374-379,1990)和甲胎蛋白启动子(campes和tilghman,.genesdev.3:537-546,1989)。
本技术进一步提供重组表达载体,其包含以反义方向克隆到表达载体中的本技术的编码trail受体结合剂的dna分子。也就是说,dna分子以这样的方式与调节序列可操作地连接,从而能够表达(通过dna分子的转录)trail受体结合剂mrna的反义rna分子。至于与按反义方向克隆的核酸可操作连接的调节序列,可以在各种细胞类型中选择指导反义rna分子的连续表达的调节序列,例如病毒启动子和/或增强子,或可以选择指导反义rna的组成型、组织特异性或细胞类型特异性表达的调节序列。反义表达载体可以是重组质粒、噬菌粒或减毒病毒的形式,其中反义核酸在高效调节区域的控制下产生,其活性可通过导入了该载体的细胞类型来测定。对于利用反义基因调节基因表达的论述。参见,例如,weintraub等人,"antisensernaasamoleculartoolforgeneticanalysis,"reviews-trendsingenetics,vol.1(1)1986。
本技术的另一个方面涉及其中导入了本技术的重组表达载体的宿主细胞。术语“宿主细胞”和“重组宿主细胞”在此可互换地使用。要理解的是,该术语不仅仅指特定的受试细胞,而且指这种细胞的子代或可能的子代。由于在后代中可能因突变或环境影响而出现某些改变,这种子代实际上可能不与母细胞完全相同,但仍然包括在此处使用的该术语的范围内。
宿主细胞可以是任何原核或真核细胞。例如,trail受体结合剂可以在细菌细胞例如大肠杆菌、昆虫细胞、酵母或哺乳动物细胞中表达。哺乳动物细胞是用于表达编码免疫球蛋白或其片段的核苷酸区段的优选的宿主。参见winnacker,fromgenestoclones,(vchpublishers,ny,1987)。本领域已经开发了一些能够分泌完整的异源蛋白质的许多适合的宿主细胞系,包括中国仓鼠卵巢(chinesehamsterovary,cho)细胞系、各种cos细胞系、hela细胞、l细胞和骨髓瘤细胞系。优选地,所述细胞是非人类的。这些细胞的表达载体可以包括表达控制序列,例如复制起点、启动子、增强子和必需的加工信息位点,例如核糖体结合位点、rna剪接位点、多聚腺苷酸位点和转录终止子序列。queen等人,immunol.rev.89:49,1986。优选的表达控制序列是来自内源的基因、巨细胞病毒、sv40、腺病毒、牛乳头瘤病毒等等的启动子。co等人,jimmunol.148:1149,1992。其他适合的宿主细胞是本领域技术人员公知的。
可以通过常规转化或转染技术将载体dna导入到原核或真核细胞中。如本文所用,术语“转化”和“转染”意指各种本领域已知的用于将外源核酸(例如dna)导入宿主细胞的技术,包括磷酸钙或氯化钙共沉淀、deae-葡聚糖介导的转染、脂质体转染或电穿孔、基因枪(biolistics)或基于病毒的转染可以用于其他细胞宿主。用于转化哺乳动物的其他方法包括使用聚凝胺(polybrene)、原生质体融合、脂质体、电穿孔和显微注射(一般参见,sambrook等人,molecularcloning)。可以在sambrook等人(molecularcloning:alaboratorymanual.2nded.,coldspringharborlaboratory,coldspringharborlaboratorypress,coldspringharbor,n.y.,1989)和其他实验手册中找到转化或转染宿主细胞的适合的方法。根据细胞宿主的种类,含有感兴趣的dna片段的载体可以通过公知的方法转移到宿主细胞中。
对于哺乳动物细胞的稳定转染,已知的是,取决于使用的表达载体和转染技术,仅小部分细胞可能将外源dna整合到它们的基因组中。为了鉴定和选择这些整合体,一般将编码选择标记(例如,抗生素抗性)的基因与感兴趣的基因一起导入宿主细胞。各种选择标记包括提供对药物,例如g418、潮霉素和氨甲蝶呤的抗性的那些选择标记。编码选择标记的核酸可以在编码trail受体结合剂的相同载体上导入宿主细胞,或可以在单独的载体上导入。可以通过药物选择来鉴定导入的核酸稳定转染的细胞(例如,纳入了选择标记基因的细胞将生存,而其他细胞将死亡)。
包括本技术的trail受体结合剂的宿主细胞,例如培养中的原核或真核宿主细胞,可以用于生产(即表达)重组trail受体结合剂。在一个实施方式中,所述方法包括在适合的培养基中培养宿主细胞(其中已经导入了编码trail受体结合剂的重组表达载体),从而产生trail受体结合剂。在另一个实施方式中,所述方法进一步包括从培养基或宿主细胞分离trail受体结合剂的步骤。一旦被表达,从培养基和宿主细胞中纯化trail受体结合剂(例如抗trail受体抗体或抗trail受体抗体相关多肽)的收集物(collections)。trail受体结合剂可以根据本领域的标准方法来纯化,包括hplc纯化、柱层析、凝胶电泳等等。在一个实施方式中,trail受体结合剂通过boss等人,美国专利no.4,816,397的方法在宿主生物体中产生。通常,抗trail受体抗体链与信号序列一起表达,因而被释放到培养基中。然而,如果宿主细胞天然地不分泌抗trail受体抗体链,可以通过用温和洗涤剂处理来释放抗trail受体抗体链。重组多肽的纯化是本领域公知的,包括硫酸铵沉淀、亲和层析纯化技术、柱层析、离子交换纯化技术、凝胶电泳等等(一般参见scopes,proteinpurification,springer-verlag,n.y.,1982)。
编码trail受体结合剂的多核苷酸,例如抗trail受体抗体编码序列,可以并入转基因中,用于导入转基因动物的基因组,随后在该转基因动物的乳汁中表达。参见,例如,美国专利no.5,741,957、5,304,489和5,849,992。适合的转基因包括与来自乳腺的特异基因,例如酪蛋白或β-乳球蛋白的启动子和增强子可操作连接的轻链和/或重链的编码序列。为产生转基因动物,可以将转基因显微注射到受精的卵母细胞中,或可以并入胚胎干细胞的基因组中,而且这些细胞的核转移到去核的卵母细胞中。
单链抗体。在一个实施方式中,本技术的结合剂是单链抗trail受体抗体。根据本技术,可以将一些技术加以调适用于生产对trail受体多肽特异性的单链抗体(参见,例如,美国专利no.4,946,778)。可以用于产生本技术的单链fv和抗体的技术的实例包括在美国专利no.4,946,778和5,258,498;huston等人,methodsinenzymology,203:46-88,1991;shu,l.等人,proc.natl.acad.sci.usa,90:7995-7999,1993;和skerra等人,science240:1038-1040,1988中公开的那些。
嵌合抗体和人源化抗体。在一个实施方式中,本技术的结合剂是嵌合的抗trail受体抗体。在一个实施方式中,本技术的结合剂是人源化的抗trail受体抗体。在本技术的一个实施方式中,供体抗体和受体抗体是来自不同物种的单克隆抗体。例如,受体抗体是人类抗体(以使得它在人类中的抗原性最小化),在这种情况下,如此产生的cdr移植的抗体被称为“人源化”抗体。
可以使用标准重组dna技术产生的重组抗trail受体抗体,例如包含人类和非人类部分的嵌合和人源化单克隆抗体,其处在本技术的范围之内。对于某些应用,包括本技术的结合剂在人体中的体内使用以及这些试剂用于体外检测分析的应用,优选的是使用嵌合的、人源化的或人类抗trail受体抗体。这些嵌合的和人源化的单克隆抗体可以通过本领域已知的重组dna技术产生。这些有用的方法包括,例如但不限于,在国际申请pct/us86/02269;美国专利no.5,225,539;欧洲专利no.184187,欧洲专利no.171496;欧洲专利no.173494;pct国际公开wo86/01533;美国专利no.4,816,567;5,225,539;欧洲专利no.125023;better等人,1988.science240:1041-1043;liu等人,1987.proc.natl.acad.sci.usa84:3439-3443;liu等人,1987.j.immunol.139:3521-3526;sun等人,1987.proc.natl.acad.sci.usa84:214-218;nishimura等人,1987.cancerres.47:999-1005;wood等人,1985.nature314:446-449;shaw等人,1988.j.natl.cancerinst.80:1553-1559);morrison(1985)science229:1202-1207;oi等人(1986)biotechniques4:214;jones等人,1986.nature321:552-525;verhoeyan等人,1988.science239:1534;morrison,science229:1202,1985;oi等人,biotechniques4:214,1986;gillies等人,j.immunol.methods,125:191-202,1989;美国专利no.5,807,715;和beidler等人,1988.j.immunol.141:4053-4060中描述的方法。例如,抗体可以使用各种技术,包括cdr移植(ep0239400;wo91/09967;美国专利no.5,530,101;5,585,089;5,859,205;6,248,516;ep460167)、饰面(veneering)或表面重修(resurfacing)(ep0592106;ep0519596;padlane.a.,molecularimmunology,28:489-498,1991;studnicka等人,proteinengineering7:805-814,1994;roguska等人,pnas91:969-973,1994)和链改组(chainshuffling)(美国专利no.5,565,332)来人源化。在一个实施方式中,编码鼠抗trail受体单克隆抗体的cdna用限制性内切酶消化,所述限制性内切酶被特别地选择来去掉编码fc恒定区的序列,用编码人类fc恒定区的cdna的相当的部分来替换(参见robinson等人,pct/us86/02269;akira等人,欧洲专利申请no.184,187;taniguchi,欧洲专利申请no.171,496;morrison等人,欧洲专利申请no.173,494;neuberger等人,wo86/01533;cabilly等人,美国专利no.4,816,567;cabilly等人,欧洲专利申请no.125,023;better等人(1988)science240:1041-1043;liu等人(1987)procnatlacadsciusa84:3439-3443;liu等人(1987)jimmunol139:3521-3526;sun等人(1987)procnatlacadsciusa84:214-218;nishimura等人(1987)cancerres47:999-1005;wood等人(1985)nature314:446-449;和shaw等人(1988)jnatlcancerinst80:1553-1559);美国专利no.6,180,370;美国专利no.6,300,064;6,696,248;6,706,484;6,828,422。
在一个实施方式中,本技术容许构建人源化的抗trail受体抗体,其不太可能诱导人类抗小鼠抗体(humananti-mouseantibody,以下称为“hama”)应答,而仍然具有有效的抗体效应物功能。如本文所用,术语“人类”和“人源化的”,就抗体而言,涉及任何预计在人类受试者中引发治疗上可耐受的弱免疫原性反应的抗体。在一个实施方式中,本技术提供了人源化的trail-r1和/或trail-r2双特异性抗体,ctb003或hctb003重链和轻链免疫球蛋白。
cdr抗体。在一个实施方式中,本技术的结合剂是抗trail受体cdr抗体。一般地,用于产生抗trail受体cdr抗体的供体和受体抗体是来自不同物种的单克隆抗体;一般受体抗体是人类抗体(以使它在人体中的免疫原性最小化),在这种情况下,如此产生的cdr移植的抗体被称为“人源化的”抗体。移植物可以是受体抗体的单个vh或vl内的单个cdr(或甚至单个cdr的一部分),或可以是vh和vl之一或两者之内的多个cdr(或其部分)。很多时候,受体抗体的所有可变域中的所有三个cdr都将被相应的供体cdr替换,尽管人们只需要替换必需数目的cdr以允许产生的cdr移植抗体对metap3的充分结合。产生cdr移植的抗体和人源化抗体的方法在queen等人,美国专利no.5,585,089,美国专利no.5,693,761;美国专利no.5,693,762;和winteru.s.5,225,539;以及ep0682040中有所教导。制备vh和vl多肽的有用方法在winter等人,美国专利no.4,816,397;6,291,158;6,291,159;6,291,161;6,545,142;ep0368684;ep0451216;ep0120694中有所教导。
在从同一家族和/或同一家族成员选择了适合的候选框架区域之后,通过将来源物种的cdr移植到杂合框架区域中来产生重链和/或轻链可变区。就上述两个方面中的任一个而言,具有杂合的可变链区域的杂合抗体或杂合抗体片段的组装可以使用本领域技术人员已知的常规方法来实现。例如,编码在此描述的杂合可变域(即基于目标物种的框架和来源物种的cdr)的dna序列可以通过寡核苷酸合成和/或pcr来产生。也可以使用适合的限制性内切酶从来源物种抗体分离编码cdr区域的核酸,并通过用适合的连接酶连接来将其连接到目标物种框架中。另外一种选择,可以通过定点诱变来改变来源物种抗体的可变链的框架区域。
由于杂合体是从对应于各个框架区域的多个候选物之中进行选择来构建的,存在着许多可以依照本文描述的原则来进行构建的序列组合。因而,可以组装杂合体的文库,该文库的成员具有单个框架区域的不同组合。这种文库可以是序列的电子数据库集合或杂合体的实体集合。
这个过程一般不改变位于被移植的cdr侧翼的受体抗体的fr。然而,本领域技术人员有时可以通过替换给定fr的某些残基来使得fr更类似于相应的供体抗体的fr,来改善产生的抗trail受体cdr移植抗体的抗原结合亲和力。优选的替换位置包括邻近cdr的氨基酸残基,或者能够与cdr相互作用的残基(参见,例如,us5,585,089,特别是第12-16栏)。或者本领域技术人员可以从供体fr开始,对它进行修饰来使它更类似于受体fr或人类共有fr。产生这些修饰的技术是本领域已知的。特别地,如果产生的fr在该位置符合人类共有fr,或与这种共有fr有至少90%或更高的同一性,那么这样做可能不会使得到的修饰的抗trail受体cdr抗体的抗原性与具有完全人类fr的相同抗体相比发生显著提高。
融合蛋白。在一个实施方式中,本技术的结合剂是融合蛋白。trail受体结合剂当与第二种蛋白质融合时,可以用作抗原标签。可以融合到多肽的结构域的实例不仅包括异源信号序列,还包括其他异源功能区域。融合不一定需要是直接的,可以通过接头序列来融合。此外,本技术的融合蛋白也可以被工程化来改善trail受体结合剂的特征。例如,可以将由额外的氨基酸,特别是带电氨基酸构成的区域添加到trail受体结合剂的n-末端,来改善在从宿主细胞纯化或后续的处理和保存期间的稳定性和持久性。并且,可以将肽模块添加到trail受体结合剂以便于纯化。这些区域可以在trail受体结合剂的最终制备之前去除。添加肽模块以便于多肽的处理是本领域惯用的和常规的技术。trail受体结合剂可以融合到标记物序列,例如,便于纯化融合多肽的肽。在一些实施方式中,标记物氨基酸序列是六聚组氨酸肽,例如在pqe载体(qiagen,inc.,9259etonavenue,chatsworth,calif.,91311)等中提供的标签,它们中许多是商业上可获得的。如gentz等人,proc.natl.acad.sci.usa86:821-824,1989中描述的,六聚组氨酸使得纯化融合蛋白易于进行。对于纯化有用的另一个肽标签,“ha”标签,对应于来自流感血凝素蛋白质的表位。wilson等人,cell37:767,1984。
因此,这些上述融合物的任一种都可以利用本技术的多核苷酸或多肽来工程化。并且,融合蛋白可以显示出增加的体内半衰期。
具有二硫键连接的二聚结构(由于igg)的融合蛋白,与单独的单体型分泌蛋白质或蛋白质片段相比,在结合和中和其他分子方面可能是更有效的。fountoulakis等人,j.biochem.270:3958-3964,1995。
类似地,ep-a-o464533(对应于加拿大的2045869)公开了一些融合蛋白,它们包含免疫球蛋白的恒定区的不同部分以及另一种人类蛋白质或其部分。在很多情况下,融合蛋白中的fc部分对于治疗和诊断是有益的,因而可以产生例如改善的药物动力学性质的结果。参见ep-a0232262。另外一种选择,可能希望在表达、检测和纯化了融合蛋白之后删除fc部分。例如,如果融合蛋白被用作免疫的抗原,fc部分可能阻碍治疗和诊断。在药物发现中,为了高通量筛选分析来鉴定hil-5的拮抗剂,例如,人类蛋白质如hil-5已经与fc部分融合。bennett等人,j.molecularrecognition8:52-58,1995;johanson等人,j.biol.chem.,270:9459-9471,1995。
通过t细胞表位修饰的治疗蛋白质的去免疫(de-immunization)。临床使用中的许多治疗蛋白质已经显示了引发不希望的抗体应答,这些应答在某些情况下伴随着不良事件。在本技术的一个实施方式中,通过鉴定重组抗trail受体抗体、trail受体多肽或trail受体结合剂的氨基酸序列中对于给定物种的t细胞的一个或多个潜在的表位,并修饰所述氨基酸序列来消除至少一个t细胞表位,使得所述抗体、多肽或结合剂对于给定的物种具有非免疫原性或较低的免疫原性。这样就消除了或降低了多肽或蛋白质暴露于给定物种的免疫系统时所述多肽或蛋白质的免疫原性。这样的去免疫化对单克隆抗体和其他免疫球蛋白样分子可能特别有益,例如,可以对小鼠衍生的免疫球蛋白加以去免疫以用于人类治疗用途。本技术领域去免疫多肽或蛋白质的方法参见,例如,carr等人,美国专利申请20030153043;和degroot等人,aidsres.andhumanretroviruses13:539-541(1997);schafer等人,vaccine16:1880-1884(1998);degroot等人,dev.biol.112:71-80(2003);degroot等人,vaccine19:4385-4395(2001);reijonenandkwokmethods29:282-288;novak等人,j.immunology166:6665-6670(2001)。
在一个实施方式中,使用编码作为融合蛋白的一部分的候选结合剂(其中这些融合蛋白在宿主细胞中表达时形成包涵体)的基因组dna或est来制备本技术的trail受体结合剂。这种编码作为融合蛋白的一部分的候选结合剂(其中这些融合蛋白在宿主细胞中表达时形成包涵体)的基因组dna或est的制备方法已经有所描述。参见美国专利no.6,653,068;u.s.s.n.20040157291。例如,包涵体可用于产生特异性结合目标(多)肽的结合配偶体,例如trail受体结合剂。
trail受体结合剂缀合蛋白。如上所述,在某些实施方式中,本技术的trail受体结合剂是抗trail受体抗体,其偶联或缀合于一种或多种治疗性或细胞毒性模块来产生本技术的trail受体结合剂缀合蛋白。任选地,trail受体结合剂可用作trail受体结合剂-细胞毒素缀合分子,例如用于肿瘤疾病治疗的施用。
一般地,治疗模块(therapeuticmoieties)可以缀合于本技术的trail受体结合剂,例如,通过任何合适的技术,同时适当地考虑药物动力学稳定性和降低对受试者的总体毒性的需要。治疗性、细胞毒性、或标记/显象试剂(即“模块(moiety)”)可以直接或间接(例如通过接头基团)偶联于适合的trail受体结合剂。当模块和trail受体结合剂各自具有能够相互反应的功能基团时,模块和trail受体结合剂之间的直接反应是可能的。例如,亲核基团,例如氨基或巯基基团,能够与含有羰基的基团例如酐或酸性卤化物(acidhalide)反应,或与含有良好的离去基团(例如卤素)的烷基(alkylgroup)反应。作为选择,可以使用适合的化学接头基团。接头基团可以起间隔区的作用,使所述模块远离所述trail受体结合剂,以避免对结合能力的干扰。接头基团也可以用来提高所述模块或trail受体结合剂上的取代基的化学反应性,并从而提高偶联效率。化学反应性的提高也可以使得本不可能使用的模块或模块上的功能基团变得容易使用。
适合的连接化学包括马来酰亚胺基接头和烷基卤接头(其与抗体模块上的巯基反应)和琥珀酰亚胺基接头(其与抗体模块上的伯胺反应)。几个伯胺和巯基基团存在于免疫球蛋白上,其他的基团可以设计到重组免疫球蛋白分子中。对于本领域技术人员明显的是,各种双官能或多官能试剂,包括同官能和异官能的(例如,在piercechemicalco.,rockford,ill.的目录中描述的那些),可以用作接头基团。结合可以例如通过氨基、羧基、巯基或氧化的糖残基来进行(参见,例如美国专利no.4,671,958)。
作为备选的偶联方法,例如,可以经由糖基化位点处的氧化的糖基团将模块偶联到本技术的trail受体结合剂上,如在美国专利no.5,057,313和5,156,840中描述的。结合trail受体结合剂到所述部分上的又一个可选择的方法是通过使用非共价结合配对,例如,链霉抗生物素蛋白/生物素,或抗生物素蛋白/生物素。在这些实施方式中,将所述配对的一个成员共价结合到trail受体结合剂,结合配对的另一个成员共价结合到所述模块上。
可断裂(cleavable)的接头。当本技术的免疫缀合物的细胞毒性或治疗模块在没有trail受体结合剂部分时效力更强时,可能希望使用在细胞内化期间或内化后可断裂的接头基团,或在细胞外环境中可随着时间逐渐地断裂。已经描述了许多不同的可断裂的接头基团。在细胞内将细胞毒性模块从这些接头基团上释放的实例包括,例如但不限于,通过二硫键的还原来断裂(例如,美国专利no.4,489,710)、通过对光不稳定键的照射(例如,美国专利no.4,625,014)、通过衍生化的氨基酸侧链的水解(例如,美国专利no.4,638,045)、通过血清补体介导的水解(例如,美国专利no.4,671,958),和酸催化的水解(例如,美国专利no.4,569,789)。
在一个实施方式中,trail受体结合剂与超过一种治疗性、细胞毒性和/或显像模块结合。通过多衍生化(poly-derivatizing)本技术的trail受体结合剂,可以同时地实现几种细胞毒性策略,可以将trail受体结合剂制成对几种可视化技术有用的造影剂,或可以对治疗性抗体加以标记以用于通过可视化技术来追踪。在一个实施方式中,将细胞毒性模块的多个分子连接到一个trail受体结合剂上。在一个实施方式中,将trail受体结合剂与至少两种模块的混合物偶联,所述模块选自细胞毒性模块、治疗模块、和标记/显像模块构成的组。也就是说,多于一种类型的模块可以连接到一个trail受体结合剂上。例如,治疗模块,如多核苷酸或反义序列,可以与细胞毒性或放射毒性模块一起缀合于trail受体结合剂,以提高化学或放射毒性治疗的有效性,以及降低获得期望的治疗效果所必需的剂量。不考虑特定的实施方式,可以以各种方式制备与多于一种模块所成的免疫缀合物。例如,可以将多于一种模块直接偶联到trail受体结合剂上,或者可以使用提供多个附接位点的接头(例如,树枝状聚合物(dendrimers))。另外一种选择,可以使用具有容纳多于一种细胞毒模块的容量的载体。
如上文说明的,trail受体结合剂可以以各种方式携带所述模块,包括直接或经由接头基团的共价键合,和非共价的缔合。在一个实施方式中,trail受体结合偶联的蛋白质可以与封装载体组合。这在化学毒性治疗实施方式中是特别有用的,因为它们可以容许治疗组合物随着时间逐渐地释放trail受体结合剂化学毒性模块,同时将它浓缩在目标细胞的附近。
与放射性核素缀合的trail受体结合剂。在一个实施方式中,本技术的trail受体结合剂与细胞毒性模块偶联,所述细胞毒性模块是放射性核素。优选的细胞毒性模块的放射性核素是适合于药理学施用的放射性核素。这些放射性核素包括123i、125i、131i、90y、211at、67cu、186re、188re、212pb、和212bi。碘和砹同位素是用于本技术的治疗组合物中的更优选的放射性核素,关于它们的用途已经积累了大量的文献。131i是特别优选的,其他的β-辐射发射性核素也是,它们具有几毫米的有效范围。123i、125i、131i或211at可以与trail受体结合剂使用几种已知的缀合试剂中的任何一种缀合用于组合物和方法中,所述已知的缀合试剂包括碘化试剂(lodogen)、3-[211at]砹代苯甲酸(astatobenzoate)n-琥珀酰亚胺酯、3-[131i]碘代苯甲酸n-琥珀酰亚胺酯(sib)和5-[131i]碘-3-吡啶羧酸n-琥珀酰亚胺酯(sipc)。可以在上述碘代试剂中利用任何碘同位素。其他放射性核素可以通过核医学领域的技术人员已知的适合的螯合试剂缀合到trail受体结合剂上。
化学毒性模块。在一个实施方式中,本技术的trail受体结合剂与化学毒性模块偶联。化学毒性试剂包括但不限于,小分子药物,例如氨甲蝶呤、和嘧啶和嘌呤类似物。化学毒素分化诱导物包括佛波醇酯和丁酸。化学毒性模块可以直接缀合于trail受体结合剂。在一个实施方式中,本技术的trail受体结合剂经由化学接头缀合于细胞毒性模块。在另一个实施方式中,模块被封装在载体中,载体则偶联于本技术的trail受体结合剂。
蛋白质毒素。在一个实施方式中,本技术的trail受体结合剂与蛋白质毒素模块偶联。优选的用作细胞毒性模块的毒素蛋白质包括,例如但不限于,放线菌或链霉菌抗生素、多卡霉素(duocarmycin)、紫杉醇(taxol)、细胞松弛素b(cytochalasinb)、短杆菌肽d(gramicidind)、溴化乙锭(ethidiumbromide)、依米丁(emetine)、丝裂霉素(mitomycin)、依托泊苷(etoposide)、替尼泊苷(tenoposide)、长春新碱(vincristine)、长春碱(vinblastine)、秋水仙碱(colchicin)、多柔比星(doxorubicin)、柔红霉素(daunorubicin)、二羟基蒽环素(dihydroxyanthracindidne)、米托蒽醌(mitoxantrone)、光神霉素(mithramycin)、放线菌素d(actinomycind)、1-去氢睾酮(1-dehydrotestosterone)、糖皮质激素(glucocorticoids)、普鲁卡因(procaine)、丁卡因(tetracaine)、利多卡因(lidocaine)、普萘洛尔(propranolol)和嘌呤霉素(puromycin)和其类似物或同源物。用作细胞毒性模块的优选的毒素蛋白质进一步包括蓖麻毒素(ricin)、相思豆毒素(abrin)、白喉毒素(diphtheriatoxin)、霍乱毒素(choleratoxin)、白树毒素(gelonin)、假单胞菌外毒素(pseudomonasexotoxin)、志贺氏菌毒素(shigellatoxin)、商陆抗病毒蛋白(pokeweedantiviralprotein)和医学生物化学领域已知的其他毒素蛋白质。由于这些毒素试剂可能在受试者中引发不希望的免疫应答,如果血管内注射尤为如此,因此优选是将它们封装在载体中用于偶联到trai受体结合剂,例如抗trail受体抗体和抗体相关多肽。
酶活性毒素。在一个实施方式中,本技术的trail受体结合剂与酶活性毒素结合。酶活性毒素可以是细菌或植物来源的,或这种毒素的酶活性片段(“a链”)。在本技术中有用的的酶活性毒素和其片段包括白喉毒素a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌)、蓖麻毒素a链、相思豆毒素a链、蒴莲根毒素(modeccin)a链、α-帚曲菌素(α-sarcin)、油桐(aleuritesfordii)蛋白、石竹素(dianthin)蛋白、美洲商陆(phytolaccaamericana)蛋白(papi、papii和pap-s)、苦瓜(momordicacharantia)抑制物、麻疯树毒素(curcin)、巴豆毒素(crotin)、肥皂草(sapaonariaofficinalis)抑制物、白树毒素(gelonin)、丝林霉素(mitogellin)、局限曲菌素(restrictocin)、酚霉素(phenomycin)和伊诺霉素(enomycin)。本技术的trail受体结合剂与细胞毒性模块的缀合物可以使用多种双功能蛋白质偶联剂来制备。这些试剂的实例有:spdp;it;亚氨酸酯(例如二甲基己二酰亚胺盐酸盐)、活性酯类(例如诸如辛二酸二琥珀酰亚胺酯)、醛类(例如戊二醛)、双叠氮化合物(例如双(对叠氮苯甲酰基)己二胺)、双叠氮衍生物(例如双(对叠氮苯甲酰基)乙二胺)、二异氰酸酯(例如甲苯2,6-二异氰酸酯)和双活性氟化合物(例如1,5-二氟-2,4-二硝基苯)的双官能衍生物。毒素的溶解性部分(lysingportion)可以与抗体(例如trail受体结合剂)的fab片段连接。
治疗性模块。在一个实施方式中,本技术的trail受体结合剂与治疗模块偶联。治疗模块包括,例如但不限于,抗代谢物(例如,氨甲蝶呤(methotrexate)、6-巯嘌呤(6-mercaptopurine)、6-硫代鸟嘌呤(6-thioguanine)、阿糖胞苷(cytarabine)、5-氟尿嘧啶达卡巴嗪(5-fluorouracildecarbazine)),烷化剂(例如,氮芥(mechlorethamine)、塞替派瘤可宁(thioepachlorambucil)、美法仑(melphalan)、卡莫司汀(carmustine,bsnu)和洛莫司汀(lomustine,ccnu)、环磷酰胺(cyclothosphamide)、白消安(busulfan)、二溴甘露醇(dibromomannitol)、链唑霉素(streptozotocin)、丝裂霉素c(mitomycinc)和顺式二氯二胺铂(cis-dichlorodiamineplatinum)(ii)(ddp)顺铂),蒽环类抗生素(anthracyclines)(例如,柔红霉素(daunorubicin)(旧称道诺霉素(daunomycin))和多柔比星(doxorubicin)),抗生素(例如,放线菌素(dactinomycin)(旧称放线菌素(actinomycin))、博来霉素(bleomycin)、光神霉素(mithramycin)和氨茴霉素(anthramycin)(amc))、多柔比星(doxorubicin)(亚德里亚霉素(adriamycin))、顺铂、硫酸博来霉素(bleomycinsulfate)、卡莫司汀(carmustine)、瘤可宁(chlorambucil)、环磷酰胺羟基脲(cyclophosphamidehydroxyurea)或蓖麻毒素a(ricina),和抗有丝分裂试剂(例如,长春新碱(vincristine)和长春碱(vinblastine))。
将治疗模块缀合到本技术的trail受体结合剂的技术是公知的,参见,例如,arnon等人,“monoclonalantibodiesforimmunotargetingofdrugsincancertherapy”,monoclonalantibodiesandcancertherapy,reisfeld等人(eds.),pp.243-56(alanr.liss,inc.1985);hellstrom等人,“antibodiesfordrugdelivery”,controlleddrugdelivery(2nded.),robinson等人(eds.),pp.623-53(marceldekker,inc.1987);thorpe,“antibodycarriersofcytotoxicagentsincancertherapy:areview”,monoclonalantibodies‘84:biologicalandclinicalapplications,pinchera等人(eds.),pp.475-506(1985);“analysis,results,andfutureprospectiveofthetherapeuticuseofradiolabeledantibodyincancertherapy”,monoclonalantibodiesforcancerdetectionandtherapy,baldwin等人(eds.),pp.303-16(academicpress1985),和thorpe等人,“thepreparationandcytotoxicpropertiesofantibody-toxinconjugates”,immunol.rev.,62:119-58(1982)。
标记的trail受体结合剂。在一个实施方式中,本技术的trail受体结合剂与标记模块,即可检测基团结合。缀合于trail受体结合剂的特定的标记物或可检测基团不是本技术的关键方面,只要它不显著地影响本技术的trail受体结合剂对trail受体多肽或trail受体样多肽的特异性结合。可检测基团可以是具有可检测的物理或化学性质的任何材料。这些可检测标记在免疫分析和显像领域已经得到了良好的开发,一般地,在这些方法中有用的几乎任何标记物都可以用于本技术中。因而,标记物是可由分光的、光化学的、生物化学的、免疫化学的、电的、光学的或化学的手段检测的任何组合物(composition)。在本技术中有用的标记物包括磁性珠子(例如,dynabeadstm)、荧光染料(例如,异硫氰酸荧光素、texas红、罗丹明等等)、放射性标记物(例如,3h、14c、35s、125i、121i、112in、99mtc),其他的显像试剂,例如微泡(microbubbles)(用于超声波显像)、18f、11c、15o(用于正电子发射层析成像)、99mtc、111in(用于单光子发射层析成像)、酶(例如,辣根过氧化物酶、碱性磷酸酶和其他通常在elisa中使用的酶),和量热标记物,例如胶体金或有色玻璃或塑料(例如,聚苯乙烯、聚丙烯、乳胶等等)珠子。描述了这些标记物的用途的专利包括美国专利3,817,837;3,850,752;3,939,350;3,996,345;4,277,437;4,275,149和4,366,241,为了所有目的通过引用将它们每一个完全并入本文。也参见handbookoffluorescentprobesandresearchchemicals(6thed.,molecularprobes,inc.,eugeneor.)。
标记物可以根据本领域公知的方法直接或间接地偶联到测定系统的希望组分上。如上所指出,可以使用各种各样的标记物,标记物的选择取决于需要的敏感性、与化合物缀合的便利性、稳定性要求、可用的测试设备和处理规定。
非放射性标记通常通过间接的方式来连接。一般地,配体分子(例如生物素)共价地结合于分子。配体然后结合于抗配体(例如,链霉抗生物素蛋白)分子,抗配体本身可被检测或者共价结合于信号系统,例如,可检测的酶、荧光化合物,或化学发光化合物。可以使用多种配体和抗配体。当配体具有天然的抗配体时,例如,生物素、甲状腺素和可的松,它可以与标记的、天然存在的抗配体结合使用。另外一种选择,任何半抗原性或抗原性化合物可以用于与抗体,例如抗trail受体抗体组合。
分子也可以直接缀合于产生信号的化合物,例如,与酶或荧光基团缀合。作为标记物感兴趣的酶将主要是水解酶,特别是磷酸酶、酯酶和糖苷酶,或氧化还原酶,特别是过氧化物酶。作为标记模块有用的荧光化合物包括但不限于,例如,荧光素和它的衍生物、罗丹明和它的衍生物、丹磺酰、伞形酮等等。作为标记模块有用的化学发光化合物包括但不限于,例如,萤光素和2,3-二氢酞嗪二酮(2,3-dihydrophthalazinediones),例如,鲁米诺。对于可以使用的各种标记和信号产生系统的综述,参见,美国专利no.4,391,904。
检测标记物的方法是本领域技术人员公知的。因而,例如,当标记物是放射性标记时,检测的手段包括闪烁计数器或放射自显影中的感光胶片。当标记物是荧光标记物时,它可以通过用合适波长的光线激发荧光染料并检测产生的荧光来检测。荧光可以通过目视、通过感光胶片、通过使用电子探测器例如电荷耦合器件(chargecoupleddevices,ccd)或光电倍增器等等来检测。类似地,酶标记物可以通过提供合适的酶底物并检测产生的反应产物来检测。最后,简单的比色标记物可以仅通过观察与标记物相关的颜色来检测。因而,在各种浸渍测定中,缀合的金子常常呈现粉色,而各种缀合的珠子呈现珠子的颜色。
某些测定模式不需要使用标记的成分。例如,凝集测定可以用于检测目标抗体,例如抗trail受体抗体的存在。在这种情况下,抗原包被的颗粒通过包含目标抗体的样品来凝聚。在这种形式中,没有组分需要被标记,目标抗体的存在通过简单的目测检查来检测。
药物组合物的制剂。本技术的trail受体结合剂可以掺入适合于施用的药物组合物中。药物组合物一般包含至少一种trail受体结合剂和处于适合于向受试者施用的形式的药学上可接受的载体。药学上可接受的载体部分地根据要施用的特定组合物,以及根据用于施用组合物的特定方法来确定。因而,存在着各种各样的适合的药物组合物的制剂用于施用所述抗体组合物(参见,例如,remington'spharmaceuticalsciences,mackpublishingco.,easton,pa18thed.,1990)。药物组合物一般地被配制为无菌的,基本上等渗的,并完全符合美国食品和药品管理局的所有的优质生产规范(gmp)规范。
术语“药学上可接受的”、“生理学上可耐受的”和其语法上的变体,当涉及组合物、载体、稀释剂和试剂时,可互换使用,表明所述材料能够施用给受试者而不产生阻止所述组合物的施用的程度的不良生理影响。例如,“药学上可接受的赋形剂”是指在制备一般安全、无毒、可取的药物组合物中有用的赋形剂,并且包括对于兽医学用途以及人类药物用途可接受的赋形剂。这些赋形剂可以是固体、液体、半固体,或对于气雾剂组合物来说,是气体。“药学上可接受的盐和酯”是指药学上可接受的并具有希望的药理学性质的盐和酯。这些盐包括在酸性质子存在于trail受体结合剂中时可以形成、并能够与无机或有机碱反应的盐。适合的无机盐包括与碱金属,例如钠和钾、镁、钙和铝形成的无机盐。适合的有机盐包括与有机碱,例如胺碱,例如,乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、n-甲基葡糖胺等等形成的有机盐。这些盐还包括与无机酸(例如,盐酸和氢溴酸)和有机酸(例如,乙酸、柠檬酸、顺丁烯二酸和烷烃和芳烃-磺酸,例如甲磺酸和苯磺酸)形成的酸加成盐。药学上可接受的酯包括从存在于trail受体结合剂上的羧基、磺酰氧基和膦羧基(phosphonoxy)基团形成的酯,例如,c1-6烷基酯。当存在两个酸性基团时,药学上可接受的盐或酯可以是单酸单盐或酯,或二盐或酯;类似地,当存在超过两个酸性基团时,某些或者所有这些基团可以被盐化或酯化。本技术中述及的trail受体结合剂可以以未盐化或未酯化的形式存在,或处于盐化和/或酯化形式,对这样的trail受体结合剂的提述意图包括最初的(未盐化和未酯化的)化合物和它的药学上可接受的盐或和酯。并且,本技术中提述的某些trail受体结合剂可以以超过一种立体异构形式存在,这种trail受体结合剂的提述意图包括所有单立体异构体和这些立体异构体的所有混合物(无论是外消旋的还是相反)。本领域普通技术人员可以无困难地确定本技术的特定药物和组合物的适当的给药时间、顺序和剂量。
这些载体或稀释剂的优选的实例包括但不限于,水、盐水、林格氏溶液、葡萄糖溶液和5%人血清白蛋白。也可以使用脂质体和非水媒介物,例如不挥发的油。这些介质和化合物用于药学活性物质的用途是本领域公知的。除非任何常规的介质或化合物与trail受体结合剂不相容,则考虑其在治疗组合物中的使用。补充的活性化合物也可以掺入到组合物中。
本技术的药物组合物被配制以适合于它预期的施用途径。本技术的trail受体结合剂组合物可以通过胃肠外的、表面的、静脉内的、口服的、皮下的、动脉内的、皮内的、穿表皮的、直肠的、颅内的、腹膜内的、鼻内的、肌肉内的途径,或作为吸入物来施用。免疫原剂如trail受体多肽的最典型的施用途径是皮下途径,而其他途径可以是同样有效的。第二最常规的途径是肌内注射。这种类型的注射最一般地在手臂或腿部肌肉中进行。在某些方法中,试剂被直接注射到积累了沉积物(deposits)的特定的组织中,例如颅内注射。肌肉内注射或静脉内输注(intramuscularinjectiononintravenousinfusion)对于trail受体结合剂,例如抗trail受体抗体的施用是优选的。在某些方法中,本技术的特定的trail受体结合剂直接注射到颅骨中。在某些方法中,trail受体结合剂作为持续释放组合物或装置,例如medipadtm设备,来施用。
本技术的trail受体结合剂任选地可以与其他试剂组合地施用,所述其他试剂在治疗各种疾病,包括各种trail受体相关疾病中是至少部分有效的。在向受试者的中枢神经系统施用的情况下,本技术的trail受体结合剂也可以与提高试剂血脑屏障的跨越的其他试剂一起施用。
用于胃肠外、皮内或皮下施用的溶液或悬浮液可以包括以下的成分:无菌的稀释剂例如注射用水、盐水溶液、不挥发油类、聚乙二醇、甘油、丙二醇或其他合成的溶剂;抗菌化合物例如苯甲醇或对羟基苯甲酸酯;抗氧化剂例如抗坏血酸或亚硫酸氢钠;螯合化合物例如乙二胺四乙酸(edta);缓冲剂例如醋酸盐、柠檬酸盐或磷酸盐,以及用于调整张度的化合物例如氯化钠或葡萄糖。可以使用酸或碱,例如盐酸或氢氧化钠,调节ph值。胃肠外的制品可以封装到由玻璃或塑料制成的安瓿瓶、一次性注射器或多剂量小瓶中。
适合于可注射使用的药物组合物一般包括无菌水溶液(在可溶于水时)或分散体和用于无菌可注射溶液或分散体的临时制备的无菌粉剂。对于静脉内施用,适合的载体包括生理盐水、抑菌水、克列莫佛(cremophor)eltm(basf;parsippany,n.j.)或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物应当是无菌的,并应当具有易于通针(easysyringeability)的程度的流动性。它在制造和储存条件下必须是稳定的,并且必须保持不受抗微生物例如细菌和真菌的污染作用。载体可以是溶剂或分散介质,其含有例如,水、乙醇、多元醇(例如,甘油、丙二醇、液体聚乙二醇等等)以及其适合的混合物。适当的流动性可以通过下述方式维持:例如,通过使用包衣例如卵磷脂;在分散体的情况下通过维持所需的粒子大小;以及通过使用表面活性剂。可以通过各种抗菌和抗真菌化合物,例如对羟苯甲酸酯、氯代丁醇、苯酚、抗坏血酸、硫柳汞等等,来实现对微生物作用的防护。在很多情况下,组合物中优选包括等渗化合物,例如糖类、多元醇如甘露醇、山梨醇、氯化钠。通过在组合物中包括延迟吸收的化合物,例如单硬脂酸铝和明胶,可以实现可注射组合物的延长的吸收。
可以通过将trail受体结合剂以所需的量掺入到具有一种上文列举的成分或上文列举的成分的组合的适合的溶剂中,根据需要,继之以过滤灭菌,来制备无菌可注射溶液。一般地,通过将结合剂掺入到含有基础分散介质以及来自以上列举那些的其他所需成分的无菌运载体中,来制备分散体。对于用于制备无菌可注射溶液其无菌粉剂来说,制备方法是通过真空干燥和冻干产生粉剂,这样的粉剂包含活性成分以及任何附加的期望的成分,后者来自所述成分的事先经无菌过滤的溶液。本技术的试剂可以以储库注射剂(depotinjection)或植入制剂的形式施用,这样的试剂可以配制成允许活性成分的持续或脉冲释放的形式。
口服组合物一般包括惰性稀释剂或可食用的载体。它们可以包装入胶囊中或压缩成片剂。对于口服治疗施用来说,粘合剂可以与赋形剂混合,以片剂、锭剂或胶囊的形式使用。口服组合物也可以使用液体载体制备来用作漱口水,其中所述液体载体中的化合物口服地施用并被吸入漱口并吐出或被吞咽。可以包括药学上相容的结合化合物,和/或佐剂材料作为组合物的一部分。片剂、药丸、胶囊、锭剂等等可以含有任何以下的成分,或性质类似的化合物:粘合剂,例如微晶纤维素、黄蓍胶或明胶;赋形剂,例如淀粉或乳糖;崩解化合物,例如海藻酸、乙醇酸淀粉钠(primogel)或玉米淀粉;润滑剂,例如硬脂酸镁或氢化植物油(sterotes);助流剂,例如胶体二氧化硅;甜味化合物,例如蔗糖或糖精;调味化合物,例如薄荷、水杨酸甲酯或橙味剂。
对于通过吸入施用,trail受体结合剂以来自压缩容器或分配器的气溶胶喷雾形式来施用,所述容器或分配器含有适合的推进剂例如气体,如二氧化碳,或喷雾器。
全身性施用也可以通过穿粘膜或穿表皮的方式。对于穿粘膜或穿表皮施用,适合于需透过的障碍物的渗透剂可以用于制剂中。这种渗透剂一般是本领域已知的,包括,例如,对于穿粘膜施用,清洗剂(detergents)、胆汁盐和夫西地酸衍生物。穿粘膜施用可以通过使用鼻喷雾或栓剂来实现。对于穿表皮施用,如本领域一般已知的,将trail受体结合剂配制到软膏剂(ointments)、油膏剂(salves)、凝胶剂或乳膏剂中。
trail受体结合剂也可以制备为用于直肠递送的栓剂(例如,具有常规的栓剂基质,例如可可脂和其他甘油酯)或滞留灌肠剂(retentionenemas)的形式的药物组合物。
在一个实施方式中,用能够保护trail受体结合剂免于从体内快速消除的载体制备trail受体结合剂,例如控释制剂,包括植入物和微封装的递送系统。可以使用生物可降解的、生物相容的聚合物,例如乙烯醋酸乙烯、聚酸酐、聚乙醇酸、胶原、聚原酸酯(polyorthoesters)和聚乳酸。这类配制剂的制备方法对于本领域技术人员是显而易见的。这些材料也可以自alzacorporation和novapharmaceuticals,inc.购得。脂质体悬液(包括带有针对病毒抗原的单克隆抗体的、靶向受感染细胞的脂质体)也可以用作药学上可接受的载体。这些可以根据本领域技术人员已知的方法来制备,例如,如美国专利no.4,522,811中描述的。
特别有利的是以单位剂型配置口服的或胃肠外的组合物,以便于施用和剂量的均匀化。在此使用的单位剂型是指适合作为单位剂量用于要治疗的受试者的、物理上离散的单位;每个单位含有经过计算可产生期望治疗效果的预定量的结合剂以及与之结合的药物载体。本技术的单位剂型的规格由下列因素决定并且直接依赖于它们:结合剂的独特特征和要实现的特定治疗效果、以及用于治疗受试者的trail受体结合剂配制技术的固有限制。
本技术的核酸分子可以插入到载体中,用作基因治疗载体。可以通过,例如,静脉内注射、局部施用(参见,例如,美国专利no.5,328,470)或通过立体定向(stereotactic)注射(参见,例如chen等人,1994.proc.natl.acad.sci.usa91:3054-3057)将基因治疗载体递送给受试者。基因治疗载体的药物制剂可以包括处在可接受的稀释剂中的基因治疗载体,或可以包含内部包埋有基因递送载体的缓释基质。另外一种选择,当可以从重组细胞完整地产生整个基因递送载体例如,逆转录病毒载体时,药物配制剂可以包括一个或多个产生该基因递送系统的细胞。所述药物组合物可以与施用说明书一起装入容器、包装袋或分配器中。
trail受体结合的测量。在一个实施方式中,trail受体结合测定是指一种测定模式,其中将trail受体多肽和trail受体结合剂在适合于trail受体多肽和trail受体结合剂之间的结合的条件下混合,并评估trail受体多肽和trail受体结合剂之间的结合的量。将结合的量与合适的对照进行比较,其中所述对照可以是在不存在trail受体多肽的情况下的结合量、存在非特异性免疫球蛋白组合物(composition)的情况下的结合量,或二者皆是。结合量可以通过任何适合的方法来评估。结合测定方法包括,例如,elisa、放射受体结合测定、闪烁迫近测定、细胞表面受体结合测定、荧光能量转移测定、液相层析、膜过滤测定等等。用于结合trail受体结合剂的trail受体多肽的直接测量的生物物理学测定有,例如,核磁共振、荧光、荧光偏振、表面等离子体共振(biacor芯片)等等。通过本领域已知的标准测定方法测定特异性结合,例如,放射性配体结合测定、elisa、fret、免疫沉淀、spr、nmr(2d-nmr)、质谱法等等。如果候选trail受体结合剂的特异性结合比不存在候选trail受体结合剂的情况下观察到的结合大至少百分之一,则候选trail受体结合剂作为本技术的trail受体结合剂是有用的。
trail受体结合剂生物学活性的测量。本技术的trail受体结合剂,例如抗trail受体抗体和抗trail受体抗体相关多肽,可以被具体指定为生物学活性的激动剂或拮抗剂,其含有本文所公开的特定活性。例如,作为trail受体结合剂的trail受体激动剂和拮抗剂可以利用本领域已知的方法来产生。参见,例如,wo96/40281;美国专利no.5,811,097;deng等人,blood92:1981-1988,1998;chen等人,cancerres.,58:3668-3678,1998;harrop等人,j.immunol.161:1786-1794,1998;zhu等人,cancerres.,58:3209-3214,1998;yoon等人,j.immunol.,160:3170-3179,1998;prat等人,j.cell.sci.,111:237-247,1998;pitard等人,j.immunol.methods,205:177-190,1997;liautard等人,cytokinde,9:233-241,1997;carlson等人,j.biol.chem.,272:11295-11301,1997;taryman等人,neuron,14:755-762,1995;muller等人,structure,6:1153-1167,1998;bartunek等人,cytokinem,8:14-20,1996。生物学活性,即trail受体结合剂的激动剂或拮抗剂性质,可以利用任何被开发用于测量trail受体多肽的生物学活性的常规体内和体外测定来表征。
vii.trail受体结合剂的用途
概述。本技术的结合剂在涉及trail受体多肽的定位和/或定量的本领域已知方法中是有用的(例如,用于测量适合的生物学样品中的trail受体多肽的水平,用于诊断方法,用于为所述多肽显像等等)。在一个实施方式中,含有抗体衍生的结合结构域的trail受体结合剂作为药理学活性组合物(以下称“治疗剂”)是有用的。结合剂对于通过标准技术,例如亲和层析或免疫沉淀来分离trail受体多肽是有用的。本技术的trail受体结合剂可以有助于纯化来自生物样品例如细胞的天然的免疫反应性trail受体多肽或免疫反应性trail受体样多肽、以及在宿主系统中表达的重组产生的免疫反应性trail受体多肽或trail受体样多肽。此外,trail受体结合剂可以用于检测免疫反应性trail受体多肽或免疫反应性trail受体样多肽(例如,在细胞溶胞产物中或细胞上清液中)以评估免疫反应性多肽的表达丰度和表达模式。trail受体结合剂可以用于诊断来监视组织中免疫反应性trail受体和/或免疫反应性trail受体样免疫反应性多肽的水平,作为临床测试程序的一部分,例如用来确定给定治疗方式的效力。如上所述,通过偶联(即物理地连接)本技术的trail受体结合剂到可检测的物质,可以使检测更容易。
a.trail受体的检测和定量
trail受体多肽表达的检测。一种示例性的用于检测生物样品中存在与否trail受体多肽或trail受体样多肽的方法包括:从测试受试者获得生物样品,使所述生物样品接触能够检测trail受体多肽或trail受体样多肽的trail受体结合剂,从而检测trail受体多肽或trail受体样多肽在所述生物样品中的存在。trail受体结合剂的一个实例是针对seqidno:17产生的抗体,能够结合trail受体多肽或trail受体样多肽。在一些实施方式中,该trail受体结合剂是抗体。在一些实施方式中,该抗体包含可检测的标记。术语“标记的”对于结合剂而言意图包括通过将结合剂与可检测物质偶联(即物理连接)而直接标记该结合剂,以及通过与直接被标记的另一个化合物反应而间接标记该结合剂。间接标记的实例包括使用荧光标记的第二抗体检测第一抗体。
在一些实施方式中,本技术的检测方法可用于体外生物样品中和体内检测trail受体多肽或trail受体样多肽。用于检测trail受体多肽或trail受体样多肽的体外技术包括酶联免疫吸附测定(elisa)、western印迹、免疫沉淀和免疫荧光。此外,用于检测trail受体多肽或trail受体样多肽的体内技术包括向受试者中导入标记的trail受体结合剂,例如抗trail受体抗体。例如,可以用放射性标记物标记抗体,所述放射性标记物在受试者中的存在和位置可以通过标准显像技术来检测。在一个实施方式中,所述生物样品含有来自测试受试者的多肽分子。
免疫测定和显像。本技术的trail受体结合剂可以采用基于抗体的技术用于测定生物样品中trail受体多肽水平或trail受体样多肽水平。例如,可以用标准的免疫组织学方法来研究组织中的蛋白质表达。jalkanen,m.等人,j.cell.biol.101:976-985,1985;jalkanen,m.等人,j.cell.biol.105:3087-3096,1987。对于检测蛋白质基因表达有用的其他基于抗体的方法包括免疫分析,例如,酶联免疫吸附分析(elisa)和放射免疫分析(ria)。适合的抗体分析标记物是本领域已知的,包括酶标记物,例如,葡萄糖氧化酶,和放射性同位素或其他放射性试剂,例如,碘(125i、121i)、碳(14c)、硫(35s)、氚(3h)、铟(112in)和锝(99mtc),以及荧光标记物,例如荧光素和罗丹明,以及生物素。
除了分析生物样品中的分泌的trail受体多肽水平或trail受体样多肽水平之外,分泌的trail受体多肽水平或trail受体样多肽水平也可以通过显像来体内检测。用于trail受体多肽水平或trail受体样多肽的体内显像的trail受体结合剂,例如,抗trail受体抗体标记物或标示物包括可通过x射线照相术、nmr或esr检测的那些。对于x射线照相术,适合的标记物包括放射性同位素,例如钡或铯,其产生可检测的辐射,但对受试者不是明显有害的。nmr和esr的适合的标示物包括具有可检测的特征性自旋的标示物,例如,氘,其可以通过标记相关scfv克隆的营养物来掺入到trail受体结合剂中。
将已经用合适的可检测显像模块,例如放射性同位素(例如,131i、112in、99mtc)、不透射线的物质、或可通过核磁共振检测的材料,进行标记的trail受体结合剂导入(例如,通过胃肠外、皮下或腹膜内导入)受试者中。本领域中要理解的是,受试者的体格(size)和使用的显像系统将决定产生诊断图像所需的显像模块的量。对于放射性同位素模块来说,对于人类受试者,注射的放射性的量通常范围将是约5到20毫居里的99mtc。标记的trail受体结合剂然后将优先地积累在细胞中含有特异性目标多肽的位置。例如,在s.w.burchiel等人,tumorimaging:theradiochemicaldetectionofcancer13(1982)中描述了体内肿瘤显像。
因而,本技术提供了医学状况的诊断方法,其涉及:(a)通过测量个体的细胞或体液中本技术的trail受体结合剂的结合来测定多肽的表达;(b)将基因表达的水平与标准的基因表达水平相比较,与标准表达水平相比所分析的多肽基因表达水平方面的提高或降低指示医学状况。
诊断用途。本技术的trail受体结合组合物在诊断方法中是有用的。因此,本技术提供了使用可用于诊断受试者中与trail受体相关的医学病症有关的结合剂的方法。可以这样地选择本技术的结合剂,使得它们对trail受体多肽具有任何水平的表位结合特异性以及非常高的结合亲和力。一般地,结合剂的结合亲和力越高,在免疫测定中可以实施越严格的洗涤条件,来除去非特异性结合的材料而不移除目标多肽。因而,在诊断测定中有用的本技术的trail受体结合剂通常具有至少108、109、1010、1011或1012m-1的结合亲和力。进一步地,理想的是用作诊断试剂的trail受体结合剂具有足够的动力学启动速率(kineticon-rate)以在至少12小时、优选的至少五(5)小时、更优选的至少一(1)小时中在标准条件下达到平衡。
本技术的某些方法采用了抗trail受体抗体的多克隆制备物以及抗trail受体抗体组合物作为诊断试剂,其他方法采用了单克隆分离物。相比由一种单克隆抗trail受体抗体组成的组合物,多克隆混合物的使用具有许多优势。通过结合到trail受体多肽、多克隆抗trail受体抗体或其他多肽上的多个位点,可以产生比结合到trail受体多肽或trail受体样多肽上单个位点的单克隆更强的(用于诊断的)信号。进一步地,多克隆制备物可以结合到原型目标序列的多种变体(例如,等位变体、种间变体、株系变体、药物诱导的逃逸变体(escapevariant)),而单克隆抗体仅可以结合原型序列或较上述范围为窄的变体。然而,在存在或潜在存在近相关抗原的情况下,单克隆的抗trail受体抗体对于检测单一抗原是有利的。
在采用根据上述方法制备的多克隆人类抗trail受体抗体的方法中,制备物一般包含具有针对目标多肽的不同表位特异性的trail受体结合剂(例如抗体)的配列(assortment)。在某些采用单克隆抗体的方法中,理想的是具有不同的表位结合特异性的两种抗体。表位结合特异性上的差异可以通过竞争性结合测定法来测定。
虽然作为人类抗体的trail受体结合剂可以用作任何类型的样品的诊断试剂,它们作为对于人类生物样品的诊断试剂是最有用的。trail受体结合剂可以用于在各种标准的测定模式中检测给定的trail受体多肽。这些模式包括免疫沉淀、western印迹、elisa、放射免疫测定和免疫测定分析(immunometricassay)。参见harlow&lane,antibodies,alaboratorymanual(coldspringharborpublications,newyork,1988);美国专利no.3,791,932;3,839,153;3,850,752;3,879,262;4,034,074,3,791,932;3,817,837;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;和4,098,876。生物样品可以从受试者的任何组织或体液获得。
免疫测定或夹心分析是本技术的诊断方法的优选的形式。参见美国专利no.4,376,110,4,486,530,5,914,241和5,965,375。这些分析使用固定到固相上的一种trail受体结合剂,例如,抗trail受体抗体或抗trail受体抗体的群体,以及另一种抗trail受体抗体或抗trail受体抗体的群体。一般地,对溶液抗trail受体抗体或抗trail受体抗体的群体加以标记。如果使用抗体群体,所述群体一般含有结合于目标多肽的不同表位特异位点的抗体。因而,对于固相和溶液抗体可以使用相同的群体。如果使用抗trail受体单克隆抗体,则对于固体和溶液相使用具有不同的结合特异性的第一和第二trail受体单克隆抗体。固相和溶液抗体可以依序地或同时地与目标抗原接触。如果固相抗体首先接触,则分析称为正向分析。反之,如果溶液抗体首先接触,则分析称为反向分析。如果目标与两种抗体同时地接触,则分析称为同时分析。在使抗trail受体抗体接触trail受体多肽之后,将样品温育一定时期,通常从约10分钟到约24小时,通常是约1小时。然后进行洗涤步骤来除去样品中没有特异性地结合于用作诊断试剂的抗trail受体抗体的成分。当固相抗体和溶液抗体在不同的步骤中结合时,可以在任一或两个结合步骤之后进行洗涤。在洗涤之后对结合加以定量,定量一般通过检测连接到固相上的标记物来进行,其中所述标记物是通过被标记的溶液抗体的结合而连接到固相的。通常,对于给定的一对抗体或一对抗体群体,以及给定的反应条件,从含有已知浓度的目标抗原的样品制备标准曲线。然后通过标准曲线的内插来读取被测试的样品中trail受体多肽的浓度。被分析物可以根据在平衡状态结合的标记溶液抗体的量,或通过在达到平衡之前一系列时间点上结合的标记溶液抗体的动力学测量来测量。这种曲线的斜率是样品中trail受体多肽的浓度的度量。
用于上述方法的适合的支持物包括,例如,硝酸纤维素膜、尼龙膜和衍生化的尼龙膜,以及颗粒,例如琼脂糖、基于葡聚糖的凝胶、浸渍片(dipsticks)、颗粒、微球体、磁性颗粒、试管、微量滴定孔、sephadextm(amershampharmaciabiotech,piscatawayn.j.)等等。固定可以通过吸附或通过共价附接来实现。任选地,抗trail受体抗体可以连接到接头分子,例如,生物素,用于附接于结合在表面上的接头,例如抗生物素蛋白上。
预测医学。本技术还涉及预测医学(predictivemedicine)的领域,其中为了预后(预测)目的使用诊断分析、预后分析、药物基因组学以及监控临床试验等来预防性地处理个体。因而,本技术的一个方面涉及用于确定生物样品(即血液、血清、细胞、组织)中trail受体多肽表达的诊断分析,以确定受试者是否患有与异常的trail受体多肽表达相关的疾病或病症,或具有发生这样的病症的风险。
本技术还提供了预后(或预测)分析,用于确定个体是否存在发展出与trail受体多肽表达或活性相关的病症的风险。这些分析可以用于预后或预测目的,以便在以trail受体多肽为特征、或与trail受体多肽相关的病症发作之前预防性地处理个体。此外,在本技术的trail受体结合剂对trail受体多肽相对于对其多态型具有更高亲和力的情况下(反之亦然),本技术的方法也可以用于评估个体是表达trail受体多肽或是表达trail受体多肽的多态型。
在受试者的特定组织中(或在血液中),某些多肽的水平可能是当给定药物施用给受试者时该药物的毒性、效力、清除速率或代谢速率的指示。在此描述的方法也可以用于测定这样的多肽在受试者中的水平以帮助预测这些受试者对这些药物的反应。本技术的另一个方面提供了一种方法来测定个体中trail受体多肽的表达,从而为该个体选择合适的治疗性或预防性化合物(在此称为“药物基因组学”)。利用药物基因组学,可以根据个体的基因型选择用于个体的治疗或预防性处理的化合物(例如药物)(例如,检查个体的基因型来确定个体对于特定化合物的响应能力)。
本技术的trail受体结合剂与trail受体多肽或trail受体样多肽的结合,例如,可以被利用来鉴定具有发生与trail受体多肽或trail受体样多肽表达或活性相关的病症(如上文描述的)的风险的受试者。另外一种方式,可以利用预后分析来鉴定具有或存在风险发生所述疾病或病症的受试者。因而,本技术提供了一种方法来鉴定与异常的trail受体多肽或trail受体样多肽表达或活性相关的疾病或病症,其中从受试者获得测试样品,检测trail受体结合剂,其中存在trail受体结合剂的改变是受试者具有或有风险发生与异常的trail受体多肽或trail受体样多肽表达或活性相关的疾病或病症的诊断依据。如本文所用,“测试样品”是指从感兴趣的受试者获得的生物样品。
此外,在此描述的预后分析可以用于确定受试者是否可以施用化合物(例如,激动剂、拮抗剂、拟肽(peptidomimetics)、多肽、肽、核酸、小分子或其他药物候选物)来治疗与异常的trail受体多肽或trail受体样多肽表达或活性相关的疾病或病症。例如,这种方法可用于确定是否可以用化合物有效地治疗受试者的trail受体多肽或trail受体样多肽相关的病症。因而,本技术提供了用于确定是否可以用化合物有效地治疗受试者的与异常的trail受体多肽或trail受体样多肽表达或活性相关的病症的方法,其中获得测试样品,并利用trail受体结合剂检测trail受体多肽或trail受体样多肽(例如,其中存在trail受体多肽或trail受体样多肽是可以施用所述化合物来治疗该受试者的与异常的trail受体多肽或trail受体样多肽表达或活性相关的病症的诊断依据)。
从受试者获得血液或组织样品,测定其中trail受体多肽或trail受体样多肽的水平,并与获自没有所述疾病的个体的血液样品或相同组织类型的样品中存在的水平相比较。与获自健康受试者的样品相比,在获自怀疑患有trail受体多肽或trail受体样多肽相关疾病的受试者的样品中trail受体多肽或trail受体样多肽的过高丰度(或过低丰度)是在被测试的受试者中与trail受体多肽或trail受体样多肽相关的疾病的指示。做出阳性诊断可能需要进一步的测试。
在许多疾病中,某些trail受体多肽或trail受体样多肽分子的过量表达(或减量表达)的程度是受试者是否患有可能响应于特定种类的治疗或处理的疾病的指示。因而,检测样品中trail受体多肽或trail受体样多肽的方法可以用作预后的方法,例如,来评估受试者所述治疗或处理应答的可能性。测定来自所述受试者的适合的组织或血液样品中相关的预后性多肽的水平,并与适合的对照,例如患有相同疾病但是对治疗应答良好的受试者中的水平相比较。与对照相比在样品中预后性多肽过量表达(或减量表达)的程度可以是受试者将不会良好地应答处理或治疗的可能性的预示。相对于对照的过量表达(或减量表达)越多,受试者将对治疗有应答的可能性越小。
已经知道,在多种疾病中,本文中称为“预测性多肽”的某些目标多肽的过量表达(或减量表达)的程度是受试者是否将发病的指示。因而,检测样品中trail受体多肽或trail受体样多肽的方法可以用作预测受试者是否将发生疾病的方法。测定来自处于发生疾病的风险中的受试者的适合的组织或血液样品中相关的预测性多肽的水平,并与适合的对照,例如不具有发生所述疾病的风险的受试者中的水平相比较。与对照相比在样品中预测性多肽过量表达(或减量表达)的程度可以是受试者将发生疾病的可能性的预示。相对于对照的过量表达(或减量表达)越多,受试者将发生疾病的可能性越高。
本文描述的方法可以,例如,通过使用包含至少一种探针试剂(例如本文所述的trail受体结合剂)的预包装的诊断试剂盒来进行,所述试剂盒可以方便地使用,例如在临床医疗设施中诊断表现涉及trail受体多肽或trail受体样多肽的疾病或病状的症状或家族史的受试者。此外,其中表达trail受体多肽或trail受体样多肽的任何细胞类型或组织均可以在本文描述的预后分析中加以利用。
b.trail受体结合剂的预防性和治疗性用途
1.概述
本技术的trail受体结合剂(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih,wiypgnvntkysekfkg和geagyfd和轻链cdr氨基酸序列kasqdvstava,wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)可用于预防或治疗疾病。在一些实施方式中,本技术提供了治疗患有(或易患有)病症或具有与异常的trail受体结合剂表达或活性相关的病症的受试者的预防和/或治疗方法。因此,本技术提供了用于预防和/或治疗受试者中与trail受体相关的医学病症的方法,包括向有需要的受试者施用有效量的trail受体结合剂。例如,受试者可以施用本技术的trail受体结合剂组合物以尽量替代不存在或降低的trail受体多肽(例如胰岛素)的水平,以补充不同多肽(例如抗trail受体抗体)的不存在或降低的水平,以抑制多肽的活性(例如癌基因),以激活trail受体多肽(例如结合受体)的活性,通过与游离配体(例如用于减少炎症的可溶性tnf受体)竞争来降低膜结合受体的活性,或以产生期望的反应(例如,血管生长)。
本技术的trail受体结合剂可用于预防和治疗应用于受试者中的各种疾病,包括但不限于:治疗、抑制或预防疾病,病症或状况,包括恶性疾病,病症或与该疾病或病症相关的病症,例如与增加的细胞相关的疾病存活或抑制凋亡,例如癌症(例如滤泡性淋巴瘤、p53突变的癌和激素依赖性肿瘤,包括但不限于结肠癌、心脏肿瘤、胰腺癌、黑色素瘤、视网膜母细胞瘤、成胶质细胞瘤、肺癌、肠癌、睾丸癌、胃癌、成神经细胞瘤、粘液瘤、肌瘤、淋巴瘤、内皮瘤、成骨细胞瘤、破骨细胞瘤、骨肉瘤、软骨肉瘤、腺瘤、乳腺癌、前列腺癌、卡波西肉瘤和卵巢癌);自身免疫性疾病(例如,多发性硬化症、干燥综合征、格雷夫病、桥本氏甲状腺炎、自身免疫性糖尿病、胆汁性肝硬化、贝切特氏病、克罗恩病、多发性肌炎、系统性红斑狼疮和免疫相关性肾小球肾炎、自身免疫性胃炎、自身免疫性血小板减少性紫癜和类风湿性关节炎)以及病毒感染(例如疱疹病毒,痘病毒和腺病毒);炎症;移植物抗宿主病(急性和/或慢性);急性移植排斥反应和慢性移植排斥反应。本公开的抗原结合多肽,其变体或衍生物用于抑制癌症,特别是上面或下面段落中列出的癌症的生长,进展和/或转移。
本公开的抗体或变体或其衍生物可治疗、预防、诊断和/或预后的与细胞存活增加相关的其它疾病或状况包括但不限于恶性肿瘤的进展和/或转移和相关疾病如白血病(包括急性白血病(例如急性淋巴细胞白血病,急性骨髓性白血病(包括成髓细胞、早幼粒细胞、骨髓单核细胞、单核细胞和红白血病))和慢性白血病(例如慢性骨髓性(粒细胞性)白血病和慢性淋巴细胞性白血病)),真性红细胞增多症,淋巴瘤(例如霍奇金病和非霍奇金病),多发性骨髓瘤,瓦尔登斯特伦巨球蛋白血症,重链疾病和实体瘤包括但不限于肉瘤和癌,例如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因氏肿瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、威尔姆(wilm)肿瘤、子宫颈癌、睾丸肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、声神经瘤、少突胶质细胞瘤、脑膜瘤(menangioma)、黑色素瘤、成神经细胞瘤和视网膜母细胞瘤。
本技术的trail受体结合剂可用于受试者的潜在预防和治疗应用,包括但不限于涉及骨细胞发育、分化和活化的那些;在血液循环中的细胞的疾病或病理中,例如红细胞和血小板;各种免疫病症和/或病理;肺部疾病和病症;自身免疫性疾病和炎性疾病;心血管疾病;代谢疾病;生殖疾病、肾脏疾病、糖尿病、脑外伤、癌症生长和转移;病毒感染、癌症治疗、牙周病;组织再生;急性淋巴细胞白血病;胶质瘤;神经系统疾病;神经退行性疾病;阿尔茨海默氏病;帕金森病和造血障碍。
在一些实施方式中,药物有效量的抗trail-r2抗体通过与靶细胞接触诱导细胞死亡。识别trail-r2的抗体或识别trail-r2的人源化抗体的药学有效量是给予个体后足以引起期望效果的量。施用药物有效量的trail-r2识别抗体的期望效果包括靶细胞的死亡,靶细胞生长的抑制,trail-r2的刺激和与靶细胞中的trail-r2的结合。靶细胞是表达trail-r2的细胞,例如包括异常生长细胞如人癌细胞和白血病细胞。还包括具有病理状况的细胞,其中细胞增殖异常或失调,如恶性或良性癌症的细胞。因此,在一些实施方式中,抗trail受体结合剂可用于预防或治疗癌症生长和/或转移的方法,所述方法例如但不限于在有需要的受试者中的乳腺癌、肝癌、前列腺癌、卵巢癌、肺癌、脑癌、胰腺癌和结肠直肠癌。在一个实施方式中,trail受体结合剂具有体外细胞凋亡诱导活性,其中所述结合剂可以以等于或低于10μg/ml的浓度,诱导至少30%的细胞死亡,优选至少50%、70%、90%,更优选100%细胞死亡。在一个实施方式中,trail受体结合剂具有体内细胞凋亡诱导活性,其中当用等于或小于10mg/kg体重的剂量治疗时,结合剂可以减少人类癌症异种移植物模型中至少30%的肿瘤大小,优选至少50%、70%、90%,更优选100%。
当体内用于治疗时,本技术的trail受体结合剂,例如抗trail受体抗体以有效量(即具有期望的治疗效果的量)施用给所述受试者。在一些实施方式中,施用为胃肠外。对于胃肠外施用,在一些实施方式中,trail受体结合剂将与药学上可接受的胃肠外施用载体相结合,以单位剂量可注射形式(溶液、悬浮液、乳剂)配制。这些载体本身是无毒的,非治疗性的。
剂量和给药方案将取决于trail受体相关疾病或病症的程度、使用的特定trail受体结合剂的特征,例如它的治疗指数,受试者和受试者的病史。在一些实施方式中,trail受体结合剂在1-2周的时间内连续地进行静脉内施用来治疗血管系统中的细胞,以及皮下和腹膜内施用来治疗局部的淋巴结。
使用抗trail受体igm抗体对于某些应用是优选的。然而,igg分子由于更小,比igm分子更有能力定位到某些类型的感染细胞。有证据表明,体内的补体激活产生了多种生物学效果,包括炎症性反应的诱导和巨噬细胞的活化(unanue和benecerraf,textbookofimmunology,2ndedition,williams&wilkins,p.218(1984))。伴随炎症的提高的血管舒张可以提高各种试剂定位到受感染细胞中的能力。因此,本技术指定的类型的trail受体抗体组合可以通过多种方式治疗性地使用。另外,抗原,例如纯化的trail受体多肽,其片段或类似物(hakomori,ann.rev.immunol.2:103,1984)或与这些抗原相关的抗独特型抗体(nepom等人,proc.natl.acad.sci.usa81:2864,1985;koprowski等人,proc.natl.acad.sci.usa81:216,1984)可以用于在人类受试者中诱导主动免疫应答。这样的应答包括形成能够活化人类补体的抗体,以实现期望的生物学效果,例如破坏目标细胞。
2.特征为trail受体水平升高的疾病和病症
对于以trail受体多肽水平或生物学活性提高(相对于不患有所述疾病或病症的受试者)为特征的疾病和病症,可以用拮抗(即降低或抑制)活性的基于trail受体结合剂的治疗化合物来加以治疗,所述化合物可以以治疗性或预防性的方式施用。可以利用的治疗化合物包括,但不限于:(i)前述的trail受体结合剂;和(ii)编码trail受体结合剂的核酸。
对于以trail受体多肽水平或生物学活性降低(相对于不患有所述疾病或病症的受试者)为特征的疾病和病症,可以用提高trail受体活性(即是trail受体活性激动剂)的基于trail受体结合剂的治疗化合物来加以治疗。上调活性的治疗剂可以以治疗性或预防性方式来施用。可以利用的治疗剂包括但不限于,提高生物利用率的trail受体结合剂。
提高或降低的水平可以容易地通过定量trail受体结合剂诱导的肽和/或rna来检测,定量是通过获得受试者的组织样品(例如来自活检组织)并体外分析它的rna或肽水平,表达的trail受体多肽的结构和/或活性(或前述多肽的mrna)。本领域公知的方法包括但不限于,免疫测定(例如通过western印迹分析、免疫沉淀以及随后十二烷基硫酸钠(sds)聚丙烯酰胺凝胶电泳、免疫细胞化学等等)和/或杂交测定来检测mrna的表达(例如northern测定、斑点印迹、原位杂交等等)。
3.预防方法
在一个方面,本技术提供了一种方法,通过向所述受试者施用调节trail受体多肽表达或至少一种trail受体多肽活性的trail受体结合剂(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih,wiypgnvntkysekfkg和geagyfd和轻链cdr氨基酸序列kasqdvstava,wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体),来预防受试者中与异常的trail受体表达或活性相关的疾病或状况。
处于由异常的trail受体多肽表达或活性引起或促发的疾病的风险中的受试者可以通过例如在此描述的诊断或预后分析的任何或组合来鉴定。在预防性的应用中,针对有风险发生或易感于疾病或状况(即免疫疾病)的受试者施用trail受体结合剂的药物组合物或药物,施用的量以足够消除或降低疾病风险、降低疾病严重度、或延迟疾病的发作,包括疾病的生物化学、组织学和/或行为症状,疾病的并发症,以及在疾病的发展期间呈现的中间病理表型。预防性trail受体结合剂(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih,wiypgnvntkysekfkg和geagyfd和轻链cdr氨基酸序列kasqdvstava,wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)的施用可以发生在出现异常的特征症状之前,从而预防疾病或病症,或者延迟其发展。取决于异常的类型,例如,可以用trail受体结合剂作为trail受体激动剂或trail受体拮抗剂来治疗所述受试者。合适的化合物可以根据在此描述的筛选分析来确定。
4.治疗方法
本技术的另一个方面包括以治疗为目的调节受试者中trail受体多肽表达或活性的方法。本技术的调节方法包括用本技术的trail受体结合剂(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih,wiypgnvntkysekfkg和geagyfd和轻链cdr氨基酸序列kasqdvstava,wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)接触细胞,所述试剂调节与细胞相关的trail受体多肽活性中的一种或多种活性。在治疗应用中,对怀疑患有或已经患有疾病的受试者施用组合物或药物,施用的量足够治愈、或至少部分地延滞所述疾病的症状(生物化学的、组织学的和/或行为的),包括它的并发症和疾病的发展中的中间病理表型。足够实现治疗或预防性治疗的量被定义为治疗或预防有效量。
在此描述了调节trail受体多肽活性的化合物,可以包括,例如编码trail受体结合剂或trail受体结合剂相关多肽的核酸。在一个实施方式中,trail受体结合剂刺激一种或多种trail受体多肽活性。这种刺激性化合物的实例包括trail受体结合剂和已经被导入细胞中,编码trail受体结合剂的核酸分子。在另一个实施方式中,trail受体结合剂抑制一种或多种trail受体多肽活性。这些调节方法可以在体外进行(例如通过将细胞和trail受体结合剂一起培养),或另外一种选择,在体内进行(例如通过向受试者施用所述trail受体结合剂)。因而,本技术提供一种治疗患有trail受体相关疾病或病症的个体的方法,所述疾病或病症以trail受体多肽或编码trail受体多肽的核酸分子的异常的表达或活性为特征。在一个实施方式中,所述方法包括施用trail受体结合剂(例如通过在此描述的筛选分析方法鉴定的化合物),或调节(例如上调或下调)trail受体多肽表达或活性的组合trail受体结合剂。在另一个实施方式中,所述方法包括施用trail受体结合剂或编码trail受体结合剂的核酸分子,作为补偿降低的或异常的trail受体多肽表达或活性的疗法。在trail受体多肽被异常下调的情况中,对trail受体多肽活性的刺激是期望的。
5.癌症和恶性肿瘤治疗
如上所述,本技术的trail受体结合剂(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih,wiypgnvntkysekfkg和geagyfd和轻链cdr氨基酸序列kasqdvstava,wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)在治疗和预防治疗方法的情景中是有用的。已经保藏了产生本技术抗体的小鼠-小鼠杂交瘤ctb006,并且已经分配了登录号cgmcc1691。
大多数肿瘤细胞,例如本文详述的那些细胞表达细胞表面trail-r2,并且对本技术的trail受体结合剂敏感的。在恶性肿瘤治疗的情景中,本技术的抗体(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih,wiypgnvntkysekfkg和geagyfd和轻链cdr氨基酸序列kasqdvstava,wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)能够诱导表达trail-r2的肿瘤细胞凋亡,具有很强的体内杀肿瘤活性。因此,本技术的trail受体结合剂可用于在有需要的受试者中治疗癌症。
关于癌症治疗,本技术的trail受体结合剂与化学治疗剂一起施用时显示出令人惊奇和意想不到的协同作用。也就是说,trail受体结合剂和化学治疗剂的组合导致比单独使用化合物或组合的加成效果更大的效果。作为举例而不是限制,组合的协同细胞毒性作用导致一个或多个更大的肿瘤消退,较少的肿瘤生长,减小的肿瘤体积,更强的肿瘤生长抑制和与单独施用化学治疗剂或单独使用trail受体结合剂的相比,改善的受试者健康(例如,较少的体重减轻)。另外地或作为选择地,在一些实施方式中,组合允许使用较低剂量的trail受体结合剂、化学治疗剂或两者来施用,以达到与单独的试剂相同或更好的结果。另外地或作为选择地,在一些实施方式中,trail受体结合剂,例如具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006(例如huctb006)相同的表位特异性的单克隆抗体和化学治疗剂的组合可更有效地减少或消除肿瘤或肿瘤生长(例如,在更短的时间内,更低的剂量,更少的剂量或更少的治疗),或者比单独使用任一化合物的治疗更有效地预防或减少转移。
如上所述,当本文公开的trail受体结合剂与化学治疗剂组合使用来治疗癌症时,对于杀死肿瘤细胞和/或抑制肿瘤细胞增殖,提供惊人的和意想不到的协同作用,或甚至显著的协同作用。作为举例而不是限制,在一些实施方式中,trail受体结合剂和化学治疗剂的组合疗法对肿瘤细胞的活力具有显著的协同或协同的细胞毒性作用。
另外地或作为选择地,在一些实施方式中,trail受体结合剂和化学治疗剂的组合治疗的协同作用是针对肿瘤体积和肿瘤重量。
在一些实施方式中,癌症/肿瘤是结肠癌、肺癌、肝癌、胰腺癌、乳腺癌、卵巢癌、胃癌和白血病中的一种或多种。
在一些实施方式中,与trail受体结合剂组合使用的化学治疗剂是以下中的一种或多种:长春花生物碱、破坏微管形成的试剂(例如秋水仙碱及其衍生物)、抗血管生成剂、治疗性抗体、egfr靶向剂、酪氨酸激酶靶向剂(如酪氨酸激酶抑制剂)、过渡金属络合物、蛋白酶体抑制剂、抗代谢物(如核苷类似物)、烷化剂、铂类药剂、蒽环类抗生素、拓扑异构酶抑制剂、大环内酯类、治疗性抗体、类维生素a(如全反式视黄酸或其衍生物);格尔德霉素或其衍生物(如17-aag)、阿霉素、秋水仙碱、环磷酰胺、放线菌素、博来霉素、多柔比星、多柔比星、表柔比星、丝裂霉素、甲氨蝶呤、米托蒽醌、氟尿嘧啶、卡铂、卡莫司汀(bcnu)、甲基ccnu、顺铂、依托泊苷、干扰素、喜树碱及其衍生物、苯芥胆甾醇(phenesterine)、紫杉烷及其衍生物(如紫杉醇(taxol)、紫杉醇(palitaxel)及其衍生物,泰索帝及其衍生物等等)、拓扑替康、长春花碱、长春新碱、他莫昔芬、哌泊舒凡(piposulfan)、nab-5404、nab-5800、nab-5801、伊立替康、hkp、ortataxel、吉西他滨、奥沙利铂、
鉴于令人惊奇和意想不到的协同作应,在一些实施方式中,组合疗法允许较低剂量或更少剂量的化学治疗剂,从而降低对正常细胞的毒性。在这方面,在一些实施方式中,本技术的trail受体结合剂的施用在化学疗法(例如辐射、化学治疗的联合循环)以及施用肿瘤坏死因子、干扰素或其它物质的过程中进行细胞保护或免疫调节剂的过程中进行。因此,本技术的trail受体结合剂和可用于辅助治疗的化合物可以与需要施用的受试者同时并依序或分开施用。
6.测定基于trail受体结合剂的治疗剂的生物学效应
在本技术的各种实施方式中,进行合适的体外或体内测定以确定特定的基于trail受体结合剂的治疗剂的效果,以及是否指示其施用用于治疗受试者中的受影响组织。
在各种实施方式中,体外测定可以用涉及受试者疾病的类型的代表性细胞进行,以确定给定的基于trail受体结合剂的治疗剂是否对细胞类型施加期望的效果。用于治疗的化合物可以在合适的动物模型系统中测试,包括但不限于大鼠、小鼠、鸡、牛、猴、兔等,然后在人类受试者中测试。类似地,对于体内测试,可以在施用于人类受试者之前使用本领域已知的任何动物模型系统。
7.治疗方案和有效剂量
一些组合物包括多种(例如两种或更多)本技术的trail受体结合剂的组合。在一些组合物中,组合物的每一种trail受体结合剂都是结合trail受体多肽的独特的、预先选择的表位的单克隆抗体或人类序列抗体。
对于本技术的trail受体结合剂,例如抗trail受体抗体或抗trail受体抗体-细胞毒素缀合物而言,其用于治疗本文所述的trail受体相关状况和疾病的有效剂量取决于许多不同的因素而变化,包括施用的方式、目标部位、受试者的生理状态、受试者是人类还是动物、使用的其他药物,以及治疗是预防性还是治疗性的。通常,受试者是人类,但非人哺乳动物包括转基因哺乳动物也可以被治疗。治疗剂量需要被滴定以优化安全性和效力。
一般地,本技术的组合物(compositions)的足以实现治疗或预防效果的有效量,范围为从约0.000001mg/千克体重/天到约10,000mg/千克体重/天。在一些实施方式中,剂量范围从约0.0001mg/千克体重/天到约100mg/千克体重/天。对于施用trail受体结合剂,例如抗trail受体抗体,剂量范围每周从约0.0001到100mg/kg/周,或每周约0.01到5mg/kg宿主体重。例如剂量可以是每周1mg/kg体重或10mg/kg体重,或在每周1-10mg/kg的范围内。在一些实施方式中,抗体的单个剂量的范围是0.1-10,000微克/千克体重。在一些实施方式中,载体中的抗体浓度为每个递送毫升0.2到2000微克。示范性的治疗方式需要每两周施用一次,或每月一次,或每3到6个月一次。在一些方法中,具有不同的结合特异性的两种或更多trail受体结合剂同时地施用,在这种情况下,施用的每种抗体的剂量落入所标明的范围内。trail受体结合剂,例如抗trail受体抗体通常在多种场合施用。单次施用之间的间隔可以是每周、每月或每年。间隔也可以是不规则的,通过测量受试者中抗体的血液水平来指示。在一些方法中,调节剂量来实现血浆trail受体结合剂(例如抗trail受体抗体)浓度为1-1000μg/ml,在一些方法中25-300μg/ml。另外一种选择,trail受体结合剂(例如抗trail受体抗体)可以作为持续释放配制剂施用,在这种情况下需要的施用频率较低。剂量和频率取决于受试者中trail受体结合剂的半衰期而变化。一般地,人类抗trail受体抗体显示的半衰期最长,接着是人源化抗trail受体抗体、嵌合抗trail受体抗体、和非人类抗trail受体抗体。施用的剂量和频率可以取决于治疗是预防性的还是治疗性的而变化。在预防性的应用中,用一段较长的时间以相对低频率的间隔施用相对低的剂量。一些受试者终身持续接受治疗。在治疗应用中,有时是需要相对短间隔的相对高剂量,直到疾病的发展被降低或终止,优选地,直到受试者显示疾病的症状的部分或完全改善。此后,本专利可以施用预防性的方案(thepatentcanbeadministeredaprophylacticregime)。编码trail受体免疫原的核酸的剂量范围是每位受试者从约10ng到1g、100ng到100mg、1μg到10mg或30-300μgdna。传染性病毒载体的剂量为每剂10-100或更多个病毒颗粒不等。
8.毒性
在一些实施方式中,在此描述的有效量(例如剂量)的trail受体结合剂将提供治疗益处而不产生对受试者的实质上的毒性。在此描述的trail受体结合剂的毒性可以在细胞培养或实验动物中利用标准药学程序,例如通过测定ld50(对50%的群体致死的剂量)或ld100(对100%的群体致死的剂量)来确定。毒性作用的和治疗作用之间的比例是治疗指数。利用这些细胞培养测定和动物研究获得的数据,可制定对人类使用无毒的剂量范围。在此描述的trail受体结合剂的剂量优选地处于一定范围的循环浓度内,所述浓度包括毒性很小或没有毒性的有效剂量。取决于采用的剂型和使用的施用途径,剂量可以在这个范围内变动。可以由医师个人根据受试者的状况选择确切的配方、施用途径和剂量。参见,例如fingl等人,in:thepharmacologicalbasisoftherapeutics,ch.1(1975)。
9.试剂盒
本技术的范围还涵盖包含trail受体结合剂组合物(例如,具有与cgmcc登录号1691的小鼠-小鼠杂交瘤ctb006相同的表位特异性的单克隆抗体;具有重链cdr氨基酸序列syfih,wiypgnvntkysekfkg和geagyfd和轻链cdr氨基酸序列kasqdvstava,wastrht和qqhyrtpw;具有如seqidno:16所示的重链氨基酸序列和如seqidno:14所示的轻链氨基酸序列;huctb006抗体)和使用说明书的试剂盒。所述试剂盒可用于检测生物样品中trail受体多肽或trail受体样多肽的存在。例如所述试剂盒可包含:能够结合生物样品中trail受体多肽或trail受体样多肽的、经标记的trail受体结合剂;用于测定样品中trail受体多肽或trail受体样多肽的量的手段;以及用于将trail受体多肽或trail受体样多肽的量与标准品比较的手段。试剂盒成分(例如试剂)可以包装在适合的容器中。所述试剂盒可以进一步包括使用该试剂盒检测trail受体多肽或trail受体样多肽的说明。
在一个实施方式中,本技术的组合物试剂盒(compositionkit)包含本技术的trail受体结合剂与疾病抑制化合物的组合,其中所述化合物是抗肿瘤药物,例如放射性同位素、化学治疗剂、治疗性抗体或细胞因子。在一些实施方式中,疾病抑制化合物是化学治疗剂。在一些实施方式中,化学治疗剂是紫杉醇(taxol)或5-氟尿嘧啶(5-fluorouracil)。
提供以下实施例以更充分地说明本技术的优选的实施方式。这些实施例决不应看作是限制本技术的范围,本技术的范围由附随的权利要求确定。
实施例
实施例1huctb006的结合特异性和亲和性的表征
1.1结合特异性
通过化学发光酶免疫分析(chemiluminescentenzymeimmunoassay,cleia)评估了huctb006的结合特异性。dr4-his–ec(批号:090222-p,0.72mg/ml,大肠杆菌)、dcr1-his(重组人trailr3/tnfrsf10c,novoproteinscience,批号:0328670)、dcr2-his(重组人trailr4/tnfrsf10d,sinobiological,批号lc06ju1502)和opg-his(重组人骨保护素(recombinanthumanosteroprotegerin)/tnfrsf11b,wuxipharmatechco.ltd,批号:20120717)被涂布在微板上,然后其被封闭(blocked)。
huctb006被稀释至200、40和8ng/ml,然后加入孔中。在37下孵育1小时后,洗涤板。用hrp标记的二级抗体和底物溶液检测huctb006与固定化抗原的结合。结果显示,如图1所示,没有mctb006或huctb006与这些被涂布的抗原的交叉反应,表明huctb006具有良好的结合特异性。
1.2亲和性
通过表面等离子体共振(surfaceplasmonresonance,spr)测定了huctb006对dr5的结合亲和力。在spr测定中,使用标准胺偶联,huctb006被固定在cm5biacore传感器芯片上。非交联蛋白质被去除,并用乙醇胺封闭未反应的位点。纯化的重组人dr5-rfc蛋白的系列浓度连续流过传感器表面。在每次测定之间,传感器表面用10mm甘氨酸-hcl(ph2.5)重新制备。通过表面上的折射率的变化来检测hdr5-rfc与活化表面的结合,记录为ru(即共振单位(resonanceunits))。曲线由ru轨迹生成,并通过拟合算法进行评估,如图2所示,将原始数据与明确的结合模型进行比较(biaevalutiontm2.0软件)。
实施例2huctb006治疗的体外有效性
2.1huctb006在人正常组织细胞系中的细胞毒性
几种人正常组织细胞系,包括人肺上皮成纤维细胞wi-38、人胚胎肺成纤维细胞hfl-1、人脐静脉上皮细胞huv-ec-c和人肝分化细胞,其来自肝脏诱导细胞(获取自北大第三医院)。细胞在37℃和5%co2以及含有10%fbs的培养基中培养。wi-38的培养基为mem,hfl-1和huv-ec-c的培养基为f-12k。细胞用奥沙利铂处理24小时,然后不同浓度的ctb006被加入合用组。结果在处理后24小时测定,如图3和图4所示。被检查的人正常组织细胞对ctb006不敏感,表明huctb006对人正常组织细胞没有细胞毒性。
2.2ctb006在人肿瘤细胞系中的细胞毒性
用62.5、125、250、500或1000ng/mlhuctb006或不同浓度的化疗药物处理18个人类肿瘤细胞系,其作为阳性对照。细胞在37℃和5%co2以及含有10%fbs的培养基中培养。sk-hep-1、hepg2、hct116、sw480、widr(1×neaa)、mia-paca-2(2.5%马血清)mda-mb-231(1mmnapyr,1xmem-neaa,1xmemvitamin)的培养基是dmem。colo205、bxpc3(2mm谷氨酰胺,10mmhepes)、panc2.03(15fbs,1mmnapyr、1xmem-neaa,10mm人胰岛素,10mmhepes)、h2122、ovcar3(1mmnapyr,10μg/ml人胰岛素,10mmhepes,2.5g/l葡萄糖)、molt-4(hepes,2.5g/l葡萄糖(glucose))、jurkat(hepes,2.5g/l葡萄糖(glucose))的培养基是rpmi-1640,sk-mes-1的培养基是eagle'smem,2-lmp和dy36t2的培养基是imem,sum102(5μg/ml胰岛素)的培养基是f-12k。细胞存活率通过atplite测定试剂盒测定。如果ic50值低于62.5ng/ml,则在第二轮实验中用更高浓度的ctb006处理细胞以确定ic50值。
结果表明,huctb006对这18个人类肿瘤细胞系有抗肿瘤活性,包括肝癌细胞系(如图5所示,sk-hep-1和hepg2),结肠直肠癌细胞系(如图6和图7所示,colo205、hct116、sw480和widr),胰腺癌细胞系(如图8所示,mia-paca-2、bxpc3和panc2.03)肺癌细胞系(如图9所示h2122和sk-mes-1),乳腺癌细胞系(如图10和11所示,mda-mb-231、2-lmp、dy36t2和sum102),卵巢癌细胞系(如图12所示ovcar3)和急性t淋巴细胞白血病细胞系(如图13所示,molt-4和jurkat)。
各种肿瘤细胞系对ctb006显示出不同的敏感性,其中一些比其他细胞更敏感,如colo205,bxpc3,jurkat和mda-mb-231。对huctb006具有更高的敏感性的细胞系如表1所示,ic50值几乎接近10ng/ml,表明huctb006对各种人类肿瘤细胞系具有有效和广谱的抗肿瘤活性。
表1.huctb006对人肿瘤细胞系的ic50值
实施例3.huctb006和化疗药物组合对人肿瘤细胞系的细胞毒性作用
药物相互作用系数(即cdi,coefficientofdruginteraction)被用来分析huctb006和化疗药物组合的协同作用(caoss等人,potentiationofantimetaboliteantitumoractivityinvivobydipyridamoleandamphotericinb.cancerchemotherpharmacol1989;24:181-186)。cdi计算如下:cdi=ab/a×b。根据各组化学发光,ab是合用组(combinationgroups)与对照组的比(ratio);a或b是单一药剂组(singleagentgroup)与对照组的比。cdi值小于、等于或大于1表示药物组合分别是协同的,加和的或拮抗的。cdi小于0.7表明药物组合是显著协同的。
3.1huctb006和5-fu组合对胃癌细胞系bgc823的细胞毒性作用
胃癌细胞系bgc823作为礼物获赠。细胞在37℃,5%co2和含有10%fbs的dmem培养基中培养。用不同浓度的ctb006和125μm5-fu处理了细胞,如下表2所示。如表2所示,cdi值均小于0.7,表明huctb006和125μm5-fu对bgc823细胞系的细胞毒性作用是显著协同的,如图14所示。细胞用5-fu处理24小时,然后将不同浓度的huctb006加入到合用组(combinedgroup)中,并在处理后24小时测定结果。
表2.ctb006和5-fu组合对于bgc823的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
3.2huctb006和5-fu组合对胰腺癌细胞系panc2.03的细胞毒性作用
用不同浓度的huctb006和62.5μm5-fu处理了胰腺癌细胞系panc2.03细胞,cdi值均小于1,表明huctb006和62.5μm5-fu的细胞毒性作用对panc2.03细胞系有协同作用。此外,当ctb006的浓度高于125ng/ml时,huctb006和62.5μm5-fu对panc2.03细胞系的细胞毒性作用是显著协同的,如图15所示。在37℃和5%co2以及含有15%fbs、1mmnapyr、1xmem-neaa、10mm人胰岛素和10mmhepes的rpmi1640培养基中培养panc2.03。细胞用5-fu处理24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表3.ctb006和5-fu组合对于panc2.03的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
3.3huctb006和紫杉醇(paclitaxel)组合对肺癌细胞系的细胞毒性作用
3.3.1a549细胞系
用不同浓度的huctb006和20μg/ml紫杉醇(paclitaxel)处理了肺癌细胞系a549细胞,cdi值均小于1,如表4所示,表明huctb006和20μg/ml紫杉醇对a549细胞系的细胞毒性作用是协同的。此外,当ctb006的浓度高于250ng/ml时,huctb006和20μg/ml紫杉醇对a549细胞系的细胞毒性作用是显著协同的,如图16所示。在37℃和5%co2以及含有10%fbs的rpmi1640培养基中培养细胞。细胞用紫杉醇处理24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表4.ctb006和紫杉醇组合对于a549的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
3.3.2h460细胞系
用不同浓度的huctb006和5μg/ml紫杉醇(paclitaxel)组合处理了肺癌细胞系h460细胞。cdi值均小于1,如表5所示,表明huctb006和5μg/ml紫杉醇组合对h460细胞的细胞毒性作用具有协同作用。此外,当huctb006的浓度高于50ng/ml时,huctb006和5μg/ml紫杉醇组合对h460细胞的细胞毒性作用是显著协同的,如图17所示。在37℃和5%co2以及含有10%fbs的rpmi1640培养基中培养细胞。细胞用紫杉醇处理24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表5.ctb006和紫杉醇组合对于a549的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
3.4huctb006和化疗药物组合对肝癌细胞系的细胞毒性作用
3.4.1huh-7细胞系
用不同浓度的huctb006和20μm5-fu的组合处理了肝癌细胞系huh-7细胞。cdi值均小于1,如表6所示,表明huctb006和20μm5-fu组合对huh-7细胞的细胞毒性作用是协同的。此外,当huctb006浓度为1000ng/ml时,huctb006和20μm5-fu组合对huh-7细胞的细胞毒性作用是显著协同的,如图18所示。在37℃,5%co2和含有10%fbs和2mm谷氨酰胺的dmem培养基中培养细胞。细胞用5-fu处理24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表6.huctb006和5-fu组合对于huh-7的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
3.4.27402细胞系
用不同浓度的huctb006和40μm吉西他滨(gemcitabine)组合处理了肝癌细胞系7402细胞,如表7所示,cdi值均小于1,表明huctb006和40μm吉西他滨组合对7402的细胞毒性作用是协同的。此外,当huctb006的浓度为500ng/ml时,huctb006和40μm吉西他滨组合对7402细胞的细胞毒性作用是显著协同的,如图19所示。在37℃和5%co2以及含有10%fbs的dmem培养基中培养细胞。细胞用吉西他滨处理24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表7.huctb006和吉西他滨组合对于7402的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
实施例4.huctb006和靶向药物组合对人肿瘤细胞系的细胞毒性作用
4.1huctb006和靶向药物组合对结肠直肠癌细胞系的细胞毒性作用
4.1.1sw480细胞系
用不同浓度的huctb006和10μm或5μm靶向药物的组合处理了结肠直肠癌细胞系sw480细胞。靶向药物包括索拉非尼(sorafenib)、拉帕替尼(lapatinib)和厄洛替尼(erlotinib)。cdi值显示在表8中。当用不同浓度的huctb006和10μm厄洛替尼或5μm厄洛替尼或5μm拉帕替尼的组合处理sw480细胞时,cdi值小于0.7,表明huctb006和10μm厄洛替尼的组合、ctb006和5μm厄洛替尼的组合,或huctb006和5μm拉帕替尼的组合,对sw480细胞的细胞毒性作用是显著协同的,如图20所示。此外,huctb006和10μm拉帕替尼对sw480细胞的细胞毒性作用在huctb006的浓度为62.5ng/ml时具有显著的协同作用。另外,62.5ng/mlhuctb006和10μm索拉非尼的组合、62.5ng/mlhuctb006和5μm索拉非尼的组合以及125ng/mlhuctb006和5μm索拉非尼组合对sw480细胞的细胞毒性作用均具有协同作用,因为cdi值小于1。在37℃和5%co2以及含有10%fbs的dmem培养基中培养细胞。细胞用索拉非尼、拉帕替尼或厄洛替尼处理24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表8.huctb006和靶向药物组合对于sw480的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
4.1.2widr细胞系
用不同浓度的huctb006和靶向药物(包括索拉非尼、拉帕替尼、厄洛替尼、爱必妥和赫赛汀)的组合处理了结肠直肠癌细胞系widr细胞。cdi值显示在表9中。当使用不同浓度的huctb006和10μm索拉非尼或5μm厄洛替尼的组合处理widr细胞时,cdi值小于0.7,表明huctb006和10μm索拉非尼的组合或huctb006和5μm厄洛替尼的组合对widr细胞的细胞毒性是显著协同的,如图21所示。此外,当huctb006的浓度为1000ng/ml时,huctb006和5μm索拉非尼的组合或huctb006和5μm拉帕替尼的组合对widr细胞的细胞毒性作用是协同的。另外,250ng/ml,125ng/ml和62.5ng/mlhuctb006和10μm拉帕替尼或10μm厄洛替尼组合对widr细胞的细胞毒性作用是协同作用的,因为cdi值小于1。huctb006和爱必妥或ctb006和赫赛汀组合对widr细胞的细胞毒性作用都是拮抗的,因为cdi值均高于1。在37℃和5%co2以及含有10%的fbs和1×neaa的dmem培养基中培养细胞。细胞用索拉非尼、拉帕替尼、厄洛替尼、爱必妥或赫赛汀处理了24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表9.huctb006和靶向药物组合对于widr的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
4.2huctb006和靶向药物组合对胃癌细胞系的细胞毒性作用
4.2.1bgc823细胞系
用不同浓度的huctb006和靶向药物(包括索拉非尼、拉帕替尼、厄洛替尼和爱必妥)组合处理了胃癌细胞系bgc823细胞。cdi值显示在表10中。当用不同浓度的huctb006和索拉非尼或厄洛替尼组合处理bgc823细胞时,cdi值小于0.7,表明huctb006和索拉非尼或厄洛替尼组合对bgc823细胞的细胞毒性作用是显著协同的,如图22所示。此外,除了125ng/mlctb006和10μm拉帕替尼的组合外,huctb006和10μm拉帕替尼对bgc823细胞的细胞毒性作用是协同的。另外,huctb006和爱必妥的组合对bgc823细胞的细胞毒性作用全部是拮抗的,因为cdi值高于1。在37℃和5%co2以及含有10%的fbs的dmem培养基中培养细胞。细胞用索拉非尼、拉帕替尼、厄洛替尼或爱必妥处理了24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表10.huctb006和靶向药物组合对于bgc823的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
4.2.2nugc3细胞系
用不同浓度的huctb006和靶向药物(包括索拉非尼、拉帕替尼、厄洛替尼和爱必妥)组合处理了胃癌细胞系nugc3细胞。cdi值显示在表11中。当用不同浓度的huctb006和10μm索拉非尼组合处理nugc3细胞时,cdi值小于1,表明huctb006和索拉非尼组合对nugc3细胞的细胞毒性作用是协同的或显著协同的,如图23所示。另外,huctb006和其它靶向药物的组合对nugc3细胞的细胞毒性作用全部是拮抗的,因为cdi值高于1。在37℃和5%co2以及含有10%的fbs的dmem培养基中培养细胞。细胞用索拉非尼、拉帕替尼、厄洛替尼或爱必妥处理了24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表11.huctb006和靶向药物组合对于nugc3的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
4.3h460细胞系
用不同浓度的huctb006和靶向药物(包括索拉非尼、拉帕替尼和厄洛替尼)组合处理了肺癌细胞系h460细胞,cdi值显示在表12中。当用huctb006和索拉非尼或huctb006和厄洛替尼组合处理h460细胞时,cdi值均小于0.7,表明ctb006和索拉非尼或厄洛替尼组合对h460细胞的细胞毒性作用是显著协同的,如图24所示。此外,当huctb006浓度为1000ng/ml时,huctb006和10μm拉帕替尼对h460细胞的细胞毒性作用是协同的,甚至是显著协同的。在37℃和5%co2以及含有10%的fbs的rpmi1640培养基中培养细胞。细胞用索拉非尼、拉帕替尼或厄洛替尼处理了24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表12.huctb006和靶向药物组合对于h460的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
4.4huctb006和靶向药物组合对乳腺癌细胞系的细胞毒性作用
4.4.1sk-br3细胞系
用不同浓度的huctb006和10μm或5μm靶向药物(包括索拉非尼、拉帕替尼和厄洛替尼)的组合处理了乳腺癌细胞系sk-br3细胞。cdi值显示在表13中。当sk-br3细胞用不同浓度的huctb006和10μm索拉非尼组合处理时,cdi值小于0.7,当sk-br3细胞用不同浓度的huctb006和5μm索拉非尼组合处理时,cdi值小于1,表明huctb006和10μm或5μm索拉非尼组合对sk-br3细胞的细胞毒性作用是显著协同的,如图25所示。此外,当huctb006的浓度为1000、250和62.5ng/ml时,huctb006和10μm厄洛替尼组合对sk-br3细胞的细胞毒性作用是协同的。huctb006和拉帕替尼组合对sk-br3细胞的细胞毒性作用是拮抗的,因为cdi值高于1。在37℃和5%的co2,以及含有10%fbs的mccoy’s5a培养基中培养细胞。细胞用索拉非尼、拉帕替尼或厄洛替尼处理了24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表13.huctb006和靶向药物组合对于sk-br3的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
4.4.2sum102细胞系
用不同浓度的huctb006和10μm或5μm靶向药物(包括索拉非尼、拉帕替尼和厄洛替尼)的组合处理了乳腺癌细胞系sum102细胞。cdi值显示在表14中。当sum102细胞用不同浓度的huctb006和拉帕替尼或厄洛替尼组合处理时,cdi值均大于1,表明huctb006和拉帕替尼或huctb006和厄洛替尼组合对sum102细胞的细胞毒性作用是拮抗的,如图26所示。huctb006和索拉非尼组合对sum102细胞的细胞毒性作用除了250ng/mlhuctb006和10μm索拉非尼的组合以及125ng/mlhuctb006和5μm索拉非尼的组合外,其它都是拮抗的。细胞在37℃,5%co2和含有10%fbs和5μg/ml胰岛素的f-12k培养基中培养。细胞用索拉非尼、拉帕替尼或厄洛替尼处理了24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表14.huctb006和靶向药物组合对于sum102的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
4.4.3dy36t2细胞系
用不同浓度的huctb006和10μm或5μm靶向药物(包括索拉非尼、拉帕替尼和厄洛替尼)的组合处理了乳腺癌细胞系dy36t2细胞。cdi值如表15所示。当用不同浓度的huctb006和10μm索拉非尼的组合处理dy36t2时,cdi值远高于1,表明huctb006和10μm索拉非尼组合对dy36t2细胞的细胞毒性作用显著拮抗,如图27所示。当huctb006的浓度为1000、125和62.5ng/ml时,huctb006和5μm索拉非尼组合对dy36t2细胞的细胞毒性作用是协同的。huctb006和拉帕替尼组合对dy36t2细胞的细胞毒性作用除了125ng/mlhuctb006和5μm拉帕替尼的组合外,是拮抗的。此外,当用不同浓度的huctb006和厄洛替尼组合处理dy36t2时,大多数cdi值小于1,表明huctb006和厄洛替尼组合对dy36t2细胞的细胞毒性作用是协同的。细胞在37℃和5%co2以及含有10%fbs的imem培养基中培养细胞。细胞用索拉非尼、拉帕替尼或厄洛替尼处理了24小时,然后将不同浓度的huctb006加入到合用组中,并在处理后24小时测定结果。
表15.huctb006和靶向药物组合对于dy36t2的cdi
*协同作用(cdi<1);**显著协同作用(cdi<0.7)。
实施例5、体内功效-人肿瘤细胞
在裸小鼠的皮下模型中使用四种人肿瘤细胞系(即两个结肠癌、一个肺癌和一个胰腺癌)测验huctb006的有效性。结果表明,即使在低剂量或微剂量下,huctb006抑制了结肠癌细胞、肺癌细胞和胰腺癌细胞的肿瘤生长,与此同时,huctb006单独治疗也显示出与化疗药物相同的治疗效果。结果是可重复的。
5.1huctb006在人类肿瘤细胞皮下模型中的疗效
5.1.1药物
huctb006(批号h61042f-p01)获自北京同为时代生物科技有限公司(beijingcotimesbiotechco.,ltd.);伊立替康和吉西他滨均获自江苏恒瑞医药有限公司(jiangsuhengruimedicineco.,ltd.);紫杉醇得自北京联合制药厂(beijingunionpharmaceuticalfactory)。首先将药物粉末溶解在ns中以达到5mg/ml的浓度,然后通过0.2μm过滤膜(pall,
5.1.2细胞和培养
h2122、colo205和mia-paca-2细胞系购自atcc。细胞在37℃,5%co2的培养箱中培养。h2122和colo205细胞在1640培养基中培养;mia-paca-2细胞在dmem中培养;以及widr细胞在imem中培养。所有培养基含有10%fcs。
5.1.3动物
动物是从军事医学院实验动物中心(动物证书号:scxk-(军)2007-004)或维通利华实验室(vitalriverlaboratories,动物证书号:scxk(京)2006-0009)购买的四(4)至六(6)周龄裸鼠。
5.1.4仪器
ivc购自苏州丰石实验动物设备有限公司(suzhoufengshilaboratoryanimalequipmentco.,ltd.);游标卡尺购自北京亚中博科有限公司(beijingyazhongbokeco.ltd.);电子天平为
5.1.5动物实验
肿瘤细胞(即mia-paca-2、widr、h2122、colo205)以每只小鼠5×106个细胞被接种在裸鼠的侧腹中。当肿瘤的平均体积达到约
表16.动物实验的剂量计划
ns(即普通盐水,normalsaline),ctb006和伊立替康静脉内给药(即i.v.intravenously);紫杉醇和吉西他滨腹膜内给药(即i.p.intraperitoneally)。
每周测量两次小鼠的体重和长轴/短轴,使用以下公式计算肿瘤体积:肿瘤体积=1/2×长轴×短轴。使用以下公式计算肿瘤生长抑制(tgi,tumorgrowthinhibition):tgi(%)=(1-t/c)×100。“t”表示实验组的平均肿瘤体积(cm3),“c”表示对照组的平均肿瘤体积(cm3)。动物随时处于监测之中。每周测量两次小鼠的体重和长/短轴。当实验结束后,处死小鼠,提取肿瘤并称重。
5.1.6统计方法
肿瘤体积以平均值±标准误差表示。使用spss16.0,one-wayanova,lsd(均匀性方差(homogeneityofvariance))或dunnettt3(方差的非均匀性(non-homogeneityofvariance))进行数据分析。数据变换使用log,置信区间为95%。p<0.05表示显著差异。
5.2huctb006对人胰腺癌肿瘤细胞mia-paca-2皮下模型的治疗作用
如图28所示,huctb006对mia-paca-2皮下模型的肿瘤生长有影响。在34天治疗期间,测量和计算了肿瘤体积。与对照组相比,所有实验组的肿瘤体积格外显著地降低,如表17所示。当使用四个huctb006剂量组(即10mg/kg、1mg/kg、0.6mg/kg和0.2mg/kg)和吉西他滨组(即60mg/kg)的肿瘤体积计算时,肿瘤生长抑制(tgi)分别为77.49%、73.86%、62.38%、47.58%和52.60%;使用肿瘤重量计算,tgi分别为89.71%、80.32%、71.09%、58.15%和55.66%。基于肿瘤体积或肿瘤重量的tgi显示出huctb006治疗的剂量依赖性反应。huctb006剂量越高,肿瘤生长抑制越多。出乎意料和令人惊讶的是,huctb006组的一些动物显示肿瘤消退,其在化疗组(例如吉西他滨)中未发现。
表17.huctb006对mia-paca-2皮下模型肿瘤生长的作用
表中的显著性(即*p<0.05)是通过比较治疗组与对照组来确定的。在治疗组中,较多个数的*表示更显著的差异(1肿瘤体积显著变化的时间由第一次治疗后的第几天来表示;2第一次治疗后第7天肿瘤体积明显减小;从第13天起,与对照组相比无显著差异;3huctb0061mg/kg组、huctb0060.2mg/kg组和吉西他滨组之间无显著差异;4huctb0060.6mg/kg组、huctb0060.2mg/kg组和吉西他滨组之间无显著差异;5huctb0060.2mg/kg组和huctb00610mg/kg组之间有显著差异,但是与其他组比较无显著差异)
在重复实验中,结果相似。根据四个huctb006剂量组和吉西他滨组的肿瘤体积计算,tgi分别为58.99%、87.52%、85.35%、59.52%和34.33%。根据肿瘤重量计算,tgi分别为71.93%、92.02%、91.39%、72.38%和31.30%。基于肿瘤体积或重量的tgi显示出huctb006治疗的剂量依赖性反应。出乎意料和令人惊讶的是,huctb006组的一些动物显示肿瘤消退,其在化疗组(例如吉西他滨)中未发现。
如图29所示,对照组和huctb006治疗组的体重随时间缓慢增加,说明huctb006的毒性低。相比之下,吉西他滨治疗组的小鼠体重在第三次给药后显著下降,戒断一次后恢复。此后,体重维持在可接受的水平。结果在重复实验中相似。
5.3huctb006在人结肠癌肿瘤细胞colo205皮下模型中的疗效
如图30所示,huctb006治疗对人结肠癌肿瘤细胞系colo25有影响。结果是由治疗后第28天的肿瘤体积计算的。如表18所示,除了huctb0060.2mg/kg组,所有实验组的肿瘤体积与对照组相比显著降低。当使用四种不同剂量的ctb006治疗组和伊立替康组的肿瘤体积计算时,tgi分别为85.24%、80.07%、84.78%、35.62%和89.81%;使用肿瘤重量计算,tgi分别为88.15%、81.78%、84.07%、33.30%和91.54%;显示了huctb006治疗的剂量依赖性反应。在本实验中,出人意料和令人惊讶的是,huctb006治疗组的四只动物显示肿瘤消退,而在伊立替康组中没有发现。
表18.huctb006治疗对colo205皮下模型肿瘤生长的作用
表中的显著性(即*p<0.05)是通过比较治疗组与对照组来确定的(1第一次治疗后的天数。2第7天与第10天之间肿瘤体积明显减小,其后与对照组相比无显著差异。3第一次治疗后第3天肿瘤体积明显增加,但第7天与第10天之间无明显差异;自17天起,肿瘤体积显著地减小,第28天无显著差异)。
在重复实验中,获得了相似的结果。使用四种huctb006给药治疗组和伊立替康组的肿瘤体积计算的tgi分别为87.12%、93.65%、79.75%、56.16%和91.64%;使用肿瘤重量计算的tgi分别为89.90%、94.33%、82.34%、58.68%和93.76%;显示了huctb006治疗的剂量依赖性反应。在实验中,没有在任何组中观察到肿瘤消退。
如图31所示,自第10天起,对照组的体重缓慢下降,但所有huctb006治疗组均未发生明显变化。对照组体重下降可能与肿瘤快速增长有关。结果在重复实验中相似。
5.3ctb006在人类结肠癌肿瘤细胞widr皮下模型中的治疗效果
如图32所示,huctb006治疗对皮下模型中widr细胞的肿瘤生长有影响。治疗后第27天用肿瘤体积计算结果。如表19所示,与对照组的肿瘤体积相比,除了huctb0060.07mg/kg组外,所有实验组的肿瘤体积显著降低。四种huctb006剂量组和伊立替康组的肿瘤生长抑制(tgi)使用肿瘤体积计算分别为57.34%,49.42%,18.71%,6.61%和81.34%;使用肿瘤重量计算,tgi分别为63.81%,53.48%,21.13%,11.99%和82.33%;显示ctb006治疗的剂量依赖性反应。
在重复实验中,获得了类似的结果。用四组不同剂量的huctb006组和伊立替康组的肿瘤体积计算,tgi分别为53.77%,53.73%,54.98%,36.21%和71.13%。当使用肿瘤重量计算时,tgi分别为53.75%,49.85%,57.56%,39.94%和72.30%;显示ctb006治疗的剂量依赖性反应,如表19所示。
表19.huctb006治疗对widr皮下模型肿瘤的作用
表中的显著性(即*p<0.05)是通过比较治疗组与对照组来确定的。如字母数相同,则无显著差异(1huctb0060.22mg/kg组与huctb0060.07mg/kg组无显著差异,p=0.224)。
如图33所示,在实验中,所有组的体重没有显示任何显著的变化。结果在重复实验中相似。
5.4huctb006在人类肺癌肿瘤细胞h2122皮下模型中的疗效
如图34所示,huctb006治疗对皮下模型中h2122细胞的肿瘤生长有影响。结果在处理后第38天使用肿瘤体积算得。与对照组的肿瘤体积相比,除huctb0060.2mg/kg组和ctb0060.6mg/kg组外,所有实验组肿瘤体积均明显减小,如表20所示。使用肿瘤体积计算,四个不同剂量的huctb006组和紫杉醇组肿瘤生长抑制(tgi)分别为91.23%、92.08%、51.06%、11.56%和48.38%;使用肿瘤重量计算的tgi分别为8.62%、92.48%、45.66%、6.45%和47.18%,显示了huctb006治疗的剂量依赖性反应。在本实验中,出乎意料和令人惊讶的是,huctb006治疗组的一些动物显示肿瘤消退,而化疗紫杉醇组则没有观察到。
在重复实验中,获得了类似的结果。四组不同剂量的huctb006组和紫杉醇组肿瘤生长抑制率(tgi)使用肿瘤体积计算,分别为91.69%、60.12%、67.66%、35.26%、54.28%;使用肿瘤重量计算,tgi分别为92.25%、64.21%、65.94%、32.46%和50.44%;显示了huctb006治疗的剂量依赖性反应。在本实验中,出乎意料和令人惊讶的是,ctb006治疗组的一些动物显示肿瘤消退,而化疗紫杉醇组则没有观察到。
表20.huctb006治疗对h2122皮下模型肿瘤的作用
表中的显著性(即*p<0.05)是通过比较治疗组与对照组来确定的。如字母数相同,则无显著差异(1huctb0065.4mg/kg组与huctb0060.6mg/kg组比较无明显差异;huctb0065.4mg/kg组与紫杉醇组比较无明显差异。2huctb0061.8mg/kg组与紫杉醇组比较有明显差异。3huctb0060.6mg/kg组与其他组比较无明显差异。4huctb0061.8mg/kg组与huctb0060.6mg/kg组比较无明显差异。5huctb0060.2mg/kg组与紫杉醇组比较有明显差异)。
如图35所示,紫杉醇组、huctb0060.2mg/kg组和对照组体重均有降低,但维持在可接受水平。结果在重复实验中相似。
实施例6.体内功效-人体肿瘤组织
在裸鼠皮下模型中测验了huctb006治疗对于五种人肿瘤组织的有效性,结果显示ctb006治疗与化疗药物联合使用具有协同作用或叠加作用,ctb006治疗效果优于单用化疗药物。
6.1huctb006在患者原发性肿瘤组织皮下模型中的治疗效果
6.1.1药物
huctb006获自北京同为时代生物科技有限公司(beijingcotimesbiotechco.,ltd.)/深圳市龙瑞药业有限公司(shenzhenlonnryonnpharmaceuticalco.,ltd.);紫杉醇(taxel)得自北京sl药业有限公司(beijingslpharmaceuticalco.,ltd.)/北京联合制药厂(beijingunionpharmaceuticalfactory);卡铂(carboplatin)从齐鲁药业有限公司获得(qilupharmaceuticalco.,ltd.);inf-α-2b得自schering-plough(brinny)co.,ltd.;伊立替康获自江苏恒瑞医药有限公司(jiangsuhengruimedicineco.,ltd.)
6.1.2组织
结肠癌组织cs146获自中国医学科学院附属肿瘤医院;结肠癌组织cs182和cs263以及肺癌组织cs113和cs225均获自朝阳医院。
6.1.3动物
动物是从军事医学院实验动物中心(动物证书号:scxk-(军)2007-004)或维通利华实验室(vitalriverlaboratories,动物证书号:scxk(京)2006-0009)购买的四(4)至六(6)周龄裸鼠。购自北京hfk生物科学有限公司(beijinghfkbioscienceco.ltd.,动物证书号:scxk(京)2009-0004)或维通利华实验室(动物证书号:scxk(京)2012-0001)的nod/scid小鼠在四(4)至五(5)周龄时进行植入。
6.1.4仪器
动物实验相关仪器与5.1.4相同。此外,脱水器(tissue-tek,viptm5jr)和嵌入机(tectm)购自日本樱花(japansakura);削片机(leica)购自leicamicrosystemslimited;石蜡膨化机和烘焙机购自天津天力航空机电有限公司(tianjintianliaviationelectro-mechanicalco.ltd.)。电热恒温干燥箱购自上海益恒科技有限公司(shanghaiyihengtechnologyco.ltd.);显微镜购自olypus(日本)。
6.1.5动物实验
将来自患者的新鲜原发肿瘤组织植入nod/scid小鼠的侧腹中,其随后发育成原发性肿瘤,然后转移到裸鼠的侧腹部,使肿瘤达到指数生长期,肿瘤命名为1#肿瘤等等。当肿瘤体积和数量达到通过要求时,将其植入裸鼠的右侧。当肿瘤的平均体积达到
表21.动物实验剂量表(huctb006在本表中以ctb006表示)
huctb006和伊立替康静脉内给药,5-fu、紫杉醇、卡铂和顺铂腹膜内给药。当两种药物一起给药时,化疗药物在抗体治疗前超过4小时给药。
每周测量两次小鼠的体重和长轴/短轴,肿瘤生长抑制(tgi)和肿瘤体积的计算如5.1.5。另外,为了评估药物组合对肿瘤生长的协同作用,金正均(jinzhengjun)q值判断方法采用下式:q=ea+b/(ea+eb-ea×eb)。ea+b是药物组合的抑制率,ea和eb是单独给药时药物治疗的抑制率。q<0.85表示拮抗剂作用,0.85≤q<1.15表示加和作用,q≥1.15表示协同作用。监测动物,当实验结束时,处死小鼠,提取肿瘤并称重。所有动物实验遵循动物福利规定和实验动物使用的管理。
6.1.6统计方法
肿瘤体积以平均值±标准误差表示。使用spss16.0,one-wayanova,lsd(均匀性方差)或dunnettt3(方差的非均匀性)进行数据分析。数据变换使用log,置信区间为95%。p<0.05表示差异显著。
6.2huctb006和5-fu的组合在患者原发肿瘤组织(结肠癌,cs146,2#)皮下模型的治疗作用
如图36所示,huctb006和5-fu的组合对皮下模型中患者原发肿瘤组织(结肠癌,cs146,2#)的肿瘤有作用。huctb006没有,但5-fu有对皮下模型中cs146的生长的抑制作用。结果用治疗后第30天的肿瘤体积计算,tgi为37.95%。ctb006和5-fu的组合在皮下模型中对cs146(结肠癌)的生长具有显著的抑制作用。结果用治疗后第30天的肿瘤重量计算,tgi为58.18%。使用金正均q值判断法计算药物组合的协同作用,q=1.32,显示huctb006和5-fu的组合治疗意外和惊人的协同作用。
6.3huctb006和伊立替康的组合在患者原发肿瘤组织(结肠癌,cs182,5#)皮下模型中的治疗效果
如图37和表22所示,huctb006和伊立替康的组合对皮下模型中来源于患者原发肿瘤组织(结肠癌,cs182,5#)的肿瘤有效果。使用治疗后第27天的肿瘤体积计算结果。与对照组肿瘤体积相比,伊立替康组和huctb006+伊立替康组肿瘤体积显著减小,huctb006、伊立替康、ctb006+伊立替康组肿瘤生长抑制率(tgi)分别为-21.15%、90.36%和95.00%。使用金正均q值判断方法计算药物组合的协同作用,q=1.07,显示加和作用。当用肿瘤重量计算时,tgi分别为-9.22%,93.46%和98.29%。使用金正均q值判断方法计算药物组合的协同作用,q=1.06,也显示加和作用。
表22.huctb006与伊立替康组合对皮下模型中患者原发肿瘤组织(结肠癌,cs182,5#)肿瘤的作用
表中的显著性通过比较治疗组与对照组来确定(即*p<0.05)(1与预先给药相比,肿瘤体积减少的时间)。
6.4huctb006和伊立替康的组合在患者原发性肿瘤组织(结肠癌,cs263,1#)皮下模型中的治疗效果
如图38和表23所示,huctb006和伊立替康的组合对皮下模型中来源于患者原发肿瘤组织(结肠癌,cs263,1#)的肿瘤有效果。使用治疗后第35天的肿瘤体积计算结果。
与对照组肿瘤体积相比,伊立替康组和huctb006+伊立替康组的肿瘤体积显著减小,ctb006、伊立替康和huctb006+伊立替康组的肿瘤生长抑制率(tgi)分别为9.42%,95.15%和96.52%。使用金正均q值判断法计算药物组合的协同作用,q=1.01,显示加和作用。当使用肿瘤重量计算时,tgi分别为16.11%、99.58%和99.25%。使用金正均q值判断方法计算药物组合的协同作用,结果q=1.00,也显示加和作用。
在本实验中,huctb006+伊立替康合用组中的两只动物在第24天和第31天显示肿瘤消退。在伊立替康组中,一只动物在第35天显示肿瘤消退。
在病理检查中,合用组(即huctb006+伊立替康)三个样本中的两个未显示任何肿瘤细胞的存在,并且甲状腺肿含有如图38所示的纤维结缔组织。在解剖和病理检查中,有4个样本没有显示任何肿瘤细胞,化疗组至少有一个样本有肿瘤细胞,表明组合治疗效果好于单独化疗组。
表23.huctb006与伊立替康组合对皮下模型中患者原发肿瘤组织(结肠癌,cs263,1#)肿瘤的作用
表中的显著性通过比较治疗组与对照组来确定(即*p<0.05)(1与预先给药相比,肿瘤体积减少的时间)。
6.5huctb006、紫杉醇和卡铂组合在患者原发性肿瘤组织(肺癌,cs113,3#)皮下模型中的治疗效果
如图39所示,huctb006、紫杉醇和卡铂的组合对皮下模型中来源自患者原发肿瘤组织(肺癌,cs113,3#)的肿瘤有效果。
紫杉醇+卡铂组和huctb006+紫杉醇+卡铂组对皮下模型中cs113(即肺癌)的生长均具有抑制作用。当使用治疗后第23天的肿瘤体积计算时,紫杉醇+卡铂组和huctb006+紫杉醇+卡铂组的tgi分别为81.01%和95.25%,显示出效果显著。使用金正均q值判断方法计算药物组合的协同作用,q=1.16,显示出协同作用。
如图39所示,在第37天,huctb006+紫杉醇+卡铂组的80%动物(4/5)显示肿瘤消退;在第50天,所有动物(5/5)显示肿瘤消退;而在紫杉醇+卡铂组中只有一只动物(1/5)显示肿瘤消退。这也表明合用组(即huctb006+紫杉醇+卡铂)的治疗效果出乎意料且令人惊讶地比单独化疗组更好。
6.6huctb006与顺铂的组合在患者原发性肿瘤组织(肺癌,cs225,1#)皮下模型中的治疗效果
如图40所示,huctb006和顺铂的组合对皮下模型中来源自患者原发性肿瘤组织(即肺癌,cs225,1#)的肿瘤有效果。
表24.huctb006和顺铂组合对皮下模型中原发性肿瘤组织(结肠癌,cs225,1#)患者肿瘤的作用
表中的显著性通过比较治疗组与对照组来确定(即*p<0.05)(1与预先给药相比,肿瘤体积减少的时间)。
用治疗后第37天的肿瘤体积计算结果。与对照组肿瘤体积相比,huctb006+顺铂组肿瘤体积明显减小。huctb006、顺铂和huctb006+顺铂组的肿瘤生长抑制率(tgi)分别为19.65%、31.45%和55.33%。使用金正均q值判断方法计算药物组合的协同作用,q=1.23,显示出协同作用。当使用肿瘤重量计算时,tgi分别为-25.23%、32.66%和45.00%。使用金正均q值判断方法计算药物组合的协同作用,q=2.87,也显示出协同作用。
实施例7.配合huctb006治疗的dr5定量试剂盒的开发
7.1试剂
使用的试剂是北京同为时代生物科技有限公司制备的抗dr5抗体,克隆:a10,批号:20110808,1.2mg/ml;北京同为时代生物科技有限公司制备的重组dr5-rfc抗原,批号:20100415,1mg/ml;北京同为时代生物科技有限公司制备的hrp抗dr5,克隆:2b9,批号:20100825;购自kpl的化学发光底物溶液,批号:110546;购自thermofisher的bca试剂盒,产品号:23227,批号:mf158389;北京同为时代生物科技有限公司制备的细胞和组织裂解液;其他化学试剂来自北京化工厂(中国)的,全部为分析纯,和双蒸水。
7.2仪器
使用的仪器是化学发光酶标仪bhp9504,北京浜松光子科技有限公司;自动化微孔板清洗机,dem-,北京拓普分析设备有限公司;电均热培养箱,dhp-9162,上海羿恒科技有限公司;涡流振荡器,ms2,ika;微板振动器,mh-1,海门其林贝尔设备有限公司;离心机,microfuge16,贝克曼库尔特(beckmancoulter);10μl、20μl、100μl、200μl、1000μl微量移液器,eppendorf。
7.3缓冲溶液
缓冲溶液为涂层溶液:0.02mol/l磷酸盐缓冲液(ph=7.2);封闭液:0.02mol/l磷酸盐缓冲液(pbs,ph=7.2,加1%bsa和0.05%proclin-300);和洗涤液:0.02mol/lpbs。
7.4人类肿瘤细胞系中dr5的测定
对于dr5检测,存在阈值(即0.2ng/ml)。低于阈值的细胞系对huctb006不敏感,部分高于阈值的细胞系对huctb006敏感。因此,不受理论的约束,可以认为下游胱天蛋白酶的级联反应仅在dr5表达达到有限阈值时被激活,然后诱导肿瘤细胞系的凋亡。换句话说,dr5的高表达可以诱导细胞凋亡途径。
表25.人肿瘤细胞裂解液中dr5浓度与huctb006体外细胞毒性敏感性的相关性
图41显示了人肿瘤细胞裂解液中dr5浓度与huctb006体外细胞毒敏感性的相关性。
7.5临床患者癌组织中dr5的测定
将临床癌症患者的癌组织和相对相邻组织溶解于裂解液中,然后用bca试剂盒测定总蛋白浓度。然后将裂解溶液中的总蛋白质水平稀释至8mg/ml,并使用cleia试剂盒测定dr5水平。结果显示于表26。
表26.癌组织与相邻组织间dr5水平的比较
通过ihc测定癌组织和相对相邻组织的dr5表达,并与cleia结果进行比较。如图42所示,cleiadr5水平和ihc结果之间存在良好的相关性,cleia试剂盒和ihc检测到的dr5表达是匹配的。
实施例8.ctb006相关序列
ctb006相关序列如下。
鼠ctb006轻链可变区核酸序列如下表27所示。
鼠ctb006轻链可变区氨基酸序列如下表28所示。
鼠ctb006轻链可变区核酸和氨基酸序列如下表29所示。
鼠ctb006轻链cdr1氨基酸序列如下表30所示。
鼠ctb006轻链cdr2氨基酸序列如下表31所示。
鼠ctb006轻链cdr3氨基酸序列如下表32所示。
鼠ctb006重链可变区核酸序列如下表33所示。
鼠ctb006重链可变区氨基酸序列如下表34所示。
鼠ctb006重链可变区核酸和氨基酸序列如下表35所示。
鼠ctb006重链cdr1氨基酸序列如下表36所示。
鼠ctb006重链cdr2氨基酸序列如下表37所示。
鼠ctb006重链cdr3氨基酸序列如下表38所示。
人嵌合ctb006轻链核酸序列如下表39所示。
人嵌合ctb006轻链氨基酸序列如下表40所示。
人嵌合ctb006轻链核酸和氨基酸序列如下表41所示。
人嵌合ctb006重链核酸序列如下表42所示。
人嵌合ctb006重链氨基酸序列如下表43所示。
人嵌合ctb006重链核酸和氨基酸序列如下表44所示。
等同物
本发明不限于本申请中描述的特定实施方式,其旨在作为本发明的各个方面的单一说明。在不脱离本发明的精神和范围的情况下,可以对本发明进行许多修改和变化,这对本领域技术人员是显而易见的。除了本文列举的那些之外,在本发明的范围内的功能上等效的方法和装置对于本领域技术人员来说将从上述描述中变得显而易见。这些修改和变化旨在落在所附权利要求的范围内。本发明仅由所附权利要求的措辞以及这些权利要求的等同物的全部范围来限制。应当理解,本发明不限于当然可以变化的特定方法、试剂、化合物组合物或生物系统。还应当理解,本文使用的术语仅用于描述特定实施方式的目的,而不是限制性的。
- 还没有人留言评论。精彩留言会获得点赞!