IL‑17C的抗体的制作方法
本申请大体涉及与il-17c相互作用的抗体或抗体片段。具体地,其涉及抗体或抗体片段,该抗体或抗体片段形成由所述抗体或抗体片段与一il-17c同型二聚体组成的复合物。
背景技术:
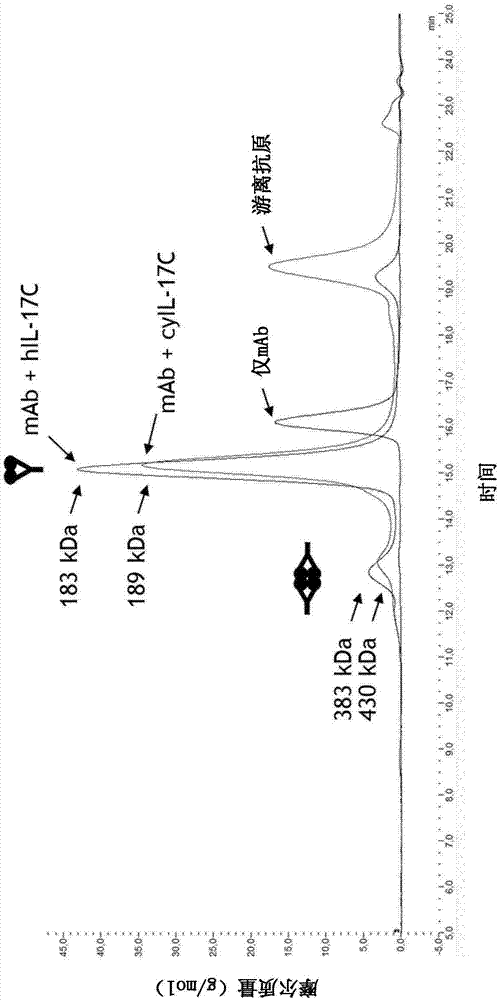
:il-17c是分泌的il17蛋白质家族的同型二聚体。已经在体外显示,il-17c刺激tnf-α和il-1β从单核细胞系thp-1的释放(li等人(2000)proc.natl.acad.sci.u.s.a.97,773-8)。il-17c可以在腹腔渗出细胞(pecs)和3t3细胞系中诱导炎性细胞因子例如il-ιβ、il-6和il-23的mrna表达(yamaguchi等人(2007)j.immunol179,7128-36)。作为il-17c特异性功能受体,识别出il-17re,并且发现il-17c-/-小鼠耐受实验性自身免疫性脑脊髓炎(eae),表明了il-17c作为促炎细胞因子的作用(chang等人(2011)immunity35,611-621)。il-17c通过il-17re和il-17ra的受体复合物激活下游信号传导,以用于诱导基因编码抗菌分子与肠道病原体介导的宿主粘膜免疫战斗(song等人(2011)natureimmunology12,12)。il-17c及其受体经进一步说明显著地在粘膜和上皮细胞上表达,因此提供了上皮细胞参与宿主防御的机制(ramirez-carrozzi等人(2011)natureimmunology12,12)。wo1999/060127是首个描述il-17c(pro1122)的克隆的公开文献。迄今假定il-17c与若干炎性病症的进展有关,但仅在最近在wo2013/057241中对其在实验上进行有评价,抑制il-17c是有前景的治疗炎性病症的方法。但是,wo2013/057241中使用的各抗体是替代物,对小鼠il-17c有特异性,显示出对人il-17c完全没有反应性。此外,在最近的公开文献中,显示出il-17c在特定肿瘤和癌组织进展中的相关性(xinyangsong(2014)immunity40,140-152)。同时,若干抗体例如源自免疫小鼠的多克隆血清或单克隆抗体作为研究工具抗体是可获得的,其包括,例如,来自r&dsystems的mab23061和mab2306,可得自abnova的抗-il-17c抗体(walnut,ca,usa;catalog#h00027189-b01p、#h00027189-d01和#h00027189-d01p)或者可得自antibodies-onlinegmbh的抗-il-17c抗体(aachen,germany;catalog#abin525892、#abin327411、#abin525893、#abin221340、#abin221341、#abin221342和#abin525891)。但是,这些抗体是多克隆血清,或者与小鼠il-17c特异性结合,例如wo2013/057241中所用的抗体,并不适用于人的治疗。因此,对于研究和识别改变人体中il-17c介导的信号传导并减轻il-17c相关的疾病或病症的方法和组合物存在需求。技术实现要素:本申请人首次公开了与人il-17c结合的抗体或抗体片段。更具体地,公开的抗体或抗体片段与il-17c同型二聚体二价结合。再更具体地,抗体或抗体片段与il-17c同型二聚体二价结合,形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在本公开内容一实施方式中,抗体或其片段是il-17c拮抗剂。在本公开内容另一实施方式中,抗体或抗体片段阻断il-17c与il17re的结合。公开的抗体或抗体片段能够通过来自vh/vl对的两个抗原结合位点的同时(二价)结合,与一il-17c同型二聚体相互作用。因此,这些抗体与il-17c在同型二聚il-17c上两次接近的特异性表位结合,并且可以通过本文公开的抗体二价结合。二价结合导致的强亲合力作用导致在一il-17c同型二聚体和这些抗体或抗体片段之间形成非常稳定的复合物。此外,公开的抗体或抗体片段抑制il-17c与其受体的相互作用,并且通过二价结合,公开的抗体或抗体片段同时阻断il-17c同型二聚体的两个受体相互作用区,其伴随有显著高效的il-17c-介导的信号传导的废除。因此,基于其出人意料的结合特性,本文公开的抗体在其拮抗活性方面非常显著。因此,公开的抗体或抗体片段就有效性而言因此很特别,并且提供了非常适合并富有前景的化合物以用于临床开发。一方面,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在一实施方式中,表位包括il-17c的氨基酸vlrpeevl(seqidno.:28)内的一个或多个氨基酸残基。在另一实施方式中,所述抗体或抗体片段与il-17c上的表位结合,其中所述表位包括seqidno.:1的氨基酸aa89-97区域中的一个或多个氨基酸残基。在进一步的实施方式中,所述抗体或抗体片段与il-17c上的表位结合,其中所述表位包括seqidno.:1的氨基酸aa90-97区域中的一个或多个氨基酸残基。本公开内容还涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体上的表位结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在另一方面,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在一实施方式中,表位包括人il-17c的氨基酸vlrpeevl(seqidno.:28)内的一个或多个氨基酸残基。在另一实施方式中,所述抗体或抗体片段与il-17c上的表位结合,其中所述表位包括seqidno.:1的氨基酸aa89-97区域中的一个或多个氨基酸残基。在另一实施方式中,所述抗体或抗体片段与il-17c上的表位结合,其中所述表位包括seqidno.:1的氨基酸aa90-97区域中的一个或多个氨基酸残基。在本公开内容的一具体实施方式中,与表位的结合通过氢/氘交换确定。在本公开内容的一实施方式中,抗体或其片段是单克隆抗体或抗体片段。在本公开内容一实施方式中,抗体或其片段是igg同种型。在一实施方式中,抗体片段是二价抗体片段。在另一实施方式中,所述抗体或抗体片段是分离的抗体或抗体片段。在另一方面,本公开内容涉及公开的抗体的医疗用途。在另一方面,本公开内容涉及公开的抗体用于治疗人体中的炎性病症或癌症的用途。在另一实施方式中,抗体或抗体片段是人、人源化或嵌合的抗体或抗体片段。在另一实施方式中,所述抗体或抗体片段包括人重链恒定区和人轻链恒定区。在另一实施方式中,所述抗体或抗体片段是重组抗体或抗体片段。在另一实施方式中,所述的重组抗体或抗体片段是重组的人抗体或抗体片段。在一实施方式中,il-17c特异性抗体或抗体片段与il-17c同型二聚体形成复合物,其中所述复合物的分子量低于200kda。在一实施方式中,所述抗体或抗体片段与il-17c同型二聚体形成复合物,其中所述形成的复合物中的至少50%的分子量低于200kda。在进一步的实施方式中,所述抗体或抗体片段与il-17c同型二聚体形成复合物,其中所述形成的复合物中的至少60%、至少70%、至少80%、至少90%的分子量低于200kda。在另一实施方式中,所述复合物是iii类复合物,如本文在实施例2部分7中所述(图1)。在另一实施方式中,所述复合物在溶液中形成,并由抗体和一il-17c同型二聚体组成。在另一实施方式中,il-17c特异性抗体和一il-17c同型二聚体形成的复合物通过尺寸排阻色谱评价。在一实施方式中,本公开内容涉及与il-17c同型二聚体二价结合的抗体或抗体片段用于治疗与il-17c的不合意存在相关的疾病或病症的用途。在一实施方式中,本公开内容涉及一种药物组合物,其包括所述抗体或抗体和药学可接受的载体或赋形剂。在另一实施方式中,本公开内容涉及所述药物组合物用于治疗与il-17c的不合意存在相关的疾病或病症的用途。要求保护的抗体或抗体片段具有实用性。而且,要求保护的识别这些抗体或片段的方法具有实用性。要求保护的抗体或抗体片段的实用性在于改变人il-17c的生物活性。具体地,要求保护的抗体或抗体片段意在用于治疗用途,例如,治疗炎性疾病,例如类风湿性关节炎、银屑病、肺炎和/或copd。附图说明图1:示出了il-17c抗体可能的结合方式。取决于抗体的结合方式,三种复合物中主要形成一种,其中两个同型二聚体与一个抗体缔合(i类),两个同型二聚体与两个抗体缔合(ii类),或者一个同型二聚体与一个抗体缔合(iii类)。形成的复合物在其分子量方面不同,其中i类复合物的分子量为~270kda,ii类复合物的分子量为~380kda,iii类复合物的分子量为~190kda。图2:抗体mab_1的尺寸排阻色谱,分析mab_1与人il-17c和食蟹猴(cynomolgus)il-17c的复合物形成。可以清楚地识别出mab_1分别与人il-17c和食蟹猴il-17c的一同型二聚体形成iii类复合物。图3:抗体mab_8的尺寸排阻色谱,分析mab_8与人il-17c的复合物形成。可以观察到与一il-17c同型二聚体形成复合物。图4和图5:两张图在尺寸排阻色谱中示例了5种额外的享有对于mab_1和mab_8所识别的相同结合方式的抗体。图6和图7:示例了许多抗体中的两种,其不享有对于mab_1和mab_8识别的结合方式。图6中的抗体主要与人il-17c形成ii类复合物(~365kda),主要与食蟹猴il-17c形成i类复合物(~253kda)。另外,图7中的抗体主要与人il-17c形成ii类复合物(~366kda),主要与食蟹猴il-17c形成i类复合物(~264kda)。图8a和8b:显示抗体mab_1(图8a)和mab_8(图8b)的hdxms表位作图(mapping)的覆盖图。识别出pvlrpeevl区(seqidno.:27,seqidno.:1的aa89-97)是两种抗体在人il-17c上的主要表位。具体实施方式本公开内容涉及多个至少识别il-17c的特定区域的抗体或抗体片段。一方面,本公开内容的抗体或抗体片段与il-17c结合,并与il-17c同型二聚体形成复合物。优选地,所述抗体或抗体片段与il-17c同型二聚体二价结合,形成由所述抗体或抗体片段与一il-17c同型二聚体组成的复合物。优选地,所述抗体或抗体片段与人il-17c结合。定义:术语“il-17c”是指称作白介素17c的蛋白质。人il-17c具有氨基酸序列(uniprotq9p0m4):mtllpgllfltwlhtclahhdpslrghphshgtphcysaeelplgqapphllargakwgqalpvalvssleaashrgrherpsattqcpvlrpeevleadthqrsispwryrvdtdedrypqklafaeclcrgcidartgretaalnsvrllqsllvlrrrpcsrdgsglptpgafafhtefihvpvgctcvlprsv(seqidno.:1)pvlrpeevl(seqidno.:27)对应于seqidno.:1的氨基酸aa89-97。vlrpeevl(seqidno.:28)对应于seqidno.:1的氨基酸aa90-97。小鼠il-17c具有氨基酸序列(uniprotq8k4c5):msllllgwlptgmthqdppswgkprshrtlrcysaeelshgqapphlltrsarweqalpvalvasleatghrrqhegplagtqcpvlrpeevleadthersispwryridtdenrypqklavaeclcrgcinaktgretaalnsvqllqsllvlrrqpcsrdgtadptpgsfafhtefirvpvgctcvlprstq(seqidno.:2)食蟹猴il-17c具有氨基酸序列(xp_005592825.1):mtllpgllfltwlhaclahqdpflrghphthgtprcysaeelplgqapphllargakwgqalpvalvssleaaghrrrhdrpsaatqcpvlrpeevleadthqrsispwryrvdtdedrypqklafaeclcrgcidprtgretaalnsvrllqsllvlrrrpcsrdgsglptpgafafhtefirvpvgctcvlprsv(seqidno.:3)术语“同型二聚体”是指例如通过二硫键或非共价相互作用连接在一起的两个相同的分子。术语“il17ra”是指称作白介素17受体a的蛋白质。人il17ra具有氨基酸序列(uniprotq96f46):mgaarsppsavpgpllgllllllgvlapggaslrlldhralvcsqpglnctvknstclddswihprnltpsspkdlqiqlhfahtqqgdlfpvahiewtlqtdasilylegaelsvlqlntnerlcvrfeflsklrhhhrrwrftfshfvvdpdqeyevtvhhlpkpipdgdpnhqsknflvpdceharmkvttpcmssgslwdpnitvetleahqlrvsftlwnesthyqilltsfphmenhscfehmhhipaprpeefhqrsnvtltlrnlkgccrhqvqiqpffssclndclrhsatvscpempdtpepipdymplwvywfitgisillvgsvillivcmtwrlagpgsekysddtkytdglpaadlippplkprkvwiiysadhplyvdvvlkfaqflltacgtevaldlleeqaiseagvmtwvgrqkqemvesnskiivlcsrgtrakwqallgrgapvrlrcdhgkpvgdlftaamnmilpdfkrpacfgtyvvcyfsevscdgdvpdlfgaapryplmdrfeevyfriqdlemfqpgrmhrvgelsgdnylrspggrqlraaldrfrdwqvrcpdwfecenlysaddqdapsldeevfeepllppgtgivkraplvrepgsqaclaidplvgeeggaavaklephlqprgqpapqplhtlvlaaeegalvaavepgpladgaavrlalagegeacpllgspgagrnsvlflpvdpedsplgsstpmaspdllpedvrehleglmlslfeqslscqaqggcsrpamvltdphtpyeeeqrqsvqsdqgyisrsspqppegltemeeeeeeeqdpgkpalplspedleslrslqrqllfrqlqknsgwdtmgsesegpsa(seqidno.:4)术语“il17re”是指称作白介素17受体e的蛋白质。人il17re具有氨基酸序列(uniprotq8nfr9):mgssrlaalllplllividlsdsagigfrhlphwntrcplashtddsftgssayipcrtwwalfstkpwcvrvwhcsrclcqhllsggsglqrglfhllvqkskksstfkfyrrhkmpapaqrkllprrhlsekshhisipspdishkglrskrtqpsdpetweslprldsqrhggpefsfdllpearairvtissgpevsvrlchqwaleceelsspydvqkivsgghtvelpyefllpclcieasylqedtvrrkkcpfqswpeaygsdfwksvhftdysqhtqmvmaltlrcplkleaalcqrhdwhtlckdlpnataresdgwyvlekvdlhpqlcfkfsfgnsshvecphqtgsltswnvsmdtqaqqlilhfssrmhatfsaawslpglgqdtlvppvytvsqargsspvsldliipflrpgccvlvwrsdvqfawkhllcpdvsyrhlgllilallalltllgvvlaltcrrpqsgpgparpvlllhaadseaqrrlvgalaellraalgggrdvivdlwegrhvarvgplpwlwaartrvareqgtvlllwsgadlrpvsgpdpraapllallhaaprpllllayfsrlcakgdippplralpryrllrdlprllraldarpfaeatswgrlgarqrrqsrlelcsrlereaarladlg(seqidno.:5)鼠il17re具有氨基酸序列(uniprotq8bh06):mgsprlaalllslpllliglavsarvacpclrswtshcllayrvdkrfaglqwgwfpllvrksksppkfedywrhrtpasfqrkllgspslseeshrisipssaishrgqrtkraqpsaaegrehlpeagsqkcggpefsfdllpevqavrvtipagpkasvrlcyqwalecedlsspfdtqkivsgghtvdlpyefllpcmcieasylqedtvrrkkcpfqswpeaygsdpwqsirftdysqhnqmvmaltlrcplkleaslcwrqdpltpcetlpnaiaqesegwyilenvdlhpqlcfkfsfensshvecphqsgslpswtvsmdtqaqqltlhfssrtyatfsaawsdpglgpdtpmppvysisqtqgsvpvtldliipflrqencilvwrsdvhfawkhvlcpdvshrhlgllilallaltalvgvvlvllgrrllpgsgrtrpvlllhaadseaqrrlvgalaellrtalgggrdvivdlwegthvarigplpwlwaarervareqgtvlllwncagpstacsgdpqaaslrtllcaaprplllayfsrlcakgdiprplralpryrllrdlprllraldaqpatlasswshlgakrclknrleqchlleleaakddyqgstnspcgfscl(seqidno.:6)术语“复合物”是指当两个或更多个化合物彼此结合、接触或缔合时形成的实体。在本文中,复合物在抗体或抗体片段与其抗原之间形成。如本文所用,“il-17c的拮抗剂”和“il-17c拮抗剂”是指任何抑制il-17c的活性或功能的分子。术语il-17c拮抗剂包括,但不限于,与il-17c特异性结合的抗体或抗体片段。优选地,在本公开内容中,il-17c拮抗剂是人il-17c特异性抗体。这样的抗体可以是任意类型的,例如,小鼠、大鼠、嵌合、人源化或人抗体。如本文所用,术语“抗体”是指与抗原相互作用(例如,通过结合、空间位阻、稳定化空间分布)的包括通过二硫键互相连接的至少两个重链(h)和两个轻链(l)的蛋白质。每个重链包括重链可变区(在本文中缩写为vh)和重链恒定区。重链恒定区包括三个结构域ch1、ch2和ch3。每个轻链包括轻链可变区(在本文中缩写为vl)和轻链恒定区。轻链恒定区包括一个结构域cl。vh和vl区可以进一步细分成称作互补决定区(cdr)的高变区,其点缀以更加保守的称作框架区(fr)的区域。每个vh和vl由以如下顺序从氨基端到羧基端排列的三个cdr和四个fr组成:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,包括各种免疫系统细胞(例如效应细胞)和经典补体系统的第一组分(clq)。术语“抗体”包括,例如,单克隆抗体、人抗体、人源化抗体、骆驼化(camelised)抗体和嵌合抗体。抗体可以是任意同种型(例如,igg、ige、igm、igd、iga和igy)、分类(例如,lgg1、lgg2、lgg3、lgg4、lga1和lga2)或子类的。重链和轻链均分为结构和功能同源性区域。如本文所用,短语“抗体片段”是指抗体保持与抗原特异性相互作用(例如,通过结合、空间位阻、稳定化空间分布)的能力的一个或多个部分。结合片段的例子包括,但不限于,fab片段,由vl、vh、cl和ch1结构域组成的单价片段;f(ab)2片段,包括两个在铰链区通过二硫桥连接的fab片段的二价片段;由vh和ch1结构域组成的fd片段;由抗体单臂的vl和vh结构域组成的fv片段;dab片段(ward等人(1989)nature341:544-546)),其由vh结构域组成;和分离的互补决定区(cdr)。而且,尽管fv片段的两个结构域vl和vh通过单独的基因编码,但它们可以使用重组方法通过能够使其成为单个蛋白质链的合成连接部分接合,其中vl和vh区域成对形成单价分子(称作单链fv(scfv);参见,例如,bird等人,(1988)science242:423-426;和huston等人,(1988)proc.natl.acad.sci.85:5879-5883)。这些单链抗体另外意在包括在术语“抗体片段”内。这些抗体片段使用本领域技术人员已知的常规技术得到,筛选与完整抗体以相同方式具有实用性的片段。抗体片段还可以并入到单结构域抗体、大抗体(maxibody)、微抗体(minibody)、胞内抗体(intrabody)、双链抗体(diabody)、三链抗体(triabody)、四链抗体(tetrabody)、v-nar和bis-scfv中(参见,例如,hollinger和hudson,(2005)naturebiotechnology23:1126-1136)。抗体片段可以接枝到基于多肽的支架(scaffold)例如iii型纤连蛋白(fn3)中(参见,美国专利第6,703,199号,其说明了纤连蛋白多肽单抗体)。抗体片段可以并入到包括一对串联fv片段(vh-ch1-vh-ch1)的单链分子中,其与互补轻链多肽一起形成一对抗原结合位点(zapata等人,(1995)proteineng.8:1057-1062;和美国专利第5,641,870号)。术语“抗原结合位点”是指抗体或抗体片段包括与抗原特异性结合的区域的部分。抗原结合位点可以通过一个或多个抗体可变结构域提供。优选地,抗原结合位点包括在抗体或抗体片段缔合的vh和vl内。如本文所用,“人抗体”或“人抗体片段”包括具有可变区的其中框架区和cdr区二者均源自人来源的序列的抗体和抗体片段。而且,如果抗体含有恒定区,恒定区也源自这些人序列,例如,人种系(germline)序列,或者人种系序列的突变版本,或者源自人框架序列分析含有共有框架序列的抗体,例如,如knappik等人,(2000)jmolbiol296:57-86中所述。免疫球蛋白可变结构域例如cdr的结构和位置可以使用公知的编码方式例如kabat编码方式、chothia编码方式或者kabt和chothia的组合来定义(参见,例如,sequencesofproteinsofimmunologicalinterest,美国卫生及公共服务部(u.s.departmentofhealthandhumanservices)(1991)kabat等人编;lazikani等人,(1997)j.mol.bio.273:927-948);kabat等人,(1991)sequencesofproteinsofimmunologicalinterest,第5版,nih公开号91-3242美国卫生及公共服务部;chothia等人,(1987)j.mol.biol.196:901-917;chothia等人,(1989)nature342:877-883;和al-lazikani等人,(1997)j.mol.biol.273:927-948。“人源化抗体”或功能性人源化抗体片段在本文中定义为以下抗体:(i)源自非人来源(例如,携带异源免疫系统的转基因小鼠),该抗体基于人种系序列,或者(ii)是cdr-接枝的,其中可变结构域的cdr来自非人来源,而可变结构域的一个或多个框架是人来源的,并且恒定结构域(如果有的话)是人来源的。术语“嵌合抗体”或功能性嵌合抗体片段在本文中定义为如下抗体分子:其具有来源于或对应于一物种中发现的序列的恒定抗体区和来源于另一物种的可变抗体区。优选地,恒定抗体区来源于或者对应于在人中例如在人种系细胞或体细胞中发现的序列,可变抗体区(例如,vh、vl、cdr或fr区)来源于非人动物例如小鼠、大鼠、兔或仓鼠中发现的序列。术语“分离”是指化合物可以是,例如,基本上不含其它具有不同抗原特异性的抗体或抗体片段的抗体或抗体片段。而且,分离的抗体或抗体片段可以基本上不含其它的细胞材料和/或化学物质。因此,在一些方面,提供的抗体是分离的抗体,其已经与具有不同特异性的抗体分离。分离的抗体可以是单克隆抗体。分离的抗体可以是重组的单克隆抗体。但是,与目标表位、同种型或变体特异性结合的分离的抗体可以与其他相关抗原例如来自其他物种者(例如物种同源物)具有交叉反应性。如本文所用,术语“重组抗体”包括所有通过重组方式制备、表达、产生或分离的抗体,例如,自人免疫球蛋白基因转基因或转染色体动物(例如小鼠)或由其制备的杂交瘤分离的抗体,自转化表达抗体的宿主细胞分离的抗体,自重组、组合人抗体文库选择和分离的抗体,和通过任何其他涉及剪接部分或全部人免疫球蛋白基因、序列至其他dna序列的方式制备、表达、产生或分离的抗体。优选地,这些重组抗体具有可变区,其中框架区和cdr区源自人种系免疫球蛋白序列。然而,在某些实施方式中,这些重组人抗体可以进行体外诱变(或者,当使用人ig序列转基因动物时,体内的体细胞诱变),因此,重组抗体vh和vl区的氨基酸序列是尽管源自人种系vh和vl序列并与其相关、但在体内在人抗体种系所有组成成分(repertoire)内均不可能天然存在的序列。重组抗体可以是单克隆抗体。在一实施方式中,本文公开的抗体和抗体片段分离自抗体库,如us13/321,564或us13/299,267中所公开,在此将二者均并入作为参考。如本文所用,术语“单克隆抗体”是指单一分子组成的抗体分子制剂。单克隆抗体组合物表现出独特的结合位点,其对于特定表位具有独特的结合特异性和亲和力。如本文所用,如果抗体能够在抗原和一种或多种参考抗原之间区分,这种抗体“特异性结合”、“特异性地结合”这种抗原是对于抗原有“特异性”、抗原“特异”、或者“特异性识别”抗原,因为结合特异性不是绝对特性,而是相对特性。参考抗原可以是一种或多种密切相关的抗原,其用作参考点,例如,il17a或il17b。以其大多数通常的形式(当没有提及定义的参考时),“特异性结合”是指抗体区分所关注的抗原和非相关抗原的能力,例如,如根据以下方法之一测定。这些方法包括,但不限于,蛋白质印迹、elisa-、ria-、ecl-、irma-测试和肽扫描。例如,可以进行标准elisa检定。可以通过标准显色进行评分(例如,带辣根过氧化物酶的二抗和带过氧化氢的四甲基联苯胺)。某些孔中的反应通过光学密度评分,例如,在450nm下。典型的背景(=阴性反应)可以是0.1od;典型的阳性反应可以是1od。这意味着阳性/阴性差异可以大于10倍。典型地,结合特异性的测定通过使用并非单一参考抗原、而是一组大约3-5种非相关抗原例如奶粉、bsa、转铁蛋白等进行。此外,“特异性结合”可以涉及抗体区分其目标抗原不同部分例如il-17c或il-17c受体的不同结构域或区域的能力,或者区分il-17c或il-17c受体的一个或多个关键氨基酸残基或氨基酸残基段(stretch)的能力。术语“亲合力(avidity)”用于说明蛋白质之间的多个键相互作用的结合强度。亲合力与说明单键强度的亲和力(affinity)不同。因此,亲合力是键亲和力的组合协同强度(功能亲合力),而不是键的总和。对于本公开内容的抗体,来自vh/vl对的两个抗原结合位点与一il-17c同型二聚体同时相互作用。尽管每个单一结合相互作用可能很容易破坏(取决于相对亲和力),但是由于同时存在许多结合相互作用,单一位点的瞬时未结合不会使得分子扩散开,而且该位点的结合很可能恢复。总体效果是抗原与抗体协同的强结合。如本文所用,术语“亲和力”是指多肽与其靶标在单一位点处的相互作用强度。在每个位点内,多肽的结合区通过弱的非共价力与其靶标在无数位点处相互作用;相互作用越多,亲和力越强。如本文所用,术语“kd”是指解离常数,其根据kd与ka的比例(即kd/ka)得到,并表达为摩尔浓度(m)。抗原结合部分例如单克隆抗体的kd值可以使用本领域的成熟方法确定。确定抗原结合部分例如单克隆抗体的kd的方法是set(可溶性平衡滴定)或使用生物传感器系统例如系统的表面等离子体共振。在本公开内容中,il-17c特异性抗体通常解离速率常数(kd)(koff/kon)小于5x10-2m,小于10-2m,小于5x10-3m,小于10-3m,小于5x10-4m,小于10-4m,小于5x10-5m,小于10-5m,小于5x10-6m,小于10-6m,小于5x10-7m,小于10-7m,小于5x10-8m,小于10-8m,小于5x10-9m,小于10-9m,小于5x10-10m,小于10-10m,小于5x10-11m,小于10-11m,小于5x10-12m,小于10-12m,小于5x10-13m,小于10-13m,小于5x10-14m,小于10-14m,小于5x10-15m,或者小于10-15m,或者更低。如本文所用,术语“二价分子”是指具有两个抗原结合位点的分子。在一些实施方式中,本发明的二价分子是二价抗体或其二价片段。在一些实施方式中,本发明的二价分子是二价抗体。在一些实施方式中,本发明的二价分子是igg。通常,单克隆抗体具有二价基本结构。igg和ige仅具有一个二价单元,而iga和igm由多个二价单元组成(分别为4个和10个),因此具有更高的价态。该二价特性增加了抗体对抗原的亲合力。如本文所用,术语“二价结合”或“二价地结合”是指二价分子的两个抗原结合位点均与其抗原结合。优选地,二价分子的两个抗原结合位点共享同样的抗原特异性。“交叉竞争”是指在标准竞争结合检定中抗体、抗体片段或其他抗原结合部分干扰其他抗体、抗体片段或抗原结合部分与特定抗原结合的能力。抗体、抗体片段或其他抗原结合部分能够干扰另一抗体、抗体片段或抗原结合部分与特定抗原结合的能力或程度,无论其是否可以根据本发明称作交叉竞争,均可以使用标准竞争结合检定确定。一种合适的检定涉及到使用biacore技术(例如,通过使用biacore3000仪器(biacore,uppsala,sweden)),其可以使用表面等离子体共振技术测量相互作用的程度。另一测量交叉竞争的检定使用基于elisa的方法。国际专利申请第wo2003/48731号中描述了一种基于其交叉竞争将抗体“表位分箱(binning)”的高通量方法。如果考察的抗体或抗体片段使表1所述的抗体之一与il-17c的结合降低60%或更多,具体地降低70%或更多,更具体地降低80%或更多,且如果表1所述的抗体之一使所述抗体或抗体片段与il-17c的结合降低60%或更多,具体地降低70%或更多,更具体地降低80%或更多,则存在交叉竞争。术语“表位”包括任何被抗体或其片段或t-细胞受体特异性识别或者与分子相互作用的蛋白质区域。通常,表位具有化学活性表面分子组群(groupings),例如氨基酸或碳水化合物或糖侧链,且通常可以具有特定的三维结构特性以及特定的电荷特性。如本领域技术人员将会认识到,实际上任何抗体可以特异性结合者均可以是表位。表位可以包括抗体结合的那些残基,可以是“线性的”或“构象的”。术语“线性表位”是指其中蛋白质与相互作用分子(例如抗体)之间相互作用的所有点沿着蛋白质一级氨基酸序列线性出现(连续)的表位。术语“构象表位”是指其中不连续的氨基酸在三维构象中在一起的表位。在构象表位中,相互作用点跨越蛋白质上彼此分离的氨基酸残基出现。例如,表位可以是如肽图谱或hdx所示的氨基酸段内的一个或多个氨基酸,或者是如x-射线晶体结构所示的一个或多个单独的氨基酸。“与…结合相同表位”是指抗体、抗体片段或其他抗原结合部分与特定抗原结合、并且与示例的抗体具有相同表位的能力。示例抗体和其他抗体的表位可以使用表位作图技术确定。表位作图技术是本领域公知的。例如,构象表位很容易通过确定氨基酸的空间构象识别,例如,通过氢/氘交换、x-射线晶体学和二维核磁共振。本发明的组合物可以用于治疗性或预防性应用。因此,本发明包括含有本发明抗体(或者功能性抗体片段)和用于其的药学可接受的载体或赋形剂的组合物。在相关方面,本发明提供一种治疗炎性疾病的方法。这些方法含有给予对其有需求的受试者有效量的含有如本文描述或构思的本发明抗体的药物组合物的步骤。本公开内容提供治疗方法,其包括将治疗有效量的公开的il-17c抗体给予对该治疗有需求的受试者。如本文所用,“治疗有效量”或“有效量”是指引起期望生物响应所需的il-17c抗体的量。根据本发明,治疗有效量是治疗和/或预防疾病所需的il-17c的量。术语“炎性疾病”或“炎性病症”可互换使用,在本文中是指任何与炎症有关的异常。炎性疾病可以是慢性的或急性的,并包括自身免疫疾病。如本上下文中所用,“受试者”是指任何动物,包括啮齿类动物,例如小鼠或大鼠,灵长类动物,例如食蟹猴(macacafascicularis)、恒河猴(macacamulatta)或人(homosapiens)。优选地,受试者是灵长类动物,更优选人。实施方式:在一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在一实施方式中,表位包括人il-17c的氨基酸vlrpeevl(seqidno.:28)内的一个或多个氨基酸残基。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸vlrpeevl(seqidno.:28)。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的区域结合,其中该区域包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的区域结合,其中该区域包括人il-17c的氨基酸vlrpeevl(seqidno.:28)。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与肽结合,其中肽包括氨基酸pvlrpeevl(seqidno.:27)。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与肽结合,其中肽包括人il-17c的氨基酸vlrpeevl(seqidno.:28)。在进一步的实施方式中,肽基本上由氨基酸pvlrpeevl(seqidno.:27)组成。在另一实施方式中,肽由氨基酸pvlrpeevl(seqidno.:27)组成。在进一步的实施方式中,肽基本上由氨基酸vlrpeevl(seqidno.:28)组成。在另一实施方式中,肽由氨基酸vlrpeevl(seqidno.:28)组成。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与seqidno.:1的氨基酸aa89-97区域结合。在进一步的实施方式中,所述抗体或抗体片段与seqidno.:1的氨基酸aa90-97区域结合。在一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基和人il-17c的区域aa98-111(adthqrsispwry;seqidno.:29)、aa132-146(crgcidartgretaal;seqidno.:30)和aa192-197(tcvlprsv;seqidno.:31)中的一个或多个内的一个或多个氨基酸残基。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸vlrpeevl(seqidno.:28)内的一个或多个氨基酸残基和人il-17c的区域aa98-111(adthqrsispwry;seqidno.:29)、aa132-146(crgcidartgretaal;seqidno.:30)和aa192-197(tcvlprsv;seqidno.:31)中的一个或多个内的一个或多个氨基酸残基。在进一步的实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基和人il-17c的区域aa192-197(tcvlprsv;seqidno.:31)内的一个或多个氨基酸残基。在进一步的实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸区域pvlrpeevl(seqidno.:27)和人il-17c的氨基酸区域aa192-197(tcvlprsv;seqidno.:31)。在进一步的实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基和人il-17c的区域aa98-111(adthqrsispwry;seqidno.:29)、aa132-146(crgcidartgretaal;seqidno.:30)和192-197(tcvlprsv;seqidno.:31)内的一个或多个氨基酸残基。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体上的表位结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在另一实施方式中,表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在一实施方式中,所述il-17c特异性抗体或抗体片段阻断il-17c与il-17c受体的结合。在进一步的实施方式中,所述il-17c特异性抗体或抗体片段阻断il-17c与il17受体的结合,其中所述受体是il17re。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段阻断il-17c与il17re的结合。在另一实施方式中,所述抗体或抗体片段是il-17c拮抗剂。在进一步的实施方式中,所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物,并且其中所述抗体或抗体片段阻断il-17c与il17re的结合。在进一步的实施方式中,所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在某些实施方式中,所述il-17c特异性抗体或抗体片段阻断il-17c与一种或多种il-17c受体的结合。在另外可选的实施方式中,所述il-17c受体特异性抗体或抗体片段阻断il-17c与il-17c受体的结合,其中il17受体包括il17re和il17ra。在另外可选的实施方式中,所述il-17c受体特异性抗体或抗体片段阻断il-17c与il17re和il17ra的结合。在某些实施方式中,所述il-17c特异性抗体或抗体片段以小于100nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、9nm、8nm、7nm、6nm、5nm、4nm、3nm、2nm、1nm、100pm、90pm、80pm、70pm、60pm、50pm、40pm、30pm、20pm、10pm、9pm、8pm、7pm、6pm、5pm、4pm、3pm、2pm或1pm的ic50浓度阻断il-17c与il17re的结合。在某些方面,ic50浓度可以通过elisa;set、facs或msd(mesoscalediscovery)确定。在一实施方式中,公开的抗体或抗体片段对人il-17c具有特异性。在进一步的实施方式中,公开的il-17c特异性抗体或抗体片段与另一物种的il-17c例如来自小鼠、大鼠、食蟹猴和/或恒河猴(rhesus)的il-17c具有交叉反应性。在另一实施方式中,抗体或抗体片段对于人il-17c、食蟹猴il-17c和小鼠il-17c具有特异性。在进一步的实施方式中,所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在一实施方式中,公开的抗体或抗体片段对于由氨基酸序列seqidno.:1编码的人il-17c具有特异性。在一实施方式中,公开的抗体或抗体片段对于包括氨基酸序列seqidno.:1的多肽具有特异性。在进一步的实施方式中,所述单克隆抗体或抗体片段是对于由氨基酸序列seqidno.:1组成的多肽具有特异性的单克隆抗体。在另一实施方式中,公开的抗体或抗体片段对于由氨基酸序列seqidno.:1编码的人il-17c具有特异性,并且是单克隆抗体或抗体片段。在一实施方式中,公开的il-17c特异性抗体或抗体片段是单克隆抗体或抗体片段。在一实施方式中,公开的il-17c特异性抗体或抗体片段是人、人源化或嵌合的抗体。在某些实施方式中,所述il-17c特异性抗体或抗体片段是分离的抗体或抗体片段。在另一实施方式中,所述抗体或抗体片段是重组抗体或抗体片段。在进一步的实施方式中,所述抗体或抗体片段是重组人抗体或抗体片段。在进一步的实施方式中,所述的重组人抗体或抗体片段是分离的重组人抗体或抗体片段。在进一步的实施方式中,所述的重组人抗体或抗体片段或分离的重组人抗体或抗体片段是单克隆的。在另一实施方式中,本公开内容涉及人il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物,其中所述抗体或抗体片段阻断il-17c与il17re的结合,并且其中所述抗体或抗体片段是单克隆抗体或抗体片段。在另一实施方式中,本公开内容涉及人il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物,其中所述抗体或抗体片段阻断il-17c与il17re的结合,并且其中所述抗体或抗体片段是单克隆抗体或抗体片段,并且其中所述抗体或抗体片段是人、人源化或嵌合的抗体或抗体片段。在一实施方式中,公开的抗体或抗体片段包括人重链恒定区和人轻链恒定区。在一实施方式中,公开的抗体或抗体片段是igg同种型的。在另一实施方式中,所述抗体是igg1。在一实施方式中,所述抗体片段是二价抗体片段。在一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体形成复合物,并且其中所述复合物的分子量小于200kda。更具体地,所述抗体或抗体片段与il-17c同型二聚体形成复合物,其中所述形成的复合物中至少50%的分子量小于200kda。在进一步的实施方式中,所述抗体或抗体片段与il-17c同型二聚体形成复合物,其中所述形成的复合物中至少50%、至少60%、至少70%、至少80%、至少90%或至少95%的分子量小于200kda。在进一步的实施方式中,所述抗体或抗体片段与人il-17c上的表位结合,其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在另一实施方式中,本公开内容涉及与表1所述抗体交叉竞争的抗体或抗体片段。在一实施方式中,本公开内容涉及抗体或抗体片段,其中所述抗体或抗体片段与包括表1中抗体之一的kabat定义的6个cdr的抗体或抗体片段交叉竞争。在另一实施方式中,本公开内容涉及人il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物,并且其中所述抗体或抗体片段与包括表1中抗体之一的kabat定义的6个cdr的抗体或抗体片段交叉竞争。在另一实施方式中,本公开内容涉及抗体或抗体片段,其中所述抗体或抗体片段与包括6个cdr的抗体或抗体片段交叉竞争,其中hcdr1是氨基酸序列seqidno.:7,hcdr2是氨基酸序列seqidno.:8,hcdr3是氨基酸序列seqidno.:9,lcdr1是氨基酸序列seqidno.:10,lcdr2是氨基酸序列seqidno.:11,lcdr3是氨基酸序列seqidno.:12。在另一实施方式中,本公开内容涉及抗体或抗体片段,其中所述抗体或抗体片段与包括根据seqidno.:14的vh和根据seqidno.:13的vl的抗体或抗体片段交叉竞争。在另一实施方式中,本公开内容涉及抗体或抗体片段,其中所述抗体或抗体片段与包括6个cdr的抗体或抗体片段交叉竞争,其中hcdr1是氨基酸序列seqidno.:17,hcdr2是氨基酸序列seqidno.:18,hcdr3是氨基酸序列seqidno.:19,lcdr1是氨基酸序列seqidno.:20,lcdr2是氨基酸序列seqidno.:21,lcdr3是氨基酸序列seqidno.:22。在另一实施方式中,本公开内容涉及抗体或抗体片段,其中所述抗体或抗体片段与包括根据seqidno.:24的vh和根据seqidno.:23的vl的抗体或抗体片段交叉竞争。在进一步的实施方式中,本公开内容涉及抗体或抗体片段,其中所述抗体或抗体片段与包括根据seqidno.:14的vh和根据seqidno.:13的vl的抗体或抗体片段交叉竞争或者与包括根据seqidno.:24的vh和根据seqidno.:23的vl的抗体或抗体片段交叉竞争。在某些实施方式中,本公开内容涉及与表1所述抗体交叉竞争、并在基于elisa的交叉竞争检定中使表1所述抗体之一的特异性结合降低至少70%、80%或90%的抗体或抗体片段。在某一实施方式中,本公开内容涉及与表1所述抗体交叉竞争、并在基于elisa的交叉竞争检定中使表1所述抗体之一与il-17c的特异性结合降低至少70%、80%或90%的单克隆抗体或抗体片段。代表性的检定设置在本公开内容中在实施例6中说明。在另一实施方式中,本公开内容涉及抗体或抗体片段,其与表1中抗体之一结合相同的表位(例如,通过结合、稳定化、空间分布)。在进一步的实施方式中,所述抗体或抗体片段与包括表1中抗体之一的kabat定义的6个cdr的抗体或抗体片段结合相同的表位(例如,通过结合、稳定化、空间分布)。在进一步的实施方式中,所述抗体或抗体片段与包括表1中抗体之一的kabat定义的6个cdr的抗体或抗体片段结合相同的表位(例如,通过结合、稳定化、空间分布),其中表位包括人il-17c的氨基酸pvlrpeevl(seqidno.:27)内的一个或多个氨基酸残基。在进一步的实施方式中,所述抗体或抗体片段与包括表1中抗体之一的kabat定义的6个cdr的抗体或抗体片段结合相同的表位(例如,通过结合、稳定化、空间分布),其中表位包括人il-17c的氨基酸vlrpeevl(seqidno.:28)内的一个或多个氨基酸残基。给定多肽的包括表位的区域可以使用多种本领域公知的表位作图技术识别。参见,例如,epitopemappingprotocolsinmethodsinmolecularbiology,vol.66(glenne.morris,ed.,1996)humanapress,totowa,newjersey。例如,线性表位可以通过以下方法确定:例如,在固体载体上同时合成大量肽,该肽对应于蛋白质分子的多个部分,在肽仍然连接在载体上的同时使肽与抗体反应。这些技术是本领域已知的,例如,描述于美国专利第4,708,871号;geysen等人,(1984)proc.natl.acad.sci.usa8:3998-4002;geysen等人,(1985)proc.natl.acad.sci.usa82:78-182;geysen等人,(1986)mol.immunol.23:709-715。类似地,构象表位很容易通过确定氨基酸的空间构象识别,例如,通过氢/氘交换、x-射线晶体学和二维核磁共振。例如,参见,epitopemappingprotocols,同上。蛋白质的抗原区域也可以使用标准抗原性和亲水性图识别,该图例如,使用例如可得自oxfordmoleculargroup的omiga1.0版软件程序计算。该计算机程序使用hopp/woods方法,hopp等人,(1981)proc.natl.acad.sciusa78:3824-3828,用于确定抗原性图谱,以及kyte-doolittle技术,kyte等人,(1982)j.mol.biol.157:105-132,用于亲水性图。而且,表位确定可以根据本公开内容实施例8中所述的方法通过质谱进行。具体地,本公开内容涉及与特定表位结合的抗体或抗体片段,其中与所述表位的所述结合通过氢/氘交换确定。在一实施方式中,本公开内容涉及包括表1中任意抗体的kabat定义的6个cdr的抗体或抗体片段。在另一方面,本公开内容涉及包括表1中各抗体的kabat定义的6个cdr的分离的单克隆抗体或其片段。在某些实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段可以与il-17c以大约小于100nm、更优选小于大约60nm、再更优选小于大约30nm的亲和力结合。更优选以小于大约10nm、更优选小于大约3nm的亲和力与il-17c结合的抗体或抗体片段。在某些实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段可以与il-17c以大约小于100nm、更优选小于大约60nm、再更优选小于大约30nm的单价亲和力结合。更优选以小于大约10nm、更优选小于大约3nm的单价亲和力与il-17c结合的抗体或抗体片段。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段具有的与il-17c的二价亲和力,其比与il-17c的单价亲和力高至少2倍、至少5倍、至少10倍、至少100倍、至少1000倍、至少10000倍、至少100000倍。在进一步的实施方式中,所述抗体或抗体片段的二价亲和力以igg-形式确定,其中所述抗体或抗体片段的单价亲和力以fab-形式确定。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段,其中所述抗体或抗体片段具有与il-17c的单价亲和力,解离速率常数(kd)小于5x10-2m,小于10-2m,小于5x10-3m,小于10-3m,小于5x10-4m,小于10-4m,小于5x10-5m,小于10-5m,小于5x10-6m,小于10-6m,小于5x10-7m,小于10-7m,小于5x10-8m,小于10-8m,小于5x10-9m,小于10-9m,小于5x10-10m,小于10-10m,小于5x10-11m,小于10-11m,小于5x10-12m,小于10-12m,小于5x10-13m,小于10-13m,小于5x10-14m,小于10-14m,小于5x10-15m,或者小于10-15m,并且其中二价形式的所述抗体或抗体片段与il-17c具有亲和力,其解离速率常数(kd)比单价形式的解离速率常数(kd)低至少2倍、5倍、10倍、100倍、1000倍、10000倍、100000倍。在进一步的实施方式中,所述抗体或抗体片段的二价亲和力以igg-形式确定,其中所述抗体或抗体片段的单价亲和力以fab-形式确定。在一实施方式中,本公开内容涉及一种核酸组合物,其包括编码抗体或抗体片段的一核酸序列或多种核酸序列,该抗体或抗体片段与il-17c同型二聚体二价结合、并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在另一实施方式中,本公开内容涉及载体组合物,其包括有包括编码抗体或抗体片段的所述一核酸序列或所述多种核酸序列的一载体或多种载体,该抗体或抗体片段与il-17c同型二聚体二价结合、并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在另一实施方式中,本公开内容涉及包括所述载体组合物的细胞。在进一步的实施方式中,所述细胞是细菌或哺乳动物细胞。在一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段用于治疗与il-17c的不合意存在相关的疾病或病症的用途,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在另一实施方式中,所述与il-17c的不合意存在相关的病症是炎性疾病或癌症。在一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段用于治疗炎性疾病的用途,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在其他方面,本公开内容涉及il-17c特异性抗体或抗体片段在制备用于治疗炎性疾病的药物中的用途。在进一步的实施方式中,本公开内容涉及用于治疗受试者中炎性疾病的方法,其包括给予受试者包括抗体或抗体片段的药物组合物,上述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段用于治疗癌症的用途,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在其他方面,本公开内容涉及il-17c特异性抗体或抗体片段在制备用于治疗癌症的药物中的用途。在进一步的实施方式中,本公开内容涉及用于治疗受试者中癌症的方法,其包括给予受试者包括抗体或抗体片段的药物组合物,上述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在一实施方式中,本公开内容涉及包括il-17c特异性抗体或抗体片段的组合物,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物,并且组合物还包括一种或多种药学可接受的载体和/或稀释剂。在一实施方式中,所述组合物是药物组合物。在进一步的实施方式中,所述组合物能够在对其有需要的受试者中拮抗il-17c。在进一步的实施方式中,所述组合物是药物组合物且能够在对其有需要的受试者中拮抗il-17c。在进一步的实施方式中,所述药物组合物还包括一种或多种药学可接受的载体和/或稀释剂。在另一实施方式中,本公开内容涉及所述药物组合物用于治疗与ic-17c的不合意存在相关的疾病或病症的用途。在另一实施方式中,所述与il-17c的不合意存在相关的病症是炎性疾病或癌症。本公开内容的组合物优选为用于治疗炎性疾病或癌症的药物组合物,其包括本文公开的il-17c特异性抗体或抗体片段和药学可接受的载体、稀释剂或赋形剂。在另一实施方式中,本公开内容涉及预防受试者中的炎性疾病的方法,所述方法包括给予所述受试者il-17c拮抗剂。如本上下文所用,“预防”是指致力于防止疾病发作或延缓疾病发作的方法。在进一步的实施方式中,本公开内容涉及包括分离的il-17c特异性抗体或抗体片段的组合物用于治疗炎性疾病的用途,其中所述分离的抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述分离的抗体或抗体片段和一il-17c同型二聚体组成的复合物。在其他方面,本公开内容涉及il-17c特异性抗体或抗体片段在制备用于治疗炎性疾病的药物中的用途。在进一步的实施方式中,本公开内容涉及用于治疗受试者中的炎性疾病的方法,其包括给予受试者包括抗体或抗体片段的药物组合物,上述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述分离的抗体或抗体片段和一il-17c同型二聚体组成的复合物。在一些实施方式中,所述受试者是人。在另外可选的方面,所述受试者是啮齿类动物,例如大鼠或小鼠。在另一实施方式中,本公开内容涉及包括分离的il-17c特异性抗体或抗体片段的组合物用于治疗癌症的用途,其中所述分离的抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述分离的抗体或抗体片段和一il-17c同型二聚体组成的复合物。在进一步的实施方式中,本公开内容涉及用于治疗癌症的il-17c特异性抗体或抗体片段。在另一实施方式中,本公开内容涉及il-17c特异性抗体或抗体片段在制备用于治疗癌症的药物中的用途。在另一实施方式中,本公开内容涉及用于治疗受试者中的癌症的方法,其包括给予受试者包括抗体或抗体片段的药物组合物,上述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。在一些实施方式中,将本公开内容的il-17c特异性抗体或抗体片段皮下给药。在其他方面,将本公开内容的il-17c特异性抗体或抗体片段静脉内、关节内、或脊柱内给药。这些载体、稀释剂和赋形剂是本领域公知的,本领域技术人员将会找到最适合于用本公开内容的il-17c抗体或抗体片段治疗受试者的制剂和给药途径。在一实施方式中,本公开内容涉及包括表1中任意抗体的vh和vl的分离的单克隆抗体或其片段。在另一实施方式中,本公开内容涉及编码分离的单克隆抗体或其片段的核酸,其中该核酸包括表1中任意抗体的vh和vl。在一实施方式中,本公开内容涉及用于产生、识别或选择本文公开的抗体或抗体片段的方法,其中该方法包括以下步骤:(a)识别与il-17c特异性结合的抗体或抗体片段;(b)将抗原与步骤(a)中识别的抗体或抗体片段混合;(c)对通过步骤(b)得到的混合物进行尺寸排阻色谱(sec),并确定形成的复合物的分子量;和(d)选择抗体或抗体片段,该抗体或抗体片段形成由所述分离的抗体或抗体片段与一il-17c同型二聚体组成的复合物。在另一实施方式中,本公开内容涉及用于产生、识别或选择抗体或抗体片段的方法,其中所述抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物,其中上述方法包括以下步骤:(a)识别与il-17c特异性结合的抗体或抗体片段;(b)将抗原与步骤(a)中识别的抗体或抗体片段混合;(c)对通过步骤(b)得到的混合物进行尺寸排阻色谱(sec),并确定形成的复合物的分子量;和(d)选择抗体或抗体片段,该抗体或抗体片段形成由所述分离的抗体或抗体片段与一il-17c同型二聚体组成的复合物。在所公开方法的另一实施方式中,在步骤(b)中将所述抗原和抗体或抗体片段以等摩尔量混合。在进一步的实施方式中,所公开方法的步骤(d)是选择抗体或抗体片段,该抗体或抗体片段形成由所述抗体或抗体片段与一il-17c同型二聚体组成的复合物,其中所述复合物的分子量小于200kda。更具体地,步骤(d)是选择与il-17c同型二聚体形成复合物的抗体或抗体片段,其中所述形成的复合物中的至少50%的分子量小于200kda。在进一步的实施方式中,步骤(d)包括选择与il-17c同型二聚体形成复合物的抗体或抗体片段,其中所述形成的复合物中的至少50%、至少60%、至少70%、至少80%、至少90%或至少95%的分子量小于200kda。在另一实施方式中,本公开内容涉及能够与il-17c同型二聚体二价结合的抗体或抗体片段。在另一方面,抗体或抗体片段与il-17c同型二聚体二价结合,并能够形成由所述抗体或抗体片段和一il-17c同型二聚体组成的复合物。改造(engineered)和修饰的抗体本公开内容的抗体或抗体片段可以是修饰的抗体或抗体片段。在本公开内容的一实施方式中,修饰的抗体或抗体片段源自表1所示的抗体。因此,表1所示的抗体可以用作原料,以改造修饰的抗体。通过修饰一个或两个可变区(即vh和/或vl)内例如一个或多个cdr区内和/或一个或多个框架区内的一个或多个残基,可以对抗体进行改造。额外地或另外可选地,通过修饰恒定区内的残基,可以对抗体进行改造,例如,以改变抗体的效应子功能。通过对抗体进行改造或修饰,可以获得亲本克隆改善的变体。同时,本领域建立了多种技术以例如提高抗体的亲和力,降低抗体的免疫原性,和增加抗体的效应子功能。抗体主要通过位于6个重链和轻链互补决定区(cdr)中的氨基酸残基与目标抗原相互作用。因此,亲和力成熟包括修饰特定的cdr,以改变抗体的结合特性。亲和力成熟包括高变区内的定点诱变,并可以包括氨基酸替换、添加和缺失。另一类型的亲和力成熟包括将特定抗体中的特定cdr用各个cdr库完全取代。可以在标准抗原结合检定(例如elisa、facs、biacore、set分析)中分析其上修饰的抗体对各自抗原的提高的亲和力。(参见,例如,riechmann等人,(1998)nature332:323-327;jones等人,(1986)nature321:522-525;queen等人,(1989)proc.natl.acad.,u.s.a.86:10029-10033;winter的美国专利第5,225,539号和queen等人的美国专利第5,530,101、5,585,089、5,693,762和6,180,370号)。由于cdr序列负责大多数抗体-抗原相互作用,因此通过构建包括接枝在来自具有不同特性的不同抗体的框架序列上的来自特定天然出现抗体的cdr序列的表达载体,可以表达模拟特定天然出现抗体特性的重组抗体。这些框架序列可以获自包括种系抗体基因序列的公共dna数据库或公开参考文献。例如,来自人重链和轻链可变区基因的种系dna序列可以见于“vase”人种系序列数据库(可于www.mrc-cpe.cam.ac.uk/vbase获自互联网),以及kabat等人,(1991)sequencesofproteinsofimmunologicalinterest,第5版,美国卫生及公共服务部,nih公开第91-3242号;chothia等人,(1987)j.mol.biol.196:901-917;chothia等人,(1989)nature342:877-883;和al-lazikani等人,(1997)j.mol.biol.273:927-948;tomlinson等人,(1992)j.fol.biol.227:776-798;和cox等人,(1994)eur.jimmunol.24:827-836;在此明确地将其内容各自并入作为参考。双特异性分子和多价抗体在另一方面,本公开内容特征在于包括il-17c特异性抗原结合位点的双互补位(biparatopic)、双特异性、多特异性或多重特异性分子。另一方面,双特异性抗原结合分子选自双特异性-scfv、四价双特异性抗体、交联fab或双特异性igg。另一方面,本公开内容提供包括至少两个源自il-17c特异性抗体的抗原结合位点的多价化合物。另一方面,所述抗原结合位点可以经由蛋白质融合或共价或非共价键连接在一起。例如,通过将本公开内容的抗体与和本公开内容的抗体的恒定区例如fc或铰链区结合的抗体交联,可以获得四价化合物。三聚结构域描述于例如borean的专利ep1012280b1中。五聚模块描述于例如pct/ep97/05897中。本公开内容的抗体或其抗原结合区可以与另一功能分子例如另一肽或蛋白质(例如,另一抗体或受体配体)连接,以产生与至少两个不同的结合位点或目标分子结合的双特异性分子。为产生本公开内容的双特异性分子,可以将抗体与一种或多种其他结合分子例如另一抗体、抗体片段、肽或结合模拟物功能性连接(例如,通过化学偶联、基因融合、非共价缔合等),使得产生双特异性分子。使用本领域已知方法,通过缀合组成结合特异性,可以制备本公开内容的双特异性分子。例如,可以单独产生双特异性分子的各个结合特异性,然后彼此缀合。当结合特异性为蛋白质或肽时,可以使用多种偶联剂或交联剂用于二价缀合。交联剂的例子包括蛋白质a、碳二亚胺、n-琥珀酰亚胺基-s-乙酰基-硫代乙酸酯(sata)、5,5'-二硫代双(2-硝基苯甲酸)(dtnb)、o-苯撑双马来酰亚胺(opdm)、n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)和磺基琥珀酰亚胺基4-(n-马来酰亚胺甲基)环己烷-l-甲酸酯(磺基-smcc)(参见,例如,karpovsky等人,(1984)j.exp.med.160:1686;liu等人(1985)proc.natl.acad.sci.usa82:8648)。其他方法包括以下文献中所述者:paulus(1985)behringins.mitt.no.78:118-132;brennan等人,(1985)science229:81-83;和glennie等人,(1987)j.immunol.139:2367-2375。缀合剂为sata和磺基-smcc,二者均可获自piercechemicalco.(rockford,il)。当结合双特异性为抗体时,可以通过将两个重链c-端铰链区的巯基键合,将其缀合。在具体实施方式中,在缀合之前,将铰链区修饰成含有奇数个巯基残基,例如,1个。另外可选地,可以将两种结合特异性编码在相同载体中,并在相同宿主细胞中表达和组装。在双特异性分子为mabxmab、mabxfab、fabxf(ab')2或配体xfab融合蛋白质时,该方法特别有用。本公开内容的双特异性分子可以是包括一单链抗体和结合决定簇的单链分子,或者包括两个结合决定簇的单链双特异性分子。双特异性分子可以包括至少两种单链分子。制备双特异性分子的方法描述于例如以下文献中:美国专利第5,260,203号;美国专利第5,455,030号;美国专利第4,881,175号;美国专利第5,132,405号;美国专利第5,091,513号;美国专利第5,476,786号;美国专利第5,013,653号;美国专利第5,258,498号;和美国专利第5,482,858号。通过在一抗体内结合两种或更多种抗原,可以提供进一步的临床有益效果(morrison等人,(1997)naturebiotech.15:159-163;alt等人(1999)febsletters454:90-94;zuo等人,(2000)proteinengineering13:361-367;lu等人,(2004)jbc279:2856-2865;lu等人,(2005)jbc280:19665-19672;marvin等人,(2005)actapharmacologicasinica26:649-658;marvin等人,(2006)curropindrugdiscdevelop9:184-193;shen等人,(2007)jimmunmethods218:65-74;wu等人,(2007)natbiotechnol.11:1290-1297;dimasi等人,(2009)jmolbiol.393:672-692;和michaelson等人,(2009)mabs1:128-141)。例如,通过酶联免疫吸附检定(elisa)、放射性免疫检定(rea)、facs分析、生物检定(例如,生长抑制)或蛋白质印迹检定,可以确认双特异性或交叉反应性分子与其特定目标的结合。这些检定各自通常通过使用对所关注复合物有特异性的标记试剂(例如抗体),检测所具体关注的抗原-抗体复合物的存在。支架(scaffolds)可以根据本公开内容使用包括“抗原结合位点”的其他抗体/免疫球蛋白框架或支架。其包括基于非免疫球蛋白的抗体和可以在其上接枝本公开内容的cdr的支架。纤连蛋白支架基于iii型纤连蛋白结构域(例如,iii型纤连蛋白的第10模块(10fn3结构域))。iii型纤连蛋白结构域具有分布在两个β折叠之间的7或8个β链,其自身彼此堆叠,形成蛋白质核心,且还含有将β链彼此连接且暴露于溶剂的环(类似于cdr)。在β折叠夹心结构的每个边缘处具有至少3个这样的环,其中边缘是垂直于β链方向的蛋白质的边缘(参见us6,818,418)。尽管整体折叠与最小功能抗体片段重链可变区紧密相关,其包括骆驼和lamaigg中整个抗原识别单元,但这些基于纤连蛋白的支架不是免疫球蛋白。由于该结构,非免疫球蛋白抗体模拟在自然界类似的抗原结合特性和与这些抗体的亲和力。这些支架可以用于体外的环随机化和洗牌(shuffling)策略,类似于体内的抗体亲和力成熟方法。这些基于纤连蛋白的分子可以用作支架,其中可以使用标准克隆技术将分子的环区用本公开内容的cdr取代。获自包括新世界成员例如驼马(llama)种(lamapaccos、lamaglama和lamavicugna)的骆驼和单峰骆驼(camelusbactrianus和calelusdromaderius)家族成员的骆驼科抗体蛋白质已经在大小、结构复杂性和人受试体免疫原性方面加以表征。来自该哺乳动物家族的某些igg抗体在自然界发现时缺少轻链,因此在结构上与来自其他动物的抗体的具有两个重链和两个轻链的典型四链四级结构不同。参见wo1994/04678。锚蛋白技术基于使用具有源自锚蛋白的重复模块的蛋白质作为支架,用于携带可以用于结合不同目标的可变区。锚蛋白重复模块是由两个反平行的α-螺旋和β-转角组成的33个氨基酸的多肽。可变区的结合主要通过使用核糖体展示进行优化。avimer来自天然a-结构域。这些结构域天然地用于蛋白-蛋白相互作用,在人中有250种以上蛋白质在结构上是基于a-结构域的。avimer由多个不同的经由氨基酸连接部分连接的“a-结构域”单体(2-10)组成。使用例如以下文献中所述的方法学,可以产生可以与目标抗原结合的avimer:美国专利申请公开第20040175756、20050053973、20050048512和20060008844号。亲合体(affibody)亲和力配体是由基于蛋白质a的igg-结合结构域之一的支架的三螺旋束组成的简单小蛋白质。蛋白质a是来自细菌金黄色葡萄球菌(staphylococcusaureus)的表面蛋白质。该支架结构域由58个氨基酸组成,其中13个氨基酸是随机的,产生具有大量配体变体的亲合体库(参见,例如,us5,831,012)。亲合体分子模拟抗体;与抗体分子量150kda比较,其分子量为6kda。尽管其尺寸小,亲合体分子的结合位点与抗体类似。anticalins是pierisproteolabag公司开发的产品。其源自脂质运载蛋白——一类广泛的强壮的小蛋白质,其通常涉及化学敏感性或不溶性化合物的生理传输或存储。在人的组织或体液中发现若干种天然的脂质运载蛋白。蛋白质架构联想到免疫球蛋白,在刚性框架的顶部具有高变区。但是,与抗体或其重组片段相反,脂质运载蛋白由具有160-180个氨基酸残基的单个多肽链组成,仅略大于单个免疫球蛋白结构域。一组四个环构成结合袋状结构,显示出显著的结构可塑性,并容许有许多种侧链。因此,结合位点可以以专有方法改造,以便以高亲合力和特异性识别指定的不同形状的靶标分子。通过对该组四个环加以诱变,已经使用欧洲粉蝶(pierisbrassicae)的胆汁三烯结合蛋白质(bbp)——脂质运载蛋白家族的一种蛋白质来开发anticalins。说明anticalins的专利申请的一个例子见于pct公开第w01999/16873号。affilin分子是小的非免疫球蛋白蛋白质,其设计用于针对蛋白质和小分子具有特异性亲和力。可以自两个文库非常迅速地选择新的affilin分子,上述文库均基于不同的人源支架蛋白质。affilin分子不显示出任何与免疫球蛋白蛋白质的结构同源性。目前,使用两种affilin支架,其一是γ结晶——人眼结构晶状体蛋白质,另一种是“泛素”超家族蛋白质。两种人支架均很小,表现出高的温度稳定性,并几乎耐受ph变化和变性剂。这种高度的稳定性主要是因为蛋白质扩展的β折叠结构。源自γ结晶的蛋白质的例子描述于wo2001/04144中,“泛素样”蛋白质的例子描述于wo2004/106368中。蛋白质表位模拟物(pem)是中等大小的肽样环状分子(mw1-2kda),其模拟β-发卡式蛋白质二级结构——参与蛋白质-蛋白质相互作用的主要二级结构。抗体的产生(i)编码抗体的核酸本公开内容提供基本上纯化的核酸分子,其编码包括上述抗体链片段或结构域的多肽。在具体实施方式中,核酸分子是表1中所识别者。本公开内容的一些其他核酸分子包括与表1所识别的核酸分子的核苷酸序列基本上同一(例如,至少65%、80%、85%、90%、95%或99%)的核苷酸序列。将上述核酸亚克隆到常规且合适的表达载体中,所述表达载体在适当表达系统中的表达产生与il-17c特异性结合的由这些多核苷酸编码的多肽。本公开内容还提供多核苷酸,其编码来自上述抗体重链或轻链的至少一个cdr区,通常为所有三个cdr区。一些其他的多核苷酸编码上述抗体的重链和/或轻链的所有或基本上所有的可变区序列。由于遗传密码的组成,许多种核酸序列将会编码各个免疫球蛋白氨基酸序列。通过从头固相dna合成,或者通过对编码il-17c特异性抗体或其结合片段的现有序列(例如,以下实施例中所述的序列)进行pcr诱变,可以产生多核苷酸序列。核酸的直接化学合成可以通过本领域已知方法完成,例如narang等人,(1979)meth.enzymol.68:90的磷酸三酯法;brown等人,(1979)meth.enzymol.68:109的磷酸二酯法;beaucage等人,(1981)tetra.lett.,22:1859的二乙基亚磷酰胺法;和美国专利第4,458,066号的固相载体法。通过pcr向多核苷酸序列中引入突变可以如以下文献所述进行:例如,pcrtechnology:principlesandapplicationsfordnaamplification,h.a.erlich(ed.),freemanpress,ny,ny,1992;pcrprotocols:aguidetomethodsandapplications,innisetal.(ed.),academicpress,sandiego,ca,1990;mattila等人,(1991)nucleicacidsres.19:967;和eckert等人,(1991)pcrmethodsandapplications1:17。本公开内容另外提供用于产生上述抗体或抗体片段的表达载体和宿主细胞。可以使用许多种表达载体来表达编码il-17c特异性抗体链或结合片段的多核苷酸。可以使用基于病毒的和非病毒的表达载体在哺乳动物宿主细胞中产生抗体。非病毒载体和系统包括质粒,附加型载体,通常具有用于表达蛋白质或rna的表达组件,和人的人工染色体(参见,例如,harrington等人,(1997)natgenet15:345)。例如,可用于在哺乳动物(例如人)细胞中表达多核苷酸和多肽的非病毒载体包括pthiohisa,b&c、pcdna3.1/his、pebvhisa,b&c(invitrogen,sandiego,ca)、mpsv载体和大量本领域已知的用于表达其他蛋白质的其他载体。可用的病毒载体包括基于逆转录病毒、腺病毒、腺相关病毒、疱疹病毒的载体,基于sv40、乳头瘤病毒、hbpepsteinbarr病毒、牛痘病毒载体和塞姆利基森林病毒(sfv)的载体。参见,brent等人,(1995)annu.rev.microbiol.49:807;和rosenfeld等人,(1992)cell68:143。表达载体的选择取决于将要在其中表达载体的预期宿主细胞。典型地,表达载体含有与编码抗体链或片段的多核苷酸可操作连接的启动子和其他调节序列(例如增强子)。在一些实施方式中,使用诱导型启动子,以防止在诱导条件以外表达插入的序列。诱导型启动子包括,例如,阿拉伯糖、lacz、金属硫蛋白启动子或热休克启动子。转化的有机体的培养物可以在非诱导条件下扩展,不偏向其表达产物被宿主细胞更好地耐受的编码序列的群体。除启动子以外,还可以要求或需要其他的调节元件,用以高效表达抗体链或片段。这些元件通常包括atg起始密码子和相邻的核糖体结合位点或其他序列。此外,通过包括适合于所用细胞系统的增强子,可以提高表达效率(参见,例如,scharf等人,(1994)resultsprobl.celldiffer.20:125;和bittner等人,(1987)meth.enzymol.,153:516)。例如,可以使用sv40增强子或cmv增强子,以增加哺乳动物宿主细胞中的表达。表达载体还可以提供分泌信号序列位置,以便与由插入的抗体序列编码的多肽形成融合蛋白质。更常见地,在包括在载体中之前,将插入的抗体序列与信号序列连接。将要用于接收编码抗体轻链和重链可变结构域的序列的载体还可以编码恒定区或其部分。这样的载体使得可以将可变区表达为与恒定区的融合蛋白质,从而导致产生完整的抗体或抗体片段。通常,这些恒定区是人的。用于带有并表达抗体链的宿主细胞可以是原核细胞或真核细胞。大肠杆菌(e.coli)是一种可用于克隆并表达本公开内容的多核苷酸的原核宿主。其他适合使用的微生物宿主包括芽孢杆菌,例如枯草芽孢杆菌(bacillussubtilis),和其他肠杆菌科,例如沙门氏菌(salmonella)、沙雷氏菌(serratia)和各种假单胞菌(pseudomonas)物种。在这些原核宿主中,也可以产生表达载体,其通常含有与宿主细胞相容的表达控制序列(例如,复制起源)。此外,将会存在有任意数目的多种公知的启动子,例如乳糖启动子系统、色氨酸(trp)启动子系统、β-内酰胺酶启动子系统或来自噬菌体λ的启动子系统。启动子通常任选地与操作子序列一起控制表达,并具有核糖体结合位点序列等,用于引发和完成转录和翻译。也可以使用其他的微生物例如酵母来表达本公开内容的多肽。也可以与杆状病毒载体结合使用昆虫细胞。在一些优选实施方式中,使用哺乳动物宿主细胞表达和产生本公开内容的il-17c特异性抗体或抗体片段。例如,它们可以是表达内源性免疫球蛋白基因的杂交瘤细胞系。优选地,使用带有外源性表达载体的哺乳动物细胞系,包括任何正常的致死或者正常或异常的永生动物或人细胞(例如,sp2/0骨髓瘤细胞、cho细胞、hela细胞、per.c6细胞、cos细胞、hkb11细胞、ns0细胞)。例如,已经开发出多种能够分泌完整免疫球蛋白的适当宿主细胞系,包括cho细胞系、各种cos细胞系、hela细胞、骨髓瘤细胞系、转化的b-细胞和杂交瘤。使用哺乳动物组织细胞培养物表达多肽通常讨论于,例如,winnacker,fromgenestoclones,vchpublishers,n.y.,n.y.,1987。哺乳动物宿主细胞表达载体可以包括表达控制序列,例如复制起源、启动子和增强子(参见,例如,queen等人,(1986)immunol.rev.89:49-68)和必要的加工信息位点,例如核糖体结合位点、rna剪接位点、聚腺苷酸化位点和转录终止子序列。这些表达载体通常含有源自哺乳动物基因或源自哺乳动物病毒的启动子。合适的启动子可以是组成型、细胞类型特异性、阶段特异性和/或可调控或可调节的。可用的启动子包括,但不限于,金属硫蛋白启动子、组成型腺病毒主要晚期启动子、地塞米松诱导型mmtv启动子、sv40启动子、mrppollll启动子、组成型mpsv启动子、四环素诱导型cmv启动子(例如人即刻-早期cmv启动子)、组成型cmv启动子和本领域已知的启动子-增强子组合。用于引入含有所关注多核苷酸序列的表达载体的方法取决于细胞宿主的类型而变化。例如,对于原核细胞常使用氯化钙转染,而对于其他细胞宿主可以使用磷酸钙处理或电穿孔。(通常参见sambrook等人,同上)。其他方法包括,例如,电穿孔、磷酸钙处理、脂质体介导的转化、注射和微注射、冲击(ballistic)方法、病毒体、免疫脂质体、聚阳离子核酸缀合物、裸dna、人工病毒体、与疱疹病毒结构蛋白质vp22融合(elliot和o'hare,(1997)cell88:223)、药剂提高的dna摄取和离体转导。对于重组蛋白质的长期、高产率产生,常期望稳定的表达。(ii)单克隆抗体的产生可以通过许多种技术产生单克隆抗体(mabs),包括常规的单克隆抗体方法学,例如,kohler和milstein,(1975)nature256:495的标准体细胞杂交技术。可以采用许多用于产生单克隆抗体的技术,例如,b淋巴细胞的病毒或致癌性转化。用于制备杂交瘤的动物系统是鼠科动物系统。小鼠中的杂交瘤产生是成熟的方法。分离免疫化脾细胞用于融合的免疫化方案和技术是本领域公知的。融合配偶体(例如,鼠科动物骨髓瘤细胞)和融合方法也是已知的。本公开内容的嵌合或人源化抗体可以基于上述制备的鼠科动物单克隆抗体的序列制备。编码重链和轻链免疫球蛋白的dna可以获自关注的鼠科动物杂交瘤,并使用标准分子生物学技术改造成含有非鼠科动物(例如人)免疫球蛋白序列。例如,为了产生嵌合抗体,可以使用本领域已知的方法将鼠科动物可变区与人恒定区连接(参见,例如,cabilly等人的美国专利第4,816,567号)。为了产生人源化抗体,可以使用本领域已知的方法将鼠科动物cdr区插入到人框架中。参见,例如,winter等人的美国专利第5225539号和queen等人的美国专利第5530101、5585089、5693762号)。在某些实施方式中,本公开内容的抗体是人单克隆抗体。这些人单克隆抗体可以使用携带部分人免疫系统而不是小鼠系统的转基因或转染色体小鼠产生。这些转基因和转染色体小鼠包括分别称作humab小鼠和km小鼠的小鼠,在本文中统称作“人ig小鼠”。humab(medarex,inc.)含有编码未重排的人重链(μ和γ)和κ轻链免疫球蛋白序列的人免疫球蛋白基因微基因座(miniloci),以及使内源性μ和κ链基因座失活的靶向突变(参见,例如,lonberg等人,(1994)nature368(6474):856-859)。因此,小鼠表现出降低的小鼠igm或κ的表达,并且响应于免疫化,引入的人重链和轻链转基因经历类别转换和体细胞突变,产生高亲合力的人iggκ单克隆(lonberg等人(1994)handbookofexperimentalpharmacology113:49-101;lonberg和huszar,(1995)intern.rev.immunol.13:65-93;和harding和lonberg,(1995)ann.n.y.acad.sci.764:536-546)。humab小鼠的制备和使用以及通过这些小鼠进行的基因组修饰进一步描述于taylor等人,(1992)nucleicacidsresearch20:6287-6295;chen等人,(1993)internationalimmunology5:647-656;tuaillon等人,(1993)proc.natl.acad.sci.usa94:3720-3724;choi等人,(1993)naturegenetics4:117-123;chen等人,(1993)emboj.12:821-830;tuaillon等人,(1994)j.immunol.152:2912-2920;taylor等人,(1994)internationalimmunology579-591;和fishwild等人,(1996)naturebiotechnology14:845-851,在此明确将其全部内容均全文并入作为参考。进一步参见,均为lonberg和kay的美国专利第5,545,806、5,569,825、5,625,126、5,633,425、5,789,650、5,877,397、5,661,016、5,814,318、5,874,299号和5,770,429;以及surani等人的美国专利第5,545,807号;均为lonberg和kay的pct公开第wo1992/103918、wo1993/12227、wo1994/25585、wo1997/113852、wo1998/24884号和wo1999/45962;和pct公开第wo2001/14424号。在另一实施方式中,本公开内容的人抗体可以使用在转基因和转染色体上携带人免疫球蛋白序列的小鼠产生,例如携带人重链转基因和人轻链转染色体的小鼠。这样的小鼠在本文中称作“km小鼠”,并详细描述于ishida等人的pct公开wo2002/43478中。再进一步,可以使用另外可选的转基因动物系统,例如转基因鼠(xenomouse)(abgenix,inc.)。这样的小鼠描述于,例如,kucherlapati等人的美国专利第5,939,598、6,075,181、6,114,598、6,150,584和6,162,963号中。而且,表达人免疫球蛋白基因的另外可选的转染色体动物系统在本领域是可获得的,并可用于产生本公开内容的抗体。例如,可以使用携带人重链转染色体和人轻链转染色体的称作“tc小鼠”的小鼠;这样的小鼠描述于tomizuka等人,(2000)proc.natl.acad.sci.usa97:722-727中。而且,本领域中已经说明了携带人重链和轻链转染色体的牛(kuroiwa等人,(2002)naturebiotechnology20:889-894),其可以用于产生本公开内容的抗体。优选地,本公开内容的人单克隆抗体还可以使用筛选人免疫球蛋白基因库的噬菌体展示方法制备。这些用于分离人抗体的噬菌体展示方法在本领域中是成熟的,或者描述于以下实施例中。参见,例如:ladner等人的美国专利第5,223,409、5,403,484和5,571,698号;dower等人的美国专利第5,427,908和5,580,717号;mccafferty等人的美国专利第5,969,108和6,172,197号;以及griffiths等人的美国专利第5,885,793、6,521,404、6,544,731、6,555,313、6,582,915和6,593,081号。本公开内容的人单克隆抗体还可以使用筛选人免疫球蛋白基因库的核糖体展示、m-rna展示、细菌展示和酵母展示方法制备。通常,展示人抗体库的真核细胞是本领域中标准的(参见,plückthun,a.(1997)proc.natl.acad.sci.u.s.a.94(10):4937-42;lipovsek等人(2004)imm.methods290(1-2):51-67;he等人(2007)nature4(3):281-288;gold等人(2001)procnatlacadsciusa98(9):4825-6;fukudai,kojohk,tabatan等人(2006)nucleicacidsres.34(19):e127;francisco等人(1993)proc.nat.acad.sci.u.s.a.90:10444-48;georgiou等人(1997)nat.biotech.15(1):29-34;boder等人(2000)procnatacadsci,97(20):10701-10705;weaver-feldhaus等人(2004)febsletters564(1-2):24-34)。本公开内容的人单克隆抗体还可以使用其中已经重构人免疫细胞使得可以在免疫化时产生人抗体响应的scid小鼠制备。这样的小鼠描述于,例如,wilson等人的美国专利第5,476,996和5,698,767号中。(iii)框架或fc改造一种类型的框架修饰涉及到对框架区内或者甚至一个或多个cdr区内的一个或多个残基进行突变,以除去t细胞-表位,从而降低抗体的潜在免疫原性。该方法也称作“去免疫化(deimmunization)”,进一步详述于carr等人的美国专利公开第20030153043号中。除框架区或cdr区内进行的修饰以外,或者另外可选地,可以对本公开内容的抗体进行改造,以在fc区内包括修饰,通常以改变抗体的一种或多种功能特性,例如血清半衰期、补体固定、fc受体结合和/或依赖于抗原的细胞的细胞毒性。而且,本公开内容的抗体可以进行化学修饰(例如,可以在抗体上连接一个或多个化学部分),或修饰成改变其糖基化,再次改变抗体的一种或多种功能特性。这些实施例各自均在下文中进一步详述。在一实施方式中,对ch1的铰链区进行修饰,使得铰链区中的半胱氨酸残基的数目被改变,例如,增加或减少。该方法进一步描述于bodmer等人的美国专利第5,677,425号中。改变ch1铰链区中半胱氨酸残基的数目,例如,以促进轻链和重链的组装,或者增加或降低抗体的稳定性。在另一实施方式中,对抗体的fc铰链区进行突变,以降低抗体的生物半衰期。更具体地,将一个或多个氨基酸突变引入到fc-铰链片段的ch2-ch3结构域界面区中,使得抗体的葡萄球菌蛋白质a(spa)结合相对于天然fc-铰链结构域spa结合而言受损。该方法进一步详述于ward等人的美国专利第6,165,745号中。在再另一实施方式中,通过将至少一个氨基酸残基用不同的氨基酸残基取代对fc区进行变化,以改变抗体的效应子功能。例如,可以将一个或多个氨基酸用不同的氨基酸残基取代,使得抗体对于效应子配体的亲和力改变,但保留亲本抗体的抗原结合能力。对于其亲和力改变的效应子配体可以是,例如,fc受体或补体的c1组分。对应的修饰的同种型版本在科学界已知为igglflala。如上文已经提到,该方法进一步详述于winter等人的美国专利第5,624,821和5,648,260号中。在另一实施方式中,可以将选自氨基酸残基的一个或多个氨基酸用不同的氨基酸残基取代,使得抗体具有改变的c1q结合,和/或降低或废除的补体依赖性细胞毒性(cdc)。该方法进一步详述于idusogie等人的美国专利第6,194,551号中。在另一实施方式中,改变一个或多个氨基酸残基,从而改变抗体固定补体的能力。该方法进一步描述于bodmer等人的pct公开wo1994/29351中。在再另一实施方式中,通过修饰一个或多个氨基酸对fc区进行修饰,以增加抗体介导抗体依赖性细胞的细胞毒性(adcc)的能力,和/或增加抗体对fcγ受体的亲和力。该方法进一步描述于presta的pct公开wo2000/42072中。而且,已经对人igg1上的fcγri、fcγrii,fcγriii和fcrn结合位点进行作图,且已描述结合提高的变体(参见shields等人,(2001)j.biol.chem.276:6591-6604)。在再另一实施方式中,对抗体的糖基化进行修饰。例如,可以产生无糖基化(aglycosylated)抗体(即,抗体缺乏糖基化)。糖基化可以进行改变,例如,以增加抗体对“抗原”的亲和力。这些碳水化合物修饰可以通过,例如,改变抗体序列内的一个或多个糖基化位点而完成。例如,可以进行导致一个或多个可变区框架糖基化位点消除的一个或多个氨基酸替换,从而在该位点处消除糖基化。这样的无糖基化可以增加抗体对抗原的亲和力。该方法进一步详述于co等人的美国专利第5,714,350和6,350,861号中。此外或者另外可选地,可以产生糖基化类型改变的抗体,例如盐藻糖基残基的量降低的低盐藻糖基化(hypofucosylated)抗体或平分型glcnac结构增加的抗体。这些改变的糖基化模式经证明增加抗体的adcc能力。这些碳水化合物修饰可以通过例如在糖基化机制改变的宿主细胞中表达抗体而完成。糖基化机制改变的细胞在本领域中已得以说明,并可以用作其中表达本公开内容的重组抗体的宿主细胞,从而产生糖基化改变的抗体。例如,hang等人的ep1,176,195说明了具有功能上破坏的fut8基因的细胞系,该基因编码盐藻糖基转移酶,使得该细胞系中表达的抗体表现出低盐藻糖基化。presta的pct公开wo2003/035835说明了变体cho细胞系、lecl3细胞,其将岩藻糖与asn(297)-连接的碳水化合物连接的能力降低,从而也导致该宿主细胞中表达的抗体的低盐藻糖基化(另外参见shields等人,(2002)j.biol.chem.277:26733-26740)。umana等人的pct公开wo1999/54342说明了改造成表达糖蛋白修饰糖基转移酶(例如,β(1,4)-n乙酰基葡糖氨基-转移酶iii(gntiii))的细胞系,使得改造的细胞系中表达的抗体表现出增加的平分型glcnac结构,其导致抗体的adcc活性增加(另外参见umana等人,(1999)nat.biotech.17:176-180)。在另一实施方式中,对抗体进行修饰,以增加其生物半衰期。可以使用许多种方法。例如,可以引入一种或多种以下突变:t252l、t254s和t256f,如ward的美国专利第6,277,375号中所述。另外可选地,为了增加生物半衰期,抗体可以在ch1或cl区内加以变化,以含有来自igg的fc区的ch2结构域的两个环的挽救受体(salvagereceptor)结合表位,如presta等人的美国专利第5,869,046和6,121,022号中所述。药物组合物在一些方面,本公开内容涉及包括分离的il-17c特异性抗体或抗体片段的组合物,其中所述分离的抗体或抗体片段与il-17c同型二聚体二价结合,并形成由所述分离的抗体或抗体片段与一il-17c同型二聚体组成的复合物。在进一步的方面,所述组合物是药物组合物。在进一步的方面,所述药物组合物用于治疗疾病。本公开内容的药物组合物可以通过许多种本领域已知的方法给药。给药途径和/或方式取决于所需的结果而变化。优选地,为静脉内、肌内、腹膜内或皮下给药,或者给予目标部位附近。药学可接受的载体应当适合于静脉内、肌内、皮下、肠胃外、脊髓或表皮给药(例如,通过注射或输注)。取决于给药途径,可以将活性化合物即抗体、抗体片段、双特异性和多特异性分子涂覆在材料中,以保护化合物不受酸和其他可能使化合物失活的天然条件的作用。药学可接受的载体提高或稳定组合物,或者有利于组合物的制备。药学可接受的载体包括生理学相容的溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等张吸收延迟剂等。组合物应当是无菌的流体。例如,通过使用包衣例如卵磷脂,在分散剂的情况下通过保持所需的粒径,通过使用表面活性剂,可以保持适当的流动性。在许多情形中,在组合物中优选地包括等渗剂,例如,糖、多元醇例如甘露醇或山梨糖醇和氯化钠。可注射组合物的长期吸收可以通过在组合物中包括延迟吸收的药剂例如单硬脂酸铝或明胶来实现。本公开内容的药物组合物可以根据本领域公知并且常规实施的方法制备。参见,例如,remington:thescienceandpracticeofpharmacy,mackpublishingco.,20thed.,2000;和sustainedandcontrolledreleasedrugdeliverysystems,j.r.robinson,ed.,marceldekker,inc.,newyork,1978。药物组合物优选地在gmp条件下制造。典型地,在本公开内容的药物组合物中使用治疗有效(effective)剂量或有效(efficacious)剂量的il-17c抗体或抗体片段。可以通过本领域技术人员已知的常规方法将抗体或抗体片段配置成药学可接受的剂型。对剂量方案进行调节,以提供最优的所需响应(例如,治疗响应)。例如,可以给予单一推注(bolus),可以随着时间给予若干分剂量,或者可以如治疗状况的紧急性所指示按比例地降低或增加剂量。特别有利的是,将肠胃外组合物配制成易于给药和剂量均匀性的单位剂型。如本文所述,单位剂型是指适合作为用于将要治疗的受试者的单一剂量的物理上分离的单位;每个单位含有计算出与所需药物载体结合产生期望治疗效果的预定量的活性化合物。本公开内容的药物组合物中活性成分的实际剂量水平可以变化,以在对患者没有毒性的情况下,得到针对具体患者、组合物和给药方式可有效实现期望的治疗反应的活性成分的量。选择的剂量水平取决于许多种药代动力学因素,包括使用的本公开内容的具体组合物或其酯、盐或酰胺的活性、给药途径、给药时间、使用的具体化合物的排泄速率、治疗持续时间、与使用的具体组合物结合使用的其他药物、化合物和/或材料、被治疗的患者的年龄、性别、体重、状况、总体健康和之前的医疗史以及类似因素。医生和兽医可以以低于实现期望治疗效果所需的水平开始药物组合物中使用的本公开内容的抗体的剂量,并逐渐增加剂量,直至达到期望效果。通常,对于本文所述的变应性炎性疾病的治疗,本公开内容的组合物的有效剂量取决于许多不同的因素而变化,包括给药方式、目标部位、患者的生理状态、患者是人还是动物、给予的其他药物以及治疗是预防性还是治疗性的。治疗剂量需要加以滴定,以对安全性和效力进行优化。对于用抗体全身给药,剂量范围为宿主体重的大约0.0001-100mg/kg,更通常为0.01-15mg/kg。示例性的治疗方案要求每两周给药一次,或者一个月一次,或者每3-6个月一次。对于用抗体玻璃体内给药,剂量范围为大约0.0001至大约10mg。示例性的治疗方案要求每两周全身给药一次,或者一个月一次,或者每3-6个月一次。本公开内容的抗体或抗体片段通常在多种情形中给药。单一剂量之间的间隔可以是周、月或年。在一些全身给药的方法中,剂量可以调节成达到1-1000μg/ml的血浆抗体浓度,在一些方法中为25-500μg/ml。另外可选地,抗体或抗体片段可以作为缓释制剂给药,在该情形中要求的给药频率更低。剂量和频率取决于患者中抗原结合部分的半衰期而变化。通常,比起嵌合抗体和非人抗体,人和人源化抗体显示出更长的半衰期。给药的剂量和频率可以取决于治疗是预防性还是治疗性而变化。在预防性应用中,在长时间内以频率相对低的间隔给予相对低的剂量。一些患者在其余生中持续接收治疗。在治疗性应用中,有时需要以相对短的间隔相对高的剂量,直至疾病进展减少或终止,优选地直至患者表现出疾病症状的部分或完全改善。之后,患者可以给予预防性方案。为了制备包括抗体或抗体片段的药物或无菌组合物,将抗体或抗体片段与药学可接受的载体或赋形剂混合。基于摩尔/kg体重,抗体或抗体片段的所需剂量大约与抗体或多肽的相同。基于摩尔/kg体重,所需的抗体或抗体片段的血浆浓度为大约。剂量可以是至少15μg,至少20μg,至少25μg、至少30μg、至少35μg、至少40μg、至少45μg、至少50μg、至少55μg、至少60μg、至少65μg、至少70μg、至少75μg、至少80μg、至少85μg、至少90μg、至少95μg或者至少100μg。给予受试者的剂量可以为数量至少1、2、3、4、5、6、7、8、9、10、11或12或更多。对于本公开内容的抗体或抗体片段,给予患者的剂量可以是患者体重的0.0001mg/kg至100mg/kg。剂量可以是患者体重的0.0001mg/kg至20mg/kg、0.0001mg/kg至10mg/kg、0.0001mg/kg至5mg/kg、0.0001至2mg/kg、0.0001至1mg/kg、0.0001mg/kg至0.75mg/kg、0.0001mg/kg至0.5mg/kg、0.0001mg/kg至0.25mg/kg、0.0001至0.15mg/kg、0.0001至0.10mg/kg、0.001至0.5mg/kg、0.01至0.25mg/kg或者0.01至0.10mg/kg。本公开内容的抗体或抗体片段的剂量可以使用以千克(kg)为单位的患者体重乘以以mg/kg为单位的给药剂量计算。本公开内容的抗体或抗体片段的剂量可以是患者体重的150μg/kg或更低、125μg/kg或更低、100μg/kg或更低、95μg/kg或更低、90μg/kg或更低、85μg/kg或更低、80μg/kg或更低、75μg/kg或更低、70μg/kg或更低、65μg/kg或更低、60μg/kg或更低、55μg/kg或更低、50μg/kg或更低、45μg/kg或更低、40μg/kg或更低、35μg/kg或更低、30μg/kg或更低、25μg/kg或更低、20μg/kg或更低、15μg/kg或更低、10μg/kg或更低、5μg/kg或更低、2.5μg/kg或更低、2μg/kg或更低、1.5μg/kg或更低、1μg/kg或更低、0.5μg/kg或更低或者0.5μg/kg或更低。本公开内容的抗体或抗体片段的单位剂量可以是0.1mg至20mg、0.1mg至15mg、0.1mg至12mg、0.1mg至10mg、0.1mg至8mg、0.1mg至7mg、0.1mg至5mg、0.1至2.5mg、0.25mg至20mg、0.25至15mg、0.25至12mg、0.25至10mg、0.25至8mg、0.25mg至7mg、0.25mg至5mg、0.5mg至2.5mg、1mg至20mg、1mg至15mg、1mg至12mg、1mg至10mg、1mg至8mg、1mg至7mg、1mg至5mg或者1mg至2.5mg。本公开内容的抗体或抗体片段的剂量可以重复,给药可以分开至少1天、2天、3天、5天、10天、15天、30天、45天、2个月、75天、3个月或至少6个月。对于具体患者来说的有效量可以取决于多种因素而变化,例如要治疗的病症、患者的总体健康、给药的方法途径和剂量以及副作用的严重程度(参见,例如,maynard等人(1996)ahandbookofsopsforgoodclinicalpractice,interpharmpress,bocaraton,fla.;dent(2001)goodlaboratoryandgoodclinicalpractice,london,uk)。给药途径可以是,例如,通过局部或皮肤涂敷,通过静脉内、腹膜内、大脑内、肌内、眼内、动脉内、脑脊髓内、病灶内注射或输注,或者通过缓释系统或植入物(参见,例如,sidman等人(1983)biopolymers22:547-556;langer等人(1981)j.biomed.mater.res.15:167-277;langer(1982)chem.tech.12:98-105;epstein等人(1985)proc.natl.acad.sci.usa82:3688-3692;hwang等人(1980)proc.natl.acad.sci.usa77:4030-4034;美国专利第6,350,466和6,316,024号)。如果必要的话,组合物还可以包括增溶剂和局部麻醉剂例如利多卡因,以减轻注射位点处的疼痛。此外,例如,通过使用吸入器或雾化器,并用雾化剂配制,还可以使用肺部给药。参见,例如,美国专利第6,019,968、5,985,320、5,985,309、5,934,272、5,874,064、5,855,913、5,290,540和4,880,078号;和pct公开第wo1992/19244、wo1997/32572、wo1997/44013、wo1998/31346和wo1999/66903号,在此将其各自全文并入作为参考。本公开内容的组合物还可以使用本领域已知的许多种方法中的一种或多种经由一种或多种给药途径给药。本领域技术人员将会认识到,给药途径和/或方式将会取决于期望的结果而变化。选择的本公开内容的抗体或抗体片段的给药途径包括静脉内、肌内、皮内、腹膜内、皮下、脊髓或其他的肠胃外给药途径,例如,通过注射或输注。肠胃外给药可以代表肠内和局部给药以外的给药方式,通常是通过注射,其包括,但不限于,静脉内、肌内、动脉内、鞘内、囊内、眶内、心脏内、皮内、腹膜内、经气管、皮下、角质层下、关节内、囊下、蛛网膜下、脊柱内、硬脑膜外和胸骨内注射和输注。另外可选地,本公开内容的组合物可以经由非肠胃外途径给药,例如,局部、表皮或粘膜给药途径,例如,鼻内、口服、阴道、直肠、舌下或局部给药途径。可以与本公开内容的抗体或抗体片段联合给予的额外的疗法(例如预防剂或治疗剂)可以与本公开内容的抗体或抗体片段间隔小于5分钟、间隔小于30分钟、间隔1小时、间隔大约1小时、间隔大约1至大约2小时、间隔大约2小时至大约3小时、间隔大约3小时至大约4小时、间隔大约4小时至大约5小时、间隔大约5小时至大约6小时、间隔大约6小时至大约7小时、间隔大约7小时至大约8小时、间隔大约8小时至大约9小时、间隔大约9小时至大约10小时、间隔大约10小时至大于11小时、间隔大约11小时至大约12小时、间隔大约12小时至18小时、间隔18小时至24小时、间隔24小时至36小时、间隔36小时至48小时、间隔48小时至52小时、间隔52小时至60小时、间隔60小时至72小时、间隔72小时至84小时、间隔84小时至96小时或者间隔96小时至120小时给药。同一次患者就诊可以给予两种或更多种疗法。在临床上可以给予本公开内容的抗体或抗体片段和其他疗法。循环疗法包括给予第一疗法(例如,第一预防剂或治疗剂)一段时间,然后给予第二疗法(例如,第二预防剂或治疗剂)一段时间,任选地,然后给予第三疗法(例如,预防剂或治疗剂)一段时间,诸如此类,并重复该顺序给药即循环,以降低对疗法之一发展耐受性,以避免或降低疗法之一的副作用,且/或提高疗法的效力。在某些实施方式中,可以将本公开内容的抗体或抗体片段加以配制,以保证适当的体内分布。例如,血脑屏障(bbb)排除了许多高度亲水的化合物。为了保证本公开内容的治疗化合物跨过bbb(如果需要),例如,可以将其配制在脂质体中。对于脂质体的制造方法,参见,例如,美国专利第4,522,811、5,374,548和5,399,331号。脂质体可以包括一个或多个选择性输送至特定细胞或器官中的部分,从而提高靶向药物输送(参见,例如,v.v.ranade(1989)j.clin.pharmacol.29:685)。示例性的靶向部分包括叶酸或生物素(参见,例如,low等人的美国专利第5,416,016号);甘露糖苷(umezawa等人,(1988)biochem.biophys.res.commun.153:1038);抗体(p.g.bloeman等人(1995)febslett.357:140;m.owais等人(1995)antimicrob.agentschemother.39:180);表面活性剂蛋白质a受体(briscoe等人(1995)am.j.physiol.1233:134);p120(schreier等人(1994)j.biol.chem.269:9090);另外参见k.keinanen;m.l.laukkanen(1994)febslett.346:123;j.j.killion;i.j.fidler(1994)immunomethods4:273。本公开内容提供将包括本公开内容的抗体或抗体片段的药物组合物单独地或者与其他疗法联合给予对其有需要的受试者的方案。本公开内容的联合疗法的疗法(例如预防剂或治疗剂)可以同时或依序给予受试者。在临床上也可以给予本公开内容的联合疗法的疗法(例如预防剂或治疗剂)。循环疗法包括给予第一疗法(例如第一预防剂或治疗剂)一段时间,然后给予第二疗法(例如,第二预防剂或治疗剂)一段时间,并重复该顺序给药即循环,以降低对疗法(例如药剂)之一发展耐受性,以避免或降低疗法(例如药剂)之一的副作用,且/或提高疗法的效力。本公开内容的联合疗法的疗法(例如预防剂或治疗剂)可以同时给予受试者。术语“同时”不限于精确地在相同的时间给予疗法(例如预防剂或治疗剂),而是意味着包括本公开内容的抗体或抗体片段的药物组合物依序在一时间间隔内给予受试者,使得本公开内容的抗体可以与其他疗法一起发生作用,以提供比起以其它方式给药时增加的有益效果。例如,可以在相同的时间或在不同的时间点以任意顺序依序将每种疗法给予受试者;但是,如果不是在相同的时间给予,其应当在时间上充分紧密地给予,以提供期望的治疗或预防效果。每种疗法可以以任何适当的形式通过任何合适的途径单独地给予受试者。在各实施方式中,将疗法(例如预防剂或治疗剂)间隔小于15分钟、小于30分钟、间隔小于1小时、间隔大约1小时、间隔大约1小时至大约2小时、间隔大约2小时至大约3小时、间隔大约3小时至大约4小时、间隔大约4小时至大约5小时、间隔大约5小时至大约6小时、间隔大约6小时至大约7小时、间隔大约7小时值大约8小时、间隔大约8小时至大约9小时、间隔大约9小时至大约10小时、间隔大约10小时至大约11小时、间隔大约11小时至大约12小时、间隔24小时、间隔48小时、间隔72小时或者间隔1周给予受试者。在其他实施方式中,同一次患者就诊给予两种或更多种疗法(例如预防剂或治疗剂)。联合治疗的预防剂或治疗剂可以在同一药物组合物中给予受试者。另外可选地,联合治疗的预防剂或治疗剂可以在单独的药物组合物中同时给予受试者。预防剂或治疗剂可以通过相同或不同的给药途径给予受试者。表1:抗体序列工作实施例实施例1:抗原产生将来自人、食蟹猴和小鼠的il-17c的氨基酸序列进行对比。在没有前导序列的情况下,所有三个物种之间享有79%的同源性。人食蟹猴小鼠人100%95%79%食蟹猴100%79%小鼠100%表2:物种序列同源性抗原产生和质量控制来自不同物种的il-17c购自不同的供应商,或者如果需要的话,自制(in-house),并溶解。每100μg蛋白质加入4μlecltm生物素化模块的生物素化试剂,在暗处在轻微搅拌下在室温下孵育60分钟。随后,使用zebatm脱盐离心柱对生物素化的蛋白质进行纯化,测定od280nm。通过使用ecltm生物素化模块(gehealthcare;#1061918)对抗原进行生物素化。生物素化之后,使用zebatm脱盐离心柱(pierce;#89889)对产物进行纯化。对生物素化和非生物素化的小鼠、食蟹猴和人il-17c进行质量控制,包括在sds-page中在变性、还原和变性、非还原条件下进行分析,以及在天然状态下通过高压尺寸排阻色谱(hp-sec)和动态光散射(dls)进行分析。hp-sec在dionexultimate3000titaniumhplc系统(dionexcorporation,germering,germany)中结合wyattminidawntreos和wyattoptilabrex(wyatttechnologyeurope,dernbach,germany)进行。使用tosohtsk-gelg3000swxl柱(tosohbioscience,stuttgart,germany)进行分离。对于每个样品,将15μg蛋白质装柱,在0.5ml/min的流速下进行分离,记录分析280nm下的uv吸收。运行缓冲液由49mmnah2po4、51mmna2hpo4、100mmk2so4、ph6.8的0.0005%tween-80组成。所有dls实验均使用dynaprotitan小杯系统(wyatttechnologyeurope,dernbach,germany)以0.2-1.0mg/ml的蛋白质浓度进行。在沉淀或形成颗粒的情况下,在实验之前以10.000g将样品离心5分钟。小鼠和人il-17受体e/fc的克隆和产生使用kpnl和ecorv将小鼠il-17受体e(uniprotq8bh06,同种型1)和人il-17受体e(uniprotq8nfr9)的细胞外结构域(ecd)在表达载体pmax_vk_fc2_his中克隆,产生c-端fc2_h融合构建体。在天然的前导序列(ag00158)近旁,产生具有vκ-前导序列的第二构建体(ag00159)。将两种构建体均在hkb11细胞中瞬时表达。转染之后三天对细胞悬浮液进行放大实验,转染之后6天收获细胞培养物上清液。无菌过滤之后,对溶液进行蛋白质a亲和力色谱。对pbs进行缓冲液交换,样品进行无菌过滤(孔径0.2μm)。蛋白质浓度通过uv-分光光度法测定。产物的纯度在sds-page中在变性、还原和变性、非还原条件下以及在天然状态下通过hp-sec和dls分析。实施例2:产生fab片段和抗体对于抗体的产生,使用morphosys库选择针对人il-17c的fab片段。morphosys库(tiller等人,mabs5:3,1-26;may/june(2013)和美国专利第8,728,981号)是市售的噬菌粒文库,使用技术用于展示噬菌体表面上的fab(lohning等人,wo2001/05950)。1.筛选策略:为了选择具有特异性特性例如与一il-17c同型二聚体二价结合的抗体,仅进行溶液筛选(panning)。抗原以其天然的同型二聚态可以在溶液中最佳存在,因此在可溶性抗原上筛选增加了识别出与il-17c二价结合的克隆的可能性。重组抗体通过迭代的三轮筛选从morphosys库产生。因此,使用生物素化的人il-17c或生物素化的小鼠il-17c作为抗原,在溶液中与噬菌体库一起孵育。溶液筛选的前提条件是保留其生物活性的抗原的生物素化。在溶液筛选过程中,将fab展示噬菌体和生物素化的抗原在溶液中孵育,其有利于噬菌体接近抗原。对于每个噬菌体池,将链霉亲和素珠(m-280streptavidin;invitrogen)在1xchemiblocker中封闭(block)。并行地,对于每次筛选,将噬菌体-抗体用等体积的2xchemiblocker/tween20封闭。然后,将100nm生物素化的抗原加入到预吸附和封闭的噬菌体颗粒中,并在室温下孵育。使用封闭的链霉亲和素珠捕获噬菌体-抗原复合物,用磁力分离器收集结合在链霉亲和素珠上的噬菌体颗粒。通过用pbs、tween20和pbs的若干洗涤步骤,洗去未特异性结合的噬菌体,使用ddt将特异性结合的噬菌体从链霉亲和素珠上洗脱。然后将dtt洗脱物转移至大肠杆菌(e.coli)tg1细菌中,在37℃下孵育,用以噬菌体感染。将细菌丸粒重新悬浮在生长培养基中,并铺在lb/cam琼脂板上,孵育过夜。从板上刮下克隆,并用于噬菌体挽救、所选择克隆的多克隆扩增、以及噬菌体产生。以类似的方式进行随后的第2轮和第3轮筛选,延长洗涤步骤,降低抗原浓度,以增加严格性,弃去特异性和亲合力低的抗体。抗原在3轮筛选中自始至终一贯使用或者以交替方式使用。两种不同设置中用于1-3轮羧基珠筛选的抗原示于表3中。表3:筛选策略3轮筛选之后,使用第3轮的输出用于产生单个克隆,并随机将这些产生fab的克隆捡取到384孔板中。2.经由elisa对筛选输出进行第一筛选,以识别对人、食蟹猴和小鼠il-17c有特异性的克隆经由第一elisa筛选考察fab对于il-17c的特异性。为了有利于可溶性fab片段在粗细菌溶解产物中的快速表达,如之前所述制备周质(periplasmatic)提取物(rauchenberger等人(2003)j.biol.chem.278.40:38194-205)。使用含有fab的大肠杆菌溶解产物用于初始命中(hit)的elisa筛选。对于生物素化抗原上的elisa筛选,将maxisorptm384孔板涂覆在pbs中1:1000稀释的fd片段特异性绵羊抗-人igg(bindingsite,#pc075)。用pbs中5%脱脂奶粉封闭之后,加入含有的大肠杆菌溶解产物,并通过抗-fd抗体捕获至板上。用bpst大量洗涤之后,加入0.5μg/ml生物素化的il-17c。在另一洗涤过程之后,使捕获的片段与生物素化的人il-17c结合,通过与缀合在碱性磷酸酶上的链霉亲和素一起孵育,然后加入attophos荧光底物(roche:#11681982001),对其进行检测。在430nm下激发,记录535nm下的荧光发射。为了排除表达具有非特异性结合的fab片段的克隆,在作为阴性对照抗原的不相关抗原上平行地进行逆向筛选(counterscreening)。将在生物素化的人il-17c上大于背底5倍、并且在不相关的抗原上小于背底2倍的elisa信号视作是阳性命中。为了进一步选择除人il-17c以外还与食蟹猴和小鼠il-17c交叉反应性结合的克隆,在生物素化的食蟹猴和小鼠il-17c上进行相同的筛选。将识别出的对小鼠和食蟹猴il-17c抗原也具有交叉反应性的克隆合并,并收集在单独的压板上,然后在受体结合抑制检定中进行筛选。在大肠杆菌中共计捡取并产生4608个单独的fab片段。其中在elisa筛选中识别出1491例在细菌溶解产物制剂中与人il-17c特异性结合的命中。对识别出与人il-17c特异性结合的1491例命中进一步进行与生物素化食蟹猴和小鼠il-17c抗原的elisa结合。其中,证实723个fab对生物素化的食蟹猴和小鼠il-17c具有交叉反应性。3.il-17c特异性克隆的拮抗活性第二筛选在接下来的筛选步骤中,考察这些fab的抑制功能性。因此,在高通量m/hull17re/fc受体抑制检定中筛选具有抑制活性的含有fab的细菌提取物。为了在高通量筛选模式中测试含有fab的粗细菌溶解产物的中和活性,将ma6000384孔板(mesoscalediscovery,msd)用30μlpbs中0.5-0.6μg/ml的小鼠或人il17re/fc嵌合蛋白质在4℃下涂覆过夜。第二天,将20-25μl含有fab的大肠杆菌溶解产物在rt下与等体积1-2nm的生物素化小鼠或人il-17c一起预孵育30分钟,以形成fab-抗原复合物。将板用pbs中5%bsa封闭1h之后,将复合物加入到涂覆有小鼠或人il17re/fc的孔中,使用msdsectorimager经由链霉亲和素-ecl对受体结合进行检测。m/hull-17re在抑制检定中信号降低>60%定义为阳性命中。受体抑制筛选总共产生285个抑制il-17c与其各自受体(人或小鼠il17re/fc)的结合的克隆。4.识别独特(unique)克隆将识别出阻断il-17c与其各自的人或小鼠il-17re受体结合的克隆捡取到另一压板上,对各个候选物的重链和轻链基因进行测序,以在所有285个克隆中识别独特序列。在测序的克隆中,识别出数量17个独特克隆。频率最高的重链是vh3-23,有8个抗体,3个抗体具有vh3-07链,2个抗体具有vh3-11和vh1-46链,1个抗体各具有vh3-15或vh3-21重链。频率最高的轻链是vlambda3-1,有8个抗体,4个抗体具有vkappal-12链,2个抗体具有vlambda2-23,1个抗体各具有vkappa1-06、vkappa1-51或vkappa3-15轻链。各个框架和重链/轻链在抗体库中提供,如us13/321,564或us13/299,367中所公开,在此将其均并入作为参考。5.将编码fab的dna克隆到表达载体中和表达/纯化将所有17个独特抗体亚克隆到细菌fab表达载体中。为进行表达和纯化,将大肠杆菌用编码fab的表达载体转化。诱导表达之后,收获细胞培养物上清液,并通过his-标记特异性亲和力色谱(gehealthcare)进行纯化,用于his-标记的fab纯化。所有样品均进行无菌过滤(孔径0.2μm)。使用labchip系统(calipergxii,perkinelmer)或者在sds-page上在变性、还原和非还原条件下对fab的纯度进行分析。通过uv-分光光度计测定蛋白质浓度。6.抗体的igg转化和表达/纯化通过亚克隆方法将17个独特克隆从fab转化成igg形式。对所有17个抗体编码载体进行酶消化,产生的载体骨架用哺乳动物表达组件连接,并进一步亚克隆到各个全长igg载体中。为进行表达和纯化,将真核hkb11细胞用同时编码igg重链和轻链的pymexl0真核表达载体dna转染。在转染后第3天收获细胞培养物上清液,并进行标准蛋白质a亲和力色谱(mabselectsure,gehealthcare),用于抗体纯化。所有样品均进行无菌过滤(孔径0.2μm)。使用labchip系统(calipergxii,perkinelmer)或者在sds-page上在变性、还原和非还原条件下对igg的纯度进行分析。通过uv-分光光度计测定蛋白质浓度,并进行hp-sec,以对天然状态下的igg制剂进行分析。以探索性规模在hkb11细胞中以人igg1同种型形式产生所有17个独特igg。所有17个igg均表现出较好的表达产率(>5mg/l),仅有3/17因为不想要的聚集趋势没有通过质量控制分析。总共可以以较好的质量产生14个单独的抗体,并在sec中成功通过质量控制(>90%单体含量)。在elisa中对所有14个纯化的igg1抗体进行il-17c结合测试,并进行进一步的功能测试。7.通过尺寸排阻色谱识别与il-17c同型二聚体二价结合的il-17c特异性抗体由于可溶性同型二聚il-17c由两个分子量各21,765da的il-17c单体组成。因此,同型二聚il-17c的总分子量为~44kda,并可以基本上以三种不同的方式与单克隆抗体结合,形成3种不同的复合物(图1)。取决于抗体的特异性,3种复合物中主要形成1种,其中两个同型二聚体与一抗体缔合(i类),两个同型二聚体与两个抗体缔合(ii)类,或者一同型二聚体与一抗体缔合(iii类)。因此,形成的复合物分子量不同,其中i类复合物的分子量为~270kda,ii类复合物的分子量为~380kda,iii类复合物的分子量为~190kda。为了选择与一il-17c同型二聚体二价结合、并主要形成分子量低于200kda的iii类复合物的抗体,将抗体与人il-17c同型二聚体一起孵育,并进行尺寸排阻色谱。通过将等摩尔量的抗原和各个抗体混合,进行结合方式的分析。抗原-抗体相互作用产生的复合物通过尺寸排阻色谱(sec)和mals确定的各个复合物的大小进行分析。形成的各个复合物通过光散射检测器进行检测。通过将检测的复合物与1:1(~190kda)、1:2(~270kda)和2:2(~380kda)复合物的理论分子量进行比较,外推出结合方式。发现2种抗体(mab_1、mab_8)主要形成iii类复合物,因此与一il-17c同型二聚体二价结合(图2、3)。两种抗体均具有抗体库中提供的vh3-23重链和vlambda3-1轻链,如us13/321,564或us13/299,367中所公开,在此将其均并入作为参考。相反,识别出其他抗体不与一il-17c同型二聚体二价结合,不形成分子量低于200kda的复合物(iii类),而是形成更大的复合物,如i类和ii类或其他(图6)。实施例3:表征il-17c特异性igg的受体抑制活性将纯化的il-17c特异性igg在mll-17re相互作用检定中进行测试。因此,将ma6000384孔板(mesoscalediscovery,msd)用30μlpbs中75ng/ml的小鼠il17re/fc嵌合蛋白质在4℃下涂覆过夜。第二天将系列抗体稀释物(浓度0.001-100nm)用等体积的生物素化il-17c在rt下预孵育30分钟。将板用pbst中的2.5%bsa封闭1h之后,向涂覆的il17re/fc加入之前形成的抗体-配体复合物1h,通过链霉亲和素-ecl使用msdsectorimager对受体结合进行检测。结果显示于表4中。表4:受体抑制检定ic50实施例4:il-17c驱动的nf-κβ报告基因检定中的功能测试在基于功能细胞的检定中进一步测试纯化的il-17c特异性igg抑制人、小鼠和食蟹猴il-17c生物活性的能力,上述检定监测过量表达鼠科动物il-17re的nih3t3细胞中il-17c驱动的nf-κβ报告基因的活化。在37℃、5%co2的条件下将nih3t3细胞在补充有10%fbs和1%pen/strep的dmem中培养。为进行检定,使用polyplusjet-pei转染试剂将nih3t3细胞在具有总量100ngdna(20ng小鼠il-17re表达构建体、50ngnf-κβ荧光素酶报告基因构建体和30ngpbluescript)的混悬液中转染。简言之,将dna在5μl150mmnacl(每孔)中稀释,制备8μl150mmnacl中的0.2μljet-pei(每孔)。在室温下孵育5分钟之后,将jetpei溶液加入到dna溶液中,并在室温下再孵育20-30分钟。将nih3t3细胞在87μl培养基中稀释至具有~40,000细胞。将细胞加入到dna-jetpei混合物中(87μl细胞和13μldna-jetpei混合物/孔),最终体积转移至96孔板中。在加湿的5%co2孵育器中在37℃下孵育过夜之后,除去培养基,用90μl含有5%fbs和1%pen/strep的培养基替换。将在dpbs中制备的10μl系列抗体稀释物在室温下与等体积纯化的重组il-17c(人il-17c(novus#nbp1-42910)、小鼠mil-17c(r&dsystems#2306-ml-025)或食蟹猴il-17c(自制))一起预孵育30分钟,将其加入到细胞中。il-17c的最终浓度为0.5ng/ml。将板在co2孵育器中在37℃下孵育之后,加入100μlsteadyliteplus(perkinelmer),然后在envision(perkinelmer)上读取发光值。发现两个抗体(mab_1、mab_8)抑制il-17c介导的信号传导最有效,如表5所示。表5:功能性nf-κb报告基因检定(igg)ic50[pm].nt=未测试实施例5:人原代角质化细胞中il-17c驱动的def4b基因表达中的功能性测试在进一步的功能实验中,在存在和不存在mab_1和mab_8的情况下分析人角质化细胞中il-17c介导的β-防御素2表达。nhek(正常的人表皮角质化细胞)获自lonza,按照制造商的方案在具有补充物(kgm-goldtmbullet试剂盒,lonza)的角质化细胞生长培养基中培养。将传代培养并在传代3代冷冻保存的nhek化冻,并立即以30,000细胞/孔在96孔板培养板中接种在kgm细胞培养基中。2天之后,除去培养基,换成kgm-goldw/o氢化可的松,之后加入hll-17c(novus#nbp1-42910)和htnfα(peprotech#300-01a),至最终浓度各为10ng/ml。为进行抗体测试,首先将人il-17c与等体积dpbs中制备的系列抗体稀释物一起在室温下预孵育30分钟。将细胞培养48小时,然后使用rneasy96试剂盒(qiagen)提取总rna,使用逆转录试剂(appliedbiosystems)进行逆转录,通过定量pcr(qpcr)测定β-防御素2(defb4a)的表达。简言之,使用通用pcr试剂/noung和对于def4b(#hs00823638_m1,均为appliedbiosystems)预设计的按需检定(assay-on-demand)基因表达引物/探针组,制备10μlpcr反应物。在viia7tm实时pcr仪(appliedbiosystems)上进行qpcr。将基因表达归一化至看家基因β-肌动蛋白(taqman引物组#4310881e)或gapdh(taqman引物组#4310893e)。两种抗体(mab_1、mab_8)均显示出有效降低β-防御素2表达,并证实了其中和人il-17c的生物活性的能力(表6)。表6:功能性角质化细胞检定(defb4a的表达)ic50[pm]实施例6:单价fab和二价igg形式的亲和力测定此外,通过set对单价fab和二价igg亲和力进行测定。因此,在人或小鼠il-17c上对纯化的fab和igg进行滴定,用于ec50测定。结果证实了主要形成iii类复合物的igg抗体发挥提出的亲合力效果。溶液平衡滴定(set)基本上如文献所述进行(friquet等人,(1985)j.immunol.meth.77:305-19)。为了提高set方法的敏感度和准确性,将其从经典的elisa转移成基于ecl的技术(haenel等人(2005)analbiochem.339.1:182-84)。如表6所示,与各个fab相比较,在人il-17c和另外在小鼠il-17c上测定的mab_1和mab_8igg抗体的ec50值均显著提高,说明基于与一il-17c同型二聚体二价结合的高亲合力效应。表7:在fab和igg中通过set测定亲和力,ec50[pm]实施例7:基于elisa的交叉竞争检定根据以下标准方法使用elisa检定,可以检测抗-il-17c抗体或另一il-17c结合剂的交叉竞争。elisa-检定的通常原理涉及将抗-il-17c抗体涂在elisa板的孔上。然后在溶液中加入过量第二种可能的交叉竞争性抗-il-17c抗体(即,不与elisa板结合)。随后,然后将有限量的il-17c-fc加入至孔中。涂在孔上的抗体和溶液中的抗体将会竞争结合数量有限的il-17c分子。然后将板洗涤,以除去未结合所涂抗体的il-17c分子,另外除去第二种溶液相抗体以及在第二种溶液相抗体和il-17c之间形成的任意复合物。然后使用适当的il-17c检测试剂测量结合的il-17c的量。因此,可以将il-17c与可以通过适当的标记特异性试剂检测的例如fc、flag等的标记融合。与所涂抗体交叉竞争的溶液中的抗体将能够导致相对于在不存在第二种溶液相抗体的情况下所涂抗体可以结合的il-17c的数量,所涂抗体可以结合的il-17c分子的数量降低。以下对于两种称作ab-x和ab-y的抗体,进一步详述该检定。在选择ab-x为固定化抗体的情形中,将其涂在elisa板的孔上,之后将板用合适的封闭溶液封闭,以使随后加入的试剂的非特异性结合最小化。然后向elisa板加入过量的ab-y,使得每孔ab-yil-17c结合位点的摩尔数比起elisa板涂覆过程中每孔使用的ab-xil-17c结合位点的摩尔数高至少10倍。加入il-17c,使得每孔加入的il-17c的摩尔数比起每孔涂覆使用的ab-xil-17c结合位点的摩尔数低至少25倍。在适当的孵育期之后,洗涤elisa板,加入il-17c抗原特异性检测试剂,以测量涂覆的抗-il-17c抗体(在这种情况下是ab-x)特异性结合的il-17c分子的量。检定的背底信号定义为在具有涂覆抗体(在这种情况下是ab-x)、第二种溶液相抗体(在这种情况下是ab-y中)、仅有缓冲剂(即没有il-17c)和检测试剂的孔中得到的信号。检定的阳性对照信号定义为在具有涂覆抗体(在这种情况下是ab-x)、仅有第二种溶液相抗体缓冲剂(即没有第二种溶液相抗体)、il-17c检测试剂的孔中得到的信号。elisa检定需要以阳性对照信号是背底信号的至少6倍的方式运行。为了避免选择哪个抗体作为涂覆抗体、选择哪个抗体作为第二(竞争物)抗体造成的伪差(即ab-x和ab-y对il-17c的亲和力显著不同),需要以两种形式进行交叉阻断检定:1)形式1,其中ab-x是涂在elisa板上的抗体,ab-y是溶液中的竞争抗体;2)形式2,其中ab-y是涂在elisa板上的抗体,ab-x是溶液中的竞争抗体。实施例8:使用氢/氘交换质谱确定表位hdx质谱(也称作hdxms)利用了蛋白质的不稳定质子与水溶液中溶剂的质子交换的原理。反应动力学取决于温度、ph、各个氨基酸的酸性性质和考察的质子对溶剂的暴露程度。通过将溶剂从基于氢取代为基于氘的水溶液,氘迅速并入到蛋白质暴露于溶剂的区域,取代各个氢原子。在蛋白质消化之后,使用质谱分析肽的质量。可识别出并入氘时质量的增加。通过比较结合和没有结合抗体片段的情况下抗原的肽质量,可以确定抗体的表位。因此,对未复合和复合(与各个抗体)的抗原样品进行不同时间的氘溶剂孵育(例如,0秒、10秒、30秒、2分钟、10分钟、30分钟、1小时)。在每个给定的时间点,通过注射到pepsin柱中将样品迅速消化,使用低ph和低温将氘交换条件淬灭,以保留特定的氘模式。将产生的氘代和非氘代肽脱盐,使用反向(rp)纳米uplc分离来分离,并注射到高分辨q-ims-tof质谱仪中。对色谱条件进行优化,以使完整抗原样品的肽序列覆盖最大化。为了识别抗体的表位,比较未结合和复合状态下每种肽的氘并入动力学速率。通过结合的抗体,肽屏蔽于周围的溶剂,导致复合状态下特定肽的并入速率降低。出于可视化的目的,将氘的不同摄取对抗原序列作图。液体处理和色谱设定基于t.e.wales和j.r.engen所述的方法设计自动化氢-氘交换色谱(hdxms)实验(massspectromrev.2006jan-feb;25(1):158-70)。使用的分析仪器由waterscorporation(milford,ma,usa)提供的hdx管理器、纳米uplc色谱系统和高分辨质谱仪组成。简言之,液体处理操作在waters自动化hdx管理器中进行,冷藏样品室保持在2℃。hdx管理器包括palhts液体处理器、2个watersm-classuplc泵系统和用于样品捕获和色谱分离的冷藏室。通过使用样品处理系统将蛋白质复合物样品孵育不同的时间,进行氘交换。随后,将样品注射到六通注射阀中,在20℃下在waterspepsin柱上在线消化。蛋白质水解肽自动收集在waters捕获柱上,并注射到watersc-18反相柱中用于分离。将脱盐并分离的蛋白质水解肽直接注射到synaptg2si质谱仪的电喷雾离子化(esi)源中。质谱分析使用waterssynaptg2si(q-ims-tof)质谱仪识别蛋白质水解肽。在峰同时洗脱的情况下,使用离子迁移分离获得进一步的分辨率。此外,使用裂解ms/ms分析可以实现更高的分辨率。在该情形中,使用电子转移解离(etd)引发各个肽的裂解,以避免氘置乱(scrambling)引起的信息丢失。制备蛋白质和蛋白质:fab复合物蛋白质:通过将50μgil-17c以1:1的摩尔比与fab混合,制备fab复合物,并在4℃下孵育至少2小时。对于交换(on-exchange)实验,将il-17c或il-17c:fab复合物用d2o缓冲液稀释。为了深入理解氘并入的动力学,在d2o缓冲液中孵育的不同时间点(例如,0秒、10秒、30秒、2分钟、10分钟、30分钟和1小时)对样品进行分析。在用淬灭缓冲液淬灭之间,通过加入还原缓冲液对混合物进行还原。一经混合,将淬灭的溶液注射到色谱系统中,在此处其被自动消化、分离并通过lc-ms分析。计算样品和对照之间的平均氘代变化,作为样品和对照氘摄取水平之间的差异。数据处理使用watersmasslynx,hdx管理器,biopharmalynx和dynamix软件包对质谱原始数据进行评价。masslynx和hdx管理器软件用于记录谱图数据。随后,使用biopharmalynx识别所有的蛋白质水解肽。该信息用于使用watersdynamix软件评价每种单独的肽的氘摄取量。将氘摄取水平报道为氘代样品和非氘代参考肽之间的质量差异。对经处理的数据进行手动评价并调节,以修正来自自动化处理步骤的不准确性和误差。通过在每个肽上使氘含量离域(例如,将观察到的氘水平除以该肽中的氨基酸数量),将氘摄取水平指认到蛋白质序列的各个残基。如果残基被一个以上的肽覆盖,通过软件对覆盖该残基的所有肽的归一化氘摄取进行平均。如果可能,使用来自ms/ms分析的额外信息增加分析的分辨率。结果对于抗体mab_1和mab_8,如上所概述使用氢-氘交换质谱(hdxms)确定表位。对于两种抗体mab_1和mab_8,均通过hdxms表位作图识别人il-17c上的相同保护区域。覆盖图(图8a和8b)清楚地将区域pvlrpeevl(seqidno.:27,seqidno.:1的aa89-97)识别为人il-17c上对两种抗体的主要表位。对于两种抗体,在人il-17c上另外识别出3个额外的具有非常弱的保护的区域(aa98-111(adthqrsispwry;seqidno.:29)、aa132-146(crgcidartgretaal;seqidno.:30)和aa192-197(tcvlprsv;seqidno.:31)。但是,由于保护水平低,这些区域不是表位的必需部分。结果表明,与il-17c上的区域pvlrpeevl(seqidno.:27)结合的示例抗体还显示出与一il-17c同型二聚体的二价结合。实施例9:通过sec对其他抗体的复合物测定此外,根据实施例2部分7中所述的方法分析了其他抗体的结合特性。5种额外的抗体在尺寸排阻色谱(sec)中显示出与一il-17c同型二聚体的二价结合。所有5种抗体的sec结果在图4-5中例示。在图6中,示例出2种抗体,其不与一il-17c同型二聚体二价结合。这两种抗体均不形成分子量小于200kda的复合物(iii类),但在其他形式中形成更大的复合物如i类和ii类。sequencelisting<110>莫佛塞斯公司加拉帕戈斯股份有限公司<120>il-17c的抗体<130>ms220/prov<150>ep14197883<151>2014-12-15<160>31<170>patentin版本3.5<210>1<211>197<212>prt<213>人(homosapiens)<400>1metthrleuleuproglyleuleupheleuthrtrpleuhisthrcys151015leualahishisaspproserleuargglyhisprohisserhisgly202530thrprohiscystyrseralaglugluleuproleuglyglnalapro354045prohisleuleualaargglyalalystrpglyglnalaleuproval505560alaleuvalserserleuglualaalaserhisargglyarghisglu65707580argproseralathrthrglncysprovalleuargproglugluval859095leuglualaaspthrhisglnargserileserprotrpargtyrarg100105110valaspthraspgluaspargtyrproglnlysleualaphealaglu115120125cysleucysargglycysileaspalaargthrglyarggluthrala130135140alaleuasnservalargleuleuglnserleuleuvalleuargarg145150155160argprocysserargaspglyserglyleuprothrproglyalaphe165170175alaphehisthrglupheilehisvalprovalglycysthrcysval180185190leuproargserval195<210>2<211>194<212>prt<213>小鼠(musmusculus)<400>2metserleuleuleuleuglytrpleuprothrglymetthrhisgln151015aspproprosertrpglylysproargserhisargthrleuargcys202530tyrseralaglugluleuserhisglyglnalaproprohisleuleu354045thrargseralaargtrpgluglnalaleuprovalalaleuvalala505560serleuglualathrglyhisargargglnhisgluglyproleuala65707580glythrglncysprovalleuargproglugluvalleuglualaasp859095thrhisgluargserileserprotrpargtyrargileaspthrasp100105110gluasnargtyrproglnlysleualavalalaglucysleucysarg115120125glycysileasnalalysthrglyarggluthralaalaleuasnser130135140valglnleuleuglnserleuleuvalleuargargglnprocysser145150155160argaspglythralaaspprothrproglyserphealaphehisthr165170175glupheileargvalprovalglycysthrcysvalleuproargser180185190thrgln<210>3<211>197<212>prt<213>食蟹猴(macacafascicularis)<400>3metthrleuleuproglyleuleupheleuthrtrpleuhisalacys151015leualahisglnasppropheleuargglyhisprohisthrhisgly202530thrproargcystyrseralaglugluleuproleuglyglnalapro354045prohisleuleualaargglyalalystrpglyglnalaleuproval505560alaleuvalserserleuglualaalaglyhisargargarghisasp65707580argproseralaalathrglncysprovalleuargproglugluval859095leuglualaaspthrhisglnargserileserprotrpargtyrarg100105110valaspthraspgluaspargtyrproglnlysleualaphealaglu115120125cysleucysargglycysileaspproargthrglyarggluthrala130135140alaleuasnservalargleuleuglnserleuleuvalleuargarg145150155160argprocysserargaspglyserglyleuprothrproglyalaphe165170175alaphehisthrglupheileargvalprovalglycysthrcysval180185190leuproargserval195<210>4<211>866<212>prt<213>人<400>4metglyalaalaargserproproseralavalproglyproleuleu151015glyleuleuleuleuleuleuglyvalleualaproglyglyalaser202530leuargleuleuasphisargalaleuvalcysserglnproglyleu354045asncysthrvallysasnserthrcysleuaspaspsertrpilehis505560proargasnleuthrproserserprolysaspleuglnileglnleu65707580hisphealahisthrglnglnglyaspleupheprovalalahisile859095glutrpthrleuglnthraspalaserileleutyrleugluglyala100105110gluleuservalleuglnleuasnthrasngluargleucysvalarg115120125pheglupheleuserlysleuarghishishisargargtrpargphe130135140thrpheserhisphevalvalaspproaspglnglutyrgluvalthr145150155160valhishisleuprolysproileproaspglyaspproasnhisgln165170175serlysasnpheleuvalproaspcysgluhisalaargmetlysval180185190thrthrprocysmetserserglyserleutrpaspproasnilethr195200205valgluthrleuglualahisglnleuargvalserphethrleutrp210215220asngluserthrhistyrglnileleuleuthrserpheprohismet225230235240gluasnhissercysphegluhismethishisileproalaproarg245250255proglugluphehisglnargserasnvalthrleuthrleuargasn260265270leulysglycyscysarghisglnvalglnileglnprophepheser275280285sercysleuasnaspcysleuarghisseralathrvalsercyspro290295300glumetproaspthrprogluproileproasptyrmetproleutrp305310315320valtyrtrppheilethrglyileserileleuleuvalglyserval325330335ileleuleuilevalcysmetthrtrpargleualaglyproglyser340345350glulystyrseraspaspthrlystyrthraspglyleuproalaala355360365aspleuileproproproleulysproarglysvaltrpileiletyr370375380seralaasphisproleutyrvalaspvalvalleulysphealagln385390395400pheleuleuthralacysglythrgluvalalaleuaspleuleuglu405410415gluglnalaileserglualaglyvalmetthrtrpvalglyarggln420425430lysglnglumetvalgluserasnserlysileilevalleucysser435440445argglythrargalalystrpglnalaleuleuglyargglyalapro450455460valargleuargcysasphisglylysprovalglyaspleuphethr465470475480alaalametasnmetileleuproaspphelysargproalacysphe485490495glythrtyrvalvalcystyrphesergluvalsercysaspglyasp500505510valproaspleupheglyalaalaproargtyrproleumetasparg515520525pheglugluvaltyrpheargileglnaspleuglumetpheglnpro530535540glyargmethisargvalglygluleuserglyaspasntyrleuarg545550555560serproglyglyargglnleuargalaalaleuaspargpheargasp565570575trpglnvalargcysproasptrppheglucysgluasnleutyrser580585590alaaspaspglnaspalaproserleuaspglugluvalphegluglu595600605proleuleuproproglythrglyilevallysargalaproleuval610615620arggluproglyserglnalacysleualaileaspproleuvalgly625630635640glugluglyglyalaalavalalalysleugluprohisleuglnpro645650655argglyglnproalaproglnproleuhisthrleuvalleualaala660665670glugluglyalaleuvalalaalavalgluproglyproleualaasp675680685glyalaalavalargleualaleualaglygluglyglualacyspro690695700leuleuglyserproglyalaglyargasnservalleupheleupro705710715720valaspprogluaspserproleuglyserserthrprometalaser725730735proaspleuleuprogluaspvalarggluhisleugluglyleumet740745750leuserleuphegluglnserleusercysglnalaglnglyglycys755760765serargproalametvalleuthraspprohisthrprotyrgluglu770775780gluglnargglnservalglnseraspglnglytyrileserargser785790795800serproglnproprogluglyleuthrglumetglugluglugluglu805810815glugluglnaspproglylysproalaleuproleuserprogluasp820825830leugluserleuargserleuglnargglnleuleupheargglnleu835840845glnlysasnserglytrpaspthrmetglyserglusergluglypro850855860serala865<210>5<211>667<212>prt<213>人<400>5metglyserserargleualaalaleuleuleuproleuleuleuile151015valileaspleuseraspseralaglyileglyphearghisleupro202530histrpasnthrargcysproleualaserhisthraspaspserphe354045thrglyserseralatyrileprocysargthrtrptrpalaleuphe505560serthrlysprotrpcysvalargvaltrphiscysserargcysleu65707580cysglnhisleuleuserglyglyserglyleuglnargglyleuphe859095hisleuleuvalglnlysserlyslysserserthrphelysphetyr100105110argarghislysmetproalaproalaglnarglysleuleuproarg115120125arghisleuserglulysserhishisileserileproserproasp130135140ileserhislysglyleuargserlysargthrglnproserasppro145150155160gluthrtrpgluserleuproargleuaspserglnarghisglygly165170175proglupheserpheaspleuleuproglualaargalaileargval180185190thrileserserglyprogluvalservalargleucyshisglntrp195200205alaleuglucysglugluleuserserprotyraspvalglnlysile210215220valserglyglyhisthrvalgluleuprotyrglupheleuleupro225230235240cysleucysileglualasertyrleuglngluaspthrvalargarg245250255lyslyscyspropheglnsertrpproglualatyrglyseraspphe260265270trplysservalhisphethrasptyrserglnhisthrglnmetval275280285metalaleuthrleuargcysproleulysleuglualaalaleucys290295300glnarghisasptrphisthrleucyslysaspleuproasnalathr305310315320alaarggluseraspglytrptyrvalleuglulysvalaspleuhis325330335proglnleucysphelyspheserpheglyasnserserhisvalglu340345350cysprohisglnthrglyserleuthrsertrpasnvalsermetasp355360365thrglnalaglnglnleuileleuhispheserserargmethisala370375380thrpheseralaalatrpserleuproglyleuglyglnaspthrleu385390395400valproprovaltyrthrvalserglnalaargglyserserproval405410415serleuaspleuileilepropheleuargproglycyscysvalleu420425430valtrpargseraspvalglnphealatrplyshisleuleucyspro435440445aspvalsertyrarghisleuglyleuleuileleualaleuleuala450455460leuleuthrleuleuglyvalvalleualaleuthrcysargargpro465470475480glnserglyproglyproalaargprovalleuleuleuhisalaala485490495aspserglualaglnargargleuvalglyalaleualagluleuleu500505510argalaalaleuglyglyglyargaspvalilevalaspleutrpglu515520525glyarghisvalalaargvalglyproleuprotrpleutrpalaala530535540argthrargvalalaarggluglnglythrvalleuleuleutrpser545550555560glyalaaspleuargprovalserglyproaspproargalaalapro565570575leuleualaleuleuhisalaalaproargproleuleuleuleuala580585590tyrpheserargleucysalalysglyaspileproproproleuarg595600605alaleuproargtyrargleuleuargaspleuproargleuleuarg610615620alaleuaspalaargprophealaglualathrsertrpglyargleu625630635640glyalaargglnargargglnserargleugluleucysserargleu645650655gluargglualaalaargleualaaspleugly660665<210>6<211>637<212>prt<213>小鼠<400>6metglyserproargleualaalaleuleuleuserleuproleuleu151015leuileglyleualavalseralaargvalalacysprocysleuarg202530sertrpthrserhiscysleuleualatyrargvalasplysargphe354045alaglyleuglntrpglytrppheproleuleuvalarglysserlys505560serproprolysphegluasptyrtrparghisargthrproalaser65707580pheglnarglysleuleuglyserproserleuserglugluserhis859095argileserileproserseralaileserhisargglyglnargthr100105110lysargalaglnproseralaalagluglyarggluhisleuproglu115120125alaglyserglnlyscysglyglyproglupheserpheaspleuleu130135140progluvalglnalavalargvalthrileproalaglyprolysala145150155160servalargleucystyrglntrpalaleuglucysgluaspleuser165170175serpropheaspthrglnlysilevalserglyglyhisthrvalasp180185190leuprotyrglupheleuleuprocysmetcysileglualasertyr195200205leuglngluaspthrvalargarglyslyscyspropheglnsertrp210215220proglualatyrglyseraspphetrpglnserileargphethrasp225230235240tyrserglnhisasnglnmetvalmetalaleuthrleuargcyspro245250255leulysleuglualaserleucystrpargglnaspproleuthrpro260265270cysgluthrleuproasnalathralaglnglusergluglytrptyr275280285ileleugluasnvalaspleuhisproglnleucysphelyspheser290295300phegluasnserserhisvalglucysprohisglnserglyserleu305310315320prosertrpthrvalsermetaspthrglnalaglnglnleuthrleu325330335hispheserserargthrtyralathrpheseralaalatrpserasp340345350proglyleuglyproaspthrprometproprovaltyrserileser355360365glnthrglnglyservalprovalthrleuaspleuileileprophe370375380leuargglngluasncysileleuvaltrpargseraspvalhisphe385390395400alatrplyshisvalleucysproaspvalserhisarghisleugly405410415leuleuileleualaleuleualaleuthralaleuvalglyvalval420425430leuvalleuleuglyargargleuleuproglyserglyargthrarg435440445provalleuleuleuhisalaalaaspserglualaglnargargleu450455460valglyalaleualagluleuleuargthralaleuglyglyglyarg465470475480aspvalilevalaspleutrpgluglythrhisvalalaargilegly485490495proleuprotrpleutrpalaalaarggluargvalalaargglugln500505510glythrvalleuleuleutrpasncysalaglyproserthralacys515520525serglyaspproglnalaalaserleuargthrleuleucysalaala530535540proargproleuleuleualatyrpheserargleucysalalysgly545550555560aspileproargproleuargalaleuproargtyrargleuleuarg565570575aspleuproargleuleuargalaleuaspalaglnproalathrleu580585590alasersertrpserhisleuglyalalysargcysleulysasnarg595600605leugluglncyshisleuleugluleuglualaalalysaspasptyr610615620glnglyserthrasnserprocysglyphesercysleu625630635<210>7<211>9<212>prt<213>人造序列<220><223>源自重组文库<400>7phethrphesersertyralametser15<210>8<211>19<212>prt<213>人造序列<220><223>源自重组文库<400>8valseralaileserglyserglyglyserthrtyrtyralaaspser151015vallysgly<210>9<211>11<212>prt<213>人造序列<220><223>源自重组文库<400>9glypheargglyglyphephealapheaspval1510<210>10<211>11<212>prt<213>人造序列<220><223>源自重组文库<400>10serglyasplysleuglyasplystyralatyr1510<210>11<211>11<212>prt<213>人造序列<220><223>源自重组文库<400>11leuvaliletyrglnaspserlysargproser1510<210>12<211>10<212>prt<213>人造序列<220><223>源自重组文库<400>12glnalatrpthrpheproleuleuthrtrp1510<210>13<211>214<212>prt<213>人造序列<220><223>源自重组文库<400>13sertyrgluleuthrglnproproservalservalserproglygln151015thralaserilethrcysserglyasplysleuglyasplystyrala202530tyrtrptyrglnglnlysproglyglnserprovalleuvaliletyr354045glnaspserlysargproserglyileprogluargpheserglyser505560asnserglyasnthralathrleuthrileserglythrglnalaglu65707580aspglualaasptyrtyrcysglnalatrpthrpheproleuleuthr859095trpvalpheglyglyglythrlysleuthrvalleuglyglnprolys100105110alaalaproservalthrleupheproproserserglugluleugln115120125alaasnlysalathrleuvalcysleuileseraspphetyrprogly130135140alavalthrvalalatrplysalaaspserserprovallysalagly145150155160valgluthrthrthrproserlysglnserasnasnlystyralaala165170175sersertyrleuserleuthrprogluglntrplysserhisargser180185190tyrsercysglnvalthrhisgluglyserthrvalglulysthrval195200205alaprothrglucysser210<210>14<211>450<212>prt<213>人造序列<220><223>源自重组文库<400>14gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargglypheargglyglyphephealapheaspvaltrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplysargvalgluprolyssercysasp210215220lysthrhisthrcysproprocysproalaprogluleuleuglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserhisglu260265270aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglntyrasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysalaleuproalaproileglu325330335lysthrileserlysalalysglyglnproarggluproglnvaltyr340345350thrleuproproserarggluglumetthrlysasnglnvalserleu355360365thrcysleuvallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleutyrserlysleuthrvalasp405410415lysserargtrpglnglnglyasnvalphesercysservalmethis420425430glualaleuhisasnhistyrthrglnlysserleuserleuserpro435440445glylys450<210>15<211>642<212>dna<213>人造序列<220><223>源自重组文库<400>15agctatgaactgacccagccgccgagcgttagcgttagcccaggccagaccgccagcatt60acctgtagcggcgacaaactgggcgacaaatacgcctactggtatcagcagaaaccgggc120cagagcccggtgctggttatctatcaggatagcaaacgcccgagcggcattccagaacgc180tttagcggcagcaacagcggcaacaccgccaccctgaccattagcggcacccaggccgaa240gacgaagccgattattactgccaggcttggactttcccgctgctgacttgggtgtttggc300ggcggtaccaagctgaccgtgctgggccagcccaaagccgcccctagcgtgaccctgttc360cccccaagcagcgaggaactccaggccaacaaggccaccctcgtgtgcctgatcagcgac420ttctaccctggcgccgtgaccgtggcctggaaggccgatagcagccctgtgaaggccggc480gtggaaaccaccacccccagcaagcagagcaacaacaaatacgccgccagcagctacctg540agcctgacccccgagcagtggaagtcccacagatcctacagctgccaggtcacacacgag600ggcagcaccgtggaaaagaccgtggcccccaccgagtgcagc642<210>16<211>1350<212>dna<213>人造序列<220><223>源自重组文库<400>16gaagtgcagctgctggaaagcggtggcggtctggtgcagccaggtggtagcctgcgcctg60agctgtgccgcaagcggctttacctttagcagctatgccatgagctgggtgcgccaagca120ccaggcaaaggcctggaatgggtgagcgccattagcggcagcggtggcagcacctattat180gccgatagcgtgaaaggtcgctttaccattagtcgcgataacagcaaaaacaccctgtat240ctgcaaatgaacagcctgcgggcagaagataccgcagtttattattgcgcgcgaggattc300cgtggtggtttcttcgcattcgatgtgtggggtcagggcaccctggttactgtctcgagc360gcgtcgaccaaaggccccagcgtgttccctctggcccccagcagcaagagcacctctggc420ggaacagccgccctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcc480tggaactctggcgccctgaccagcggcgtgcacacctttccagccgtgctccagagcagc540ggcctgtacagcctgagcagcgtcgtgaccgtgcccagcagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacacaaaggtggacaagcgggtggaaccc660aagagctgcgacaagacccacacctgtcccccctgccctgcccctgaactgctgggaggc720ccctccgtgttcctgttccccccaaagcctaaggacaccctgatgatcagccggaccccc780gaagtgacctgcgtggtggtggacgtgtcccacgaggaccctgaagtgaagtttaattgg840tacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagtacaac900agcacctaccgggtggtgtccgtgctgaccgtgctgcaccaggactggctgaacggcaaa960gagtacaagtgcaaggtgtccaacaaggccctgcctgcccccatcgagaaaaccatcagc1020aaggccaaaggccagccccgcgagccccaggtgtacacactgccccctagccgggaagag1080atgaccaagaaccaggtgtccctgacctgcctcgtgaagggcttctaccccagcgacatt1140gccgtggaatgggagagcaacggccagcccgagaacaactacaagaccaccccccctgtg1200ctggacagcgacggctcattcttcctgtacagcaagctgaccgtggacaagagccggtgg1260cagcagggcaacgtgttcagctgctccgtgatgcacgaggccctgcacaaccactacacc1320cagaagtccctgagcctgagccccggcaag1350<210>17<211>9<212>prt<213>人造序列<220><223>源自重组文库<400>17phethrphesersertyralametser15<210>18<211>19<212>prt<213>人造序列<220><223>源自重组文库<400>18valseralaileserglyserglyglyserthrtyrtyralaaspser151015vallysgly<210>19<211>11<212>prt<213>人造序列<220><223>源自重组文库<400>19glyphealaileargtyrtyrglypheasptyr1510<210>20<211>11<212>prt<213>人造序列<220><223>源自重组文库<400>20serglyasplysleuglyasplystyralatyr1510<210>21<211>11<212>prt<213>人造序列<220><223>源自重组文库<400>21leuvaliletyrglnaspserlysargproser1510<210>22<211>10<212>prt<213>人造序列<220><223>源自重组文库<400>22glnvalphethrpheproleuvalthrthr1510<210>23<211>214<212>prt<213>人造序列<220><223>源自重组文库<400>23sertyrgluleuthrglnproproservalservalserproglygln151015thralaserilethrcysserglyasplysleuglyasplystyrala202530tyrtrptyrglnglnlysproglyglnserprovalleuvaliletyr354045glnaspserlysargproserglyileprogluargpheserglyser505560asnserglyasnthralathrleuthrileserglythrglnalaglu65707580aspglualaasptyrtyrcysglnvalphethrpheproleuvalthr859095thrvalpheglyglyglythrlysleuthrvalleuglyglnprolys100105110alaalaproservalthrleupheproproserserglugluleugln115120125alaasnlysalathrleuvalcysleuileseraspphetyrprogly130135140alavalthrvalalatrplysalaaspserserprovallysalagly145150155160valgluthrthrthrproserlysglnserasnasnlystyralaala165170175sersertyrleuserleuthrprogluglntrplysserhisargser180185190tyrsercysglnvalthrhisgluglyserthrvalglulysthrval195200205alaprothrglucysser210<210>24<211>450<212>prt<213>人造序列<220><223>源自重组文库<400>24gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargglyphealaileargtyrtyrglypheasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplysargvalgluprolyssercysasp210215220lysthrhisthrcysproprocysproalaprogluleuleuglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserhisglu260265270aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglntyrasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysalaleuproalaproileglu325330335lysthrileserlysalalysglyglnproarggluproglnvaltyr340345350thrleuproproserarggluglumetthrlysasnglnvalserleu355360365thrcysleuvallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleutyrserlysleuthrvalasp405410415lysserargtrpglnglnglyasnvalphesercysservalmethis420425430glualaleuhisasnhistyrthrglnlysserleuserleuserpro435440445glylys450<210>25<211>642<212>dna<213>人造序列<220><223>源自重组文库<400>25agctatgaactgacccagccgccgagcgttagcgttagcccaggccagaccgccagcatt60acctgtagcggcgacaaactgggcgacaaatacgcctactggtatcagcagaaaccgggc120cagagcccggtgctggttatctatcaggatagcaaacgcccgagcggcattccagaacgc180tttagcggcagcaacagcggcaacaccgccaccctgaccattagcggcacccaggccgaa240gacgaagccgattattactgccaggttttcactttcccgctggttactactgtgtttggc300ggcggtaccaagctgaccgtgctgggccagcccaaagccgcccctagcgtgaccctgttc360cccccaagcagcgaggaactccaggccaacaaggccaccctcgtgtgcctgatcagcgac420ttctaccctggcgccgtgaccgtggcctggaaggccgatagcagccctgtgaaggccggc480gtggaaaccaccacccccagcaagcagagcaacaacaaatacgccgccagcagctacctg540agcctgacccccgagcagtggaagtcccacagatcctacagctgccaggtcacacacgag600ggcagcaccgtggaaaagaccgtggcccccaccgagtgcagc642<210>26<211>1350<212>dna<213>人造序列<220><223>源自重组文库<400>26gaagtgcagctgctggaaagcggtggcggtctggtgcagccaggtggtagcctgcgcctg60agctgtgccgcaagcggctttacctttagcagctatgccatgagctgggtgcgccaagca120ccaggcaaaggcctggaatgggtgagcgccattagcggcagcggtggcagcacctattat180gccgatagcgtgaaaggtcgctttaccattagtcgcgataacagcaaaaacaccctgtat240ctgcaaatgaacagcctgcgggcagaagataccgcagtttattattgcgcgcgtggtttc300gcaatccgttattatggatttgattattggggccagggcaccctggttactgtctcgagc360gcgtcgaccaaaggccccagcgtgttccctctggcccccagcagcaagagcacctctggc420ggaacagccgccctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcc480tggaactctggcgccctgaccagcggcgtgcacacctttccagccgtgctccagagcagc540ggcctgtacagcctgagcagcgtcgtgaccgtgcccagcagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacacaaaggtggacaagcgggtggaaccc660aagagctgcgacaagacccacacctgtcccccctgccctgcccctgaactgctgggaggc720ccctccgtgttcctgttccccccaaagcctaaggacaccctgatgatcagccggaccccc780gaagtgacctgcgtggtggtggacgtgtcccacgaggaccctgaagtgaagtttaattgg840tacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagtacaac900agcacctaccgggtggtgtccgtgctgaccgtgctgcaccaggactggctgaacggcaaa960gagtacaagtgcaaggtgtccaacaaggccctgcctgcccccatcgagaaaaccatcagc1020aaggccaaaggccagccccgcgagccccaggtgtacacactgccccctagccgggaagag1080atgaccaagaaccaggtgtccctgacctgcctcgtgaagggcttctaccccagcgacatt1140gccgtggaatgggagagcaacggccagcccgagaacaactacaagaccaccccccctgtg1200ctggacagcgacggctcattcttcctgtacagcaagctgaccgtggacaagagccggtgg1260cagcagggcaacgtgttcagctgctccgtgatgcacgaggccctgcacaaccactacacc1320cagaagtccctgagcctgagccccggcaag1350<210>27<211>9<212>prt<213>人<400>27provalleuargproglugluvalleu15<210>28<211>8<212>prt<213>人<400>28valleuargproglugluvalleu15<210>29<211>13<212>prt<213>人<400>29alaaspthrhisglnargserileserprotrpargtyr1510<210>30<211>16<212>prt<213>人<400>30cysargglycysileaspalaargthrglyarggluthralaalaleu151015<210>31<211>8<212>prt<213>人<400>31thrcysvalleuproargserval15当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1