具备抗微生物、抗癌/促进伤口愈合活性的肽及其用途的制作方法
本发明系关于一种新颖之肽,且特别关于一种同时具备抗微生物、抗癌及/或促进伤口愈合之活性的肽、含此肽之医药组成物,以及此肽之用途。
背景技术:
阳离子抗微生物肽,对于植物、昆虫与动物的先天性免疫系统的调控是重要的(Zasloff M(2002)Antimicrobial peptides of multicellular organisms.Nature 415:389-395.),且原先被认为是抗细菌与抗真菌的候选物(Rothstein DM,Spacciapoli P,Tran LT,Xu T,Roberts FD,et al.(2001)Anticandida activity is retained in P-113,a 12-amino-acid fragment of histatin 5.Antimicrob Agents Chemother 45:1367-1373;Yu HY,Huang KC,Yip BS,Tu CH,Chen HL,et al.(2010)Rational design of tryptophan-rich antimicrobial peptides with enhanced antimicrobial activities and specificities.Chembiochem 11:2273-2282.)。阳离子抗微生物肽一般以它们的正电荷与两性特性为特征,这使它们能够与带负电荷之细菌细胞膜结合,而导致细胞膜破裂,且因此导致细菌死亡(Hancock RE and Sahl HG(2006)Antimicrobial and host-defense peptides as new anti-infective therapeutic strategies.Nat Biotechnol 24:1551-1557.;La Rocca P,Shai Y and Sansom MS(1999)Peptide-bilayer interactions:simulations of dermaseptin B,an antimicrobial peptide.Biophys Chem 76:145-159.)。阳离子抗微生物肽的细胞膜裂解特性,使得它们成为克服抗生素抗性问题的潜力治疗剂(Yu HY,Huang KC,Yip BS,Tu CH,Chen HL,et al.(2010)Rational design of tryptophan-rich antimicrobial peptides with enhanced antimicrobial activities and specificities.Chembiochem 11:2273-2282.)。
虽然已投入了极大的努力于新治疗方式的发展,然而,癌症目前仍维持为主要死亡原因(Siegel R,Ma J,Zou Z and Jemal A(2014)Cancer statistics 2014.CA Cancer J Clin 64:9-29)。而,尽管化学疗法对于正常细胞与组织具有副作用,且容易形成多重药物抗性,但,它们仍然是用于治疗在后段与转 移阶段中之癌症的主要药物(Siegel R,Ma J,Zou Z and Jemal A(2014)Cancer statistics 2014.CA Cancer J Clin 64:9-29)。
因此,对于正常细胞具有低毒性的新颖癌症药物以及可避免多重药物抗性之新颖机制的模式,可提供抗癌治疗的一个新方向。
故,目前亟需一种对于正常细胞具有低毒性且可具有抗微生物与抗癌活性的新颖肽药物。
技术实现要素:
本发明提供一种具备抗微生物、抗癌及/或促进伤口愈合之活性的肽,包括:一α-螺旋(α-helix)肽;以及一短肽,系由约4至10个带正电荷之氨基酸所构成,连接于该α-螺旋肽之N端,以形成该具备抗微生物、抗癌及/或促进伤口愈合之活性的肽,其中该具备抗微生物、抗癌及/或促进伤口愈合之活性的肽的总长为约10至20个氨基酸。
本发明也提供一种医药组成物,包括:前述之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽;以及一药学上可接受之载体或盐类,其中该医药组成物具有抗微生物活性、具有抗癌活性及/或具有促进伤口愈合之活性,且不影响正常细胞。
本发明还提供一种前述之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽用于制备抗微生物、抗癌及/或促进伤口愈合之药物的用途,其中该药物具有抗微生物活性、具有抗癌活性及/或具有促进伤口愈合之活性,且不影响正常细胞。
为了让本发明之上述和其他目的、特征、和优点能更明显易懂,下文特举较佳实施例,并配合所附图示,作详细说明如下:
附图说明
图1显示在不同NaCl之浓度下,氨苄西林(ampicillin,AP)以及S1、Nal2-S1、K4R2-Nal2-S1与K6-Nal2-S1肽对于大肠杆菌(Escherichia coli)、金黄葡萄球菌(Staphylococcus aureus)与铜绿假单胞菌(Pseudomonas aeruginosa)之最小抑制浓度(minimum inhibitory concentration,MIC)的色彩分级(以灰阶显示)。
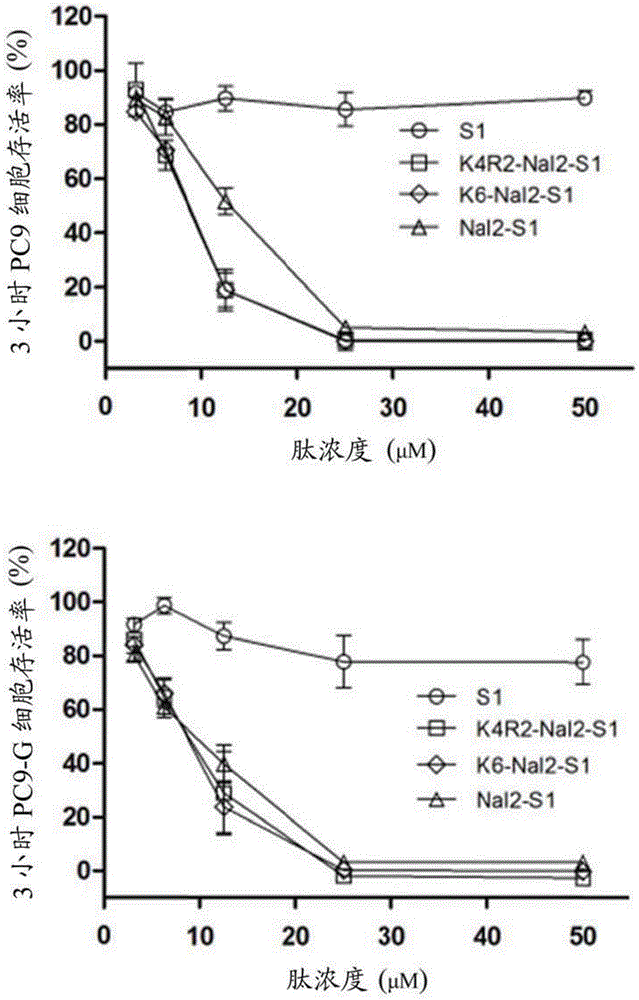
图2A显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理3小时后, PC9与PC9-G细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗PC9与PC9-G细胞株的活性)。
图2B显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理3小时后,A549与OECM-1细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗A549与OECM-1细胞株的活性)。
图2C显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理3小时后,SAS与C9细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗SAS与C9细胞株的活性)。
图3A显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理12小时后,PC9与PC9-G细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗PC9与PC9-G细胞株的活性)。
图3B显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理12小时后,A549与OECM-1细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗A549与OECM-1细胞株的活性)。
图3C显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理12小时后,SAS与C9细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗SAS与C9细胞株的活性)。
图4A显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理24小时后,PC9与PC9-G细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗PC9与PC9-G细胞株的活性)。
图4B显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理24小时后,A549与OECM-1细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗A549与OECM-1细胞株的活性)。
图4C显示,经S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1肽处理24小时后,SAS与C9细胞的存活率(S1、Nal2-S1、K4R2-Nal2-S1或K6-Nal2-S1抵抗SAS与C9细胞株的活性)。
图5A显示,S1、Nal2-S1、K4R2-Nal2-S1与K6-Nal2-S1肽对于人类红血球细胞的溶血性。
图5B显示,S1、Nal2-S1、K4R2-Nal2-S1与K6-Nal2-S1肽对于人类纤维母细胞(HFW)的细胞毒性。
图6A显示,将PC9与HFW细胞经由或未经由12μM FITC-K4R2-Nal2-S1 处理5分钟的代表性相位差影像。
图6B显示,将FITC-结合-K4R2-Nal2-S1肽与PC9细胞及HFW细胞交互作用之免疫荧光分析的结果。为了细胞核之侦测,将细胞预先以DAPI染色,接着将细胞以FITC-K4R2-Nal2-S1肽(12μM)处理1小时。DAPI与FITC在UV与蓝光光源下,分别呈现蓝色与绿色信号。所有比例尺=20μm。
图7显示,对于经活化之caspase 3表达的Western印迹分析,以监测在所指出之时间点上之PC9细胞与HFW细胞中的细胞凋亡(apoptosis)。GAPDH作为一加载的对照组(loading control)。
图8A显示,经皮下注射PC9人类肺癌细胞,并以静脉注射K4R2Nal2-S1肽(右图)或PBS对照组(左图)之雄性裸鼠在癌症细胞移植后第46天的背侧(5天让肿瘤生长,然后经过40天处理,于第46天照相)。
图8B与8C显示,图8A中之裸鼠在所指出之监测期间的体重(图8B)与肿瘤体积(图8C)。
图8D显示,经K4R2Nal2-S1肽(上部)或PBS(下部)处理之小鼠之暴露于外的肿瘤(小鼠在癌症细胞植入后第46天被处死)。于PBS处理组中发现12个暴露的肿瘤(6只小鼠x 2侧植入),但在K4R2Nal2-S1肽处理组中仅发现7个暴露的肿瘤。
图8E显示,图8D中之经K4R2Nal2-S1肽处理之小鼠之肿瘤总重与经PBS处理之小鼠之肿瘤总重。
图9显示,将来切除自图5A与5B之小鼠的异种移植肿瘤进行苏木素-伊红染色(hematoxylin and eosin stain,H&E stain)与对于经裂解PARP之表达的免疫组织化学染色法(immunohistochemistry,IHC),以监测细胞凋亡。比例尺分别=500μm、100μm与50μm(40X、200X与400X)。
图10A显示,于细胞迁移分析中,于0、12与24小时所观察之不同测试组别之影像。
图10B显示,于细胞迁移分析中之不同测试组别的修复率。
具体实施方式
在本发明一实施态样中,本发明提供一种新颖之肽,其具备抗微生物、抗癌及/或促进伤口愈合之活性。
上述本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽,可包 括,但不限于,一α-螺旋(α-helix)肽与一短肽,其中上述短肽可由约4至10个带正电荷之氨基酸所构成,且连接于上述α-螺旋肽之N端以形成上述本发明之肽。
上述本发明之肽的总长可为约10至20个氨基酸,例如,10个、11个、12个、13个、14个、15个、16个、17个、18个或19个氨基酸,但不限于此。
构成上述α-螺旋肽的氨基酸并无特殊限制,可全部皆为自然氨基酸或全部皆为非自然氨基酸,或者,也可同时包含自然氨基酸与非自然氨基酸,只要这些氨基酸所构成之肽可以形成α-螺旋结构即可。换言之,上述α-螺旋肽的序列并无特殊限制,只要构成此序列中的氨基酸可以形成α-螺旋结构即可。
在一实施方案中,上述α-螺旋肽可具有一个或一个以上之非自然氨基酸,但不限于此。上述一个或一个以上非自然氨基酸的各个可独立地为,例如,萘基丙氨酸(β-naphthylalanine,Nal)、(3-苯并噻吩基)-丙氨酸((benzothien-3-yl)alanine,Bal)、二苯基丙氨酸(diphenylalanine,Dip)、4,4'-联苯丙氨酸(4,4'-biphen-yl)alanine,Bip)、(9-蒽基)-丙氨酸(anthracen-9-yl)alanine,Ath)或(2,5,7-三-叔-丁基-吲哚-3-基)丙氨酸((2,5,7-tri-tert-butyl-indol-3-yl)alanine)(Tht)等,但不限于此。在一实施方案中,上述一个或一个以上非自然氨基酸可为萘基丙氨酸。
又,在上述α-螺旋肽之一个以上之非自然氨基酸可为完全连续排列或部分连续排列。于此处所使用之用语“完全连续排列”意指,在上述α-螺旋肽中,任两个非自然氨基酸之间并不具有任何自然氨基酸。而用语“部分连续排列”意指,在上述α-螺旋肽中,对于一部分非自然氨基酸而言,为任两个非自然氨基酸之间并不具有任何自然氨基酸,而对于另一部分之非自然氨基酸而言,与各非自然氨基酸直接连接的氨基酸为自然氨基酸。
或者,在上述α-螺旋肽之一个以上之非自然氨基酸可为非连续排列。而用语“非连续排列”意指,在上述α-螺旋肽中,与各非自然氨基酸直接连接的氨基酸必然为自然氨基酸。
在一实施方案中,上述一个以上之非自然氨基酸为完全连续排列。于此实施方案中,上述一个以上之非自然氨基酸可为位于此α-螺旋肽之N端且与短肽直接连接,或者也可位于此α-螺旋肽之C端,又,或者可位于此α-螺旋肽的中间区域。
在一特定实施方案中,上述一个以上之非自然氨基酸为完全连续排列,且位于上述α-螺旋肽之N端而与短肽直接连接。于此特定实施方案中,上述α-螺旋肽具有两个非自然氨基酸,又,两个非自然氨基酸可皆为萘基丙氨酸。
在另一特定实施方案中,α-螺旋肽的序列可包括序列辨识号:1,例如,α-螺旋肽的序列可由序列辨识号:1之序列所构成,但不限于此。
再者,于本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽中,构成上述短肽之带正电荷之氨基酸并无特别限制,只要是带有正电荷氨基酸即可。短肽之各个带正电荷之氨基酸可独立地为,例如,赖氨酸(lysine)、精氨酸(arginine)或组氨酸(histidine)等,但不限于此。
在一实施方案中,于本发明具备抗微生物、抗癌及/或促进伤口愈合之活性的肽中之上述短肽的长度可为六个氨基酸。于此实施方案中,构成上述短肽之六个带正电氨基酸可皆为赖氨酸。或者,于此实施方案中,构成上述短肽之六个带正电氨基酸可为4个赖氨酸与2个精氨酸之组合。又,于一特定实施方案中,构成上述短肽之六个带正电氨基酸为4个赖氨酸与2个精氨酸之组合,且从上述短肽之N端至C端,这些带正电荷之氨基酸依序为4个赖氨酸与2个精氨酸。
此外,本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽之N端氨基酸可被乙酰化。或者,本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽之C端氨基酸可被酰胺化。又,或者,本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽之N端氨基酸与C端氨基酸,可分别被乙酰化与酰胺化。
在一实施方案中,本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽的序列可包括,序列辨识号:2或序列辨识号:3之序列,但不限于此。在一特定实施方案中,本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽的序列系由序列辨识号:2之序列所构成。又,在另一特定实施方案中,本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽的序列系由序列辨识号:3之序列所构成。
在本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽的序列系由序列辨识号:2之序列所构成的特定实施方案中,序列辨识号:2之序列的N端氨基酸可进一步被乙酰化。或者,于此特定实施方案中,序列辨识号:2之序列的C端氨基酸可进一步被酰胺化。又,或者,于此特定实施方案中, 序列辨识号:2之序列的N端氨基酸与C端氨基酸,可进一步分别被乙酰化与酰胺化。
相似地,在本发明之具备抗微生物、抗癌及/或促进伤口愈合之活性的肽的序列系由序列辨识号:3之序列所构成的特定实施方案中,序列辨识号:3之序列的N端氨基酸可进一步被乙酰化,或者,序列辨识号:3之序列的C端氨基酸可进一步被酰胺化,又,或者,序列辨识号:3之序列的N端氨基酸与C端氨基酸,可进一步分别被乙酰化与酰胺化。
本发明之上述包括一α-螺旋肽与一短肽之新颖肽可具有下述功效,但不限于此。
本发明之上述新颖肽具有抗微生物活性。于本发明中所述之“抗微生物活性”系指肽可改变目标微生物的功能或代谢,例如,影响复制、生长、毒素的产生、生存等。在一实施方案中,抗微生物活性系指抑制微生物的生长。又,在一特定实施方案中,抗微生物活性系指本发明肽可毒杀至少一种微生物。
本发明中所述之微生物的例子可包括,细菌、真菌、病毒、原生动物等,特别是,具有脂质双层膜之细胞或结构的微生物,但不限于此。
上述细菌可包括革兰氏阳性细菌及/或革兰氏阴性细菌,但不限于此。革兰氏阳性细菌的例子包括金黄葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、无乳链球菌(Streptococcus agalactiae)、A型链球菌(Group A streptococcus)、化脓性链球菌(Streptococcus pyogenes)、B型革兰氏阳性链球菌(Group B gram-positive streptococcus)、单核细胞增生李斯特氏菌(Listeria monocytogenes)等,但不限于此。而,上述革兰氏阳性细菌的例子则可包括,但不限于大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)、沙门氏菌(Salmonella)、流感嗜血杆菌(Haemophilus influenza)、霍乱弧菌(Vibrio cholera)、副溶血性弧菌(Vibrio parahaemolyticus)、幽门螺旋杆菌(Helicobacter pylori)等。
上述真菌包括,酵母菌,例如,白色念珠菌(Candida albicans)。而上述病毒可包括,但不限于麻疹病毒(Measles virus)、疱疹病毒(herpes simplex virus,HSV)(例如,疱疹病毒-1(HSV-1、)、疱疹病毒-2(HSV-2))、人类免疫缺陷病毒(human immunodeficiency virus,HIV)、C型肝炎病毒(hepatitis C virus,HCV)、水疱性口炎病毒(vesicular stomatitis virus,VSV)、绵羊髓鞘脱落病毒 (visna virus)、巨细胞病毒(cytomegalovirus,CMV)。此外,上述原生动物可包括贾第鞭毛虫(Giardia),但不限于此。
又,本发明上述新颖肽具有抗癌活性,且不影响正常细胞。换言之,本发明上述新颖肽对于癌细胞具有高度选择性。
于本发明中所述之“抗癌活性”系指肽可改变目标癌细胞的功能或代谢,例如,影响复制、生长、生存等,但不限于此。在一实施方案中,抗癌活性系指抑制癌细胞的生长。又,在一特定实施方案中,抗癌活性系指本发明肽可毒杀至少一种癌细胞。
而,上述癌细胞并无特别限制,例如,可为肺癌细胞、口腔癌细胞、前列腺癌、乳癌、肝癌、胰脏癌等细胞,但不限于此。上述肺癌细胞包括肺腺癌细胞,但不限于此。而上述口腔癌细胞的例子,则可包括,但不限于,口腔鳞状细胞癌(oral squamous-cell carcinoma,OSCC)细胞。
此外,本发明上述新颖肽还进一步具有杀死对抗癌药物具有抗性之癌细胞的能力。在一实施方案中,本发明上述新颖肽具有杀死对艾瑞莎(gefitinib)具有抗性之肺腺癌细胞的能力。
于本发明中所述之“伤口愈合”可为连续、动态、复杂性生理过程,其可包括,但不限于,细胞增生、细胞迁移等。于一实施方案中,于本发明中所述之“促进伤口愈合”,也可意指“促进细胞增生”或“促进细胞迁移”,但不限于此。
本发明之新颖肽,视需要而定,可单纯作为抗微生物肽使用,也可单纯作为抗癌肽使用,也可单纯作为促进伤口愈合之肽使用,或者,也可同时作为抗微生物、抗癌与促进伤口愈合之肽来使用,并无特别限制。
在本发明另一实施态样中,本发明提供一种医药组成物,其可包括任何前述本发明之新颖肽与一药学上可接受之载体或盐类。
前述本发明之种医药组成物具有抗微生物、抗癌及/或促进伤口愈合而不影响正常细胞之能力。
可以本发明之医药组成物来抵抗的微生物的例子可包括,细菌、真菌、病毒、原生动物等,特别是,具有脂质双层膜之细胞或结构的微生物,但不限于此。
而上述细菌可包括革兰氏阳性细菌及/或革兰氏阴性细菌,但不限于此。革兰氏阳性细菌可例如,金黄葡萄球菌、表皮葡萄球菌、无乳链球菌、A型 链球菌、化脓性链球菌、B型革兰氏阳性链球菌、单核细胞增生李斯特氏菌等,但不限于此。而,上述革兰氏阳性细菌的例子则可包括,但不限于,大肠杆菌、铜绿假单胞菌、沙门氏菌、流感嗜血杆菌、霍乱弧菌、副溶血性弧菌、幽门螺旋杆菌等。
上述真菌包括,酵母菌,例如,白色念珠菌。而上述病毒可包括,但不限于麻疹病毒、疱疹病毒(例如,疱疹病毒-1、疱疹病毒-2))、人类免疫缺陷病毒、C型肝炎病毒、水疱性口炎病毒、绵羊髓鞘脱落病毒、巨细胞病毒。再者,上述原生动物可包括,但不限于,贾第鞭毛虫等。
再者,上述癌细胞可包括,但不限于肺癌细胞、口腔癌细胞、前列腺癌、乳癌、肝癌、胰脏癌等。肺癌细胞包括肺腺癌细胞,但不限于此。口腔癌细胞的例子则可包括,口腔鳞状细胞癌细胞,但不限于此。
又,本发明上述医药组成物还进一步具有杀死对抗癌药物具有抗性之癌细胞的能力。在一实施方案中,本发明上述医药组成物具有杀死对艾瑞莎具有抗性之肺腺癌细胞的能力。
于本发明之医药组成物之促进伤口愈合的功效,也可意指“促进细胞增生”、“促进细胞迁移”等功效,但不限于此。
于前述本发明之医药组成物中,上述药学上可接受之载体可包括,但不限于溶剂、分散媒(dispersion medium)、套膜(coating)、抗菌与抗真菌试剂与一等渗透压与吸收延迟(absorption delaying)试剂等与药学投予相容者。对于不同的给药方式,可利用一般方法将医药组合物配制成剂型(dosage form)。
又,上述药学上可接受之盐类可包括,但不限于盐类包括无机阳离子,例如,碱金属盐类,如钠、钾或胺盐,碱土金族盐类,如镁、钙盐,含二价或四价阳离子之盐类,如锌、铝或锆盐。此外,也可是为有机盐类,如二环己胺盐类、甲基-D-葡糖胺,氨基酸盐类,如精氨酸、赖氨酸、组织胺酸、麸胺酸酰胺。
本发明所制备出药物给药可以口服、非口服、经由吸入喷雾(inhalation spray)或藉由植入贮存器(implanted reservoir)的方式。非口服可包括皮下(subcutaneous)、皮内(intracutaneous)、静脉内(intravenous)、肌肉内(intramuscular)、关节内(intraarticular)、动脉(intraarterial)、滑囊(腔)内(intrasynovial)、胸骨内(intrasternal)、蜘蛛膜下腔(intrathecal)、疾病部位内(intralesional)注射以及灌注技术。
口服成分的形式可包括,但不限定于,药锭、胶囊、乳剂(emulsions)、水性悬浮液(aqueous suspensions)、分散液(dispersions)与溶液。
本发明之医药组合物可投予至植物或动物等。上述可包括鱼类、禽类、哺乳动物等,但不限于此。哺乳动物的例子可包括,但不限于,猫、狗、牛、马、猪、人类等。在一实施方案中,医药组合物可投予至人类。
在本发明又另一实施态样中,本发明提供一种任何前述本发明之新颖肽用于制备抗微生物、抗癌及/或促进伤口愈合之药物的用途。
实施例
A.材料与方法
1.伦理声明
人类静脉血液收集自三位健康的自愿者,具备其事先书面通知同意书,以及经台湾台大医院新竹分院之人体试验委员会所同意。
所有动物实验为根据台湾清华大学实验动物照护及使用委员会(National Tsing Hua University Institutional Animal Care)(许可号:10260)的动物使用方针来执行。所有裸鼠于CO2下被处死,而所有努力系为了使动物痛苦最小化。
2.肽制备
合成所设计之肽。肽的身份(identity)为藉由电喷洒质谱仪(electrospray mass spectroscopy)来确认,而纯度(>95%)则由HPLC来评估。肽浓度则藉由使用紫外光/可见光光谱仪(spectrophotometer)于280nm来确认。缓冲溶液则以二次玻璃蒸馏水来配制。
3.细菌培养
大肠杆菌(Escherichia coli)菌株(ATCC 25922)、金黄葡萄菌(Staphylococcus aureus)subsp菌株(ATCC 25923,methicillin-resistant)与铜绿假单胞菌(Pseudomonas aeruginosa)Migula菌株(Pseudomonas aeruginosa Migula)(ATCC 27853,氨苄西林抗性)为用于测试肽的抗菌活性。将细菌培养于经灭菌之米勒亨顿(Mueller-Hinton,MH)培养液于200rpm且于37℃,8小时。
于培养8小时之后,藉由以紫外光/可见光光谱仪来测量于600nm之光密度的吸收,以确认接种体(inoculums)的浓度(OD 600=1,约等于108个CFU/mL)
4.抗微生物活性
藉由台湾临床检验室标准委员会(National Committee for Clinical Laboratory Standards)的标准肉汤微量稀释法(standard broth microdilution method)以LYM肉汤(broth)来测定抗菌活性。LYM肉汤包含5.4mM KCl、5.6mM Na2HPO4,0.5mM MgSO4与1.0mM柠檬酸钠(sodium citrate)。此外,每公升之培养基添加0.4mg之ZnCl2、2.0mg之FeCl3·6H2O、0.1mg之CuSO4·5H2O、0.1mg之MnSO4·H2O、0.1mg之Na2B4O7·10H2O、700mg之无色氨酸(tryptophan)的氨基酸混合物(Clontech,Lot Number:2803C347)与20mg之L-色氨酸。以终浓度2%来添加一维他命混合物(100X,Sigma,Product Number:M6895-100ML)与葡萄糖。
制备1μl肽溶液(以连续稀释(serial dilution),范围从5000μg/ml至78μg/ml)并于聚丙烯(polypropylene)96-孔盘中与99μl接种体(5x 105CFU/ml)混合。藉由ELISA读板仪(Thermo Max,Molecular Devices,Sunnyvale,CA)于OD 600nm测量浊度(turbidity)。将没有肽之培养基与接种体悬浮液,分别做为负对照组与正对照组。最低抑制浓度(minimum inhibitory concentration,MIC)值为并无明显生长(等于或小于90%)之肽的最低浓度。藉由使用TreeView Program(Arnusch CJ,Ulm H,Josten M,Shadkchan Y,Osherov N,et al.(2012)Ultrashort Peptide Bioconjugates Are Exclusively Antifungal Agents and Synergize with Cyclodextrin and Amphotericin B.Antimcrob Agents Chemother 56:1-9.;Eisen MB,Spellman PT,Brown PO and Botstein D(1998)Cluster analysis and display of genome-wide expression patterns.Proc Natl Acad Sci 95:14863-14868.)来将最低抑制浓度转换为色彩分级(color scale)并显示。将所有肽以三重复来进行测试。
5.溶血活性(hemolytic activity)
藉由静脉血液收集试管(venous blood collection tube)(BD Vacutainer,REF 367525)来收集人类静脉血液。经由PBS缓冲溶液清洗以及于800g离心5分钟来移除血清。重复上述程序至少三次以完全移除血清。
将50μl之肽(以连续稀释,范围从1.6mM至3.1μM)与50μl之10%人类红血球(hRBC)混合,并培养于37℃,1小时。在以800g离心5分钟之后收集上清液。藉由测量于405nm的吸收来确认释放自人类红血球之血红素的量。以10%人类红血球未以肽处理以及以1%Triton X-100处理,来分别代表负对 照组以及正对照组。
6.细胞培养
将人类肺癌细胞株PC9与A549,以及口腔鳞状细胞癌细胞株OECM-1培养于添加10%胎牛血清(fetal bovine serum)与抗生素的RPMI培养基中。将人类舌癌细胞株SAS、口腔癌细胞株C9与人类二倍体纤维原细胞株(human diploid fibroblast)HFW培养于添加10%胎牛血清与抗生素的DMEM培养基中。将细胞培养于含5%CO2在37℃之一潮湿培养器中。
A549,OECM-1,SAS,C9与HFW细胞株皆获自台湾清华大学生物科技研究所,杨嘉铃教授。PC9与抗艾瑞莎(gefitinib)之PC9(PC9-G)细胞株为获自台湾清华大学生物科技研究所,周裕珽教授。PC9-G为产生自将PC9细胞株以艾瑞莎(500nM)培养60天。
7.细胞毒性
使用MTT分析来确认体外细胞毒性。将所有癌症细胞株以5000个细胞/100μl/孔之浓度接种于96-孔盘中,并培养24小时。将HFW细胞以8000个细胞/100μl/孔之浓度来接种。
在移除培养基之后,将包含肽(范围从50μM至3.13μM,HFW细胞以75μM与100μM肽另外处理)之100μl之新鲜培养基添加至孔洞中。于3、12或24小时培养后,以含有MTT(0.5mg/ml)之新鲜培养基取代并培养3小时。在移除培养基/MTT之后,添加DMSO至100μl以溶解甲瓒(formazan)结晶。藉由使用多重标记微盘分析仪(Multi-labeled Microplate Reader)(VICTOR3)来测量于540nm之吸收以计算细胞存活率。对癌细胞而言,与H2O2(aq)混合之培养基为正对照组(细胞全死),而仅有培养基为负对照组(细胞全活);对正常细胞而言,仅有培养基为正对照组(细胞全活),而与H2O2(aq)混合之培养基为负对照组(细胞全死)。
8.细胞存活影像
将PC9与HFW细胞(~105个细胞)预先接种于6-cm聚苯乙烯(polystyrene)盘达24小时。以终浓度10μg/ml之4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)来标记细胞核。在10分钟培养之后,以PBS来清洗细胞。以12μM之终浓度来将FITC-K4R2Nal2S1-NH2添加至培养盘。在于37℃培养5、10、20分钟或1小时之后,将细胞以PBS清洗。使用倒立荧光显微镜(Inverted Fluorescent Microscope Zeiss/Observer.Z1)来观察 FITC-K4R2Nal2S1-NH2在PC9细胞与HFW细胞中的影像。
9.Western印迹法(Western blotting)
将PC9细胞接种于10-cm聚苯乙烯盘达48小时。将约70%满的细胞以12μM K4R2Nal2S1处理10分钟、1小时或24小时。以无经肽之RPMI培养基处理24小时者做为负对照组。
藉由200μl RIPA与蛋白酶抑制剂(protease inhibitor)混合缓冲溶液来收集细胞。在超音波震荡与于4℃以13000rpm离心10分钟后,收集上清液(细胞分解物)。以Bradford试剂来测定细胞萃取物之蛋白质浓度。将等量之经煮沸的细胞分解物(总量50μg)以10%丙烯酰胺胶体(acrylamide gel)来分离。于电转渍系统(electro-blot system),以300V、350A与80分钟来将胶体转移至PVDF膜。
于室温将膜培养于封闭缓冲溶液(blocking buffer)(5%脱脂乳,TBST缓冲溶液)中1小时,并于TBST缓冲溶液中清洗两次。将经封闭之膜以Caspase-3抗体(EPITOMICS,clone ID:E83-77)于4℃隔夜培养、清洗五次,且之后于室温培养于二次抗体中(HRP,GeneTex catalogue number:GTX21311-01),达1小时。藉由增强化学发光(enhanced chemiluminescence,ECL)以使信号显像,并藉由一侦测系统(ImageQuant LAS 4000mini)来记录。
10.小鼠与病理研究
12只雄性裸鼠(BALB/cAnN.Cg-Foxn1nu/CrlNarl)为购自台湾实验动物中心(台湾)。
将在Matrigel(Corning)中之100μl人类肺癌细胞PC9(3x 106个细胞)皮下注射至5周大之雄性裸鼠的背侧。每只小鼠被接种于其背部的两侧(Taguchi F,Koh Y,Koizumi F,Tamura T,Saijo N,et al.(2004)Anticancer effects of ZD6474,a VEGF receptor tyrosine kinase inhibitor,in gefitinib ("Iressa")-sensitive and resistant xenograft models.Cancer Sci 95:984-989.)。于植入(癌症大小>95mm3)5天后,将12只小鼠随机分派成两组。一组为经由一周三次尾静脉注射(tail vein injection)来接受K4R2Nal2S1肽(5mg/Kg,溶解于100μl PBS缓冲溶液中),而另一组注入PBS为对照组。
体重与癌症大小为一周测量三次。经由宽度2×长度×0.52的公式来计算癌症体积。低于100%之处理前体积的癌症体积被定义为“癌症缩小”(Taguchi F,Koh Y,Koizumi F,Tamura T,Saijo N,et al.(2004)Anticancer effects of ZD6474, a VEGF receptor tyrosine kinase inhibitor,in gefitinib("Iressa")-sensitive and resistant xenograft models.Cancer Sci 95:984-989.)。又,藉由解剖小鼠,来确认“癌症缩小”。
在经处理40天后,将小鼠处死,并将肿瘤移出、照相并且秤重。所有动物实验为根据台湾清华大学实验动物照护及使用委员会(National Tsing Hua University Institutional Animal Care)的动物使用方针来执行,并经动物照护委员会(Animal Care Committee)同意。
将固态癌症固定于4%甲醛缓冲溶液。将石蜡包埋组织(paraffin-embedded tissues)裁剪成2μm-后之切片,并于Ultraclear Buffer(J.T.Baker)与梯度乙醇(graded ethanol)中去石蜡。藉由苏木素-伊红染色(hematoxylin and eosin stain,H&E stain)之切片来观察癌症的形态学。此外,将切片以抗-经裂解-PARP(1:100)抗体(Cell Signaling,clone number:D65E10)来进行免疫染色(immunostain)。
使用光显微镜(Eclipse E400,Nikon)偕同数位显微相机(AxioCam ICc 5,ZEISS)来捕捉影像于40X、200X与400X视野。
B.结果
1.肽设计
先前,发明人已发展藉由在短的抗微生物肽之末端添加萘基氨基酸(β-naphthylalanine,Nal)来增加之其盐类耐受性与血清稳定度的策略(Chu HL,Yu HY,Yip BS,Chih YH,Liang CW,et al.(2013)Boosting salt resistance of short antimicrobial peptides.Antimicrob Agents Chemother 57:4050-4052.)。此策略已被成功地应用至S1肽(序列辨识号:4)与超短肽KWWK(序列辨识号:5)。
然而,具有萘基氨基酸末端标志的肽,也被证实了具有较高的细胞分解活性(cell lytic activity)(细胞毒性)。(Chu HL,Yu HY,Yip BS,Chih YH,Liang CW,et al.(2013)Boosting salt resistance of short antimicrobial peptides.Antimicrob Agents Chemother 57:4050-4052.)。此问题可藉由将带正电氨基酸添加至抗微生物肽之N端及/或C端来抵销(Yin LM,Edwards MA,Li J,Yip CM and Deber CM(2012)Roles of Hydrophobicity and Charge Distribution of Cationic Antimicrobial Peptides in Peptide-Membrane Interactions.J Biol Chem 287:7738-7745.)。
于此设计并合成Nal2-S1、K4R2-Nal2-S1与K6-Nal2-S1肽,并与它们的抗微生物活性与抗癌活性以及它们的细胞毒性,与其起源肽S1进行比较。将S1、Nal2S1、K4R2-Nal2-S1与K6-Nal2-S1肽之序列与分子量列于下方表1中。
表1、S1肽与其类似物之一级结构
a萘基氨基酸(β-naphthylalanine,Nal)
2.抗微生物活性
于各种盐类条件下来测试S1肽与其类似物抵抗革兰氏阳性与革兰氏阴性细菌的活性。
分析前述肽的最小抑制浓度,结果如第1图所示。第1图显示,在LYM肉汁条件下,Nal2-S1、K4R2-Nal2-S1与K6-Nal2-S1三个肽皆对于抵抗细菌非常有效。
Nal2-S1与K4R2-Nal2-S1肽显示在高盐条件下具有可期望的活性。然而,K6-Nal2-S1肽的活性则由于100或200mM NaCl的添加而被减弱。
3.细胞毒性
S1肽及其类似物,Nal2-S1、K4R2-Nal2-S1与K6-Nal2-S1三个肽对于人类肺癌细胞(即,PC9、PC9-G与A549)、人类口腔癌细胞(即,OECM-1、 SAS与C9)以及人类纤维母细胞(HFW)的3小时、12小时与24小时细胞毒性,经由MTT分析来进行评估。
上述肽对于各种癌细胞的3小时细胞毒性分别显示于第2A-2C图,上述肽对于各种癌细胞的12小时细胞毒性分别显示于第3A-3C图,而上述肽对于各种癌细胞的24小时细胞毒性分别显示于第4A-4C图。
结果显示,于将各种癌细胞以肽处理24小时之后,包埋有萘基氨基酸(Nal)之三个肽,Nal2-S1、K4R2-Nal2-S1与K6-Nal2-S1,皆具有强效之抵抗不同癌细胞的抗癌活性(参见第4A-4C图)。
相似的结果也可于较早的时间点观察到(即,3小时与12小时,分别参见第2A-2C图以及第3A-3C图)。
使用人类红血球细胞(hRBCs)与人类纤维母细胞(HFW)来研究这些肽的选择性。结果如第5A与5B图所示。
所有肽对于人类红血球细胞的分解活性。在37℃,1小时培养下测试,并由最低溶血浓度(minimal hemolytic concentration)来计算。
Nal2-S1肽于25μM之肽浓度显示10%溶血活性。令人惊讶地,K4R2-Nal2-S1与K6-Nal2-S1肽甚至在浓度800μM也并未被发现溶血活性。而,这些肽对于人类纤维母细胞的细胞毒性,则被发现为S1肽<K4R2-Nal2-S1肽<K6-Nal2-S1肽<Nal2-S1肽。
由于K4R2-Nal2-S1肽显现较佳之盐类耐受性,以及相较于Nal2-S1与K6-Nal2-S1肽,对于人类红血球细胞与人类纤维母细胞毒性较低,因此选择K4R2-Nal2-S1肽来研究其在PC9癌症细胞株与异种移植动物模型(xenograft animal model)中的抗癌活性。
4.体外抗癌机制
为了研究K4R2Nal2-S1肽对于人类癌症细胞株(PC9)与人类纤维母细胞(HFW)的作用模式,将细胞以FITC-标记-K4R2-Nal2-S1进行处理。细胞核则被以DAPI来进行标记,且经由UV激发光来观察蓝色信号。FITC-标记-K4R2-Nal2-S1肽在细胞膜上之荧光分布则以倒立荧光显微镜来显像。
相位差显微镜(phase-contrast microscopy)显示K4R2-Nal2-S1肽处理,并未在人类纤维母细胞中,而是在PC9中诱导细胞膨大(参见第6A图)。此外,免疫荧光分析显示,FITC-标记-K4R2-Nal2-S1肽的处理,在PC9细胞中导致形成小色斑于细胞膜上,但并未在人类纤维母细胞中导致形成小色斑于细胞 膜上(参见第6B图)。由此可知,于癌细胞中,K4R2-Nal2-S1与细胞膜结合且诱导细胞死亡。
免疫印迹指出的结果,K4R2-Nal2-S1肽的处理,是在PC9细胞中而并非人类纤维母细胞中活化了caspase 3,建议了K4R2-Nal2-S1肽介导的细胞死亡,涉及了细胞凋亡(apoptosis)(参见第7图)。
上述结果指出,K4R2-Nal2-S1肽优先与癌细胞结合,且导致细胞凋亡。
5.于异种移植动物模型中抑制肺癌细胞生长
为了评估体内K4R2-Nal2-S1肽之抗癌功效,将PC9细胞皮下植入裸鼠中(参见第8A图),且接着经由静脉途径,以5mg/kg之剂量,每周三次,将K4R2-Nal2-S1肽注入裸鼠(参见第8B与8C图)。
在投予期间,并未在K4R2Nal2-S1肽处理组中发现到体重减少(参见第8B);然而,在经K4R2-Nal2-S1肽处理只小鼠中,观察到肿瘤生长方面的显著抑制(参见第8C图)。在注射40天后,K4R2-Nal2-S1肽处理也减少了所得到之肿瘤的体积与重量(参见第8D与8E图)。
上述结果清楚显示K4R2-Nal2-S1肽处理减弱了异种移植肿瘤的生长。
为了检验细胞坏死(necrosis)与细胞凋亡在K4R2Nal2-S1肽介导之抗癌作用中的关联性,将在异种移植小鼠模型中产生的肺肿瘤切除,并且以苏木素-伊红(H&E)染色与对于为细胞凋亡标记之经裂解PARP的免疫组织化学染色法(immunohistochemistry,IHC)进行分析。
苏木素-伊红(H&E)染色显示了大范围的细胞坏死区域于经K4R2-Nal2-S1肽处理的癌症中,但并未显示于以PBS处理之癌症中(第9图)。免疫组织化学染色则指出,在K4R2-Nal2-S1肽处理下,癌症中紧邻细胞坏死区域之经裂解PARP的表达增加。这些结果支持了K4R2Nal2-S1肽处理,抑制肿瘤生长的见解。
6.细胞迁移(cell migration)分析(体外伤口愈合分析)
将悬浮于添加10%胎牛血清之DMEM培养基中的HaCaT细胞(40,000)接种于一培养插件(culture insert)(ibidi,Germany)的各侧。将插件置于24孔盘中。在于37℃与5%CO2隔夜培养之后,移除插件,并加入添加有不同浓度之肽的1ml无血清DMEM。不含有肽之培养基与含有100ng/ml表皮生长因子(epidermal growth factor,EGF)之培养基,分别为负对照组与正对照组。藉由使用倒立荧光显微镜(Zeiss/Observer.Z1)(10X),于0、12与24小时,观察受 损区域之影像(injury area)。又,伤口面积(wound area)藉由Adobe Photoshop来评估。然后,计算修复率(repairing rate):修复率=(面积t0–面积t12,24)/面积t0,其中t为时间。
第10A图显示,于细胞迁移分析中于0、12与24小时所观察之不同测试组别之影像。而,第10B图显示,于细胞迁移分析中之不同测试组别之伤口修复率。
根据第10A图与第10B图可以清楚得知,不同浓度之K4R2-Nal2-S1肽,相较于负对照组,皆具有较佳之伤口修复能力。换言之,K4R2-Nal2-S1肽具备促进伤口愈合之活性。
虽然本发明已以较佳实施例揭露如上,然其并非用以限定本发明,任何熟习此技艺者,在不脱离本发明之精神和范围内,当可作些许之更动与润饰,因此本发明之保护范围当视后附之申请专利范围所界定者为准。
- 还没有人留言评论。精彩留言会获得点赞!