Midkine稳定低表达的LM3细胞系及其构建方法与流程
本发明涉及生物医学领域,具体地说涉及一种稳定低表达Midkine蛋白的LM3稳定细胞系及其构建方法。
背景技术:
Midkine蛋白是一种重要的细胞因子,分子量大小为13kDa,可以与肝素结合,是肝素结合生长因子家族成员之一。近些年研究发现,Midkine蛋白在正常人组织中不表达或低表达,而在多种恶性肿瘤中过度表达,包括肝癌、胰腺癌、乳腺癌、肠癌等。研究发现,Midkine蛋白具有多种生物学功能,如促进细胞有丝分裂、细胞增殖、血管生成、诱导细胞恶性转化、抗凋亡等活性,从而影响肿瘤细胞的增殖、分化和凋亡,成为肿瘤生物学研究的热点之一。此外,Midkine蛋白还具有分泌性,在恶性肿瘤患者血清中发现Midkine蛋白表达量显著提高,而在正常人血清中几乎检测不到。因此,血清Midkine有望成为一种新的肿瘤标志物,用于肿瘤临床早期诊断、预后判断等辅助性治疗,成为肿瘤生物标志物研究的目标。
肝癌在我国的发病率和死亡率很高,严重危害国民身体健康。对肝癌发病机制的研究是肿瘤生物学研究的重要课题。目前关于Midkine功能研究主要发生在肿瘤增殖、迁移和表皮细胞间质化(Epithelial-to-Mesenchymal Transition,EMT)等方面,而Midkine蛋白对肝癌细胞发生发展的生物学调控机制报道很少,尤其是Midkine与肝癌能量代谢的调控机制尚不清楚。本发明通过慢病毒转染体系构建Midkine低表达稳定肝癌细胞株,为研究Midkine对肝癌的致病机制以及生物学功能提供有力工具。
技术实现要素:
本发明的目的是提供一种低表达Midkine蛋白的LM3稳定细胞系及其构建方法,该细胞系可作为细胞模型,用于研究Midkine对肿瘤尤其是肝癌发生发展的调控机制以及对细胞代谢通路的影响等生物学功能。
本发明提供的一种低表达Midkine蛋白的LM3稳定细胞系,是以肝癌细胞 系LM3作为宿主细胞,感染带有Midkine shRNA基因的病毒培养液,经过Puromycin抗性筛选、细胞扩大培养后获得低表达Midkine蛋白的稳定细胞系。由于Midkine基因与tGFP报告基因融合表达,可以在荧光显微镜下直接观测到Midkine重组质粒的转染效率。
本发明提供的一种低表达Midkine蛋白的LM3稳定细胞系的构建方法,包括如下步骤:
(1)从Open Biosystems公司购买携带Midkine shRNA序列的pSM2载体。设计对应Midkine shRNA的PCR引物(如下),采用PCR方法扩增Midkine shRNA基因;
Forward primer:5′-AAGCCCTTTGTACACCCTAAGCCT-3′
Reverse primer:5′-ACTGGTGAAACTCACCCAGGGATT-3′
(2)采用PCR产物清洁试剂盒将上述PCR产物清洁后,测定OD值。
(3)采用Mlu I和Xho I酶对慢病毒表达载体pLenti进行双酶切,切胶回收线性载体。
(4)利用T4DNA连接酶将步骤(2)中PCR片断与步骤(3)中线性载体pLenti于16℃过夜连接,构建pLenti-MDKshRNA重组质粒。
(5)将上述连接反应液转化E.coli.DH5a感受态细胞,放入37℃过夜培养16小时以上;次日收集菌体,从细菌培养液中提取重组质粒pLenti-MDKshRNA,进行Mlu I和Xho I双酶切鉴定。
(6)细胞转染实验前一天,在100mm培养皿中接种0.5×106~1×106cells个HEK293T细胞,次日细胞汇合度达到50~70%。
(7)细胞转染实验。采用慢病毒转染方法,将步骤(5)获得的重组质粒pLenti-MDKshRNA与病毒包装质粒psPAX2、pVSVG按照10:9:1质量比例混合(总质量6μg),添加到580μl Opti-MEM基本培养基中,然后加入12μl转染试剂,混匀、室温静置20min;取出HEK293T细胞,除去培养基,添加5ml PBS清洗1次;除去PBS溶液,添加3ml DMEM基本培养基室温培养20min;然后将上述转染试剂混合液逐滴添加到预先接种HEK293细胞的100mm培养皿中,轻轻摇匀,放入37℃、5%CO2培养箱里培养;6个小时后取出培养皿,补加7ml DMEM完全培养基,放入培养箱中继续培养。
(8)培养48小时后,收集含有上述含有病毒的细胞培养液,使用0.45μm 低吸附无菌滤膜过滤并保留滤液。该病毒培养液可以直接使用或浓缩后使用,也可放置-80℃长期保存。
(9)病毒转染实验前一天,在6孔板中接种LM3细胞,每孔接种2×105cells,次日细胞汇合度可达50~70%。
(10)病毒转染实验。从细胞培养箱中取出培养LM3细胞的6孔板,除去细胞培养液,将步骤(8)中获得的含有病毒的细胞培养液添加到上述LM3细胞培养皿中,每孔添加2.5ml,然后放入37℃、5%CO2培养箱,继续培养24小时。
(11)次日从细胞培养箱中取出上述6孔板,除去含有病毒的培养液,添加含有体积浓度10%胎牛血清和终浓度1×P/S的DMEM新鲜培养液,放入细胞培养箱中培养48~72小时。
(12)培养48~72小时以后,在荧光显微镜下可见细胞发出绿色荧光。在培养液中添加终浓度为2μg/ml的Puromycin进行阳性细胞系筛选。每三天更换一次含有2μg/ml Puromycin的DMEM新鲜培养液。连续筛选七周以上,直到荧光显微镜下可见所有细胞都发出绿色荧光,说明获得了稳定生长的阳性细胞系。
(13)阳性细胞系鉴定。取出部分筛选后的LM3细胞,分别采用细胞倒置荧光显微镜、RT-qPCR和Western Blot鉴定Midkine基因和蛋白的表达。采用该转染方法,Midkine基因沉默效率可达80%以上,并且持续低表达,证明Midkine低表达LM3细胞系构建成功。
(14)与现有技术相比,本发明通过调整慢病毒转染时间、转染体系等条件,获得了稳定低表达Midkine细胞系,该方法具有转染效率高,能特异、持续、稳定的低表达Midkine优点。本发明为研究Midkine蛋白在肝癌中的作用机制与肿瘤能量代谢提供有力工具。
附图说明
图1:pLenti-MDKshRNA重组质粒的酶切图;其中M表示λ-HindⅢdigest,泳道1表示重组质粒,泳道2表示重组质粒酶切图。
图2:低表达人Midkine基因的LM3稳定细胞系在倒置荧光显微镜(100倍)的细胞荧光鉴定图。
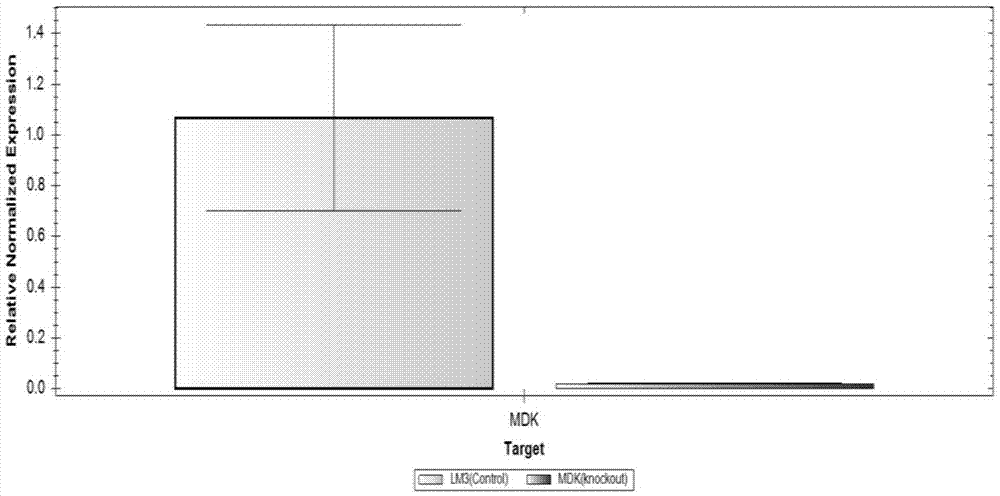
图3:低表达人Midkine基因的LM3稳定细胞系RT-qPCR鉴定图。
图4:低表达人Midkine基因的LM3稳定细胞系Western Blot鉴定图。泳道1为对照,泳道2为稳定细胞系,抗体为Rabbit Anti-Midkine Antibody。
具体实施方式
实施例1、重组表达载体pLenti-MDKshRNA构建
(1)从Open Biosystems公司购买商品化带有Midkine shRNA序列的pSM2载体。采用PCR方法扩增Midkine shRNA基因,引物序列如下:
MDKshRNA Forward Primer:5′-AAGCCCTTTGTACACCCTAAGCCT-3′
MDKshRNA Reverse primer:5′-ACCTGGTGAAACTCACCCAGGGATT-3′
PCR扩增反应体系如下:
PCR反应条件:
(2)采用宝生物公司TaKaRa MiniBEST DNA Fragment Purification Kit将上述PCR产物进行清洁回收,并溶于110μl无菌水。操作步骤参照说明书。
(3)将回收的PCR产物进行Mlu I和Xho I双酶切,酶切反应体系如下:50μl酶切体系,分别添加5μl PCR产物、10U Mlu I、10U Xho I、5μl 10×H buffer,其余用dH2O补足,混匀后,放入37℃水浴孵育1小时。
(4)将酶切产物在1.2%~1.5%(g/ml)琼脂糖凝胶上电泳,并进行切胶回收。采用宝生物公司凝胶回收试剂盒TaKaRa MiniBEST Agarose Gel DNA Extraction Kit,参照产品说明书操作。Midkine shRNA片断长度为345bp,最终溶于50μl无菌水。
(5)采用NanoDrop1000测定Midkine shRNA片断浓度。
(6)准备慢病毒载体plenti。采用Mlu I和Xho I限制酶对重组质粒pLenti进行双酶切,在37℃水浴孵育1小时;然后在0.8%琼脂糖凝胶电泳,并切 胶回收线性载体。
(7)利用T4DNA连接酶将plenti线性载体和Midkine shRNA片断,于16℃过夜连接。
(8)采用热转化方法,将上述连接反应液转化E.coli.DH5a感受态细胞后,在含有100μg/ml Ampicillin的LB培养基过夜培养,次日提取pLenti-MDKshRNA重组质粒。质粒提取试剂盒采用TaKaRa MiniBEST Plasmid Purification Kit,具体操作步骤参照说明书。
(9)对提取的pLenti-MDKshRNA重组质粒进行Mlu I和Xho I双酶切鉴定(见图1)。酶切反应体系如下:50μl酶切体系,含有1μg的pLenti-MDKshRNA重组质粒、10U Mlu I、10U Xho I、5μl 10×H buffer,其余用dH2O补足,混匀后,放入37℃水浴孵育1小时;然后在1%(g/ml)琼脂糖凝胶电泳检测。
实施例2、低表达Midkine稳定细胞系的建立,具体实施步骤如下:
(1)将pLenti-MDKshRNA重组质粒大量提取后,测定OD值。
(2)在100mm培养皿中接种1×106个HEK293T细胞,添加10ml含有10%胎牛血清、1×P/S的DMEM培养基,放入37℃、5%CO2培养箱里培养,次日细胞汇合度约50~70%。
(3)细胞转染实验。将重组质粒pLenti-MDKshRNA和病毒包装质粒psPAX2、pVSVG按照10:9:1质量比例混合到Opti-MEM基本培养液中,具体操作如下:分别将3μg pLenti-MDKshRNA重组质粒、2.7μg psPAX2和0.3μg pVSVG包装质粒添加到580μl Opti-MEM基本培养液中,混合均匀,然后添加12μl Transfect Reagent(ThermoFisher)转染试剂,混匀、室温静置20分钟;取出HEK293T细胞,除去培养液,添加5ml PBS清洗一次;除去PBS溶液、添加3ml DMEM基本培养液室温放置20min;然后将上述含有转染试剂的培养液逐滴添加到HEK293T细胞培养皿中,轻轻摇匀,放入37℃、5%CO2培养箱里培养;培养6小时以后,补加含有10%胎牛血清和终浓度1×P/S的DMEM培养基,继续培养48小时。
(4)培养48小时后,收集含有病毒的细胞培养液,采用0.45μm滤膜过滤含有病毒的细胞培养液,保留含有病毒的滤出液。该病毒培养液可以直接使用或浓缩后使用,也可以放置在-80℃长期保存备用。
(5)病毒转染实验前一天,在6孔板中接种LM3细胞,每孔接入2×105cells,添加含有10%胎牛血清、1×P/S的DMEM培养基,放入37℃、5%CO2培养箱里培养,次日细胞汇合度约50~70%。
(6)病毒转染实验当天,取出预先接种LM3细胞的6孔板,除去细胞培养液,每孔添加2ml PBS清洗一次,除去PBS溶液,然后将步骤(3)获得的病毒培养液,按照250μl/孔添加到6孔板中,轻轻混匀,放入CO2培养箱,培养24小时。
(7)次日取出6孔板,除去病毒培养液,每孔添加2.5ml含有10%胎牛血清、1×P/S的DMEM新鲜培养基,继续培养48~72小时。期间在荧光显微镜下观察细胞是否发出绿色荧光。
(8)阳性细胞系筛选。培养48~72小时以后,在荧光显微镜下可见细胞发出绿色荧光,然后在细胞培养液中添加终浓度为2μg/ml Puromycin筛选阳性细胞;每三天更换一次含有2μg/ml Puromycin的DMEM完全培养基,连续筛选七周以上,直到观测到几乎所有细胞都发出绿色荧光为止(见图2);当细胞汇合度达到80~90%时,按照1/5比例传代,同时添加含有2μg/ml Puromycin的DMEM完全培养基进行筛选;也可以在荧光显微镜下挑取阳性细胞簇,使用培养基稀释到1cell/孔,利用96孔板筛选阳性单克隆细胞系。
(9)低表达Midkine基因检测。根据人Midkine基因的外显子序列,设计一对特异性引物(如下)。提取阳性细胞系总RNA,进行RT-qPCR检测,电泳检测(结果如图3)。核酸提取试剂和qPCR检测试剂分别采用宝生物公司RNAiso Plus和One Step SYBR PrimeScrip RT-PCR Kit,操作步骤参照产品说明书。引物序列如下:
MDK Forward Primer:5’-TGCCCTGCAACTGGAAGAA-3’
MDK Reverse Primer:5’-CTTGGTGACGCGGATGGT-3’
(10)转染效率检测。提取稳定细胞株总蛋白,采用BCA方法进行蛋白定量,然后进行Western Blot检测Midkine蛋白表达量(见图4)。具体操作方法如下:将Midkine低表达的LM3细胞传代至100mm培养皿中,添加8ml预冷的PBS清洗1次,弃上清,加入350μl预冷的RIPA细胞裂解液(ThermoFisher)到上述培养皿中,将培养皿置于冰上裂解细胞30min,期间轻轻混匀几次;然后使用预冷的细胞刮铲将细胞快速刮下,并转移到1.5ml离 心管中;然后12000rpm,4℃离心30min,小心吸取上清液,转移到新的1.5ml离心管中。采用BCA法测定蛋白浓度(ThermoFisher),操作方法参考产品说明书。吸取20μg蛋白提取液,加入终体积1/5的4×SDS PAGE Loading Buffer,于100℃变性5min,进行10%SDS-聚丙烯酰胺凝胶电泳,恒定电压80V;然后将蛋白电转至PVDF膜,恒定电流250mA;转膜后,将PVDF膜用质量体积比为5%的脱脂奶粉(用TBST溶液配制)封闭1小时,然后加入TBST溶液洗膜3次,每次10min,加入rabbit anti-MDK抗体,于4℃过夜孵育。次日早上,回收一抗,添加TBST洗膜3次,每次10min,再加入鼠二抗,室温孵育1小时,TBST洗膜3次,每次10min。加入ECL化学发光试剂后进行成像分析。如图4所示,对照细胞可见Midkine蛋白带,而转染Midkine shRNA重组质粒后该蛋白表达量很低,几乎看不到条带,沉默效率超过80%以上,表明Midkine低表达LM3细胞系构建成功。
(11)将步骤(8)获得的低表达Midkine的LM3稳定细胞系,扩大培养后,放置在液氮中长期保存。
- 还没有人留言评论。精彩留言会获得点赞!