具有生物可逆性和非生物可逆性基团的多核苷酸构建体的制作方法
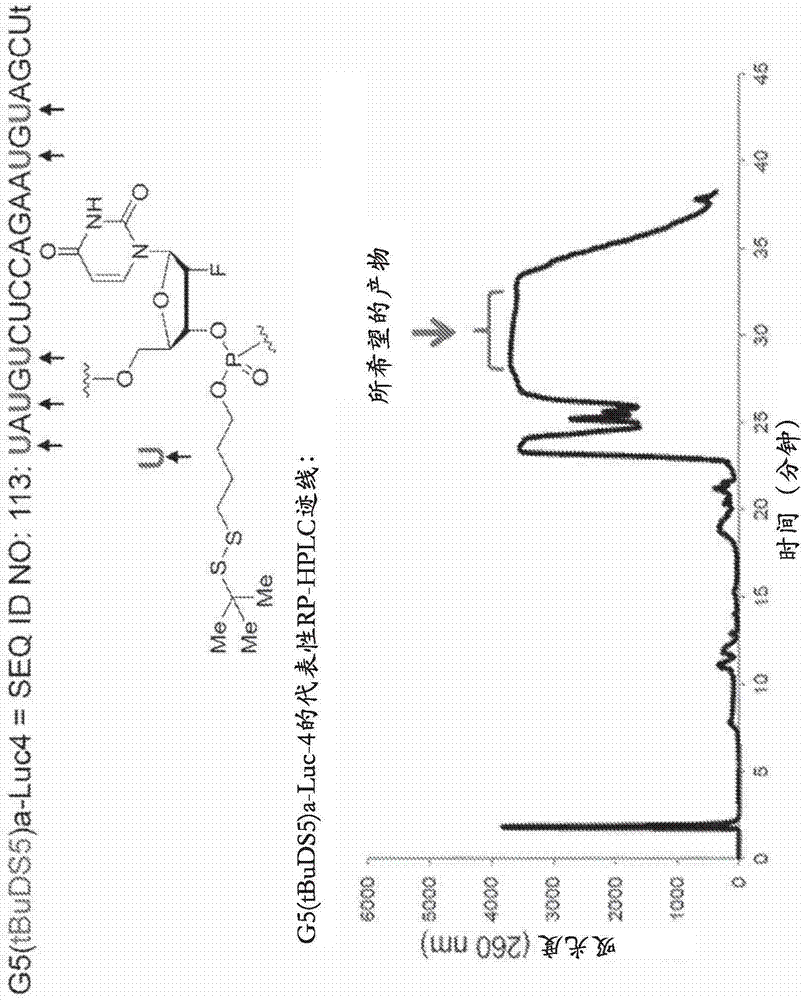
本发明涉及用于转染细胞的组合物和方法。
背景技术:
:已使用各种重组病毒载体、脂质递送系统和电穿孔进行了体外和体内向细胞的核酸递送。这类技术试图通过减少或抑制基因表达、提供用于基因疗法的遗传构建体来治疗各种疾病和障碍或试图研究各种生物系统。聚阴离子聚合物如多核苷酸不容易扩散穿过细胞膜。为了克服针对培养的细胞的这一问题,典型地将阳离子脂质与阴离子多核苷酸组合以便帮助摄取。不幸的是,这种复合物通常是对细胞有毒的,这意味着必须小心地控制阳离子脂质的暴露时间和浓度两者以便确保活细胞的转染。rna干扰(rnai)作为一种选择性地降解mrna的细胞机制的发现允许在细胞培养中靶向操纵细胞表型以及开发定向治疗剂的潜力(贝克(behlke),分子治疗(mol.ther.)13,644-670,2006;谢(xie)等人,今日药物发现(drugdiscov.today)11,67-73,2006)。然而,由于它们的大小和带负电荷(阴离子)的性质,sirna是不能进入细胞的大分子。确实,sirna超过膜可扩散分子的细胞递送的通常将大小限制至小于500da的利平斯基(lipinski)“5s法则”25倍。因此,在不存在一种递送媒介物或转染剂的情况下,即使在毫摩尔浓度下裸sirna也不会进入细胞(巴基内罗(barquinero)等人,基因治疗(genether.)11增刊1,s3-9,2004)。显著注意力一直集中于使用阳离子脂质,这些阳离子脂质使sirna缩合并且在细胞膜中穿孔以便解决sirna递送问题。尽管广泛使用,但转染试剂未能实现有效递送到许多细胞类型中,尤其是原代细胞和造血细胞谱系(t细胞和b细胞,巨噬细胞)。此外,脂质转染试剂经常导致从在肿瘤细胞中轻度到在原代细胞中高度范围的不同程度的细胞毒性。因此,对于具有增加的转染细胞能力的多核苷酸构建体存在需要。发明概述一般来说,本发明提供了具有非生物可逆性基团或非生物可逆性基团和生物可逆性基团的组合的杂交多核苷酸。特定地,本发明的特征是具有引导链和过客链的杂交的多核苷酸构建体,其中该引导链包括非生物可逆性基团。在第一方面,本发明提供了一种杂交的多核苷酸构建体,该多核苷酸构建体包括过客链,可加载到risc复合物中的引导链,以及(i)在引导链中的3’末端或核苷酸间非生物可逆性基团;或(ii)在过客链中的5’末端、3’末端、或核苷酸间非生物可逆性基团,和在引导链或过客链中的5’末端、3’末端、或核苷酸间二硫化物生物可逆性基团。在具体的实施例中,该杂交的多核苷酸构建体包括至少一个二硫化物生物可逆性基团。在一些实施例中,该二硫化物生物可逆性基团包括-s-s-(连接a)-b,其中连接a为二价或三价连接子,包括键合至b的sp3-杂化碳原子和键合至-s-s-的碳原子,其中,当连接a是三价连接子时,连接a的第三化合价与-s-s-组合以形成任选取代的c3-9亚杂环基,并且b是5’末端磷(v)基团、3’末端磷(v)基团、或核苷酸间磷(v)基团。在某些实施例中,杂交的多核苷酸构建体包括过客链和可加载到risc复合物中的引导链,其中每个过客链和引导链具有根据下化学式的结构:5’-d-(nuc-e)n-nuc-f,或其盐,其中每个n独立地是从10至150的一个整数;每个nuc独立是核苷;并且引导链的d是羟基、磷酸酯或二硫化物生物可逆性基团;过客链的d是h、羟基、任选取代的c1-6烷氧基、受保护的羟基基团、磷酸酯、二磷酸酯、三磷酸酯、四磷酸酯、五磷酸酯、5’帽、磷酸硫醇、任选取代的c1-6烷基、含氨基基团、含生物素基团、含地高辛基团、含胆固醇基团、含染料基团、含淬灭剂基团、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、非生物可逆性基团或二硫化物生物可逆性基团;每个e独立地是磷酸酯、硫代磷酸酯、非生物可逆性基团或二硫化物生物可逆性基团;每个f独立地是h、羟基、任选取代的c1-6烷氧基、受保护的羟基基团、单磷酸酯、二磷酸酯、三磷酸酯、四磷酸酯、五磷酸酯、磷酸硫醇、任选取代的c1-6烷基、含氨基基团、含生物素基团、含地高辛基团、含胆固醇基团、含染料基团、含淬灭剂基团、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、非生物可逆性基团或二硫化物生物可逆性基团;例如,其中二硫化物生物可逆性基团中至少一个包括-s-s-(连接a)-b,其中连接a独立地为二价或三价连接子,包括键合至b的sp3-杂化碳原子和键合至-s-s-的碳原子,其中,当连接a是三价连接子时,连接a的第三化合价与-s-s-组合以形成任选取代的c3-9亚杂环基;并且b独立地是5’末端磷(v)基团、3’末端磷(v)基团、或核苷酸间磷(v)基团;其中杂交的多核苷酸构建体包括在引导链中的至少一个非生物可逆性基团,或者杂交的多核苷酸构建体包括二硫化物生物可逆性基团和至少一个非生物可逆性基团。在具体的实施例中,二硫化物生物可逆性基团具有以下结构:(r1)q-(连接c)-s-s-(连接a)-b,其中每个q独立地是从1至10的一个整数;每个连接c独立为键或具有从12da至10000da的分子量的多价连接子;并且每个r1独立地是h、叠氮基、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、或内体逃逸部分。在一些实施例中,杂交的多核苷酸构建体进一步包含第二过客链或第二引导链(例如,杂交的多核苷酸构建体包含两个过客链和两个引导链),其中连接c是一种进一步键合至第二过客链或第二引导链的-s-s-(连接a)-b的多价连接子(例如,连接c键合至两个引导链或两个过客链)。在其他实施例中,连接c包括一个或多个单体,其中每个单体独立地是任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;亚氨基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在又其他实施例中,连接c包括一个或多个单体,其中每个单体独立地是任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;亚氨基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在仍其他实施例中,连接c包括一个或多个单体,其中每个单体独立地是任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在一些实施例中,连接c包括1至500个单体(例如,1至300个单体,1至200个单体,1至150个单体,或1至100个单体)。在某些实施例中,连接c包括一个或多个c1-6亚烷氧基基团(例如,少于100个c1-6亚烷氧基基团)。在具体实施例中,连接c包括一个或多个聚(环氧烷),例如,聚环氧乙烷、聚环氧丙烷、聚(氧杂环丁烷)、聚环氧丁烷、聚(氧杂环戊烷)、以及其二嵌段或三嵌段共聚物(例如,聚(环氧烷)是聚环氧乙烷)。在具体实施例中,连接c包括独立地选自下组的一个或多个基团,该组由以下各项组成及其组合。在另外的实施例中,杂交的多核苷酸构建体进一步包括第二过客链或第二引导链(例如,杂交的多核苷酸构建体包含两个过客链和两个引导链),其中该过客链或该引导链通过非生物可逆性基团共价连接至该第二过客链或该第二引导链(例如,两个过客链或两个引导链通过非生物可逆性基团共价地连接)。在某些实施例中,连接a包括独立地选自下组的1、2、或3个单体,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;任选取代的n;o;或s(o)m,其中每个m独立地为0、1、或2。在其他实施例中,连接a包括独立地选自下组的1、2、或3个单体,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;任选取代的n;o;或s(o)m,其中每个m独立地为0、1、或2。在又其他实施例中,连接a包括独立地选自下组的1、2、或3个单体,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;或o。在一些实施例中,连接a包括2或3个单体,这些单体之一具有以下结构:其中z1是至-s-s-的键;z2是至连接a的另一个单体的键;q1是n或cr2;q2是o、s、nr3、或-c(r5)=c(r6)-;q3是与r4键合的n或c;r2、r3、r4、r5、和r6各自独立地为h、c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;或-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;或r5和r6与各自附接的原子一起组合以形成选自下组的环状基团,该组由以下各项组成:c6芳基、c2-7杂芳基和c2-7杂环基,其中该环状基团任选地被选自下组的1、2、或3个取代基取代,该组由以下各项组成:c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;和-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基。在某些实施例中,q1是cr2。在具体实施例中,r2是h、卤代、或c1-6烷基。在其他实施例中,q2是o或-c(r5)=c(r6)-。在又其他实施例中,q2是-c(r5)=c(r6)-。在仍其他实施例中,r5是h、卤代、或c1-6烷基。在一些实施例中,r6是h、卤代、或c1-6烷基。在仍然其他实施例中,r5和r6与各自附接的原子一起组合以形成被选自下组的1、2或3个取代基任选取代的c2-5杂芳基,该组由以下各项组成:c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;和-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基。在某些实施例中,该c2-5杂芳基包括两个氮原子(例如,c2-5杂芳基任选地被c1-6烷基取代)。在具体的实施例中,q2是o。在某些实施例中,q3是cr4。在一些实施例中,r4是h、卤代、或c1-6烷基。在其他实施例中,连接a和-s-s-组合以形成一种结构:其中每个r7独立地为c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;或-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;或两个相邻的r7基团与每个r7附接的原子一起组合以形成选自下组的环状基团,该组由以下各项组成:c6芳基、c2-5杂环基或c2-5杂芳基,其中该环状基团任选地被选自下组的1、2、或3个取代基取代,该组由以下各项组成:c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;和-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;q是0、1、2、3、或4;并且s是0、1、或2。在又其他实施例中,r7是卤代或任选取代的c1-6烷基。在仍其他实施例中,s是0或1(例如,s是0)。在某些实施例中,q是0、1或2(例如,q是0或1)。在具体实施例中,两个相邻r7基团与每个r7所附接的原子一起组合以形成任选地被1、2、或3个c1-6烷基基团取代的c2-5杂芳基。在一些实施例中,连接a和-s-s-组合以形成一种结构:其中这些虚线表示一个且仅一个双键,并且r8附接到具有空化合价的氮原子并且是h,c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;或-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基。在某些实施例中,r8是h或c1-6烷基。在其他实施例中,二硫化物生物可逆性基团中的至少一个包括一个或多个单体,其中每个单体独立地是任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;亚氨基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在又其他实施例中,生物可逆性基团中的至少一个包括一个或多个单体,其中每个单体独立地是任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;亚氨基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在仍然其他实施例中,生物可逆性基团中的至少一个包括一个或多个单体,其中每个单体独立地是任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在具体的实施例中,单体中的至少一个是s(o)m,并且m是2。在某些实施例中,生物可逆性基团中的至少一个包括2至500个单体(例如,2至300个单体,2至200个单体,2至150个单体,或2至100个单体)。在一些实施例中,生物可逆性基团中的至少一个包括一个或多个c1-6亚烷氧基基团(例如,生物可逆性基团中的至少一个包括少于100个c1-6亚烷氧基基团)。在具体的实施例中,生物可逆性基团中的至少一个包括一个或多个聚(环氧烷)(例如,聚环氧乙烷、聚环氧丙烷、聚(氧杂环丁烷)、聚环氧丁烷、聚(氧杂环戊烷)、以及其二嵌段或三嵌段共聚物)。在其他实施例中,该聚(环氧烷)是聚环氧乙烷。在另外的实施例中,非生物可逆性基团中的至少一个包括一个或多个辅助部分,一个或多个辅助部分各自独立地是多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、和内体逃逸部分。在一些实施例中,非生物可逆性基团中的至少一个包括碳水化合物(例如,碳水化合物是甘露糖、n-乙酰半乳糖胺、或d-葡萄糖醇)。在具体的实施例中,非生物可逆性基团中的至少一个包括靶向部分(例如,靶向部分是叶酸配体,靶向部分是前列腺特异性膜抗原(psma),靶向部分是内质网靶向基团,或靶向部分是结合白蛋白的基团)。在其他实施例中,非生物可逆性基团中的至少一个包括多肽(例如,多肽是细胞穿透肽,或该多肽是内体逃逸部分)。在又其他实施例中,生物可逆性基团中的至少一个包括碳水化合物(例如,碳水化合物是甘露糖、n-乙酰半乳糖胺、或d-葡萄糖醇)。在具体的实施例中,至少一个r1是碳水化合物(例如,碳水化合物是甘露糖、n-乙酰半乳糖胺、或d-葡萄糖醇)。在仍然其他实施例中,生物可逆性基团中的至少一个包括靶向部分(例如,靶向部分是叶酸配体,靶向部分是前列腺特异性膜抗原(psma),靶向部分是内质网靶向基团,或靶向部分是结合白蛋白的基团)。在一些实施例中,至少一个r1是靶向部分(例如,靶向部分是叶酸配体,靶向部分是前列腺特异性膜抗原(psma),靶向部分是内质网靶向基团,或靶向部分是结合白蛋白的基团)。在具体的实施例中,生物可逆性基团中的至少一个包括多肽(例如,多肽是细胞穿透肽,多肽是内体逃逸部分,或引导链包括非生物可逆性基团)。在一些实施例中,至少一个r1是多肽(例如,多肽是细胞穿透肽,多肽是内体逃逸部分,或引导链包括非生物可逆性基团)。在其他实施例中,生物可逆性基团中的至少一个包括多肽(例如,多肽是细胞穿透肽,或该多肽是内体逃逸部分)。在某些其他实施例中,至少一个r1是多肽(例如,多肽是细胞穿透肽,或该多肽是内体逃逸部分)。在其他实施例中,至少一个r1是叠氮基、多肽、碳水化合物、靶向部分、或内体逃逸部分。在某些实施例中,非生物可逆性基团中的一个连接引导链的第二核苷和第三核苷。在具体的实施例中,非生物可逆性基团中的一个连接引导链的第五核苷和第六核苷。在其他的实施例中,非生物可逆性基团中的一个连接引导链的第十七核苷和第十八核苷。在又其他实施例中,非生物可逆性基团中的一个是引导链的3'末端基团。在具体的实施例中,引导链包括从1到5个非生物可逆性基团(例如,引导链包括1个非生物可逆性基团)。在一些实施例中,过客链包括至少一个非生物可逆性基团(例如,过客链包括1至5个非生物可逆性基团(例如,1个非生物可逆性基团))。在其他实施例中,非生物可逆性基团连接过客链的两个核苷,其中核苷布置在5’方向上距离天然risc介导的切割位点至少一个核苷处。在又其他实施例中,非生物可逆性基团连接过客链的第一和第二核苷。在仍然其他实施例中,引导链包括至少一个二硫化物生物可逆性基团。在某些实施例中,过客链包括至少一个二硫化物生物可逆性基团。在具体的实施例中,二硫化物生物可逆性基团连接选自引导链的三个5’末端核苷的两个连续核苷(例如,b是连接选自引导链的3个5'末端核苷酸的两个连续核苷酸的核苷酸间磷(v)基团)。在一些实施例中,在具体的实施例中,二硫化物生物可逆性基团连接选自引导链的3个3’末端核苷的两个连续核苷。在其他实施例中,生物可逆性基团是过客链的5’末端基团(例如,过客链的d是二硫化物生物可逆性基团)。在某些其他实施例中,生物可逆性基团是引导链的5'末端基团(例如,引导链的d是二硫化物生物可逆性基团)。在又其他实施例中,生物可逆性基团是引导链的3’末端基团(例如,引导链的f是二硫化物生物可逆性基团)。在仍其他实施例中,生物可逆性基团是过客链的3’末端基团(例如,过客链的f是二硫化物生物可逆性基团)。在具体的实施例中,二硫化物生物可逆性基团连接选自过客链的三个5’末端核苷的两个连续核苷(例如,b是连接选自过客链的3个5'末端核苷酸的两个连续核苷酸的核苷酸间磷(v)基团)。在一些实施例中,二硫化物生物可逆性基团连接选自过客链的三个3’末端核苷的两个连续核苷(例如,b是连接选自过客链的3个3’末端核苷的两个连续核苷的核苷酸间磷(v)基团)。在其他实施例中,非生物可逆性基团是过客链的5’末端基团(例如,过客链的d是非生物可逆性基团)。在又其他实施例中,非生物可逆性基团是引导链的3’末端基团(例如,引导链的f是非生物可逆性基团)。在仍其他实施例中,非生物可逆性基团是过客链的3’末端基团(例如,过客链的f是非生物可逆性基团)。在某些实施例中,非生物可逆性基团包括一个或多个单体,每个单体独立地是任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在具体的实施例中,该一个或多个单体中的每个独立地是任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在其他实施例中,该一个或多个单体中的每个独立地是任选取代的c1-6亚烷基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;任选取代的n;o;或s(o)m,其中m是0、1、或2。在又其他实施例中,单体中的至少一个是s(o)m,并且m是0或2(例如,m是2)。在具体的实施例中,非生物可逆性基团独立地包括从1至200个单体。在一些实施例中,非生物可逆性基团独立地包括从1至150个单体。在其他实施例中,非生物可逆性基团独立地包括从1至100个单体。在又其他实施例中,非生物可逆性基团独立地包括从1至3个单体。在仍其他实施例中,非生物可逆性基团独立地包括1个单体。在一些实施例中,非生物可逆性基团独立地是被独立选自下组的取代基取代的磷酸酯或硫代磷酸酯,该组由以下各项组成:任选取代的c3-6烷基;任选取代的c3-6烯基;任选取代的c3-6炔基;任选取代的c3-8环烷基;任选取代的c3-8环烯基;任选取代的(c3-8环烷基)-c1-4-烷基;任选取代的(c3-8环烯基)-c1-4-烷基;任选取代的c6-14芳基;任选取代的(c6-14芳基)-c1-4-烷基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂芳基;具有选自n、o中的1至4个杂原子的任选取代的(c1-9杂芳基)-c1-4-烷基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂环基,其中该杂环基不包括s-s键;和具有选自n、o和s的1至4个杂原子的任选取代的(c1-9杂环基)-c1-4-烷基,其中该杂环基不包括s-s键。在某些实施例中,将-s-s-连接到核苷酸间磷(v)基团、5’末端基团或3’末端基团的最短原子链是3。在其他实施例中,将-s-s-连接到核苷酸间磷(v)基团、5’末端基团或3’末端基团的最长原子链是6。在又其他实施例中,该至少一个二硫化物生物可逆性基团独立地包括至少一个邻近二硫化物的庞大基团。在其他实施例中,引导链包括19或更多个核苷(例如,引导链的n是17或更大)。在又其他实施例中,引导链包括少于100个核苷(例如,引导链的n是98或更小)。在仍其他实施例中,引导链包括少于50个核苷(例如,引导链的n是48或更小)。在具体的实施例中,引导链包括少于32个核苷(例如,引导链的n是30或更小)。在某些实施例中,过客链包括19或更多个核苷。在其他实施例中,过客链包括19或更多个核苷(例如,过客链的n是17或更大)。在又其他实施例中,过客链包括少于100个核苷(例如,过客链的n是98或更小)。在仍其他实施例中,过客链包括少于50个核苷(例如,过客链的n是48或更小)。在具体的实施例中,过客链包括少于32个核苷(例如,过客链的n是30或更小)。在某些实施例中,过客链包括19或更多个核苷。在第二方面,本发明提供了一种将多核苷酸构建体递送至细胞的方法,该方法包括使该细胞与以上方面的任一实施例的杂交的多核苷酸构建体接触。在第三方面,本发明提供了一种降低细胞中多肽表达的方法,该方法包括使该细胞与第一方面的任一实施例的杂交的多核苷酸构建体接触。在具体的实施例中,上述方面中任一方面所述的生物可逆性或非生物可逆性基团是具有化学式(ii)或的基团、或其盐,其中,u是0或1;a1是键或连接子,其包含或为以下各项中的一个或多个:任选取代的n;o;s;任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的(c3-8环烷基)-c1-4-亚烷基;任选取代的(c3-8环烯基)-c1-4-亚烷基;任选取代的c6-14亚芳基;任选取代的(c6-14芳基)-c1-4-亚烷基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的(c1-9杂芳基)-c1-4-亚烷基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;和具有选自n、o和s的1至4个杂原子的任选取代的(c1-9杂环基)-c1-4-亚烷基,条件是当a1包括任选取代的n、o和s中的一个或多个时,该任选取代的n、o或s不直接键合到二硫化物;并且每个a2独立地选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;和具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;或a1和a2与-s-s-一起连接以形成任选取代的5至16元环;a3选自下组,该组由以下各项组成:键,任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基,具有选自n、o、和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;o;任选取代的n;和s;a4选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;和具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;l不存在或是一个共轭基团,该共轭基团包含一个或多个共轭部分或由一个或多个共轭部分组成;每个r4独立地是氢、任选取代的c1-6烷基、亲水性官能团、或包括辅助部分的基团,该辅助部分选自下组,该组由以下各项组成:小分子、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、以及其组合;并且r独立地是从1至10的一个整数。对于非生物可逆性基团,u为0。在一些实施例中,生物可逆性基团是具有化学式(ii)的基团或其盐,其中u是1。在其他实施例中,生物可逆性基团是具有化学式(ii)的基团或其盐,其中u是0。在具体的实施例中,当生物可逆性基团是具有化学式的基团或其盐时,其中a2、a3、和a4组合以形成c4-5亚烷基。在具体的实施例中,当生物可逆性基团是具有化学式的基团或其盐时,其中a2、a3、和a4组合以形成c4-5亚烷基。在其他实施例中,当生物可逆性基团是具有化学式的基团或其盐时,基团-a2-a3-a4-x-不包含磷酸酯、酰胺、酯、或亚烯基。在某些实施例中,每个x是o。在具体实施例中,每个z是o。在本发明任何方面的某些实施例中,所有核苷都是核糖核苷,例如,其中每个核糖核苷酸的2’位置被f、-ome、或-o-et-o-me取代。定义如在此所用,术语“约”表示为所列举值的±10%的一个值。如在此所用,术语“活化的羰基”表示具有-c(o)ra的化学式的官能团,其中ra是卤素、任选取代的c1-6烷氧基、任选取代的c6-10芳氧基、任选取代的c2-9杂芳氧基(例如,-obt)、任选取代的c2-c9杂环氧基(例如,-osu)、任选取代的吡啶鎓(例如,4-二甲基氨基吡啶鎓)、或-n(ome)me。如在此所用,术语“活化的磷中心”表示三价磷(iii)或五价磷(v)中心,其中这些取代基中的至少一个是卤素、任选取代的c1-6烷氧基、任选取代的c6-10芳氧基、磷酸酯、二磷酸酯、三磷酸酯、四磷酸酯、任选取代的吡啶鎓(例如,4-二甲基氨基吡啶鎓)、或任选取代的铵。如在此所用,术语“活化的硅中心”表示四取代的硅中心,其中这些取代基中的至少一个是卤素、任选取代的c1-6烷氧基、或氨基。如在此所用,术语“活化的硫中心”表示四价硫,其中这些取代基中的至少一个是卤素、任选取代的c1-6烷氧基、任选取代的c6-10芳氧基、磷酸酯、二磷酸酯、三磷酸酯、四磷酸酯、任选取代的吡啶鎓(例如,4-二甲基氨基吡啶鎓)、或任选取代的铵。如在此所用,术语“烷酰基”表示通过羰基基团附接至母体分子基团的氢或烷基基团(例如,卤代烷基基团)并且由甲酰基(即,甲醛基团)、乙酰基、丙酰基、丁酰基、异丁酰基等举例说明。示例性未取代的烷酰基基团包括从1至7个碳。在一些实施例中,烷基基团进一步被如在此所述的1、2、3、或4个取代基取代。如在此所用,术语“(cx1-y1芳基)-cx2-y2-烷基”表示通过具有x2至y2个碳原子的一个亚烷基基团附接至母体分子基团的具有x1至y1个碳原子的一个芳基基团。示例性未取代的(cx1-y1芳基)-cx2-y2-烷基基团是从7至16个碳。在一些实施例中,亚烷基和芳基各自均可以进一步被针对相应基团如在此所定义的1、2、3、或4个取代基基团取代。以相同方式定义后接“烷基”的其他基团,其中除非另外指出,否则“烷基”是指c1-6亚烷基,并且所附接的化学结构是如在所定义。如在此所用,术语“烯基”表示包含一个、两个或三个碳-碳双键的无环单价直链或支链的烃基团。烯基基团的非限制性实例包括乙烯基、丙-1-烯基、丙-2-烯基、1-甲基乙烯基、丁-1-烯基、丁-2-烯基、丁-3-烯基、1-甲基丙-1-烯基、2-甲基丙-1-烯基、以及1-甲基丙-2-烯基。烯基基团可以任选地被独立地选自下组的1、2、3、或4个取代基基团取代,该组由以下各项组成:如在此所定义的芳基、环烷基、杂环基(例如,杂芳基)以及针对烷基描述的这些取代基基团。此外,当烯基基团存在于本发明的生物可逆性基团中时,该烯基基团可以被结合至如在此所定义的共轭部分、亲水性官能团、或辅助部分的硫酯或二硫化物基团取代。如在此所用,术语“亚烯基”是指去除一个氢、从而使该基团二价的一个直链或支链烯基基团。亚烯基基团的非限制性实例包括乙烯-1,1-二基;乙烯-1,2-二基;丙-1-烯-1,1-二基,丙-2-烯-1,1-二基;丙-1-烯-1,2-二基,丙-1-烯-1,3-二基;丙-2-烯-1,1-二基;丙-2-烯-1,2-二基;丁-1-烯-1,1-二基;丁-1-烯-1,2-二基;丁-1-烯-1,3-二基;丁-1-烯-1,4-二基;丁-2-烯-1,1-二基;丁-2-烯-1,2-二基;丁-2-烯-1,3-二基;丁-2-烯-1,4-二基;丁-2-烯-2,3-二基;丁-3-烯-1,1-二基;丁-3-烯-1,2-二基;丁-3-烯-1,3-二基;丁-3-烯-2,3-二基;丁-1,2-二烯-1,1-二基;丁-1,2-二烯-1,3-二基;丁-1,2-二烯-1,4-二基;丁-1,3-二烯-1,1-二基;丁-1,3-二烯-1,2-二基;丁-1,3-二烯-1,3-二基;丁-1,3-二烯-1,4-二基;丁-1,3-二烯-2,3-二基;丁-2,3-二烯-1,1-二基;和丁-2,3-二烯-1,2-二基。亚烯基基团可以是未取代的或取代的(例如,任选取代的亚烯基),如针对烯基基团所描述。如在此所用,术语“烷氧基”表示具有化学式-or的一个化学取代基,其中r是一个c1-6烷基,除非另外说明。在一些实施例中,烷基基团可以进一步被如在此定义的1、2、3、或4个取代基基团取代。如在此所用,术语“烷基”是指具有从1至12个碳的一个无环直链或支链的饱和烃基团,除非另外说明。烷基基团由甲基;乙基;正丙基和异丙基;正丁基、仲丁基、异丁基和叔丁基;新戊基等举例说明,并且可以任选地被独立地选自下组的一个、两个、三个、或(在具有两个碳或更多个碳的烷基基团的情况下)四个取代基取代,该组由以下各项组成:(1)烷氧基;(2)烷基亚磺酰基;(3)氨基;(4)芳基烷氧基;(5)(芳烷基)氮杂;(6)叠氮基;(7)卤代;(8)(杂环基)氧基;(9)(杂环基)氮杂;(10)羟基;(11)硝基;(12)氧代;(13)芳氧基;(14)硫化物;(15)硫代烷氧基;(16)硫醇;(17)-co2ra,其中ra选自下组,该组由以下各项组成:(a)烷基、(b)芳基、(c)氢、和(d)芳烷基;(18)-c(o)nrbrc,其中rb和rc各自独立地选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳基亚烷基;(19)-so2rd,其中rd选自下组,该组由以下各项组成:(a)烷基、(b)芳基、和(c)芳基亚烷基;(20)-so2nrerf,其中re和rf各自独立地选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳烷基;(21)甲硅烷基;(22)氰基;和(23)-s(o)rh,其中rh选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳烷基。在一些实施例中,这些基团各自可以进一步如在此所描述被取代。在某些实施例中,键合至母体分子基团的烷基碳原子不是氧代取代的。如在此所用,术语“亚烷基”是指通过去除至少两个氢原子而衍生自一个直链或支链的饱和烃基团的一个饱和的二价、三价、或四价烃基团。亚烷基在键合至一个不是任选取代基的氮杂基团时可以是三价的;亚烷基在键合至两个不是任选取代基的氮杂基团时可以是三价或四价的。在此定义的亚烷基的化合价不包括这些任选取代基。亚烷基基团的非限制性实例包括亚甲基、乙烷-1,2-二基、乙烷-1,1-二基、丙烷-1,3-二基、丙烷-1,2-二基、丙烷-1,1-二基、丙烷-2,2-二基、丁烷-1,4-二基、丁烷-1,3-二基、丁烷-1,2-二基、丁烷-1,1-二基、以及丁烷-2,2-二基、丁烷-2,3-二基。术语“cx-y亚烷基”表示具有x与y个碳之间的亚烷基基团。x的示例性值是1、2、3、4、5、以及6,并且y的示例性值是2、3、4、5、6、7、8、9、10、11、以及12。在一些实施例中,亚烷基可以进一步被如在此针对一个烷基基团所定义的1、2、3、或4个取代基基团取代。类似地,后缀“ene”指明如在此定义的相应单价基团的一个二价基团。例如,亚烯基、亚炔基、亚芳基、芳基亚烷基、亚环烷基、环烷基亚烷基、亚环烯基、杂亚芳基、杂芳基亚烷基、亚杂环基、以及杂环基亚烷基是烯基、炔基、芳基、芳基烷基、环烷基、环烷基烷基、环烯基、杂芳基、杂芳基烷基、杂环基、以及杂环基烷基的二价形式。对于芳基亚烷基、环烷基亚烷基、杂芳基亚烷基、以及杂环基亚烷基,该基团中的两个化合价仅可以位于无环部分中,或一个位于环状部分中且一个位于无环部分中。此外,当烷基或亚烷基、烯基或亚烯基、或炔基或亚炔基基团存在于生物可逆性或非生物可逆性基团中时,该基团可以被结合至如在此所定义的共轭部分、亲水性官能团、或辅助部分的酯、硫酯或二硫化物基团取代。例如,一个芳基-c1-亚烷基或一个杂环基-c1-亚烷基的亚烷基基团可以进一步被一个氧代基团取代以得到对应的芳酰基和(杂环基)酰基取代基基团。如本文所用的术语“亚烷氧基”是指二价基团-r-o-,其中r是亚烷基。如在此所用,术语“炔基”表示具有从2至6个碳原子的包含至少一个碳-碳三键的单价直链或支链的烃基团,并且由乙炔基、1-丙炔基等举例说明。炔基基团可以任选地被独立地选自以下各项的1、2、3、或4个取代基基团取代:如在此所定义的芳基、烯基、环烷基、杂环基(例如,杂芳基)、以及针对烷基描述的这些取代基基团。如在此所用,术语“亚炔基”是指包括一个或两个碳-碳三键且在未取代时仅包含c和h的一个直链或支链的二价取代基。亚烯基基团的非限制性实例包括乙炔-1,2-二基;丙-1-炔-1,3-二基;丙-2-炔-1,1-二基;丁-1-炔-1,3-二基;丁-1-炔-1,4-二基;丁-2-炔-1,1-二基;丁-2-炔-1,4-二基;丁-3-炔-1,1-二基;丁-3-炔-1,2-二基;丁-3-炔-2,2-二基;和丁-1,3-二炔-1,4-二基。亚炔基基团可以是未取代的或取代的(例如,任选取代的亚炔基),如针对炔基基团所描述。如在此所用,术语“氨基”表示-n(rn1)2或-n(rn1)c(nrn1)n(rn1)2,其中每个rn1独立地是h、oh、no2、n(rn2)2、so2orn2、so2rn2、sorn2、n-保护基团、烷基、烯基、炔基、烷氧基、芳基、芳基烷基、环烷基、环烷基烷基、杂环基(例如,杂芳基)、杂环基烷基(例如,杂芳基烷基)、或两个rn1组合以形成一个杂环基,并且其中每个rn2独立地是h、烷基、或芳基。在一个实施例中,氨基是-nh2或-nhrn1,其中rn1独立地是oh、no2、nh2、nrn22、so2orn2、so2rn2、sorn2、烷基、或芳基,并且每个rn2可以是h、烷基、或芳基。每个rn1基团可以独立地是未取代的或取代的,如在此所描述。此外,当氨基基团存在于本发明的生物可逆性基团中时,该氨基基团可以被结合至如在此所定义的共轭部分、亲水性官能团、或辅助部分的酯、硫酯或二硫化物基团取代。如在此所用,术语“抗体”在广义上使用并且具体地涵盖例如单一单克隆抗体、具有多表位特异性的抗体组合物、单链抗体,以及抗体的片段(例如,抗原结合片段或fc区)。如在此所用的“抗体”包括完整免疫球蛋白或抗体分子、多克隆抗体、多特异性抗体(即,由至少两种完整抗体形成的双特异性抗体)、以及免疫球蛋白片段(如fab、f(ab’)2或fv),只要它们识别抗原和/或表现出在此所述的任何所希望的激动特性或拮抗特性。抗体或片段可以是人源化、人、或嵌合的。本文所用的术语“芳基”表示具有一个或两个芳环的单环、双环或多环碳环系统,并且由以下各项举例说明:苯基、萘基、1,2-二氢萘基、1,2,3,4-四氢萘基、芴基、茚满基、茚基等,并且可以任选地被一个、两个、三个、四个、或五个独立地选自下组的取代基取代,该组由以下各项组成:(1)烷酰基(例如,甲酰基、乙酰基等);(2)烷基(例如,烷氧基烷基、烷基亚磺酰基烷基、氨基烷基、叠氮基烷基、酰基烷基、卤代烷基(例如,全氟烷基)、羟基烷基、硝基烷基或硫代烷氧基烷基);(3)烯基;(4)炔基;(5)烷氧基(例如,全氟烷氧基);(6)烷基亚磺酰基;(7)芳基;(8)氨基;(9)芳烷基;(10)叠氮基;(11)环烷基;(12)环烷基烷基;(13)环烯基;(14)环烯基烷基;(15)卤代;(16)杂环基(例如,杂芳基);(17)(杂环基)氧基;(18)(杂环基)氮杂;(19)羟基;(20)硝基;(21)硫代烷氧基;(22)-(ch2)qco2ra,其中q是从0至4的一个整数,并且ra选自下组,该组由以下各项组成:(a)烷基、(b)芳基、(c)氢、和(d)芳烷基;(23)-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳烷基;(24)-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:(a)烷基、(b)芳基、和(c)芳烷基;(25)-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳烷基;(26)硫醇;(27)芳氧基;(28)环烷氧基;(29)芳基烷氧基;(30)杂环基烷基(例如,杂芳基烷基);(31)甲硅烷基;(32)氰基;和(33)-s(o)rh,其中rh选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳烷基。在一些实施例中,这些基团各自可以进一步如在此所描述被取代。此外,当芳基基团存在于本发明的生物可逆性基团中时,该芳基基团可以被结合至如在此所定义的共轭部分、亲水性官能团、或辅助部分的酯、硫酯或二硫化物基团取代。如在此所用,术语“芳基烷基”表示被芳基基团取代的烷基基团。这些芳基和烷基部分可以被取代为如在此所描述的这些单独基团。术语“辅助部分”是指能够与在此披露的一种核苷酸构建体共轭的任何部分,包括但不限于,小分子、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、以及其任何组合。通常,但并不总是如此,“辅助部分”通过与存在于二硫化物生物可逆性基团或非生物可逆性基团上的一个或多个共轭基团形成一个或多个共价键而连接或附接至在此披露的一种核苷酸构建体。然而,在替代实施例中,“辅助部分”可以通过除了存在于二硫化物生物可逆性基团上的共轭基团之外与核苷酸构建体的任何部分(如与核苷酸糖分子的2’、3’、或5’位置,或核苷碱基的任何部分)形成一个或多个共价键,来与本文披露的核苷酸构建体连接或附接。虽然一种特定辅助部分的名称可能暗示一种游离分子,但是应当了解这样一种游离分子附接至一种核苷酸构建体。本领域的技术人员将容易地理解一种特定辅助部分与一种核苷酸构建体的适当附接点。如在此所用,术语“氮杂”表示一个二价-n(rn1)-基团或一个三价-n=基团。氮杂基团可以是未取代的,其中rn1是h或不存在;或取代的,其中rn1是如针对“氨基”所定义。氮杂也可被称为“n”,例如,“任选取代的n”。两个氮杂基团可以连接以形成“二氮杂”。如在此所用,术语“叠氮基”表示一个n3基团。如在此所用,术语“生物可逆性基团”表示包括官能团的部分,该官能团可以例如经由一个或多个细胞内酶(例如,细胞内还原酶)的作用在细胞内主动裂解或在细胞内被动裂解,如通过使该基团暴露于细胞内环境或存在于细胞中的条件(例如,ph、还原或氧化环境,或与细胞内物质如谷胱甘肽反应)。生物可逆性基团在其内并入多核苷酸的磷酸酯或硫代磷酸酯。示例性生物可逆性基团包括二硫化物。其他示例性生物可逆性基团包括硫酯。如在此所用,术语“庞大基团”表示如在此所定义的任何取代基或取代基组,其中该庞大基团的自由基携带一个氢原子或更少(如果该自由基是sp3-杂化碳),不携带有氢原子(如果该自由基是sp2-杂化碳)。该自由基不是sp-杂化碳。该庞大基团仅通过一个碳原子键合至另一个基团。例如,声明“键合至二硫键联的庞大基团”、“附接至二硫键联的庞大基团”、以及“连接至二硫键联的庞大基团”指示该庞大基团通过碳自由基键合至二硫键联。如在此所用的术语“碳烯”表示官能团,该官能团是具有六价电子和结构=c或-c(rb)的二价碳物质:其中rb选自h、任选取代的c1-12烷基、任选取代的c6-14芳基、任选取代的(c6-14芳基)-c1-12-亚烷基、或任选取代的羰基;并且c是具有不是共价键的一部分的两个电子的碳。这两个电子可以是成对的(例如,单线态碳烯)或不成对的(例如,三线态碳烯)。如在此所用,术语“碳环”表示任选取代的c3-12单环、双环或三环结构,其中可以是芳族或非芳族的环由碳原子形成。碳环结构包括环烷基基团、环烯基基团、以及芳基基团。如在此所用,术语“碳水化合物”表示包含一个或多个单糖单元的一种化合物,这些单糖单元具有至少5个碳原子(这些碳原子可以是直链、支链或环状的)与结合至每个碳原子的一个氧、氮或硫原子。因此,术语“碳水化合物”涵盖单糖、二糖、三糖、四糖、寡糖、以及多糖。代表性碳水化合物包括糖(单糖、二糖、三糖、以及包含从约4-9个单糖单元的寡糖),以及多糖如淀粉、糖原、纤维素、以及多糖胶。具体单糖包括c5-6糖;二糖和三糖包括具有两个或三个单糖单元(例如,c5-6糖)的糖。如在此所用,术语“羰基”表示一个c(o)基团。包含一个“羰基”的官能团的实例包括酯、酮、醛、酸酐、乙酰氯、酰胺、羧酸、以及羧酸酯。如在此所用,关于多核苷酸的术语“互补”意指沃森-克里克互补。如在此所用,术语“偶联反应的组分”表示能够参与偶联反应的一种分子物质。偶联反应的组分包括氢化硅烷(hydridosilanes)、烯烃、以及炔烃。如在此所用,术语“环加成反应的组分”表示能够参与环加成反应的一种分子物质。在键形成涉及[4n+2]π电子(其中n是1)的环加成反应中,一种组分将提供2π电子,并且另一种组分将提供4π电子。环加成反应的提供2π电子的代表性组分包括烯烃和炔烃。环加成反应的提供4π电子的代表性组分包括1,3-二烯、α,β-不饱和羰基、以及叠氮化物。如在此所用,术语“共轭基团”表示包含一个或多个共轭部分的二价或更高化合价基团。共轭基团将一个或多个辅助部分连接至生物可逆性基团(例如,包含二硫化物部分的基团)。如在此所用,术语“共轭部分”表示能够在适当的条件下与另一个基团(例如,为亲核试剂、亲电子试剂、环加成反应中的组分、或偶联反应中的组分的官能团)形成一个或多个共价键的一个官能团。该术语还指一种共轭反应的残基,例如,酰胺基团。在此提供这类基团的实例。如在此所用,术语“偶联反应”表示两种组分的反应,其中一种组分包括非极性σ键如si-h或c-h,并且第二组分包括π键如烯烃或炔烃,该反应导致在该π键上净添加该σ键以形成c-h、si-c、或c-c键,或在这两种组分之间形成单一共价键。一种偶联反应是在烯烃上添加si-h(也被称为氢化硅烷化)。其他偶联反应包括施蒂勒偶联(stillecoupling)、铃木偶联(suzukicoupling)、薗头偶联(sonogashiracoupling)、桧山偶联(hiyamacoupling)、以及赫克反应(heckreaction)。催化剂可以用于促进偶联反应。典型的催化剂是包含fe(ii)、cu(i)、ni(0)、ni(ii)、pd(0)、pd(ii)、pd(iv)、pt(0)、pt(ii)、或pt(iv)的那些。如在此所用,术语“环加成反应”表示两种组分的反应,其中当不存在活化、通过一种化学催化剂活化、抑或使用热能活化时[4n+2]π电子参与键形成,并且n是1、2、或3。一种环加成反应还是两种组分的一种反应,其中涉及[4n]π电子,存在光化学活化并且n是1、2、或3。令人希望地,[4n+2]π电子参与键形成,并且n=1。代表性环加成反应包括烯烃与1,3-二烯的反应(狄尔斯-阿尔德反应(diels-alderreaction))、烯烃与α,β-不饱和羰基的反应(杂狄尔斯-阿尔德反应)、以及炔烃与叠氮化合物的反应(胡伊斯根环加成反应)。如在此所用,术语“环烯基”是指具有从3至10个碳的一个非芳香族碳环基团(例如,c3-c10亚环烷基),除非另外说明。环烯基的非限制性实例包括环丙-1-烯基、环丙-2-烯基、环丁-1-烯基、环丁-1-烯基、环丁-2-烯基、环戊-1-烯基、环戊-2-烯基、环戊-3-烯基、降冰片烯-1-基、降冰片烯-2-基、降冰片烯-5-基、以及降冰片烯-7-基。环烯基基团可以是未取代的或取代的(例如,任选取代的环烯基),如针对环烷基所描述。如在此所用,术语“亚环烯基”是指具有从3至10个碳的二价碳环非芳香族基团(例如,c3-c10亚环烯基),除非另外说明。亚环烯基的非限制性实例包括:环丙-1-烯-1,2-二基;环丙-2-烯-1,1-二基;环丙-2-烯-1,2-二基;环丁-1-烯-1,2-二基;环丁-1-烯-1,3-二基;环丁-1-烯-1,4-二基;环丁-2-烯-1,1-二基;环丁-2-烯-1,4-二基;环戊-1-烯-1,2-二基;环戊-1-烯-1,3-二基;环戊-1-烯-1,4-二基;环戊-1-烯-1,5-二基;环戊-2-烯-1,1-二基;环戊-2-烯-1,4-二基;环戊-2-烯-1,5-二基;环戊-3-烯-1,1-二基;环戊-1,3-二烯-1,2-二基;环戊-1,3-二烯-1,3-二基;环戊-1,3-二烯-1,4-二基;环戊-1,3-二烯-1,5-二基;环戊-1,3-二烯-5,5-二基;降冰片二烯-1,2-二基;降冰片二烯-1,3-二基;降冰片二烯-1,4-二基;降冰片二烯-1,7-二基;降冰片二烯-2,3-二基;降冰片二烯-2,5-二基;降冰片二烯-2,6-二基;降冰片二烯-2,7-二基;和降冰片二烯-7,7-二基。亚环烯基可以是未取代的或取代的(例如,任选取代的亚环烯基),如针对环烷基所描述。如在此所用,术语“环烷基”是指具有从3至10个碳的一个环状烷基基团(例如,c3-c10环烷基),除非另外说明。环烷基基团可以是单环的或双环的。双环环烷基基团可以具有双环[p.q.0]烷基类型,其中p和q各自独立地是1、2、3、4、5、6、或7,条件是p和q的和是2、3、4、5、6、7、或8。可替代地,双环环烷基基团可以包括桥联的环烷基结构,例如,双环[p.q.r]烷基,其中r是1、2、或3,p和q各自独立地是1、2、3、4、5、或6,条件是p、q、以及r的和是3、4、5、6、7、或8。环烷基基团可以是螺环基团,例如螺[p.q]烷基,其中p和q各自独立地是2、3、4、5、6、或7,条件是p和q的和是4、5、6、7、8、或9。环烷基的非限制性实例包括环丙基、环丁基、环戊基、环己基、环庚基、1-双环[2.2.1.]庚基、2-双环[2.2.1.]庚基、5-双环[2.2.1.]庚基、7-双环[2.2.1.]庚基、以及十氢萘基。环烷基基团可以是未取代的或取代的,如在此所定义(例如,任选取代的环烷基)。本披露的环烷基基团可以任选地被以下各项取代:(1)烷酰基;(例如,甲酰基,乙酰基等);(2)烷基(例如,烷氧基烷基、烷基亚磺酰基烷基、氨基烷基、叠氮基烷基、酰基烷基、卤代烷基(例如,全氟烷基)、羟基烷基、硝基烷基或硫代烷氧基烷基);(3)烯基;(4)炔基;(5)烷氧基(例如,全氟烷氧基);(6)烷基亚磺酰基;(7)芳基;(8)氨基;(9)芳烷基;(10)叠氮基;(11)环烷基;(12)环烷基烷基;(13)环烯基;(14)环烯基烷基;(15)卤代;(16)杂环基(例如,杂芳基);(17)(杂环基)氧基;(18)(杂环基)氮杂;(19)羟基;(20)硝基;(21)硫代烷氧基;(22)-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:(a)烷基、(b)芳基、(c)氢、和(d)芳烷基;(23)-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳烷基;(24)-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:(a)烷基、(b)芳基、和(c)芳烷基;(25)-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳烷基;(26)硫醇;(27)芳氧基;(28)环烷氧基;(29)芳基烷氧基;(30)杂环基烷基(例如,杂芳基烷基);(31)甲硅烷基;(32)氰基;和(33)-s(o)rh,其中rh选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳烷基。在一些实施例中,这些基团各自可以进一步如在此所描述被取代。如在此所用,术语“环烷基烷基”表示被一个环烷基基团取代的一个烷基基团。这些环烷基和烷基部分可以被取代为如在此所描述的这些单独基团。如在此所用,术语“亲电子试剂”或“亲电基团”表示被吸引至富含电子的中心并且能够接受来自一个或多个亲核试剂的电子对以便形成一个或多个共价键的官能团。亲电子试剂包括但不限于:阳离子;极化中性分子;氮烯;氮烯前体,如叠氮化物;碳烯;碳烯前体;活化的硅中心;活化的羰基;烷基卤;烷基拟卤化物;环氧化物;缺电子芳基;活化的磷中心;和活化的硫中心。典型遇到的亲电子试剂包括阳离子,如h+和no+;极化中性分子,如hcl;烷基卤;酰基卤;含羰基化合物,如醛;以及连接至良好离去基团如甲磺酸酯、三氟甲磺酸酯和甲苯磺酸酯的原子。如在此所用,术语“内体逃逸部分”表示增强内体内容物的释放或允许一种分子从一个内部细胞区室(如一个内体)逃逸的一个部分。如在此所用,术语“卤代”表示选自溴、氯、碘、以及氟的一种卤素。如在此所用,术语“卤代烷基”表示被卤素基团(即,f、cl、br、或i)取代的如在此所定义的烷基基团。卤代烷基可以被一个、两个、三个或者(在具有两个碳或更多个碳的烷基基团的情况下)四个卤素取代,或者当卤素基团是f时,卤代烷基可以是全氟烷基。在一些实施例中,卤代烷基可以进一步任选地被如在此针对烷基基团所描述的1、2、3、或4个取代基基团取代。如在此所用,术语“杂芳基”表示为芳香族的如在此所定义的杂环基的子集:即,它们在单环或多环环系统内包含4n+2个π电子。在一个实施例中,杂芳基被如针对一个杂环基基团所定义的1、2、3、或4个取代基基团取代。如在此所用,术语“杂芳基烷基”表示被一个杂芳基基团取代的一个烷基基团。这些杂芳基和烷基部分可以被取代为如在此所描述的这些单独基团。如在此所用,术语“杂环基”表示包含一个、两个、三个、或四个杂原子的5元、6元或7元环(除非另外说明),这些杂原子独立地选自包括氮、氧和硫的基团。5元环具有0至2个双键,并且6元环和7元环具有0至3个双键。某些杂环基基团包括从2至9个碳原子。其他这类基团可以包括达12个碳原子。术语“杂环基”还表示具有桥联的多环结构的杂环化合物,其中一个或多个碳和/或杂原子桥联单环的两个非相邻成员,例如,奎宁环基基团。术语“杂环基”包括双环基团、三环基团和四环基团,其中任何以上杂环稠合至一个、两个或三个碳环,例如,芳环、环己烷环、环己烯环、环戊烷环、环戊烯环或另一个单环杂环,如吲哚基、喹啉基、异喹啉基、四氢喹啉基、苯并呋喃基、苯并噻吩基等。稠合杂环基的实例包括莨菪烷和1,2,3,5,8,8a-六氢吲嗪。杂环包括吡咯基、吡咯啉基、吡咯烷基、吡唑基、吡唑啉基、吡唑烷基、咪唑基、咪唑啉基、咪唑烷基、吡啶基、哌啶基、高哌啶基、吡嗪基、哌嗪基、嘧啶基、哒嗪基、噁唑基、噁唑烷基、异噁唑基、异噁唑烷基、吗啉基、硫代吗啉基、噻唑基、噻唑烷基、异噻唑基、异噻唑烷基、吲哚基、喹啉基、异喹啉基、苯并咪唑基、苯并噻唑基、苯并噁唑基、呋喃基、噻吩基、噻唑烷基、异噻唑基、异吲唑基(isoindazoyl)、三唑基、四唑基、噁二唑基、嘌呤基、噻二唑基(例如,1,3,4-噻二唑基)、四氢呋喃基、二氢呋喃基、四氢噻吩基、二氢噻吩基、二氢吲哚基、四氢喹啉基、四氢异喹啉基、吡喃基、二氢吡喃基、二噻唑基、苯并呋喃基、苯并噻吩基等。仍其他示例性杂环基包括:2,3,4,5-四氢-2-氧代-噁唑基;2,3-二氢-2-氧代-1h-咪唑基;2,3,4,5-四氢-5-氧代-1h-吡唑基(例如,2,3,4,5-四氢-2-苯基-5-氧代-1h-吡唑基);2,3,4,5-四氢-2,4-二氧代-1h-咪唑基(例如,2,3,4,5-四氢-2,4-二氧代-5-甲基-5-苯基-1h-咪唑基);2,3-二氢-2-硫代-1,3,4-噁二唑基(例如,2,3-二氢-2-硫代-5-苯基-1,3,4-噁二唑基);4,5-二氢-5-氧代-1h-三唑基(例如,4,5-二氢-3-甲基-4-氨基5-氧代-1h-三唑基);1,2,3,4-四氢-2,4-二氧代吡啶基(例如,1,2,3,4-四氢-2,4-二氧代-3,3-二乙基吡啶基);2,6-二氧代-哌啶基(例如,2,6-二氧代-3-乙基-3-苯基哌啶基);1,6-二氢-6-氧代嘧啶基;1,6-二氢-4-氧代嘧啶基(例如,2-(甲硫基)-1,6-二氢-4-氧代-5-甲基嘧啶-1-基);1,2,3,4-四氢-2,4-二氧代嘧啶基(例如,1,2,3,4-四氢-2,4-二氧代-3-乙基嘧啶基);1,6-二氢-6-氧代-哒嗪基(例如,1,6-二氢-6-氧代-3-乙基哒嗪基);1,6-二氢-6-氧代-1,2,4-三嗪基(例如,1,6-二氢-5-异丙基-6-氧代-1,2,4-三嗪基);2,3-二氢-2-氧代-1h-吲哚基(例如,3,3-二甲基-2,3-二氢-2-氧代-1h-吲哚基和2,3-二氢-2-氧代-3,3’-螺环丙烷-1h-吲哚-1-基);1,3-二氢-1-氧代-2h-异吲哚基;1,3-二氢-1,3-二氧代-2h-异吲哚基;1h-苯并吡唑基(例如,1-(乙氧基羰基)-1h-苯并吡唑基);2,3-二氢-2-氧代-1h-苯并咪唑基(例如,3-乙基-2,3-二氢-2-氧代-1h-苯并咪唑基);2,3-二氢-2-氧代-苯并噁唑基(例如,5-氯-2,3-二氢-2-氧代-苯并噁唑基);2,3-二氢-2-氧代-苯并噁唑基;2-氧代-2h-苯并吡喃基;1,4-苯并二噁烷基;1,3-苯并二噁烷基;2,3-二氢-3-氧代,4h-1,3-苯并噻嗪基;3,4-二氢-4-氧代-3h-喹唑啉基(例如,2-甲基-3,4-二氢-4-氧代-3h-喹唑啉基);1,2,3,4-四氢-2,4-二氧代-3h-喹唑啉基(例如,1-乙基-1,2,3,4-四氢-2,4-二氧代-3h-喹唑啉基);1,2,3,6-四氢-2,6-二氧代-7h-嘌呤基(例如,1,2,3,6-四氢-1,3-二甲基-2,6-二氧代-7h-嘌呤基);1,2,3,6-四氢-2,6-二氧代-1h-嘌呤基(例如,1,2,3,6-四氢-3,7-二甲基-2,6-二氧代-1h-嘌呤基);2-氧代苯并[c,d]吲哚基;1,1-二氧代-2h-萘并[1,8-c,d]异噻唑基;以及1,8-亚萘基二甲酰胺基。杂环基团还包括以下化学式的基团其中f'选自下组,该组由以下各项组成:-ch2-、-ch2o-、以及-o-,并且g'选自下组,该组由以下各项组成:-c(o)-和-(c(r’)(r”))v-,其中r’和r”各自独立地选自下组,该组由以下各项组成:氢或具有1至4个碳原子的烷基,并且v是1至3,并且包括基团如1,3-苯并间二氧杂环戊烯基、1,4-苯并二噁烷基等。在此提及的任何杂环基基团可以任选地被独立地选自下组的1、2、3、4、或5个取代基取代,该组由以下各项组成:(1)烷酰基(例如,甲酰基、乙酰基等);(2)烷基(例如,烷氧基亚烷基、烷基亚磺酰基亚烷基、氨基亚烷基、叠氮基亚烷基、酰基亚烷基、卤代亚烷基(例如全氟烷基)、羟基亚烷基、硝基亚烷基、或硫代烷氧基亚烷基);(3)烯基;(4)炔基;(5)烷氧基(例如,全氟烷氧基);(6)烷基亚磺酰基;(7)芳基;(8)氨基;(9)芳基-亚烷基;(10)叠氮基;(11)环烷基;(12)环烷基-亚烷基;(13)环烯基;(14)环烯基-亚烷基;(15)卤代;(16)杂环基(例如,杂芳基);(17)(杂环基)氧基;(18)(杂环基)氮杂;(19)羟基;(20)氧代;(21)硝基;(22)硫化物;(23)硫代烷氧基;(24)-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:(a)烷基、(b)芳基、(c)氢、和(d)芳基-亚烷基;(25)-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳基-亚烷基;(26)-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:(a)烷基、(b)芳基、和(c)芳基-亚烷基;(27)-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳基-亚烷基;(28)硫醇;(29)芳氧基;(30)环烷氧基;(31)芳基烷氧基;(31)杂环基-亚烷基(例如,杂芳基-亚烷基);(32)甲硅烷基;(33)氰基;和(34)-s(o)rh,其中rh选自下组,该组由以下各项组成:(a)氢、(b)烷基、(c)芳基、和(d)芳基-亚烷基。在一些实施例中,这些基团各自可以进一步如在此所描述被取代。例如,一个芳基-c1-亚烷基或一个杂环基-c1-亚烷基的亚烷基基团可以进一步被一个氧代基团取代以得到对应的芳酰基和(杂环基)酰基取代基基团。此外,当一个杂环基基团存在于本发明的生物可逆性基团中时,该杂环基基团可以被结合至如在此所定义的共轭部分、亲水性官能团、或辅助部分的酯、硫酯或二硫化物基团取代。如在此所用,术语“杂环基烷基”表示被一个杂环基基团取代的一个烷基基团。这些杂环基和烷基部分可以被取代为如在此所描述的这些单独基团。如在此所用,术语“亲水性官能团”表示赋予对水的亲和力且增加一个烷基部分在水中的溶解度的一个部分。亲水性官能团可以是离子型或非离子型的,并且包括带正电荷的、带负电荷的、和/或能够参与氢键合相互作用的部分。示例性亲水性官能团包括羟基、氨基、羧基、羰基、硫醇、磷酸酯(例如,单磷酸酯、二磷酸酯、或三磷酸酯)、聚环氧烷(例如,聚乙二醇)、以及杂环基。如在此可互换使用,术语“羟基(hydroxyl)”和“羟基(hydroxy)”表示一个-oh基团。如在此所用,术语“亚胺”表示在碳与氮之间具有一个双键(其可以被表示为“c=n”)的一个基团。在一个质子是亚胺官能团的α的一个具体实施例中,该亚胺还可以呈互变异构烯胺的形式。一种类型的亚胺键是腙键,其中该亚胺键的氮共价附接至三价氮(例如,c=n-n(r)2)。在一些实施例中,每个r可以独立地是h、oh、任选取代的c1-6烷氧基、或任选取代的c1-6烷基。如在此所用,术语“核苷酸间基团”表示将两个连续核苷共价连接在一起的基团。核苷酸间基团可以是如本文所定义的非生物可逆性或生物可逆性基团。核苷酸间磷(v)基团是磷酸酯或硫代磷酸酯。核苷酸间基团的一个氧原子在一个核苷的3’位置处,并且核苷酸间基团的另一氧原子是在另一个相邻核苷的5’位置处。如本文所用,术语“可加载到risc复合物”是指将引导链加载到risc复合物中的能力和risc介导的与引导链杂交的过客链的降解。因此,该多核苷酸不包括在引导链5’位置处的非生物可逆性的核苷酸间基团,或包括天然risc介导的切割位点的三个连续核苷酸。优选的天然risc介导的切割位点位于与引导链的第十和第十一核苷酸互补的两个核苷之间的过客链上。如在此所用,术语“氮烯”表示单价氮物质,该氮物质具有六价电子和结构=n或-nra:其中ra选自任选取代的c1-12烷基、任选取代的c6-12芳基、任选取代的(c6-12芳基)-c1-12-亚烷基、或任选取代的羰基;并且n是具有四价电子的氮,这些电子中的至少两个是成对的。两个剩余电子可以是成对的(即,单线态氮烯)或不成对的(即,三线态氮烯)。如在此所用,术语“硝基”表示一个-no2基团。如在此所用,术语“非生物可逆性基团”是指包括不是生物可逆性基团的官能团的部分。非生物可逆性基团在其内并入多核苷酸的磷酸酯或硫代磷酸酯。例如,非生物可逆性基团可以是核苷酸间非生物可逆性基团或末端非生物可逆性基团,这取决于与多核苷酸的一个或多个附接点。核苷酸间非生物可逆性基团包含包括与连接多核苷酸的两个核苷酸的磷酸酯或硫代磷酸酯的氧或硫原子键合的官能团的部分。末端非生物可逆性基团包含包括与多核苷酸的末端磷酸酯或硫代磷酸酯的一个或两个氧和/或硫原子键合的官能团的部分。非生物可逆性基团可以包括与磷酸酯或硫代磷酸酯的氧或硫原子键合的c3-6亚烷基,亚烯基,亚炔基,亚芳基,芳基亚烷基,亚环烷基,环烷基亚烷基或亚环烯基,或本文所述的任何其他连接基团。一种“非天然存在的氨基酸”是非天然地在一种哺乳动物中产生或发现的一种氨基酸。“非极性σ键”意指如根据鲍林标度(paulingscale)所测量具有相差小于或等于1.0单位的电负性值的两种元素之间的一个共价键。非极性σ键的非限制性实例包括c-c、c-h、si-h、si-c、c-cl、c-br、c-i、c-b、以及c-sn键。如在此所用,术语“核碱基”表示在一个核苷酸或核苷的糖部分的1’位置处发现的一个含氮杂环。核碱基可以是未修饰的或修饰的。如在此所用,“未修饰得”或“天然的”核碱基包括嘌呤碱基腺嘌呤(a)和鸟嘌呤(g),以及嘧啶碱基胸腺嘧啶(t)、胞嘧啶(c)和尿嘧啶(u)。修饰的核碱基包括其他合成和天然的核碱基,如5-甲基胞嘧啶(5-me-c或m5c);5-羟甲基胞嘧啶;黄嘌呤;次黄嘌呤;2-氨基腺嘌呤;腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物;腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物;2-硫尿嘧啶、2-硫胸腺嘧啶和2-硫胞嘧啶;5-卤代尿嘧啶和胞嘧啶;5-丙炔基尿嘧啶和胞嘧啶;6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶;5-尿嘧啶(假尿嘧啶);4-硫尿嘧啶;8-卤代、8-氨基、8-硫醇、8-硫烷基、8-羟基以及其他8-取代的腺嘌呤和鸟嘌呤;5-卤代、尤其5-溴、5-三氟甲基以及其他5-取代的尿嘧啶和胞嘧啶;7-甲基鸟嘌呤和7-甲基腺嘌呤;8-氮杂鸟嘌呤和8-氮杂腺嘌呤;7-脱氮鸟嘌呤和7-脱氮腺嘌呤;以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。另外的核碱基包括在美国专利号3,687,808中披露的那些核碱基;在聚合物科学与工程简明百科全书(theconciseencyclopediaofpolymerscienceandengineering),第858-859页,克洛舍维奇(kroschwitz),j.i.编著,约翰威利父子出版公司(johnwiley&sons),1990中披露的那些核碱基;在恩利施(englisch)等人,应用化学(angewandtechemie),国际版,1991,30,613中披露的那些核碱基;以及由赛格维(sanghvi),y.s.,第15章,反义研究与应用(antisenseresearchandapplications),第289-302页,(克鲁克(crooke)等人编著,crc出版社,1993)披露的那些核碱基。某些核碱基尤其适用于提高本发明的聚合物化合物的结合亲和力,包括5-取代的嘧啶、6-氮杂嘧啶和n-2、n-6和o-6取代的嘌呤,包括2-氨丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶。已显示5-甲基胞嘧啶取代使核酸双链体稳定性提高0.6℃至1.2℃。(赛格维等人编著,反义研究与应用1993,crc出版社,博卡拉顿(bocaraton),第276-278页)。在具体实施例中,这些可以与2’-o-甲氧基乙基糖修饰组合。传授这些修饰的核碱基以及其他修饰的核碱基中的某些的制备的美国专利包括但不限于,上述美国专利号3,687,808;4,845,205;5,130,302;5,134,066;5,175,273;5,367,066;5,432,272;5,457,187;5,459,255;5,484,908;5,502,177;5,525,711;5,552,540;5,587,469;5,594,121;5,596,091;5,614,617;以及5,681,941。出于本披露的目的,如在此所用,“修饰的核碱基”进一步表示天然或非天然的核碱基,这些核碱基包含如在此所描述的一个或多个保护基团。如在此所用,术语“亲核试剂”表示通过从电子对或π键供电子而参与共价键的形成的任选取代的官能团。亲核试剂可以选自烯烃、炔烃、芳基、杂芳基、二氮杂基团、羟基基团、烷氧基基团、芳氧基基团、氨基基团、烷基氨基基团、苯胺基基团、硫代基团、以及硫代苯氧基基团。如在此所用,术语“核苷”表示糖-核碱基组合。糖是在异头碳处包含核碱基的修饰的糖或在异头碳处包含核碱基的3,5-二脱氧戊呋喃糖,和在每个位置3和5处与另一个基团的键。戊呋喃糖可以是3,5-二脱氧核糖或2,3,5-三脱氧核糖或其2修饰版本,其中位置2被or、r、卤代(例如,f)、sh、sr、nh2、nhr、nr2、或cn取代,其中r是任选取代的c1-6烷基(例如,(c1-6烷氧基)-c1-6-烷基)或任选取代的(c6-14芳基)-c1-4-烷基。这些修饰的糖是非核糖糖,如甘露糖、阿拉伯糖、吡喃葡萄糖、吡喃半乳糖、4-硫代核糖、以及其他糖、杂环、或碳环。在一些实施例中,术语“核苷”是指具有以下结构的二价基团:其中b1是核碱基;y是h,卤素(例如,f),羟基,任选取代的c1-6烷氧基(例如,甲氧基或甲氧基乙氧基),或保护的羟基基团;并且3'和5'各自表示与另一个基团的键的位置。如在此所用,术语“核苷酸”是指进一步包括与二价基团的3’或5’位置共价连接的核苷酸间或末端磷(v)基团或生物可逆性或非生物可逆性基团的核苷。核苷酸还包括锁核酸(lna)、甘油核酸、吗啉代核酸、以及苏糖核酸。如可在此互换使用,术语“氧杂”和“氧基”表示连接至两个基团的一个二价氧原子(例如,氧基的结构可以被示出为-o-)。如在此所用,术语“氧代”表示连接至一个基团的一个二价氧原子(例如,氧代的结构可以被示出为=o)。术语“磷(v)基团,”如本文所用,是指具有结构-o-p(=za)(-zb)-o-的二价基团,其中za是o或s,并且zb为oh、sh、或氨基或其盐。如在此所用,术语“多核苷酸”,表示包含通过核苷酸间磷(v),生物可逆性,或非生物可逆性基团的任何组合共价结合在一起的11个或更多个连续核苷的结构。多核苷酸可以是线性或环状的。如在此所用,术语“多肽”表示通过肽键连接的两个或更多个氨基酸残基。此外,出于本披露的目的,术语“多肽”和术语“蛋白质”在所有情况下可在此互换使用。多种多肽可以在在此提供的这些方法和组合物的范围内使用。在某些实施例中,多肽包括抗体或抗体的片段或其抗原结合片段。合成制备的多肽可以包括由dna天然编码的氨基酸(例如,非天然存在或非天然氨基酸)的取代。如在此所用,术语“ph”表示苯基。如在此所用,术语“光解活化”或“光解”表示通过用光照射反应促进或引发一种化学反应。适合于光解活化的光的波长在200-500nm之间的范围内,并且包括从200-260nm和300-460nm范围内的波长。其他有用的范围包括200-230nm、200-250nm、200-275nm、200-300nm、200-330nm、200-350nm、200-375nm、200-400nm、200-430nm、200-450nm、200-475nm、300-330nm、300-350nm、300-375nm、300-400nm、300-430nm、300-450nm、300-475nm、以及300-500nm。如在此所用,术语“保护基团”表示旨在保护官能团(例如,羟基、氨基、或羰基)免于参与化学合成(例如,多核苷酸合成)过程中的一个或多个不希望的反应的基团。如在此所用,术语“o-保护基团”表示旨在保护含氧(例如,苯酚、羟基或羰基)基团免于参与化学合成过程中的一个或多个不希望的反应的基团。如在此所用,术语“n-保护基团”表示旨在保护含氮(例如,氨基或肼)基团免于参与化学合成过程中的一个或多个不希望的反应的基团。通常使用的o-保护基团和n-保护基团在格林(greene),“有机合成中的保护基团(protectivegroupsinorganicsynthesis)”,第3版(约翰威利父子出版公司,纽约,1999)中披露,该文献通过引用结合在此。示例性o-保护基团和n-保护基团包括烷酰基基团、芳酰基基团、或氨基甲酰基基团,如甲酰基、乙酰基、丙酰基、新戊酰基、叔丁基乙酰基、2-氯乙酰基、2-溴乙酰基、三氟乙酰基、三氯乙酰基、邻苯二甲酰基、邻-硝基苯氧基乙酰基、α-氯丁酰基、苯甲酰基、4-氯苯甲酰基、4-溴苯甲酰基、叔丁基二甲基甲硅烷基、三-异丙基甲硅烷基氧基甲基、4,4'-二甲氧基三苯甲基、异丁酰基、苯氧基乙酰基、4-异丙基苯氧基乙酰基、二甲基亚胺甲基氨基、以及4-硝基苯甲酰基。用于保护含羰基基团的示例性o-保护基团包括但不限于:缩醛、缩羰基酯(acylal)、1,3-二噻烷、1,3-二噁烷、1,3-二氧戊环、以及1,3-二硫戊环。其他o-保护基团包括但不限于:取代的烷基、芳基和芳基-亚烷基醚(例如,三苯甲基;甲硫基甲基;甲氧基甲基;苄氧基甲基;甲硅烷氧基甲基;2,2,2,-三氯乙氧基甲基;四氢吡喃基;四氢呋喃基;乙氧基乙基;1-[2-(三甲基甲硅烷基)乙氧基]乙基;2-三甲基甲硅烷基乙基;叔丁醚;对-氯苯基、对-甲氧基苯基、对-硝基苯基、苄基、对-甲氧基苄基、以及硝基苄基);甲硅烷基醚(例如,三甲基甲硅烷基;三乙基甲硅烷基;三异丙基甲硅烷基;二甲基异丙基甲硅烷基;叔丁基二甲基甲硅烷基;叔丁基二苯基甲硅烷基;三苄基甲硅烷基;三苯基甲硅烷基;以及二苯基甲基甲硅烷基);碳酸酯(例如,甲基、甲氧基甲基、9-芴基甲基;乙基;2,2,2-三氯乙基;2-(三甲基甲硅烷基)乙基;乙烯基、烯丙基、硝基苯基;苄基;甲氧基苄基;3,4-二甲氧基苄基;以及硝基苄基)。其他n-保护基团包括但不限于,手性助剂如保护的或未保护的d,l或d,l-氨基酸如丙氨酸、亮氨酸、苯丙氨酸等;含磺酰基基团如苯磺酰基、对甲苯磺酰基等;氨基甲酸酯形成基团如苄氧羰基、对-氯苄氧羰基、对-甲氧基苄氧羰基、对-硝基苄氧羰基、2-硝基苄氧羰基、对-溴苄氧羰基、3,4-二甲氧基苄氧羰基、3,5-二甲氧基苄氧羰基、2,4-二甲氧基苄氧羰基、4-甲氧基苄氧羰基、2-硝基-4,5-二甲氧基苄氧羰基、3,4,5-三甲氧基苄氧羰基、1-(对-联苯基)-1-甲基乙氧基羰基、α,α-二甲基-3,5-二甲氧基苄氧羰基、二苯甲基氧基羰基、叔丁氧基羰基、二异丙基甲氧基羰基、异丙氧基羰基、乙氧基羰基、甲氧基羰基、烯丙氧基羰基、2,2,2,-三氯乙氧基羰基、苯氧基羰基、4-硝基苯氧基羰基、芴基-9-甲氧基羰基、环戊氧基羰基、金刚烷基氧基羰基、环己氧基羰基、苯硫基羰基等;芳基-亚烷基基团,如苄基、三苯基甲基、苄氧基甲基等;以及甲硅烷基基团,如三甲基甲硅烷基等。有用的n-保护基团是甲酰基、乙酰基、苯甲酰基、新戊酰基、叔丁基乙酰基、丙氨酰基、苯磺酰基、苄基、叔丁氧基羰基(boc)、以及苄氧基羰基(cbz)。如在此所用,术语“空间位阻”描述在一种分子间或一种分子内亲核试剂或亲电子试剂存在下具有至少24小时半衰期的一个化学基团。如在此所用,术语“受试者”表示人或非人动物(例如,哺乳动物)。如在此所用,术语“硫化物”表示一个二价-s-或=s基团。如在此所用,术语“靶向部分”表示与一种受体或其他反应性部分特异性地结合或反应性地缔合或复合的任何部分,该受体或其他反应性部分与一种给定靶细胞群体相关。如在此所用,术语“末端基团”是指位于多核苷酸中的第一个或最后一个核苷处的基团。5'末端基团是与多核苷酸内的第一核苷的5'碳原子键合的末端基团。3'末端基团是与多核苷酸内的最后一个核苷的3'碳原子键合的末端基团。如在此所用,术语“治疗有效剂量”表示根据本发明的sirna或多核苷酸的用于改善、治疗疾病或病症或至少部分地阻止该疾病或病症的症状(例如,抑制细胞增殖)所需的量。对于这种用途有效的量当然将取决于受试者的疾病的严重程度以及体重和总体状态。典型地,在体外使用的剂量可以提供适用于体内给予药物组合物的量的有用指导,并且动物模型可以用于确定用于治疗特定病症的有效剂量。如在此所用,术语“硫代羰基”表示c(=s)基团。包含一个“硫代羰基”的官能团的非限制性实例包括硫酯、硫酮、硫醛、硫代酸酐、硫代酰基氯化物、硫代酰胺、硫代羧酸、以及硫代羧酸酯。如在此所用,术语“硫醇”表示一个-sh基团。如在此所用,术语“病症”旨在总体上是与术语“疾病”、“综合征”以及“病状”(如在医学病状中)同义的并且可与其互换使用,因为它们都反映由受试者或其中一部分呈现的损伤正常功能且典型地表现为有区别的病征和症状的一种异常状况。如关于受试者的一种病症所用的术语“治疗”旨在是指通过向该受试者给予治疗剂(例如,本发明的核苷酸构建体)来减少该病症的至少一种症状。当在本文和附带的权利要求中使用时,单数形式“一个/种(a)”、“和(and)”和“所述/该(the)”包括复数指代物,除非上下文明确地指示其他的情况。因此,例如提及“靶向部分”包括多个这类靶向部分,并且提及“该细胞”包括提及本领域的技术人员已知的一个或多个细胞等。除非另外定义,否则在此所用的所有技术和科学术语具有与本披露所属领域的普通技术人员通常所理解相同的含义。虽然可以在所披露的方法和组合物的实践中使用类似或等效于在此所描述的那些方法和材料的任何方法和材料,但是在此描述了示例性方法、装置和材料。类似地,“包含(comprise)”、“包含(comprises)”、“包含(comprising)”、“包括(include)”、“包括(includes)”、以及“包括(including)”是可互换的并且不旨在是限制性的。应当进一步理解,在各种实施例的描述使用术语“包含”的情况下,本领域的技术人员将理解在一些具体情况下,一个实施例可以使用语言“基本上由...组成”或“由...组成”来替代地描述。出于本披露的目的,对于与本公开中明确定义的任何术语相同的本领域中存在的任何术语,在所有方面将以在本披露中提出的该术语的定义为准。附图简要说明图1a示出本发明的包含两条链的sirna,其中这些链中的一条包含本发明的二硫键联。图1b示出本发明的包含两条链的sirna,其中两条链均包含本发明的二硫键联。图2示出本发明的一种代表性多核苷酸构建体以及该多核苷酸的rp-hplc迹线。图3示出本发明的多核苷酸的粗混合物的一个质谱,该多核苷酸的结构在图2中示出。图4示出本发明的纯化的多核苷酸的一个质谱,该多核苷酸的结构在图2中示出。图5a示出具有一个或三个ads共轭位点的本发明的单链rna构建体的结构。图5b示出本发明的单链rna构建体的凝胶分析的一个照片。这些构建体的结构在图6a、图6b和图8中描述。图5c示出本发明的单链rna构建体的凝胶分析的一个照片。这些构建体的结构在图6a、图6b和图7a中描述。图5d示出本发明的单链rna构建体的凝胶分析的一个照片。这些构建体的结构在图6a、图6b和图7b中描述。图6a示出本发明的代表性sirna构建体的一般结构。图6b示出并入图6a中所示的sirna构建体中的ads共轭基团。图7a示出连接至一个代表性共轭部分的一个代表性靶向部分(叶酸)的一种结构。图7b示出连接至一个代表性共轭部分的一个代表性靶向部分(galnac)的一种结构。图8示出连接至一个代表性共轭部分的一个代表性靶向部分(甘露糖)的一种结构。图9a是示出某些示例性生物可逆性和非生物可逆性基团的图表。图9b是示出用于制备表7中所列的多核苷酸的某些化合物的图表。图10示出[3+2]环加成之前的两种示例性sirna结构。图11示出galnac-sirna共轭物的列表。图12示出根据实例2中所述的程序测定的体外转染数据。链1是过客链,并且链2是引导链。由每个字母指定的条表示表9中描述的sirna结构之一的ic50(pm)。sb-0165是对照。每个字母按从5’至3’的顺序对应于核苷酸间非生物可逆性基团的位置(例如,链1的a在24小时和48小时提供化合物sb-0166的ic50数据,其包括连接第一和第二核苷的非生物可逆性基团)。图13a和13b是示出在表5-7中列出的示例性sirna化合物在体外抑制来自c57/bi6小鼠的原代小鼠肝细胞中的apob基因表达中的功效的曲线图。所测定的ic50值提供于每个曲线图下方的表中。图14a示出结合至kb细胞的本发明的sirna共轭物((叶酸)3-sirnn-cy3)的剂量曲线。图14b示出测定本发明的sirna共轭物((叶酸)3-sirnn-cy3或(叶酸)1-sirnn-cy3)与kb细胞的解离常数(kd)的一个曲线图。图15a示出结合至hepg2细胞的本发明的sirna共轭物((galnac)9-sirnn-cy3)的剂量曲线。图15b示出测定本发明的sirna共轭物((galnac)9-sirnn-cy3或(galnac)3-sirnn-cy3)与hepg2细胞的解离常数(kd)的一个曲线图。图16a示出结合至原代腹膜巨噬细胞的本发明的sirna共轭物((甘露糖)18-sirnn-cy3)的剂量曲线。图16b示出测定本发明的sirna共轭物((甘露糖)18-sirnn-cy3或(甘露糖)6-sirnn-cy3)与原代腹膜巨噬细胞的解离常数(kd)的一个曲线图。图17是在腹膜内给予肿瘤坏死因子-α(tnf-α)之后4小时nfκb-re-luc小鼠的图像。提供与阴性对照的比较。相较于阴性对照小鼠,用本发明的sirna处理的小鼠表现出降低的萤光素酶水平。图18a和18b是示出在表5中列出的示例性sirna化合物在体内抑制c57bi6小鼠中的apob基因表达中的功效的曲线图。图18a是展示在72小时通过标准化至体内β2微球蛋白(b2m)基因表达的肝apob基因表达对比给予仅一种媒介物测量的剂量反应函数的曲线图。图18b是展示在给予sirna(sb0097,参见表5)之后96、72、48、以及24小时标准化至体内b2m基因表达的体内肝apob基因表达对比给予仅媒介物的时间进程的一个曲线图。图19a和19b是提供本发明的杂交的多核苷酸构建体相对于载体的标准化apob表达水平的比较的曲线图。图20a示出图20b中的数据的阳性对照的结构。阳性对照(sb-0165)包括4个生物可逆性基团(邻-(叔丁基二硫基)苯乙基磷酸酯)和一个非生物可逆性基团(连接两个核苷的高炔丙基磷酸酯)。图20b示出图20a中所示阳性对照与具有非生物可逆性三酯e或q的阳性对照的apob基因表达水平的比较,字母符号与图12一致。具有三酯e的阳性对照是sb0190,并且具有三酯q的阳性对照是sb0202。图21a和21b是示出标准化至管家基因表达的gapdh表达的曲线图。在从经腹膜内给予对照(例如,媒介物)或本发明的杂交的多核苷酸构建体的小鼠中分离的巨噬细胞中测量gapdh表达。图22是示出标准化至管家基因的表达的gapdh表达的曲线图。在从给予媒介物或本发明的杂交的多核苷酸构建体的小鼠中分离的巨噬细胞中测量gapdh表达。图23a和23b示出来自小鼠原代骨髓细胞实验的结果。图23a示出随时间推移巨噬细胞中的甘露糖受体表达的标准化量。图23b示出在用表5中列出的示例性sirna化合物处理48小时之后标准化至b2m的gapdhmrna的曲线图。图23b示出在给予本发明的杂交的多核苷酸构建体后gapdhmrna水平的剂量依赖性降低。图24a和24b是示出gapdh表达的剂量依赖性和本发明的杂交的多核苷酸的相关ic50数据的曲线图。gapdh的表达被标准化为管家基因的表达。图25是在用溴化乙锭染色的15%变性凝胶的照片,该照片示出在小鼠血清中在37℃下在孵育开始(0h)和24小时或48小时后的2’修饰的sirna的条带。凝胶右侧的三条泳道示出针对本发明的杂交的多核苷酸构建体所获得的条带,并且左侧的三条泳道是对照泳道(不具有磷酸三酯基团的sirna)。详细说明将某些生物活性剂递送至细胞的内部的能力是有问题的,这是由于细胞质膜的选择渗透性。细胞的质膜形成一个屏障,该屏障将分子的细胞内摄取限制至足够非极性且大小小于约500道尔顿的那些。用于增强蛋白质的细胞内化的先前努力集中于使蛋白质与受体配体融合(ng等人,美国科学院院刊(proc.natl.acad.sci.usa),99:10706-11,2002)或者通过将这些蛋白质包装至笼状脂质体载体中(阿布-阿梅尔(abu-amer)等人,生物化学杂志(j.biol.chem.),276:30499-503,2001)。然而,这些技术可能导致不良细胞摄取和细胞内封存到内吞途径中。由于其阴离子电荷和约14,000道尔顿的较大大小,sirna的递送是哺乳动物(包括人)中的一个艰巨挑战。然而,带阳离子电荷的肽和蛋白质带来了在多核苷酸递送方面的进展。例如,将肽转导结构域(ptd)连接至一个核酸提供了在多核苷酸递送方面的一些进展。本发明提供了包含过客链和引导链的杂交的多核苷酸构建体,其中该过客链包含5’末端、3’末端、或核苷酸间非生物可逆性基团,和/或该引导链包含3'末端或核苷酸间非生物可逆性基团。这些杂交的多核苷酸构建体相对于区别仅在于不存在非生物可逆性基团的杂交的多核苷酸构建体可以在基因沉默中表现出优异的功效。不受理论的束缚,卓越的功效可能是由于risc复合物加载的动力学的改进或杂交的多核苷酸构建体的稳定性的改进。本发明还提供包括一个或多个生物可逆性基团(例如,二硫化物)的核苷酸构建体。空间位阻二硫化物是特别有利的。键合至至少一个庞大基团的二硫化物相较于未键合至至少一个庞大基团的二硫化物在核苷酸构建体合成过程中表现出更大稳定性,因为后者可以与核苷酸构建体的磷(iii)原子反应而裂解二硫键。相对较大的部分(例如,多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其组合)可以包含在生物可逆性基团内,而不影响生物可逆性基团在细胞内裂解的能力。本发明还提供包括生物可逆性基团(这些生物可逆性基团具有疏水性或亲水性官能团)和/或共轭部分的核苷酸构建体,其中这些共轭部分允许多肽、小分子、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其任何组合附接至核苷酸间或末端磷酸酯或硫代磷酸酯。本发明进一步提供包括一个或多个生物可逆性基团和/或一个或多个共轭基团的核苷酸构建体,该一个或多个生物可逆性基团包括一个或多个疏水性或亲水性官能团,该一个或多个共轭基团具有一个或多个共轭部分,该一个或多个共轭部分允许辅助部分(例如,多肽、小分子、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其任何组合)附接至该核苷酸构建体。在一个实施例中,在此披露的核苷酸构建体包含一定数量的降低这些构建体的总体负电荷的生物可逆性基团,从而允许或促进细胞对构建体的摄取。在此描述的核苷酸构建体可以允许或促进多核苷酸本身或连接至附接辅助部分(例如,小分子、肽、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其组合)的多核苷酸的细胞内运输。细胞内酶(例如,细胞内蛋白质二硫化物异构酶、硫氧还蛋白或硫酯酶)的作用或暴露于细胞内环境可以导致二硫化物或硫酯键联的裂解,从而释放该辅助部分和/或暴露(unmasking)该多核苷酸。暴露的多核苷酸然后可以例如引发反义或rnai介导的反应。此外,本发明的核苷酸构建体还允许或促进多核苷酸或通过二硫键联或硫酯键联连接至一个附接的辅助部分(例如,小分子、肽、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其组合)的多核苷酸的细胞内递送而不需要载体(如脂质体或阳离子脂质)。优选地,该辅助部分与该多核苷酸之间的键联包括二硫键联。这些特征各自在此进一步描述。本发明提供通过减少或中和与带阴离子电荷的多核苷酸相关的电荷并且任选地向该分子添加另外官能团(例如,阳离子肽、靶向部分和/或内体逃逸部分)来促进且改进多核苷酸的细胞摄取的方法和组合物。在具体实施例中,本发明的组合物可以通过产生具有一个阳离子电荷的核苷酸构建体来促进一种多核苷酸的摄取。本发明提供用于递送适用于选择性地治疗人病症和用于促进研究的序列特异性多核苷酸的组合物和方法。本发明的的组合物和方法将多核苷酸(包括sirna、rna和dna)有效地递送至受试者和细胞,而无当前核酸递送方法的缺点。本发明提供组合物和方法,这些组合物和方法克服使得rnai构建体难以递送至细胞或使得这些构建体不可递送的大小和电荷限制。通过可逆地中和核酸(例如,dsrna)的阴离子电荷,包括根据本发明的生物可逆性基团的核苷酸构建体能够在体外和体内将核酸递送至细胞中。本发明提供了包括电荷中和部分(例如,非生物可逆性基团、生物可逆性基团;或组分(i),具有化学式(ii)的基团,或具有化学式(iia)的基团,用作核苷酸间或末端磷(v)基团的保护基团)的核苷酸构建体。该构建体可以进一步包含适用于细胞转染和细胞调节的辅助部分。这类辅助部分可以包括小分子、肽、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其任何组合。本发明提供用于递送核苷酸构建体的组合物和方法,这些核苷酸构建体包括一个或多个靶向部分以用于靶向递送至特定细胞(例如,在其表面上具有去唾液酸糖蛋白受体的细胞(例如,肝细胞)、肿瘤细胞(例如,在其表面上具有叶酸受体的肿瘤细胞)、携带甘露糖受体的细胞(例如,巨噬细胞、树突细胞和皮肤细胞(例如,成纤维细胞或角化细胞)))。甘露糖受体超家族的非限制性实例包括mr、endo180、pla2r、mgl、以及dec205。本发明的核苷酸构建体的靶向递送可能涉及受体介导的内化。在一些实施例中,靶向部分可以包括甘露糖、n-乙酰半乳糖胺(galnac)、或一种叶酸配体。如在此所证明,将一个或多个可去除的(例如,可逆地附接的)电荷中和部分添加至核酸可以促进细胞转染。任何核酸(不管序列组成)可以进行修饰。因此,本发明不限于任何特定序列(即,任何特定sirna、dsrna、dna等)。在一些实施例中,本发明提供具有一个或多个生物可逆性部分的核苷酸构建体,该一个或多个生物可逆性部分有助于提高细胞膜渗透和对外切核酸酶和内切核酸酶降解的抗性的化学和生物物理特性。本发明进一步提供用于合成在此披露的核苷酸构建体的试剂,例如,亚磷酰胺试剂。此外,这些生物可逆性基团是在合成过程期间是稳定的。在细胞中,这些生物可逆性部分可以通过酶(例如,具有硫代还原酶(thioreductase)活性的酶(例如,蛋白质二硫化物异构酶或硫氧还蛋白))的作用或通过暴露于细胞内条件(例如,氧化或还原环境)或反应物(例如,谷胱甘肽或其他游离硫醇)来去除,以产生能够杂交至特定内源核酸和/或对特定内源核酸具有亲和力的生物活性多核苷酸化合物。生物可逆性部分可以与合成的dna或rna的反义多核苷酸或与属于基因或属于mrna的靶序列的互补序列的混合分子一起使用,这些靶序列的表达被特异性设计为阻断或下调。这些抑制性多核苷酸可以是针对一个靶mrna序列,或者可替代地针对一个靶dna序列,并且杂交至它们所互补的核酸,从而抑制转录或翻译。因此,在此披露的核苷酸构建体可以有效地阻断或下调基因表达。本发明的核苷酸构建体也可以是针对某些双链(bicatenary)dna区(同型嘌呤/同型嘧啶序列或富含嘌呤/嘧啶的序列),并且因此形成三螺旋。在特定序列处形成三螺旋能够阻断调控或以另外的方式控制基因表达的蛋白质因子的相互作用,和/或如果所得到的多核苷酸被制备成具有反应性官能团的情况下,可以促进待引入特定核酸位点的不可逆损伤。多核苷酸本发明提供包含多核苷酸(“多核苷酸构建体”)的核苷酸构建体,这些多核苷酸具有附接至核苷酸间或末端磷(v)基团的一个或多个电荷中和基团(例如,生物可逆性基团,非生物可逆性基团;或组分(i),具有化学式(ii)的基团,或具有化学式(iia)的基团)。该一个或多个电荷中和基团可以包含生物可逆性基团,如二硫键联或硫酯键联。优选地,该一个或多个电荷中和基团包括二硫键联。该一个或多个电荷中和基团可以包含连接到核苷酸间磷(v)基团或末端磷(v)基团的一个或多个辅助部分(例如,具有二硫键联或硫酯键联的生物可逆性基团;优选二硫键联)。这类辅助部分的实例包括小分子、共轭基团、亲水性官能团、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、以及其任何组合。该生物可逆性基团可能能够经历单独的反应(例如,分子内),以留下未修饰的核苷酸间桥联基团或末端核苷酸基团。虽然可以采用如在在此提供的核苷酸的定义中所描述的各种糖和主链,但多核苷酸将典型地采用核糖、脱氧核糖或lna糖以及磷酸酯或硫代磷酸酯核苷酸间磷(v)基团。还考虑这些糖和桥联基团在单一多核苷酸中的混合物。在此所描述的多核苷酸构建体特征在于生物可逆性基团,这些生物可逆性基团能够在细胞内选择性地裂解(例如,通过暴露于被动环境、酶的作用或其他反应物),从而促进将多核苷酸细胞内递送至细胞。示例性生物可逆性基团包括二硫键联。例如,在此所描述的多核苷酸构建体可以包括可通过具有硫代还原酶活性的细胞内酶裂解的二硫键联。一旦进入细胞,这些二硫键联(例如,包含在具有化学式(ii)的a1基团与a2基团之间的那些)可以通过酶选择性地裂解以便暴露核酸。在此所述的二硫键联还可以提供有用的处理,通过该处理,用一个或多个辅助部分(例如,一个或多个靶向部分)和其他共轭物,或者用将修饰核酸的物理化学性质的基团(例如,亲水性基团如羟基(-oh)基团)来官能化该核酸。该策略可以容易地推广至多种结构上和功能上不同的核酸,以便允许靶向细胞递送而无需使用单独的递送剂。在此所描述的多核苷酸构建体可以包括,例如,1-40个独立的生物可逆性基团或非生物可逆性基团。例如,在此披露的多核苷酸构建体可以括1-30、1-25、1-20、2-15、2-10、或1-5个之间的独立生物可逆性基团或非生物可逆性基团。在具体实施例中,不超过75%的组成核苷酸包括生物可逆性基团(例如,不超过20%、30%、40%、50%、55%、60%、65%、70%、或75%包括生物可逆性基团)。在另一个实施例中,本发明的多核苷酸构建体内高达90%的核苷酸可以具有生物可逆性基团。在又另一个实施例中,不超过一半的这些生物可逆性基团将包括疏水性末端,例如,烷基基团(例如,当(r4)r-l-a1组合以形成疏水性基团时)。在某些实施例中,不超过75%的组成核苷酸包括非生物可逆性基团(例如,不超过20%、30%、40%、50%、55%、60%、65%、70%、或75%包括生物可逆性基团)。在此披露的多核苷酸构建体可以特征在于生物可逆性基团的任何组合,例如包括共轭部分、亲水性官能团、多肽、小分子、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其任何组合的生物可逆性基团。该多核苷酸构建体长度通常将达150个核苷酸。在一些实施例中,该多核苷酸构建体在长度上由5-100、5-75、5-50、5-25、8-40、10-32、15-30、或19-28个核苷酸组成。在某些实施例中,该多核苷酸构建体包含一种或多种组分(i)或具有化学式(ii)的基团,这些组分各自独立地包含多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、或内体逃逸部分;其中这些组分(i)和具有化学式(ii)的基团各自包括与该多核苷酸构建体的核苷酸间桥联基团的连接子,该连接子包含二硫化物或硫酯(优选地,二硫化物,例如,该连接子是-l-a1-s-s-a2-a3-a4-)以及邻近该二硫化物基团且使该二硫化物基团空间位阻的一个或多个庞大基团。在一些实施例中,该多核苷酸构建体包含一种或多种组分(i),这些组分各自独立地包含多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、或内体逃逸部分。在具体实施例中,选择多核苷酸构建体内的生物可逆性基团的位置,以便改进所得到的构建体的稳定性(例如,以便在负责裂解二硫键联的试剂(例如,氧化或还原环境)不存在下增加该多核苷酸构建体的半衰期)。特别地,对于双链多核苷酸,这些生物可逆性基团的位置将使得形成在哺乳动物生理温度下稳定的一个双链分子。在其他实施例中,可以选择每个生物可逆性基团的性质以便产生有利的溶解度和递送特性。这类变化可以包括调节,例如,核苷酸间桥联基团或末端核苷酸基团与二硫化物基团之间和/或二硫化物基团与任何共轭部分、亲水性官能团或辅助部分之间的连接子长度。由疏水性生物可逆性基团引起的溶解度的降低可以部分地通过在该多核苷酸中的其他地方使用一个或多个亲水性生物可逆性基团来抵消。在一个具体的实施例中,与生物可逆性基团键合的核苷不包括2'oh基团,例如,而是包括2'f或ome基团。例如,在此描述的多核苷酸构建体中的一些可以包括根据化学式i的结构,或其一种盐,其中n是从0至150的一个数;每个b1独立地是一个核碱基;每个x独立地选自下组,该组由以下各项组成:缺失、o、s、以及任选取代的n;每个y独立地选自下组,该组由以下各项组成:氢、羟基、卤代、任选取代的c1-6烷氧基、以及一个受保护的羟基基团;每个y1独立地是h或任选取代的c1-6烷基(例如,甲基);每个z独立地是o或s;r1选自下组,该组由以下各项组成:h、羟基、任选取代的c1-6烷氧基、受保护的羟基基团、单磷酸酯、二磷酸酯、三磷酸酯、四磷酸酯、五磷酸酯、5’帽、磷酸硫醇、任选取代的c1-6烷基、含氨基基团、含生物素基团、含地高辛基团、含胆固醇基团、含染料基团、含淬灭剂基团、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、和与连接到寡核苷酸的连接子的键、以及其任何组合,或者r1是或其盐;r2选自下组,该组由以下各项组成:h、羟基、任选取代的c1-6烷氧基、受保护的羟基基团、单磷酸酯、二磷酸酯、三磷酸酯、四磷酸酯、五磷酸酯、任选取代的c1-6烷基、含氨基基团、含生物素基团、含地高辛基团、含胆固醇基团、含淬灭剂基团、磷酸硫醇、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、以及其任何组合,或r2是或其一种盐;并且每个r3独立地不存在、是一个氢、任选取代的c1-6烷基、或具有化学式ii的结构的一个基团:其中每个a1独立地是键或连接子,其包含或为以下各项中的一个或多个:任选取代的n;o;s;任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的(c3-8环烷基)-c1-4-亚烷基;任选取代的(c3-8环烯基)-c1-4-亚烷基;任选取代的c6-14亚芳基;任选取代的(c6-14芳基)-c1-4-亚烷基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的(c1-9杂芳基)-c1-4-亚烷基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;和具有选自n、o和s的1至4个杂原子的任选取代的(c1-9杂环基)-c1-4-亚烷基,条件是当a1包括任选取代的n、o和s中的一个或多个时,该任选取代的n、o或s不直接键合到二硫化物;并且每个a2独立地选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;和具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;或a1和a2与-s-s-一起连接以形成任选取代的5至16元环;每个a3独立地选自下组,该组由以下各项组成:键,任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基,具有选自n、o、和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;o;任选取代的n;和s;每个a4独立地选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;和具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;每个l独立地是不存在的或者是共轭基团,该共轭基团包括一个或多个共轭部分,或由其组成;每个r4独立地是氢、任选取代的c1-6烷基、亲水性官能团、或包括辅助部分的基团,该辅助部分选自下组,该组由以下各项组成:小分子、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、以及其组合;每个r独立地是从1至10的一个整数;每个u独立地是0或1;其中,在r1、r2和r3中的至少一个中,a2、a3和a4组合以形成在连接-s-s-与x的最短链中具有至少三个原子的一个基团;并且其中至少一个r3具有化学式(ii)的结构。在一些实施例中,l包括至另一种多核苷酸(例如,具有化学式(i)的另一种多核苷酸)的键。在具体实施例中,y1是h。本发明的多核苷酸和核苷酸中的二硫键联可以被另一种生物可逆性基团(例如,硫酯部分)置换。例如,具有化学式(ii)、(iia)、(viii)、或(viiia)的基团可以被具有化学式(iib)的基团置换:在此所述的合成方法可适于制备此类多核苷酸和核苷酸。因此,这些含硫酯基团都被认为在本发明的范围内。化学式(i)的某些实施例包括x和z均是o的那些(例如,磷酸酯)。在一些实施例中,在此披露的多核苷酸构建体主要包括具有化学式(i)的结构,但所描绘的具有化学式(i)的核苷酸间磷(v)基团被在此所描述的另一个核苷酸间磷(v)基团(例如,修饰的多核苷酸主链)置换。在替代实施例中,在此披露的多核苷酸构建体主要包含化学式(i)的结构,但所描绘的化学式(i)的基团r1和/或r2被具有基团r3的一个末端核苷酸基团置换。在此披露的多核苷酸构建体可以具有修饰的多核苷酸主链。修饰的多核苷酸主链的实例包括例如硫代磷酸酯;手性硫代磷酸酯;二硫代磷酸酯;氨基烷基-磷酸三酯;甲基膦酸酯和其他烷基膦酸酯,包括3'-亚烷基膦酸酯和手性膦酸酯;亚膦酸酯;氨基磷酸酯,包括3'-氨基氨基磷酸酯和氨基烷基氨基磷酸酯;硫代羰基氨基磷酸酯;硫代羰基烷基磷酸酯;硫代羰基烷基磷酸三酯;以及具有正常3’-5’键联的硼烷磷酸酯、这些酯的2’-5’连接的类似物,和具有反转极性的那些酯,其中相邻对的核苷单元对被3’-5’连接至5’-3’或2’-5’连接至5’-2’。传授制备上述含磷键联的代表性美国专利包括美国专利号3,687,808;4,469,863;4,476,301;5,023,243;5,177,196;5,188,897;5,264,423;5,276,019;5,278,302;5,286,717;5,321,131;5,399,676;5,405,939;5,453,496;5,455,233;5,466,677;5,476,925;5,519,126;5,536,821;5,541,306;5,550,111;5,563,253;5,571,799;5,587,361;以及5,625,050,其每一者通过引用结合在此。在此公开的具有修饰的多核苷酸主链(其中不包括磷原子)的核苷酸构建体可以具有由短链烷基或环烷基核苷酸间桥连基团,混合的杂原子和烷基或环烷基核苷酸间桥联基团或一个或多个短链杂原子或杂环核苷酸间桥联基团所形成的主链。这些包括具有以下结构的那些:吗啉代键联(从核苷的糖部分中部分地形成);硅氧烷骨架;硫化物、亚砜和砜骨架;甲酰乙酰基和硫代甲酰乙酰基骨架;亚甲基甲酰乙酰基和硫代甲酰乙酰基骨架;含烯的骨架;氨基磺酸盐骨架;亚甲亚氨基和亚甲肼基骨架;磺酸酯和磺酰胺骨架;酰胺骨架;以及具有混合n、o、s和ch2组分部分的其他骨架。传授制备上述多核苷酸的代表性美国专利包括美国专利号5,034,506;5,166,315;5,185,444;5,214,134;5,216,141;5,235,033;5,264,562;5,264,564;5,405,938;5,434,257;5,466,677;5,470,967;5,489,677;5,541,307;5,561,225;5,596,086;5,602,240;5,610,289;5,602,240;5,608,046;5,610,289;5,618,704;5,623,070;5,663,312;5,633,360;5,677,437;以及5,677,439,其每一者通过引用结合在此。示例性-a1-s-s-a2-a3-a4-或-s-s-a2-a3-a4-基团如下:其中每个r9独立地是卤代,任选取代的c1-6烷基;任选取代的c2-6烯基;任选取代的c2-6炔基;任选取代的c3-8环烷基;任选取代的c3-8环烯基;任选取代的(c3-8环烷基)-c1-4-烷基;任选取代的(c3-8环烯基)-c1-4-烷基;任选取代的c6-14芳基;任选取代的(c6-14芳基)-c1-4-烷基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂芳基;具有选自氮、氧中的1至4个杂原子的任选取代的(c1-9杂芳基)-c1-4-烷基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂环基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的(c1-9杂环基)-c1-4-烷基;氨基;或任选取代的c1-6烷氧基;或两个相邻的r9基团与每个r9附接的原子一起组合以形成选自下组的环状基团,该组由以下各项组成:c6芳基、c2-5杂环基或c2-5杂芳基,其中该环状基团任选地被选自下组的1、2、或3个取代基取代,该组由以下各项组成:c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;和-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;q是0、1、2、3、或4;并且s是0、1、或2。在本发明的生物可逆性基团中包括的示例性基团如下:其中每个r7独立地为c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;或-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;或两个相邻的r7基团与每个r7附接的原子一起组合以形成选自下组的环状基团,该组由以下各项组成:c6芳基、c2-5杂环基或c2-5杂芳基,其中该环状基团任选地被选自下组的1、2、或3个取代基取代,该组由以下各项组成:c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;和-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;q是0、1、2、3、或4;并且s是0、1、或2。本发明进一步提供用于制造本发明的多核苷酸构建体的方法。用于制备核苷酸和多核苷酸的方法是本领域中已知的。例如,用于制备多核苷酸的亚磷酰胺化学的实践是从卡拉瑟斯(caruthers)和贝卡格(beaucage)的出版的作品和其他已知的。参见,例如,美国专利号4,458,066;4,500,707;5,132,418;4,415,732;4,668,777;4,973,679;5,278,302;5,153,319;5,218,103;5,268,464;5,000,307;5,319,079;4,659,774;4,672,110;4,517,338;4,725,677;以及re34,069描述多核苷酸合成的方法,其每一者通过引用结合在此。此外,亚磷酰胺化学的实践已由贝卡格等人,四面体(tetrahedron),48:2223-2311,1992;和贝卡格等人,四面体,49:6123-6194,1993,连同其中引用的参考文献进行了系统性综述,其全部通过引用结合在此。核酸合成器是可商购的,并且其用途通常由本领域的普通技术人员理解为有效地产生几乎任何可能需要的合理长度的多核苷酸。在实践亚磷酰胺化学中,有用的5’oh糖封闭基团是三苯甲基、单甲氧基三苯甲基、二甲氧基三苯甲基、以及三甲氧基三苯甲基,尤其是二甲氧基三苯甲基(dmtr)。在实践亚磷酰胺化学中,有用的亚磷酸酯活化基团是二烷基取代的氮基团和氮杂环。一种方法包括使用二-异丙基氨基活化基团。多核苷酸可以通过一种mermade-6固相自动多核苷酸合成器或任何可商购的自动多核苷酸合成器进行合成。三酯、亚磷酰胺、或氢膦酸酯偶联化学(描述于例如,m.卡拉瑟斯,寡核苷酸:基因表达的反义抑制剂(oligonucleotides:antisenseinhibitorsofgeneexpression),第7-24页,j.s.科恩(cohen)编辑(crc出版公司,博拉卡顿,佛罗里达州(fla.),1989);寡核苷酸合成,实用方法(oligonucleotidesynthesis,apracticalapproach),m.j.盖特(gait)编辑,irl出版社,1984;以及寡核苷酸和类似物,实用方法(oligonucleotidesandanalogues,apracticalapproach),f.埃克斯坦(eckstein),irl出版社,1991中)由这些合成器用于提供所希望的多核苷酸。贝卡格试剂(如描述于例如,美国化学学会会志(journalofamericanchemicalsociety),112:1253-1255,1990中)或元素硫(如描述于贝卡格等人,四面体通讯(tetrahedronletters)22:1859-1862,1981中)与亚磷酰胺或氢膦酸酯化学一起用于提供取代的硫代磷酸酯多核苷酸。例如,包含在此所述的这些保护基团的试剂可以用于希望保护的多种应用中。这类应用包括但不限于,固相和液相多核苷酸合成等。例如,结构基团被任选地添加至核苷的核糖或碱基以用于并入多核苷酸,如在核糖上的2’-o位置处的甲基、丙基或烯丙基基团,或取代2’-o基团的氟代基团,或核糖核苷碱基上的溴代基团。对于与亚磷酰胺化学一起使用,各种亚磷酰胺试剂是可商购的,包括2’-脱氧亚磷酰胺、2’-o-甲基亚磷酰胺、以及2’-o-羟基亚磷酰胺。还可以采用用于这种合成的任何其他方式。这些多核苷酸的实际合成完全在本领域技术人员的才能范围内。使用类似技术来制备其他多核苷酸(如硫代磷酸酯、甲基膦酸酯、以及烷基化衍生物)也是熟知的。还熟知使用类似技术和可商购的修饰的亚磷酰胺和控制孔径玻璃(controlled-poreglass;cpg)产品(如生物素、cy3、荧光素、吖啶或补骨脂素修饰的亚磷酰胺和/或cpg(可从格伦研究公司(glenresearch),弗吉尼亚州斯特林(sterlingva)获得))来合成荧光标记的、生物素化的或其他共轭的多核苷酸。化学式(ia):或其盐,b1是一个核碱基;x是o、s、或任选取代的n;y是氢、羟基、卤代、任选取代的c1-6烷氧基、或一个受保护的羟基基团;y1独立地是h或任选取代的c1-6烷基(例如,甲基);z不存在;r1是受保护的羟基(例如,4,4’-二甲氧基三苯甲基基团(dmt));r2是-n(r3)r4或-n(c1-6烷基)2(例如,-n(ipr)2);并且r3是具有化学式(iia)的结构的基团:其中a1是键或连接子,该键或连接子包含以下各项或由以下各项组成:一个或多个任选取代的n、o、s;任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的(c3-8环烷基)-c1-4-亚烷基;任选取代的(c3-8环烯基)-c1-4-亚烷基;任选取代的c6-14亚芳基;任选取代的(c6-14芳基)-c1-4-亚烷基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自氮、氧中的1至4个杂原子的任选取代的(c1-9杂芳基)-c1-4-亚烷基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9亚杂环基;和具有选自氮、氧和硫中的1至4个杂原子的任选取代的(c1-9杂环基)-c1-4-亚烷基,条件是当a1包括氨基、o和s中的一个或多个时,该氨基、o和s都不直接键合到二硫化物上;并且a2选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂亚芳基;和具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9亚杂环基;或a1和a2与-s-s-一起连接以形成任选取代的5至16元环;a3选自下组,该组由以下各项组成:键,任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基,具有选自氮,氧,和硫的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9亚杂环基;o;任选取代的n;和s;a4选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;和具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9亚杂环基;l是一个键或一个共轭基团,该共轭基团包含一个或多个共轭部分或由一个或多个共轭部分组成;r5是氢、任选取代的c1-6烷基、一个亲水性官能团、或包含一个辅助部分的一个基团,该辅助部分选自下组,该组由以下各项组成:小分子、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、以及其组合;r是从1至10的一个整数;其中a2、a3、以及a4组合以形成在连接-s-s-与x的最短链中具有至少三个原子的基团;并且每个r4和r6独立地选自下组,该组由以下各项组成:氢;任选取代的c1-6烷基;任选取代的c2-7烷酰基;羟基;任选取代的c1-6烷氧基;任选取代的c3-8环烷基;任选取代的c3-8环烯基;任选取代的c6-14芳基;任选取代的c6-15芳酰基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂环基;和具有选自氮、氧和硫中的1至4个杂原子的任选取代的c3-10(杂环)酰基。本发明还提供了加工通过使用本文公开的制造方法合成的多核苷酸构建体的方法。例如,在合成多核苷酸构建体之后,如果核碱基包含一个或多个保护基团,则可以去除这些保护基团;和/或对于含有通过保护基团保护的亲水性官能团或共轭部分的任何-l-a1-s-s-a2-a3-a4-,则可以去除该保护基团。此外,在合成多核苷酸构建体之后,包含小分子、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、以及内体逃逸部分中的一个或多个的一个基团可以被连接至一个或多个生物可逆性基团的一个或多个共轭部分。核苷酸本发明可以使用包含单一核苷酸的化合物(“本发明的化合物”)。这种化合物可以具有根据化学式(vii)的结构:或其盐,其中b1是一个核碱基;x是o、s、或nr4;y是氢、羟基、卤代、任选取代的c1-6烷氧基、或一个受保护的羟基基团;y1独立地是h或任选取代的c1-6烷基(例如,甲基);z不存在、是o或s;r1是羟基、任选取代的c1-6烷氧基、受保护的羟基基团、单磷酸酯、二磷酸酯、三磷酸酯、四磷酸酯、和五磷酸酯、5’帽、磷酸硫醇、任选取代的c1-6烷基、含氨基基团、含生物素基团、含地高辛基团、含胆固醇基团、含染料基团、含淬灭剂基团、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其任何组合;r2是h、羟基、任选取代的c1-6烷氧基、受保护的羟基基团、单磷酸酯、二磷酸酯、三磷酸酯、四磷酸酯、五磷酸酯、和氨基、5’帽、磷酸硫醇、任选取代的c1-6烷基、含氨基基团、含生物素基团、含地高辛基团、含胆固醇基团、含染料基团、含淬灭剂基团、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其任何组合;并且r3是具有化学式(viii)的结构的一个基团:其中a1是键或包括以下各种中的一个或多个(或由其组成)的连接子;任选取代的n;o;s;任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的(c3-8环烷基)-c1-4-亚烷基;任选取代的(c3-8环烯基)-c1-4-亚烷基;任选取代的c6-14亚芳基;任选取代的(c6-14芳基)-c1-4-亚烷基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的(c1-9杂芳基)-c1-4-亚烷基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;和具有选自n、o和s的1至4个杂原子的任选取代的(c1-9杂环基)-c1-4-亚烷基,条件是当a1包括任选取代的n、o和s中的一个或多个时,该任选取代的n、o或s不直接键合到二硫化物;并且a2选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9杂亚芳基;和具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;或a1和a2与-s-s-一起连接以形成任选取代的5至16元环;a3选自下组,该组由以下各项组成:键,任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基,具有选自n、o、和s的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;o;任选取代的n;和s;a4选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;和具有选自n、o和s的1至4个杂原子的任选取代的c1-9亚杂环基;l不存在或是一个共轭基团,该共轭基团包含一个或多个共轭部分或由一个或多个共轭部分组成;r5不存在、是氢、任选取代的c1-6烷基、一个亲水性官能团、或包含一个辅助部分的一个基团,该辅助部分选自下组,该组由以下各项组成:小分子、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其任何组合,其中该亲水性官能团任选地用一个保护基团保护;r是从1至10的一个整数;其中a2、a3、以及a4组合以形成在连接-s-s-a1-r5与-x-的最短链中具有至少三个原子的一个基团;并且每个r4和r6独立地选自下组,该组由以下各项组成:氢;任选取代的c1-6烷基;任选取代的c2-7烷酰基;羟基;任选取代的c1-6烷氧基;任选取代的c3-8环烷基;任选取代的c3-8环烯基;任选取代的c6-14芳基;任选取代的c6-15芳酰基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂环基;和具有选自氮、氧和硫中的1至4个杂原子的任选取代的c3-10(杂环)酰基。具有化学式(vii)的化合物的其他实施例包括以下:z不存在;a1选自下组,该组由以下各项组成:键,任选取代的c1-6亚烷基;任选取代的c2-6亚烯基;任选取代的c2-6亚炔基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的(c3-8环烷基)-c1-4-亚烷基;任选取代的(c3-8环烯基)-c1-4-亚烷基;任选取代的c6-14亚芳基;任选取代的(c6-14芳基)-c1-4-亚烷基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自氮、氧中的1至4个杂原子的任选取代的(c1-9杂芳基)-c1-4-亚烷基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9亚杂环基;和具有选自氮、氧和硫中的1至4个杂原子的任选取代的(c1-9杂环基)-c1-4-亚烷基;并且a2选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂亚芳基;和具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9亚杂环基;或a1和a2与-s-s-一起连接以形成任选取代的5至16元环;a3选自下组,该组由以下各项组成:键,任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;任选取代的c3-8亚环烯基;任选取代的c6-14亚芳基,具有选自氮,氧,和硫的1至4个杂原子的任选取代的c1-9杂亚芳基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9亚杂环基;o;nr6;和s;a4选自下组,该组由以下各项组成:任选取代的c1-6亚烷基;任选取代的c3-8亚环烷基;和具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9亚杂环基;l是一个键或一个共轭基团,该共轭基团包含一个或多个共轭部分或由一个或多个共轭部分组成;r5不存在、是氢、任选取代的c1-6烷基、一个亲水性官能团、或包含一个辅助部分的一个基团,该辅助部分选自下组,该组由以下各项组成:小分子、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、以及其组合;r是从1至10的一个整数;其中a2、a3、以及a4组合以形成在连接-s-s-与x的最短链中具有至少三个原子的基团;并且每个r4独立地是氢;任选取代的c1-6烷基;任选取代的c2-7烷酰基;羟基;任选取代的c1-6烷氧基;任选取代的c3-8环烷基;任选取代的c3-8环烯基;任选取代的c6-14芳基;任选取代的c6-15芳酰基;具有选自氮、氧和硫中的2至4个杂原子的任选取代的c1-9杂环基;或具有选自氮、氧和硫中的1至4个杂原子的任选取代的c3-10(杂环)酰基。在具有化学式(vii)的化合物的又其他实施例中,-a1-s-s-a2-a3-a4-或-s-s-a2-a3-a4-基团是以下中的一个:其中每个r9独立地是卤代,任选取代的c1-6烷基;任选取代的c2-6烯基;任选取代的c2-6炔基;任选取代的c3-8环烷基;任选取代的c3-8环烯基;任选取代的(c3-8环烷基)-c1-4-烷基;任选取代的(c3-8环烯基)-c1-4-烷基;任选取代的c6-14芳基;任选取代的(c6-14芳基)-c1-4-烷基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂芳基;具有选自氮、氧中的1至4个杂原子的任选取代的(c1-9杂芳基)-c1-4-烷基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的c1-9杂环基;具有选自氮、氧和硫中的1至4个杂原子的任选取代的(c1-9杂环基)-c1-4-烷基;氨基;或任选取代的c1-6烷氧基;或两个相邻的r9基团与每个r9附接的原子一起组合以形成选自下组的环状基团,该组由以下各项组成:c6芳基、c2-5杂环基或c2-5杂芳基,其中该环状基团任选地被选自下组的1、2、或3个取代基取代,该组由以下各项组成:c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;和-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;q是0、1、2、3、或4;并且s是0、1、或2。在仍其他实施例中,生物可逆性基团包含以下结构之一:其中每个r7独立地为c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;或-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;或两个相邻的r7基团与每个r7附接的原子一起组合以形成选自下组的环状基团,该组由以下各项组成:c6芳基、c2-5杂环基或c2-5杂芳基,其中该环状基团任选地被选自下组的1、2、或3个取代基取代,该组由以下各项组成:c2-7烷酰基;c1-6烷基;c2-6烯基;c2-6炔基;c1-6烷基亚磺酰基;c6-10芳基;氨基;(c6-10芳基)-c1-4-烷基;c3-8环烷基;(c3-8环烷基)-c1-4-烷基;c3-8环烯基;(c3-8环烯基)-c1-4-烷基;卤代;c1-9杂环基;c1-9杂芳基;(c1-9杂环基)氧基;(c1-9杂环基)氮杂;羟基;c1-6硫代烷氧基;-(ch2)qco2ra,其中q是从0至4的一个整数并且ra选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qconrbrc,其中q是从0至4的一个整数并且其中rb和rc独立地选自下组,该组由以下各项组成:氢、c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2rd,其中q是从0至4的一个整数并且其中rd选自下组,该组由以下各项组成:c1-6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;-(ch2)qso2nrerf,其中q是从0至4的一个整数并且其中re和rf各自独立地选自下组,该组由以下各项组成:氢、烷基、芳基和(c6-10芳基)-c1-4-烷基;硫醇;芳氧基;环烷氧基;芳基烷氧基;(c1-9杂环基)-c1-4-烷基;(c1-9杂芳基)-c1-4-烷基;c3-12甲硅烷基;氰基;和-s(o)rh,其中rh选自下组,该组由以下各项组成:氢、c1-c6烷基、c6-10芳基、和(c6-10芳基)-c1-4-烷基;q是0、1、2、3、或4;并且s是0、1、或2。在具体实施例中,该辅助部分可以通过与在共轭基团中发现的共轭部分形成一个或多个共价键而附接至包含二硫键联的基团。共轭物本发明的核苷酸构建体可以包含具有一个或多个共轭部分的一个或多个共轭基团。这些共轭部分进而可以用于将各种其他辅助部分附接至核苷酸构建体,这些辅助部分例如,小分子、多肽、碳水化合物、中性有机聚合物、带正电荷的聚合物、治疗剂、靶向部分、内体逃逸部分、或其组合。在某一实施例中,多于一种类型的共轭部分的存在于一种核苷酸构建体中,由此允许辅助部分选择性和/或顺序偶联至核苷酸构建体。一种多核苷酸构建体中的附接位置是通过在聚合物的合成中使用适当的核苷酸构建体来确定的。包含一个或多个共轭部分的核苷酸构建体将在适当条件下与辅助部分上的一个或多个相应共轭部分反应。辅助部分可以在本质上具有共轭部分,例如肽或多肽中的末端或赖氨酸胺基团和硫醇基团,或者该辅助部分可以被修饰成包括一个较小连接基团以便引入共轭部分。这类连接基团的引入是本领域中众所周知的。应当理解,附接至本发明的核苷酸构建体的一个辅助部分包含任何必要的连接基团。各种键形成方法可以用于将辅助部分共轭至在此描述的核苷酸构建体。示例性反应包括:叠氮化物与炔烃之间以形成三唑的胡伊斯根环加成反应;二烯亲和物与二烯/杂二烯之间的狄尔斯-阿尔德反应;经由其他周环反应如烯反应的键形成;酰胺或硫代酰胺键形成;磺酰胺键形成;醇或酚烷基化(例如,用重氮化合物);缩合反应以形成肟、腙、或氨基脲基团;通过亲核试剂(例如,胺和硫醇)进行的共轭加成反应;二硫键形成;以及在羧酸官能团处的亲核取代(例如,被胺、硫醇或羟基亲核试剂取代)。键形成的其他示例性方法在此进行描述并且是本领域中已知的。亲核试剂/亲电子试剂反应亲核试剂和亲电子试剂可以参与键形成反应,这些键形成反应选自但不限于:通过亲电子试剂插入c-h键中;通过亲电子试剂插入o-h键中;通过亲电子试剂插入n-h键中;在烯烃上加成亲电子试剂;在炔烃上加成亲电子试剂;加成至亲电子羰基中心;在亲电子羰基中心处取代;加成至烯酮;亲核加成至异氰酸酯;亲核加成至异硫氰酸酯;在活化的硅中心处亲核取代;烷基卤的亲核置换;在烷基拟卤化物处的亲核置换;在活化的羰基处亲核加成/消除;亲核试剂1,4-共轭加成至α,β-不饱和羰基;环氧化物的亲核开环;缺电子芳香族化合物的亲核芳香族取代;亲核加成至活化的磷中心;在活化的磷中心处亲核取代;亲核加成至活化的硫中心;以及在活化的硫中心处亲核取代。一个亲核共轭部分可以选自任选取代的烯烃、任选取代的炔烃、任选取代的芳基、任选取代的杂环基、羟基基团、氨基基团、烷基氨基基团、苯胺基基团、以及硫代基团。一个亲电子共轭部分可以选自氮烯、氮烯前体(如叠氮化物)、碳烯、碳烯前体、活化的硅中心、活化的羰基、酸酐、异氰酸酯、硫代异氰酸酯、琥珀酰亚胺酯、磺基琥珀酰亚胺酯、马来酰亚胺、烷基卤、烷基拟卤化物、环氧化物、环硫化物、氮丙啶、缺电子芳基、活化的磷中心、以及活化的硫中心。例如,共轭可以经由一种缩合反应发生以便形成为一个腙键的一个键联。经由一个酰胺键的形成进行的共轭可以通过活化一个基于羧基的共轭部分且随后与一个基于伯胺的共轭部分反应来介导。活化剂可以是各种碳二亚胺,像:edc(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐)、edac(1-乙基-3(3-二甲基氨基丙基)碳二亚胺盐酸盐)、dcc(二环己基碳二亚胺)、cmc(1-环己基-3-(2-吗啉代乙基)碳二亚胺)、dic(二异丙基碳二亚胺)或伍德沃德氏(woodward’s)试剂k(n-乙基-3-苯基异噁唑鎓-3'-磺酸盐)。一种基于活化的nhs-酯的共轭部分与一种基于伯胺的共轭部分也导致形成一个酰胺键。核苷酸构建体可以包含一个基于羰基的共轭部分。经由一种仲胺的形成进行的共轭可以通过使一个基于胺的共轭部分与一个基于醛的共轭部分反应、接着用一种氢化物供体像氰基硼氢化钠还原来实现。基于醛的共轭部分可以例如通过氧化糖部分或通过与sfb(琥珀酰亚胺基-对甲酰基苯甲酸酯)或sfpa(琥珀酰亚胺基-对甲酰基苯氧基乙酸酯)反应来引入。醚形成也可以用于将辅助部分共轭至本发明的核苷酸构建体。经由醚键联进行的共轭可以通过一个基于环氧化物的共轭部分与一个基于羟基的共轭部分的反应来介导。硫醇也可以用作共轭部分。例如,经由二硫化物的形成进行的共轭可以通过吡啶基二硫化物介导的二硫醇-二硫化物交换来完成。基于巯基的共轭部分的引入是例如通过特劳特氏试剂(traut’sreagent)(2-亚氨基硫烷)、sata(n-琥珀酰亚胺基s-乙酰基硫代乙酸酯)、satp(乙酰基硫代丙酸琥珀酰亚胺酯)、spdp(3-(2-吡啶基二硫代)丙酸n-琥珀酰亚胺酯)、smpt(琥珀酰亚胺基氧基羰基-α-甲基-α-(2-吡啶基二硫代)甲苯)、n-乙酰基高半胱氨酸硫代内脂、samsa(s-乙酰基巯基琥珀酸酐)、ambh(2-乙酰胺基-4-巯基丁酸酰肼)、以及胱胺(2,2’-二硫代双(乙胺)来介导的。经由硫醚键联的形成进行的共轭可以通过使基于巯基的共轭部分与基于马来酰亚胺或碘乙酰基的共轭部分反应或通过与基于环氧化物的共轭部分反应来进行。基于马来酰亚胺的共轭部分可以通过smcc(4-(n-马来酰亚胺基甲基)环己烷-1-甲酸琥珀酰亚胺酯)、磺基-smcc(4-(n-马来酰亚胺基甲基)-环己烷-1-甲酸琥珀酰亚胺酯)、mbs(间-马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯)、磺基mbs(间-马来酰亚胺基苯甲酰基-n-磺基羟基琥珀酰亚胺酯)、smpb(4-(对-马来酰亚胺基苯基)-丁酸琥珀酰亚胺酯)、磺基-smpb(4-(对-马来酰亚胺基苯基)丁酸磺基琥珀酰亚胺酯)、gmbs(n-α-马来酰亚胺基丁酰基-氧基琥珀酰亚胺酯)、磺基gmbs(n-α-马来酰亚胺基丁酰基-氧基磺基琥珀酰亚胺酯)来引入。基于硫醇的共轭部分也可以与基于碘乙酰基的共轭部分反应。基于碘乙酰基的共轭部分可以用siab(4-(碘乙酰基)-氨基苯甲酸n-琥珀酰亚胺酯)、磺基siab(4-(碘乙酰基)-氨基苯甲酸磺基-琥珀酰亚胺酯)、siax(6-[(碘乙酰基-氨基]己酸琥珀酰亚胺酯)、siaxx(6-[6-(((碘乙酰基)氨基)-己酰基)氨基]己酸琥珀酸亚胺酯)、siac(4-(((碘乙酰基)氨基)甲基)-环己烷-1-甲酸琥珀酰亚胺酯)、siacx(6-((((4-(碘乙酰基)氨基)甲基)-环己烷-1-羰基)氨基)己酸琥珀酰亚胺酯)、以及npia(对-硝基苯基碘乙酸酯)插入。经由一个氨基甲酸酯键联的形成进行的共轭可以通过一个基于羟基的共轭部分与cdi(n,n’-羰基二咪唑)或dsc(n,n’-二琥珀酰亚胺基碳酸酯)或n-羟基琥珀酰亚胺基氯甲酸酯的反应且随后与一个基于胺的共轭部分反应来进行。光解和热解共轭可替代地,共轭部分可以采用光解或热解活化以便形成所希望的共价键。包括叠氮基官能团的共轭部分是一个实例。因此,共轭还可以通过引入一个光反应性共轭部分来实现。光反应性共轭部分是芳基叠氮化物、卤化芳基叠氮化物、二苯甲酮、某些重氮化合物、以及双吖丙啶衍生物。这些光反应性共轭部分与基于氨基的共轭部分或与具有活化的氢键的共轭部分反应。基于叠氮基的共轭部分是uv不稳定的并且在光解时可能导致氮烯亲电子试剂的形成,这些氮烯亲电子试剂可以与亲核共轭部分如基于芳基的共轭部分或基于烯基的共轭部分反应。可替代地,这些叠氮化合物的加热也可能导致氮烯形成。环加成反应环加成反应可以用于形成所希望的共价键。代表性环加成反应包括但不限于,基于烯烃的共轭部分与基于1,3-二烯的共轭部分的反应(狄尔斯-阿尔德反应)、基于烯烃的共轭部分与基于α,β-不饱和羰基的共轭部分的反应(杂狄尔斯-阿尔德反应)、以及基于炔烃的共轭部分与基于叠氮基的共轭部分的反应(胡伊斯根环加成反应)。包括用于环加成反应的反应物的共轭部分的选定的非限制性实例是:烯烃、炔烃、1,3-二烯、α,β-不饱和羰基、以及叠氮化物。例如,叠氮化物与炔烃之间的胡伊斯根环加成反应(点击反应)已用于各种生物实体的官能化。偶联反应共轭部分还包括但不限于,用于氢化硅烷化、烯烃交叉复分解、共轭加成、施蒂勒偶联、铃木偶联、薗头偶联、桧山偶联、以及赫克反应。用于这些反应的共轭部分包括氢化硅烷、烯烃(例如,活化的烯烃,如烯酮或烯酸酯)、炔烃、芳基卤、芳基拟卤化物(例如,三氟甲磺酸酯或全氟丁磺酸酯)、烷基卤、以及烷基拟卤化物(例如,三氟甲磺酸酯、全氟丁磺酸酯和磷酸酯)。用于交叉偶联反应的催化剂是本领域中熟知的。这类催化剂可以是有机金属复合物或金属盐(例如,pd(0)、pd(ii)、pt(0)、pt(ii)、pt(iv)、cu(i)、或ru(ii))。可以添加添加剂如配体(例如,pph3、pcy3、binap、dppe、dppf、sime、或sipr)和金属盐(例如,licl)来促进交联偶联反应。用于共轭的辅助部分各种辅助部分可以共轭至本发明的核苷酸构建体(例如,sirna),并且这些辅助部分可以具有任何数量的生物或化学作用。生物作用包括但不限于,诱导细胞内化、结合至细胞表面、靶向特定细胞类型、允许内体逃逸、在体内改变多核苷酸的半衰期、以及提供治疗作用。化学作用包括但不限于,改变溶解度、电荷、大小、以及反应性。小分子基于小分子的辅助部分(例如,具有约1000da或更小分子量的的有机化合物)可以共轭至本发明的核苷酸构建体。这类小分子的实例包括但不限于,取代或未取代的烷烃、烯烃、或炔烃,例如,羟基取代的、nh2取代的、单、二或三烷基氨基取代的、胍基取代的、杂环基取代的、以及其受保护的型式。其他小分子包括类固醇(例如,胆固醇)、其他脂质、胆汁、以及氨基酸。一种小分子可以被添加至一种多核苷酸以便提供中性或正电荷或改变该多核苷酸的亲水性或疏水性。多肽多肽(包括一种融合多肽)是指其中单体是通过酰胺键连接在一起的氨基酸残基的一种聚合物。当这些氨基酸是α-氨基酸时,可以使用l-光学异构体抑或d-光学异构体。多肽涵盖一个氨基酸序列并且包含修饰的序列,如糖蛋白、逆反式(retro-inverso)多肽、d-氨基酸等。多肽包含天然存在的蛋白质,以及重组或合成地合成的那些。多肽可以包含多于一个结构域,该结构域具有可以归因于多肽的特定片段或部分的功能。一个结构域,例如,包括显示至少一个有用的表位或功能结构域的多肽的一部分。两个或更多个结构域可以是功能性相关的,这样使得每个结构域保留其功能,然而包括单一肽或多肽(例如,融合多肽)。例如,一个ptd的一个功能片段包括保留转导活性的一个片段。生物功能片段例如可以在大小上从小到能够结合一个抗体分子的一个表位的一个片段至能够参与特征性诱导或编程细胞内的表型变化的一种较大多肽而不同。在一些实施例中,使用逆反式多肽。“逆反式”意指氨基-羧基反转,以及一个或多个氨基酸中的对映异构体变化(即,左旋(l)至右旋(d))。本发明的多肽涵盖,例如,氨基酸序列的氨基-羧基反转、包含一个或多个d-氨基酸的氨基-羧基反转、以及包含一个或多个d-氨基酸的非反转序列。稳定且保留生物活性的逆反式肽模拟物可以如由布吕吉杜(brugidou)等人(生物化学与生物物理研究通讯(biochem.biophys.res.comm.)214(2):685-693,1995)和可莱芜(chorev)等人(生物技术趋势(trendsbiotechnol.)13(10):438-445,1995)所描述来设计。一种逆反式多肽的总体结构特征类似于母体l-多肽的那些特征。然而,这两种分子是大致镜像,因为它们固有地共享手性二级结构元件。基于肽键逆转和手性反转的主链肽模拟物代表肽和蛋白质的重要结构改变,并且对于生物技术是高度显著的。抗原性和免疫原性可以通过代谢上稳定的抗原如天然抗原肽和多肽的所有d-和逆反式异构体来实现。在此提供几种ptd来源的肽模拟物。多肽和片段可以具有与天然来源的多肽或结构域相同的或基本上相同的氨基酸序列。“基本上相同”意指一个氨基酸序列在很大程度上、但不完全与它所相关的序列相同,但保留它所相关的序列的一种功能活性。一种功能活性的一个实例是能够转导或能够结合至一种rna的片段。例如,在此描述具有转导活性的全长tat的片段。通常,如果两种肽、多肽或结构域的序列是至少85%、90%、95%、98%或99%相同的或如果存在序列的保守性变化,则这两种肽、多肽或结构域是“基本上相同的”。计算机程序,如blast程序(阿尔丘尔(altschul)等人,1990)可以用于比较序列一致性。本发明的多肽可以由通过肽键或修饰的肽键(即肽等排体)彼此连接的氨基酸组成,并且可以包含除20种基因编码的氨基酸以外的氨基酸。这些多肽可以通过天然过程(如翻译后加工)抑或通过本领域中熟知的化学修饰技术进行修饰。此类修饰在基础教科书和更详细的专著以及大量研究文献中进行了充分说明。修饰可以发生于多肽中的任何地方,包括主链、氨基酸侧链以及氨基或羧基末端。应当理解,同一类型的修饰可以在一种给定肽或多肽的几个位点处以相同或不同程度存在。此外,给定多肽可以包含许多类型的修饰。多肽可以例如由于泛素化而是支链的,并且它们可以是环状的,有或没有分支。环状多肽、支链多肽和支化环状多肽可以由翻译后天然过程产生,或可以通过合成方法制备。修饰包括例如乙酰化、酰化、adp-核糖基化、酰胺化、共价附接黄素、共价附接血红素部分、共价附接核苷酸或核苷酸衍生物、共价附接脂质或脂质衍生物、共价附接磷脂酰肌醇、交联、环化、二硫化物形成、脱甲基、形成共价交联、形成半胱氨酸、形成焦谷氨酸、甲酰化、γ-羧化、糖基化、gpi锚形成、羟基化、碘化、甲基化、肉豆蔻酰化、氧化、聚乙二醇化、蛋白水解加工、磷酸化、异戊烯化、外消旋化、硒化、硫酸化、转移rna介导的向蛋白质添加氨基酸(如精氨酰化)、以及泛素化。(参见,例如,蛋白质结构和分子特性(proteins--structureandmolecularproperties),第2版,t.e.克莱顿(creighton)、w.h.弗里曼(freeman)以及康帕尼(company),纽约(1993);蛋白质的翻译后共价修饰(posttranslationalcovalentmodificationofproteins),b.c.约翰逊(johnson)编辑,学术出版社(academicpress),纽约,第1-12页(1983);赛夫特(seifter)等人,酶学方法(methenzymol)182:626-646(1990);拉坦(rattan)等人,纽约科学院年报(annn.y.acadsci)663:48-62(1992))。本发明的多肽结构域或融合多肽可以通过通常使用的方法,如包括α-氨基基团的t-boc或fmoc保护的那些方法来合成。这两种方法均涉及分步合成,其中从肽或多肽的c末端开始,在每个步骤添加单个氨基酸(参见,科里根(coligan)等人,免疫学实验指南(currentprotocolsinimmunology),威利跨学科出版公司(wileyinterscience),1991,第9单元)。本发明的多肽还可以使用包含0.1-1.0mmol胺/g聚合物的共聚(苯乙烯-二乙烯基苯)通过熟知的固相肽合成方法来合成,这些方法是如由梅里菲尔德(merrifield),美国化学学会会志(j.am.chem.soc.)85:2149,1962;以及斯图尔特(stewart)和杨(young),固相肽合成(solidphasepeptidessynthesis),弗里曼,旧金山,1969,第27-62页所描述的那些方法。在化学合成完成后,可以通过在0℃下用液态hf-10%苯甲醚处理约1/4-1小时来使这些多肽脱保护且从聚合物裂解。在试剂蒸发之后,用1%乙酸溶液从该聚合物中萃取这些多肽,然后将这些多肽冷冻干燥以得到粗材料。这些多肽可以通过如凝胶过滤的这类技术在sephadexg-15上使用5%乙酸作为溶剂来进行纯化。柱洗脱液的适当级分的冷冻干燥得到均匀的肽或多肽,这些肽或多肽然后可以通过标准技术进行表征,这些技术如氨基酸分析、薄层色谱法、高效液相色谱法、紫外吸收光谱、摩尔旋光度、或测量溶解度。如果需要,这些多肽可以通过固相埃德曼(edman)降解来定量。碳水化合物可以附接至本发明的核苷酸构建体的基于碳水化合物的辅助部分包括单糖、二糖和多糖。实例包括阿洛糖、阿卓糖、阿拉伯糖、克拉定糖、赤藓糖、赤藓酮糖、果糖、d-岩藻糖醇、l-岩藻糖醇、岩藻糖胺、岩藻糖、墨角藻糖、半乳糖胺、d-半乳糖胺醇、n-乙酰基-半乳糖胺、半乳糖、葡糖胺、n-乙酰基-葡糖胺、葡糖胺醇、葡萄糖、葡萄糖-6-磷酸、古洛糖甘油醛、l-甘油-d-甘露-庚糖、甘油、甘油酮、古洛糖、艾杜糖、来苏糖、甘露糖胺、甘露糖、甘露糖-6-磷酸、阿洛酮糖、异鼠李糖、异鼠李糖胺、鼠李糖醇、鼠李糖胺、鼠李糖、核糖、核酮糖、景天庚酮糖、山梨糖、塔格糖、塔罗糖、酒石酸、苏糖、木糖、以及木酮糖。单糖可以呈d-构型或l-构型。单糖可以进一步是脱氧糖(醇羟基基团被氢置换)、氨基糖(醇羟基基团被氨基基团置换)、硫代糖(醇羟基基团被硫醇置换,或者c=o被c=s置换,或者环状形式的一个环氧被硫置换)、硒代糖、碲代糖、氮杂糖(环碳被氮置换)、亚氨基糖(环氧被氮置换)、磷代糖(环氧被磷置换)、磷杂糖(环碳被磷置换)、c-取代的单糖(一个非末端碳原子的氢被碳置换)、不饱和单糖、醛糖醇(羰基基团被choh基团置换,例如,葡糖醇)、醛糖酸(醛基团被羧基基团置换)、酮醛糖酸、糖醛酸、醛糖二酸等。氨基糖包括氨基单糖,如半乳糖胺、葡糖胺、甘露糖胺、岩藻糖胺、异鼠李糖胺、神经氨酸、胞壁酸、乳糖二胺、acosamine、杆菌胺(bacillosamine)、柔红糖胺(daunosamine)、德糖胺(desosamine)、福乐糖胺(forosamine)、加拉糖胺、卡糖胺(kanosamine)、卡糖胺、碳霉糖、海藻糖胺、perosamine、pneumosamine、绛红糖胺(purpurosamine)、紫红霉胺(rhodosmine)。应当理解,单糖等可以被进一步取代。二糖和多糖包括阿比可糖、阿卡波糖(acrabose)、amicetose、支链淀粉、直链淀粉、芹菜糖、碳霉氨糖(arcanose)、蛔糖、抗坏血酸、波伊文糖、纤维二糖、纤维三糖、纤维素、马铃薯三糖、查耳霉糖、壳多糖、可立糖、环糊精、磁麻糖、糊精、2-脱氧核糖、2-脱氧葡萄糖、2-脱氧毛地黄糖(diginose)、毛地黄糖、毛地黄毒素糖、evalose、evemitrose、果糖低聚糖(fructooligosachharide)、低聚半乳糖、龙胆三糖、龙胆二糖、葡聚糖、糖原(glucogen)、糖原(glycogen)、金缕梅糖、肝素、菊糖、异左旋葡聚酮糖(isolevoglucosenone)、异麦芽糖、异麦芽三糖、异葡糖基麦芽糖、曲二糖、乳糖、乳糖胺、乳糖二胺、昆布二糖(laminarabiose)、左旋葡聚糖、左旋葡聚酮糖、β-麦芽糖、麦芽三糖(maltriose)、甘露聚糖-低聚糖、甘露三糖、松三糖、蜜二糖、胞壁酸、碳霉糖、6-脱氧-d-阿洛糖(mycinose)、神经氨酸、黑曲霉糖、野尻霉素(nojirimycon)、诺维糖、夹竹桃糖、潘糖(panose)、泊雷糖、车前糖、樱草糖、棉子糖、rhodone、芸香糖、夹竹桃糖、潘糖、泊雷糖、车前糖、樱草糖、棉子糖、rhodinose、芸香糖、蔓茎毒毛旋花子糖(sarmentose)、景天庚酮糖、景天庚醛聚糖、茄三糖、槐糖、水苏糖、链霉糖、蔗糖、α,α-海藻糖、海藻糖胺、松二糖、泰威糖、木二糖、伞形糖等。碳水化合物可以在本发明的多核苷酸构建体中发挥一种或多种功能,例如,碳水化合物可以是靶向部分(例如,甘露糖)或可以改进多核苷酸构建体在水性介质(例如,葡萄糖醇)中的溶解度。聚合物在此描述的核苷酸构建体还可以包括共价附接的基于中性或带电荷的(例如,阳离子)聚合物的辅助部分。带正电荷的聚合物的实例包括聚(乙烯亚胺)(pei)、精胺、亚精胺、以及聚(酰胺基胺)(pamam)。中性聚合物包括聚(c1-6环氧烷),例如,聚(乙二醇)和聚(丙二醇)以及其共聚物,例如,二嵌段共聚物和三嵌段共聚物。聚合物的其他实例包括酯化的聚(丙烯酸)、酯化的聚(谷氨酸)、酯化的聚(天冬氨酸)、聚(乙烯醇)、聚(乙烯-乙烯醇共聚物)、聚(n-乙烯基吡咯烷酮)、聚(丙烯酸)、聚(乙基噁唑啉)、聚(丙烯酸烷基酯)、聚(丙烯酰胺)、聚(n-烷基丙烯酰胺)、聚(n-丙烯酰基吗啉)、聚(乳酸)、聚(乙醇酸)、聚(二氧环己酮)、聚(己内酯)、苯乙烯-马来酸酐共聚物、聚(l-丙交酯-乙交酯共聚物)共聚物、二乙烯醚-马来酸酐共聚物、n-(2-羟丙基)甲基丙烯酰胺共聚物(hmpa)、聚氨酯、聚(2-乙基丙烯酸)、n-异丙基丙烯酰胺聚合物、聚磷嗪、以及聚(n,n-二烷基丙烯酰胺)。示例性聚合物辅助部分可以具有小于100、300、500、1000、或5000的分子量。其他聚合物是本领域中已知的。治疗剂治疗剂(其包括诊断剂/显像剂)可以作为辅助部分共价附接至本发明的核苷酸构建体或可以如在此所描述作为一种共同疗法给予。这些治疗剂可以是天然存在的化合物、合成的有机化合物、或无机化合物。示例性治疗剂包括但不限于,抗生素、抗增殖剂、雷帕霉素大环内酯类、镇痛剂、麻醉剂、抗血管生成剂、血管活性剂、抗凝剂、免疫调节剂、细胞毒性剂、抗病毒剂、抗血栓形成药物、抗体、神经递质、精神药物、以及其组合。治疗剂的另外实例包括但不限于,细胞周期控剂;抑制细胞周期蛋白产生剂;细胞因子,包括但不限于白细胞介素1至13和肿瘤坏死因子;抗凝剂、抗血小板剂;tnf受体结构域等。典型地,治疗剂是中性的或带正电荷的。在某些情况下,当治疗剂带负电荷的情况下,可以使用另外的电荷中和部分(例如,阳离子肽)。一个治疗部分可以作为一个辅助部分连接至在此披露的一种核苷酸构建体以便允许诊断测定/成像。这类部分的实例包括但不限于,可检测的标记,如同位素、放射成像剂、标记物、示踪剂、荧光标记(例如,若丹明)、以及报道分子(例如,生物素)。示例性诊断剂包括但不限于,成像剂,如在正电子发射断层摄影术(pet)、计算机辅助断层摄影术(cat)、单光子发射计算机断层摄影术、x-射线、荧光镜透视检查、以及磁共振成像(mri)中使用的那些成像剂。用作mri中的造影剂的适合的材料包括但不限于,钆螯合物、以及铁、镁、锰、铜、以及铬螯合物。适用于cat和x-射线的材料的实例包括但不限于,基于碘的材料。可以是适合的发射辐射的放射成像剂的实例由铟-111、锝-99、或低剂量碘-131举例说明。用于作为辅助部分与本发明的核苷酸构建体结合使用或附接至本发明的核苷酸构建体的可检测的标记或标记物可以是放射性标记、荧光标记、核磁共振活性标记、发光标记、发色团标记、用于pet扫描仪的正电子发射同位素、化学发光标记、或酶标记。荧光标记包括但不限于,绿色荧光蛋白(gfp)、荧光素、以及若丹明。标记可以是例如一种医用同位素,例如像但不限于,锝-99、碘-123和碘-131、铊-201、镓-67、氟-18、铟-111等。本领域中已知的其他治疗剂可以同样作为辅助部分与本发明的核苷酸构建体结合使用或附接至本发明的核苷酸构建体。靶向部分本发明提供一个或多个靶向部分,该一个或多个靶向部分可以作为一个辅助部分(例如作为一个靶向辅助部分)附接至在此披露的一种核苷酸构建体。靶向部分(例如,细胞外靶向部分)是基于其将本发明的构建体靶向至表达选定靶向部分的相应结合配偶体(例如,相应受体抑或配体)的所希望或选定的细胞群体的能力进行选择的。例如,本发明的一种构建体可以通过作为靶向部分的选定表皮生长因子(egf)靶向表达表皮生长因子受体(egfr)的细胞。可替代地,靶向部分(例如,细胞内靶向部分)可以将本发明的构建体靶向细胞内的所希望的位点(例如,内质网、高尔基体、细胞核、或线粒体)。细胞内靶向部分的非限制性实例包括表3的化合物p38和p39以及其肽片段(分别mkwvtfisllflffssays(seqidno:56)和mirtlllstlvagals(seqidno:57))。本发明的一种多核苷酸构建体因此可以包含选自下组的一个或多个靶向部分,该组由以下各项组成:细胞内靶向部分、细胞外靶向部分、以及其组合。因此,在本发明的多核苷酸构建体中包含一个或多个细胞外靶向部分(例如,每个细胞外靶向部分独立地选自下组,该组由以下各项组成:叶酸、甘露糖、半乳糖胺(例如,n-乙酰基半乳糖胺)、以及前列腺特异性膜抗原)和一个或多个细胞内靶向部分(例如,靶向内质网、高尔基体、细胞核、或线粒体的一个部分)可以促进这些多核苷酸递送至特定细胞群体内的一个特定位点。在一些实施例中,靶向部分包含一个或多个甘露糖碳水化合物。甘露糖靶向甘露糖受体,其是在正弦肝细胞和抗原呈递细胞(例如,巨噬细胞和树突细胞)上表达的175kda膜相关受体。它是高效的内吞/再循环受体,其结合并内化甘露糖化病原体和蛋白质(伦纳茨(lennartz)等人,生物化学杂志(j.biol.chem.)262:9942-9944,1987;泰勒(taylor)等人,生物化学杂志265:12156-62,1990)。在此描述了本发明的一些细胞外靶向部分。在一个实施例中,靶向部分是一个受体结合结构域。在另一个实施例中,靶向部分是或特异性地结合选自下组的一种蛋白质,该组包括胰岛素、胰岛素样生长因子受体1(igf1r)、igf2r、胰岛素样生长因子(igf;例如,igf1或2)、间质上皮转化因子受体(c-met;还称为肝细胞生长因子受体(hgfr))、肝细胞生长因子(hgf)、表皮生长因子受体(egfr)、表皮生长因子(egf)、调蛋白(heregulin)、成纤维细胞生长因子受体(fgfr)、血小板源性生长因子受体(pdgfr)、血小板源性生长因子(pdgf)、血管内皮生长因子受体(vegfr)、血管内皮生长因子(vegf)、肿瘤坏死因子受体(tnfr)、肿瘤坏死因子α(tnf-α)、tnf-β、叶酸受体(folr)、叶酸、转铁蛋白、转铁蛋白受体(tfr)、间皮素、fc受体、c-kit受体、c-kit、一种整联蛋白(例如,一种α4整联蛋白或一种β-1整联蛋白)、p-选择素、鞘氨醇-1-磷酸酯受体-1(s1pr)、透明质酸受体、白细胞功能抗原-1(lfa-1)、cd4、cd11、cd18、cd20、cd25、cd27、cd52、cd70、cd80、cd85、cd95(fas受体)、cd106(血管细胞粘附分子1(vcam1))、cd166(活化的白细胞粘附分子(alcam))、cd178(fas配体)、cd253(tnf相关凋亡诱导配体(trail))、icos配体、ccr2、cxcr3、ccr5、cxcl12(基质细胞源性因子-1(sdf-1))、白细胞介素-1(il-1)、il-1ra、il-2、il-3、il-4、il-6、il-7、il-8、ctla-4、mart-1、gp100、mage-1、肝配蛋白(eph)受体、粘膜地址素细胞粘附分子1(madcam-1)、癌胚抗原(cea)、lewisy、muc-1、上皮细胞粘附分子(epcam)、癌抗原125(ca125)、前列腺特异性膜抗原(psma)、tag-72抗原、以及其片段。在另外的实施例中,靶向部分是成红细胞白血病病毒致癌基因同源物(erbb)受体(例如,erbb1受体;erbb2受体;erbb3受体;以及erbb4受体)。在其他实施例中,一个靶向部分可以选择性地结合至脱唾液酸糖蛋白受体、一种甘露受体、或一种叶酸受体。在具体实施例中,该靶向部分包含一个或多个n-乙酰基半乳糖胺(galnac)、甘露糖、或叶酸配体。在某些实施例中,该叶酸配体具有以下结构:该靶向部分也可以选自铃蟾肽、胃泌素、胃泌素释放肽、肿瘤生长因子(tgf)(如tgf-α和tgf-β)、以及牛痘病毒生长因子(vvgf)。非肽基配体也可以用作靶向部分并且可以包括例如类固醇、碳水化合物、维生素、以及凝集素。该靶向部分还可以选自多肽,如生长抑素(例如,具有核心序列环[cys-phe-d-trp-lys-thr-cys](seqidno:103)的生长抑素,并且其中,例如,该生长抑素类似物的c末端是:thr-nh2)、生长抑素类似物(例如,奥曲肽和兰瑞肽)、铃蟾肽、铃蟾肽类似物、或抗体(如单克隆抗体)。用作本发明的核苷酸构建体中的靶向辅助部分的其他肽或多肽可以选自kiss肽和类似物、尾加压素(urotensin)ii肽和类似物、gnrhi和ii肽和类似物、地普奥肽、伐普肽、血管活性肠肽(vip)、缩胆囊素(cck)、含rgd肽、促黑素细胞激素(msh)肽、神经降压素、降钙素、来自一种抗肿瘤抗体的互补决定区的肽、谷胱甘肽、yigsr(seqidno:104)(白细胞亲合肽,例如,p483h,其包含血小板因子-4(pf-4)的肝素结合区和富含赖氨酸的序列)、心房钠尿肽(anp)、β-淀粉样肽、δ-阿片类拮抗剂(如itipp(psi))、膜联蛋白-v、内皮素、白三烯b4(ltb4)、趋化肽(例如,n-甲酰基-甲硫氨酰基-亮氨酰基-苯丙氨酸-赖氨酸(fmlfk;seqidno:105)、gpiib/iiia受体拮抗剂(例如,dmp444)、人嗜中性粒细胞弹性蛋白酶抑制剂(epi-hne-2和epi-hne-4)、纤溶酶抑制剂、抗微生物肽、apticide(p280和p274)、血小板反应蛋白受体(包括类似物如tp-1300)、bitistatin、垂体腺苷酸环化酶i型受体(pac1)、纤维蛋白α-链、源自噬菌体展示文库的肽(例如,seqidno:13和14)、以及其保守取代。用作本发明的核苷酸构建体中的一个靶向部分的免疫反应性配体包括一种识别抗原的免疫球蛋白(还被称为“抗体”)或其抗原识别片段。如在此所用,“免疫球蛋白”是指任何公认类别或亚类的免疫球蛋白,如igg、iga、igm、igd、或ige。典型的是属于免疫球蛋白的igg类的那些免疫球蛋白。免疫球蛋白可以源自任何物种。然而,典型地,免疫球蛋白具有人、鼠或兔来源。此外,免疫球蛋白可以是多克隆的或单克隆的,但典型地是单克隆的。本发明的靶向部分可以包括一个抗原识别免疫球蛋白片段。这类免疫球蛋白片段可以包括,例如,fab’、f(ab’)2、fv、或fab片段、单结构域抗体、scfv、或其他抗原识别免疫球蛋白片段。fc片段也可以用作靶向部分。这类免疫球蛋白片段可以例如通过蛋白水解酶消化(例如,通过胃蛋白酶或木瓜蛋白酶消化)、还原烷基化、或重组技术来制备。用于制备这类免疫球蛋白片段的材料和方法是本领域的技术人员熟知的。参见,帕勒姆(parham),免疫学杂志(j.immunology),131,2895,1983;拉莫伊(lamoyi)等人,免疫学方法杂志(j.immunologicalmethods),56,235,1983。本发明的靶向部分包括本领域中已知、但未提供为本披露中的一个具体事例的那些靶向部分。内体逃逸本发明提供一个或多个内体逃逸部分,其可以附接于本文公开的核苷酸构建体作为辅助部分,例如作为内体逃避辅助部分。示例性内体逃逸部分包括化学治疗剂(例如,喹诺酮类,如氯喹);融合脂质(例如,二油酰磷脂酰基-乙醇胺(dope));以及聚合物,如聚乙烯亚胺(pei);聚(β-氨基酯);肽或多肽,如聚精氨酸(例如,八聚精氨酸)和聚赖氨酸(例如,八聚赖氨酸);质子海绵、病毒衣壳、以及如在此所描述的肽转导结构域。例如,融合肽可以源自甲型流感病毒的m2蛋白;流感病毒血凝素的肽类似物;丙型流感病毒的hef蛋白;线状病毒的跨膜糖蛋白;狂犬病毒的跨膜糖蛋白;水泡性口炎病毒的跨膜糖蛋白(g);仙台病毒的融合蛋白;塞姆利基森林病毒的跨膜糖蛋白;人呼吸道合胞病毒(rsv)的融合蛋白;麻疹病毒的融合蛋白;新城疫病毒的融合蛋白;绵羊髓鞘脱落病毒的融合蛋白;鼠白血病病毒的融合蛋白;htl病毒的融合蛋白;以及猿免疫缺陷病毒(siv)的融合蛋白。可以用于促进内体逃逸的其他部分在多米尼斯卡(dominska)等人,细胞科学杂志(journalofcellscience),123(8):1183-1189,2010中进行了描述。示例性内体逃逸部分提供于实例1的表3中。递送结构域本发明提供一个或多个递送结构域部分,其可以附接至本文公开的核苷酸构建体作为辅助部分,例如作为递送结构域辅助部分。递送结构域是通过任何机制诱导本发明的多核苷酸转运至细胞中的部分。典型地,本发明的核苷酸构建体将通过巨胞饮作用(macropinocytosis)、吞噬作用、或内吞作用(例如,网格蛋白介导的内吞作用、小窝介导的内吞作用、以及脂筏依赖性内吞作用)进行内化,参见例如,化学会评论(chem.soc.rev.),2011,40,233-245。递送结构域可以包含肽或多肽(例如,肽转导结构域)、碳水化合物(透明质酸)、以及带正电荷的聚合物(聚(乙烯亚胺)),如在此所描述的。肽转导结构域细胞递送可以通过“货物”生物剂(在这种情况下,多核苷酸)与阳离子肽转导结构结构域(ptd;也称为细胞穿透肽(cpp))如tat(seqidno:1)或arg8(seqidno:2)的大分子融合来完成(斯奈德(snyder)和道迪(dowdy),2005,药物递送专家评论(expertopin.drugdeliv.)2,43-51)。ptd可以用于递送各种各样的大分子货物,包括在此所描述的多核苷酸(施瓦茨(schwarze)等人,1999,科学(science)285,1569-1572;江口(eguchi)等人,2001,生物化学杂志(j.biol.chem.)276,26204-26210;以及koppelhus等人,2002,反义核酸药物开发(antisensenucleicaciddrugdev.)12,51-63)。阳离子ptd通过巨胞饮作用进入细胞,该巨胞饮作用是所有细胞执行的流体相摄取的一种特殊形式。关于模型囊泡的生物物理研究表明,货物从巨胞饮体(macropinosome)囊泡逃逸到细胞质中,因此需要ph降低(马吉祖布(magzoub)等人,2005,生物化学(biochemistry)44,14890-14897)。ptd的阳离子电荷是分子穿过细胞膜所必需的。不出人意料地,阳离子ptd(6-8个正电荷)与阴离子sirna(约40个负电荷)的共轭产生电荷中和以及在无sirna进入细胞的情况下ptd的失活(特纳(turner)等人,血细胞、分子和疾病(bloodcellsmol.dis.),38(1):1-7,2007)。然而,阳离子ptd与在此描述的核苷酸构建体(例如,阴离子rna或dna)的化学共轭仍然产生能够被细胞摄取的核苷酸构建体,并且因此在此披露的新颖的且非显而易见的核苷酸构建体不遭受在其他类似方法情况下观察到的任何电荷中和有害制品。另外,这些ptd的细胞内裂解允许多核苷酸被不可逆地递送至靶细胞。能够有效地穿过真核细胞的质膜的几种蛋白质的发现带来了一类蛋白质的鉴别,从该类蛋白质已获得了肽转导结构域。这些蛋白质的最佳特征是果蝇同源异型触角足转录蛋白(anthd)(约里奥(joliot)等人,新生物学(newbiol.)3:1121-34,1991;约里奥等人,美国科学院院刊,88:1864-8,1991;勒鲁(leroux)等人,美国科学院院刊,90:9120-4,1993)、单纯疱疹病毒结构蛋白vp22(艾略特(elliott)和奥黑尔(o’hare),细胞(cell)88:223-33,1997)、hiv-1转录活化因子tat蛋白(格林(green)和洛文斯顿(loewenstein),细胞55:1179-1188,1988;弗兰克尔(frankel)和帕博(pabo),细胞55:1189-1193,1988)、以及最近朊病毒蛋白的阳离子n末端结构域。在表1中提供示例性ptd序列。本发明进一步提供作为辅助部分待共轭至在此披露的核苷酸构建体的表1中列出的一种或多种ptd或本领域中已知的其他ptd(参见例如,约里奥等人,自然细胞生物学(naturecellbiology),6(3):189-196,2004)。用于共轭的策略包括使用双功能连接子,该连接子包含能够通过细胞内酶的作用裂解的官能团。表1在表2中提供包括可以共轭至在此描述的任何核苷酸构建体的tat肽的示例性辅助部分。表2序列(n’至c’)peg-(ptd)gg-(ptd)-peg-(ptd)peg-(ptd)-peg-(ptd)gg-(ptd)-peg-peg-peg-(ptd)peg-(ptd)-peg-peg-peg-(ptd)gg-(ptd)-peg-(ptd)-peg-(ptd)gg-(ptd)-peg-peg-peg-(ptd)-peg-peg-peg-(ptd)peg=具有六个重复单元的一个聚(乙二醇)连接子在一个具体实施例中,在表2中描述的辅助部分包括与在n’末端的z’的一个共价键,其中z’是6-肼基烟酸(hynic)或多肽rz的一个氨基基团与一种醛的共轭的残基。在表3中提供另外的示例性阳离子ptd(cpp)序列。因此,可以共轭至本发明的一种核苷酸构建体的ptd包括但不限于,anthd、tat、vp22、阳离子朊病毒蛋白质结构域、以及其功能片段。不仅这些肽能够穿过质膜,而且附接其他肽或多肽(如酶β半乳糖苷酶)足以刺激这些复合物的细胞摄取。这类嵌合蛋白以一种生物活性形式存在于细胞质和细胞核内。该过程的表征显示,这些融合多肽的摄取是快速的,通常在几分钟之内以一种受体独立的方式发生。此外,这些蛋白质的转导似乎不受细胞类型影响,并且这些蛋白质能够有效地转导培养物中的约100%的细胞而无明显毒性(长原(nagahara)等人,自然医学(nat.med.)4:1449-52,1998)。除了全长蛋白质外,肽转导结构域也已成功地用于诱导dna(阿布-阿梅尔,同上)、反义多核苷酸(阿斯特里亚(astriab)-费舍尔(fisher)等人,药物研究(pharm.res),19:744-54,2002)、小分子(波利亚科夫(polyakov)等人,生物共轭化学(bioconjug.chem.)11:762-71,2000)、以及甚至无机40nm铁颗粒(多德(dodd)等人,免疫学方法杂志(j.immunol.methods)256:89-105,2001;温德巴尔丁格(wunderbaldinger)等人,生物共轭化学13:264-8,2002;卢因(lewin)等人,自然生物技术(nat.biotechnol.)18:410-4,2000;约瑟夫逊(josephson)等人,生物共轭化学10:186-91,1999)的细胞内摄取,从而表明在此过程中存在颗粒大小的相当大的灵活性。在一个具体实施例中,本发明因此提供组合使用ptd(如tat和聚-arg)与在此披露的一种核苷酸构建体以便促进该构建体靶向摄取到靶细胞中和/或在靶细胞内释放的方法和组合物。在此披露的核苷酸构建体因此提供方法,其中可以通过这些核苷酸构建体靶向作为辅助部分连接的治疗剂或诊断剂以便递送在某些细胞中,这些核苷酸构建体进一步包括作为辅助部分连接的一个或多个ptd。本发明的核苷酸构建体可以是本身提供一种治疗或诊断益处的sirna或其他抑制性核酸序列。然而,在一些情况下,可能希望附接另外的辅助部分作为治疗剂或以便促进摄取。在ptd的情况下,这些ptd充当另外的电荷修饰部分以便通过中和核苷酸构建体上的电荷或典型地向核苷酸构建体提供一个轻微净阳离子电荷来促进该核苷酸构建体的摄取。应当进一步理解,该核苷酸构建体可以包含其他辅助部分,如但不限于,靶向部分、生物活性分子、治疗剂、小分子(例如,细胞毒素)等。在这类情况下,具有这类辅助部分的核苷酸构建体可以取决于这些辅助部分的大小和电荷而是带中性电荷的或带阳离子电荷的。在这些辅助部分带阴离子电荷的情况下,添加带阳离子电荷的肽(例如,ptd)可以进一步中和该构建体的电荷或提高该构建体的净阳离子电荷。一般来说,连接至在此披露的一种核苷酸构建体的递送结构域可以是几乎任何合成的或天然存在的氨基酸序列,该氨基酸序列有助于在此披露的一种核酸构建体细胞内递送至靶细胞中。例如,转染可以根据本发明通过使用共价连接至本发明的一种核苷酸构建体的一个共轭部分的一个肽转导结构域(如一种hivtat蛋白或其片段)来实现。可替代地,该肽转导结构域可以包括触角足同源结构域或hsvvp22序列、朊病毒蛋白的n末端片段或其适合的转导片段,如本领域中已知的那些片段。ptd的类型和大小将由几个参数(包括所希望的转染程度)指导。典型地,ptd将能够转染至少约20%、25%、50%、75%、80%或90%、95%、98%且达并包括约100%的细胞。转染效率(典型地表示为转染的细胞的百分比)可以通过几种常规方法来测定。ptd将显示有利于至少皮摩尔量的在此披露的核苷酸构建体进入靶细胞的细胞进入和离开率(有时分别被称为k1和k2)。ptd和任何货物的进入和离开率可以使用可检测标记的融合分子通过标准动力学分析容易地测定或至少粗略估计。典型地,进入率与离开率的比率将在约5至约100直至约1000之间的范围内。在一个实施例中,适用于本发明的方法和组合物的ptd包括以实质性α-螺旋度为特征的多肽。据发现,当该ptd表现出显著α-螺旋度时,转染得以优化。在另一个实施例中,该ptd包括包含碱性氨基酸残基的序列,这些碱性氨基酸残基是沿肽或多肽的至少一个面基本上对准的。适用于本发明的一种ptd结构域可以是一种天然存在的肽或多肽或一种合成的肽或多肽。在另一个实施例中,该ptd包括氨基酸序列,该氨基酸序列包括强α-螺旋结构,沿螺旋圆柱体向下具有精氨酸(arg)残基。在又另一个实施例中,该ptd结构域包括多肽,该多肽由以下通式表示:bp1-xp1-xp2-xp3-bp2-xp4-xp5-bp3,其中bp1、bp2、以及bp3各自独立地是相同或不同的碱性氨基酸;并且xp1、xp2、xp3、xp4、以及xp5各自独立地是相同或不同的增强α-螺旋的氨基酸。在另一个实施例中,该ptd结构域由以下通式表示:bp1-xp1-xp2-bp2-bp3-xp3-xp4-bp4,其中bp1、bp2、bp3、以及bp4各自独立地是相同或不同的碱性氨基酸;并且xp1、xp2、xp3、以及xp4各自独立地是相同或不同的增强α-螺旋的氨基酸。此外,ptd结构域包括碱性残基,例如,赖氨酸(lys)或精氨酸(arg);并且可以进一步包含足以将“扭结”引入该结构域中的至少一个脯氨酸(pro)残基。这类结构域的实例包括朊病毒的转导结构域。例如,这种多肽包括kkrpkpg(seqidno:15)。在一个实施例中,该结构域是由以下序列表示的多肽:xp-xp-r-xp-(p/xp)-(bp/xp)-bp-(p/xp)-xp-bp-(bp/xp),其中x是任何促进α-螺旋的残基如丙氨酸;p/xp是脯氨酸抑或如先前所定义的xp;bp是碱性氨基酸残基,例如,精氨酸(arg)或赖氨酸(lys);r是精氨酸(arg)并且bp/xp是如上文所定义的bp抑或xp。在另一个实施例中,该ptd是阳离子的且由7与10个之间的氨基酸组成,并且具有化学式kxp1rxp2xp1,其中xp1是r或k并且xp2是任何氨基酸。这种多肽的实例包含rkkrrqrrr(seqidno:1)。在另一个实例中,该ptd是在5-15个氨基酸内具有5-10个精氨酸(和/或赖氨酸)残基的一个阳离子肽序列。根据本披露的另外递送结构域包含tat片段,该tat片段包含tat的至少氨基酸49至56(seqidno:1)达约全长tat序列(参见,例如,seqidno:16)。一个tat片段可以包含足以增加该片段的α-螺旋度的一个或多个氨基酸改变。在一些情况下,所引入的这些氨基酸变化将涉及添加一种公认的增强α-螺旋的氨基酸。可替代地,这些氨基酸改变将涉及从该tat片段中除去妨碍α螺旋形成或稳定性的一个或多个氨基酸。在一个更具体的实施例中,该tat片段将包含用一种增强α-螺旋的氨基酸进行的至少一个氨基酸取代。典型地,该tat片段将通过标准肽合成技术来制备,但是也可以在一些情况下使用重组dna方法。在一个实施例中,该取代被选择为使得tat片段中的至少两个碱性氨基酸残基是沿该tat片段的至少一个面基本上对准的。在一个更具体的实施例中,该取代被选择为使得tat49-56序列(seqidno:1)中的至少两个碱性氨基酸残基是沿该序列的至少一个面基本上对准的。可以在本发明的组合物和方法中使用的另外转导蛋白质(ptd)包括tat片段,其中tat49-56序列已被修饰为使得该序列中的至少两个碱性氨基酸是沿该tat片段的至少一个面基本上对准的。说明性tat片段包括在tat的至少氨基酸49-56中的至少一个指定氨基酸取代,所述取代使该49-56序列的碱性氨基酸残基沿该区段且典型地该tat49-56序列的至少一个面对准。还包括嵌合ptd结构域。这类嵌合ptd包含至少两种不同的转导蛋白质的部分。例如,嵌合ptd可以通过融合两个不同的tat片段来形成,这些tat片段例如一个来自hiv-1(seqidno:16)且另一个来自hiv-2(seqidno:17)或一个来自一种朊病毒蛋白质(seqidno:18)且一个来自hiv。一个ptd可以作为一个辅助部分使用氨基磷酸酯或磷酸三酯连接子在一个核苷酸间桥联基团或在3’或5’端处连接至本发明的一种核苷酸构建体。例如,包含3’-氨基基团与3-碳连接子的sirna构建体可以用于将该sirna构建连接至ptd。该sirna构建体可以经由一种异双功能交联剂共轭至该ptd。该ptd可以作为辅助部分经由生物可逆性基团附接至核苷酸构建体,其中该生物可逆性基团可以细胞内裂解(例如通过细胞内酶(例如,蛋白质二硫化物异构酶、硫氧还蛋白、或硫酯酶))且由此释放多核苷酸。例如,除了共轭在5’端与3’端之间的ptd之外,ptd可以经由游离硫醇基团在5’端和/或3’端处直接共轭至包含在此披露的核苷酸构建体的多核苷酸(例如,rna或dna)。例如,ptd可以通过二硫键联连接至该多核苷酸。这种方法可以适用于任何多核苷酸长度,并且将允许将多核苷酸(例如,sirna)递送至细胞中。该多核苷酸还可以包含,例如,一个或多个递送结构域和/或包含一个碱性基团的一个保护基团。一旦在细胞内部,多核苷酸基于细胞内条件(例如,还原环境)通过水解或其他酶活性(例如,蛋白质二硫化物异构酶、硫氧还蛋白、或硫酯酶活性)回复至未保护的多核苷酸。表3在表3中:(1)hynic=肼-烟酰胺,k’=boc-lys(fmoc)-oh;bip:双-苯丙氨酸;(2)化合物p01、p02、p03、p04、p05、p06、p07、p08、p09、p10、p11、p12、p13、p14、p15、p16、p19、p20、p21、p22、p23、p24、p25、以及p26包括细胞穿透肽;化合物p16、p17、p18、p27、p28、p29、p31、p32、p33、p34、p35、以及p36包括内体溶解肽;化合物p37、p38、以及p39包括靶向内质网的肽;化合物p40和p41包括白蛋白结合部分,并且化合物p42包括kdel受体靶向部分。其他化合物如表中所示。可用于本发明的构建体和方法中的肽连接子通常包括高达约20或30个氨基酸,通常高达约10或15个氨基酸,并且仍更经常为从约1至5个氨基酸。连接子序列通常是柔性的,以便不会使融合分子保持呈一种单一刚性构象。例如,连接子序列可用于将ptd结构域与核酸隔开。例如,肽连接子序列可以位于肽转导结构域和核酸结构域之间,例如以提供分子柔性。选择连接子部分的长度以优化肽或多肽的生物活性,包括例如ptd结构域融合构建体,并且可以凭经验确定而无需过度实验。连接子部分的实例是-gly-gly-、ggggs(seqidno:106)、(ggggs)n、gkssgsgsesks(seqidno:107)、gstsgsgkssegkg(seqidno:108)、gstsgsgkssegsgstkg(seqidno:109)、gstsgsgkpgsgegstkg(seqidno:110)、或egkssgsgseskef(seqidno:111)。肽或多肽连接部分例如在休斯顿(huston)等人,美国国家科学院院刊85:5879,1988;惠特洛(whitlow)等人,蛋白质工程(proteinengineering)6:989,1993;以及牛顿(newton)等人,生物化学(biochemistry)35:545,1996中进行了描述。其他适合的肽或多肽连接子是描述于美国专利号4,751,180和4,935,233中的那些,这些专利特此通过引用而结合。药物组合物本发明的一种核苷酸构建体的递送可以通过使用本领域的技术人员已知的各种方法使一种细胞与该构建体相接触来实现。在具体实施例中,本发明的一种核苷酸构建体与各种载体、分散剂等一起配制,如在此其他地方更详细地描述。根据本发明的药物组合物可以被制备为包含在此披露的核苷酸构建体,使用载体、赋形剂和添加剂或助剂制备成适合于向受试者给予的形式。经常使用的载体或助剂包括碳酸镁、二氧化钛、乳糖、甘露醇和其他糖、滑石、乳蛋白、明胶、淀粉、维生素、纤维素及其衍生物、动物和植物油、聚乙二醇和溶剂,如无菌水、醇、甘油、以及多元醇。静脉内媒介物包括流体和营养补充剂。防腐剂包括抗微生物剂、抗氧化剂、螯合剂、以及惰性气体。其他药学上可接受的载体包括水溶液、无毒赋形剂,包括盐、防腐剂、缓冲剂等,如描述于例如雷明登氏:药物科学与实践(remington:thescienceandpracticeofpharmacy),第21版,真纳罗(gennaro)编辑,利平科特.威廉斯.威尔金斯出版公司(lippencottwilliams&wilkins)(2005)和2013年出版的美国药典:国家处方集(theunitedstatespharmacopeia:thenationalformulary)(usp36nf31)中。药物组合物的各种组分的ph和精确浓度是根据本领域中的常规技能来调节的。参见古德曼(goodman)和吉尔曼(gilman),治疗剂的药理学基础(thepharmacologicalbasisfortherapeutics)。根据本发明的药物组合物可以局部或全身给予。治疗有效量将根据以下因素而变化:如受试者中的感染程度、个体的年龄、性别和体重。可以对给药方案进行调节以便提供最佳治疗反应。例如,可以每日给予若干分开剂量或可以如治疗情况的紧急程度所指示按比例减少剂量。该药物组合物可以按方便的方式给予,该方式如通过注射(例如,皮下、静脉内、眶内等)、口服给予、眼部施用、吸入、经皮施用、局部施用、或直肠给予。取决于给予途经,药物组合物可以用材料包覆以便保护该药物组合物免受酶、酸和其他可以使该药物组合物灭活的天然条件的作用。该药物组合物还可以胃肠外或腹膜内给予。分散体也可以在甘油、液态聚乙二醇及其混合物、以及油中制备。在普通储存和使用条件下,这些制剂可以包含防腐剂以便防止微生物生长。适合于可注射使用的药物组合物包括无菌水溶液(在水溶性的情况下)或分散体、以及用于临时制备无菌可注射溶液或分散液的无菌粉末。该组合物典型地将是无菌和流体至存在易注射性的程度。典型地,该组合物将是在制造和储存的条件下稳定的,并且抵抗微生物如细菌和真菌的污染作用进行保存。该载体可以是包含以下各项的一种溶剂或分散介质:例如,水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)、其适合的混合物、以及植物油。可以例如通过使用一种包衣(如卵磷脂)、通过在分散情况下维持所需颗粒大小以及通过使用表面活性剂来维持适当的流动性。防止微生物的作用可以通过各种抗细菌剂和抗真菌剂,例如对羟苯甲酸酯、三氯叔丁醇、苯酚、抗坏血酸、硫柳汞等来实现。在许多情况下,在组合物中使用等渗剂,例如糖、多元醇(如甘露醇、山梨醇)或氯化钠。可以通过在组合物中包含延迟吸收的一种药剂(例如单硬脂酸铝和明胶)而使可注射组合物的吸收延长。根据需要,可以通过将所需量的药物组合物与以上列举的成分中的一种或其组合一起并入一种适当溶剂中,随后过滤灭菌来制备无菌可注射溶液。通常,分散液是通过将药物组合物并入一种无菌媒介物中来制备,该无菌媒介物包含一种基础分散介质以及来自以上列举的那些成分的所需其他成分。该药物组合物可以例如,与惰性稀释剂或可吸收可食用载体一起口服给予。该药物组合物和其他成分还可以封闭在一种硬壳或软壳明胶胶囊中,压缩成片剂,或直接并入受试者的饮食中。对于口服治疗性给药,可以将药物组合物与赋形剂结合并且以可摄入片剂、口含片剂、锭剂、胶囊、酏剂、混悬剂、糖浆剂、糯米纸囊剂等形式使用。此类组合物和制剂应包含按重量计至少1%的活性化合物。当然,这些组合物和制剂的百分比可以改变并且可以合宜地在单位重量的约5%至约80%之间。片剂、锭剂、丸剂、胶囊等还可以包含以下各项:粘合剂,如黄蓍树胶、阿拉伯胶、玉米淀粉或明胶;赋形剂,如磷酸二钙;崩解剂,如玉米淀粉、马铃薯淀粉、海藻酸等;润滑剂,如硬脂酸镁;以及甜味剂,如蔗糖、乳糖或糖精;或调味剂,如胡椒薄荷、冬青油或樱桃香精。当单位剂型是胶囊时,除上述类型的材料之外,它可以包含液体载体。各种其他材料可以作为包衣存在或以其他方式修饰剂量单位的物理形式。例如,可以用紫胶、糖或两者包覆片剂、丸剂或胶囊。糖浆剂或酏剂可以包含药剂、作为甜味剂的蔗糖、作为防腐剂的对羟苯甲酸甲酯和对羟苯甲酸丙酯、染料、以及调味剂(如樱桃或橙香料)。当然,在制备任何单位剂型中使用的任何材料应当是药用纯的并且在所用量的情况下基本上无毒。此外,可以将药物组合物并入持续释放制剂和配制品中。因此,一种药学上可接受的载体旨在包括溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂、以及吸收延迟剂等。用于药物活性物质的此类介质和药剂的使用是本领域中熟知的。除非任何常规介质或药剂与药物组合物不相容,否则涵盖其用于治疗性组合物和治疗方法中。补充活性化合物也可以并入这些组合物中。特别有利的是以剂量单位形式配制胃肠外组合物以便于给予和剂量统一。如在此使用的单位剂型是指作为针对待治疗受试者的单一剂量适合的物理上离散的单位;每个单位包含经计算产生与所需药用载体相关的所希望的治疗效果的药物组合物的预定量。本发明的单位剂型的规格与药物组合物的特征和待实现的特定治疗作用相关。将主要药物组合物以有效量与适合的药学上可接受的载体以可接受的剂量单位混合以用于方便且有效的给予。在包含补充活性成分的组合物的情况下,剂量是通过参考这些成分的常用剂量和给予方式来确定的。对于局部配制品,可以用任何溶剂系统,如由美国食品与药品管理局(fda)通常视为安全(gras)的那些溶剂系统来制备基础组合物。gras溶剂系统包括作为递送媒介物的许多短链烃,如丁烷、丙烷、正丁烷、或其一种混合物,这些短链烃由fda批准用于局部使用。局部组合物可以使用任何皮肤病学上可接受的载体进行配制。示例性载体包括固体载体,如氧化铝、粘土、微晶纤维素、二氧化硅或滑石;和/或液体载体,如醇、二醇、或水-醇/二醇掺混物。这些化合物还可以以允许化合物进入皮肤的脂质体配制品给予。此类脂质体配制品在美国专利号5,169,637;5,000,958;5,049,388;4,975,282;5,194,266;5,023,087;5,688,525;5,874,104;5,409,704;5,552,155;5,356,633;5,032,582;4,994,213;以及pct公开号wo96/40061中进行了描述。其他适当的媒介物的实例在美国专利号4,877,805、u.s.4,980,378、u.s.5,082,866、u.s.6,118,020、以及ep公布号0586106a1中进行了描述。本发明的适合的媒介物还可以包括矿物油、凡士林、聚癸烯、硬脂酸、肉豆蔻酸异丙酯、硬脂酸酯聚烃氧40酯、硬脂醇、或植物油。局部组合物可以任何有用的形式来提供。例如,本发明的组合物可以被配制为溶液、乳剂(包括微乳剂)、混悬液、乳膏、泡沫、洗剂、凝胶、粉末、香膏、或用于施用至可以使用这些组合物的皮肤或其他组织的其他典型的固体、半固体或液体组合物。此类组合物可以包含典型地用于此类产品中的其他成分,如着色剂、芳香剂、增稠剂、抗微生物剂、溶剂、表面活性剂、洗涤剂、胶凝剂、抗氧化剂、填充剂、染料、粘度控制剂、防腐剂、湿润剂、软化剂(例如,天然或合成油、烃油、蜡、或硅酮)、水化剂、螯合剂、缓和剂、增溶赋形剂、佐剂、分散剂、皮肤渗透增强剂、增塑剂、防腐剂、稳定剂、破乳剂、润湿剂、防晒剂、乳化剂、保湿剂、收敛剂、除臭剂,且任选地包括麻醉剂、止痒活性物质、植物提取物、调理剂、增亮剂或增深剂、闪光剂、湿润剂、云母、矿物质、多酚、硅酮或其衍生物、防晒霜、维生素、以及植物药。在一些配制品中,组合物被配制用于眼部施用。例如,用于眼部施用的药用配制品可以包含与生理学上可接受的眼用载体介质如水、缓冲液、盐水、甘氨酸、透明质酸、甘露醇等混合的例如按重量计达99%的量的如在此所描述的多核苷酸构建体。对于眼部递送,如在此所描述的一种多核苷酸构建体可以与眼科学上可接受的防腐剂、共溶剂、表面活性剂、粘度增强剂、渗透增强剂、缓冲剂、氯化钠或水组合以便形成一种水性、无菌眼用混悬液或溶液。可以通过将该多核苷酸构建体溶解在一种生理学上可接受的等渗的水性缓冲液中来制备眼用溶液配制品。此外,该眼用溶液可以包含一种眼科学上可接受的表面活性剂以便有助于溶解该抑制剂。可以将增粘剂如羟甲基纤维素、羟乙基纤维素、甲基纤维素、聚乙烯吡咯烷酮等添加至本发明的组合物以便改进化合物的保留。根据有经验的临床医生的常规酌情决定,将局部组合物例如,每天一至四次或按延长的递送时间表(如每日、每周、每两周、每月或更长)递送至眼睛表面。该配制品的ph可以在从约ph4-9或约ph4.5至ph7.4的范围内。对于本发明的核苷酸构建体,适合的药学上可接受的盐包括(i)与阳离子如钠、钾、铵、镁、钙、聚胺(如精胺和亚精胺)等形成的盐;(ii)与无机酸,例如盐酸、氢溴酸、硫酸、磷酸、硝酸等形成的酸加成盐;(iii)与有机酸,例如像乙酸、草酸、酒石酸、琥珀酸、马来酸、富马酸、葡糖酸、柠檬酸、苹果酸、抗坏血酸、苯甲酸、鞣酸、棕榈酸、海藻酸、聚谷氨酸、萘磺酸、甲磺酸、对甲苯磺酸、萘二磺酸、聚半乳糖醛酸等形成的盐;以及(iv)由元素阴离子如氯、溴和碘形成的盐。虽然在此描述的这些核苷酸构建体可能不需要使用载体用于递送至靶细胞,但载体的使用可以是在一些实施例中有利的。因此,为了递送至靶细胞,本发明的核苷酸构建体可以非共价地结合载体以便形成复合物。该载体可以用于在递送之后改变生物分布以便增强吸收、提高多核苷酸的半衰期或稳定性(例如,提高核酸酶抗性)和/或增加靶向至特定细胞或组织类型。示例性载体包括缩合剂(例如,能够通过离子或静电相互作用吸引或结合核酸的试剂);融合剂(例如,能够融合和/或转运通过细胞膜的试剂);用于靶向特定细胞或组织类型的蛋白质(例如,促甲状腺素、促黑激素、凝集素、糖蛋白、表面活性蛋白a、或任何其他蛋白质);脂质;脂多糖;脂质微胶粒或脂质体(例如,由磷脂如磷脂酰胆碱、脂肪酸、糖脂、神经酰胺、甘油酯、胆固醇、或其任何组合形成);纳米颗粒(例如,二氧化硅、脂质、碳水化合物、或其他药学上可接受的聚合物纳米颗粒);由阳离子聚合物和阴离子试剂(例如,cro)形成的多聚物,其中示例性阳离子聚合物包括聚胺(例如,聚赖氨酸、聚精氨酸、聚酰胺基胺、以及聚乙烯亚胺);胆固醇;树枝状聚合物(例如,聚酰胺基胺(pamam)树枝状聚合物);血清蛋白(例如,人血清白蛋白(hsa)或低密度脂蛋白(ldl));碳水化合物(例如,葡聚糖、支链淀粉、壳多糖、脱乙酰壳多糖、菊糖、环糊精、或透明质酸);脂质;合成聚合物(例如,聚赖氨酸(pll)、聚乙烯亚胺、聚-l-天冬氨酸、聚-l-谷氨酸、苯乙烯-马来酸酐共聚物、聚(l-丙交酯-乙醇酸共聚物)共聚物、二乙烯醚马来酸酐共聚物、n-(2-羟丙基)甲基丙烯酰胺共聚物(hmpa)、聚乙二醇(peg)、聚乙烯醇(pva)、聚氨酯、聚(2-乙基丙烯酸)、n-异丙基丙烯酰胺聚合物、伪肽-聚胺、肽模拟物聚胺、或聚胺);阳离子部分(例如,阳离子脂质、阳离子卟啉、聚胺的季盐、或α-螺旋肽);多价糖(例如,多价乳糖、多价半乳糖、n-乙酰基-半乳糖胺、n-乙酰基-葡萄糖胺、多价甘露糖、或多价岩藻糖);维生素(例如,维生素a、维生素e、维生素k、维生素b、叶酸、维生素b12、核黄素、生物素、或吡哆醛);辅因子;或用于破坏细胞骨架以便增加摄取的一种药物(例如,紫杉酚、长春新碱、长春花碱、细胞松弛素、诺考达唑、促微丝聚合剂(japlakinolide)、拉春库林(latrunculin)a、鬼笔环肽、海洋苔藓素(latrunculin)a、茚满诺星(indanocine)或myoservin)。如在此所描述的其他治疗剂可以与本发明的核苷酸构建体组合包含于本发明的药物组合物中。核苷酸构建体的细胞内活性本发明提供用于递送在此披露的核苷酸构建体(例如,rna、dna、包括经修饰的碱基的核酸、其他阴离子核酸等)的组合物和方法。因此,本发明提供适用于递送对基因或蛋白质表达施加一种调控作用的非编码核苷酸构建体的方法和组合物。本发明的多核苷酸构建体可以是单链的或双链的。当是双链时,一条或两条链可以包括一个或多个生物可逆性基团。当该多核苷酸充当sirna时,过客链可以包括不可逆地结合至核苷酸间桥联基团的基团,例如,c1-6烷基磷酸三酯。典型地,这种基团位于从3’端的第一或第二个核苷酸之后。该不可逆的基团防止过客链充当引导链,并且由此防止或减少可能的脱靶效应。rna干扰(rnai)是其中信使rna(mrna)通过源自双链rna(dsrna)的包含与待沉默的靶基因的核苷酸序列相同或非常相似的核苷酸序列的小干扰rna(sirna)降解的过程。该过程通过转录后、翻译前操纵防止由靶向基因编码的一种蛋白质的产生。因此,可以完成显性疾病基因或其他靶基因的沉默。体内rnai通过过程进行,在该过程中dsrna通过被称为dicer的酶(dsrna核糖核酸内切酶)裂解成短干扰rna(sirna)(伯恩斯坦(bernstein)等人,2001;汉密尔顿(hamilton)和鲍尔库姆(baulcombe),1999,科学(science)286:950;迈斯特(meister)和tuschl,2004,自然(nature)431,343-9),从而从原始单一dsrna产生多个分子。将sirna加载到多聚rnai沉默复合物(risc)中,导致催化活化和mrna靶特异性(汉农(hannon)和罗西(rossi),自然431,371-378,2004;挪威纳(novina)和夏普(sharp),自然430,161-164,2004)。在sirna加载至risc期间,将反义链或引导链与sirna分开,并且保持驻留在argonaute-2(ago2)(risc催化亚基)中(洛伊什纳(leuschner)等人,embo报告7,314-320,2006)。某些细胞区室如内质网(er)、高尔基体、er-高尔基中间区室(ergic)、p-小体、以及早期内体富含ago2。从细胞核输出至细胞质中的mrna被认为在核糖体到达之前通过活化的risc,从而允许基因表达的定向、转录后、翻译前调控。在理论上,每个和所有细胞mrna都可以通过选择性rnai反应的诱导来调控。21-23bpsirna在哺乳动物细胞中有效诱导rnai反应的能力现在是常规的(宗特海默尔(sontheimer),分子细胞生物学自然评论(nat.rev.mol.cell.biol.)6,127-138,2005)。sirna的ic50在10-100pm范围内,显著低于具有在1-10nm范围内的ic50值的最佳药物。因此,由于其精确选择性,rnai已成为用于细胞表型的定向操纵的基石,从而绘制遗传途径的图谱,发现且确认治疗靶点,并且具有显著治疗潜力。rnai的方面包括:(1)dsrna而不是单链反义rna是干扰剂;(2)该过程是高度特异性的并且是显着有效的(每个细胞仅需要一些dsrna分子以用于有效干扰);(3)干扰活性(且可能dsrna)可以导致细胞和组织中的干扰远离引入位点除去。然而,dsrna的有效递送是困难的。例如,具有13,860道尔顿分子量的21bpdsrna不能穿过细胞膜来进入细胞质,这是由于rna的(1)大小和(2)极其负(酸性)电荷所致。由本发明提供的方法和组合物实现核苷酸构建体(如dsrna)通过电荷中和和改进的摄取递送至细胞中。包括与靶基因的核苷酸序列互补的sirna序列的dsrna可以按任何数目的方法来制备。用于鉴别sirna序列的方法和技术是本领域中已知的。sirna核苷酸序列可以在从从国家生物技术信息中心网站(可在万维网ncbi.nlm.nih.gov上获得)提供登录号或gi号之后,从sirna选择程序,怀特海德生物医学研究所(whiteheadinstituteforbiomedicalresearch),麻省理工学院(massachusettsinstituteoftechnology),马萨诸塞州剑桥市(cambridge,mass.)(当前可在http:[//]jura.wi.mit.edu/bioc/sirnaext/获得;注意已添加括号来去除超链接)获得。可替代地,包含适当sirna序列的dsrna可以使用宮岸(miyagishi)和平良(taira)2003)的策略来确定。还存在可商购的rnai设计算法(http:[//]rnaidesigner.invitrogen.com/rnaiexpress/)。按要求制备售rna也是可商购的。本发明的核苷酸构建体还可以充当mirna以便诱导mrna的裂解。可替代地,本发明的核苷酸构建体可以充当反义试剂以结合mrna,以便通过rna酶诱导裂解抑或空间上阻断翻译。在此描述本发明的核苷酸构建体可以被转运至细胞中的示例性方法。治疗方法可以使用本发明的核苷酸构建体来治疗各种疾病和病症。例如,可以在递送一种抗肿瘤sirna之后抑制、遏制或破坏肿瘤细胞的生长。例如,一种抗肿瘤sirna可以是靶向编码促进血管新生的多肽的基因的一种sirna。与肿瘤生长相关的各种血管生成蛋白质是本领域已知的。在此描述的核苷酸构建体因此可以用于治疗疾病,如抗增殖病症(例如,癌症)、病毒感染、以及遗传性疾病。可以使用本发明的多核苷酸治疗的其他疾病是眼部病症(如年龄相关性黄斑变性)(例如,如在u.s.7,879,813和u.s.2009/0012030中所描述)和局部病症如银屑病。包含有效量的组合物可以出于预防性或治疗性治疗给予。在预防性应用中,组合物可以给予至对癌症具有临床上确定的易感染性或增加的易感性或在此描述的任何疾病的受试者。本发明的组合物可以按足以延迟、减少或预防临床疾病的发作的量给予至受试者(例如,人)。在治疗应用中,以足以治愈或至少部分地阻止该病状以及其并发症的症状的量向已经罹患疾病(例如,癌症,如白血病或骨髓增生异常综合征)的受试者(例如,人)给予组合物。对于这种用途有效的量可以取决于疾病或病状的严重程度以及受试者的体重和总体状况,但通常在每受试者每剂量从约0.05μg至约1000μg(例如,0.5-100μg)的等效量的药剂的范围内。用于初始给予和加强给予的适合的方案由初始给予、接着通过随后给予在一个或多个每小时、每天、每周、或每月间隔的重复剂量作为典型。存在于本发明的组合物中的总有效量的药剂可以在一段相对较短的时间内作为大丸剂或通过输注以单次剂量给予至哺乳动物,或可以使用分次治疗方案给予,其中在更长的时间段内给予多次剂量(例如,每4-6小时、8-12小时、14-16小时、18-24小时、每2-4天、每1-2周一次剂量,以及每月一次)。可替代地,考虑足以在血液中维持治疗有效浓度的连续静脉输注。施加至哺乳动物(例如,人)的存在于本发明的组合物内和用于本披露的方法中的治疗有效量的一个或多个药剂可以通过普通技术人员在考虑哺乳动物的年龄、体重和状况方面的个体差异的情况下来确定。本发明的包括效量的组合物的单次或多次给予可以采用由治疗医师选择的剂量水平和模式来进行。剂量和给药方案可以基于受试者的疾病或病状的严重程度来确定和调整,该严重程度可以根据通常由临床医师实践的方法或在此描述的那些方法在整个治疗过程中进行监测。本发明的一个或多个核苷酸构建体可以与常规治疗方法或疗法组合使用,抑或可以与常规治疗方法或疗法分开使用。当本发明的一个或多个核苷酸构建体与其他药剂以组合疗法给予时,它们可以顺序地或同时地给予至个体。可替代地,根据本发明的药物组合物可以包含与如在此所描述的药学上可接受的赋形剂缔合的本发明的核苷酸构建体与本领域中已知的另一种治疗剂或预防剂的一种组合。以下实例意在说明本发明。这些实例不意欲以任何方式限制本发明。实例实例1.本发明的核苷酸和多核苷酸的合成和纯化通用合成程序本发明的多核苷酸构建体可以根据在此描述的通用方法和具体方法来制备。例如,包含硫醇的起始材料经历与2,2’-二吡啶基二硫化物的反应,从而得到相应的二吡啶基二硫化物化合物(例如,参见方案1),然后使该二吡啶基二硫化物化合物经受与核苷亚磷酰二胺的反应以产生本发明的核苷酸构建体(例如,参见方案1)。这些核苷酸构建体然后用于标准寡核苷酸合成方案中以形成多核苷酸构建体。然后使这些多核苷酸构建体脱保护且使用hplc进行纯化。方案1本发明的核苷酸的具体合成以下描述了本发明的核苷酸及其前体的示例性合成。前体化合物s2向4-巯基-丁醇(10.0g,94mmol)和二硫代吡啶(25.0g,113mmol)于400ml乙醇中的溶液添加7.0ml的乙酸。将反应混合物在室温下搅拌1小时,之后在真空下浓缩。将500ml的乙酸乙酯添加至粗产物,并且将溶液用1nnaoh水溶液(200ml)和盐水(200ml)顺序洗涤,且然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-40%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的12.8g(64%)的产物s2。1hnmr(500mhz):δ8.45(d,j4.5hz,1h),7.70(d,j8.0hz,1h),7.62(m,1h),7.06(m,1h),3.65(t,j6.0hz,2h),2.83(t,j7.0hz,2h),1.80(m,2h),1.70(brs,1h),1.65(m,2h)。化合物s3向s2(1.3g,6.0mmol)和4-硫烷基戊酸(0.67g,5.0mmol)于30ml甲醇中的溶液添加30μl的乙酸。将反应混合物在室温下搅拌16小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷/2%乙酸溶剂系统(在combi快速rf仪器上0%-70%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的1.13g(95%)的产物s3。1hnmr(500mhz):δ4.95(brs,1h),3.68(t,j6.0hz,2h),2.88(m,1h),2.71(t,j7.0hz,2h),2.50(m,2h),1.98(m,1h),1.18(m,1h),1.75(m,2h),1.65(m,2h),1.32(d,j7.0hz,3h)。化合物s4向s3(1.13g,5.0mmol)、苄胺(0.84ml,7.7mmol)和3.6ml的n,n-二异丙基乙胺(diea)于25.0ml二氯甲烷中的溶液添加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edci,1.5g,7.7mmol)。将反应混合物在室温下搅拌2小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-100%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的1.17g(70%)的产物s4。1hnmr(500mhz):δ7.22-7.31(m,5h),6.55(brs,1h,4.35(d,j5.5hz,2h),4.20(brs,1h),3.55(m,2h),2.80(m,1h),2.60(t,j7.5hz,2h),2.25(t,j7.5hz,2h),1.85(m,1h),1.75(m,1h),1.65(m,2h),1.55(m,2h),1.25(d,j6.5hz,3h)。化合物s5向s2(1.82g,8.4mmol)和4-硫烷基-4-甲基戊酸(1.04g,7.0mmol)于45.0ml甲醇中的溶液添加35μl的乙酸。将反应混合物在室温下搅拌16小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷/2%乙酸溶剂系统(在combi快速rf仪器上0%-70%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.82g(50%)的产物s5。1hnmr(500mhz):δ7.25(brs,1h),3.63(t,j6.0hz,2h),2.69(m,2h),2.40(m,2h),1.83(m,2h),1.70(m,2h),1.62(m,2h),1.25(s,6h)。化合物s6向s5(0.82g,3.25mmol)、苄胺(0.53ml,4.88mmol)和2.3ml的n,n-二异丙基乙胺(diea)于20.0ml二氯甲烷中的溶液添加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edci,0.94g,4.88mmol)。将反应混合物在室温下搅拌2小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-100%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.80g(73%)的产物s6。1hnmr(500mhz):δ7.22-7.40(m,5h),6.30(brs,1h),4.37(d,j=6.0hz,2h),3.60(m,2h),2.80(m,1h),2.68(m,2h),2.25(m,2h),1.85(m,2h),1.75(m,1h),1.65(m,2h),1.55(m,2h),1.25(s,6h)。化合物s7向s2(1.0g,4.6mmol)和2-丙硫醇(0.52ml,5.5mmol)于20.0ml甲醇中的溶液添加15μl的乙酸。将反应混合物在室温下搅拌16小时,之后在真空中浓缩。将粗混合物用100ml的乙酸乙酯稀释,并且用1nnaoh水溶液(200ml)和盐水(200ml)顺序洗涤,且然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.40g(40%)的产物s7。1hnmr(500mhz):δ3.63(t,j6.5hz,2h),2.89(m,1h),2.70(t,j7.0hz,2h),1.80(s,1h),1.75(m,2h),1.65(m,1h),1.27(d,j7.0hz,6h)。化合物s8向s2(6.0g,27.7mmol)和2-甲基-2-丙硫醇(2.5g,27.7mmol)于100ml甲醇中的溶液添加100μl的乙酸。将反应混合物在室温下搅拌16小时,之后在真空中浓缩。将粗混合物用400ml的乙酸乙酯稀释,并且用1nnaoh水溶液(200ml)和盐水(200ml)顺序洗涤,且然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的3.0g(60%)的产物s8。1hnmr(500mhz):δ3.65(m,2h),2.75(t,j7.5hz,2h),1.75(m,2h),1.65(m,2h),1.30(s,9h)。化合物s9向3,4-二羟基甲基呋喃(1.0g,7.8mmol)和三苯基膦(2.3g,8.6mmol)于25.0ml二氯甲烷中的溶液添加四溴化碳(2.85g,8.6mmol)。将反应混合物在室温下搅拌16小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-35%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的1.09g(74%)的产物s9,将该产物快速溶解于甲醇中用于下一反应。1hnmr(500mhz):δ7.50(s,1h),7.40(s,1h),4.65(s,2h),4.46(s,2h)。化合物s10向s9(1.09g,5.7mmol)和硫代乙酸(0.52g,6.8mmol)于10.0ml甲醇中的溶液分批添加nahco3(0.58g,6.8mmol)。将反应混合物在室温下搅拌2小时,之后用1nhcl溶液中和至ph7,并且在真空中蒸发挥发物。将残余物用200ml的乙酸乙酯稀释,并且用饱和nahco3溶液(50ml)和盐水(50ml)顺序洗涤,且然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.80g(75%)的产物s10。1hnmr(500mhz):δ7.37(s,1h),7.35(s,1h),4.53(d,j5.5hz,2h),4.00(s,2h),2.34(s,3h),1.88(t,j5.5hz,1h)。化合物s11在氩气氛下向s10(0.60g,3.2mmol)于15.0ml甲醇中的溶液分批添加k2co3(0.53g,3.86mmol)。将反应混合物在室温下搅拌30分钟,之后用1nhcl溶液中和至ph7,并且在真空中蒸发挥发物。将残余物用100ml的乙酸乙酯稀释,并且用饱和nahco3溶液(30ml)和盐水(30ml)顺序洗涤,且然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物直接用于下一反应。化合物s12向粗s11(0.46g,3.2mmol)和二硫代吡啶(0.85g,3.8mmol)于12.0ml乙醇中的溶液添加200μl的乙酸。将反应混合物在室温下搅拌45分钟,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.40g(50%产率)的产物s12。1hnmr(500mhz):δ8.46(d,j5.0hz,1h),7.56(m,1h),7.40(d,j8.0hz,1h),7.32(s,2h),7.09(m,1h),4.65(s,2h),3.97(s,2h),1.60(brs,1h)。化合物s13向s12(0.39g,1.5mmol)和叔丁基硫醇(0.21ml,1.8mmol)于20.0ml甲醇中的溶液添加50μl的乙酸。将反应混合物在室温下搅拌40小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.33g(95%)的产物s13。1hnmr(500mhz):δ7.40(s,1h),7.37(s,1h),4.60(s,2h),3.82(s,2h),1.84(brs,1h),1.34(s,9h)。化合物s14向48%氢溴酸(15.0ml)的溶液添加1,2-苯二甲醇(4.0g,29.0mmol),并且将反应混合物在室温下搅拌2小时。将1nnaoh水溶液添加至反应混合物以将溶液中和至ph7。将所得混合物用乙酸乙酯(200ml)稀释,通过饱和nahco3溶液(20ml)和盐水(20ml)顺序洗涤,且然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈白色固体的2.6g(45%)的产物s14。1hnmr(500mhz):δ7.30-7.45(m,4h),4.85(s,2h),4.64(s,2h),1.81(brs,1h)。化合物s15向s14(1.0g,5.0mmol)和硫代乙酸(0.46g,6.0mmol)于10.0ml甲醇中的溶液分批添加nahco3(0.50g,6.0mmol)。将反应混合物在室温下搅拌2小时,之后用1nhcl溶液中和至ph7,并且在真空中蒸发挥发物。将残余物用200ml的乙酸乙酯稀释,通过饱和nahco3溶液(50ml)和盐水(50ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.97g(99%)的产物s15。1hnmr(500mhz):δ7.40(m,2h),7.25(m,2h),4.73(d,j5.5hz,2h),4.24(s,2h),2.34(s,3h),2.05(t,j5.5hz,1h)。化合物s16在氩气氛下向s15(0.75g,3.8mmol)于20.0ml甲醇中的溶液分批添加k2co3(0.64g,4.6mmol)。将反应混合物在室温下搅拌30分钟,之后用1nhcl溶液中和至ph7,并且在真空中蒸发挥发物。将残余物用100ml的乙酸乙酯稀释,通过饱和nahco3溶液(30ml)和盐水(30ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗产物直接用于下一反应。化合物s17向粗s16(0.52g,3.4mmol)和二硫代吡啶(0.89mg,4.05mmol)于15.0ml乙醇中的溶液添加0.30ml的乙酸。将反应混合物在室温下搅拌30分钟,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.52g(50%)的产物s17。1hnmr(500mhz):δ8.42(d,j5.0hz,1h),7.25-7.51(m,7h),4.83(s,2h),4.19(s,2h),3.85(brs,1h)。化合物s18向s17(0.42g,1.6mmol)和叔丁基硫醇(0.21ml,1.9mmol)于20.0ml甲醇中的溶液添加50μl的乙酸。将反应混合物在室温下搅拌48小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.32g(94%产率)的产物s18。1hnmr(500mhz):δ7.40(m,1h),7.26-7.30(m,3h),4.80(d,2h,j4.0hz),4.06(s,2h),1.95(brs,1h),1.35(s,9h)。化合物s19向5-巯基丁醇(0.85g,7.1mmol)和二硫代吡啶(1.87g,8.5mmol)于25.0ml乙醇中的溶液添加0.2ml的乙酸。将反应混合物在室温下搅拌1小时,之后在真空下浓缩。将50.0ml的乙酸乙酯添加至粗产物,并且将溶液通过1nnaoh水溶液(50ml)和盐水(30ml)顺序洗涤,且然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-40%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的1.21g(75%)的产物s19。1hnmr(500mhz):δ8.45(d,j5.0hz,1h),7.71(d,j8.0hz,1h),7.63(m,1h),7.07(m,1h),3.62(t,j6.5hz,2h),2.81(t,j7.5hz,2h),1.73(m,2h),1.56(m,2h),1.48(m,2h)。化合物s20向s19(1.2g,5.3mmol)于20.0ml二氯甲烷中的溶液添加三氟甲磺酸甲酯(0.87g,5.3mmol)。将反应混合物在室温下搅拌15分钟,接着添加2-甲基-2-丙硫醇(1.2ml,10.6mmol)和二异丙基乙胺(diea)(2.7ml,15.9mmol)。将反应混合物搅拌另1小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.67g(61%)的产物s20。1hnmr(500mhz):δ3.65(t,j6.5hz,2h),2.70(t,j7.0hz,2h),1.67(m,2h),1.57(m,2h),1.45(m,2h),1.32(s,9h)。化合物s21将4-氰基苯甲醛(5.0g,38.1mmol)、2,2-二乙基-1,3-丙二醇(5.5g,41.9mmol)、以及对甲苯磺酸一水合物(0.21g,1.14mmol)于250ml甲苯中的悬浮液用迪安-斯达克(dean-stark)设备回流16小时。将反应混合物冷却至室温,且在减压下除去挥发物。将粗混合物用300ml的乙酸乙酯稀释,通过饱和nahco3溶液(30ml)和盐水(30ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-20%梯度)通过硅胶柱色谱法进行纯化以给出呈白色固体的8.7g(94%)的产物s21。1hnmr(500mhz):δ7.66(d,j6.5hz,2h),7.61(d,j8.5hz,2h),5.4(s,1h),3.97(d,j11.5hz,2h),3.61(d,j12.0hz,2h),1.79(q,j7.5hz,2h),1.15(q,j7.5hz,2h),0.89(t,j7.5hzm,3h),0.82(t,j7.5hzm,3h)。化合物s22将氢化铝锂(0.94g,24.6mmol)于thf中的悬浮液冷却至0℃,在氩气氛下向该悬浮液逐滴添加s21(2.0g,8.2mmol)于25.0mlthf中的溶液。将反应混合物升温至室温并且进一步搅拌3小时。将悬浮液通过冰浴冷却至0℃,用饱和na2so4溶液淬灭,并且通过垫过滤。在减压下浓缩滤液。将粗混合物用100ml的乙酸乙酯稀释,用饱和nahco3溶液(20ml)和盐水(20ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,以给出呈无色油状物的粗中间体s22,该粗中间体无需进一步纯化而用于下一反应。化合物s23向s5(2.8g,11.0mmol)、edci(2.5g,13.0mmol)、以及diea(7.6ml,44.0mmol)于25.0ml二氯甲烷中的溶液添加s22(2.84g,11.0mmol)于10.0ml二氯甲烷中的溶液。将反应混合物在室温下搅拌16小时,之后在减压下浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-40%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的2.5g(47%)的产物s23。1hnmr(500mhz):δ7.45(d,j8.0hz,2h),7.26(d,j8.0hz,2h),5.85(brs,1h),5.37(s,1h),5.29(s,2h),4.41(d,j5.5hz,2h),3.93(d,j11.5hz,2h),3.60(m,4h),2.69(t,j7.5hz,2h),2.29(m,2h),1.93(m,2h),1.80(q,j7.5hz,2h),1.75(m,2h),1.60(m,2h),1.28(s,6h),1.13(q,j7.5hz,2h),0.89(t,j7.5hz,3h),0.81(t,j7.5hz,3h)。化合物s24向4-甲酰基苯甲酸(15.01g,100mmol)和2,2-二乙基-1,3-丙二醇(14.54g,110mmol)于甲苯(250ml)中的悬浮液添加对甲苯磺酸一水合物(0.57g,3.0mmol)。将混合物用一种迪安-斯达克设备回流过夜。将反应混合物冷却至室温以形成较大量的沉淀。将固体过滤,用100ml的乙酸乙酯加热,并且冷却以收集沉淀,将沉淀在高真空下干燥以得到20g的标题化合物s24。将滤液用水和盐水洗涤,经无水na2so4干燥,并且蒸发以得到白色固体,将该白色固体从乙酸乙酯中重结晶以得到另1.5g的s24(总计21.5g,81%)。1hnmr(500mhz,cdcl3):δ8.12(2h,d,j8.5hz),7.61(2h,d,j8.5hz),5.45(1h,s),3.98(2h,d,j11.5hz),3.62(2h,d,j11.5hz),1.83(2h,q,j7.5hz),1.16(2h,q,j7.5hz),0.90(3h,t,j7.5hz),0.83(3h,t,j7.5hz)。化合物s25向s24(1.32g,5.0mmol)和单-fmoc乙二胺hcl盐(1.75g,5.5mmol)于二甲基甲酰胺(15.0ml)中的溶液添加hatu(2.28g,6.0mmol)和n,n-二异丙基乙胺(4.35ml,25.0mmol)。将所得混合物搅拌30分钟,并且在高真空下除去挥发物以得到一种褐色固体。将固体用乙酸乙酯洗涤三次以得到呈白色固体的1.95g(74%)的纯化合物s25。1hnmr(500mhz,cdcl3):δ7.78(2h,d,j8.0hz),7.74(2h,d,j7.5hz),7.55(2h,d,j7.5hz),7.53(2h,d,j8.0hz),7.37(2h,t,j7.5hz),7.26(2h,t,j7.5hz),7.07(1h,brs),5.47(1h,brs),5.38(1h,s),4.40(2h,d,j6.5hz),4.16(1h,t,j6.5hz),3.95(2h,d,11.5hz),3.58(2h,d,j11.5hz),3.55-3.50(2h,m),3.43-3.35(2h,m),1.81(2h,q,j7.5hz),1.14(2h,q,j7.5hz),0.89(3h,t,j7.5hz),0.82(3h,t,j7.5hz)化合物s26向化合物s25(1.95g,3.68mmol)于二甲基甲酰胺(15ml)中的溶液添加3ml的哌啶,并且将混合物搅拌30分钟。将混合物用己烷(20ml×2)洗涤,并且在高真空下蒸发二甲基甲酰胺层以得到粗化合物s26,该粗化合物无需进一步纯化而用于下一反应。化合物s27向化合物s26和s5(0.87g,3.45mmol)于二甲基甲酰胺(10ml)中的混合物添加hatu(1.68g,4.4mmol)和n,n-二异丙基乙胺(1.2ml,6.9mmol)。将混合物搅拌1小时,并且在高真空下除去挥发物以得到褐色固体。将固体用乙酸乙酯洗涤数次,并且在高真空下干燥以得到呈白色固体的0.95g(51%)的标题化合物s27。1hnmr(500mhz,cdcl3):δ7.81(2h,d,j8.5hz),7.57(2h,d,j8.5hz),7.19(1h,brs),6.42(1h,brs),5.42(1h,s),3.96(2h,d,j11.0hz),3.64-3.55(6h,m),3.53-3.47(2h,m),2.66(2h,t,j7.5hz),2.31-2.26(2h,m),2.05(1h,brs),1.90-1.85(2h,m),1.82(2h,q,j7.5hz),1.75-1.66(2h,m),1.63-1.55(2h,m),1.25(6h,s),1.15(2h,q,j7.5hz),0.89(3h,t,j7.5hz),0.82(3h,t,j7.5hz)。化合物s29向异丙基硫醇(7.6g,100mmol)于乙醇(300ml)中的溶液添加二硫代二吡啶(24.2g,110mmol)和乙酸(7.0ml)。将混合物搅拌过夜,并且然后蒸发以给出残余物,将该残余物溶解于200ml的乙酸乙酯中。将溶液用1nnaoh(50ml×3)和盐水洗涤。将有机层经无水na2so4干燥,过滤且蒸发以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-20%)以给出呈无色油状物的14.4g(77%)的标题化合物s29。1hnmr(500mhz,cdcl3):δ8.44(1h,d,j5.0hz),7.75(1h,d,j8.0hz),7.63(1h,td,j8.0,1.5hz),7.06(1h,m),3.13(1h,m),1.33(6h,d,j7.0hz)。化合物s30向化合物s29(1.86g,10.0mmol)于二氯甲烷(5.0ml)中的溶液中添加meotf(1.64g,10.0mmol)。将混合物搅拌15分钟,并且用己烷(10ml×2)洗涤。将二氯甲烷层蒸发以给出呈黄色油状物的粗盐(s30),该粗盐直接用于下一反应。化合物s31向4-巯基-4-甲基丁-1-醇(0.36g,3.0mmol)于二氯甲烷中的溶液添加粗s30(1.26g,3.6mmol)和n,n-二异丙基乙胺(1.0ml)。将混合物搅拌10分钟,在真空下除去挥发物以给出残余物,使该残余物经受在一种isco手册仪器上的快速硅胶柱纯化(乙酸乙酯/己烷=5%-40%)以给出呈无色油状物的0.50g(85%)的标题化合物s31。1hnmr(500mhz,cdcl3):δ3.67(2h,t,j6.5hz),2.96(1h,j6.5hz),2.83(1h,m),1.77-1.67(3h,m),1.63-1.55(1h,m),1.32(3h,d,j6.5hz),1.30(6h,d,j6.5hz)。化合物s32向4-巯基-4-甲基戊-1-醇(0.19g,1.39mmol)于二氯甲烷中的溶液添加粗s30(0.58g,1.66mmol)和n,n-二异丙基乙胺(1.0ml)。将混合物搅拌10分钟,在真空下除去挥发物以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-40%)以给出呈无色油状物的0.26g(89%)的标题化合物s32。1hnmr(500mhz,cdcl3):δ3.66(2h,t,j5.5hz),2.94(1h,j6.5hz),1.72-1.60(4h,m),1.29(6h,s),1.29(6h,d,j6.5hz)。化合物s33向4-巯基-4-甲基丁-1-醇(0.18g,1.5mmol)于甲醇(5.0ml)中的溶液添加二硫代二吡啶(0.35g,1.6mmol)和乙酸(30μl)。将混合物搅拌30分钟,然后蒸发以给出一种残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=15%-70%)以给出呈无色油状物的0.27g(78%)的标题化合物s33。1hnmr(500mhz,cdcl3):δ8.84(1h,d,j5.0hz),7.73(1h,d,j8.0hz),7.63(1h,td,j8.0,1.5hz),7.07(1h,m),3.64(2h,t,j6.5hz),2.99(1h,m),1.82-1.60(4h,m),1.34(3h,d,j7.0hz)。化合物s34向化合物s33(0.27g,1.15mmol)于二氯甲烷(5.0ml)中的溶液中添加meotf(0.19g,1.15mmol)。将混合物搅拌15分钟,且然后添加2-甲基-2-丙硫醇(0.21g,2.3mmol)和n,n-二异丙基乙胺(1.0ml)。将所得混合物搅拌另外30分钟。蒸发挥发物得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-40%)以给出呈无色油状物的0.19g(79%)的标题化合物s34。1hnmr(500mhz,cdcl3):δ3.67(2h,t,j6.5hz),2.84(1h,m),1.75-1.65(3h,m),1.62-1.55(1h,m),1.32(9h,s),1.31(3h,d,j7.0hz)。化合物s35向6-巯基-1-己醇(2.68g,20.0mmol)于甲醇(50.0ml)中的溶液添加二硫代二吡啶(6.6g,30.0mmol)和乙酸(1.0ml)。将混合物搅拌30分钟,且然后蒸发以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=15%-70%)以给出呈无色油状物的4.37g(90%)的标题化合物s35。1hnmr(500mhz,cdcl3):δ8.46(1h,d,j4.5hz),7.72(1h,d,j8.0hz),7.64(1h,td,j8.0,1.5hz),7.07(1h,m),3.63(2h,t,j6.5hz),2.80(2h,t,j7.0hz),1.72(2h,p,j7.5hz),1.60-1.53(2h,m),1.47-1.40(2h,m),1.39-1.34(2h,m)。化合物s36向化合物s35(1.0g,4.1mmol)于二氯甲烷(15.0ml)中的溶液添加meotf(0.67g,4.1mmol)。将混合物搅拌15分钟,且然后添加2-甲基-2-丙硫醇(0.9ml,8.2mmol)和n,n-二异丙基乙胺(2.0ml)。将所得混合物搅拌另外30分钟。蒸发挥发物得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-60%)以给出呈无色油状物的0.61g(67%)的标题化合物s36。1hnmr(500mhz,cdcl3):δ3.65(2h,t,j6.5hz),2.70(2h,t,j7.0hz),1.70-1.64(2h,m),1.62-1.55(2h,m),1.45-1.35(4h,m),1.33(9h,s)。化合物s37向化合物s2(0.43g,2.0mmol)于二氯甲烷(10.0ml)中的溶液添加meotf(0.33g,2.0mmol)。将混合物搅拌15分钟,且然后添加环己硫醇(0.23g,2.0mmol)和n,n-二异丙基乙胺(1.0ml)。将所得混合物搅拌另外30分钟。蒸发挥发物得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-60%)以给出呈无色油状物的0.36g(81%)的标题化合物s37。1hnmr(500mhz,cdcl3):δ3.67(2h,t,j6.5hz),2.74-2.68(1h,m),2.71(1h,t,j7.0hz),2.05-2.00(2h,m),1.81-1.74(4h,m),1.71-1.65(2h,m),1.65-1.58(1h,m),1.40-1.20(6h,m)。化合物s38向化合物s2(0.65g,3.0mmol)于二氯甲烷(12.0ml)中的溶液添加meotf(0.49g,3.0mmol)。将混合物搅拌15分钟,且然后添加1-环己基乙烷-1-硫醇(0.42g,3.6mmol)和n,n-二异丙基乙胺(1.0ml)。将所得混合物搅拌另外30分钟。蒸发挥发物得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-60%)以给出呈无色油状物的0.58g(78%)的标题化合物s38。1hnmr(500mhz,cdcl3):δ3.68(2h,t,j6.5hz),2.75-2.65(1h,m),2.70(2h,t,j7.0hz),1.82-1.72(6h,m),1.70-1.63(3h,m),1.58-1.52(1h,m),1.28(3h,d,j7.0hz),1.30-1.05(5h,m)。化合物s39向化合物s2(0.43g,2.0mmol)于甲醇(5.0ml)中的溶液添加苄基乙烷-1-硫醇(0.28g,2.0mmol)和乙酸(30μl)。将所得混合物搅拌过夜。蒸发挥发物得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-60%)以给出呈无色油状物的0.24g(50%)的标题化合物s39。1hnmr(500mhz,cdcl3):δ7.38-7.30(4h,m),7.27-7.23(1h,m),3.59(2h,t,j6.5hz),2.30(2h,t,j7.0hz),1.67(3h,d,j7.0hz),1.62-1.51(4h,m)。化合物s40在0℃下向2-巯基-2-甲基丙-1-醇(0.50g,4.7mmol)于二氯甲烷(15.0ml)中的溶液添加tbdmscl(0.75g,4.9mmol)和咪唑(0.48g,7.1mmol),并且搅拌30分钟,从而形成较大量的白色沉淀。滤出白色固体,且用10ml的二氯甲烷洗涤。将滤液蒸发以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=0%-30%)以给出呈无色油状物的0.66g(64%)的标题化合物s40。1hnmr(500mhz,cdcl3):δ3.47(2h,s),1.32(6h,s),0.92(9h,s),0.07(6h,s)。化合物s41向化合物s2(0.78g,3.6mmol)于二氯甲烷(12.0ml)中的溶液添加meotf(0.59g,3.6mmol)。将混合物搅拌15分钟,且然后添加s40(0.66g,3.0mmol)和n,n-二异丙基乙胺(1.0ml)。将所得混合物搅拌另外30分钟。蒸发挥发物得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-60%)以给出呈无色油状物的0.80g(82%)的标题化合物s41。1hnmr(500mhz,cdcl3):δ3.58(2h,t,j6.5hz),3.41(2h,s),2.62(2h,t,j7.0hz),1.70-1.63(2h,m),1.62-1.55(2h,m),1.17(6h,s),0.81(9h,s),0.03(6h,s)。化合物s42向硫茚-2-硼酸(3.09g,17.0mmol)于etoh(30.0ml)中的溶液逐滴添加过氧化氢(30%,5.6ml)。在搅拌过夜之后,将反应混合物在减压下小心地浓缩,用水(100ml)稀释且用乙酸乙酯(70ml×3)萃取。将合并的有机层经无水硫酸钠干燥,并且在真空中浓缩以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=0%-20%)以给出呈无色油状物的2.17g(85%)的标题化合物s42。1hnmr(500mhz,cdcl3):δ7.34(1h,dd,j8.0hz),7.31-7.28(2h,m),7.22(1h,td,j8.0,1.0hz),3.98(2h,s)。化合物s43向lialh4(1.1g,28.8mmol)于thf(40.0ml)中的溶液添加化合物s42(2.16g,14.4mmol)于thf中的溶液。将混合物搅拌过夜,并且将反应混合物用水(20ml)小心地淬灭,同时冷却至0℃,接着添加50ml的1nhcl。分离各相,并且将水层用乙酸乙酯(2×50ml)萃取。将合并的有机层用盐水洗涤,经无水硫酸钠干燥,并且在真空中浓缩以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=10%-50%)以给出呈无色油状物的0.69g(31%)的标题化合物s43。1hnmr(500mhz,cdcl3):δ7.31(1h,dd,j7.5,1.5hz),7.20(1h,dd,j7.5,1.5hz),7.16-7.08(2h,m),3.91(2h,t,j6.5hz),3.41(1h,s),2.98(1h,j6.5hz)。化合物s44向化合物s43(0.23g,1.5mmol)于二氯甲烷(5.0ml)中的溶液添加二硫化物吡啶鎓盐s30(0.70g,2.0mmol)和n,n-二异丙基乙胺(1.0ml)。将混合物搅拌10分钟,并且在真空下除去挥发物以给出残余物,使该残余物经受根据isco手册(进行的快速硅胶柱纯化乙酸乙酯/己烷=5%-50%)以给出呈无色油状物的0.29g(85%)的标题化合物s44。1hnmr(500mhz,cdcl3):δ7.79(1h,d,j8.0hz),7.27-7.23(1h,m),7.21-7.18(2h,m),3.91(2h,t,j6.5hz),3.10(2h,t,j6.5hz),3.07-3.03(1h,m),1.30(6h,d,j7.0hz)。化合物s48将异丁烯硫醚(0.88g,10.0mmol)与哌啶(0.84ml,8.5mmol)的混合物加热至80℃并且搅拌4小时。蒸发挥发物得到粗产物s48,该粗产物无需纯化直接用于下一步骤。化合物s49向化合物s2(0.65g,3.0mmol)于二氯甲烷(12.0ml)中的溶液添加meotf(0.49g,3.0mmol)。将混合物搅拌15分钟,且然后添加粗s48(0.49g,3.0mmol)和二异丙基乙胺(1.0ml)。将所得混合物搅拌另外30分钟。蒸发挥发物得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-60%)以给出呈无色油状物的0.50g(对于两个步骤52%)的标题化合物s49。1hnmr(500mhz,cdcl3):δ3.69(2h,m),2.72(2h,t,j7.0hz),2.49(4h,m),2.37(2h,s),1.80-1.70(2h,m),1.70-1.62(2h,m),1.55-1.47(4h,m),1.40-1.34(2h,m),1.27(6h,s)。化合物s56将氢化铝锂(1.03g,27.0mmol)于thf中的悬浮液冷却至0℃,在氩气氛下向该悬浮液逐滴添加3-异苯并二氢吡喃酮s50(2.0g,13.5mmol)于25mlthf中的溶液。将反应混合物升温至室温并且进一步搅拌3小时。将悬浮液通过冰浴再次冷却至0℃,用饱和na2so4溶液淬灭,并且通过垫过滤。在减压下浓缩滤液。将粗混合物用100ml的乙酸乙酯稀释,用饱和nahco3溶液(20.0ml)和盐水(20.0ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,以给出呈无色油状物的中间体s51(2.01g,99%产率),该中间体无需进一步纯化而直接用于下一步骤。1hnmr(500mhz):δ7.34-7.22(m,4h),4.65(s,2h),3.89(t,j6.0hz,2h),2.96(t,j6.0hz,2h)向中间体s51(4.0g,26.5mmol)中逐滴添加48%氢溴酸(20.0ml)的溶液。将反应混合物在室温下搅拌3小时,之后倒入冰水中。将所得混合物用乙醚(200ml)萃取,用饱和nahco3溶液(20.0ml)和盐水(20.0ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,以给出呈浅黄色油状物的中间体s52(4.2g,72%产率),该中间体无需进一步纯化而直接用于下一步骤。1hnmr(500mhz):δ7.37-7.15(m,4h),4.59(s,2h),3.94(t,j6.5hz,2h),3.03(t,j6.5hz,2h)向s52(5.5g,25.6mmol)和硫代乙酸(2.24g,30.7mmol)于50.0ml甲醇中的溶液分批添加nahco3(2.58g,30.7mmol)。将反应混合物在室温下搅拌2小时,之后用1nhcl溶液中和至ph7,并且在真空中蒸发挥发物。将残余物用300ml的乙酸乙酯稀释,用盐水(50.0ml)洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈浅黄色油状物的产物s53(3.8g,71%产率)。1hnmr(500mhz):δ7.30-7.18(m,4h),4.20(s,2h),3.87(t,j7.0hz,2h),2.92(t,j7.0hz,2h),2.34(s,3h)在氩气氛下向s53(3.8g,18.1mmol)于50ml甲醇中的溶液分批添加k2co3(3.0g,21.7mmol)。将反应混合物在室温下搅拌30分钟,之后用1nhcl溶液中和至ph7,并且在真空中蒸发挥发物。将残余物用200ml的乙酸乙酯稀释,用盐水(50.0ml)洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,以给出呈浅黄色油状物的粗产物s54(2.8g,93%产率),该粗产物无需进一步纯化而直接用于下一步骤。向粗s54(2.8g,16.7mmol)和二硫代吡啶(4.4g,20.0mmol)于50.0ml乙醇中的溶液添加1.0ml的乙酸。将反应混合物在室温下搅拌3小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的产物s55(2.5g,60%产率)。1hnmr(500mhz):δ8.43(d,j4.5hz,1h),7.58-7.55(m,2h),7.26-7.07(m,5h),4.14(s,2h),3.96(t,j6.5hz,2h),3.04(t,j6.5hz,2h)向s55(1.14g,4.1mmol)和叔丁基硫醇(560μl,4.9mmol)于25ml甲醇中的溶液添加100μl的乙酸。将反应混合物在室温下搅拌48小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的产物s56(0.90g,97%产率,回收0.14g的s55)。1hnmr(500mhz):δ7.29-7.20(m,4h),4.03(s,2h),3.92(t,j6.5hz,2h),3.01(t,j6.5hz,2h),1.36(s,9h)化合物s58在氩气氛下向4-硫烷基-4-甲基戊酸(5.0g,33.7mmol)和乙酸酐(3.5ml,37.1mmol)于30.0ml乙腈中的溶液添加三乙胺(9.4ml,67.4mmol)和催化量的dmap。将反应混合物在室温下搅拌30分钟,在此时添加于15.0ml乙腈中的中间体s57(12.6g,50.55mmol)。将反应混合物在室温下搅拌过夜,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈浅黄色油状物的产物s58(6.2g,49%产率)。1hnmr(500mhz):δ7.32(d,j8.5hz,2h),7.26(d,j8.5hz,2h),5.7(brs,1h),5.37(s,1h),4.41(d,j5.5hz,2h),3.94(d,j11.5hz,2h),3.58(d,j11.5hz,2h),2.37(m,2h),1.93(m,2h),1.81(q,j7.5hz,2h),1.38(s,6h),1.13(q,j8.0hz,2h),0.89(t,j7.5hz,3h),0.81(t,j8.0hz,3h),1.83(m,2h),1.70(m,2h),1.62(m,2h),1.25(s,6h)化合物s59向s55(0.50g,1.8mmol)和s58(0.68g,1.8mmol)于10.0ml甲醇中的溶液添加100μl的乙酸。将反应混合物在室温下搅拌16小时,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈浅黄色油状物的产物s59(0.60g,61%产率)。c30h43no4s2的esims计算值545,观测值[m+h]+546。1hnmr(500mhz):δ7.44(d,j8.0hz,2h),7.30-7.18(m,6h),5.78(brs,1h),5.36(s,1h),4.41(d,j5.5hz,2h),4.07(s,2h),3.93(d,j11.5hz,2h),3.81(brs,2h),3.58(d,j11.5hz,2h),3.02(t,j7.5hz,2h),2.86(brs,1h),2.34(m,2h),2.05(m,2h),1.81(q,j7.5hz,2h),1.30(s,6h),1.13(q,j8.0hz,2h),0.89(t,j8.0hz,3h),0.81(t,j7.5hz,3h)化合物s60在45分钟内向化合物s60a(30.0g,168.5mmol)于etoh(120ml)中的溶液逐滴添加30%过氧化氢(50ml)(注意:放热)。反应混合物变得浑浊,具有白色固体。tlc显示反应在第3小时完成,在此时将反应混合物用水(300ml)稀释且用二氯甲烷(200ml×3)小心地萃取。将合并的有机层经无水硫酸钠干燥并且在真空中浓缩以得到粗产物。将该粗产物使用isco手册通过快速硅胶柱(220g)进行纯化(乙酸乙酯/己烷,在15个柱体积内0%-20%)以给出呈浅黄色油状物的23.5g(92%)的化合物s60b,该化合物在室温下在静置后变成固体。1hnmr(500mhz,cdcl3):δ7.34(1h,dd,j8.0hz),7.31-7.28(2h,m),7.22(1h,td,j8.0,1.0hz),3.98(2h,s)经1小时向lialh4(7.4g,200.0mmol)于二乙醚(200ml)中的冰冷溶液逐滴添加化合物s60b(15.0g,100.0mmol)于二乙醚中的溶液(注意:气体逸出且放热)。使反应混合物达到室温,且继续搅拌过夜。tlc显示反应完成,在此时将反应混合物通过添加水性硫酸钠小心地淬灭直到气体逸出停止且白色沉淀的形成终止。向该混合物小心地添加100ml的10%h2so4,并且分离各层。用3×75ml醚萃取水层,并且将合并的有机层用水、盐水洗涤,经硫酸钠干燥且浓缩以给出呈无色油状物的化合物s60c(14.6g,95%),该化合物无需进一步纯化而用于下一反应。1hnmr(500mhz,cdcl3):δ7.31(1h,dd,j7.5,1.5hz),7.20(1h,dd,j7.5,1.5hz),7.16-7.08(2h,m),3.91(2h,t,j6.5hz),3.41(1h,s),2.98(1h,j6.5hz)在室温下向二硫代二吡啶(52.0g,236.3mmol)和乙酸(3.0ml)于甲醇(200ml)中的溶液添加化合物s60c(14.6g,94.5mmol)于甲醇(50ml)中的溶液并且搅拌过夜。除去挥发物,并且向该残余物添加100ml的二乙醚。将分离的固体过滤且用二乙醚(3×50ml)洗涤。将合并的醚洗涤液浓缩以得到粗产物,该粗产物在使用isco手册快速硅胶柱纯化(乙酸乙酯/己烷,0%-50%)后得到14.1g(57%)的化合物s60。1hnmr(500mhz,cdcl3):δ8.48(1h,d,j5.0hz),7.65-7.60(3h,m),7.25-7.18(3h,m),7.13-7.10(1h,m),3.96(2h,t,j6.5hz),3.17(1h,t,j6.5hz)化合物s61在室温下向化合物s60(4.5g,17.0mmol)于30.0ml二氯甲烷中的溶液逐滴添加meotf。将反应混合物搅拌10分钟,之后添加叔丁基硫醇(1.9ml,17.0mmol)和diea(6.0ml,34.0mmol)。将反应混合物在室温下搅拌另外30分钟,之后在真空中浓缩。将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的产物s61(2.5g,61%产率)。1hnmr(500mhz):δ7.84(d,j5.0hz,1h),7.25-7.13(m,3h),3.92(t,j7.0hz,2h),3.12(t,j7.0hz,2h),1.30(s,9h)化合物s62如上文所报道使用acoh活化剂根据针对化合物s55描述的程序来制备化合物s62。1hnmr(500mhz,cdcl3):δ8.45(1h,s),7.78(1h,d,j8.0hz),7.64(1h,t,j8.0hz),7.09-7.04(1h,m),2.90-2.80(1h,m),2.06-1.98(2h,m),1.80-1.73(2h,m),1.63-1.56(1h,m),1.45-1.35(2h,m),1.33-1.18(3h,m)化合物s63如上文所报道使用meotf活化剂根据针对化合物s41描述的程序来制备化合物s63。1hnmr(500mhz,cdcl3):δ7.80(1h,d,j=8.0hz),7.30-7.23(1h,m),7.21-7.17(2h,m),3.90(2h,t,j6.5hz),3.09(2h,t,j6.5hz),2.82-2.70(1h,m),2.06-1.98(2h,m),1.80-1.72(2h,m),1.63-1.55(1h,m),1.41-1.18(5h,m)化合物s64如上文所报道使用meotf活化剂根据针对化合物s41描述的程序来制备化合物s64。1hnmr(500mhz,cdcl3):δ7.81(1h,d,j8.0hz),7.26-7.21(1h,m),7.19-7.13(2h,m),3.93(2h,t,j6.5hz),3.13(2h,t,j6.5hz),2.38-2.34(2h,m),1.90-1.86(2h,m),1.27(1h,s)化合物s65向化合物s57(1.13g,4.54mmol)和s64(1.24g,4.13mmol)于dmf(12ml)中的混合物添加hctu(2.56g,6.20mmol)和n,n-二异丙基乙胺(1.76ml,10.3mmol)。将混合物搅拌1小时,并且在高真空下除去挥发物以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,10%-70%)以给出呈无色油状物的1.28g(58%)的标题化合物s65。1hnmr(500mhz,cdcl3):δ7.81(1h,d,j8.0hz),7.47(2h,d,j8.0hz),7.21-7.10(3h,m),7.07(1h,t,j7.5hz),7.01(1h,d,j7.5hz),5.40(1h,s),4.92(1h,s,br),4.24(2h,d,j5.5hz),3.96(2h,d,j11.5hz),3.73(2h,t,j6.5hz),3.61(2h,d,j11.5hz),2.97(2h,t,j6.5hz),2.10-2.02(2h,m),1.84(2h,q,j7.5hz),1.81-1.76(2h,m),1.29(6h,s),1.15(2h,q,j7.5hz),0.90(3h,t,j7.5hz),0.82(3h,t,j7.5hz)化合物s66向2-甲基-2-巯基戊酸(0.74g,5.0mmol)和乙酸酐(0.52ml,5.5mmol)于乙腈(10.0ml)中的混合物添加三乙胺(1.39ml,10.0mmol)和dmap(5mg)。将混合物搅拌1小时,然后将苄胺(1.37ml,12.5mmol)添加至该混合物,并且继续搅拌过夜。在真空下除去挥发物以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,10%-70%)以给出呈无色油状物的0.70g(59%)的标题化合物s66。1hnmr(500mhz,cdcl3):δ7.36-7.32(2h,m),7.30-7.26(3h,m),5.73(1h,s),4.45(2h,d,j6.0hz),2.43-2.38(2h,m),1.98-1.94(2h,m),1.39(6h,s)化合物s67如上文所报道使用meotf活化剂根据针对化合物s41描述的程序来制备化合物s67。1hnmr(500mhz,cdcl3):δ7.81(1h,d,j8.0hz),7.37-7.26(3h,m),7.21-7.15(3h,m),7.08-7.02(2h,m),5.14(1h,s,br),4.28(2h,d,j5.5hz),3.89(2h,t,j6.5hz),3.08(2h,t,j6.5hz),2.12-2.05(2h,m),1.87-1.82(2h,m),1.29(6h,s)化合物s68向2-甲基-2-巯基戊酸(0.74g,5.0mmol)和乙酸酐(0.52ml,5.5mmol)于乙腈(10.0ml)中的混合物添加三乙胺(1.39ml,10.0mmol)和dmap(5mg)。将混合物搅拌1小时,然后将丙炔胺(0.69g,12.5mmol)添加至该混合物,并且继续搅拌过夜。在真空下除去挥发物以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,5%-55%)以给出呈白色固体的0.72g(59%)的标题化合物s68。1hnmr(500mhz,cdcl3):δ5.66(1h,s),4.06(2h,dd,j5.0,2.5hz),2.41-2.37(2h,m),2.23(1h,t,j2.5hz),1.95-1.91(2h,m),1.39(6h,s)化合物s69如上文所报道使用meotf活化剂根据针对化合物s41描述的程序来制备化合物s69。1hnmr(500mhz,cdcl3):δ7.83(1h,d,j8.0hz),7.30-7.16(3h,m),5.05(1h,s),3.95(2h,t,j6.5hz),3.88(2h,dd,j5.5,2.5hz),3.15(2h,t,j6.5hz),2.23(1h,t,j2.5hz),2.10-2.04(2h,m),1.83-1.79(2h,m),1.28(6h,s)化合物s72在0℃下向2-巯基-2-甲基丁-1-醇(1.2g,10mmol)于二氯甲烷(25.0ml)中的溶液添加tbdmscl(1.58g,10.5mmol)和咪唑(1.02g,15mmol)。将所得混合物搅拌30分钟,从而形成较大量的白色沉淀。将白色固体过滤,且用30.0ml的二氯甲烷洗涤。将滤液蒸发以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,0%-30%)以给出呈无色油状物的1.63g(71%)的标题化合物s72。1hnmr(500mhz,cdcl3):δ7.83(1h,d,j8.0hz),7.30-7.16(3h,m),5.05(1h,s),3.95(2h,t,j6.5hz),3.88(2h,dd,j5.5,2.5hz),3.15(2h,t,j6.5hz),2.23(1h,t,j2.5hz),2.10-2.04(2h,m),1.83-1.79(2h,m),1.28(6h,s)化合物s73如上文所报道使用meotf活化剂根据针对化合物s41描述的程序来制备化合物s73。1hnmr(500mhz,cdcl3):δ7.83(1h,d,j8.0hz),7.30-7.12(3h,m),3.91(2h,t,j6.5hz),3.68(2h,t,j7.0hz),3.12(2h,t,j6.5hz),1.83(1h,t,j6.5hz),1.28(6h,s),0.87(9h,s),0.03(6h,s)化合物s74向tbdmscl(6.7g,44.6mmol)和咪唑(6.3g,92.9mmol)于dmf(5.0ml)中的溶液添加三(羟甲基)甲胺(1.5g,12.4mmol)并且搅拌1小时。将混合物用水(15.0ml)稀释且用二氯甲烷(3×15.0ml)萃取。将合并的有机层经无水硫酸钠干燥,并且在真空中浓缩滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,0%-20%)以给出呈无色油状物的4.0g(70%)的s74。1hnmr(500mhz,cdcl3):δ3.48(6h,s),0.89(27h,s),0.04(18h,s)化合物s75向化合物s64(0.6g,2.0mmol)和s74(1.16g,2.5mmol)于dmf(10.0ml)中的混合物添加hatu(1.14g,3.0mmol)和n,n-二异丙基乙胺(0.85ml,5mmol)。将混合物搅拌1小时,在此时在高真空下除去挥发物以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,10%-40%)以给出呈无色油状物的0.60g(40%)的化合物s75。1hnmr(500mhz,cdcl3):δ7.81(1h,d,j8.0hz),7.26-7.12(3h,m),5.45(1h,s),3.92(2h,t,j6.5hz),3.80(6h,s),3.11(2h,t,j6.5hz),2.14-2.10(2h,m),1.90-1.86(2h,m),1.23(6h,s),0.90(27h,s),0.04(18h,s)化合物s76向tbdmscl(7.2g,48mmol)、n,n-二异丙基乙胺(5.0ml,29mmol)和dmap(50mg)于二氯甲烷(50.0ml)中的溶液添加2-氨基-1,3-丙-二醇(2.0g,22mmol),并且将混合物搅拌过夜。在高真空下除去挥发物以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,50%-100%,包含2%三乙胺)以给出呈无色油状物的1.2g(17%)的化合物s76。1hnmr(500mhz,cdcl3):δ3.70(2h,dd,j10.0,5.5hz),3.63(2h,dd,j10.0,5.5hz),3.04(1h,m),0.90(18h,s),0.07(12h,s)化合物s77向化合物s64(0.77g,2.56mmol)和s76(0.82g,2.56mmol)于dmf(10.0ml)中的混合物添加hatu(1.17g,3.07mmol)和n,n-二异丙基乙胺(0.87ml,5.12mmol)。将混合物搅拌1小时,并且在高真空下除去挥发物以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,10%-40%)以给出呈无色油状物的0.52g(34%)的标题化合物s77。1hnmr(500mhz,cdcl3):δ7.81(1h,d,j7.5hz),7.26-7.12(3h,m),5.59(1h,d,j8.5hz),3.94(2h,t,j6.5hz),3.92-3.82(1h,m),3.68(2h,dd,j13.5,4.5hz),3.50(2h,dd,j9.5,6.5hz),3.12(2h,t,j6.5hz),2.16-2.10(2h,m),1.92-1.84(2h,m),1.26(6h,s),0.90(18h,s),0.07(12h,s)化合物s78如上文所报道使用acoh活化剂根据针对化合物s55描述的程序来制备化合物s78。1hnmr(500mhz,cdcl3):δ8.47(1h,d,j4.5hz),7.70-7.60(2h,m),7.52(2h,d,j8.5hz),7.31(2h,d,j8.5hz),7.10(1h,t,j6.0hz),4.67(2h,s)化合物s79如上文所报道使用meotf活化剂根据针对化合物s41描述的程序来制备化合物s79。1hnmr(500mhz,cdcl3):δ7.55(2h,d,j8.0hz),7.29(2h,d,j8.0hz),4.67(2h,s),1.31(9h,s)化合物s83根据在以上方案中概述的程序来制备化合物s83。化合物s84在氩下将7-甲基苯并[b]噻吩(0.74g,5mmol)溶解于醚中,且将溶液冷却至0℃。添加正丁基锂(2.0ml的于己烷中2.5m,5mmol),同时将温度维持在0℃-5℃下。将混合物在0℃下搅拌10分钟,然后在室温下搅拌45分钟。然后,将混合物冷却至0℃,并且逐滴添加硼酸三丁酯(1.47ml,5.5mmol)。在0℃下搅拌1小时之后,将混合物升温至室温且静置过夜,在此时将反应用1m盐酸淬灭。用醚萃取水相,且用水性氢氧化钠(1m)萃取醚层。将碱性水层用浓盐酸酸化至ph2并且用醚(2x50ml)萃取。将合并的有机层经无水na2so4干燥。在真空中蒸发剂以给出呈白色固体的粗s84(0.80g)。化合物s85向粗s84(0.80g,4.2mmol)于etoh(10.0ml)中的溶液逐滴添加过氧化氢(30%,1.4ml)。在搅拌过夜之后,将反应混合物在减压下小心地浓缩,用水(30ml)稀释且用乙酸乙酯(20ml×3)萃取。将合并的有机层经无水硫酸钠干燥,并且在真空中浓缩以得到一种残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,0%-20%)以给出呈无色油状物的0.51g(74%)的化合物s85。1hnmr(500mhz,cdcl3):δ7.13(3h,s),4.00(2h,s),2.31(3h,s)化合物s86向s85(0.51g,3.1mmol)于etoh(5ml)中的溶液一次性添加nabh4(0.59g,15.5mmol),并且将混合物回流15分钟且冷却至室温。蒸发挥发物以得到一种白色浆料,将该浆料溶解于水中且用1mhcl酸化至ph2。将混合物用二氯甲烷(3×20ml)萃取且将合并的有机层用盐水洗涤,经无水硫酸钠干燥,且在真空中浓缩以给出呈无色油状物的粗化合物s86。1hnmr(500mhz,cdcl3):δ7.11-7.04(3h,m),3.92(2h,t,j6.5hz),3.30(1h,s),3.05(2h,t,j6.5hz),2.39(3h,s)化合物s87向二硫代二吡啶(1.7g,7.8mmol)和乙酸(0.03ml)于meoh(10ml)中的溶液添加于meoh(5ml)中的粗s86。将反应混合物搅拌30分钟且蒸发以给出黄色残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,0%-40%)以给出呈无色油状物的0.38g(44%)的化合物s87。1hnmr(500mhz,cdcl3):δ8.49(1h,d,j5.0hz),7.64-7.58(2h,m),7.19(1h,t,j7.0hz),7.13(2h,t,j6.5hz),3.83(2h,t,j7.0hz),3.26(2h,t,j6.5hz),2.55(3h,s)化合物s88在室温下向化合物s87(0.57g,2.0mmol)于10.0ml二氯甲烷中的溶液添加meotf(0.36g,2.0mmol)。将反应混合物搅拌10分钟,在此时添加叔丁基硫醇(0.23ml,2.2mmol)和二异丙基乙胺(0.5ml)。将反应混合物在室温下搅拌另外30分钟,之后在真空中浓缩。将粗混合物根据isco手册使用快速硅胶柱纯化(乙酸乙酯/己烷,0%-50%)进行纯化以给出呈无色油状物的化合物s88(0.46g,87%)。1hnmr(500mhz):δ7.17(1h,t,j7.0hz),7.11(m,2h),3.89(2h,t,j7.0hz),3.34(2h,t,j7.0hz),2.64(3h,s),1.27(s,9h)化合物s89向5-溴苯并[b]噻吩-2-硼酸(1.0g,3.90mmol)于etoh(12.0ml)中的溶液逐滴添加过氧化氢(30%,1.5ml)。在搅拌过夜之后,将反应混合物在减压下小心地浓缩,用水(30ml)稀释且用乙酸乙酯(20ml×3)萃取。将合并的有机层经无水硫酸钠干燥,并且在真空中浓缩以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,0%-20%)以给出呈无色油状物的0.64g(72%)的化合物s89。1hnmr(500mhz,cdcl3):δ7.44(1h,s),7.43(1h,d,j8.0hz),7.21(1h,d,j8.0hz),3.96(2h,s)化合物s90向s89(0.64g,2.8mmol)于etoh(10ml)中的回流溶液一次性添加nabh4(0.53g,13.9mmol)。将反应混合物回流另外15分钟并且冷却至室温,将挥发物蒸发以得到白色浆料,将该白色浆料溶解于水中,并且将溶液用1mhcl酸化至ph2。将水层用二氯甲烷(3×20ml)萃取且将合并的有机层用盐水洗涤,经无水硫酸钠干燥,且在真空中浓缩以得到呈白色固体的粗化合物s90。1hnmr(500mhz,cdcl3):δ7.37(1h,s),7.23(1h,d,j8.0hz),7.18(1h,d,j8.0hz),3.90(2h,t,j6.5hz),3.42(1h,s),2.94(2h,t,j6.5hz)化合物s91向二硫代二吡啶(1.84g,8.34mmol)和乙酸(0.03ml)于meoh(10ml)中的溶液添加于meoh(5ml)中的粗s90,并且将混合物搅拌30分钟,然后蒸发以给出黄色残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,0%-40%)以给出呈无色油状物的0.50g(对于两个步骤53%)的化合物s91。1hnmr(500mhz,cdcl3):δ8.47(1h,d,j5.0hz),7.64-7.58(3h,m),7.31-7.26(2h,m),7.13(1h,m),3.95(2h,t,j6.5hz),3.12(2h,t,j6.5hz)化合物s92在室温下向化合物s91(0.50g,1.47mmol)于10.0ml二氯甲烷中的溶液添加meotf(0.24g,1.47mmol)。将反应混合物搅拌10分钟,在此时添加叔丁基硫醇(0.18ml,1.62mmol)和n,n-二异丙基乙胺(0.5ml)。将反应混合物在室温下搅拌另外30分钟,并且在真空中浓缩。将粗混合物根据isco手册使用快速硅胶柱纯化(乙酸乙酯/己烷溶剂,0%-50%)进行纯化以给出呈无色油状物的化合物s92(0.37g,78%)。1hnmr(500mhz):δ7.72(2h,d,j8.5hz),7.34(2h,m),3.91(2h,t,j7.0hz),3.07(2h,t,j7.0hz),1.29(s,9h)化合物s93在氩下将4-甲基苯并噻吩(1.0g,6.75mmol)溶解于醚中,且将溶液冷却至0℃。添加正丁基锂(2.7ml的于己烷中2.5m,6.75mmol),同时将温度维持在0℃-5℃下。将混合物在0℃下搅拌10分钟,然后在室温下搅拌45分钟,再次冷却至0℃,并且逐滴添加硼酸三丁酯(1.99ml,7.43mmol)。将反应混合物在0℃下搅拌1小时,然后升温至室温,并使其静置过夜,然后用1m盐酸淬灭。将水相用醚(2×30ml)萃取,且将合并的有机层用水性氢氧化钠(1m)洗涤。将碱性水层用浓盐酸酸化至ph2并且用醚(2x30ml)萃取。将合并的有机层经无水na2so4干燥。将溶剂在真空中蒸发以给出呈白色固体的粗s93(1.05g,81%),其无需进一步纯化而直接用于下一步骤中。1hnmr(500mhz,cd3od):δ7.93(1h,s),7.70(1h,d,j8.0hz),7.25(1h,t,j7.0hz),7.13(1h,d,j7.0hz),7.04(1h,d,j7.0hz),2.62(3h,s)化合物s94向粗s93(1.05g,5.5mmol)于etoh(10.0ml)中的溶液逐滴添加过氧化氢(30%,1.0ml)。在搅拌过夜之后,将反应混合物在减压下小心地浓缩,用水(30ml)稀释且用乙酸乙酯(3×20ml)萃取。将合并的有机层经无水硫酸钠干燥,并且在真空中浓缩以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-15%)以给出呈无色油状物的0.80g(89%)的标题化合物s94。1hnmr(500mhz,cdcl3):δ7.23-7.17(2h,m),7.04(1h,d,j7.0hz),3.85(2h,s),2.28(3h,s)。化合物s95向s94(0.69g,4.2mmol)于etoh(25ml)中的回流溶液一次性添加nabh4(0.79g,21mmol)。使混合物回流另外15分钟,然后冷却至室温。将混合物蒸发以得到白色浆料,将该浆料溶解于水中。将混合物用1mhcl酸化至ph2。将混合物用二氯甲烷(3x20ml)萃取。将合并的有机层用盐水洗涤,经无水硫酸钠干燥,并且在真空中浓缩以得到一种残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=0%-40%)以给出呈无色油状物的0.67g(95%)的标题化合物s95。1hnmr(500mhz,cdcl3):δ7.16(1h,m),7.00-6.96(2h,m),3.86(2h,t,j7.0hz),3.44(1h,s),3.06(2h,t,j7.0hz),2.35(3h,s)化合物s96向二硫代二吡啶(2.64g,12.0mmol)和乙酸(0.1ml)于meoh(60ml)中的溶液添加s95(0.66g,3.94mmol)于meoh(5ml)中的溶液。将混合物搅拌30分钟且蒸发以给出黄色残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=0%-40%)以给出呈无色油状物的1.09g(100%)的标题化合物s96。1hnmr(500mhz,cdcl3):δ8.49(1h,d,j4.5hz),7.64-7.58(2h,m),7.50(1h,dd,j7.0,2.5hz),7.11(1h,m),7.08-7.02(2h,m),3.91(2h,t,j7.0hz),3.25(2h,t,j7.0hz),2.38(3h,s)化合物s97在室温下向化合物s96(0.69g,2.5mmol)于10.0ml二氯甲烷中的溶液添加meotf(0.41g,2.5mmol)。将反应混合物搅拌10分钟,在此时添加叔丁基硫醇(0.34ml,3.0mmol)和二异丙基乙胺(0.5ml),并且在室温下继续搅拌另外30分钟。将所得混合物在真空中浓缩。将粗混合物根据isco手册使用快速硅胶柱纯化(乙酸乙酯/己烷溶剂=0%-40%)进行纯化以给出呈无色油状物的化合物s97(0.45g,70%)。1hnmr(500mhz):δ7.71(1h,d,j8.0hz),7.12(1h,t,j8.0hz),7.01(1h,d,j8.0hz),3.86(2h,t,j7.0hz),3.21(2h,t,j7.0hz),2.37(3h,s),1.30(s,9h)化合物s98在0℃下在氩气氛下将氢化钠(于油中60%)(1.80g,45.0mmol)和叔丁基甲醚(15ml)添加至圆底烧瓶。向该混合物中逐滴添加2,5-二甲基苯硫醇(4.07ml,30.0mmol)于叔丁基甲醚(15ml)中的溶液,接着添加二甲基氨基甲酰氯(3.03ml,33.0mmol)于叔丁基甲醚(10ml)中的溶液。将反应混合物加热至60℃,搅拌1.5小时,且确认起始材料的消失。将混合物在冰浴中冷却并且用1m盐酸(20ml)中和。将水层用醚(2×30ml)萃取,并且将有机层合并且用水性1m氢氧化钠、水和盐水洗涤。在经无水硫酸钠干燥有机层之后,将滤液蒸发以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-50%)以给出呈无色油状物的标题化合物s98(5.15g,82%)。1hnmr(500mhz,cdcl3):δ7.30(1h,s),7.18(1h,d,j8.0hz),7.11(1h,d,j8.0hz),3.15-3.00(6h,brs),2.36(3h,s),2.30(3h,s)化合物s99在0℃下向lda(12.5ml,于thf中2m,25mmol)于叔丁基甲醚(35ml)中的溶液逐滴添加二甲基-硫代氨基甲酸s-(2,3-二甲基苯基)酯(s98,2.09g,10mmol)于叔丁基甲醚(8ml)中的溶液,且将所得混合物在0℃下搅拌30分钟。将反应混合物通过添加6ml的乙酸、接着添加2ml的37%hcl水溶液和水淬灭,并且将温度升至接近室温,且分离各相。将水层用乙酸乙酯(2×50ml)萃取,并且将有机层合并且用盐水洗涤。在经硫酸镁干燥有机层之后,将滤液在减压下浓缩以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-25%)以给出呈白色固体的标题化合物s99(0.98g,60%)。1hnmr(500mhz,cdcl3):δ7.16(2h,s),7.01(1h,d,j8.0hz),3.92(2h,s),2.36(3h,s)化合物s100向s99(0.98g,6.0mmol)于etoh(30ml)中的回流溶液一次性添加nabh4(1.13g,30mmol)。使混合物回流另外15分钟,且冷却至室温。将混合物蒸发以给出白色浆料,将该浆料溶解于水中且用1mhcl酸化至ph2。将该混合物用二氯甲烷(3x20ml)进行萃取。将合并的有机层用盐水洗涤,经无水硫酸钠干燥且真空浓缩以给出呈无色油状物的粗标题化合物s100。1hnmr(500mhz,cdcl3):δ7.14(1h,s),7.08(1h,d,j8.0hz),6.94(1h,d,j8.0hz),3.88(2h,t,j6.5hz),3.36(1h,s),2.94(2h,t,j6.5hz),2.28(3h,s)化合物s101向二硫代二吡啶(4.0g,18mmol)和乙酸(0.1ml)于meoh(70ml)中的溶液添加于meoh(10ml)中的化合物s100。将反应混合物搅拌30分钟,蒸发以给出黄色残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=0%-40%)以给出呈无色油状物的1.55g(在两个步骤中93%)的标题化合物s101。1hnmr(500mhz,cdcl3):δ8.49(1h,d,j4.5hz),7.65-7.61(2h,m),7.45(1h,s),7.13-7.11(2h,m),7.01(1h,d,j8.0hz),3.92(2h,t,j6.5hz),3.13(2h,t,j6.5hz),2.25(3h,s)化合物s102在室温下向化合物s101(0.69g,2.5mmol)于10.0ml二氯甲烷中的溶液添加meotf(0.41g,2.5mmol)。将反应混合物搅拌10分钟,在此时添加叔丁基硫醇(0.34ml,3.0mmol)和n,n-二异丙基乙胺(0.5ml),并且在室温下继续搅拌另外30分钟。将所得混合物在真空中浓缩。将粗混合物根据isco手册使用快速硅胶柱纯化(乙酸乙酯/己烷溶剂=0%-40%)进行纯化以给出呈无色油状物的化合物s102(0.49g,77%)。1hnmr(500mhz):δ7.64(1h,s),7.06(1h,d,j8.0hz),6.95(1h,d,j8.0hz),3.89(2h,t,j7.0hz),3.08(2h,t,j7.0hz),2.36(3h,s),1.30(s,9h)。化合物s103向叔丁基硫醇(4.5g,50mmol)于乙醇(150ml)中的溶液添加二硫代二吡啶(12.1g,55.0mmol)和乙酸(3.5ml)。将混合物搅拌过夜,蒸发以给出残余物,将该残余物溶解于100ml的乙酸乙酯中。将溶液用1nnaoh(50ml×3)和盐水洗涤。将有机层经无水na2so4干燥,过滤且蒸发以给出残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷,5%-20%)以给出呈无色油状物的7.3g(73%)的标题化合物s103。1hnmr(500mhz,cdcl3):δ8.44(1h,d,j5.0hz),7.75(1h,d,j8.0hz),7.63(1h,td,j8.0,1.5hz),7.06(1h,m),1.33(9h,s)化合物s104向s103(1.81g,9.0mmol)于己烷(30ml)中的溶液中添加meotf(1.48g,9.0mmol)。将混合物搅拌15分钟,过滤所得沉淀,并且用己烷(10mlx3)洗涤。将分离的白色固体在真空下干燥,以给出粗s104,其不经进一步纯化即用于下一反应。化合物s105向s104(9.0mmol)在dmf(5ml)中的溶液中添加2-巯基咪唑(0.90g,9.0mmol),以形成黄色混合物。将混合物搅拌30分钟,此时添加二异丙基乙胺(1ml)和水(4ml)。添加水(20ml)后,形成沉淀,将其过滤,用水洗涤,然后用己烷洗涤,并且真空干燥,以给出呈白色固体的1.13g(两步骤中为67%)s105。1hnmr(500mhz,cdcl3):δ7.11(1h,s),1.33(9h,s)化合物s106在0℃下,在氩气下,向nah(0.38g,60%在矿物油中,9.4mmol)在thf(5ml)中的悬浮液中添加在thf(2ml)中的s105(0.89g,4.7mmol)。将得到的混合物升温至室温并搅拌1小时。将反应混合物冷却至0℃,添加碳酸亚乙酯(0.50g,5.6mmol)在thf(3ml)中的溶液,并且将所得混合物升温至室温并搅拌过夜。添加饱和nh4cl水溶液以猝灭反应,并将所得混合物用乙酸乙酯(20mlx3)萃取。将合并的有机层用盐水洗涤,并且用无水na2so4干燥,过滤,并且蒸发,以给出残余物,使用isco手册通过快速硅胶柱纯化(乙酸乙酯/二氯甲烷,10%-100%),以给出呈白色固体的0.39g(35%)化合物s106。1hnmr(500mhz,cdcl3):δ7.16(1h,d,j1.0hz),7.06(1h,d,j1.0hz),4.28(1h,t,j5.0hz),4.00(1h,t,j5.0hz),1.36(9h,s)化合物s107在氮气下,向配备有磁力搅拌棒和隔膜的火焰干燥的500-ml施兰克烧瓶中添加双(n,n-二异丙基氨基)氯膦(2.66g,10mmol),无水乙醚(200ml),并且将混合物冷却至0℃。向该溶液中,在15分钟内通过注射器逐滴添加乙炔基溴化镁(在thf中0.5m,11mmol),并将反应混合物在0℃下搅拌1小时。使混合物达到室温,在氮气下过滤,并将溶液在旋转蒸发器上浓缩。将所得粘稠油用无水己烷萃取三次,在此期间油转化成固体。然后将固体溶于最小体积的无水乙腈中,并且将所得溶液用无水己烷萃取两次。将己烷部分合并并在真空中浓缩,以给出半透明的白色油s107(2.3g,90%),其无需进一步纯化即可使用。连接至二硫键联的苯并咪唑的制备n-甲基1-羟乙基2-巯基4,5-苯并咪唑连接子(bim9)的制备:可商购的2-氯-4-硝基-甲苯(bim1)可以在碱性条件下与多聚甲醛同素化以提供苯乙醇(bim2)。其他碱可包括但不限于naoet、kotbu、diea、tea、dbu、以及无机碱。4-硝基基团的氢化和甲酰化可以得到bim4。在bim4硝化为bim5之后,可以通过用na2s处理引入一个硫醇基团以得到硫醇(bim6)。在加热下通过一种还原铁催化剂还原5-硝基可伴随得到2-巯基苯并咪唑(bim7)。在转化成硫代吡啶(bim8)之后,用meotf活化且用叔丁基硫醇(r=hs-tbu)处理可以产生(bim9)。连接至二硫键联的peg链的制备用于合成二硫化物peg侧链的通用程序:在室温下向羧酸s5(1.98mmol)和mpegn-nh2(1.98mmol)于无水二甲基甲酰胺(5.0ml)中的溶液以该次序顺序地添加hatu(2.97mmol)和n,n-二异丙基乙胺(2.97mmol),并且将所得混合物搅拌2小时。tlc显示反应完成。在真空下除去二甲基甲酰胺,并且将残余物溶解于ch2cl2(10.0ml)中。将混合物用盐水(10ml×2)洗涤,并且将有机层经无水na2so4干燥且蒸发以给出粗化合物。使用isco手册的硅胶柱纯化(甲醇/二氯甲烷,0%-10%)给出呈粘稠浆液的化合物。亚磷酰胺和其他单体化合物u1在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷(3.9g,5.6mmol)和n,n-二异丙基乙胺(1.1ml,6.16mmol)于25.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(1.64g,6.16mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌1小时。逐滴添加s8(1.0g,5.6mmol)于5.0ml无水二氯甲烷中的溶液并且搅拌10分钟,之后分批添加二异丙基铵四氮唑(diat)(1.0g,5.88mmol)于5.0ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时。将粗混合物用200ml的二氯甲烷稀释,并且用饱和nahco3溶液(50ml)和盐水(50ml)顺序洗涤,然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的2.32g(48%)的产物u1(非对映异构体混合物)。c44h59fn3o8ps2的esims计算值872.05,观测值871.0[m-h]+。31pnmr(202mhz,cdcl3):δ150.7(d,j7.5hz),150.0(d,j9.3hz)。化合物c1在氩气氛下向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-胞苷(n-pac)(3.8g,5.6mmol)和n,n-二异丙基乙胺(1.1ml,6.16mmol)于25.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(1.64g,6.16mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s8(1.0g,5.6mmol)于5.0ml无水二氯甲烷中的溶液并且搅拌10分钟,之后分批添加二异丙基铵四氮唑(1.0g,5.88mmol)于5.0ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时。将粗混合物用200ml的二氯甲烷稀释,并且用饱和nahco3溶液(50ml)和盐水(50ml)顺序洗涤,然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的1.43g(26%)的产物c1(非对映异构体混合物)。c52h66fn4o9ps2的esims计算值1005.2,观测值1004.0[m-h]+。31pnmr(202mhz,cdcl3):δ150.6(d,j6.5hz),150.0(d,j5.5hz)。化合物a1在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-o-甲基-腺苷(n-pac)(4.02g,5.6mmol)和n,n-二异丙基乙胺(1.1ml,6.16mmol)于25.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(1.64g,6.16mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s8(1.0g,5.6mmol)于5.0ml无水二氯甲烷中的溶液并且将反应混合物搅拌10分钟,之后分批添加二异丙基铵四氮唑(1.0g,5.88mmol)于5.0ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时。将粗混合物用200ml的二氯甲烷稀释,并且用饱和nahco3溶液(50ml)和盐水(50ml)顺序洗涤,然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的1.99g(35%)的产物a1(非对映异构体混合物)。c54h69n6o9ps2的esims计算值1041.26,观测值1040.4[m-h]+。31pnmr(202mhz,cdcl3):δ150.4,149.5。化合物g1在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-o-甲基-鸟苷(正-异丙基-pac)(3.2g,4.1mmol)和n,n-二异丙基乙胺(0.78ml,4.5mmol)于20.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(1.2g,4.5mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s8(0.74g,4.1mmol)于5.0ml无水二氯甲烷中的溶液并且将所得混合物搅拌10分钟,在此时分批添加二异丙基铵四氮唑(0.74g,4.3mmol)于5.0ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时。将粗混合物用100ml的二氯甲烷稀释,通过饱和nahco3溶液(25ml)和盐水(25ml)顺序洗涤,并且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-100%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的0.60g(13%)的产物g1(非对映异构体混合物)。c57h75n6o10ps2的esims计算值1099.34,观测值1098.2[m]+。31pnmr(202mhz,cdcl3):δ150.5,149.9。化合物u2在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷(0.36g,0.65mmol)和n,n-二异丙基乙胺(0.13ml,0.72mmol)于10.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(0.19g,0.72mmol)于3.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s13(0.15g,0.65mmol)于3.0ml无水二氯甲烷中的溶液并且将所得混合物搅拌10分钟,在此时分批添加二异丙基铵四氮唑(0.11g,0.65mmol)于3.0ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时。将粗混合物用50ml的二氯甲烷稀释,用饱和nahco3溶液(20ml)和盐水(20ml)顺序洗涤,并且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的0.12g(20%)的产物u2(非对映异构体混合物)。c46h57fn3o9ps2的esims计算值910.0,观测值909[m-h]+。31pnmr(202mhz,cdcl3)δ151.3(d,j8.5hz),151.2(d,j10.5hz)。化合物u3在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷(0.73g,1.32mmol)和n,n-二异丙基乙胺(0.25ml,1.45mmol)于15.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(0.39g,1.45mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s18(0.32g,1.32mmol)于5.0ml无水二氯甲烷中的溶液并且将所得混合物搅拌10分钟,在此时分批添加乙硫基四唑于乙腈(0.25m,3.2ml,0.80mmol)中的溶液。将反应混合物在室温下进一步搅拌3小时。将粗混合物用100ml的二氯甲烷稀释,用饱和nahco3溶液(40ml)和盐水(40ml)顺序洗涤,并且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的0.17g(20%)的产物u3(非对映异构体混合物)。c48h59fn3o8ps2的esims计算值920.0,观测值943.0[m+na]+。31pnmr(202mhz,cdcl3):δ156.3(d,j7.3hz),155.6(d,j11.3hz)。化合物u4在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷(1.77g,3.2mmol)和n,n-二异丙基乙胺(0.62ml,3.54mmol)于20.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(0.94g,3.54mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s20(0.67g,3.22mmol)于5.0ml无水二氯甲烷中的溶液并且将所得混合物搅拌10分钟,在此时分批添加乙硫基四唑于乙腈(0.25m,7.7ml,1.93mmol)中的溶液。将反应混合物在室温下进一步搅拌3小时。将粗混合物用100ml的二氯甲烷稀释,用饱和nahco3溶液(30ml)和盐水(30ml)顺序洗涤,并且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的1.48g(52%)的产物u4(非对映异构体混合物)。c45h61fn3o8ps2的esims计算值886.08,观测值884.8[m-h]+。31pnmr(202mhz,cdcl3)δ150.6(d,j6.8hz),149.9(d,j9.1hz)。化合物u5在氩气氛下向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷(0.66g,1.2mmol)和n,n-二异丙基乙胺(0.23ml,1.32mmol)于10.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(0.35g,1.32mmol)于3.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s23(0.58g,1.2mmol)于3.0ml无水二氯甲烷中的溶液并且将所得混合物搅拌10分钟,在此时分批添加乙硫基四唑于乙腈(0.25m,2.9ml,0.72mmol)中的溶液。将反应混合物在室温下进一步搅拌3小时。将粗混合物用50ml的二氯甲烷稀释,通过饱和nahco3溶液(20ml)和盐水(20ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-40%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的0.35g(27%)的产物u5(非对映异构体混合物)。c61h82fn4o11ps2的esims计算值1161.42,观测值1162[m+h]+。31pnmr(202mhz,cdcl3)δ154.87(d,j7.3hz),154.53(d,j9.0hz)。化合物a2在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-o-甲基-腺苷(n-pac)(1.48g,2.1mmol)和n,n-二异丙基乙胺(0.4ml,2.28mmol)于15.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(0.61g,2.28mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s23(1.0g,2.1mmol)于5.0ml无水二氯甲烷中的溶液并且将所得混合物搅拌10分钟,在此时分批添加二异丙基铵四氮唑(0.35g,2.1mmol)于5.0ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时。将粗混合物用75.0ml的二氯甲烷稀释,通过饱和nahco3溶液(25ml)和盐水(25ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-60%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的1.01g(37%)的产物a2(非对映异构体混合物)。c71h92n7o12ps2的esims计算值1330.63,观测值1331.3[m+h]+。31pnmr(202mhz,cdcl3)δ154.93&154.29。化合物c2在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-胞苷(n-pac)(1.4g,2.1mmol)和n,n-二异丙基乙胺(0.4ml,2.28mmol)于15.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(0.61g,2.28mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s23(1.0g,2.1mmol)于5.0ml无水二氯甲烷中的溶液,将所得混合物搅拌10分钟,在此时分批添加二异丙基铵四氮唑(0.35g,2.1mmol)于5.0ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时。将粗混合物用75ml的二氯甲烷稀释,通过饱和nahco3溶液(25ml)和盐水(25ml)顺序洗涤,并且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的0.75g(29%)的产物c2(非对映异构体混合物)。c69h89fn5o12ps2的esims计算值1294.57,观测值1295.2[m+h]+。31pnmr(202mhz,cdcl3)δ154.77(d,j5.6hz),154.69(d,j7.7hz)。化合物u6在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s6(0.34g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.17g,1.0mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。然后将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物用无水硫酸钠干燥。在真空中蒸发挥发物以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=20%-55%)以给出呈无色泡沫的0.50g(49%)的化合物u6。c53h68fn4o9ps2的esims计算值1018.4,观测值1018.1(m+)。31pnmr(202mhz,cdcl3):δ150.15(d,j6.9hz),149.65(d,j8.7hz)。化合物u7在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s4(0.33g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中除去挥发物以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=20%-55%)以给出呈无色泡沫的0.15g(15%产率)的化合物u7。c52h66fn4o9ps2的esims计算值1004.4,观测值1004.0(m+)。31pnmr(202mhz,cdcl3):δ50.16(d,j7.9hz),149.65(d,j10.7hz)。化合物u8在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s7(0.18g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中浓缩以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=10%-55%)以给出呈无色泡沫的0.30g(35%)的标题化合物u8。c43h57fn3o8ps2的esims计算值857.3,观测值856.9(m+)。31pnmr(202mhz,cdcl3):δ150.76(d,j7.7hz),150.03(d,j9.3hz)。化合物u9在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s27(0.54g,1.0mmol)于20.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将反应混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中蒸发滤液以得到残余物,使该残余物经受在isco手册仪器上的快速硅胶柱纯化(乙腈/二氯甲烷=30%-90%)以给出呈无色泡沫的0.68g(56%)的标题化合物u9。c63h85fn5o12ps2的esims计算值1217.5,观测值1217.2(m+)。31pnmr(202mhz,cdcl3):δ150.18(d,j5.7hz),148.40(d,j11.1hz)。化合物u10在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.16g,0.61mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.32g,0.58mmol)和n,n-二异丙基乙胺(0.11ml,0.61mmol)于无水ch2cl2(5ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s28(0.18g,0.58mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.10g,0.61mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将反应混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中蒸发挥发物以得到残余物,使该残余物经受在isco手册仪器上的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=10%-55%)以给出呈无色泡沫的0.15g(26%)的标题化合物u10。c49h71fn3o9ps2si的esims计算值987.4,观测值987.0(m+)。31pnmr(202mhz,cdcl3):δ150.88(s),150.08(d,j9.3hz)。化合物u11在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s31(0.18g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将反应混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中浓缩以得到残余物,使该残余物经受在isco手册仪器上的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=10%-55%)以给出呈无色泡沫的0.38g(44%)的标题化合物u11。c44h59fn3o8ps2的esims计算值871.3,观测值870.8(m+)。31pnmr(202mhz,cdcl3):δ150.84(d,j7.6hz),150.73(d,j7.6hz)150.06(d,j9.1hz),150.02(d,j9.1hz)。化合物u12在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至s32(0.18g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将2-乙硫基四唑(2.4ml,于乙腈中0.25m,0.6mmol)的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将反应混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中蒸发滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=10%-55%)以给出呈无色泡沫的0.47g(53%)的标题化合物u12。c45h61fn3o8ps2的esims计算值885.4,观测值884.7(m-1)。31pnmr(202mhz,cdcl3):δ150.88(d,j7.7hz),150.03(d,j9.5hz)。化合物u13在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.26g,0.97mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至s34(0.19g,0.92mmol)和n,n-二异丙基乙胺(0.17ml,0.97mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.50g,0.92mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将2-乙硫基四唑(ett)(2.6ml,于乙腈中0.25m,0.65mmol)的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中蒸发滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=10%-55%)以给出呈无色泡沫的0.29g(36%)的标题化合物u13。c45h61fn3o8ps2的esims计算值885.4,观测值885.2(m+)。31pnmr(202mhz,cdcl3):δ150.91(d,j7.7hz),150.76(d,j7.7hz),150.07(d,j9.1hz),150.02(d,j9.5hz)。化合物u14在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s36(0.22g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将反应混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中浓缩滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=10%-55%)以给出呈无色泡沫的0.37g(41%)的标题化合物u14。c46h63fn3o8ps2的esims计算值899.4,观测值900.7(m+1)。31pnmr(202mhz,cdcl3):δ155.32(d,j7.7hz),154.72(d,j9.3hz)。化合物u15在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s37(0.22g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将反应混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将有机层经无水硫酸钠干燥,并且在真空中浓缩滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=10%-55%)以给出呈无色泡沫的0.34g(38%)的标题化合物u15。c46h61fn3o8ps2的esims计算值897.4,观测值896.7(m-1)。31pnmr(202mhz,cdcl3):δ150.73(d,j7.7hz),150.01(d,j9.5hz)。化合物u16在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s38(0.25g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将有机层经无水硫酸钠干燥,并且在真空中蒸发滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(具有5%甲醇的乙酸乙酯/己烷=10%-55%)以给出呈无色泡沫的0.38g(41%)的标题化合物u16。c48h65fn3o8ps2的esims计算值925.4,观测值926.5(m+1)。31pnmr(202mhz,cdcl3):δ150.78(d,j6.9hz),150.02(d,j9.5hz)。化合物u17在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s39(0.24g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将有机层经无水硫酸钠干燥,并且在真空中蒸发滤液以得到一种残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=10%-55%)以给出呈无色泡沫的0.24g(26%)的标题化合物u17。c48h59fn3o8ps2的esims计算值919.3,观测值920.7(m+1)。31pnmr(202mhz,cdcl3):δ155.41(d,j7.1hz),154.73(d,j8.9hz)。化合物u18在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s41(0.32g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将反应混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将有机层经无水硫酸钠干燥,并且在真空中蒸发滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=10%-55%)以给出呈无色泡沫的0.25g(25%)的标题化合物u18。c50h73fn3o9ps2si的esims计算值1001.4,观测值1003.1(m+2)。31pnmr(202mhz,cdcl3):δ155.67(d,j7.7hz),154.81(d,j9.7hz)。化合物u19在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s44(0.23g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将混合物经无水硫酸钠干燥,并且在真空中浓缩滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化((具有5%甲醇的乙酸乙酯)/己烷=10%-55%)以给出呈无色泡沫的0.24g(27%)的标题化合物u19。c47h57fn3o8ps2的esims计算值905.3,观测值907.0(m+2)。31pnmr(202mhz,cdcl3):δ154.74(d,j8.9hz),154.53(d,j7.7hz)。化合物u20在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.57g,2.14mmol)于无水ch2cl2(2.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(1.11g,2.0mmol)和n,n-二异丙基乙胺(0.37ml,2.14mmol)于无水ch2cl2(10.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s45(0.72g,2.0mmol)于5.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.37g,2.14mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将有机层经无水硫酸钠干燥,并且在真空中蒸发滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(etoac/己烷,包含2.5%meoh)以给出呈无色油状物的0.45g(23%)的标题化合物u20。31pnmr(202mhz,cdcl3):δ150.13(d,j6.5hz),149.13(d,j9.1hz)化合物u21在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s46(0.44g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将有机层经无水硫酸钠干燥,并且在真空中浓缩滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(甲醇/二氯甲烷=1%-8%)以给出呈无色油状物的0.30g(27%)的标题化合物u21。c55h80fn4o13ps2的esims计算值1118.5,观测值1118.3(m+)。31pnmr(202mhz,cdcl3):δ150.15(d,j6.5hz),149.23(d,j9.1hz)。化合物u22在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.38g,1.41mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.74g,1.34mmol)和n,n-二异丙基乙胺(0.25ml,1.41mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s47(0.75g,1.22mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.24g,1.41mmol)于10ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将有机层经无水硫酸钠干燥,并且在真空中浓缩滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(甲醇/二氯甲烷=1%-8%)以给出呈无色油状物的0.56g(32%)的标题化合物u22。c63h96fn4o17ps2的esims计算值1294.6,观测值1294.4(m+)。31pnmr(202mhz,cdcl3):δ150.15(d,j7.1hz),149.21(d,j9.5hz)。化合物u23在-78℃下,将双-(n,n-二异丙基氨基)-氯膦(0.28g,1.05mmol)于无水ch2cl2(1.0ml)中的溶液逐滴添加至5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(0.55g,1.0mmol)和n,n-二异丙基乙胺(0.18ml,1.05mmol)于无水ch2cl2(5.0ml)中的溶液。将反应混合物升温至室温且搅拌1.5小时。添加s49(0.32g,1.0mmol)于1.0ml无水ch2cl2中的溶液,且将所得混合物搅拌10分钟。然后,将二异丙基铵四氮唑(0.18g,1.05mmol)于8.0ml无水ch2cl2中的溶液分批添加至反应混合物,且将所得混合物搅拌过夜。将混合物用ch2cl2(20ml)稀释并且用饱和水性碳酸氢钠(20ml)和盐水(20ml)洗涤。将有机层经无水硫酸钠干燥,并且在真空中浓缩滤液以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(乙酸乙酯/己烷=5%-80%)以给出呈无色泡沫的0.34g(36%)的标题化合物u23。c49h68fn4o8ps2的esims计算值954.4,观测值955.9(m+1)。31pnmr(202mhz,cdcl3):δ155.54(d,j7.0hz),154.80(d,j8.3hz)。化合物u24程序1/方案1:在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷(1.93g,3.52mmol)和l-二异丙基乙胺(680μl,3.87mmol)于20.0ml无水二氯甲烷中的冷却溶液(-78℃)中逐滴添加双-(l-二异丙基氨基)-氯膦(1.03g,3.87mmol)于10.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。向该混合物逐滴添加s56(0.90g,3.52mmol)于5.0ml无水二氯甲烷中的溶液并且将所得混合物搅拌10分钟,在此时分批添加二异丙基铵四氮唑(0.66g,3.87mmol)于5.0ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时。将反应混合物用200ml的二氯甲烷稀释,并且通过饱和nahco3溶液(40.0ml)和盐水(40.0ml)顺序洗涤,然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的产物u24(1.1g,33%产率)。c49h61fn3o8ps2的esims计算值934.1,观测值934.9[m+h]+。31pnmr(202mhz,cdcl3)δ155.3(d,j8.7hz),154.7(d,j8.9hz)化合物u25程序2/方案2:在氩气氛下向5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷(0.60g,1.1mmol)和n,n-二异丙基乙胺(211μl,1.21mmol)于10.0ml无水二氯甲烷中的冷却溶液(-78℃)中逐滴添加双-(n,n-二异丙基氨基)-氯膦(0.32g,1.21mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。逐滴添加s59(0.60g,1.1mmol)于5.0ml无水二氯甲烷中的溶液并且将所得混合物搅拌10分钟,在此时分批添加乙硫基四唑(ett)于乙腈(0.25m,2.6ml,0.66mmol)中的溶液。将反应混合物在室温下进一步搅拌3小时。将粗混合物用50.0ml的二氯甲烷稀释,通过饱和nahco3溶液(25.0ml)和盐水(25.0ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-50%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的产物u25(0.77g,58%产率)。c66h84fn4o11ps2的esims计算值1223.5,观测值[m+h]+1224.2。31pnmr(202mhz,cdcl3)δ154.8(d,j7.0hz),154.6(d,j9.5hz)化合物u26化合物u26是采用程序2从烷基二硫化物(根据针对化合物s59描述的工序从化合物s68和s55制备)和5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷制备的。化合物u27、c3、a3、以及g2化合物u27是根据方案1(参见化合物u24)以41%产率从化合物s61制备的。c48h59fn3o8ps2的esims计算值920.1,观测值920.9[m+h]+。31pnmr(202mhz,cdcl3)δ154.7(d,j8.9hz),154.5(d,j7.7hz)化合物c3是根据方案1(参见化合物u24)以59%产率制备的。c56h66fn4o9ps2的esims计算值1053.2,观测值1051.5[m-h]+。31pnmr(202mhz,cdcl3)δ154.6(d,j5.45hz),154.4(d,j8.3hz)化合物a3是根据方案1(参见化合物u24)以39%产率制备的。c58h69fn6o9ps2的esims计算值1089.3,观测值1090.2[m+h]+。31pnmr(202mhz,cdcl3)δ154.8(s),154.6(s)化合物g2可以根据在此所描述的方法从例如化合物s61制备。化合物c4化合物c4是根据程序2(参见化合物u25)以22%产率制备的。c61h71fn5o10ps2的esims计算值1148.3,观测值1147.0[m-h]+。31pnmr(202mhz,cdcl3)δ154.7(d,j5.05hz),154.1(d,j10.7hz)化合物a4化合物a4是根据程序2(参见化合物u25)以18%产率制备的。c63h74n7o10ps2的esims计算值1184.4,观测值1183.2[m-h]+。31pnmr(202mhz,cdcl3)δ154.7(s),154.1(s)化合物g3化合物g3是根据程序2(参见化合物u25)制备的。化合物u28化合物u28是根据程序1(参见化合物u24)制备的。c53h64fn4o9ps2的esims计算值1015.2,观测值1016.2(m+1)。31pnmr(202mhz,cdcl3):δ154.79(d,j7.5hz),154.38(d,j10.5hz)化合物u29化合物u29是根据程序1(参见化合物u24)制备的。c50h61fn3o8ps2的esims计算值946.1,观测值947.6(m+1)。31pnmr(202mhz,cdcl3):δ154.74(d,j7.7hz),154.50(d,j7.7hz)化合物u30化合物u30是根据程序2(参见化合物u25)制备的。c65h82fn4o11ps2的esims计算值1209.5,观测值1210.6(m+1)。31pnmr(202mhz,cdcl3):δ154.74(d,j6.7hz),154.34(d,j10.3hz)化合物c5、a5、以及g4化合物c5、a5、以及g4是根据程序2(参见化合物u25)制备的。化合物u31化合物u31是根据程序1(参见化合物u24)制备的。c57h68fn4o9ps2的esims计算值1067.3,观测值1065.6(m-1)。31pnmr(202mhz,cdcl3):δ154.76(d,j7.4hz),154.49(d,j10.1hz)化合物u32化合物u32是根据程序1(参见化合物u24)制备的。c59h80fn4o13ps2的esims计算值1167.4,观测值1166.5(m-1)。31pnmr(202mhz,cdcl3):δ154.71(d,j7.3hz),154.00(d,j10.9hz)化合物u33化合物u33是根据程序1(参见化合物u24)制备的。c55h68fn6o9ps2的esims计算值1071.3,观测值1072.1(m+1)。31pnmr(202mhz,cdcl3):δ155.09(s),152.98(d,j14.9hz)化合物u34化合物u34是根据程序1(参见化合物u24)制备的。c55h75fn3o9ps2si的esims计算值1064.4,观测值1065.1(m+1)。31pnmr(202mhz,cdcl3):δ154.81(d,j8.9hz),154.56(d,j7.9hz)化合物u35化合物u35是根据程序1(参见化合物u24)制备的。31pnmr(202mhz,cdcl3):δ154.62(d,j7.3hz),154.50(d,j9.2hz)化合物u36化合物u36是根据程序1(参见化合物u24)制备的。c65h96fn4o11ps2si2的esims计算值1279.8,观测值1278.5(m-1)。31pnmr(202mhz,cdcl3):δ154.72(d,j7.1hz),154.60(d,j9.1hz)化合物u37化合物u37是根据程序1(参见化合物u24)制备的。c47h57fn3o8ps2的esims计算值906.1,观测值906.7(m+1)。31pnmr(202mhz,cdcl3):δ156.35(d,j8.5hz),155.98(d,j8.7hz)化合物u38、u39、u40、以及u41化合物u38、u39、u40、以及u41是根据程序1(参见化合物u24)制备的。u38:c49h61fn3o8ps2的esims计算值934.1,观测值933.1(m-1)。31pnmr(202mhz,cdcl3):δ154.74(d,j7.7hz),154.70(d,j7.9hz)u39:c49h61fn3o8ps2的esims计算值934.1,观测值844.8(m-t-bus)。31pnmr(202mhz,cdcl3):δ154.81(d,j8.7hz),154.58(d,j8.3hz)u40:c49h61fn3o8ps2的esims计算值934.1,观测值933.5(m-1)。31pnmr(202mhz,cdcl3):δ154.64(d,j8.3hz),154.53(d,j7.9hz)u41:c48h58brfn3o8ps2的esims计算值999.0,观测值999.9(m+1)。31pnmr(202mhz,cdcl3):δ155.47(d,j7.7hz),154.74(d,j8.7hz)化合物u42化合物u42是根据方案1(参见化合物u24)从化合物s83制备的。化合物g5化合物g5是如在此所描述制备的。c57h75n6o10ps2的esims计算值1099.34,观测值[m-h]+1098.2。31pnmr(202mhz,cdcl3)δ150.48(s),149.87(s)化合物u43、a6、g6、和c6根据本领域已知的方法,从3-丁炔-1-醇、双-(n,n-二异丙基氨基)-氯膦和相应的保护的核苷来制备化合物u43、a6、g6、和c6。化合物a7在氩气氛下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-o-甲基-腺苷(n-bz)(14.24g,20.7mmol)和n,n-二异丙基乙胺(4.0ml,22.7mmol)于100.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(6.07g,22.7mmol)于20.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。添加s61(5.0g,20.7mmol)于15.0ml无水二氯甲烷中的溶液,将所得混合物搅拌10分钟,在此时逐滴添加ett(50.0ml,12.42mmol)的0.25m乙腈溶液。将反应混合物在室温下进一步搅拌16小时。将粗混合物用200ml的二氯甲烷稀释,并且用饱和nahco3溶液(50ml)和盐水(50ml)顺序洗涤,然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-30%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的8.7g(40%)的产物a7(非对映异构体混合物)。c57h67n6o8ps2的esims计算值1059.28,观测值1057.9[m-h]+。31pnmr(202mhz,cdcl3):δ154.8,154.0。化合物c7化合物c7可以使用本文报道的方案(例如,针对a7所述的方案)来制备。化合物g7在氩气氛下,向丁-3-炔-1-醇(0.52g,7.46mmol)和n,n-二异丙基乙胺(1.35ml,7.78mmol)于15.0ml无水二氯甲烷中的-78℃冷却溶液中逐滴添加双-(n,n-二异丙基氨基)-氯膦(2.07g,7.78mmol)于5.0ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。将该溶液逐滴添加至5’-o-(4,4’-二甲氧基三苯甲基)-2’-o-甲基-鸟苷(ibu)(2.5g,3.73mmol)和二异丙基铵四氮唑(1.28g,7.46mmol)的于二氯甲烷悬(15ml)浮液,并且在室温下搅拌16小时。将反应混合物用15ml的二氯甲烷稀释,并且用饱和nahco3溶液(10ml)和盐水(10ml)顺序洗涤,然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-60%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的2.1g(65%)的产物g7(非对映异构体混合物)。c46h57n6o9p的esims计算值868.95,观测值868.0[m-h]+;31pnmr(202mhz,cdcl3):δ155.4,154.5。化合物u44根据对化合物u24所述的程序来制备u44。c45h57fn5o8ps2的esims计算值910.1,观测值910.7(m+1);31pnmr(202mhz,cdcl3):δ151.70(d,j8.1hz),150.90(d,j9.5hz)化合物u45在氩气氛下,向s107(1.28g,5.0mmol)在20ml无水二氯甲烷中的溶液中缓慢添加5’-o-(4,4’-二甲氧基三苯甲基)-2’-f-尿苷(2.74g,5.0mmol)和1h-四唑(13.3ml,0.45m,6.0mmol)在10ml二氯甲烷中的溶液,并搅拌1小时。缓慢添加三乙胺(50μl)以中和反应混合物,将挥发物在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上20%-70%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的u45(2.63g,75%)。c38h47fn3o7p的esims计算值703.7,观测值702.8(m-1);31pnmr(202mhz,cdcl3):δ109.65(d,j5.1hz),106.24(d,j10.9hz)。化合物a8使用与针对u45描述的相同的方案来制备a8。c48h53n6o8p的esims计算值872.9,观测值873.7(m+1);31pnmr(202mhz,cdcl3):δ106.37(s),105.97(s)。化合物g8使用与针对u45描述的相同的方案来制备g8。c51h59n6o9p的esims计算值931.0,观测值930.0(m-1);31pnmr(202mhz,cdcl3):δ106.57(s),105.27(s)。化合物u46将亚磷酸(1.64g,20.0mmol)与无水吡啶(5ml)共蒸发三次,并且然后当加热时溶解于10ml无水吡啶中。向该混合物中添加5'-o-(4,4'-二甲氧基三苯甲基)-2'-f-尿苷(1.10g,2.0mmol),搅拌10分钟,冷却至0℃,并且然后缓慢添加新戊酰氯(1.23ml,10.0mmol)。将混合物升温至室温并搅拌过夜。用三乙基碳酸氢铵缓冲液(5ml,1m)淬灭反应,然后用乙酸乙酯(30ml)稀释。用乙酸乙酯(3x20ml)萃取后,将合并的有机层用三乙基碳酸氢铵缓冲液(5ml,0.5m)洗涤并用无水硫酸钠干燥。在真空下除去挥发物以得到残余物,使该残余物经受根据isco手册进行的快速硅胶柱纯化(10%甲醇/二氯甲烷,包含1%三乙胺)以给出呈白色固体的0.96g(67%)的u46。31pnmr(202mhz,cdcl3):δ9.08(s)。化合物a9使用针对化合物u46所述的方案来制备a9。31pnmr(202mhz,cdcl3):δ4.33(s),3.51(s)。化合物g9使用针对化合物u46所述的方案来制备g9。31pnmr(202mhz,cdcl3):δ3.89(s),3.25(s)。化合物u47在氩气下,向5’-o-(4,4’-二甲氧基三苯甲基)-2’-moe-尿苷(2.0g,3.3mmol)和n,n-二异丙基乙胺(0.63ml,3.6mmol)于30ml无水二氯甲烷中的冷却溶液(-78℃)中逐滴添加双-(n,n-二异丙基氨基)-氯膦(0.96g,3.6mmol)于10ml二氯甲烷中的溶液。使反应混合物升温至室温,同时维持搅拌(1小时)。向该混合物逐滴添加化合物s61(0.80g,3.3mmol)于5ml无水二氯甲烷中的溶液并且搅拌10分钟,之后分批添加二异丙基铵四氮唑(diat,0.56g,3.3mmol)于5ml二氯甲烷中的悬浮液。将反应混合物在室温下进一步搅拌16小时,用200ml的二氯甲烷稀释,并且通过饱和nahco3溶液(40ml)和盐水(40ml)顺序洗涤,然后经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用乙酸乙酯/己烷溶剂系统(在combi快速rf仪器上0%-70%梯度)通过硅胶柱色谱法进行纯化以给出呈白色粉末的1.28g产物u47(40%产率,作为非对映异构体混合物)。c51h66n3o10ps2的esims计算值976.2,观测值[m-h]+975.2;31pnmr(202mhz,cdcl3):δ148.9(s),148.6(s)。化合物c8使用上述程序来制备化合物c8(22%产率,作为非对映异构体混合物)。c58h71n4o10ps2的esims计算值1079.3,观测值[m-h]+1078.6;31pnmr(202mhz,cdcl3):δ149.0(s),147.8(s)。化合物g10使用上述程序来制备化合物g10(27%产率,作为非对映异构体混合物)。c59h73n6o9ps2的esims计算值1105.4,观测值[m-h]+1104.3;31pnmr(202mhz,cdcl3):δ149.4(s),148.8(s)。化合物a10使用上述程序来制备化合物a10(58%产率,作为非对映异构体混合物)。c68h88n7o13ps2的esims计算值1306.6,观测值[m-h]+1307.7;31pnmr(202mhz,cdcl3):δ154.7(s),154.1(s)。化合物u48根据上述程序来制备化合物u48(54%产率,作为非对映异构体混合物)。c52h66fn4o9ps2的esims计算值1005.2,观测值[m-h]+1003.8;31pnmr(202mhz,cdcl3)δ154.7(jp-f=9.3hz),154.6(d,jp-f=8.1hz)。使用本文所述的标准合成程序来合成表4中所示的亚磷酰胺单体。表4本文所述的合成方法可用于制备其它亚磷酰胺单体,这些其它亚磷酰胺单体可用于制备本发明的多核苷酸,例如:此外,具有靶向配体如甘露糖,galnac等的以下亚磷酰胺单体可以使用针对m21描述的程序进行合成。类似的方法可用于其它小分子/肽靶向配体,例如,叶酸,psma,cpp等。在上述方案中,x可以是f、ome、2-甲氧基乙基(moe)等;碱基可以是u、c、a、g;并且r可以是ac,叔丁基二甲基甲硅烷基(tbdms),烯丙基等。细胞穿透肽(蛋白质转导结构域)的合成肽合成:合成:将rink酰胺聚苯乙烯树脂(0.080g,0.61mmol/g)添加至反应容器,在二甲基甲酰胺(5体积)中溶胀三次持续7分钟,每次伴随氮鼓泡;且然后排出。使用以下循环且采用标准fmoc化学进行肽的组装:●用二甲基甲酰胺(dmf)中的20%哌啶进行fmoc脱保护3x4分钟;●将树脂用dmf洗涤,6x1分钟;●使用5当量受保护的氨基酸、15当量n-甲基吗啉(nmm)、以及5当量hctu偶联。在添加偶联溶液之后,使反应进行持续2x20分钟;●在完成偶联之后,将树脂用dmf洗涤6x1分钟;●对于最终组装步骤,通过添加dmf中的5当量的fmoc-6-肼基盐酸、5当量hatu、以及15当量nmm并且混合直到反应完成(大约1小时)(如通过凯撒(kaiser)(茚三酮)测试所确认)来将n-末端封端。通过dmf中的20%哌啶除去fmoc3x4分钟;并且●将完成的树脂结合的肽用dmf洗涤三次,用二氯甲烷(dcm)洗涤三次且然后在真空下干燥。裂解:使用以下溶液将肽从树脂裂解/脱保护:三氟乙酸/二硫代苏糖醇/水/丙酮/三异丙基硅烷(10ml,90/3/2/3/2),伴随搅拌2小时。将树脂通过中级玻璃料注射器过滤器过滤且用纯三氟乙酸(tfa)洗涤两次。将滤液合并且通过蒸发使体积减至一半。搅拌tfa溶液并且通过缓慢添加4体积的冰冷醚来沉淀粗肽。通过过滤收集沉淀的粗肽。纯化:使用一个phenomenexlunac18(100x4.6mm5μ)柱使用15%-75%b(a=0.1%三氟乙酸/水;b=0.1%三氟乙酸/乙腈)在20分钟内通过lc/ms分析粗材料。所合成的细胞穿透肽、内体溶解肽、以及某些靶向部分的列表在表3中示出。靶向配体的合成galnac(nag)配体合成:d-半乳糖胺五乙酸酯(nag2)的制备。将d-半乳糖胺(25.0g,116mmol)悬浮于无水吡啶(250ml)中并且在一种惰性气氛下冷却至0℃。在2小时的过程内添加乙酸酐(120ml,1160mmol)。在搅拌过夜之后,在真空中浓缩反应混合物。在添加甲醇之后,白色固体沉淀且通过过滤收集以提供所希望的产物(42.1g,93%产率)。1hnmr(cdcl3,500mhz):δ5.69(d,1h,j9.0hz),5.40(m,1h),5.37(d,1h,j3.0hz),5.08(dd,1h,j3.0hz,11hz),4.44(dt,1h,j9.5hz,11hz),4.17(dd,1h,j7.0hz,11.5hz),4.11(dd,1h,,j7.0hz,11.5hz),4.01(t,1h,j7.0hz),2.17(s,3h),2.13(s,3h),2.05(s,3h),2.02(s,3h),1.94(s,3h),1.57(s,3h)。5-羟基戊酸苄酯(nag5)的制备。将δ-戊内脂(10.0g,100mmol)和naoh(4.00g,100mmol)于水(100ml)中的溶液在70℃下搅拌过夜。将反应混合物冷却至室温且在真空中浓缩以得到白色固体nag4。将该固体悬浮于丙酮(100ml)中并且用苄基溴(20.5g,120mmol)和溴化四丁基铵(1.61g,0.50mmol)回流过夜。将丙酮在真空中除去以得到油状残余物,将该残余物溶解于etoac中并且用饱和nahco3(水溶液)和盐水洗涤。将有机层经na2so4干燥并且在真空中浓缩以给出呈油状产物的nag5(17.1g,82%产率)。1hnmr(cdcl3,500mhz):δ7.35(m,5h),3.64(q,2h,j6hz,11.5hz),2.41(t,2h,j7.5hz),1.75(m,2h),1.60(m,2h),1.44(t,1h,j6hz)。苄氧基羰基丁基2-脱氧2-n-乙酰基-3,4,6-三-o-乙酰基-β-d-吡喃半乳糖苷(nag7)的制备-方法a。在一种惰性气氛下,在环境温度下将tmsotf(8.56g,38.4mmol)添加至nag2(10.0g,25.6mmol)于dce(100ml)中的溶液。将混合物在55℃下搅拌2小时,加热除去且搅拌过夜。将反应混合物倒入冰冷饱和nahco3(水溶液)中且用ch2cl2萃取。将有机层经na2so4干燥且在真空中浓缩以得到浆液nag6。将nag6于dce(60ml)中的溶液装入醇nag5(8.00g,38.4mmol)和分子筛。将混合物置于一种惰性气氛下,用tmsotf(2.85g,12.8mmol)处理,并且在室温下搅拌过夜。将混合物倒在冰冷饱和nahco3(水溶液)上且用ch2cl2萃取。将有机层经na2so4干燥且在真空中浓缩以得到浆液。将该粗材料经由sio2凝胶色谱法纯化以得到糖苷nag7(3.3g,24%产率)。1hnmr(cdcl3,500mhz):δ7.35(m,5h),5.98(d,1h,j7.0hz),5.57(m,1h),5.34(d,1h,j3.0hz),5.25(dd,1h,j3.0hz,11hz),5.10(s,2h),4.63(d,1h,j8.5hz),4.11(m,2h),3.95(m,1h),3.88(m,2h),3.49(m,1h),2.37(m,2h),2.13(s,3h),2.03(s,3h),1.99(s,3h),1.90(s,3h),1.70(m,2h),1.61(m,2h)。苄氧基羰基丁基2-脱氧2-n-乙酰基-3,4,6-三-o-乙酰基-β-d-吡喃半乳糖苷(nag7)的制备-方法b。向nag2(5.00g,12.8mmol)和醇nag5(5.33g,25.6mmol)于dce(50ml)中的溶液一次性添加sc(otf)3(0.44g,0.90mmol)。将混合物置于一种惰性气氛下且回流3小时。在冷却之后,将混合物用ch2cl2稀释,用饱和nahco3(水溶液)洗涤,经mgso4干燥,并且在真空中浓缩。通过sio2凝胶色谱法纯化得到糖苷nag7(5.53g,80%产率)。羧基丁基2-脱氧2-n-乙酰基-3,4,6-三-o-乙酰基-β-d-吡喃半乳糖苷(nag8)的制备。将糖苷nag7(1.50g,2.41mmol)于etoh(25ml)中的溶液通过施加真空且用氩回填来脱气。一次性添加钯催化剂(10%wt.于活性碳上,0.50g),并且将混合物通过施加真空且用氩回填来脱气。向该非均匀混合物中添加环己烯(25ml),并且回流6小时。在冷却之后,通过过滤除去催化剂,并且在真空中浓缩母液。将粗产物经由sio2凝胶色谱法纯化以得到一种白色泡沫nag8(0.76g,70%产率)。1hnmr(cdcl3,500mhz):δ5.72(d,1h,j8.5hz),5.35(d,1h,j3.5hz),5.26(dd,1h,j3.5hz,11.5hz),4.67(d,1h,j8.5hz),4.17(dd,1h,j6.5hz,11.5hz),4.12(dd,1h,6.5hz,11.5hz),4.00(dt,1h,j8.5hz,11.5hz),3.92(m,2h),3.53(m,1h),2.39(m,2h),2.15(s,3h),2.05(s,3h),2.01(s,3h),1.97(s,3h),1.71(m,2h),1.65(m,2h)。氨基丙基6-肼基烟酰胺丙酮腙(nag11)的制备。将dcm(20ml)中的boc6-肼基盐酸(520mg,2.1mmol)用edci(440mg,2.3mmol)、n-羟基琥珀酰亚胺(nhs;260mg,2.3mmol)、boc-二胺(650mg,2.6mmol)、以及diea(1.1ml,6.2mmol)处理3小时。将反应混合物在真空中浓缩并且通过硅胶色谱法进行纯化以得到nag10(364mg,43%产率)。1hnmr(cdcl3,500mhz):δ8.55(br,1h),7.93(d,2h,j7.5hz),7.45(br,1h),7.12(br,1h),6.62(d,1h,j8.5hz),5.17(br,1h),3.42(m,2h),3.13(m,2h),1.65(m,2h),1.41(s,18h)。通过用tfa(9ml)和丙酮(1ml)处理nag10(160mg,0.4mmol)处理1小时来形成hynic丙酮腙。将反应混合物在真空中浓缩且置于高真空上以得到nag11。三价galnac-hynic的合成三-(羧基乙氧基甲基)-甲基酰胺基-十二烷二酸甲酯(nag14)的制备。向用hatu(122mg,0.50mmol)和diea(218μl,1.25mmol)活化的十二烷二酸甲酯(211mg,0.42mmol)于dmf(2ml)中的的溶液添加tris连接子nag12。在1小时之后,将反应混合物在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到nag13(214mg,70%产率)。maldi-tof质量计算值c38h69no12:731.48,实测值:755.10[m+na]。将三叔丁酯nag13用一种tfa:tips:dcm(9:0.25:1)混合物(10.25ml)水解4小时并且在真空中浓缩以得到三酸nag14。maldi-tof质量计算值c26h45no12:563.29,实测值:565.33[m+h]。三-(氨基丙酰胺基-乙氧基甲基)-甲基酰胺基-十二烷二酸甲酯(nag16)的制备。向用hatu(557mg,1.35mmol)和diea(470μl,2.70mmol)活化的三酸nag14(230mg,0.41mmol)于dmf(4ml)中的的溶液添加单boc1,3-二氨基丙烷(250mg,1.44mmol)。在1小时之后,将反应在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到nag15(335mg,79%产率)。maldi-tof质量计算值c50h93n7o15:1031.67,实测值:1056.40[m+na]。将trisboc连接子nag15用一种tfa:tips:dcm(9:0.25:1)混合物(10.25ml)处理1小时并且在真空中浓缩以得到三胺nag16。maldi-tof质量计算值c35h69n7o9:731.51,实测值:733.18[m+h]。三-galnac(nag18)的制备:将单糖nag8(192mg,0.43mmol)用于dmf(2ml)中的hatu(163mg,0.43mmol)和diea(150μl,0.86mmol)处理。在30分钟之后,添加nag16(80mg,0.11mmol)于dmf(1ml)中的溶液,并且将混合物搅拌1小时。将粗混合物通过sio2凝胶色谱法纯化以得到nag17(82mg,37%产率)。质量计算值c92h150n10o39:2019.00,实测值:2041.85[m+na]。当用在thf:h2o(3:1)溶液(8ml)中的lioh·h2o(34mg,0.81mmol)处理时,将全乙酰化的三聚体galnac(82mg,0.04mmol)水解以得到nag18。maldi-tof质量计算值c73h130n10o30:1626.89,实测值:1634.52[m+li]。hynic三聚体galnac(nag19)的制备。将galnac三聚体nag18(32mg,0.02mmol)和hynic胺nag11(20.0mg,0.08mmol)于dmf(1ml)中的溶液用edci(16.2mg,0.08mmol)、nhs(2.5mg,0.02mmol)、以及diea(28μl,0.16mmol)处理且搅拌4小时。在真空中浓缩之后,将粗产物溶解于dmso中并且通过rp-hplc纯化以得到nag19(12.6mg,35%产率)。maldi-tof质量计算值c85h147n15o30:1858.04,实测值:1859.83[m+h]。三价galnac叠氮化物的合成叠氮基-peg3-三聚体galnac(nag21)的制备。将galnac三聚体羧酸nag18(60mg,0.03mmol)、叠氮基-peg3-胺nag20(45.6mg,0.21mmol)、tbtu(23.8mg,0.07mmol)、hobt(11.5mg,0.03mmol)、以及diea(34ul)溶解于dmso(0.5ml)中且搅拌2小时。将碱在真空中除去,并且通过rp-hplc纯化粗产物以得到nag21(24mg,44%)。ap-esi+质量计算值c81h146n14o32:1827.02,实测值:914.8[m+2h]2+galnac叠氮化物的合成1-溴-2-脱氧-2-乙酰氨基3,4,6-三-o-乙酰基-β-d-吡喃半乳糖苷(nag22)的制备。在氩气球下,在0℃下,在冰浴中,在搅拌下,向在dcm(90ml)中的d-半乳糖胺五乙酸酯(nag2,10.0g,1当量,25.8mmol)悬浮液中逐滴添加溴三甲基硅烷(4.1ml,1.2当量,31mmol)。10分钟后除去冰浴,并且将反应在室温下搅拌过夜。通过在75%己烷:乙酸乙酯中的tlc(hanessian染色)来检查反应进程。将反应混合物真空浓缩,与环己烷(3x50ml)共沸,在高真空下干燥过夜,并且将所得产物直接使用。1-叠氮基2-脱氧-2-乙酰氨基3,4,6-三-o-乙酰基-β-d-吡喃半乳糖苷(nag23)的制备。将nag22(10.6g,1.0当量,25.8mmol)溶于dcm(100ml)中。向该溶液中添加在水(100ml)和硫酸氢四丁基铵(8.32g,0.95当量,24.5mmol)中的叠氮化钠(4.86g,2.9当量,74.8mmol)。将反应混合物剧烈搅拌1小时。通过在75%己烷:乙酸乙酯中的tlc(hanessians染色)来检查反应进程。将反应混合物用dcm(2x50ml)进行萃取。将有机层用无水mgso4干燥并真空浓缩。然后将该材料通过硅胶快速色谱法(3:1己烷:乙酸乙酯)进行纯化。分离的物质的1hnmr与公开的结构一致。m+h=373.01-氨基2-乙酰氨基1,2-二脱氧-3,4,6-三-o-乙酰基-β-d-吡喃半乳糖(nag24)的制备。向溶解在乙酸乙酯(25ml)中的nag23(0.26g,1当量,0.7mmol)中添加钯碳(约26mg)。接下来,插入氢气球和真空管线。将反应混合物抽真空3次并在每次抽真空后用氢气吹扫。将反应混合物在室温下搅拌1小时。1小时后的lc/ms证实产物的形成。将反应混合物经过床过滤,将其用3x10mletoac洗涤。将合并的滤液真空浓缩,并且不经进一步纯化用于下一步骤。m+h=346.61-氨基(15’-叠氮基-四乙二醇丙酰基)2-乙酰氨基1,2-二脱氧-β-d-吡喃半乳糖苷(nag26)的制备。在氩气氛下,在搅拌下,向溶解在乙酸乙酯(45ml)和diea(0.24ml,2当量,1.4mmol)中的nag24(0.24g,1当量,0.7mmol)中逐滴添加在乙酸乙酯(5ml)中的叠氮基-peg4-nhs(0.41g,1.5当量,1.05mmol)。允许将该反应在室温下搅拌过夜。通过lc/ms验证反应的完成。m+h=619.5。真空除去乙酸乙酯,并且将所得材料不经进一步纯化用于下一步骤。向溶解在meoh(10ml)中的nag25(0.43g,1当量,0.7mmol)中添加100μl在甲醇中的25%甲醇钠溶液。将反应混合物在氩气氛下在室温下搅拌1小时。1小时后的lc/ms仅显示起始原料,在此时添加500μl在甲醇中的25%甲醇钠溶液。1小时后的lc/ms显示产物的形成和原料的消失。添加dowex树脂,直到溶液的ph达到约7。通过过滤除去树脂,在真空中除去溶剂,并将残余物通过反相hplc进行纯化。m+h=493.7。单价galnachynic的合成[5-(2-{2-[2-(2-叠氮基乙氧基)乙氧基]乙氧基}乙基氨基)-5-氧代戊酰基]2-脱氧2-n-乙酰基-3,4,6-三-o-乙酰基-β-d-吡喃半乳糖苷(nag27)的制备。向nag8(1.00g,2.24mmol)在thf(8ml)中的溶液中添加dic(0.56g,4.48mmol)和hobt(0.25g,2.17mmol)。1小时后,形成白色沉淀,并且将反应混合物冷却至0℃。添加叠氮基-peg3-胺(0.63g,2.91mmol)在thf(2ml)中的溶液,并且将反应再搅拌1小时。rp-hplcms显示nag27的形成。esims+质量计算值c27h45n5o13:647.7,实测值:647.8[m+h]。通过过滤除去沉淀,并且将反应混合物真空浓缩,以给出粘稠浆液。[5-(2-{2-[2-(2-2-叠氮基乙氧基)乙氧基]乙氧基}乙基氨基)-5-氧代戊酰基]2-脱氧2-n-乙酰基-β-d-吡喃半乳糖苷(nag28)的制备。将粗nag27溶于无水甲醇(10ml)中,并用在meoh中的naome(25wt%,250μl)处理。将该反应混合物在室温下搅拌过夜。rp-hplcms显示nag27的消耗和nag28的形成。esims+质量计算值c21h31n5o10:521.6,实测值:522.3[m+h]。添加dowexh+树脂以中和碱,然后通过过滤除去树脂,并将溶液真空浓缩。将粗nag28通过rp-hplc纯化,得到0.42g,经2步骤产率36%。([3-(叔丁氧基羰基氨基)丙基氨基])-5-氧代戊酰基]2-脱氧2-n-乙酰基-3,4,6-三-o-乙酰基-β-d-吡喃半乳糖苷(nag29)的制备。用hatu(0.25g,0.65mmol)和diea(0.34ml,1.95mmol)活化在dmf(3ml)中的nag8(0.29g,0.65mmol)。10分钟后,添加单boc保护的1,3-二氨基丙烷(0.13g,0.72mmol),并且将所得混合物搅拌2小时。将混合物真空浓缩,并且通过sio2色谱进行纯化以提供nag29(0.30g,77%产率)。esims+质量计算值c27h45n3o12:603.7,实测值:626.8[m+na]。([3-(氨基)丙基氨基])-5-氧代戊酰基]2-脱氧2-n-乙酰基-β-d-吡喃半乳糖苷(nag31)的制备。用在meoh中的naome的(25wt%,50μl)处理nag29(0.30g,0.50mmol)在无水甲醇中的溶液。20分钟后,tlc显示了nag29完全消耗。添加dowex强h+树脂来酸化反应混合物,然后将其搅拌30分钟。通过过滤除去树脂并用在meoh和1mnaoh中的1%tea(水溶液)洗涤。将滤液用1mhcl(水溶液)中和,并且真空浓缩以给出nag31(0.052g,28%产率)。esims+质量计算值c16h31n3o7:377.4,实测值:377.6[m+h]。({3-[6-(异亚丙基肼基)-烟酰基氨基]丙基氨基}-5-氧代戊酰基)2-脱氧2-n-乙酰基-β-d-吡喃半乳糖苷(nag32)的制备。用hynic-磺基-nhs(0.007g,18μmol)和diea(9.4μl,54μmol)处理在dmso(1ml)中的溶液nag31(0.009g,22μmol)1小时,并通过rp-hplc纯化以得到nag32tfa盐(0.010g,68%产率)。esims+质量计算值c25h40n6o8:552.6,实测值:554.0[m+h]。葡萄糖醇辅助部分的合成:二葡萄糖醇叠氮化物辅助部分的合成2-{2-[2-(2-叠氮基乙氧基)乙氧基]乙氧基}乙基氨基d-葡萄糖醇(poh2)的制备。将d-葡萄糖(0.093g,0.52mmol)和氨基-peg3-叠氮化物(0.11g,0.52mmol)在甲醇(2ml)中的反应溶液在室温下搅拌3小时。向反应混合物中添加在1ml甲醇中的nabh3cn(0.033g,0.52mmol),然后添加一滴乙酸。将反应混合物在室温下搅拌16小时,此时将混合物真空浓缩并通过制备型hplc纯化,以提供0.11g呈油状的产物poh2(56%产率)。c14h30n4o8的esims计算值382.4,观测值[m-h]+383.0。2-{2-[2-(2-叠氮基乙氧基)乙氧基]乙氧基}乙基氨基1,1-双(d-葡萄糖醇)(poh3)的制备。将d-葡萄糖(0.19g,1.04mmol)和氨基-peg3-叠氮化物(0.11g,0.52mmol)在甲醇(3ml)中的反应溶液在室温下搅拌3小时。向反应混合物中添加在1ml甲醇中的nabh3cn(0.065g,1.04mmol),然后添加一滴乙酸。将反应混合物在室温下搅拌16小时,此时将混合物真空浓缩并通过制备型hplc纯化,以得到0.13g呈油状的产物poh3(45%产率)。c20h42n4o13的esims计算值546.6,观测值[m-h]+547.0。二葡萄糖醇hynic辅助部分的合成(2-{2-[2-(2-叠氮基乙氧基)乙氧基]乙氧基}乙基氨基){6-[(叔丁基)-2-羧基肼基]-3-吡啶基}甲醛(poh4)的制备。在室温下,向6-boc-肼基烟酸(nag9,0.25g,1.0mmol),氨基-peg3-叠氮化物(poh1,0.22g,1.0mmol),hctu(0.83g,2.0mmol)和hobt·h2o(0.31g,2.0mmol)在dmf(5ml)中的溶液中添加dipea(0.70ml,2.0mmol)。将反应混合物搅拌16小时,此时将混合物真空浓缩。将粗混合物用30ml的二氯甲烷稀释,通过饱和nahco3溶液(10ml)和盐水(10ml)顺序洗涤,且经无水na2so4干燥。将溶剂在真空中蒸发,并且将粗混合物使用(乙酸乙酯,5%甲醇)/己烷溶剂系统(在combi快速rf仪器上0%-100%梯度)通过硅胶柱色谱法进行纯化以给出呈无色油状物的0.098g的中间体poh4(22%产率)。c19h37n7o6的esims计算值453.5,观测值[m-h]+454.0。(2-{2-[2-(2-氨基乙氧基)乙氧基]乙氧基}乙基氨基){6-[(叔丁基)-2-羧基肼基]-3-吡啶基}甲醛(poh5)的制备。在室温下,将在4ml的甲醇中的化合物poh4(0.098g,0.22mmol)和催化量的pd/碳(10%w/w)暴露于氢气氛1小时。将反应混合物过滤,并将滤液真空浓缩以产生0.090g呈油状物的poh5(98%产率),其不经进一步纯化即用于下一反应。c19h33n5o6的esims计算值427.5,观测值[m-h]+428.0。{2-[2-(2-{2-[双(2,3,4,5,6-五羟基己基)氨基]乙氧基}乙氧基)乙氧基]乙基氨基}[6-(异亚丙基肼基)-3-吡啶基]甲醛(poh6)的制备。将d-葡萄糖(0.16g,0.86mmol)和化合物poh5(0.09g,0.22mmol)在5ml甲醇中的溶液在室温下搅拌3小时。向反应混合物中添加在1ml甲醇中的nabh3cn(0.054g,0.86mmol),然后添加一滴乙酸,并且将反应混合物在室温下搅拌16小时。向该悬浮液中添加另一部分d-葡萄糖(0.16g,0.86mmol),并且将混合物搅拌3小时,此时添加在1ml甲醇中的nabh3cn(0.054g,0.86mmol),然后添加一滴加乙酸。将反应混合物在室温下进一步搅拌16小时。通过制备型hplc纯化后,将所得产物用三氟乙酸/丙酮(90:10,v/v)处理15分钟,之后通过制备性hplc纯化产物。冻干hplc级分得到3.0mg呈油状物的产物poh6(2%产率)。c29h53n5o14的esims计算值695.7,观测值[m-h]+696.0。四葡萄糖醇叠氮化物辅助部分的合成3-{n-叔丁氧基羰基[4-({3-[3-(2-{2-[2-(2-叠氮基乙氧基)乙氧基]乙氧基}乙氧基)丙酰基氨基]丙基}-n-叔丁氧基羰基氨基)丁基]氨基}丙基氨基2,2-二甲基丙酸酯(poh8)的制备。对poh7(0.18g,0.36mmol)在dcm(3ml)中的溶液用nhs叠氮基-peg4羧酸酯(0.13g,0.33mmol)和diea(0.12ml,0.66mmol)进行处理。将混合物在室温下搅拌1小时,并且通过rp-lcms证实产物形成。将反应真空浓缩,并且通过sio2色谱进行纯化以得到poh8(0.23g,89%产率)。esims+质量计算值c36h69n7o11:775.5,实测值:776.0[m+h]。1-{3-[4-(3-氨基丙基氨基)丁基氨基]丙基氨基}-3-(2-{2-[2-(2-叠氮基乙氧基)乙氧基]乙氧基}乙氧基)-1-丙酮(poh9)的制备。当在真空浓缩时,将在ch2cl2(2ml)中的三-bocpoh8(0.23g,0.29mmol)用tfa(10ml)和tips(0.10ml)处理1小时,以定量产率得到poh9。将poh9未经进一步纯化地用于下一步骤中。esims+质量计算值c21h45n7o5:475.4,实测值:476.0[m+h]。1-{3-[4-(3-氨基丙基氨基)丁基氨基]丙基氨基}-3-(2-{2-[2-(2-叠氮基乙氧基)乙氧基]乙氧基}乙氧基)-1-丙酮(poh10)的制备。将三胺poh9(0.29mmol)、d-葡萄糖(1.46g,8.11mmol)和nacnbh3(0.15g,2.34mmol)在meoh(10ml)中的混合物加热至50℃持续4小时。观察到3和4次添加d-葡萄糖的混合物。使用rp-hplc分离所希望的加合物poh10(0.016g)。esims+质量计算值c45h93n7o25:1132.3,实测值:1132.6[m+h]。叶酸配体的合成:n-boc-peg11叶酸(f2)的制备。向叶酸(225mg,0.51mmol)于dmso(4ml)中的溶液添加二异丙基碳二亚胺(80μl,0.51mmol)。在搅拌1.5小时之后,添加boc-peg11-二胺(220mg,0.34mmol)在dmso(1ml)中的溶液,并且将反应搅拌过夜。当添加水(35ml)时,形成沉淀,将其通过过滤收集并通过rp-hplc纯化以得到f2(364mg,67%产率)。maldi-tof质量计算值c48h77n9o18:1067.54,实测值:1069.89[m+h]。叶酸-peg11-hynic丙酮腙(f3)的制备。将单bocf2(210mg,0.2mmol)用tfa(9ml)和丙酮(1ml)处理1.5小时,将得到的混合物在真空中浓缩且在高真空下干燥。maldi-tof质量计算值c43h69n9o16:967.48,实测值:969.86[m+h]。将粗微黄色固体溶解于dmso(200μl)中并且用hynic-nhs酯(10.0mg,0.03mmol)和diea(40μl,0.23mmol)的溶液处理1.5小时。通过rp-hplc纯化粗产物以得到f3(1.2mg,3.5%产率)。maldi-tof质量计算值c52h78n12o17:1142.56,实测值:1144.03[m+h]。单价叶酸叠氮化物的合成叠氮基-peg4-氨基-peg11叶酸(f6)的制备。将在dmso(1.0ml)中的氨基-peg11叶酸f4(115mg,0.12mmol)添加至用tbtu(42mg,0.13mmol)、hobt(20mg,0.13mmol)、以及diea(63μl,0.36mmol)活化的叠氮基-peg4酸(38mg,0.13mmol)于dmso(1.0ml)中的溶液。在2小时之后,将碱在真空中除去,并且通过rp-hplc纯化粗产物以得到f6(75mg,50%)。ap-esi+质量计算值c54h88n12o21:1240.61,实测值:1241.7[m+h]+,621.5[m+2h]2+psma配体的合成cbz-lys脲基glu三-叔丁酯(psma4)的制备。向谷氨酸二-叔丁酯(1.06g,3.58mmol)、dmap(27mg)、以及tea(1.25ml,8.95mmol)于ch2cl2(10.0ml)中的冰冷溶液一次性添加cdi(638mg,3.94mmol)。在30分钟之后,将反应从冰浴中除去且搅拌过夜。将反应用ch2cl2稀释并且用饱和nahco3(水溶液)、水和盐水洗涤。在经na2so4干燥之后,将有机层在真空中浓缩且在高真空下干燥以给出psma2。将psma2于dce(10ml)中的溶液冷却至0℃并且用meotf(0.59g,3.58mmol)和tea(1.00ml,7.16mmol)顺序地处理。在45分钟之后,添加dce(2ml)中的cbz-lys叔丁酯psma3(1.34g,3.58mmol),并且将混合物加热至40℃。在2小时之后,将反应用ch2cl2稀释并且用饱和nahco3(水溶液)、水和盐水洗涤。将有机层经na2so4干燥且在真空中浓缩以得到粘稠浆液。将粗材料通过sio2凝胶色谱法纯化以给出呈白色泡沫的psma4(1.73g,78%)。ap-esi+质量计算值c32h51n3o9:621.36,实测值:622.4[m+h]+,644.4[m+na]+lys脲基glu三-叔丁酯(psma5)的制备。将psma4(1.73g,2.79mmol)于etoac(100ml)中的溶液通过施加真空且用氩回填来脱气。一次性添加钯(活性炭上的10%wt,0.15g),通过施加真空使混合物脱气并用h2(g)吹扫,并搅拌6小时。通过过滤除去催化剂,且在真空中浓缩母液以定量地得到psma5。ap-esi+质量计算值c24h45n3o7:487.32,实测值:488.4[m+h]+单价psma叠氮化物(psma7)的合成叠氮基-peg4-lys脲基glu三-叔丁酯(psma6)的制备。将叠氮基-peg4酸(133mg,0.45mmol)用在dmf(3.0ml)中的tbtu(146mg,0.45mmol)、hobt(69mg,0.45mmol)、以及diea(216μl,1.24mmol)活化。在15分钟之后,递送psma5(202mg,0.41mmol)的溶液,并且将反应在室温下搅拌1.5小时。rp-hplcms显示所希望的产物的形成。将反应混合物在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到psma6(257mg,83%)。ap-esi+质量计算值c35h64n6o12:760.46,实测值:761.5[m+h]+,783.5[m+na]+叠氮基-peg4-lys-脲基glu(psma7)的制备。将三-叔丁酯psma6(257mg,0.34mmol)用tfa:tips(10ml,97.5:2.5,v/v)的溶液处理30分钟。rp-hplcms显示完全转化成所希望的产物。将反应混合物在真空中浓缩,并且通过rp-hplc纯化以得到psma7(112mg,56%)。ap-esi+质量计算值c23h40n6o12:592.27,实测值:593.3[m+h]+单价psmahynic(psma10)的合成n-boc4-肼基-烟酰胺基peg4酸(psma8)的制备。将n-boc4-肼基烟酸nag9(137mg,0.54mmol)用dmf中的tbtu(124mg,0.49mmol)、hobt(83mg,0.54mol)、以及diea(128μl,0.74mmol)处理20分钟。向该活化的酯添加氨基-peg4-酸(130mg,0.49mmol)的溶液,且将混合物搅拌2小时。将反应在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到psma8(107mg,44%)。ap-esi+质量计算值c22h36n4o9:500.25,实测值:501.3[m+h]+n-boc4-肼基-烟酰胺基peg4-ε-酰胺基lys-α-脲基-glu三叔丁酯(psma9)的制备。在dmf中氨基psma5(104mg,0.21mmol)存在下,用hatu(81mg,0.21mmol)和diea(93μl,0.53mmol)处理psma8(107mg,0.21mmol)1小时。然后将反应混合物在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到psma9(85mg,42%)。ap-esi+质量计算值c46h79n7o15:969.46,实测值:760.6[m+h]+二甲基4-肼基烟酰胺基peg4-ε-酰胺基lys-α-脲基-glu(psma10)的制备。将三-叔丁酯psma9(85mg,0.09mmol)用tfa:丙酮(10ml,97.5:2.5,v/v)的溶液处理30分钟。rp-hplcms显示完全转化成所希望的产物。将反应混合物在真空中浓缩,并且通过rp-hplc纯化以得到psma10(55mg,84%)。ap-esi+质量计算值c32h51n7o13:741.35,实测值:742.4[m+h]+二价psma叠氮化物(psma18)的合成n-fmoc双-亚氨基-(乙酰胺基-peg4叔丁酯)(psma13)的制备。将n-fmoc亚氨基二乙酸psma11(107mg,0.30mmol)用dmf中的psma12(212mg,0.66mmol)、tbtu(193mg,0.60mmol)、hobt(92mg,0.60mmol)、以及diea(209μl,1.20mmol)处理2小时。将反应在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到psma13(250mg,91%)。ap-esi+质量计算值c49h75n3o16:961.51,实测值:962.6[m+h]+,984.6[m+na]+n-fmoc双-亚氨基-(乙酰胺基-peg4-ε-酰胺基lys-α-脲基-glu三叔丁酯)(psma15)的制备。将dcm(1ml)中的二叔丁酯pmsa13(250mg,0.26mmol)用tfa(10ml)和tips(111μl,0.54mmol)处理。在30分钟之后,将反应在真空中浓缩以得到浆液,将该浆液用己烷洗涤以给出呈粘稠浆液的二酸psma14。将psma14用dmf中的hatu(198mg,0.54mmol)、psma5(292mg,0.57mmol)、以及diea(362μl,2.08mmol)处理1小时。将反应混合物在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到psma15(408mg,88%)。psma14:ap-esi+质量计算值c41h59n3o16:849.39,实测值:850.5[m+h]+,872.5[m+na]+。psma15:ap-esi+质量计算值c89h145n9o28:1788.02,实测值:895.3[m+2h]2+,917.2[m+2na]2+双-亚氨基-(乙酰胺基-peg4-ε-酰胺基lys-α-脲基-glu三叔丁酯)(psma16)的制备。将乙腈(10ml)中的n-fmocpmsa15(408mg,0.22mmol)用哌啶处理30分钟。将反应混合物在真空中浓缩,用phme(3×10ml)共沸,用己烷(3×20ml)洗涤,且在高真空下干燥以得到psma16。ap-esi+质量计算值c74h135n9o26:1565.95,实测值:895.3[m+2h]2+,917.2[m+2na]2+叠氮基-peg4-亚氨基-双-(乙酰胺基-peg4-ε-酰胺基lys-α-脲基-glu三叔丁酯)(psma17)的制备。将胺pmsa16(172mg,0.11mmol)添加至用dmf(2ml)中的hatu(52mg,0.14mmol)和diea(116μl,0.66mmol)活化的n3-peg4-cooh(40mg,0.14mmol)。在1小时之后,将反应混合物在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到psma17(194mg,91%)。ap-esi+质量计算值c85h154n12o31:1839.08,实测值:895.3[m+2h]2+,917.2[m+2na]2+叠氮基-peg4-亚氨基-双-(乙酰胺基-peg4-ε-酰胺基lys-α-脲基-glu)(psma18)的制备。将六-叔丁酯psma17(194mg,0.10mmol)用tfa:丙酮(10ml,97.5:2.5,v/v)的溶液处理30分钟。rp-hplcms显示完全转化成所希望的产物。将反应混合物在真空中浓缩,并且通过rp-hplc纯化以得到psma18(69.4mg,44%)。ap-esi+质量计算值c61h106n12o31:1502.70,实测值:752.5[m+2h]2+二价psmahynic(psma20)的合成n-boc4-肼基-烟酰胺基peg4-亚氨基-双-(乙酰胺基-peg4-ε-酰胺基lys-α-脲基-glu三叔丁酯)(psma19)的制备。将胺pmsa16(172mg,0.11mmol)添加至用dmf(2ml)中的hatu(46mg,0.12mmol)和diea(116μl,0.66mmol)活化的psma8(61mg,0.12mmol)。在1小时之后,将反应混合物在真空中浓缩并且通过sio2凝胶色谱法进行纯化以得到psma19(201mg,89%)。ap-esi+质量计算值c96h169n13o34:2048.19,实测值:1025.3[m+2h]2+,684.0[m+3h]3+二甲基4-肼基-烟酰胺基-peg4-亚胺基-双-(乙酰胺基-peg4-ε-酰胺基lys-α-脲基-glu)(psma20)的制备。将六-叔丁酯psma19(201mg,0.10mmol)用tfa:丙酮(10ml,9:1,v/v)的溶液处理60分钟。rp-hplcms显示完全转化成所希望的产物。将反应混合物在真空中浓缩,并且通过rp-hplc纯化以得到psma20(69.4mg,44%)。ap-esi+质量计算值c70h117n13o32:1651.79,实测值:827.1[m+2h]2+甘露糖配体的合成:lys6-peg24-hynic(m5)的制备。肽骨架是使用标准fmoc化学在一种rink酰胺树脂(0.61mmol/g)上在hctu偶联和20%哌啶脱保护情况下合成的。简言之,在一个自动合成器上根据25μmol规模来制备肽m1。在lys(mtt)脱保护之后,将peg24氨基(mtt)酸偶联以提供m3。mtt基团的除去和bochynic的随后偶联提供m4。使用三氟乙酸:三异丙基硅烷:水:丙酮:二硫代苏糖醇(90:2:2:3:3)从树脂释放肽且通过rp-hplc纯化得到m5(7.0mg)。ap-esi+质量计算值c96h185n17o32:2088.33,实测值:1046m/2z,698m/3z,524m/4z。man6-lys6-peg24-hynic(m6)的制备。将dmso(1ml)中的肽骨架m5(7.0mg)用甘露糖异硫氰酸酯(8.0mg)和n-甲基吗啉(nmm;200μl)处理。将反应在37℃下搅拌4小时且通过rp-hplc纯化以得到m6(1.2mg)。maldi-tof质量计算值c174h275n23o68s6:3966.70,实测值:3987.39[m+na]。六价甘露糖叠氮化物(m9)的合成lys6-peg24-叠氮化物(m8)的制备。肽骨架是使用标准fmoc化学在一种rink酰胺树脂(0.61mmol/g)上在hctu偶联和20%哌啶脱保护情况下合成的。简言之,在一个自动合成器上根据100μmol规模来制备肽m1。在lys(mtt)脱保护之后,将叠氮基-peg24酸偶联以提供m7。使用混合物tfa:tips:h2o(92.5:2.5:5)从树脂释放肽得到m8(167.0mg)。malditof质量计算值c87h174n16o31:1940.4,实测值:1941.1man6-lys6-peg24-叠氮化物(m9)的制备。将dmso(2ml)中的肽骨架m4(167.0mg)用甘露糖异硫氰酸酯和nmm(500μl)处理。将反应混合物在37℃下搅拌并且通过malditof监测直到实现完全转化成所希望的产物(添加总计58mg的甘露糖异硫氰酸酯)。将最终产物通过rp-hplc纯化以得到m9(22mg)。maldi-tof质量计算值c165h264n22o67s6:3820.37,实测值:3843.79[m+na]。三价甘露糖叠氮化物(m15)的合成叠氮基三-甘露糖(m15)的制备:将d-甘露糖通过吡啶中的ac2o全乙酰化过夜。通过旋转蒸发浓缩、接着用phme共沸提供定量产率的五-乙酸酯(m8)。在可商购的叠氮基peg2醇存在下用sc(otf)3活化m8得到叠氮基-peg2甘露糖苷(m9),将其定量氢化为胺(m10)。同时,将三连接子(nag13)的甲酯选择性地水解成酸(m11)。通过tbtu活化将可商购的叠氮基peg3胺与m11偶联提供叠氮基三连接子(m12)。用tfa处理三叔丁酯m12得到三-酸m13。m10与m13的偶联是通过hatu介导的,并且将粗混合物整体脱乙酰化以得到叠氮基三-甘露糖(m15)。单价甘露糖亚磷酰胺(m21)的合成甘露糖二硫化物2-氟尿苷亚磷酰胺(m21)的制备:通过标准保护/脱保护化学,将m9的乙酸酯通过脱乙酰化的中间体m16转化成叔丁基甲硅烷基(tbs)m17。通过氢化将叠氮化物m17还原成胺m18有助于用位阻硫内脂n-酰化以得到硫醇m19。通过添加芳基巯基-硫代吡啶干净地形成二硫化物m20,用meotf预活化。通过用双(二异丙基氨基)氯膦处理2-氟尿苷,接着添加糖二硫化物m20,以标准2步一锅法方式形成亚磷酰胺m21。六价甘露糖叠氮化物(m30)的合成n-苄氧羰基三-(叔丁氧基乙氧羰基甲基)-甲基酰胺(m22)的制备:向nag12(3.55g,7.02mmol)于在冰浴中冷却的ch2cl2(12ml)中的溶液添加cbz-cl(35%于phme中,7.3ml)和tea(3.9ml)。将反应混合物升温至室温且搅拌过夜。将混合物用ch2cl2稀释,用饱和nahco3(水溶液)洗涤,经na2so4干燥,并且在真空中浓缩。将粗产物通过sio2色谱法纯化以得到m22(0.98g,22%产率)。ap-esi+质量计算值c33h53no11:639.4,实测值:662.4[m+na]+n-苄氧羰基三-((2,3,4,6-四-o-乙酰基-1-o-α-d-吡喃甘露糖基)-peg3-酰胺基乙氧基甲基)-甲基酰胺(m24)的制备:将ch2cl2(5ml)中的三-叔丁酯m22(0.97g,1.51mmol)和tips(0.93ml,4.55mmol)用tfa(20ml)处理5小时。将混合物在真空中浓缩,将油状残余物用己烷洗涤且在高真空下干燥以提供m23。ap-esi+质量计算值c21h29no11:471.2,实测值:493.9[m+na]+将dmf(5ml)中的粗m23在冰浴上冷却并且用hatu(0.62g,1.63)和diea(0.65ml,3.71mmol)处理。在搅拌20分钟之后,添加m10(0.89g,1.86mmol)于dmf(5ml)中的溶液,并且将混合物温至室温且搅拌3小时。将溶剂在真空中除去,并且将粗产物溶解于etoac中,用饱和nahco3(水溶液)洗涤,经na2so4干燥且在真空中浓缩。通过sio2色谱法纯化得到m24(0.49g,62%产率)。maldi-tof质量计算值c81h122n4o44:1854.74,实测值:1850.14三-((2,3,4,6-四-o-乙酰基-1-o-α-d-吡喃甘露糖基)-peg3-酰胺基乙氧基甲基)-甲基酰胺(m25)的制备:将m24(0.49g,0.26mmol)的溶液用hoac(0.2ml)溶解于etoac(50ml)中且通过施加真空且用ar(g)回填来脱气。添加活性炭上pd(0.16g),并且将混合物排空并然后用h2(g)吹扫三次。将反应混合物搅拌2天,通过过滤除去催化剂,并将母液真空浓缩以得到m25。ap-esi+质量计算值c73h116n4o42:1720.7,实测值:1723.42叠氮基-peg4-酰亚胺基-双-(乙酰胺基-peg4-叔丁酯)(m27)的制备:将ch2cl2中的n-fmocpsma13(0.72g,0.75mmol)用哌啶(0.75ml)处理1小时。hplcms显示完全转化成m26,ap-esi+质量计算值c34h65n3o14:739.4,实测值:740.5[m+h]+。将混合物在真空中浓缩并用phme共沸。使粗m26与叠氮基peg4酸(0.44g,1.51mmol)、hatu(0.57g,1.51mmol)、以及diea(0.52ml)于dmf(5ml)中的溶液反应1小时。在真空中除去溶剂之后,将粗产物溶解于etoac中,用饱和nahco3(水溶液)洗涤,经na2so4干燥且在真空中浓缩。通过sio2色谱法纯化得到m27(0.71g,93%产率,2步)。ap-esi+质量计算值c45h84n6o19:1012.6,实测值:1013.6[m+h]+叠氮基-peg4-酰亚胺基-双-(三聚体甘露糖)(m30)的制备:将酰亚胺基连接子m27(0.69g,0.68mmol)用tips(0.28ml,1.36mmol)和tfa(10ml)处理以得到三酸m28;ap-esi+质量计算值c37h68n6o19:900.5,实测值900.9[m+h]+,922.9[m+na]+。在真空中除去挥发物,并且在高真空下干燥m28。在0℃下将二酸m28(82.0mg,0.09mmol)用dmf(2ml)中的hatu(75mg,0.2mmol)和diea(0.28ml)活化。在30分钟之后,添加m25(0.26mmol)于dmf(2ml)中的溶液,并且将混合物升温至室温且搅拌2小时。rp-hplcms显示完全转化成m29;质量计算值c183h296n14o101:4305.84,maldi-tof实测值:4303.36ap-esi+实测值:1436.1[m+3h]3+,1077.3[m+4h]4+。将反应用ch2cl2稀释,用饱和nahco3(水溶液)洗涤,经na2so4干燥,并且在真空中浓缩。将粗m29(538mg)溶解于meoh(20ml)中,用naome(25wt%于meoh中,0.5ml)处理1小时。rp-hplcms显示完全转化成m30。通过添加dowexh+树脂中和来淬灭反应。将粗材料通过hplc纯化以得到m30(38.1mg,在3个步骤内13%产率)。质量计算值c135h248n14o77:3297.59,maldi-tof实测值:3318.61[m+na]+ap-esi+实测值:1100.0[m+3h]3+,825.3[m+4h]4+。abl配体(abl)的合成n-棕榈酰基l-谷氨酸α-叔丁氧基酯(abl3)的制备:将thf(10ml)中的棕榈酸abl1(1.0g,3.8mmol)用n-羟基琥珀酰亚胺(0.9g,7.6mmol)和二异丙基碳二亚胺(1.2ml,7.6mmol)处理过夜以得到酯(abl2)。通过过滤除去沉淀,并且真空蒸发挥发物。将所得到的残余物溶解于dmf(6ml)中并且用谷氨酸叔丁酯(0.7g,3.4mmol)和diea(1.8ml,10mmol)处理。在2小时后,将反应混合物用水稀释,且用et2o萃取所希望的产物。将醚层经na2so4干燥,在真空中浓缩,且将粗物质通过sio2色谱法纯化以得到灰白色固体abl3(1.2g,74%产率)。ap-esi+质量计算值c25h47no5:441.3,实测值:464.0[m+na]+n-棕榈酰基δ-(酰胺基peg3叠氮化物)l-谷氨酸α-叔丁氧基酯(abl4)的制备:向abl3(1.24g,2.8mmol)于thf(10ml)中的溶液添加11-叠氮基-peg3胺(0.92g,4.2mmol)和二异丙基碳二亚胺(0.87ml,5.6mmol)。在搅拌过夜之后,通过过滤除去沉淀,在真空中浓缩母液,并且将粗物质通过sio2色谱法纯化以得到灰白色固体abl4(1.7g,94%产率)。ap-esi+质量计算值c33h63n5o7:641.5,实测值:642.4[m+h]+n-棕榈酰基δ-(酰胺基peg3叠氮化物)l-谷氨酸(abl5)的制备:将叔丁酯abl4(1.71g,2.66mmol)和tips(0.54ml,2.66mmol)于dcm(2ml)中的溶液用tfa(10ml)进行处理。在1.5小时之后,在真空中浓缩混合物。将油状粗产物用己烷洗涤,在真空中干燥,且通过rp-hplc纯化以得到abl5(930mg,60%产率)。ap-esi+质量计算值c29h55n5o7:585.4,实测值:586.0[m+h]+n-α-fmocn-咪唑基-三苯甲基α-(酰胺基peg3叠氮化物)l-组氨酸(abl7)的制备:将dmf(5ml)中的n-α-fmocn-咪唑基-三苯甲基l-组氨酸(1.00g,1.61mmol)用tbtu(0.57g,1.77mmol)、hobt(0.27g,1.77mmol)、以及diea(0.84ml,4.84mmol)活化20分钟。添加11-叠氮基-peg3胺(0.35g,1.61mmol)于dmf(1.0ml)中的溶液,并且将混合物搅拌3小时。将反应混合物用h2o稀释并且用et2o萃取。将醚层经na2so4干燥,在真空中浓缩,且将粗物质通过sio2色谱法纯化以得到淡黄色固体abl7(1.17g,88%产率)。ap-esi+质量计算值c48h49n7o6:819.4,实测值:819.8[m+h]+n-α-棕榈酰基-n-咪唑基-三苯甲基-α-(酰胺基peg3叠氮化物)l-组氨酸(abl9)的制备:将ch2cl2(5ml)中的n-fmocabl7(1.17g,1.42mmol)用哌啶(0.56ml)处理且搅拌1小时以提供可接受纯度的abl8;ap-esi+质量计算值c33h39n7o4:597.3,实测值:597.9[m+h]+。在真空中浓缩混合物,并且用己烷洗涤残余物。将粗abl8溶解于ch2cl2(5ml)中且用棕榈酸(0.73g,2.84mmol)、二异丙基碳二亚胺(0.36g,2.84mmol)、以及nhs(0.43g,2.84mmol)处理。通过过滤除去沉淀,并且将粗产物通过sio2色谱法纯化以得到灰白色固体abl9(0.71g,60%产率)。ap-esi+质量计算值c49h69n7o5:835.5,实测值:835.9[m+h]+n-α-棕榈酰基-α-(酰胺基peg3叠氮化物)l-组氨酸(abl10)的制备:将n-咪唑基-三苯甲基abl9(0.71g,0.85mmol)和tips(0.17ml,0.85mmol)于dcm(2ml)中的溶液用tfa(10ml)进行处理。在1.5小时之后,在真空中浓缩混合物。将油状粗产物用己烷洗涤,在真空中干燥,且通过rp-hplc纯化以得到abl10(394mg,79%产率)。ap-esi+质量计算值c30h55n7o5:593.4,实测值:594.3[m+h]+寡核苷酸交联辅助部分的合成:3-[2-(2-{2-[2-(2-{2-[2-(2-{6-[(叔丁基)-2-甲基肼基]-烟酰基氨基}乙氧基)乙氧基]乙氧基}乙氧基)乙氧基]乙氧基}乙氧基)乙氧基]丙酸(bil1)的制备。将n-boc4-肼基烟酸nag9(0.38g,1.50mmol)用在dmf(10ml)中的tbtu(0.48g,1.50mmol)、hobt(0.23g,1.50mmol)、以及diea(0.39g,3.00mg)活化。20分钟后,添加peg8氨基酸(0.44g,1.00mmol)溶液,并且将反应在室温下搅拌1小时。将反应混合物真空浓缩,并且通过sio2色谱用在dcm中的5%meoh进行纯化以得到bil1(0.39g,58%产率)。esims+质量计算值c30h72n4o13:676.4,实测值:677.0[m+h]+。甲基(2s)-2,6-双{3-[2-(2-{2-[2-(2-{2-[2-(2-{6-[(叔丁基)-2-羧基肼基]-烟酰基氨基}乙氧基)乙氧基]乙氧基}乙氧基)乙氧基]乙氧基}乙氧基)乙氧基]丙酰氨基}己酸酯(bil2)的制备。用在dmf(5ml)中的tbtu(0.19g,0.58mmol),hobt(0.089g,0.58mmol)和diea(0.23ml,1.30mmol)活化bil1(0.39g,0.57mmol)。15分钟后,添加lys甲酯盐酸盐和另外的diea(0.23ml)。将反应进行超声处理以完全溶解lys甲酯。搅拌过夜后,真空浓缩反应物,并且用在ch2cl2中的5%-15%meoh通过sio2色谱法纯化以得到bil2(0.38g,93%产率)。esims+质量计算值c67h116n10o26:1476.8,实测值:1477.0[m+h]+。(2s)-2,6-双{3-[2-(2-{2-[2-(2-{2-[2-(2-{6-[(叔丁基)-2-羧基肼基]-烟酰基氨基}乙氧基)乙氧基]乙氧基}乙氧基)乙氧基]乙氧基}乙氧基)乙氧基]丙酰氨基}己酸(bil3)的制备。通过用在水(2ml)和meoh(2ml)中的lioh·h2o(0.032g,0.75mmol)处理将在thf(30ml)中的bil2(0.37g,0.26mmol)进行皂化。将反应在室温下搅拌1小时,之后hplcms显示完全转化。用dowexh+树脂中和混合物,并且真空浓缩滤液以提供bil3(0.25g,66%产率)。该材料对于下一反应是足够纯的。esims+质量计算值c66h114n10o26:1462.8,实测值:732.0[m+h]3+m/3z。(2s)-1-[3-(2-{2-[2-(3-{2-氮杂三环[10.4.0.04,9]十六碳-1(16),4,6,8,12,14-六烯-10-炔-2-基}-3-氧代丙基)乙氧基]乙氧基}乙氧基)丙基氨基]-2,6-双[3-(2-{2-[2-(2-{2-[2-(2-{2-[6-(异亚丙基肼基)-烟酰基氨基]乙氧基}乙氧基)乙氧基]乙氧基}乙氧基)乙氧基]-乙氧基}乙氧基)丙酰氨基]-1-己酮(bil5)的制备。在dbco-peg4胺(0.049g,0.09mmol)存在下,用tbtu(0.033g,0.10mmol)、hobt(0.016g,0.10mmol)和diea(65μl,0.38mmol)处理在dmf(3ml)中的bil3(0.14g,0.09mmol)。将混合物在室温下搅拌1小时,真空浓缩,并且通过sio2色谱法(在ch2cl2中的5%meoh)纯化以得到bil4(0.051g,28%产率)。esims+质量计算值c95h149n13o31:1968.0,实测值:884.7[m+2h-2boc]2+。将bil4(0.051g)用tfa(9ml)和无水丙酮(1ml)处理30分钟。将反应混合物真空浓缩,并且通过快速rp-hplc梯度纯化以提供bil5·2xtfa盐(0.050g,85%产率)。maldi-tofms+质量计算值c91h141n13o27:1849.16,实测值:1850.14[m+h]+。二硫化物磷酸三酯寡核苷酸合成:通用方案:实验详情:将所合成的所有寡核苷酸序列在2’-核糖位置处用2’-f和2’-ome修饰进行修饰以便改进血清稳定性且使脱靶效应最小化。用以下试剂/溶剂进行自动寡核苷酸合成(1μmol规模):氧化剂-0.02mi2于thf/吡啶/h2o中(每个循环60秒氧化),去封闭-3%三氯乙酸(每个循环2x40秒去封闭),封端混合物a-thf/吡啶/pac2o(每个循环60秒封端),和封端混合物b-thf中的16%甲基咪唑(每个循环60秒封端)标准寡核苷酸合成条件的例外是如下:-使用用于更温和脱保护的具有q-连接子(氢醌-o,o’-二乙酸连接子臂)的cpg支持体;-在合成之前将所有二硫化物亚磷酰胺在100%无水乙腈中再悬浮至100mm;并且-亚磷酰胺活化是用2.5倍摩尔过量的5-苄硫基-1-h-四唑(btt)进行的。每次插入,将活化的亚磷酰胺偶联2×3分钟的偶联步骤。二硫化物磷酸三酯寡核苷酸脱保护和纯化方案:●在自动寡核苷酸合成之后,将二硫化物磷酸三酯寡核苷酸裂解且在室温下在甲醇中的1ml10%二异丙胺(10%dia/meoh)中脱保护4小时。在4小时脱保护之后,将寡聚物样品通过离心蒸发进行干燥。●在使用具有标准保护基团(如苯甲酰基(bz)、乙酰基(ac)、以及异丁基(ibu)等)的亚磷酰胺单体的寡核苷酸合成中,将所得到的二硫化物磷酸三酯寡核苷酸裂解且在室温下在1.0ml的ama(甲醇中的1:1比例的36%氨水和40%甲胺)脱保护2小时,接着离心蒸发。●将粗寡聚物沉淀再悬浮于100μl的50%乙腈中,短暂加热至65℃,并且彻底地涡旋。将总计100μl粗寡聚物样品注入到rp-hplc上,使用以下缓冲液/梯度:-缓冲液a=50mmteaa于水中;-缓冲液b=90%乙腈;并且-流速=1ml/分钟;ο梯度:·0-2分钟(100%缓冲液a/0%缓冲液b),·2-42分钟(0%至60%缓冲液b),和·42-55分钟(60%至100%缓冲液b)。●跨主要rp-hplc峰,收集0.5ml级分且通过maldi-tof质谱法进行分析以确认所希望物质的存在。将包含正确物质的纯化级分冷冻且冻干。一旦干燥,就将级分再悬浮,与相应级分合并,冷冻且冻干以获得最终产物。将需要另外脱保护的二硫化物插入物如上所描述初始分离,接着进行必要的第二脱保护步骤(参见下文):醛-二硫化物磷酸三酯第二脱保护:将rp-hplc纯化的寡聚物产物再悬浮于100μl的80%甲酸中。使反应在室温下进行1小时/醛修饰。通过maldi-tof质谱法监测反应以确认完全脱保护。一旦脱保护完成,就将样品冷冻且冻干直到干燥。然后将冻干的样品再悬浮于1ml的20%乙腈中且凝胶过滤以用于分离最终寡聚物产物。羟基-二硫化物磷酸三酯第二脱保护:将rp-hplc纯化的寡聚物产物再悬浮于219μl的无水dmso中,短暂加热至65℃,并且彻底地涡旋。向dmso溶液中添加31μl的6.1m三乙胺三氟化氢(tea.3hf)以得到0.75m的最终浓度。使反应在室温下进行1小时/tbdms-保护的羟基修饰。通过maldi-tof质谱法监测反应以确认完全脱保护。一旦脱保护完成,就添加35μl的3m乙酸钠,接着添加1ml的丁醇。将样品彻底地涡旋且置于-80℃下持续2小时。在2小时之后,将样品离心以沉淀寡核苷酸。除去丁醇层,并且将寡聚物沉淀再悬浮于1ml的20%乙腈中。将样品凝胶过滤以用于分离最终寡聚物产物。包含寡核苷酸的甲基膦酸酯合成:使用本文所述的标准寡核苷酸合成方案,使用市售的对甲基亚磷酰胺,合成甲基膦酸寡核苷酸。例如,在合成中使用以下市售的p-甲基亚膦酰胺单体:包含寡核苷酸的磷酸酯合成:以下通式的氨基磷酸酯寡核苷酸来自相应的亚磷酸酯(h-磷酸酯)和胺。通用方案:实验详情:所有制备的寡核苷酸包括2’-f或2’-ome修饰的核糖以改进血清稳定性并且使脱靶效应最小化。使用以下步骤进行自动寡核苷酸合成(1μmol规模):去封闭-3%三氯乙酸(每个循环2x40秒去封闭)偶联-在无水乙腈:吡啶(1:1)中1:1的新戊酰氯(0.5m)和3’-h-膦酸酯(0.1m),x2次氧化步骤-4.5:4.5:1的ccl4/吡啶/正丁胺(手动,每个循环2×120秒)封端混合物a-thf/吡啶/pac2o(每个循环60秒封端)封端混合物b-thf中的16%甲基咪唑(每个循环60秒封端)标准寡核苷酸合成条件的例外是如下:-使用用于更温和脱保护的具有q-连接子(氢醌-o,o’-二乙酸连接子臂)的cpg支持体;-在合成之前将保护的3’-h-磷酸酯在1:1无水乙腈和吡啶中重悬浮至100mm;-在合成前将新戊酰氯溶解在1:1无水乙腈和吡啶中,以给出500mm溶液-手动进行偶联步骤,用5.0倍摩尔过量的新戊酰氯进行受保护的3’-h-磷酸酯活化。每次插入,偶联步骤进行2×5分钟的偶联步骤-通过用90:90:20μl无水ccl4:吡啶:正丁胺的氧化步骤获得氨基磷酸酯键联,持续2×2分钟循环二硫化物磷酸三酯寡核苷酸脱保护和纯化方案:●在自动寡核苷酸合成之后,将二硫化物磷酸三酯寡核苷酸裂解且在室温下在甲醇中的1ml10%二异丙胺(10%dia/meoh)中脱保护4小时。在4小时脱保护之后,将寡聚物样品通过离心蒸发进行干燥。●使用具有标准保护基(如a-bz、c-ac和g-ibu(异丁酸酯)等)的亚磷酰胺和3’-h-膦酸酯单体的寡聚合成,将氨基磷酸酯寡核苷酸在1.0ml的ama(在甲醇中的1:1比例的36%氨水溶液和40%甲胺)中在室温下裂解并去保护2小时,然后离心蒸发。●将粗寡聚物沉淀再悬浮于100μl的50%乙腈中,短暂加热至65℃,并且彻底地涡旋。将总计100μl粗寡聚物样品注入到rp-hplc上,使用以下缓冲液/梯度:-缓冲液a=50mmteaa于水中-缓冲液b=90%乙腈-流速=1ml/分钟ο梯度:·0-2分钟(100%缓冲液a/0%缓冲液b)·2-42分钟(0%至60%缓冲液b)·42-55分钟(60%至100%缓冲液b)●跨主要rp-hplc峰,收集0.5ml级分且通过maldi-tof质谱法进行分析以确认所希望物质的存在。将包含正确物质的纯化级分冷冻且冻干。一旦干燥,就将级分再悬浮,与相应级分合并,冷冻且冻干以获得最终产物。通过缩合反应进行的二硫化物磷酸三酯寡核苷酸共轭-通用方案(参见共轭通用方案1-3):●通过等摩尔混合所希望的过客链和引导链寡聚物来产生二硫化物磷酸三酯双链体。在添加氯化钠至50mm的最终浓度之后,将样品加热至65℃持续5分钟,并且使其冷却至室温以完成退火。●对于醛修饰的二硫化物磷酸三酯寡聚物,将sirna双链体稀释到1x共轭缓冲液中,之后添加所希望的hynic共轭部分。共轭缓冲液:10mmhepes(ph5.5)、20mm苯胺、50mmnacl、50%乙腈●一旦混合上述反应,就将两倍摩尔过量的hynic共轭组分添加至该混合物。使反应在室温下进行1小时。●在1小时之后,将共轭的sirna寡核苷酸通过凝胶过滤、hplc纯化或离心旋转过滤进行分离以在细胞处理之前获得最终产物。通过点击反应进行的二硫化物磷酸三酯寡核苷酸共轭-通用方案(参见共轭通用方案4-9):铜-thpta复合物制备:将五水合硫酸铜(cuso4-5h2o)的5mm水溶液和三(3-羟基丙基三唑基甲基)胺(thpta)的10mm水溶液1:1(v/v)(1:2摩尔比)混合并且使其在室温下静置1小时。这种复合物可用于催化胡伊斯根环加成,例如,参见,通用共轭方案4和5。点击反应(100nm规模)向710ul的水和100ul叔丁醇(10%的最终体积)于1.7ml埃彭道夫管中的溶液添加60ul的铜-thpta复合物,接着添加50ul的2mm寡聚物溶液、60ul的20mm抗坏血酸钠水溶液、以及20ul的10mmgalnac-叠氮化物溶液。在充分混合之后,使该溶液在室温下静置1小时。通过凝胶分析确认反应的完成。将反应混合物添加至包含5-10倍摩尔过量的taacona(树脂结合的edta钠盐)的螺旋盖小瓶中。将混合物搅拌1小时。然后将该混合物通过一个illustratmnaptm-10柱sephadextm进行洗脱。然后将溶液冷冻且冻干过夜。无金属点击反应[3+2]环加成也使用本领域已知的方法用dbco部分进行而不使用铜(参见,例如,朱厄特(jewett)和贝尔托齐(bertozzi),化学会评论(chem.soc.rev.),39:1272-1279,2010)。通用共轭方案1:通用共轭方案2:通用共轭方案3:通用共轭方案4:通用共轭方案5:通用共轭方案6:通用共轭方案7:通用共轭方案8:通用共轭方案9:通用共轭方案10:(a)或者(b)本文所述的共轭方案也适用于非生物可逆性基团,并且与显示生物可逆性基团的共轭方案不同,因为非生物可逆性基团不包括二硫化物。本发明的多核苷酸的具体合成已根据在此描述的方法制备了本发明的多核苷酸。示例性多核苷酸是具有图1a中的序列或图1b中的序列(seqidno:112和113)的sirna构建体。seqidno:113的示例性rp-hplc迹线在图2中示出。包含具有seqidno:113的序列的寡核苷酸的粗反应混合物的质谱在图3中示出。具有seqidno:113的序列的纯化的寡核苷酸的质谱在图4中示出。已根据在此描述的方法制备了本发明的其他多核苷酸。例如,图5a示出具有序列seqidno:112的ssrna,单一ads共轭ssrna包含具有“ads共轭”的结构的5’末端ads共轭位点,并且三重ads共轭ssrna包含三个ads共轭位点,这些位点各自具有“ads共轭”的结构。图5b-5d示出本发明的具有一个或三个核苷酸的多核苷酸中的一些的凝胶分析,其中共轭的靶向部分包含在ads共轭结构的z中。包含过客链的所制备的sirna分子的一般结构在图6a和图6b中示出,该过客链具有包含靶向部分的一个或三个基团。图6a中的引导链具有5’末端cy3部分。本发明的两种示例性多核苷酸包含一个或三个图7a中所示的叶酸-peg11-hynic基团。(叶酸)1-sirnn-cy3是具有序列5’-gcuacauucuggagacauaut(小写字母t是胸苷;seqidno:112)的多核苷酸构建体,该多核苷酸构建体含有共轭至5’-末端g的核苷酸间桥联基团的一个叶酸-peg11-hynic基团。(叶酸)3-sirnn-cy3是具有序列5’-gcuacauucuggagacauaut的多核苷酸构建体,该多核苷酸构建体含有共轭至5’-gcu的三个核苷酸间桥联基团的三个叶酸-peg11-hynic基团。本发明的两种示例性多核苷酸包含一个或三个图7b中所示的(galnac)3-hynic基团。(galnac)3-sirnn-cy3是具有序列5’-gcuacauucuggagacauaut的多核苷酸构建体,该多核苷酸构建体含有共轭至5’-末端g的核苷酸间桥联基团的一个(galnac)3-hynic基团。(galnac)9-sirnn-cy3是具有序列5’-gcuacauucuggagacauaut的多核苷酸构建体,该多核苷酸构建体含有共轭至5’-gcu的三个核苷酸间桥联基团的三个(galnac)3-hynic基团。本发明的两种示例性多核苷酸包含一个或三个图8中所示的man6-lys6-peg24-hynic基团。(甘露糖)6-sirnn-cy3是具有序列5’-gcuacauucuggagacauaut的多核苷酸构建体,该多核苷酸构建体含有共轭至5’-末端g的核苷酸间桥联基团的一个man6-lys6-peg24-hynic基团。(甘露糖)18-sirnn-cy3是具有序列5’-gcuacauucuggagacauaut的多核苷酸构建体,该序列在5’-gcu内包含5’末端生物可逆性基团和两个核苷酸间生物可逆性基团,每个生物可逆性基团包括共轭到的三个核苷酸间基团的man6-lys6-peg24-hynic基团。本发明的其它制备的多核苷酸包含作为非生物可逆性或生物可逆性基团的一部分的与一至十个(例如一至四个)核苷酸间基团共轭的一至三个galnac单体(参见下文)。galnac单体。在表5-9和在图10,11和20a提供了示例性的sirna三酯和共轭物的列表。针对表7,sb-0535包括将第一过客链的3’端连接至第二过客链的5’端的peg6间隔子。将第一过客链与第一引导链杂交,并且将第二过客链与第二引导链杂交。两个引导链不直接与彼此共价键合。从以下亚磷酰胺形成peg6间隔子:sb-0600包括共轭到两个如上表所示的引导链的nag21-bil5连接子。将第一引导链与第一引过客链交,并且将第二引导链与第二过客链杂交。两个过客链不直接与彼此共价键合。sb-0639和sb-0640包括将第一过客链的3'端连接到第二过客链的5'端的c6二硫化物间隔子。将第一过客链与第一引导链杂交,并且将第二过客链与第二引导链杂交。两个引导链不直接与彼此共价键合。从以下亚磷酰胺形成c6二硫化物间隔子:表8在表8中,粗体表示具有与3’-磷酸结合的邻-(叔丁基二硫基)苯乙基基团的核苷酸;已加下划线表示具有键合到3'-磷酸的炔基基团的核苷酸。通过在如本文所述的标准条件下使链退火来制备具有过客链和引导链的沃森-克里克比对的双链体。由表8中所示的链产生的双链体列于表9中。表9在此披露的任何基团可以通过以下非限制性示例性基团中的一个连接至一个核苷酸间桥联磷酸酯或一个末端磷酸酯:和可以根据在此描述的方法来制备本发明的其他多核苷酸。这类多核苷酸可以是如下:(galnac-二硫化物1)或(甘露糖基-二硫化物1)。还可以制备包含直接键合至二硫键联的辅助部分的多核苷酸;示例性多核苷酸在以下示出:(galnac-二硫化物2)和(甘露糖基-二硫化物2)。实例2.体外活性测定荧光素酶表达的抑制合成靶向萤光素酶基因(gl3)的多核苷酸,并用于产生具有生物可逆性基团(二硫化物磷酸二酯或二硫化物磷酸三酯)的多核苷酸构建体。为了评定这些二硫化物磷酸三酯的体外活性,使用稳定地表达荧光素酶(gl3)的人卵巢skov-3细胞。将细胞生长在补充有10%胎牛血清(fbs)、100μg/ml的链霉素、以及100u/ml的青霉素的mccoy氏5a培养基(生命技术公司(lifetechnologies))中。将细胞(1×104/孔)接种在96孔微量滴定板中且在37℃下在5%co2下孵育过夜。对照:使用lipofectaminernaimax(生命技术公司)根据制造商的建议将靶向荧光素酶基因的对照sirna或非靶向对照基因以所指示的浓度(典型地0.01-30nm)转染至细胞中。本发明的多核苷酸构建体:将这些多核苷酸构建体添加至细胞且孵育两小时,在其之后添加相等体积的含有4%fbs的optimem(生命技术公司),并且将这些细胞孵育24-48小时。然后将这些细胞溶解且在添加荧光素(britelitetm,珀金埃尔默(perkinelmer))之后测量细胞内荧光素酶活性,且使用victor2tm光度计(珀金埃尔默)捕获荧光信号。使用celltiterfluortm测定试剂盒(普洛麦格公司(promega))评定细胞毒性,并且将荧光素酶基因的敲除针对细胞毒性进行校正且表示为媒介物对照处理的孔的百分比。使用graphpadprism软件生成荧光素酶敲低ec50值。用于本发明的杂交的多核苷酸(seqidno:112和113)的这一测定的结果在表10中示出(关于结构,参见图1a)。在表10中,r4是2-(苄基氨基羰基)乙基。表10(a)在室温下进行退火以形成sirna双链体。(b)在65℃下进行退火以形成sirna双链体。(c)在室温下进行退火以形成sirna双链体,接着冷冻过夜。(d)阴性对照:含有相同序列的sirna,除了含有二硫化物的这些基团被3,3-二甲基丁基(dmb)置换;dmb(在生理条件下)可逆地连接至磷酸酯。nd=未确定。na=无活性。本发明的杂交的多核苷酸(关于结构参见图1b)的ec50(在第48小时)被测量为1.1nm。表11示出本发明的其他杂交的多核苷酸(关于结构,参见图1a)的数据,其中某些尿苷(用一个箭头标记的)具有一个核苷酸间3’-磷酸三酯,其具有表11中所示的结构。包括生物可逆性和非生物可逆性基团的sirna的体外转染数据在图12中提供。在skov-3-luc细胞中的转染数据:表11seqidno:112:gcuacauucuggagacauautseqidno:113:tucgauguaagaccucuguau小鼠原代肝细胞分离和体外实验:使用标准的两步胶原酶灌注技术分离原代小鼠肝细胞(李(li)等人,分子生物学方法(methodsmol.biol.),633:185-196;2010;其公开内容通过引用以其全文并入本文)。简言之,将6-10周龄雌性c57/bl6小鼠通过腹膜内注射氯胺酮(80-100mg/kg)/甲苯噻嗪(5-10mg/kg)的混合物来进行麻醉。然后使腹腔暴露,并且使用一个22g针对内脏腔静脉插管。将肝静脉切断,并且使用含有0.5mmetda的磷酸盐缓冲盐水(pbs)的溶液将肝立即灌注5-10分钟。将该溶液立即转移至胶原酶(100iu/ml)于杜氏改良的伊格尔氏培养基(dmem,gibco)的溶液中持续另外5-10分钟。在灌注结束时,将肝除去,并且将肝细胞在4℃下收集在含有10%胎牛血清的的dmem中。然后将这些细胞通过一个70μm无菌过滤器过滤,在同一溶液中洗涤三次,并且使用台盼蓝染色评定细胞活力。然后将细胞接种在涂覆有0.1%大鼠尾胶原或2%基质胶的96孔板中,并且在37℃下在一个5%co2孵育器中孵育3-4小时。然后将测试化合物添加至细胞并且在37℃下在一个5%co2孵育器中孵育。在孵育期结束时,将细胞溶解,分离mrna,并且通过qpcr测量靶基因的表达且使用标准方案将该表达针对一种管家基因标准化。结果绘制在图13a和13b中,并提供在表12中。表12实例3.细胞结合实验二硫化物磷酸三酯寡核苷酸-cy3细胞结合通用方案:将包含二硫键生物可逆性基团的本发明的多核苷酸构建体以10mm的终浓度退火至g2’mod-cy3(引导链)。细胞处理设置:在48孔板中每孔接种40,000个细胞;使细胞粘附过夜。然后,将细胞用500μl的pbs洗涤一次,然后添加150μl处理(注意:对于游离叶酸样品,在处理之前将细胞用含有2.3mm叶酸的培养基处理1小时)。将细胞处理4小时;在4小时之后,将细胞用pbs洗涤一次,胰蛋白酶化且通过流式细胞术针对sirna-cy3细胞缔合进行分析。这些实验的结果显示于图14a、14b、15a、15b、16a和16b中。图14a示出结合至kb细胞的(叶酸)3-sirnn-cy3共轭物的剂量曲线。图14b示出测定(叶酸)3-sirnn-cy3和(叶酸)1-sirnn-cy3共轭物的解离常数(kd)的一个曲线图。图15a示出结合至hepg2细胞的(galnac)9-sirnn-cy3共轭物的剂量曲线。图15b示出测定(galnac)9-sirnn-cy3和(galnac)3-sirnn-cy3共轭物的解离常数(kd)的一个曲线图。图16a示出结合至原代腹膜巨噬细胞的(甘露糖)18-sirnn-cy3共轭物的剂量曲线。图16b示出测定(甘露糖)18-sirnn-cy3和(甘露糖)6-sirnn-cy3共轭物的解离常数(kd)的一个曲线图。实例4.体内活性测定使用雄性nfκb-re-luc小鼠(泰康利(taconic))测试荧光素酶二硫化物磷酸三酯分子的体内活性。这些小鼠在整个身体(包括肝)中表达荧光素酶基因(gl3),并且荧光素酶活性可通过nfκb活化剂如tnfα诱导。将测试剂(荧光素酶二硫化物磷酸三酯、野生型荧光素酶sirna序列、以及一种非靶向对照sirna序列)与invivofectamine2.0试剂(生命科学公司)根据制造商的建议复合并且使用无菌胰岛素注射器注射(约200μl,7mg/kg体重)至尾静脉中(n=1-2小鼠/处理)。将两只另外小鼠注射相同体积的媒介物并且充当一种模拟处理对照。在注射后二十四小时,使小鼠经受腹膜内注射鼠tnfα(0.03μg/g)以便诱导肝荧光素酶活性。在tnfα注射之后四小时,将小鼠腹膜内注射d-荧光素(150mg/kg),并且在d-荧光素注射之后大约10分钟使用ivislumina全身成像仪(珀金埃尔默)测量肝荧光素酶活性。在sirna给予之后第3、第6和第8天再次对小鼠成像以便如上所述评定肝荧光素酶活性。这一测定的结果在图17中示出。体内实验:将测试化合物经由皮下或静脉内(侧尾静脉)注射(200μl;3只小鼠/处理)给予至雌性c57bl6小鼠。在注射后的适当时间点,将小鼠杀死且通过心脏穿刺收集血液样品。收集大约50-100mg的肝样品片并且立即冷冻在液氮中。使用标准方案从肝匀浆分离总mrna,并且使用标准方案将靶基因的表达通过qpcr定量且标准化至一种管家基因。结果示于图18a、18b、19a、19b和20b中(对于用于产生图20b中的数据的sirna结构,参见图20a)。关于小鼠肝细胞的示例性分离和培养程序,参见:李(li)等人,分子生物学方法(methodsmol.biol.),633:185-196;2010;该文献的披露内容通过引用以其全部内容结合在此。药理学:表13剩余的apobmrna%*表14剩余at3血浆活性*gapdh-甘露糖共轭物证明剂量依赖性的体内活性方案1:雌性c57bl6小鼠接受3%硫代乙醇酸(thioglycollate)(2.5ml)的腹膜内(ip)注射。在硫代乙醇酸(thioglycollate)注射后6小时、24小时、和48小时通过ip注射给予测试化合物(10mg/kg)(三次剂量)。24小时后通过用冰冷的pbs洗涤腹膜腔来收获腹膜巨噬细胞。用pbs洗涤细胞两次,重悬于包含10%胎牛血清的rpmi中,并在96孔板中铺板3小时以允许巨噬细胞粘附。然后将细胞洗涤,裂解,并使用标准方法萃取总mrna。gapdh基因的表达通过rtqpcr来定量,并且标准化至管家基因。结果提供在图21a中。方案2:雌性c57bl6小鼠接受3%硫代乙醇酸(2.5ml)的腹膜内(ip)注射。在硫代乙醇酸注射后6h和24h通过ip注射给予测试化合物(2次剂量)。24小时后通过用冰冷的pbs洗涤腹膜腔来收获腹膜巨噬细胞。用pbs洗涤细胞两次,重悬于包含10%胎牛血清的rpmi中,并在37℃下在5%co2气氛下在96孔板中铺板3小时以允许巨噬细胞粘附。然后洗涤细胞以除去非巨噬细胞细胞,裂解,并使用标准方法萃取总mrna。gapdh基因的表达通过rtqpcr来定量,并且标准化至管家基因。结果提供在图21b中。方案3:雌性c57bl6小鼠接受3%硫代乙醇酸(2.5ml)的腹膜内(ip)注射。在硫代乙醇酸注射后24h通过ip注射给予测试化合物(单次剂量)。2小时后通过用冰冷的pbs洗涤腹膜腔来收获腹膜巨噬细胞。用pbs洗涤细胞两次,重悬于包含10%胎牛血清的rpmi中,并在37℃下在5%co2气氛下在96孔板中铺板3小时以允许巨噬细胞粘附。通过pbs洗去非巨噬细胞,并且将巨噬细胞在含有10%胎牛血清的rpmi中在37℃,5%co2气氛下孵育48小时。然后将细胞裂解,并通过rtqpcr来定量gapdh基因的表达,并标准化至管家基因。结果提供在图22中。实例5:小鼠原代骨髓祖细胞分离和使用巨噬细胞的体外实验:方案1:小鼠原代骨髓祖细胞是根据已披露的方案从雌性c57bl6小鼠的股骨和胫骨分离的。将细胞立即用4℃的pbs洗涤并且以2×106个细胞/ml悬浮于含有10%胎牛血清和20ng/ml重组小鼠m-csf的的rpmi中。将细胞接种在96孔板中并且在37℃下在5%co2气氛下孵育7天以便允许分化成巨噬细胞。将细胞每24小时洗涤以便除去潜在非巨噬细胞污染。将细胞基于甘露糖受体表达在第7天使用。随时间推移的甘露糖受体表达在图23a中用曲线表示。将来自表5和7的测试化合物稀释于无血清optimem中且与细胞孵育48小时。然后将细胞溶解,萃取总mrna,并且使用rtqpcr定量gapdh基因的表达且标准化至管家基因。结果在图23b中示出。方案2:小鼠原代骨髓祖细胞是根据已披露的方案从雌性c57bl6小鼠的股骨和胫骨分离的。将细胞立即用4℃的pbs洗涤并且以2×106个细胞/ml悬浮于含有10%胎牛血清和20ng/ml重组小鼠csf的的rpmi中。将细胞接种在96孔板中并且在37℃下在5%co2气氛下孵育3天以便允许分化成巨噬细胞。在第4天,添加重组小鼠il-4(20ng/ml),并将细胞在37℃,5%co2气氛下再孵育48小时。将测试化合物稀释于optimem中且与细胞孵育48小时。然后将细胞溶解,萃取总mrna,并且通过rtqpcr定量gapdh基因的表达且标准化至管家基因。结果在图24a中示出。方案3:根据公开的方案从b-肌动蛋白-luc小鼠(fvb/ntac-tg-actb-luc-46xen,泰康利(taconic))的股骨和胫骨中分离小鼠原代骨髓祖细胞。将细胞立即用4℃的pbs洗涤并且以2×106个细胞/ml悬浮于含有10%胎牛血清和20ng/ml重组小鼠m-csf的的rpmi中。将细胞接种在96孔板中并且在37℃下在5%co2气氛下孵育3天以便允许分化成巨噬细胞。在第4天,添加重组小鼠il-4(20ng/ml),并将细胞在37℃,5%co2气氛下再孵育48小时。将测试化合物稀释于optimem中且与细胞孵育48小时。通过添加britelitetm(珀金埃尔默)评估萤光素酶活性。结果在图24b中示出。例6:小鼠血清稳定性如下所述进行包含寡核苷酸(单链和双链)的三酯的血清稳定性的评价。方案:制备20μl的250μmdsrna储备液;从每份中取出4μl,并置于16μl新鲜的小鼠血清中;将20μl样品置于pcr板中并在37℃下在热循环仪上加热;在指定的时间点取出2μl,添加到18μl甲酰胺上样缓冲液中,并在凝胶分析前冷冻;每孔加载2μl用于通过凝胶电泳分析(15%变性凝胶;溴化乙锭染色)。结果示于图25中。其他实施例本发明的所描述装置和使用方法的各种修改和变化对于本领域的技术人员将是显而易知的,而不背离本发明的范围和精神。虽然已结合特定实施例描述了本发明,但应当理解,要求保护的本发明不应不适当地限于这类特定实施例。事实上,本领域技术人员显而易知的用于执行本发明的所描述模式的各种修改预期在本发明的范围内。其他实施例在权利要求中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1