联合疗法的制作方法
本公开涉及药物组合,例如产品,包括以下组合:(i)met抑制剂或其药学上可接受盐或水合物和(ii)egfr(erbb-1)抑制剂,它们联合有效于增生性疾病的治疗,和对应的药物制剂、应用、方法、工艺、商业包装以及相关实施方式。
发明背景
设计成针对单个分子靶标的药物通常不适合抵御有一个以上靶标作为病因的疾病(多基因疾病),如癌或其它增生性疾病。
为抵御这类疾病,一种方法是使用单一多靶点药物——然而,这要求成因性地参与疾病表现的靶标都被所考虑的药物命中。另一方面,多靶点药物可能导致不想要的副作用,因为其可能也影响不参与疾病表现的靶标。
一种不同的方法是使用药物组合作为多靶点药物。在最佳情况下,这可产生合并效率,如协同,由此甚至可能减少由单一药物在单独使用时所导致的副作用。
有时候,这类药物的组分(组合伴侣)可能影响不同靶标而产生组合效应,并由此可能产生超出单一化合物所能达到的,和/或当分别考虑它们在同一通路或不同通路中、在单个细胞内或不同组织的不同细胞内的孤立效应时所能达到的,组合效应。或者,一种组分可能改变另一种组分到达其靶标的能力,例如通过抑制外排泵等。又或者,组合伴侣能结合同一靶标的不同位点。靶标连接度的这些变化阻碍了对合适组合的寻找,这是因为它大幅增加了对于组合或许可用或无用的可能的相互作用类型。
然而,在许多情况下可能找不到所期望的采用这类药物的协作或甚至协同性。由于成对(r=2)药物组合数(根据公式n!/(r!(n-r)!))随着所测试试剂数n增加(例如,测试2000种试剂会产生1,999,000个独特的成对组合),需要允许高效率的合适筛选方法。
另外,考虑任何组合前,一项关键要求是鉴定成因性地或支持性地参与疾病表现的通路、酶、代谢状态等。
许多情况下,甚至完全不知道给定疾病是多基因疾病。
因此,对合适组合和量的搜索可恰当地比喻为大海捞针。
原癌基因cmet(met)编码蛋白质肝细胞生长因子受体(hgfr),hgfr具有酪氨酸激酶活性且对于胚胎发育和伤口愈合是必不可少的。受肝细胞生长因子(hgfr)刺激后,met诱导数种生物反应,引起侵袭性生长。异常met活化在多种不同类型的恶性肿瘤中(触发肿瘤生长、新血管形成(血管生成)和瘤转移,包括包括肾癌、肝癌、胃癌、乳腺癌和脑癌。许多met激酶抑制剂是已知的,或者称作hgf诱导的met(=hgfr)活化的抑制剂。c-met(或c-met信号通路)在正常组织和人恶性肿瘤如癌中的生物功能已有文献详尽记载(christensen,j.g.等,cancerlett.2005,225(1):1-26;corso,s.等,trendsinmol.med.2005,11(6):284-292)。
失调的c-met(c-met)通路在肿瘤形成、生长、维持和发展中起着重要且有时是成因(基因改变的情况下)性的作用(birchmeier,c.等,nat.rev.mol.cell.biol.2003,4(12):915-925;boccaccio,c.等,nat.rev.cancer2006,6(8):637-645;christensen,j.g.等,cancerlett.2005,225(1):1-26)。hgf和/或c-met在大多数人类癌症的大部分中过表达,且通常与不良临床结果相关,如疾病更具侵袭性、疾病发展、肿瘤转移和患者存活期缩短。此外,hgf/c-met蛋白水平高的患者对化疗和放疗的抗性更大。除了异常hgf/c-met表达,c-met受体也能通过基因突变(胚系突变和体细胞突变)和基因扩增在癌症患者中活化。尽管基因扩增和突变是已报告在患者中最常见的基因改变,所述受体还能通过缺失、截断、基因重排来活化。
多种涉及c-met的癌症包括但不限于:上皮细胞肿瘤如膀胱癌、乳腺癌、子宫颈癌、胆管癌、结直肠癌、食管癌、胃癌、头颈癌、肾癌、肝癌、肺癌、鼻咽癌、卵巢癌、胰腺癌、前列腺癌、甲状腺癌);肌肉骨骼肉瘤(如骨肉瘤、滑膜肉瘤、横纹肌肉瘤);软组织肉瘤(如mfh/纤维肉瘤、平滑肌肉瘤、卡波济氏肉瘤);造血系统恶性肿瘤(如多发性骨髓瘤、淋巴瘤、成人t细胞白血病、急性骨髓性白血病、慢性髓性白血病);和其它赘生物(如成胶质细胞瘤、星形细胞瘤、黑素瘤、间皮瘤和肾母细胞瘤)(www.vai.org/met/;christensen,j.g.等,cancerlett.2005,225(1):1-26)。
活化的c-met通路有助于肿瘤形成和发展且有可能成为有效癌症干预的良好靶标,这一想法已得到大量临床前研究的进一步巩固(birchmeier,c.等,nat.rev.mol.cellbiol.2003,4(12):915-925;christensen,j.g.等,cancerlett.2005,225(1):1-26;corso,s.等,trendsinmol.med.2005,11(6):284-292)。例如,研究显示tpr-met融合基因、c-met过表达和活化的c-met突变(本文统称为met)全都引起多个模型细胞系的致癌性转化并导致小鼠肿瘤形成和转移。更重要的是,采用特异性损坏和/或阻断hgf/c-met信号转导的试剂在体内和体外均已证实了显著的抗肿瘤(有时是肿瘤抑制)和抗转移活性。这些试剂包括抗hgf和抗c-met抗体、hgf肽拮抗剂、诱饵c-met受体、c-met肽拮抗剂、显性负c-met突变、c-met特异性反义寡核苷酸和核酶、以及选择性小分子c-met激酶抑制剂(christensen,j.g.等,cancerlett.2005,225(1):1-26)。
除了在癌中已确立的作用,异常hgf/met信号转导也参与动脉粥样硬化、肺纤维化、肾纤维化和再生、肝病、变应性紊乱、炎症和自身免疫性疾病、脑血管疾病、心血管疾病、与器官移植相关的病症(ma,h.等,atherosclerosis.2002,164(1):79-87;crestani,b.等,lab.invest.2002,82(8):1015-1022;sequra-flores,a.a.等,rev.gastroenterol.mex.2004,69(4)243-250;morishita,r.等,curr.genether.2004,4(2)199-206;morishita,r.等,endocr.j.2002,49(3)273-284;liu,y.,curr.opin.nephrol.hypertens.2002,11(1):23-30;matsumoto,k.等,kidneyint.2001,59(6):2023-2038;balkovetz,d.f.等,int.rev.cytol.1999,186:225-250;miyazawa,t.等,j.cereb.bloodflowmetab.1998,18(4)345-348;koch,a.e.等,arthritisrheum.1996,39(9):1566-1575;futamatsu,h.等,circ.res.2005,96(8)823-830;eguchi,s.等,clin.transplant.1999,13(6)536-544)。
表皮生长因子受体(egfr,akaerbb-1;人中的her1)是表皮生长因子家族配体的受体。已知数种癌症依赖egfr过度活跃或过表达,如肺癌、肛门癌、多形性成胶质细胞瘤和许多其它(主要是)上皮细胞肿瘤。
癌通常依赖于例如通过点突变、基因扩增或染色体易位而产生的受体酪氨酸激酶(rtk)的遗传改变,这些改变导致这些rtk不受控制的活性由此而具致癌性。癌细胞的细胞增殖依赖于这些异常rtk的活性。
当治疗所造成的增生性疾病时,常使用所涉及的癌基因rtk的抑制剂。然而,通常在一定治疗时间后,观察到对所用药物的抗性。一种抗性机制可能涉及靶rtk,影响治疗剂的结合或活性。另一机制是替代性激酶的补偿激活,所述激酶在主要激酶受抑制时继续推动癌生长。一个已被深入了解的涵盖两种机制类型的示例是,在带有活化的egfr突变的非小细胞癌(nsclc)中对表皮生长因子受体(egfr)吉非替尼和埃罗替尼的获得性耐药(参见lynch,t.j.,等,.nengljmed,350:2129-2139,2004;或paez,j.g.,等,science,304:1497-1500,2004)。例如,met活化可通过下游激活信号分子如her3来补偿egfr活性丢失(通过抑制),如met扩增可补偿,或其配体肝细胞生长因子可活化met(参见engelman,j.a.等,science,316:1039-1043,2007;yano,s.等,cancerres,68:9479-9487,2008;和turke,a.b.等,cancercell,17:77-88,2010)。还已知met依赖性癌细胞系(其增殖依赖于met活性)能通过配体诱导的egfr激活而从met抑制剂中被挽救(参见bachleitner-hofmann,t.等,.molcancerther,7:3499-3508,2008)。
wo2013/149581公开了各种不同cmet抑制剂与各种不同egfr抑制剂的组合。其涉及含以下组合的药物产品:(i)met抑制剂和(ii)egfr抑制剂,或其各自药学上可接受盐或水合物、或其前药,它们联合有效于增生性疾病的治疗,对应的药物制剂、应用、方法、工艺、商业包装以及相关实施方式。
技术实现要素:
本公开涉及药物组合,其包含
(i)met酪氨酸激酶抑制剂,其是具有下式的inc280
或其药学上可接受盐或水合物,
(ii)egfr酪氨酸激酶抑制剂,其是具有式(x)的化合物或其互变异构体:
其中a环是6-10元单环或双环芳基;5-10元杂芳基,包括1-4个选自n、o和s的杂原子;或4-12元单环或双环杂环基,包括1-4个选自n、o和s的杂原子,可选用氧代基团取代;
b环是苯基;5-6元杂芳基,包括1-3个选自n、o和s的杂原子;或5-6元杂环基,包括1-2个选自n、o和s的杂原子,可选用氧代基团取代;
e是nh或ch2;
r1、r1’和r2独立地是氢;卤素;氰基;c1-6烷基;c1-6卤代烷基;5-6元杂芳基,包括1-4个选自n、o和s的杂原子;苯基,5-6元杂环基,包括1-2个选自n、o、s和p的杂原子,可选用氧代基团取代;-x1-c(o)or3;-x1-o-c(o)r3;-x1-c(o)r3;-x1-c(o)nr4r5;-x1-c(o)nr4-x3-c(o)or3;-x1-c(o)nr4-x3-s(o)0-2r6;-x1-nr4r5;-x1nr4-x2-c(o)r3;-x1-nr4-x2-c(o)or3;-x1-nr4-x2-c(o)nr4r5;-x1-nr4-x3-s(o)0-2r6;-x1-nr4s(o)2r6;-x1-os(o)2r6;-x1-or3;-x1-o-x4-or3;-x1-o-x4-s(o)0-2r6;-x1-o-x4-nr4r5;-x1-s(o)0-2r6;-x1-s(o)0-2-x3-nr4r5;-x1-c(o)nr4-x3-p(o)r6ar6b;-x1-nr4-x1-p(o)r6ar6b;-x1-o-x1-p(o)r6ar6b;-x1-p(o)r6a-x1-nr4r5;-x1-p(o)r6ar6b或-x1-s(o)2nr4r5;其中r1或r2内的各苯基、杂芳基或杂环基未取代或取代有1-3个选自oh、卤素、c1-6烷基、c1-6卤代烷基和c1-6卤代烷氧基的基团;
r3、r4和r5独立地是氢、c1-6烷基或c1-6卤代烷基;或其中r4和r5可与nr4r5中的n一起形成4-7元环,所述环包含1-2个选自n、o、s和p的杂原子,可选用1-4个r7取代;
r6是c1-6烷基或c1-6卤代烷基;
r6a和r6b独立地是羟基、c1-6烷基、c1-6卤代烷基、c1-6烷氧基、c1-6卤代烷氧基、6-10元单环或双环芳基;5-10元杂芳基,包括1-4个选自n、o和s的杂原子;或4-12元单环或双环杂环基,包括1-4个选自n、o和s的杂原子,可选用氧代基团取代;
z是
r8是
r9和r10独立地是氢、卤素、c1-6烷基、c1-6卤代烷基、oh、氰基、c1-6烷氧基、c1-6卤代烷氧基;
r11a,r11b,r11c,r11d,r11e,r11f,r11g,r11h,r11i,r11j,r11k和r11l独立地是氢、c1-6烷基或c1-6卤代烷基;
r12和r13独立地是氢、卤素、氰基、c1-6烷基或c1-6卤代烷基;
r14和r15独立地是氢、c1-6烷基、–l1-r23、-(crarb)2-3-rc或–l2-rd;或r14和r15可与nr14r15中的n一起形成4-7元环,所述环包含1-2个选自n、o、s和p的杂原子,可选用1-4个r18基团取代;
r16和r17独立地是氢或c1-6烷基;或r16和r17可与其结合的碳一起形成c3-6环烷基;
x1和x2独立地是键或c1-6烷基;
x3是c1-6烷基;
x4是c2-6烷基;
r19是氢、c1-6烷基、cor20、coor20、conr20r21或s(o)2r20;
r20是c1-6烷基、c1-6卤代烷基或环烷基;
r21是氢或c1-6烷基;或r20和r21可与nr20r21中的n一起形成4-7元环,所述环包含1-2个选自n、o、s和p的杂原子,可选用1-4个r22基团取代;
r7、r18和r22独立地是氧代基团、卤素、羟基、c1-6烷基、c1-6卤代烷基、c1-6烷氧基或c1-6卤代烷氧基;
r23独立地是c3-7环烷基或4-10元杂环,所述杂环包括1-3个选自n、o和s的杂原子且可选用氧代基团取代;r23未取代或取代有c1-6烷基、c1-6卤代烷基、-l3-re或–l4-rf;
rc和re独立地是卤素、氰基、羟基、-or24、-nrr25、-nr-co2r24、-nr-so2-r26、-nr-cor26、-nr-c(o)-nrr25、-oc(o)-nrr25,或用卤素、c1-6烷氧基、羟基或氰基取代的c1-6烷基;
rd和rf独立地是-so2nrr25、-conrr25、-c(o)or24、-so2r26或c(o)r26;
r24是c1-6烷基、c1-6卤代烷基、–l2-r23a或–(crarb)2-3-n(rarb)2;
r25是氢、c1-6烷基、c1-6卤代烷基、–l2-r23b或–(cr2)2-3-n(rarb)2;
r26是c1-6烷基、c1-6卤代烷基、–l2-r23c或–(crarb)1-3-n(rarb)2;
r23a、r23b和r23c独立地选自r23;
r、ra和rb独立地是氢或c1-6烷基;
l1、l2、l3和l4独立地是键或–(crarb)1-3;和
n和m独立地是1-3;且p和q是1-4;
或其药学上可接受盐;和
(iiii)至少一种药学上可接受载体。
本公开还涉及药物组合,包括
(i)met酪氨酸激酶抑制剂,其是具有下式的inc280
或其药学上可接受盐或水合物,
(ii)egfr酪氨酸激酶抑制剂,其是具有如上所述式(x)的化合物或其互变异构体:
或其药学上可接受盐。
在所述组合的一个实施方式中,所述egfr酪氨酸激酶抑制剂是化合物a,其化学名为(r,e)-n-(7-氯-1-(1-(4-(二甲基氨基)丁-2-烯酰)氮杂环庚烷-3-基)-1h-苯并[d]咪唑-2-基)-2-甲基异烟酰胺且具有结构
wo2013/184757详细描述本公开的egfr酪氨酸激酶抑制剂。特别地,wo2013/184757的实施例5描述化合物a。
在所述组合的一个实施方式中,所述inc280采用其二盐酸盐形式。
在另一实施方式中,所述inc280采用二盐酸盐一水合物形式。
在所述组合的一个实施方式中,所述met酪氨酸激酶抑制剂和egfr酪氨酸激酶抑制剂同时、分开或依序给药。
本公开还涉及治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导的疾病尤其是癌的方法,包括给予含以下的药物组合
(i)met酪氨酸激酶抑制剂,其是具有下式的inc280
或其药学上可接受盐或水合物,
(ii)egfr酪氨酸激酶抑制剂,其是具有式(x)的化合物或其互变异构体:
其中a环是6-10元单环或双环芳基;5-10元杂芳基,包括1-4个选自n、o和s的杂原子;或4-12元单环或双环杂环基,包括1-4个选自n、o和s的杂原子,可选用氧代基团取代;
b环是苯基;5-6元杂芳基,包括1-3个选自n、o和s的杂原子;或5-6元杂环基,包括1-2个选自n、o和s的杂原子,可选用氧代基团取代;
e是nh或ch2;
r1、r1’和r2独立地是氢;卤素;氰基;c1-6烷基;c1-6卤代烷基;5-6元杂芳基,包括1-4个选自n、o和s的杂原子;苯基,5-6元杂环基,包括1-2个选自n、o、s和p的杂原子,可选用氧代基团取代;-x1-c(o)or3;-x1-o-c(o)r3;-x1-c(o)r3;-x1-c(o)nr4r5;-x1-c(o)nr4-x3-c(o)or3;-x1-c(o)nr4-x3-s(o)0-2r6;-x1-nr4r5;-x1nr4-x2-c(o)r3;-x1-nr4-x2-c(o)or3;-x1-nr4-x2-c(o)nr4r5;-x1-nr4-x3-s(o)0-2r6;-x1-nr4s(o)2r6;-x1-os(o)2r6;-x1-or3;-x1-o-x4-or3;-x1-o-x4-s(o)0-2r6;-x1-o-x4-nr4r5;-x1-s(o)0-2r6;-x1-s(o)0-2-x3-nr4r5;-x1-c(o)nr4-x3-p(o)r6ar6b;-x1-nr4-x1-p(o)r6ar6b;-x1-o-x1-p(o)r6ar6b;-x1-p(o)r6a-x1-nr4r5;-x1-p(o)r6ar6b或-x1-s(o)2nr4r5;其中r1或r2内的各苯基、杂芳基或杂环基未取代或取代有1-3个选自oh、卤素、c1-6烷基、c1-6卤代烷基和c1-6卤代烷氧基的基团;
r3、r4和r5独立地是氢、c1-6烷基或c1-6卤代烷基;或其中r4和r5可与nr4r5中的n一起形成4-7元环,所述环包含1-2个选自n、o、s和p的杂原子,可选用1-4个r7取代;
r6是c1-6烷基或c1-6卤代烷基;
r6a和r6b独立地是羟基、c1-6烷基、c1-6卤代烷基、c1-6烷氧基、c1-6卤代烷氧基、6-10元单环或双环芳基;5-10元杂芳基,包括1-4个选自n、o和s的杂原子;或4-12元单环或双环杂环基,包括1-4个选自n、o和s的杂原子,可选用氧代基团取代;
z是
r8是
r9和r10独立地是氢、卤素、c1-6烷基、c1-6卤代烷基、oh、氰基、c1-6烷氧基、c1-6卤代烷氧基;
r11a,r11b,r11c,r11d,r11e,r11f,r11g,r11h,r11i,r11j,r11k和r11l独立地是氢、c1-6烷基或c1-6卤代烷基;
r12和r13独立地是氢、卤素、氰基、c1-6烷基或c1-6卤代烷基;
r14和r15独立地是氢、c1-6烷基、–l1-r23、-(crarb)2-3-rc或–l2-rd;或r14和r15可与nr14r15中的n一起形成4-7元环,所述环包含1-2个选自n、o、s和p的杂原子,可选用1-4个r18基团取代;
r16和r17独立地是氢或c1-6烷基;或r16和r17可与其结合的碳一起形成c3-6环烷基;
x1和x2独立地是键或c1-6烷基;
x3是c1-6烷基;
x4是c2-6烷基;
r19是氢、c1-6烷基、cor20、coor20、conr20r21或s(o)2r20;
r20是c1-6烷基、c1-6卤代烷基或环烷基;
r21是氢或c1-6烷基;或r20和r21可与nr20r21中的n一起形成4-7元环,所述环包含1-2个选自n、o、s和p的杂原子,可选用1-4个r22基团取代;
r7、r18和r22独立地是氧代基团、卤素、羟基、c1-6烷基、c1-6卤代烷基、c1-6烷氧基或c1-6卤代烷氧基;
r23独立地是c3-7环烷基或4-10元杂环,所述杂环包括1-3个选自n、o和s的杂原子且可选用氧代基团取代;r23未取代或取代有c1-6烷基、c1-6卤代烷基、-l3-re或–l4-rf;
rc和re独立地是卤素、氰基、羟基、-or24、-nrr25、-nr-co2r24、-nr-so2-r26、-nr-cor26、-nr-c(o)-nrr25、-oc(o)-nrr25,或用卤素、c1-6烷氧基、羟基或氰基取代的c1-6烷基;
rd和rf独立地是-so2nrr25、-conrr25、-c(o)or24、-so2r26或c(o)r26;
r24是c1-6烷基、c1-6卤代烷基、–l2-r23a或–(crarb)2-3-n(rarb)2;
r25是氢、c1-6烷基、c1-6卤代烷基、–l2-r23b或–(cr2)2-3-n(rarb)2;
r26是c1-6烷基、c1-6卤代烷基、–l2-r23c或–(crarb)1-3-n(rarb)2;
r23a、r23b和r23c独立地选自r23;
r、ra和rb独立地是氢或c1-6烷基;
l1、l2、l3和l4独立地是键或–(crarb)1-3;和
n和m独立地是1-3;且p和q是1-4;
或其药学上可接受盐;和
(iiii)可选至少一种药学上可接受载体。
在所述方法的一个实施方式中,所述egfr酪氨酸激酶抑制剂是化合物a,化学名为(r,e)-n-(7-氯-1-(1-(4-(二甲基氨基)丁-2-烯酰)氮杂环庚烷-3-基)-1h-苯并[d]咪唑-2-基)-2-甲基异烟酰胺且具有结构
化合物a可采用药学上可接受形式,如盐酸盐形式或甲磺酸盐形式。
在所述方法的一个实施方式中,所述inc280采用其二盐酸盐形式。
在另一实施方式中,所述inc280采用二盐酸盐一水合物形式。
在所述方法的一个实施方式中,所述met酪氨酸激酶抑制剂和egfr酪氨酸激酶抑制剂同时、分开或依序给药。
在所述方法的一个实施方式中,所述癌症选自上皮细胞肿瘤(如膀胱癌、乳腺癌、子宫颈癌、胆管癌、结直肠癌、食管癌、胃癌、头颈癌、肾癌、肝癌、肺癌、鼻咽癌、卵巢癌、胰腺癌、前列腺癌、甲状腺癌);肌肉骨骼肉瘤(如骨肉瘤、滑膜肉瘤、横纹肌肉瘤);软组织肉瘤(如mfh/纤维肉瘤、平滑肌肉瘤、卡波济氏肉瘤);造血系统恶性肿瘤(如多发性骨髓瘤、淋巴瘤、成人t细胞白血病、急性骨髓性白血病、慢性骨髓性白血病);和其它赘生物(如成胶质细胞瘤、星形细胞瘤、黑素瘤、间皮瘤和肾母细胞瘤)。
在所述方法的一个实施方式中,所述癌症是非小细胞肺癌(nsclc)。
在所述方法的另一实施方式中,所述癌症是转移性非小细胞肺癌。
在所述方法的另一实施方式中,所述癌症是结直肠癌(crc)。
在所述方法的另一实施方式中,所述癌症是转移性结直肠癌(mcrc)。
在所述方法的另一实施方式中,所述癌症是头颈癌。
在所述方法的另一实施方式中,所述癌症是转移性头颈癌。
在所述方法的另一实施方式中,所述癌症是头颈部鳞状细胞癌(hnscc)。
附图说明
图1-4证明化合物a与inc280组合的效果。
图5示供体研究和确认埃罗替尼抗性nci-hcc827异种移植模型。
图6示通过prtk分析确认磷酸化met活性。
图7示供体研究和确认化合物a抗性nci-hcc827异种移植模型。
图8示通过prtk分析确认磷酸化met活性。
图9示用肿瘤裂解物的pd蛋白质印迹,显示采用化合物a和/或inc280选择性耗竭pegfr和pmet表达。
图10示化合物a与inc280组合在化合物a抗性nci-hcc827小鼠异种移植模型中的体内功效。
图11显示组合研究中的体重变化百分比。
图12示ihc和组织学结果。
发明详述
本公开涉及药物组合(如组合产品),包括(i)为inc280的met抑制剂或其药学上可接受盐或水合物和(ii)具有如本文所述式(x)的egfr抑制剂如化合物a。
根据一个实施方式,本公开涉及药物组合(如组合产品),包括(i)为inc280的met抑制剂或其药学上可接受盐和(ii)具有如本文所述式(x)的egfr抑制剂或其药学上可接受盐以及至少一种药学上可接受载体。
式(x)的优选egfr抑制剂是化合物a,或其药学上可接受盐。化合物a可以是游离形式(即不是盐)。或者,化合物a可作为盐存在。化合物a可作为盐酸盐或甲磺酸盐(甲基磺酸盐)存在,更优选作为单甲磺酸盐。所述甲磺酸盐可采用晶态的无定形形式。尤其有用的化合物a盐形式是其单甲磺酸盐三水合物。pct申请pct/ib2014/066475(公开为wo/2015/083059)描述了化合物a的游离形式和盐形式。
inc280的化学名是2-氟-n-甲基-4-[(7-喹啉-6-基-甲基)-咪唑并[1,2-b]三嗪-2-基]苯甲酰胺,具有下式
icn280公开于wo2008/064157的实施例7。inc280盐形式的非限制性示例是二盐酸形式和二苯磺酸盐。特别地,inc280可采用二盐酸盐一水合物形式(也描述于美国专利号8,420,645)。inc280也通过其inn苯扎米特(capmatinib)(国际非专利名)已知。
本公开的另一实施方式提供包括一定量的组合(如组合产品),所述量共同有效治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导的疾病,尤其是癌,所述组合包括组合伴侣(i)具有本文所述式(x)的egfr酪氨酸激酶抑制剂如化合物a或其药学上可接受盐和(ii)为inc280的met酪氨酸激酶抑制剂或其药学上可接受盐,以及可选至少一种药学上可接受载体。
另一实施方式涉及本发明组合(如组合产品)在治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导疾病尤其是癌中的应用。
还提供本文所述组合,用于治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导的疾病,尤其是癌。所述组合可以是固定组合或非固定组合。
另一实施方式涉及以下组合在生产治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导疾病尤其是癌的药物或药用制品中的应用:(i)具有本文所述式(x)的egfr酪氨酸激酶抑制剂如化合物a或其药学上可接受盐和(ii)为inc280的met酪氨酸激酶抑制剂或其药学上可接受盐。
另一实施方式涉及治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导的疾病尤其是癌的方法,采用以下组合:(i)具有本文所述式(x)的egfr酪氨酸激酶抑制剂如化合物a或其药学上可接受盐和(ii)作为inc280的met酪氨酸激酶抑制剂或其药学上可接受盐。
另一实施方式涉及治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导疾病尤其是癌的方法,所述方法包括向所需对象如温血动物特别是人给予有效量的组合或组合产品,所述组合或组合产品包括(i)具有本文所述式(x)的egfr酪氨酸激酶抑制剂如化合物a或其药学上可接受盐和(ii)作为inc280的met酪氨酸激酶抑制剂或其药学上可接受盐。
本公开的另一实施方式涉及药物产品或商业包装,其包含根据本公开内容所述的组合产品,特别是一并包含指导同时、分开或依序使用(尤其是联合作用)其治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导疾病尤其是癌的说明书。
本公开的另一实施方式涉及(i)具有本文所述式(x)的egfr酪氨酸激酶抑制剂或其药学上可接受盐和(ii)作为inc280的met酪氨酸激酶抑制剂或其药学上可接受盐在制备本公开所述组合(如组合产品)中的应用。
下列定义显示可用于替换此处上下文中所述实施方式中的一个、多于一个或全部一般特征或表达的一般特征或表达的更具体的实施方式,从而产生更为具体的实施方式。
定义
本文所用的术语“c1-6烷基”表示具有1到多至6个碳原子的饱和或不饱和烷基,所述基团为直链或有一个或多个分支;例如丁基如正丁基、仲丁基、异丁基、叔丁基;丙基如正丙基或异丙基;乙基或甲基。在特定实施方式中,c1-6烷基是饱和烷基,且在指定时可以未取代或取代,例如用卤素(即卤代烷基如三氟甲基等)、羟基(羟烷基如羟甲基、羟乙基、2-羟基-2-丙基等)或氰基(氰基烷基如氰基甲基、氰基乙基等)。
本文所用的术语“c1-6烷氧基”指基团–ora,其中ra是本文定义的c1-6烷基。本文所用的烷氧基非限制性示例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、叔丁氧基、戊氧基、己氧基等。
术语“c1-6卤代烷基”指本文所定义的c1-6烷基,用一个或多个相同或不同的卤基取代。卤代烷基可以是单卤代烷基、二卤代烷基或多卤代烷基,包括全卤代烷基。在某些实施方式中,卤代烷基是三氟甲基。
本文所用的术语“环烷基”指饱和或不饱和单环烃基。本文所用的术语“c3-7环烷基”或“c5-6环烷基”指分别具有3到多至7个碳原子,或5-6个碳原子的环烷基;例如环丙基、环丁基、环戊基、环己基或环庚基。
本文所用的术语“芳基”指环部分具有6-10个碳原子的芳族烃基,且可以是单或双环芳香环。非限制性示例包括苯基、萘基或四氢萘基。
本文所用的术语“杂芳基”指5-10元芳杂环,具有1-4个独立选自氮、氧和硫的杂原子,其可以是5-6元单环或8-10元稠合双环,其中至少一个环是芳香环。这种双环体系可稠合一个或多个芳基、环烷基或杂环烷基环。本文所用的杂芳基非限制性示例包括2-或3-呋喃基;1-,2-,4-或5-咪唑基;3-,4-或5-异噻唑基;3-,4-或5-异恶唑基;2-,4-或5-恶唑基;4-或5-1,2,3-恶二唑基;2-或3-吡嗪基;1-,3-,4-或5-吡唑基;3-,4-,5-或6-哒嗪基;2-,3-或4-吡啶基;2-,4-,5-或6-嘧啶基;1-,2-或3-吡咯基;1-或5-四唑基;2-或5-1,3,4-噻二唑基;2-,4-或5-噻唑基;2-或3-噻吩基;2-,4-或6-1,3,5-三嗪基;1-,3-或5-1,2,4-三唑基;1-,4-或5-1,2,3-三唑基;2-,4-,5-,6-或7-苯并恶唑基;1-,2-,4-,5-,6-或7-苯并咪唑基;2-,4-,5-,6-或7-苯并噻唑基;2-,3-,4-,5-,6-,7-苯并[b]噻吩基;2-,3-,4-,5-,6-,7-,8-,9-苯并[b]氧杂环庚烷;2-,4-,5-,6-,7-或8-苯并恶嗪基;1-,2-,3-,4-,5-,6-,7-,8或9-咔唑基;3-,4-,5-,6-,7-或8-噌啉基;2-,4-或5-4h-咪唑并[4,5-d]噻唑基;2-,3-,5-或6-咪唑并[2,1-b]噻唑基;2-,3-,6-或7-咪唑并[1,2-b][1,2,4]三嗪基;1-,3-,4-,5-,6-或7-吲唑基;1-,2-,3-,5-,6-,7-或8-吲哚嗪基;1-,2-,3-,4-,5-,6-或7-吲哚基;1-,2-,3-,4-,5-,6-或7-异吲哚基;1-,3-,4-,5-,6-,7-或8-异喹啉基;2-,3-,4-,5-,6-或7-萘啶基;1-,4-,5-,6-,7-或8-酞嗪基;2-,4-,6-或7-蝶啶基;2-,6-,7-或8-嘌呤基;2-,3-,5-,6-或7-呋喃并[3,2-b]-吡喃;1-,3-或5-1h-吡唑[4,3-d]-恶唑基;2-,3-,5-或8-吡嗪并[2,3-d]哒嗪;1-,2-,3-,4-,5-或8-5h-吡啶并[2,3-d]-o-恶嗪;1-,2-,3-,4-,6-,7-,8-或9-喹嗪基;2-,3-,4-,5-,6-,7-或8-喹啉基;2-,3-,4-,5-,6-,7-或8-喹唑啉基;和2-,3-,4-或5-噻吩[2,3-b]呋喃基。
本文所用的术语“杂环基”或“杂环”指饱和或不饱和非芳香环或环体系,例如,其是4-,5-,6-或7-元单环,或6-,7-,8-,9-,10-,11-或12-元双环体系,包含至少一个选自o、s、p和n的杂原子,其中n、s和p还可选氧化成多个氧化状态。杂环基能在杂原子或碳原子处被结合。杂环示例包括四氢呋喃(thf)、二氢呋喃、1,4-二恶烷、吗啉、1,4-二噻烷、哌嗪、哌啶、1,3-二氧戊环、咪唑烷、咪唑啉、吡咯啉、吡咯烷、氮杂环丁烷、四氢吡喃、二氢吡喃、氧硫杂环戊烷、二硫戊环、1,3-二恶烷、1,3-二噻烷、噻恶烷、硫代吗啉等。指定时,术语“杂环基”还指由氧代基团取代的杂环基团;例如吡咯烷-2-酮、1,6-二氢-吡啶-2(3h)-酮、吡啶-2-(3h)-酮等。
本文所用的术语“杂原子”指氮(n)、氧(o)、硫(s)或磷(p)原子,其中n、s和p可选地可被氧化成多个氧化状态。
根据本公开所述有用的化合物还能包括在中间物或终化合物中出现的原子的全部同位素。同位素包括具有相同原子数但质量数不同的那些原子。能纳入本公开化合物的同位素示例包括氢、碳、氮、氧、磷、氟和氯,分别例如2h,3h,11c,13c,14c,15n,18f31p,32p,35s,36cl,125i。本公开的多个同位素标记化合物,例如纳入放射性同位素如3h,13c和14c的那些。这种同位素标记化合物用于代谢研究(优选用14c),反应动力学研究(采用例如2h或3h),检测或成像技术如正电子发射断层成像(pet)或单光子发射计算机断层扫描(spect),包括药物或底物组织分布试验,或患者的放射治疗。具体地,18f或标记化合物尤其优选用于pet或spect研究。此外,用较重的同位素如氘(即2h)取代可提供由更高代谢稳定性引起的某些治疗优势,例如体内半衰期增加或剂量要求减少。本公开的同位素标记化合物一般能如下制备:完成方案或实施例所公开的过程以及实施下述制备,这是通过用现成的同位素标记试剂取代非同位素标记试剂。
此外,用较重的同位素尤其是氘(即2h或d)取代可提供由更高代谢稳定性引起的某些治疗优势,例如体内半衰期增加或剂量要求减少或治疗指数改善。应理解此上下文中的氘视作式(i)化合物的取代基。这种较重同位素特别是氘的浓度可由同位素富集系数定义。本文所用的术语“同位素富集系数”指指定同位素的同位素丰度与天然丰度之间的比例。如果本公开化合物的取代基指示是+氘,这种化合物就各指定氘原子而言的同位素富集系数是至少3500(在各指定氘原子处52.5%的氘纳入)、至少4000(60%氘纳入)、至少4500(67.5%氘纳入)、至少5000(75%氘纳入)、至少5500(82.5%氘纳入)、至少(90%氘纳入)、至少6333.3(95%氘纳入)、至少6466.7(97%氘纳入)、至少6600(99%氘纳入)、或至少6633.3(99.5%氘纳入)。在本公开化合物中,未特别指定为具体同位素的任何原子意在代表该原子的任何稳定同位素。除非另有说明,某一位置特别指定为“h”或“氢”时,该位置应理解为具有处于其天然丰度同位素组成的氢。因此,在本公开化合物中,特别指定为氘(d)的任何原子意在代表氘,例如在上面给出的范围内。
形成本公开所述组合产品的一部分的经同位素标记的met和/或egfr酪氨酸激酶抑制剂化合物一般能通过本领域技术人员已知的常规技术或与所附“实施例和制备”所述类似的工艺来制备,使用合适的同位素标记试剂取代之前采用的未标记试剂。
本公开的实施方式还包括根据本文所述公开内容使用的化合物的药学上可接受盐。本文所用的“药学上可接受盐”指所公开化合物的衍生物,其中母体化合物如下修饰:将现有酸或碱部分转变成其盐形式。药学上可接受盐的示例包括但不限于碱性残基如胺的矿物或有机酸盐;酸性残基如羧酸的碱性或有机盐等。本公开的药学上可接受盐包括母体化合物的常规无毒盐,例如形成自无毒的无机或有机酸。本公开的药学上可接受盐能通过常规化学法合成自含碱性或酸性部分的母体化合物。一般,这种盐能如下制备:这些化合物的游离酸或碱形式与化学计算量的合适碱或酸在水或有机溶剂或两者的混合物中反应;一般,优选非水介质如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈。合适盐的列表参见《雷明顿药物科学》(remington’spharmaceuticalsciences),第17版,宾夕法尼亚州伊士顿的麦克出版公司(mackpublishingcompany),1985,第1418页和journalofpharmaceuticalscience,66,2(1977),各通过引用全文纳入本文。
本文所用的短语“药学上可接受”指在合理医学判断范围内适于用于接触人和动物组织的那些化合物、材料、组合物和/或剂型,而没有过度毒性、刺激、过敏反应和其它问题或并发症,并具有合理的效益/风险比。
本公开所述有用的化合物(=分别纳入本公开所述组合,特别是组合产品,或根据本公开使用,可选还包括如下定义的其它助剂,即所有活性成分)以及其药学上可接受盐还能作为互变异构体、n-氧化物或溶剂合物如水合物存在。在提到包含于创造性组合产品中的化合物(例如egfr酪氨酸激酶抑制剂和/或met酪氨酸激酶抑制剂)时,所有这些变体,以及其任意单个变体、或两或多到少于全部的这些变体的组合,均被涵盖在本文范围内并能在本文中被读出。
根据上下文提及的一个实施方式,本公开涉及药物组合,特别是药物组合产品,包括提及的组合伴侣和至少一种药学上可接受载体。
本发明还提供药物组合,尤其是药物组合产品,其包含所提及的组合伴侣。
“组合”指独立伴侣的制剂,带有或不带有联合使用指导或组合产品指导。因此,所述组合伴侣可以是完全分开的药物剂型或药物组合物,其也彼此独立销售且仅提供其联合使用指导于包装装备如小册子等中,或采用其它信息形式如提供给医生和医务人员(例如,口头沟通、书面沟通等),为共同起效而同时或依序使用,尤其如下所定义。
“组合产品”尤其涉及,或采用一个剂量单位形式的固定组合,或联合给药的成套药盒,其中egfr酪氨酸激酶抑制剂和met酪氨酸激酶抑制剂以及可选的另一组合伴侣(如下解释的其它药物,也称为“助剂”)可同时独立给药或在时间间隔内分开给药,尤其是这些时间间隔允许组合伴侣显示合作(=共同)如协同效应。本文所用术语“共给药”或“联合给药”等的意思是涵盖选定组合伴侣向单个所需对象(如一名患者)的施用,且意在包括所述试剂不必定通过同一给药途径和/或同时给药的治疗方案。因此,本文所用的术语“组合产品”指通过将多于一种活性成分混合或组合而得到的药物产品,且其包括活性成分(其也可以是组合的)的固定和非固定组合。
术语“固定组合”指活性成分如egfr酪氨酸激酶抑制剂和met酪氨酸激酶抑制剂以单一实体或剂量形式同时给予患者。换言之:活性成分以一种剂型存在,如一个片剂或一个胶囊。
术语“非固定组合”指活性成分各作为独立实体没有特定时间限制地同时、同步或依序给予患者,此处这种给药在患者体内提供两种化合物的治疗有效水平。后者还应用于鸡尾酒疗法,如给予三种或更多活性成分。因此,术语“非固定组合”尤其被定为“成套药盒”,在这种意义上,如本文定义的组合伴侣(i)egfr酪氨酸激酶抑制剂和(ii)met酪氨酸激酶抑制剂(和(若存在)其它一种或多种助剂)能彼此独立给药或通过利用具有不同量组合伴侣的不同固定组合给药,即同时或在不同时间点,其中组合伴侣也可作为完全分开的药物剂型或药物制剂使用,这些分开的药物剂型或药物制剂也彼此独立销售且仅在包装装备如小册子等中或在例如提供给医生和医务人员的其它信息形式中提供其联合使用可能性的指导。由此,独立制剂或成套药盒之部分能例如同时或按时间顺序交叉给药,即在不同时间点、且就成套药盒之任何部分而言时间间隔相同或不同。非常优选地,时间间隔选择成联合使用所述部分时对所治疗疾病的效果大于仅使用任何一种组合伴侣(i)和(ii)会获得的效果,因而是共同作用。组合制品中待给药的组合伴侣(i)与组合伴侣(ii)总量之比可变,例如为了适应待治疗患者亚群需求或单一患者需求,所述不同需求可能归因于患者的年龄、性别、体重等。
本公开还涉及(i)为inc280的met抑制剂或其药学上可接受盐和(ii)具有如本文所述式(x)的egfr抑制剂或其药学可接受盐,以联合用于治疗egfr酪氨酸激酶活性和/或met酪氨酸激酶活性介导的疾病尤其是癌的方法。
任何实施方式中的组合伴侣(i)和(ii)优选配制或使用成共同起(预防性或尤其是治疗性)作用。这尤其意味着有至少一种有益效果,如组合伴侣(i)和(ii)效果的互相提高,特别是协同作用,例如大于累加的效应、额外有利效果(如就任何单一化合物而言未见的其它治疗效果)、副作用少、非有效剂量的组合伴侣(i)和(ii)之一或两者的联合治疗效果,以及非常优选地组合伴侣(i)和(ii)的明显协同作用。例如,术语“联合起(治疗)作用”可指化合物能分开给予或以一定时间间隔依序(采用按时间顺序交叉方式,特别是顺序特异性方式)给予,从而其优选在待治疗的温血动物尤其是人中仍显示(优选协同)相互作用(联合治疗效果)。联合治疗效果等能通过跟踪血液水平测定,显示两种化合物在至少某些时间间隔中存在于待治疗人的血液内,但这不排除化合物尽管不同时存在于血液中但共同作用的情况。
因此,本公开涉及用于同时、分开或依序应用的组合产品,如组合制剂或药物固定组合,或这类制剂和组合的组合。
在本公开的联合疗法中,本公开所述有用的化合物可由同一或不同厂商制造和/配制。此外,所述组合伴侣可集合到联合疗法中:(i)在向医生发放组合产品前(例如,在含本公开化合物和其他治疗剂的药盒的情况中);(ii)临给药前由医生自身进行(或在医生指导下);(iii)患者自身体内,例如在依序给药本公开化合物和其他治疗剂期间。
在某些实施方式中,任何上述方法涉及进一步给予一种或多种其它(如第三)助剂,尤其是化疗剂。
因此,在另一实施方式中,本公开涉及组合产品,尤其是药物组合物,其包括治疗有效量的(i)具有如本文所述式(x)的egfr酪氨酸激酶抑制剂或其药学可接受盐和(ii)为inc280的met酪氨酸激酶抑制剂或其药学上可接受盐,以及至少一种第三治疗活性剂(助剂),如另一化合物(i)和/或(ii)或不同助剂。额外助剂优选选自抗癌剂;抗炎剂。
同样在此情况下,形成本公开所述对应产品的组合伴侣可混合形成固定药物组合物或其可分开或成对给药(即,在其他药物之前、同时或之后)。
除此之外或另外,本公开所述组合产品能联合化疗、放疗、免疫疗法、手术介入或其组合特别给药用于癌症治疗。在上述其它治疗策略背景下,长期疗法和辅助疗法同样有可能。其它可能的治疗是在肿瘤消退后维持患者状态的疗法,或甚至化学预防疗法,例如在有风险的患者中。
作为助剂的可能抗癌剂(如用于化疗)包括但不限于芳香酶抑制剂;抗雌激素药;拓扑异构酶i抑制剂;拓扑异构酶ii抑制剂;微管活性化合物;烷化化合物;组蛋白脱乙酰酶抑制剂;诱导细胞分化过程的化合物;环氧化酶抑制剂;mmp抑制剂;mtor抑制剂;抗肿瘤的抗代谢物;铂化合物;靶向/降低蛋白或脂质激酶活性的化合物;抗血管生成化合物;靶向、降低或抑制蛋白或脂磷酸酶活性的化合物;促性腺激素释放激素激动剂;抗雄激素药;甲硫氨酸氨肽酶抑制剂;二磷酸盐;生物反应调节剂;抗增殖抗体;乙酰肝素酶抑制剂;ras致癌同种型抑制剂;端粒酶抑制剂;蛋白酶体抑制剂;用于治疗恶性血液病的化合物;靶向、降低或抑制flt-3活性的化合物;hsp90抑制剂;纺锤体驱动蛋白抑制剂;mek抑制剂;亚叶酸;edg粘合剂;抗白血病化合物;核糖核苷酸还原酶抑制剂;s-腺苷甲硫氨酸脱羧酶抑制剂;血管抑制性类固醇;皮质类固醇;其它化疗化合物(如下定义);光敏化合物。
而且,或者或另外,本公开所述组合产品可与其它肿瘤治疗方法联用,包括手术、电离辐射、光动力疗法、植入例如皮质类固醇、激素,或其可用作放射致敏剂。
本文所用的术语“芳香酶抑制剂”涉及抑制雌激素生成的化合物,即将底物雄烯二酮和睾酮分别转换成雌酮和雌二醇。所述术语包括但不限于类固醇,尤其是阿他美坦、依西美坦和福美司坦,以及特别是非类固醇,尤其是氨鲁米特、洛太米特(roglethimide)、吡鲁米特、曲洛司坦、睾内酯、酮康唑、伏罗唑、法曲唑、阿那曲唑和来曲唑。
本文所用的术语“抗雌激素药”涉及在雌激素受体水平拮抗雌激素作用的化合物。所述术语包括但不限于他莫昔芬、氟维司群、雷洛昔芬和盐酸雷洛昔芬。
本文所用的术语“抗雄激素药”涉及能抑制雄性激素的生物学作用的任何物质,其包括但不限于比卡鲁胺(casodex)),其可以如us4,636,505所公开的进行配制。
本文所用的术语“促性腺激素释放激素激动剂”包括但不限于阿巴瑞克、戈舍瑞林和醋酸戈舍瑞林。本文所用的术语“拓扑异构酶i抑制剂”包括但不限于托泊替康、吉马替康、伊立替康、喜树碱及其类似物、9-硝基喜树碱和大分子喜树碱轭合物pnu-166148(wo99/17804中的化合物a1)。
本文所用的术语“拓扑异构酶ii抑制剂”包括但不限于蒽环类抗生素如阿霉素(包括脂质体制剂,例如caelyx)、柔红霉素、表阿霉素、伊达比星和奈莫柔比星、蒽醌类化合物米托蒽醌和洛索蒽醌,以及鬼臼毒素类化合物依托泊苷和替尼泊苷。
本文所用的术语“微管活性化合物”涉及微管稳定、微管去稳定化合物和微管聚合抑制剂,包括但不限于紫杉烷,例如紫杉醇和多西他赛,长春花生物碱,例如长春碱,特别是硫酸长春碱,长春新碱,尤其是硫酸长春新碱以及长春瑞滨,圆皮海绵内酯,秋水仙碱和埃坡霉素及其衍生物,例如埃坡霉素b或d或其衍生物。
本文所用的术语“烷化化合物”包括但不限于环磷酰胺、异环磷酰胺、美法仑或亚硝基脲(bcnu或gliadel)。
本文所用的术语“组蛋白脱乙酰酶抑制剂”或“hdac抑制剂”涉及抑制组蛋白脱乙酰酶和具有抗增殖活性的化合物。这包括wo02/22577公开的化合物,尤其是n-羟基-3-[4-[[(2-羟乙基)[2-(1h-吲哚-3-基)乙基]-氨基]甲基]苯基]-2e-2-丙烯酰胺、n-羟基-3-[4-[[[2-(2-甲基-1h-吲哚-3-基)-乙基]-氨基]甲基]苯基]-2e-2-丙烯酰胺和其药学上可接受盐。其进一步特别包括辛二酰苯胺异羟肟酸(saha)。靶向、降低或抑制组蛋白脱乙酰酶(hdac)抑制剂活性的化合物如丁酸钠和辛二酰苯胺异羟肟酸(saha)抑制称为组蛋白脱乙酰酶的酶活性。特异hdac抑制剂包括ms275、saha、fk228(之前的fr901228)、曲古抑菌素a和us6,552,065公开的化合物,尤其是n-羟基-3-[4-[[[2-(2-甲基-1h-吲哚-3-基)-乙基]-氨基]甲基]苯基]-2e-2-丙烯酰胺或其药学上可接受盐和n-羟基-3-[4-[(2-羟乙基){2-(1h-吲哚-3-基)乙基]-氨基]甲基]苯基]-2e-2-丙烯酰胺或其药学上可接受盐,特别是乳酸盐。
术语“抗肿瘤的抗代谢物”包括但不限于5-氟尿嘧啶或5-fu、卡培他滨、吉西他滨、dna去甲基化剂如5-氮杂胞苷和地西他滨、甲氨蝶呤和依达曲沙、以及叶酸拮抗剂如培美曲塞。
本文所用的术语“铂化合物”包括但不限于卡铂、顺铂和奥沙利铂。
本文所用的术语“靶向/降低蛋白或脂质激酶活性的化合物”;或“蛋白或脂磷酸酶活性”;或“其它抗血管生成化合物”包括但不限于c-met酪氨酸激酶和/或丝氨酸和/或苏氨酸激酶抑制剂或脂质激酶抑制剂,例如
a)靶向、降低或抑制血小板衍生生长因子-受体(pdgfr)活性的化合物,如靶向、降低或抑制pdgfr活性的化合物,特别是抑制pdgfr受体的化合物,例如n-苯基-2-嘧啶-胺衍生物,如伊马替尼、su101、su6668和gfb-111;
b)靶向、降低或抑制胰岛素样生长因子受体i(igf-ir)活性的化合物,如靶向、降低或抑制igf-ir活性的化合物,特别是抑制igf-ir受体的激酶活性的化合物,例如wo02/092599公开的那些化合物,或靶向igf-ir受体胞外结构域或其生长因子的抗体;
c)靶向、降低或抑制trk受体酪氨酸激酶家族活性的化合物,或肝配蛋白激酶家族抑制剂;
d)靶向、降低或抑制axl受体酪氨酸激酶家族活性的化合物;
e)靶向、降低或抑制ret受体酪氨酸激酶活性的化合物;
f)靶向、降低或抑制kit/scfr受体酪氨酸激酶活性的化合物,如伊马替尼;
g)靶向、降低或抑制c-kit受体酪氨酸激酶-(pdgfr家族的部分)活性的化合物,如靶向、降低或抑制c-kit受体酪氨酸激酶家族活性的化合物,特别是抑制c-kit受体的化合物,例如伊马替尼;
h)靶向、降低或抑制c-abl家族成员、其基因融合产物(如bcr-abl激酶)和突变体活性的化合物,如靶向、降低或抑制c-abl家族成员和其基因融合产物其基因融合产物的化合物,如n-苯基-2-嘧啶-胺衍生物,例如伊马替尼或尼罗替尼(amn107);pd180970;ag957;nsc680410;来自派德药厂(parkedavis)的pd173955;或达沙替尼(bms-354825);
i)靶向、降低或抑制蛋白激酶c(pkc)和丝氨酸/苏氨酸激酶raf家族的成员,mek、src、jak、fak、pdk1、pkb/akt和ras/mapk家族成员和/或细胞周期蛋白依赖性激酶家族(cdk)成员活性的化合物,且特别是us5,093,330公开的那些星孢菌素衍生物,如米哚妥林;其它化合物示例包括例如ucn-01,沙芬戈,bay43-9006,苔藓虫素1,哌立福辛;伊莫福新;ro318220和ro320432;go6976;isis3521;ly333531/ly379196;异喹啉化合物如wo00/09495公开的那些;ftis;pd184352或qan697(p13k抑制剂)或at7519(cdk抑制剂);
j)靶向、降低或抑制蛋白-酪氨酸激酶抑制剂活性的化合物,如靶向、降低或抑制蛋白-酪氨酸激酶抑制剂活性的化合物包括甲磺酸伊马替尼(gleevec)或酪氨酸磷酸化抑制剂。酪氨酸磷酸化抑制剂优选是低分子量(mr<1500)化合物,或其药学上可接受盐,特别是选自苯亚甲基丙二腈类或s-芳基苯丙二腈或双底物喹啉类的化合物,更特别是选自下组的任何化合物:酪氨酸磷酸化抑制剂a23/rg-50810;ag99;酪氨酸磷酸化抑制剂ag213;酪氨酸磷酸化抑制剂ag1748;酪氨酸磷酸化抑制剂ag490;酪氨酸磷酸化抑制剂b44;酪氨酸磷酸化抑制剂b44(+)对映异构体;酪氨酸磷酸化抑制剂ag555;ag494;酪氨酸磷酸化抑制剂ag556,ag957和adaphostin(4-{[(2,5-二羟苯基)甲基]氨基}-苯甲酸金刚烷基酯;nsc680410,adaphostin);
k)靶向、降低或抑制表皮生长因子家族受体酪氨酸激酶(同或异二聚体形式的egfr、erbb2、erbb3、erbb4)和其突变体活性的化合物,如靶向、降低或抑制表皮生长因子受体家族活性的化合物特别是抑制egf受体酪氨酸激酶家族如egf受体、erbb2、erbb3和erbb4,或者结合egf或egf相关配体的化合物、蛋白或抗体,且具体是wo97/02266一般和特定公开的那些化合物、蛋白或单克隆抗体,如ex.39的化合物,或公开于ep0564409、wo99/03854、ep0520722、ep0566226、ep0787722、ep0837063、us5,747,498、wo98/10767、wo97/30034、wo97/49688、wo97/38983且尤其是wo96/30347(如称为cp358774的化合物)、wo96/33980(如化合物zd1839)和wo95/03283(如化合物zm105180);例如曲妥单抗(herceptintm)、西妥昔单抗(erbituxtm)、易瑞沙、特罗凯、osi-774、ci-1033、ekb-569、gw-2016、e1.1、e2.4、e2.5、e6.2、e6.4、e2.11、e6.3或e7.6.3、和wo03/013541公开的7h-吡咯并-[2,3-d]嘧啶衍生物;和
l)靶向、降低或抑制c-met受体活性的化合物,如靶向、降低或抑制c-met活性的化合物,特别是抑制c-met受体激酶活性的化合物,或靶向c-met胞外结构域或结合hgf的抗体;
m)靶向、降低或抑制ron受体酪氨酸激酶活性的化合物。
其它抗血管生成化合物包括有另外活性机理的化合物,例如与蛋白或脂质激酶抑制作用无关的活性机理,如沙利度胺(thalomid)和tnp-470。
术语“靶向、降低或抑制蛋白或脂磷酸酶活性的化合物”包括但不限于磷酸酶1、磷酸酶2a或cdc25的抑制剂,例如冈田酸或其衍生物。术语“诱导细胞分化过程的化合物”包括但不限于视黄酸、α-、γ-或δ-生育酚或者α-、γ-或δ-生育三烯酚。
本文所用的术语“环加氧酶抑制剂”包括但不限于例如cox-2抑制剂、5-烷基取代的2-芳基氨基苯乙酸和衍生物,如塞来考昔(celebrex)、罗非考昔(vioxx)、艾托考昔、伐地考昔或5-烷基-2-芳基氨基苯乙酸,例如5-甲基-2-(2’-氯-6’-氟苯氨基)苯乙酸、罗美昔布。本文所用的术语“二磷酸盐”包括但不限于依替膦酸、氯膦酸、替鲁膦酸、帕米膦酸、阿仑膦酸、伊班膦酸、利塞膦酸和唑来膦酸。“
术语“mtor抑制剂”涉及抑制哺乳动物雷帕霉素靶蛋白(mtor)和具有抗增殖活性的化合物,如西罗莫司
本文所用的术语“乙酰肝素酶抑制剂”指靶向、降低或抑制硫酸肝素降解的化合物。所述术语包括但不限于pi-88。
本文所用的术语“生物反应调节剂”指淋巴因子或干扰素,如干扰素γ。
本文所用术语“ras致癌同种型抑制剂”如h-ras、k-ras或n-ras指靶向、降低或抑制ras致癌活性的化合物,如“法尼基转移酶抑制剂”,例如l-744832、dk8g557或r115777(zarnestra)。
本文所用的术语“端粒酶抑制剂”指靶向、降低或抑制端粒酶活性的化合物。靶向、降低或抑制端粒酶活性的化合物特别是抑制端粒酶受体的化合物,如端粒酶抑素。
本文所用的术语“甲硫氨酸氨肽酶抑制剂”指靶向、降低或抑制甲硫氨酸氨肽酶活性的化合物。靶向、降低或抑制甲硫氨酸氨肽酶活性的化合物是例如bengamide或其衍生物。
本文所用的术语“蛋白酶体抑制剂”指靶向、降低或抑制蛋白酶体活性的化合物。靶向、降低或抑制蛋白酶体活性的化合物包括例如硼替佐米(velcadetm)和mln341。
本文所用的术语“基质金属蛋白酶抑制剂”或(“mmp抑制剂”)包括但不限于胶原拟肽和非拟肽抑制剂、四环素衍生物,例如异羟肟酸盐拟肽抑制剂巴马司他和其口服生物可利用的类似物马立马司他(bb-2516)、普啉司他(ag3340)、metastat(nsc683551)bms-279251、bay12-9566、taa211、mmi270b或aaj996。
本文所用的术语“用于恶性血液病治疗的化合物”包括但不限于fms样酪氨酸激酶抑制剂例如靶向、降低或抑制fms样酪氨酸激酶受体(flt-3r)活性的化合物;干扰素、1-b-d-阿糖呋喃基胞嘧啶(ara-c)和白消安;以及alk抑制剂例如靶向、降低或抑制间变性淋巴瘤激酶的化合物。
术语“靶向、降低或抑制fms样酪氨酸激酶受体(flt-3r)活性的化合物”尤其是抑制flt-3r受体激酶家族成员的化合物、蛋白或抗体,例如pkc412、米哚妥林、星孢菌素衍生物、su11248和mln518。
本文所用的术语“hsp90抑制剂”包括但不限于靶向、降低或抑制hsp90的固有atp酶活性的化合物;通过泛素蛋白酶体通路降解、靶向、降低或抑制hsp90客户蛋白的化合物。靶向、降低或抑制hsp90的固有atp酶活性的化合物尤其是抑制hsp90的atp酶活性的化合物、蛋白或抗体例如17-烯丙基氨,17-脱甲氧基格尔德霉素(17aag,17-dmag)、格尔德霉素衍生物;其它与格尔德霉素相关的化合物;根赤壳菌素和hdac抑制剂;ipi-504,cnf1010,cnf2024,来自conforma治疗公司(conformatherapeutics)的cnf1010;替莫唑胺,来自诺华公司(novartis)的auy922。
本文所用的术语“抗增殖抗体”包括但不限于爱必妥、贝伐单抗、利妥昔单抗、pro64553(抗-cd40)和2c4抗体。抗体指例如完整的单克隆抗体、多克隆抗体、由至少2个完整抗体形成的多特异性抗体、和抗体片段,只要其表现出所需生物活性即可。
本文所用的术语“edg粘合剂”指一类调节淋巴细胞再循环的免疫抑制剂,如fty720。
术语“纺锤体驱动蛋白抑制剂”为本领域已知且包括来自葛兰素史克(glaxosmithkline)的sb715992或sb743921,来自combinatorx的戊烷脒/氯丙嗪。
术语“mek抑制剂”为本领域已知且包括来自arraypiopharma的arry142886,来自阿斯利康(astrazeneca)的azd6244,来自辉瑞(pfizer)的pd181461,亚叶酸。
术语“核糖核苷酸还原酶抑制剂”包括但不限于嘧啶或嘌呤核苷类似物,包括但不限于氟达拉滨和/或阿糖胞苷(ara-c)、6-硫鸟嘌呤、5-氟尿嘧啶、克拉屈滨、6-巯嘌呤(尤其是与ara-c联合对抗all)和/或喷司他丁。核糖核苷酸还原酶抑制剂特别是羟基脲或2-羟基-1h-异吲哚-1,3-二酮衍生物,如pl-1,pl-2,pl-3,pl-4,pl-5,pl-6,pl-7或pl-8,描述于nandy等,actaoncologica,卷33,第8期,第953-961页(1994)。
本文所用的术语“s-腺苷甲硫氨酸脱羧酶抑制剂”包括但不限于us5,461,076公开的化合物。
还包括尤其是wo98/35958中所公开的那些化合物、蛋白或vegf/vegfr单克隆抗体,例如1-(4-氯苯氨基)-4-(4-吡啶甲基)酞嗪或其药学上可接受盐,如琥珀酸盐,或公开于wo00/09495、wo00/27820、wo00/59509、wo98/11223、wo00/27819和ep0769947中的那些;由以下描述的那些:prewett等,cancerres,卷59,第5209-5218页(1999);yuan等,procnatlacadsciusa,卷93,第14765-14770页(1996);zhu等,cancerres,卷58,第3209-3214页(1998);和mordenti等,toxicolpathol,卷27,第1期,第14-21页(1999);公开于wo00/37502和wo94/10202的;血管抑素,由o’reilly等,cell,卷79,第315-328页(1994)描述;内皮抑素,由o’reilly等,cell,vol.88,第277-285页(1997)描述;邻氨基苯甲酸酰胺;zd4190;zd6474;su5416;su6668;贝伐单抗;或抗vegf抗体或抗vegf受体抗体如rhumab和rhufab,vegf适体如macugon;flt-4抑制剂、flt-3抑制剂、vegfr-2igg1抗体、angiozyme(rpi4610)和贝伐单抗。
本文所用的术语“光动力疗法”指采用称为光敏化合物的某些化学品以治疗或预防癌症的疗法。光动力疗法示例包括用化合物治疗,例如visudyne和卟吩姆钠。
本文所用的“血管抑制性类固醇”指阻断或抑制血管生成的化合物,例如阿奈可他、去炎松、氢化可的松、11-α-表氢皮质醇、脱氧可的松、17α-羟孕酮、皮质酮、去氧皮质酮、睾酮、雌酮和地塞米松。
本文所用的“皮质类固醇”包括但不限于化合物,例如氟轻松、地塞米松;尤其是采用植入物形式。
其它化疗化合物包括但不限于植物生物碱、激素化合物和拮抗剂;生物反应调节剂,优选淋巴因子或干扰素;反义寡核苷酸或寡核苷酸衍生物;shrna或sirna;或混配化合物或有其它或未知作用机制的化合物。
本公开所述组合产品还可包含一种多种其它药物或与之组合,所述药物选自抗炎药物;抗组胺药物;支气管扩张药物、nsaid;趋化因子受体拮抗剂。
合适的抗炎药包括类固醇,尤其是糖皮质激素如布地奈德、二丙酸倍氯米松、丙酸氟替卡松、环索奈德或糠酸莫米松,或wo02/88167、wo02/12266、wo02/100879、wo02/00679(特别是实施例3、11、14、17、19、26、34、37、39、51、60、67、72、73、90、99和101的那些)、wo03/035668、wo03/048181、wo03/062259、wo03/064445、wo03/072592所述的类固醇,非类固醇类糖皮质激素受体激动剂,例如wo00/00531、wo02/10143、wo03/082280、wo03/082787、wo03/104195和wo04/005229所述的那些。
ltb4拮抗剂如ly293111、cgs025019c、cp-195543、sc-53228、biil284、ono4057、sb209247和us5451700所述的那些;ltd4拮抗剂如孟鲁司特和扎鲁司特;pde4抑制剂,如西洛司特、罗氟司特(百克顿),v-11294a(napp)、bay19-8004(拜耳)、sch-351591(先灵葆雅)、阿罗茶碱(艾美罗医用药物有限公司)、pd189659/pd168787(派德药厂)、awd-12-281(爱斯达制药股份有限公司)、cdc-801(新基)、selcid(tm)cc-10004(新基)、vm554/um565(vernalis)、t-440(tanabe)、kw-4490(协和发酵工业株式会社(kyowahakkokogyo)),和wo92/19594、wo93/19749、wo93/19750、wo93/19751、wo98/18796、wo99/16766、wo01/13953、wo03/104204、wo03/104205、wo03/39544、wo04/000814、wo04/000839、wo04/005258、wo04/018450、wo04/018451、wo04/018457、wo04/018465、wo04/018431、wo04/018449、wo04/018450、wo04/018451、wo04/018457、wo04/018465、wo04/019944、wo04/019945、wo04/045607及wo04/037805所述的那些;a2a激动剂,如ep409595a2、ep1052264、ep1241176、wo94/17090、wo96/02543、wo96/02553、wo98/28319、wo99/24449、wo99/24450、wo99/24451、wo99/38877、wo99/41267、wo99/67263、wo99/67264、wo99/67265、wo99/67266、wo00/23457、wo00/77018、wo00/78774、wo01/23399、wo01/27130、wo01/27131、wo01/60835、wo01/94368、wo02/00676、wo02/22630、wo02/96462、wo03/086408、wo04/039762、wo04/039766、wo04/045618和wo04/046083所公开的那些;a2b拮抗剂,如wo02/42298所述的那些;和β-2肾上腺素受体激动剂,如阿布叔醇(沙丁胺醇)、奥西那林、特布他林、沙美特罗、非诺特罗、丙卡特罗,尤其是福莫特罗和其药学上可接受盐,以及wo0075114的式i化合物(游离或盐或溶剂合物形式),所述文献通过引用纳入本文,优选其实施例的化合物,特别是下式化合物
和其药学上可接受盐,以及wo04/16601的式i化合物(游离或盐或溶剂合物形式),和wo04/033412的化合物。
合适的支气管扩张药包括抗胆碱能或抗毒蕈碱化合物,尤其是异丙托溴铵、氧托溴铵、噻托铵盐和chf4226(凯西制药)、格隆溴铵,以及wo01/04118、wo02/51841、wo02/53564、wo03/00840、wo03/87094、wo04/05285、wo02/00652、wo03/53966、ep424021、us5171744、us3714357、wo03/33495和wo04/018422所述的那些。
合适的趋化因子受体包括例如ccr-1、ccr-2、ccr-3、ccr-4、ccr-5、ccr-6、ccr-7、ccr-8、ccr-9和ccr10、cxcr1、cxcr2、cxcr3、cxcr4、cxcr5,尤其是ccr-5拮抗剂如先灵葆雅拮抗剂sc-351125、sch-55700和sch-d、武田拮抗剂如n-[[4-[[[6,7-二氢-2-(4-甲基苯基)-5h-苯并-环庚烯-8-基]羰基]氨基]苯基]-甲基]四氢-n,n-二甲基-2h-吡喃-4-氯化铵(tak-770),以及us6166037(特别是权利要求18和19)、wo00/66558(特别是权利要求8)、wo00/66559(特别是权利要求9)、wo04/018425和wo04/026873所述的ccr-5拮抗剂。
合适的抗组胺药物包括盐酸西替利嗪、对乙酰氨基酚、富马酸氯马斯汀、异丙嗪、氯雷他定、地氯雷他定、苯海拉明和盐酸非索非那定、阿伐斯汀、阿司咪唑、氮斯汀、依巴斯汀、依匹斯汀、咪唑斯汀和特芬那定以及wo03/099807、wo04/026841和jp2004107299中公开的那些。
由编号、通用名或商品名确定的活性成分结构可获自标准纲要《默克索引》的现行版本或获自数据库,如国际专利(patentsinternational)(如imsworldpublications)。其对应内容通过引用纳入本文。
术语“药学上有效”优选涉及如本公开文本所述抵御疾病或紊乱发展的治疗或更广意义上预防有效的量。
本文所用的术语“商业包装”特别定义“成套药盒”,在此意义上,如上下文定义的组分(a)met酪氨酸激酶抑制剂和(b)egfr酪氨酸激酶抑制剂以及可选的其它助剂,能彼此独立给药或者用具有不同含量的组分(a)和(b)的不同固定组合,即同时或在不同时间点,给药。此外,这些术语包括商业包装,含有(特别是组合)组分(a)和(b)作为活性成分,以及在延迟增生性疾病发展或治疗中同时、依序(按时间顺序交叉,时间特异顺序,优选)或(不太优选)分开应用其的说明书。然后,成套药盒部分能同时或按时间顺序交叉给药,即在不同时间点或就成套药盒任何部分而言时间间隔相同或不同。非常优选地,时间间隔选择成联合使用所述部分时对所治疗疾病的效果大于仅使用任何一种组合伴侣(a)和(b)会获得的效果(能根据标准方法测定)。组合制品中待给药的组合伴侣(a)与组合伴侣(b)总量之比可变,例如为了适应待治疗患者亚群需求或单一患者需求,所述不同需求可能归因于患者的特定疾病、年龄、性别、体重等。优选有至少一种有益效果,如互相提高组合伴侣(a)和(b)效果,特别是大于累加效应,其因而能用各自较低剂量的各组合药物获得,所述剂量低于仅个体药物而非组合治疗情况中可耐受的剂量,产生额外有利效果,例如副作用少、非有效剂量的组合伴侣(组分)(a)和(b)之一或两者的联合治疗效果,以及非常优选组合伴侣(a)和(b)的强协同作用。
在组分(a)和(b)组合以及商业包装的应用情况中,同时、依序和分开应用的任何的组合都可行,意味着组分(a)和(b)可在某一时间点同时给药,然后仅给药宿主毒性较低的一种组分,按时间顺序交叉如每日给药超过3-4周,在稍后时间点且随后是另一组分,或2种组分的组合在更后面的时间点(后续药物组合治疗进程中用于最优效果)等。
本公开所述组合产品适于治疗各种分别由egfr和/或met酪氨酸激酶活性介导的,尤其是依赖于其的,疾病。因此,所述产品能用于治疗可由egfr酪氨酸激酶抑制剂和met酪氨酸激酶抑制剂治疗的任何疾病。
本公开的组合特别用于治疗癌症,其中所述癌是有c-met活化/扩增的egfr抗性肿瘤。例如,所述癌可以是非小细胞肺癌(nsclc)或转移性非小细胞肺癌。
当癌无法响应先前治疗如用化合物a和埃罗替尼、吉非替尼或阿法替尼治疗时,本公开的组合可能对该癌(如nsclc)特别有用。因此,待治疗的癌可以是已发现对选自下组的治疗剂的治疗有抗性的:埃罗替尼、吉非替尼、阿法替尼、化合物a或其组合。
egfr抑制剂可用于,例如,治疗一种或多种响应egfr活性抑制的疾病,尤其是赘生性或肿瘤疾病,特别是实体瘤,更特别是涉及egfr激酶的那些癌,包括乳腺癌、胃癌、肺癌、前列腺癌、膀胱癌和子宫内膜癌。其它癌包括肾癌、肝癌、肾上腺癌、胃癌、卵巢癌、结肠癌、直肠癌、胰腺癌、阴道癌或甲状腺癌、肉瘤、成胶质细胞瘤和多种头颈部肿瘤以及白血病和多发性骨髓瘤。尤其优选乳腺癌或卵巢癌;肺癌,如nsclc或sclc;头颈癌、肾癌、结直肠癌、胰腺癌、膀胱癌、胃癌或前列腺癌;或神经胶质瘤;特定提及神经胶质瘤或结肠、直肠或结直肠癌,或更特定提及肺癌。也包括依赖于egfr配体的疾病,如egf;tgf-α;hb-egf;双调蛋白;表皮调节素;β细胞素。
met抑制剂可用于,例如,治疗met相关疾病,尤其是有证据显示met和fgfr同时活化的癌,证据包括基因扩增、激活突变、同源rtk配体表达、指示激活的残基处rtk磷酸化,例如此处所述癌选自脑癌、胃癌、生殖器官癌症、泌尿系统癌(urinarycancer)、前列腺癌、(尿)膀胱癌(表面和肌层浸润性)、乳腺癌、宫颈癌、结肠癌、结直肠癌、神经胶质瘤(包括成胶质细胞瘤、间变型星形细胞瘤、少突星形细胞瘤、少突神经胶质瘤)、食管癌、胃肿瘤、胃肠癌、肝癌、肝细胞癌(hcc)包括儿童hcc在内、头颈癌(包括头颈部鳞状细胞癌、鼻咽癌)、嗜酸细胞腺瘤、上皮细胞肿瘤、皮肤癌、黑素瘤(包括恶性黑素瘤)、间皮瘤、淋巴瘤、骨髓瘤(包括多发性骨髓瘤)、白血病、肺癌(包括非小细胞肺癌(包括所有组织学亚型:腺癌、鳞状细胞癌、支气管肺泡癌、大细胞癌和腺鳞混合型)、小细胞肺癌)、卵巢癌、胰腺癌、前列腺癌、肾癌(包括但不限于乳头状肾细胞癌)、肠癌、肾细胞癌(包括遗传性和零星乳头状肾细胞癌,i型和ii型以及肾透明细胞癌);肉瘤,尤其是骨肉瘤、透明细胞肉瘤和软组织肉瘤(包括腺泡状和(例如胚胎性)横纹肌肉瘤、腺泡状软组织横纹肌肉瘤);甲状腺癌(乳头状和其它亚型)。
例如,met抑制剂也用于治疗癌,其中所述癌是胃癌、结肠癌、肝癌、生殖器官癌、泌尿系统癌、黑素瘤或前列腺癌。在一个特定实施方式中,所述癌是肝癌或食管癌。
例如,met抑制剂也用于治疗结肠癌,包括转移瘤,如在肝中,以及治疗非小细胞肺癌。
例如,met抑制剂也可用于治疗遗传性乳头状肾癌(schmidt,l.等.nat.genet.16,68-73,1997)和其它增生性疾病,其中c-met过表达或者由突变(jeffers和vandewoude.oncogene18,5120-5125,1999;和其中引用的参考文献)或染色体重排(如tpr-met;cooper等.nature311,29-33,1984;park.等.cell45,895-904,1986)组成型激活。
例如,met抑制剂进一步用于治疗本文提供或本领域已知的其他癌和病症。
例如,met抑制剂也适于治疗一种或多种炎性病症。
在另一个实施方式中,所述炎性病症归因于感染。在一个实施方式中,所述治疗方法阻断病原体感染。在一个特定实施方式中,所述感染是细菌感染,例如李斯特菌(listeria)感染。参见例如shen等.cell103:501-10,(2000),其中细菌表面蛋白通过结合受体胞外结构域来活化c-met激酶,从而模拟同源配体hgf/sf的效果。
本公开的组合产品特别适用于治疗上述顺应于egfr或met抑制剂治疗的任何癌,尤其是选自腺癌(特别是乳腺癌或更特别是肺腺癌)、横纹肌肉瘤、骨肉瘤、膀胱癌、结直肠癌和神经胶质瘤的癌。
术语“治疗有效量”的本公开化合物是指将引发对象的生物或医学反应的本公开化合物的量,例如降低或抑制酶或蛋白活性,或减轻症状,缓解病症,减缓或延迟疾病发展,或预防疾病等。在一个非限制性实施方式中,术语“治疗有效量”指这样量的本公开化合物:当给予对象时,有效用于(1)至少部分缓解、抑制、预防和/或减轻病症、紊乱或疾病,所述疾病(i)由cmet(met)和/或egfr活性介导或(ii)表征为cmet和/或egfr活性(正常或异常);或(2)降低或抑制cmet和/或egfr活性;或(3)降低或抑制cmet和/或egfr表达。在另一非限制性实施方式中,术语“治疗有效量”指这样量的本公开化合物:当给予细胞或组织或非细胞生物材料或介质时,有效用于至少部分降低或抑制cmet和/或egfr活性;或至少部分降低或抑制cmet和/或egfr表达。
本文所用的术语“对象”指动物。通常,所述动物是哺乳动物。对象也指例如灵长类(如人)、牛、绵羊、山羊、马、狗、猫、兔、大鼠、小鼠、鱼、鸟等。在某些实施方式中,所述对象是灵长类。在另一实施方式中,所述对象是人。
“和/或”指清单中的一种或两种或所有组分或特征均为可能的变体,特别是其中两种或更多采用替代或累积方式。
本文所用的术语“抑制”、“抑制作用”或“阻止”指减少或遏制给定病症、症状、或紊乱、或疾病,或者生物活性或过程的基线活性显著降低。
在一个实施方式中,本文所用的术语“治疗”、“处理”或“对待”任何疾病或紊乱指缓解疾病或紊乱(即减缓或阻滞或减少疾病发展或其至少一种临床症状)。在另一实施方式中,“治疗”、“处理”或“对待”指减轻或缓解至少一种物理参数,包括可能不由患者识别的那些。在另一实施方式中,“治疗”、“处理”或“对待”指调节疾病或紊乱,身体上(如可识别症状的稳定)、生理上(如物理参数的稳定)或两者皆有。在另一实施方式中,“治疗”、“处理”或“对待”指预防或延迟疾病或紊乱发生或发展或进展。
例如,术语“治疗”包括将组合伴侣预防性或特别是治疗性给予需要这类治疗的温血动物,优选人,旨在治愈疾病或对疾病消退或疾病进展延迟产生影响。
如本文所用,若对象从治疗中获得生活质量上的生物、或医学益处,则对象“需要”治疗。
本文所用的术语“一个”、“一种”、“所述”和本公开上下文(尤其是权利要求的上下文)所用类似术语应解释为涵盖单数和复数,除非本文另有说明或与上下文明显矛盾。
本公开所述组合能以已知方式制备且是适合肠部如口服或直肠和胃肠外给予包括人在内的哺乳动物(温血动物)的那些,包括治疗有效量的至少一种药理学活性组合伴侣,单独或与一种或多种药学上可接受载体联合,尤其适合肠部或胃肠外施用。在本公开的一个实施方式中,一种或多种活性成分口服给药。
本文所用的术语“载体”或“药学上可接受载体”包括任何和所有溶剂、分散介质、涂层、表面活性剂、抗氧化剂、防腐剂(例如抗菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料等和其组合,如本领域技术人员已知(参见例如《雷明顿药物科学》),第18版,麦克出版公司,1990,第1289-1329页)。除非任何常规载体与活性成分不相容,否则考虑其在治疗或药物组合物中的应用。
本公开所述药物组合产品(作为固定组合,或作为药盒,例如作为固定组合和就组合伴侣之一或两者而言个体制剂的组合,或作为组合伴侣个体制剂的药盒)包括本公开的组合伴侣(至少一种met酪氨酸激酶抑制剂、至少一种egfr酪氨酸激酶抑制剂和可选的一种或多种其它助剂)以及一种或多种药学上可接受载体材料(载体、赋形剂)。组合产品或构成其的组合伴侣能配制用于特定给药途径,如口服给药、胃肠外给药和直肠给药等。另外,本公开的组合产品能以固体形式(包括但不限于胶囊、片剂、药丸、颗粒、粉末或栓剂)或液体形式(包括但不限于溶液、悬液或乳液)制备。组合产品和/或其组合伴侣能经受常规药物操作如灭菌和/或能包含常规惰性稀释剂、润滑剂或缓冲剂以及佐剂如防腐剂、稳定剂、润湿剂、乳剂和缓冲剂等。
在一个实施方式中,所述药物组合物是片剂或明胶胶囊,包括活性成分与一种或多种通常已知的载体,如选自下组的一种或多种载体
a)稀释剂,例如乳糖、右旋糖、蔗糖、甘露醇、山梨醇、纤维素和/或甘氨酸;
b)润滑剂,例如二氧化硅、滑石、硬脂酸、其镁或钙盐和/或聚乙二醇;也用于片剂
c)粘合剂,例如硅酸镁铝、淀粉糊、明胶、黄芪胶、甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮;若需要
d)崩解剂,例如淀粉、琼脂、藻酸或其钠盐、或泡腾合剂;和
e)吸附剂、着色剂、调味料和甜味剂。
片剂可根据本领域已知方法采用薄膜包衣或肠溶包衣。
用于口服给药的合适组合物特别包括有效量的一种或多种或(在固定组合制剂情况中)各组合伴侣,采用片剂、锭剂、水或油悬液、可分散粉末或颗粒、乳液、硬或软胶囊、或糖浆剂或酏剂形式。旨在口服应用的组合物根据本领域已知用于生产药物组合物的任何方法制备,这类组合物能包括一种或多种选自甜味剂、调味剂、着色剂和防腐剂的试剂以提供药用优雅性和可口的制品。片剂可包含活性成分,混合适于生产片剂的无毒药学上可接受赋形剂。例如,这些赋形剂是惰性稀释剂,如碳酸钙、碳酸钠、乳糖、磷酸钙或磷酸钠;成粒和崩解剂,例如玉米淀粉或藻酸;粘合剂,例如淀粉、明胶或阿拉伯树胶;和润滑剂,例如硬脂酸镁、硬脂酸或滑石。片剂不加包衣,或通过在胃肠道中延迟崩解和吸收的已知技术包衣,从而提供较长阶段的持续作用。例如,能采用延时材料如单硬脂酸甘油酯或二硬脂酸甘油酯。口服应用的制剂能呈现为硬明胶胶囊,其中活性成分混合惰性固体稀释剂,例如碳酸钙、磷酸钙或高岭土,或作为软明胶胶囊,其中活性成分混合水或油介质,例如花生油、液体石蜡或橄榄油。
某些可注射组合物(特别是例如当抗体用作egfr抑制剂时有用)是水性等渗溶液或悬液,且栓剂有利地制备自脂肪乳液或悬液。所述组合物可以无菌和/或包含佐剂,如防腐、稳定、润湿或乳化剂,溶液促进剂,调节渗透压的盐和/或缓冲剂。另外,其还可包含其它治疗上有价值的物质。所述组合物分别根据常规混合、制粒或包衣法制备,且包含约0.1-75%或包含约1-50%的活性成分。
经皮施用的合适组合物包括有效量的一种或多种活性成分与合适载体。适于经皮递送的载体包括可吸收的药学上可接受溶剂以协助穿过宿主皮肤。例如,经皮装置采用绷带形式,包括支持构件,含所述化合物的储库(可选有载体),可选速率控制屏障从而在延长时间段中以受控和预定速度递送化合物至宿主皮肤,和将装置稳固到皮肤的手段。
用于局部如皮肤和眼部施用的合适组合物包括水溶液、悬液、油膏、乳膏、凝胶或可喷射制剂,如气雾剂递送等。这种局部递送系统尤其适于皮肤给药,例如用于治疗皮肤癌,例如在防晒霜、洗剂、喷雾等中的预防性应用。因此,其特别适合用于本领域熟知的局部制剂,包括化妆品。这些可包含增溶剂、稳定剂、张力增强剂、缓冲剂和防腐剂。
本文所用的局部施用还可涉及吸入或鼻内施用。其可以来自干粉吸入器的干粉(单独,作为混合物,例如有乳糖的干混料,或混合的组分颗粒,例如有磷脂)或来自增压容器、泵、喷雾、喷雾器或雾化器的气雾剂喷雾呈现形式方便地递送,后者有或没有使用合适推进剂。
本公开还涉及成套药盒或固定药物组合物,包括有效量的至少一种met酪氨酸激酶抑制剂、至少一种egfr酪氨酸激酶抑制剂或其分别药学上可接受盐,尤其是有效治疗上述疾病之一的量,和可选地至少一种额外助剂或其药学上可接受的盐,以及一种或多种药学上可接受载体,其适合局部、肠内例如口服或直肠、或胃肠外给药,且可以是无机或有机,固体或液体。
在所有制剂中,构成本公开所述组合产品之部分的活性成分可各以对应制剂重量0.5-95%的相对量(涉及无包装和小册子的制剂)存在,例如,分别为1-90,5-95,10-98或10-60或40-80%重量。
用于温血动物的活性成分剂量取决于多种因素,包括患者类型、种类、年龄、体重、性别和医学状况;待治疗病症的严重度;给药途径;患者的肾和肝功能;和所用具体化合物。掌握普通技术的医生、临床医师或兽医能容易确定和处方预防、抵抗或阻滞病症进展所需的有效量药物。在产生功效而无毒性范围内达到药物浓度的最优精度需要一个基于药物到达靶位点可及性动力学的方案。这涉及到考虑药物的分布、平衡和消除。待给予温血动物,例如约70kg体重的人,的各组合伴侣或其药学上可接受盐的剂量优选是每人每天约3mg-约5g,更优选约10mg-约1.5g,例如优选分成1-3个单一剂量,例如每天使用一次或两次,其可以例如具有相同尺寸。通常,儿童接受成人剂量的一半。
例如就约50-70kg的对象而言,本公开药物组合产品的单位剂量可以是约1-1000mg活性成分,或就任何一种活性成分或尤其是活性成分总和而言是约1-500mg或约1-250mg或约1-150mg或约0.5-100mg或约1-50mg;或就任何一种活性成分或尤其是活性成分总和而言分别是(特别用于egfr抑制剂)50-900、60-850、75-800或100-600mg。化合物、药物组合物、或其组合的治疗有效剂量取决于对象种类、体重、年龄和个体状况、所治疗紊乱或疾病或其严重度。掌握普通技术的医生、临床医师或(在动物应用中)兽医能容易确定有效量的预防、治疗或抑制紊乱或疾病进展所需的各活性成分。
本公开的特定实施方式也在通过引用纳入本文的权利要求中以及实施例中给出。
实施例
下列实施例阐述本公开并提供特定实施方式,然而不限制本公开之范围。
实施例1细胞培养数据
试剂:
inc280(nvp-inc280)和化合物a以10mm溶于dmso并在-20℃等分保存。
细胞培养:
hcc827获自atcc。hcc827gr5(抗吉非替尼)获自麻省综合医院的jeffengleman实验室。2种细胞都在带10%fbs(赛默飞世尔(thermoscientific),#sh30071.03)的rpmi-1640(atcc,#30-2001)中培养,并维持于37℃,5%co2培养箱。细胞用trypletmexpress(英杰(invitrogen),#12604-013)一周传代两次,用于分离贴壁哺乳动物细胞的无动物源性重组酶与常规胰蛋白酶作比较。
细胞增殖试验:
细胞活力通过测量细胞atp含量确定,根据厂商操作使用
计算组合效果的方法:
为以无偏方式评估组合效果并以所有可能浓度鉴定协同效应,组合研究用“剂量矩阵”进行,其中组合以连续稀释化合物的所有可能排列测试。所有组合试验中,化合物同时应用。用于此研究的所述“剂量矩阵”如下:化合物a接受7剂量3x连续稀释,最高剂量为3um且最低剂量为约1.37nm。inc280接受7剂量3x连续稀释,最高剂量为1.5μm且最低剂量为约686pm。协同相互作用使用chalice软件(combinatorx,马萨诸塞州剑桥)分析。通过将试剂组合的应答与各单个试剂的应答进行比较,而非采用药物-自身剂量-叠加对照模型,来计算协同性。剂量叠加的偏差能用组合指数在数字上评价,所述指数定量组合效应的总强度,其本质上是体积得分vhsa=σx,ylnfxlnfy(i数据–ihsa),并且也在数据与最高单试剂表面之间计算,就单试剂稀释因子fx,fy标准化(lehar等,2009)。
结果:
图1-4显示组合结果。化合物a和inc280在hcc-827吉非替尼耐药细胞系(cmet扩增)中彼此受益,而亲代细胞系仅对化合物a响应(无组合效应)。
实施例2用化合物a与inc280在人nsclc埃罗替尼和化合物a抗性hcc827异种移植模型中的体内组合研究,所述模型携带活化egfrex19del突变
缩写列表
研究化合物a与inc280组合的体内抗肿瘤活性,用化合物a抗性人非小细胞肺癌(nsclc)细胞系hcc827作为皮下植入scid浅褐色小鼠的异种移植。nci-hcc827携带活化和致癌ex19delegfr突变。inc280是口服生物可利用、选择性c-met受体酪氨酸激酶抑制剂。
如下详示,化合物a与inc280组合在化合物a抗性nsclchcc827荷瘤浅褐色小鼠中实现显著抗肿瘤活性。在治疗进程中每日口服给药30mg/kg化合物a联合每日两次口服剂量10mg/kginc280引起相较载剂对照的显著肿瘤消退(p<0.0001)。组合实现的肿瘤消退水平显著优于单一治疗臂中单独的inc280或化合物a(p<0.0001)。此外,单独化合物a耐受良好,在测试剂量中很少或没有显著体重减轻。单一治疗中对于此实验采用每日两次(bid)安排的inc280在第7、8天有药物假期,而组合臂在第9、10和11天不给药。化合物a与inc280联合给药时候显示在egfr抗性背景下的显著肿瘤消退,所述背景有c-met活化/扩增。
方法
测试化合物:
化合物a(hcl盐形式)
埃罗替尼(用于形成抗性条件),和
inc280(二盐酸盐形式)
制剂:
含30mg/kg化合物a(hcl盐形式)的0.5%mc(甲基纤维素)0.5%吐温80,悬液。
含30-100mg/kg埃罗替尼的90%水、10%乙醇/克列莫佛(1:1),悬液。
含10mg/kginc280-aa-3(二盐酸盐形式)的0.25%mc(甲基纤维素)0.05%吐温80于水中,精细悬液。
材料:
harlan雌性foxn1裸小鼠和scid浅褐色小鼠(6-8周龄)用作实验动物。nci-hcc827细胞系购自atcc(弗吉尼亚州马纳萨斯的美国模式培养物保藏所)。埃罗替尼(hcl盐)购自lc实验室(lclaboratories,马萨诸塞沃本)cat#e-4007批号bbe-106。中性缓冲福尔马林、丽春红s溶液#p7170、bsa、tbst、磷酸酶抑制剂混合物i和ii购自西格玛奥德里奇(sigma-aldrich)。一抗-抗磷酸化egf受体(tyr1173)(53a5)(兔,1:1000,cat#4407,总egfr(兔,1:1000,cat#2232)磷酸化akt(ser473)(193h12),(兔,1:1000,cat#4058)和总akt兔,1:1000,cat#9272,磷酸化p44/42mapk(erk1/2)(thr202/tyr204)(197g2)兔1:1000cat#4377,总p44/42mapk(erk1/2)兔1:1000,cat#9102,磷酸化met(tyr1234/1235)(兔-xpmab,1:1000,细胞信号传导公司(cellsignaling),cat#3077)和总met(兔1:1000,细胞信号传导,cat#4560)都购自cst(cellsignalingtechnology,宾夕法尼亚州西格罗夫)。对照抗体-兔igg同种型购自jir(jacksonimmunoresearch,宾夕法尼亚州西格罗夫)。supersignalwestpico化学发光底物购自赛默飞世尔,cat#34087。3x完全蛋白酶抑制剂片剂购自罗氏(roche,cat.#04693159001)。rtk印迹购自安迪生物(r&dsystems),proteomeprofiler抗体阵列-人磷酸化激酶阵列cat.ary003b和人磷酸化rtk阵列试剂盒cat.ary001b。
对于所有实验,动物饲养于12h光/暗周期设施并可自由获得水和食物。
所有动物相关程序根据gnfiacuc批准操作方案(p11-308-dd)执行,符合动物福利法条款以及实验动物管理和使用指南。
建立埃罗替尼/化合物a抗性nci-hcc827肿瘤模型
原始肿瘤系如下建立:在scid浅褐色小鼠中细胞植入肿瘤组织和随后连续传代(第3代)以产生稳定肿瘤系。如下述及附图5和7,该稳定肿瘤系用于形成埃罗替尼/化合物a抗性肿瘤系。
磷酸化rtk阵列显示来自hcc827亲代和动物8的肿瘤裂解物(图6)。亲代hcc827显示pegfr上调而pmet下调。埃罗替尼抗性hcc827中的rtk印迹显示,相较hcc827亲代,pegfr略下调,而pmet上调。
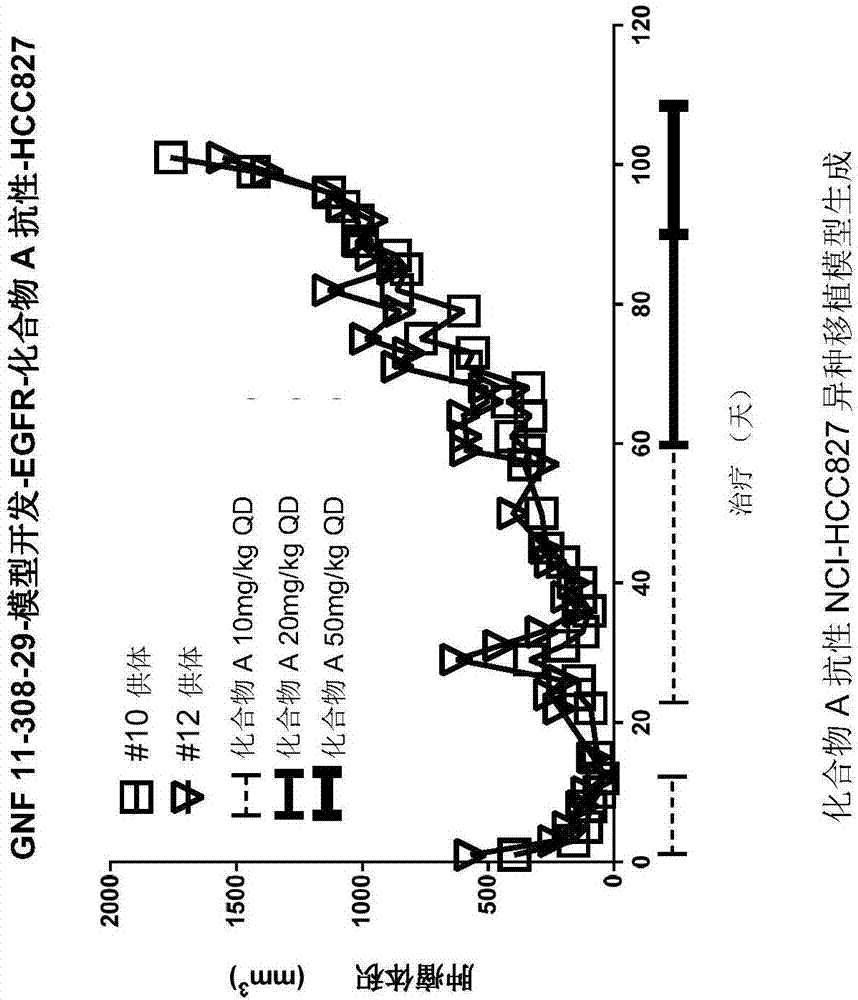
有cmet扩增的埃罗替尼/化合物a抗性hcc827肿瘤储备
对于11308-138研究,用于埃罗替尼的供体肿瘤储备来自11-308-29小鼠#8,用于化合物a抗性的来自#10,#12。在研究11-308-29中,原初肿瘤给药埃罗替尼,从30mg/kg开始持续75天,剂量增加到第76天的100mg/kg并持续32天。化合物a以10mg/kg连续给药2周并在第14-30天为药物假期。化合物a给药在第30-60天恢复10mg/kg。化合物a剂量从第60-85天提高到20mg/kg,剂量从第85-106天再次提高到50mg/kg。肿瘤在达到1700mm3时进行收集。对于组织植入,小鼠用2-4%异氟烷/氧混合物的连续流麻醉,使用便携式麻醉诱导箱(加利福尼亚州普莱森顿的维特普(vetequipinc.)),2-3块肿瘤组织皮下植入40只带基质胶的scid浅褐色小鼠(第2代)用于研究11-308-138并如图5和7所述。
图8的rtk印迹显示,相较在先前埃罗替尼抗性部分所示亲代hcc827,来自研究11-308-29动物10,12(11-308-29动物#10供体源用于11-308-138)的肿瘤裂解物,pegfr略下降且pmet上调。与埃罗替尼抗性hcc827肿瘤中类似,相较亲代hcc827,化合物a抗性hcc827肿瘤的pegfr略下降且pmet上调。
用埃罗替尼、化合物a和inc280作为单一疗法或组合在抗性nci-hcc827肿瘤中进行的灵敏pd蛋白质印迹
在肿瘤片段植入50天后将荷有埃罗替尼抗性肿瘤的scid浅褐色小鼠(动物2-5)随机分为4组,每组n=1,平均肿瘤体积为1236.18mm3且sd为316.57mm3。将化合物a抗性hcc827肿瘤(动物6-16)在肿瘤片段植入后24天随机分入4组(每组n=3只小鼠),平均肿瘤体积为963.24mm3且sd为179.56mm3。每组动物接受每日一次30mg/kg口服给药化合物a或每日两次10mg/kginc280-aa-3,单独或组合。
药效动力学测量
评估pegfr和pmet的靶抑制由蛋白质印迹完成。每个样品的40g肿瘤裂解蛋白进行电泳,使用criterion4-12%bis-tris胶(伯乐公司(bio-rad),cat#345-0124)。完成蛋白转移后,膜用含5%bsa(西格玛(sigma))的tbst(25mmtris,150mmnacl,0.1%吐温-20)室温孵育1h以阻断非特异结合。膜随后用稀释于5%bsa-tbst的一抗在摇摆式振荡摇床上4℃过夜孵育,所述抗体针对磷酸化egfr(egfr,y1173)(兔,1:1000,细胞信号传导公司,cat#4407,马萨诸塞州丹佛斯)和总egfrr(兔,1:1000,细胞信号传导公司,cat#2232);磷酸化met(y1234/1235),(兔-xpmab,1:1000,细胞信号传导公司,cat#3077)和总met(兔,1:1000,细胞信号传导公司cat#4560)。tbst中洗3次,每次10分钟,然后膜用二抗即溶于5%bsa-tbst的hrp缀合抗兔抗体(1:2000,细胞信号传导公司,cat#7074)室温孵育1h。膜随后在tbst中洗5次,每次5分钟,用supersignalwestpico化学发光底物(赛默飞世尔cat#34087)室温孵育2分钟。化学发光信号通过薄膜曝光20秒到2分钟来检测(thermocl-xposure薄膜cat#34091)。
化合物a抗性hcc827小鼠异种移植模型中的功效研究(gnf-11-308-138)
荷有hcc827埃罗替尼抗性肿瘤的雌性scid浅褐色小鼠在肿瘤细胞植入后6天随机分入4组(每组n=6只小鼠),平均肿瘤体积范围为89.30-386.24mm3(表1)。化合物a-aa-14配制于0.5%mc,0.5%吐温80悬液制剂。inc280-aa-3配制于0.25%mc(甲基纤维素)0.05%吐温80的水溶液。各组的动物在治疗进程中接受载剂、每日一次口服的化合物a-aa-1430mg/kg和每日两次口服的inc280-aa-310mg/kg,给药体积为5ml/kg动物体重。动物在给药日称重且剂量根据体重调整。肿瘤体积用数显卡尺每周测量3次,在整个研究中记录所有动物的体重。
数据分析
肿瘤测量和体重:
每日监测体重且体重%变化按(bw当前-bw初始)/(bw初始)x100计算。数据表示为相比治疗起始日的体重变化百分比。
一旦肿瘤可触摸,每周三次评价肿瘤尺寸。用卡尺测量确定肿瘤尺寸。肿瘤体积按以下公式计算:(长x宽x宽)/2。
肿瘤的治疗/对照(t/c)值百分比用下式计算:
如果δt>0,则%t/c=100×δt/δc
如果δt<0,则%消退=100×δt/t初始
其中:
t=药物治疗组在研究最后一天的平均肿瘤体积;
δt=药物治疗组在研究最后一天的平均肿瘤体积–药物治疗组在初始给药日的平均肿瘤体积;
t初始=药物治疗组在初始给药日的平均肿瘤体积;
c=对照组在研究最后一天的平均肿瘤体积;和
δc=对照组在研究最后一天的平均肿瘤体积–对照组在初始给药日的平均肿瘤体积。
所有数据表示为均值±均值标准偏差(sem)。δ肿瘤体积和体重用于统计分析。组间比较用单向anova以及之后事后图基检验或邓恩检验来完成。对于所有统计评估,显著性水平设为p<0.05。报告相较载剂对照组的显著性,除非另有说明。
结果
化合物a和inc280的抗肿瘤活性和耐受性在egfri抗性hcc827小鼠异种移植模型中检测。埃罗替尼和化合物a抗性肿瘤模型都由内部建立。这些肿瘤通过蛋白质和prtk分析确认具有c-met扩增/活化。化合物a、inc280作为单一疗法或组合的单剂量药效学(pd)评价表明,该组合对抑制egfr和cmet磷酸化最有效。载剂和30mg/kg剂量的化合物a每天一次口服给予,且10mg/kg剂量的inc280通过管饲每天两次口服给药,持续14天。然而,由于用inc280每日两次安排出现体重减轻,在该研究单一疗法臂的第7和8天以及组合臂中的第9、10和11天实施了药物假期。化合物a与inc280的组合引起体内肿瘤消退,而任一单一药剂单独未引起。
egfr和cmet的磷酸化在来自亲代hcc827的肿瘤裂解物中,及在埃罗替尼/化合物a抗性肿瘤显示(图3-1)。埃罗替尼100mg/kg、化合物a30mg/kg和inc28010mg/kg都在有效水平给药,给药后6小时取肿瘤。
化合物a在hcc827小鼠异种移植中的功效
如图10所示,载剂或30mg/kg的化合物a每天一次口服给药,10mg/kg的inc280每天两次口服给药。化合物a也与inc280联合评估。图显示单独化合物a与载剂没有显著差异(p>0.05),t/c为64%。单独化合物a有显著差异(p<0.001),t/c为23%。化合物a联合inc280与载剂有显著差异(p<0.0001),诱导统计上显著的肿瘤消退(t/c-86%)。此外,化合物a与inc280的组合显著优于任一单药剂即单独化合物a或inc280(p<0.0001)。详细的肿瘤体积测量和肿瘤体积变化列于附录表1及2。
化合物在hcc827小鼠异种移植模型中的耐受性
化合物耐受性通过组的体重百分比变化监测,如图11所示。单独化合物a耐受良好,体重在14天治疗进程中维持。然而,单独inc280必须在第7和8天给予药物假期,因为体重分别变化-8.5%和-5.66%,但给药在第9天恢复。由于inc280也是联合组一部分并在第9天显示体重减轻趋势,联合组也接受第9、10和11天的药物假期,这是基于组体重分别变化-4.72%、-3.91和-1.0%,并在第12天至第14天恢复给药。初始和最终体重测量详示于表3。
组合研究中pegfr(400x)和pmet(200x)的免疫组化评估
ihc和组织学示于图12。上排是pegfrihc(p-egfr(d).ms,hu;免疫组织化学sop33)100x。下排是pmetihc(p-met(d).hu;免疫组织化学sop53)100x。从左到右为载剂、化合物a、inc280、化合物a/inc280组合。
结论与讨论
egfr突变分子靶向治疗的进步是nsclc患者的重要治疗策略。发现其中约5%对egfrtki有获得性抗性的egfr突变阳性肿瘤具有met基因扩增。
化合物a设计成提高第一和第二代egfr抑制剂功效,同时相较先前egfrtki其具有降低的剂量限制性相关毒性。化合物a有潜力与inc280联合提供在有met活化/扩增的患者群中治疗nsclc的有效疗法。
化合物a联合inc280在对化合物a单一疗法有抗性的hcc827肿瘤中获得显著抗肿瘤活性和肿瘤消退。30mg/kg化合物a每天一次口服给药联合10mg/kginc280每天两次口服给药14天后,实现显著肿瘤消退(t/c-86%)。单独化合物a耐受良好,30mg/kg时观察到很少或没有体重减轻。单独inc280显示在第7天体重略减轻(-8.5%),且对于剩下的研究耐受良好。联合时,即使对化合物a与inc280组合耐受,由于inc280单药剂影响,也在第9、10和11天实施药物假期。总之,化合物a联合inc280能为nsclc患者提供临床益处,所述患者也是受cmet影响。
表1hcc827小鼠异种移植中治疗后的个体肿瘤体积测量(研究#gnf-11-308-138-eff-egfr-化合物a-inc280-化合物a抗性hcc827)
表1.人化合物a抗性nsclchcc827肿瘤片段皮下植入6-8周龄雌性scid浅褐色小鼠右侧腹部。当肿瘤体积达到~580mm3时,开始治疗。载剂(0.5%mc,0.5%吐温80)或30mg/kg化合物a每天一次给药和10mg/kginc280-aa-3通过口服管饲每天两次给药,连续14天。肿瘤体积通过卡尺测量计算,(长x宽x宽)/2,每周3次记录。
表2化合物a每天一次口服给药和或inc280每天两次口服给药14天后,hcc827小鼠异种移植中的平均初始和终肿瘤体积以及抗肿瘤效果t/c(治疗相比对照百分比)汇总(研究#gnf-11-308-138-eff-egfr-化合物a-hcc827)
表2.人化合物a抗性nsclchcc827肿瘤片段皮下植入6-8周龄雌性scid浅褐色小鼠右侧腹部。当肿瘤体积达到~580mm3时,开始治疗。载剂(0.5%mc,0.5%吐温80)或30mg/kg化合物a每天一次给药和10mg/kginc280-aa-3通过口服管饲每天两次给药,连续14天。肿瘤体积通过卡尺测量计算,(长x宽x宽)/2,每周3次记录。se:标准偏差。各治疗(t)和对照(c)组的肿瘤体积变化如下测量:指定观察日的平均肿瘤体积减去首次治疗日(起始日)的平均肿瘤体积。这些值用于如下计算百分比t/c:
%t/c=(δt/δc)×100;当δt>0
%t/c=(δt/ti)×100;当δt<0,
ti是治疗开始时的平均肿瘤重量。
表3每天一次口服给药化合物a或载剂和每天两次口服给药inc280后第14天,小鼠化合物a抗性hcc827异种移植中的平均初始和终体重以及百分比体重变化(研究#11-308-138)。
表3.人化合物a抗性nsclchcc827肿瘤片段皮下植入6-8周龄雌性scid浅褐色小鼠右侧腹部。当肿瘤体积达到~580mm3时,开始治疗。载剂(0.5%mc,0.5%tween80)或30mg/kg化合物a每天一次给药和10mg/kginc280-aa-3通过口服管饲每天两次给药,连续14天。体重用梅特勒分析天平(克)计算并从第1天到第14天记录。sd:标准偏差。体重百分比变化计算为(bw当前-bw初始)/(bw初始)x100。数据表示为相比治疗起始日的体重变化百分比。
实施例3化合物a与inc280联合用于有egfr突变非小细胞肺癌的成年患者
有晚期或转移性egfr突变l858r或ex19delnsclc的患者能用化合物a与inc280组合治疗。
化合物a用50mg,75mg,150mg,300mg,450mg,600mg或800mg剂量每日给药。inc280用100mg每日两次,200mg每日两次,400mg每日两次或600mg每日两次给药。
- 还没有人留言评论。精彩留言会获得点赞!
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法