一种提取大豆种子全基因组DNA的方法与流程
本发明属于分子生物学领域,具体涉及一种提取大豆种子全基因组DNA的方法。
背景技术:
随着分子生物学的快速发展,国内外已经开展了大量的基础生物学研究和分子辅助育种,基因组DNA提取作为分子实验中最为基础而重要的技术手段应用在各个研究领域。很多研究需要大量实验材料,DNA提取工作量大,而且纯度要求高,DNA的提取质量和效率将会直接影响后续实验结果。
大豆(学名:Glycine max(L.)Merr)通称黄豆。属于双子叶植物纲、豆目、蝶形花科、大豆属一年生草本植物。营养价值最丰富,含高品质的蛋白质约40%。脂肪含量为15%到20%,富含不饱和脂肪酸。此外,还含有维生素A、B、D、E及钙、磷、铁等矿物质。正是由于大豆中蛋白和脂肪等含量丰富,较其他主要农作物(如水稻,小麦,玉米等)DNA提取的难度较高。传统的CTAB法、SDS法或者高盐低pH法等提取基因组DNA耗时长,而且提取大豆种子全基因组DNA时的杂质比较多;而试剂盒方法提取的大豆种子全基因组DNA浓度也不高,无法满足基因组学研究。因此急需一种简便、高效、经济的提取大豆种子全基因组DNA的方法。
技术实现要素:
本发明的目的在于提供一种提取大豆种子全基因组DNA的方法。
本发明的目的可以通过以下技术方案实现:
一种提取大豆种子全基因组DNA的方法,包括以下步骤:
(1)将大豆种子加液氮研磨成细粉;
(2)向研磨后的细粉中加入细胞提取缓冲液和0.2mol/L NaOH混匀后90~95℃水浴8-10min,然后离心留上清液;
(3)向步骤(2)所得到的上清液中加入20mg/mL的蛋白酶K和10mg/ml RNAase,56℃水浴10min,然后离心留上清液;
(4)向步骤(3)所得到的上清液中加入与上清液等体积的苯酚和氯仿的混合液,所述混合液中苯酚和氯仿体积比为1:1,充分混匀并离心后取上清液;
(5)向步骤(4)所得到的上清液中加入与上清液等体积的氯仿和异戊醇的混合液,所述混合液中氯仿和异戊醇体积比为24:1,充分混匀并离心后取上清液;
(6)向步骤(5)所得到的上清液中加入所述上清液4/5体积的异丙醇,于-20℃沉淀后离心弃上清液,得到沉淀的DNA;
(7)向步骤(6)所得到的DNA中加入75%(V/V)乙醇洗涤,离心弃上清液,得到沉淀的DNA;
(8)向步骤(7)所得到的沉淀DNA中加入无水乙醇洗涤,离心弃上清液,残留的乙醇挥发干净,加入TE溶液溶解,于-20~-70℃下保存备用。
所述的细胞提取缓冲液成分为:0.01mol/L Tris,1mmol/L EDTA,0.1mol/LNaCl,pH为8.0。
所述TE溶液成分为:10mmol/L Tris-HCl,1mmol/L EDTA,pH 8.0。
步骤(2)中研磨后的细粉与细胞提取缓冲液和0.2mol/L NaOH的用量比为:每50mg研磨后的细粉中加入880μL细胞提取缓冲液、120μL 0.2mol/L NaOH。
步骤(3)中蛋白酶K和RNAase的添加量为:2.0mL离心管中加入10μL蛋白酶K(20mg/mL)和5μL RNAase(10mg/mL)。
步骤(2)中所述离心的条件为:12 000r/min离心5~10min。
步骤(3)~(8)中所述离心的条件为:12 000r/min离心10~15min。
步骤(6)中所述沉淀的时间为10~15min。
本发明提供一种快速、经济提取大豆种子全基因组DNA的方法,涉及分子生物学领域中植物全基因组DNA提取方法。该方法主要步骤是:向液氮充分研磨的大豆样品中加入细胞核提取缓冲液,经过高温裂解,蛋白酶消化,RNA酶处理,苯酚/氯仿和氯仿/异戊醇抽提,异丙醇沉淀以及乙醇洗涤,快速提取到较高浓度和纯度的大豆全基因组DNA。本发明较传统的DNA提取方法(CTAB法)用时极大的缩短,DNA质量也有一定提高;较DNA提取试剂盒方法,DNA浓度增加一倍,费用却大大降低,用时相当。本发明适用于常温保存以及新鲜的大豆种子高质量全基因组DNA的提取。
本发明的最优选详细技术方案为:
(1)称取大豆种子,置于研钵中加入液氮研磨成细粉;
(2)将研磨后的大豆细粉转入2.0mL离心管中,每管50mg,再加入880μL细胞提取缓冲液、120μL 0.2mol/L NaOH,混匀后95℃水浴8min,12 000r/min离心5min,吸取上清液加入新的2.0mL离心管中;细胞提取缓冲液成分为:1mL 1mol/L Tris,0.2mL 0.5mol/L EDTA,0.5844g NaCl定容至100mL,pH为8.0;
(3)加入10μL蛋白酶K(20mg/mL)和5μl RNAase(10mg/mL)56℃水浴10min,12 000r/min离心10min,吸取上清液加入新的2.0mL离心管中;
(4)加入等体积的苯酚/氯仿(1:1),充分混匀,12 000r/min离心10min,吸取上清液加入新的2.0mL离心管中;
(5)加入等体积的氯仿/异戊醇(24:1),充分混匀,12 000r/min离心10min,吸取上清液加入新的2.0mL离心管中;
(6)上清液中加入4/5体积的异丙醇,-20℃沉淀10min,12 000r/min离心10min,弃上清液,得到沉淀的DNA;
(7)加入1mL 75%乙醇洗涤DNA,12 000r/min离心2min,弃上清液,得到沉淀的DNA;
(8)加入500μL无水乙醇洗涤,弃上清液,残留的乙醇挥发干净;
加入50μL TE溶解,于-20~-70℃下保存备用;TE溶液成分为:10 mmol/L Tris-HCl,1mmol/L EDTA,pH 8.0。
取2μl上述步骤制备的DNA溶液,经1%琼脂糖凝胶电泳检测,并在核酸蛋白检测仪上检测A260nm/A280nm以及DNA浓度。
本发明的有益效果:
采用本实验方法提取大豆种子全基因组DNA可以缩短时间至1.5h,实验所用试剂较少、较普遍,且实验流程比较简单。
附图说明
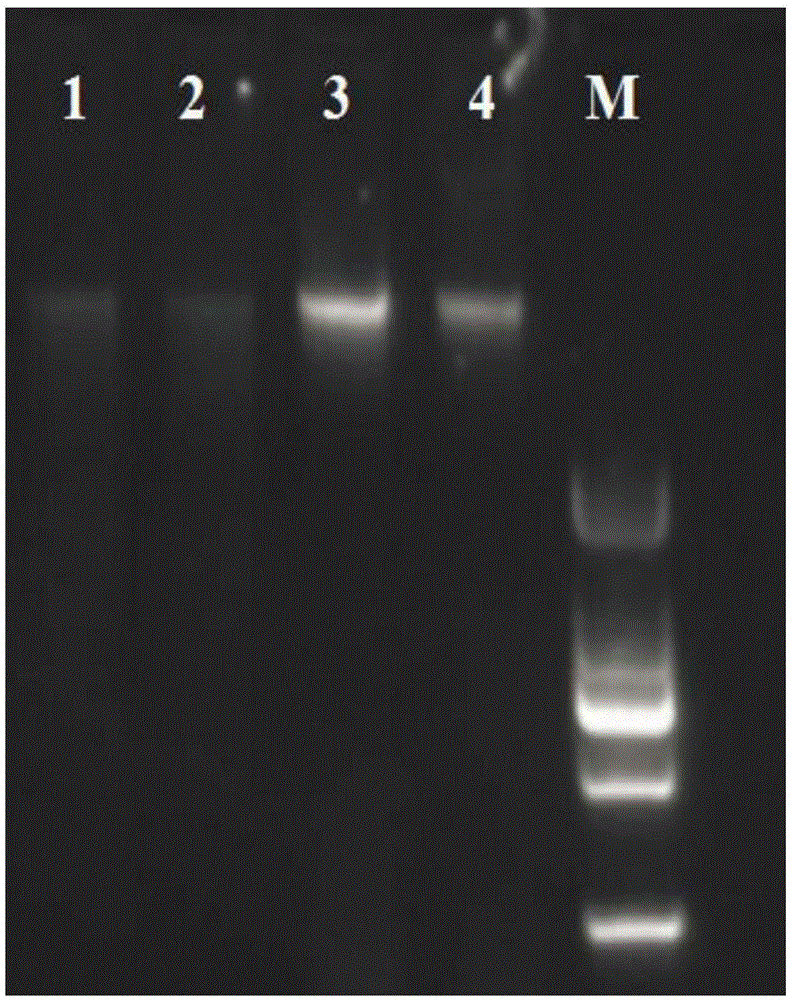
图1为大豆全基因组DNA凝胶电泳。
图中:1代表用试剂盒提取新鲜大豆种子,2代表用试剂盒提取常温保存的大豆种子,3代表用本发明提取新鲜大豆种子,4代表用本发明提取常温保存的大豆种子,M是DNAMarker。
具体实施方式
结合附图和具体实施方式对本发明的技术方案进一步说明
实施例1
(1)分别称取100mg常温保存和新鲜的大豆种子,分别置于研钵中加入液氮,充分研磨成细粉;
(2)将研磨后的大豆细粉转入2.0mL离心管中,每管50mg,再加入880μL细胞提取缓冲液(1mL 1mol/L Tris,0.2mL 0.5mol/L EDTA,0.5844g NaCl定容至100mL)、120μL 0.2mol/L NaOH;混匀后95℃水浴8min,12 000r/min离心5min,小心吸取上清液加入新的2.0ml离心管中;
(3)加入10μL蛋白酶K(20mg/mL)和5μl RNAase(10mg/mL)56℃水浴10min,12 000r/min离心10min,小心吸取上清液加入新的2.0mL离心管中;
(4)加入等体积的苯酚/氯仿(1:1),充分混匀,12 000r/min离心10min,小心吸取上清液加入新的2.0mL离心管中;
(5)加入等体积的氯仿/异戊醇(24:1),充分混匀,12 000r/min离心10min,小心吸取上清液加入新的2.0mL离心管中;
(6)向上清液中加入4/5体积的异丙醇,充分混匀,-20℃沉淀10min,12 000r/min离心10min,弃上清液,得到沉淀的DNA;
(7)加入1mL 75%乙醇洗涤DNA,12 000r/min离心2min,弃上清液,得到沉淀的DNA;
(8)加入500μL无水乙醇洗涤,弃上清液,超净工作台吹干;加入50μL TE(10mmol/L Tris-HCl、1mmol/L EDTA,pH 8.0)溶解,于-20℃下保存备用。
比较例
采用天根生化科技(北京)有限公司生产的植物基因组DNA提取试剂盒(DP305)按照说明分别提取常温保存和新鲜的大豆种子的DNA。
取2μL上述实施例和比较例制备的DNA溶液,经1%琼脂糖凝胶电泳检测,图1中的1-4四条带从左到右分别是:用试剂盒提取的新鲜大豆种子,用试剂盒提取的常温保存的大豆种子,用本发明提取的新鲜大豆种子,用本发明提取的常温保存的大豆种子;M是DNAMarker。在核酸蛋白检测仪上检测OD260nm/OD280nm以及DNA浓度结果如表1。
表1提取所得大豆全基因组DNA浓度及纯度
注:表中1代表用试剂盒提取新鲜大豆种子,2代表用试剂盒提取常温保存的大豆种子,3代表用本发明提取新鲜大豆种子,4代表用本发明提取常温保存的大豆种子。
另外,实施例1提取大豆种子DNA只需要1.5h,现有技术中采用CTAB法提取大豆种子DNA一般需要3个小时,与现有CTAB法相比提取时间缩短了一半,DNA质量也有一定提高。
采用本实验方法提取大豆种子全基因组DNA可以缩短时间至1.5h,实验所用试剂较少、较普遍,且实验流程比较简单,更容易操作,与比较例相比提取的DNA条带更清晰,纯度和浓度更高(DNA浓度增加一倍),费用却大大降低,用时基本相当。将用试剂盒和新方法提取的DNA经过PCR验证后均满足分子实验要求,但是扩增出的条带并无明显差别。
- 还没有人留言评论。精彩留言会获得点赞!