一种特异性结合CD3的核酸适配体及其筛选方法和应用与流程
本发明属于生物医药领域,更具体地说,涉及一种特异性结合cd3的核酸适配体及其筛选方法和应用。
背景技术:
cd3是一种重要的白细胞分化抗原,几乎在所有t细胞表面均存在。cd3抗原由6条肽链组成,常与tcr紧密结合形成含有8条肽链的tcr-cd3复合体。其通过盐桥与t细胞抗原受体(tcellreceptor,tcr)相连,参与t细胞的信号转导,主要用于标记胸腺细胞、t淋巴细胞及t细胞淋巴瘤。t淋巴细胞介导的细胞免疫是机体抗肿瘤免疫的主要机制,t细胞经特异抗原刺激后,tcr特异性识别结合抗原呈递细胞(apc)表面mhc-ⅱ类分子/抗原肽,产生第一信号;t细胞与apc表面多对共刺激分子(如cd28、ctla-4和cd80、cd86等)相互作用产生t细胞活化的第二信号,并分泌il-2、tnf-α、tnf-β、ifn-γ和il-4等多种细胞因子,产生特异性的细胞毒作用,发挥抗肿瘤效应。
核酸适配体(aptamer)是一类通过指数富集配体系统进化技术(systematicevolutionofligandsbyexponentialenrichment,selex)从大容量的核酸文库中筛选获得能与靶分子高特异性高亲和力结合的单链dna或rna序列,因其类似于抗体的高亲和力而被称为“化学抗体”。适配体有许多独特的优势,如靶分子范围广泛、无免疫原性、分子量小、稳定性好等。这些特性使它在识别靶标时相较抗体或其他类型配体有较大的优势。
近来,越来越多的研究使用cell-selex技术筛选出具有较好的亲和力和特异性的核酸适配体,并进一步探究其功能。目前有部分适配体已用于肿瘤相关的诊治当中,适配体在肿瘤靶向诊断及治疗方面具有十分广泛的应用前景。
然而,目前缺少以cd3分子为靶标能够有效特异性结合t细胞的核酸适 配体。
技术实现要素:
针对以上现状,本发明提供了一种特异性结合cd3的核酸适配体及其筛选方法和应用。
本发明所提供的特异性结合cd3的核酸适配体,具体为如下(a)或(b):
(a)序列表中序列1所示的单链dna片段;
(b)将序列表中序列1经过一个或几个核苷酸的取代和/或缺失和/或添加后所得序列所示的单链dna片段,且与(a)中所述单链dna片段具有相同功能。
将所述单链dna片段进行修饰或改造得到的核酸适配体衍生物也属于本发明的保护范围。
所述核酸适配体衍生物可为如下任意一种:
1)将所述核酸适配体删除部分或增加部分核苷酸,得到与所述核酸适配体具有相同功能的核酸适配体衍生物;
2)将所述核酸适配体进行核苷酸取代或部分修饰,得到与所述核酸适配体具有相同功能的核酸适配体衍生物;
3)将所述核酸适配体的骨架改造为硫代磷酸脂骨架,得到与所述核酸适配体具有相同功能的核酸适配体衍生物;
4)将所述核酸适配体改为肽核酸,得到与所述核酸适配体具有相同功能的核酸适配体衍生物;
5)将所述核酸适配体的任一端或中间或两端接上信号分子(如荧光素fitc、fam、罗丹明b、或放射性分子)、活性分子(如生物素、氨基、羧基、酶)或其它功能基团后,得到与所述核酸适配体具有相同功能的核酸适配体衍生物。
本发明还提供一种核酸探针。
本发明所提供的核酸探针,具体为如下(c)或(d):
(c)序列表中序列1所示的单链dna片段,且在3’或5′末端标记有荧 光报告基团;
(d)将序列表中序列1经过一个或几个核苷酸的取代和/或缺失和/或添加后所得序列所示的单链dna片段,且与序列1所示的单链dna片段具有相同功能,并在3’或5′末端标记有荧光报告基团。其中,所述荧光报告基团具体可为异硫氰酸荧光素(fitc)、罗丹明b、羧基荧光素(fam)(如6-fam)、四甲基罗丹明(tamra)、cy3或cy5。
含有所述特异性结合cd3的核酸适配体或所述核酸探针的试剂盒也属于本发明的保护范围。
所述特异性结合cd3的核酸适配体或所述核酸探针或所述试剂盒在如下(a1)-(a4)任一中的应用也属于本发明的保护范围:
(a1)鉴定或辅助鉴定cd3;
(a2)制备鉴定或辅助鉴定cd3的产品;
(a3)检测待测物质中cd3的浓度;
(a4)分离和/或富集cd3。
其中,(a1)所述的鉴定或辅助鉴定cd3具体可为检测待测物质是否为或候选为cd3、检测待测物质是否含有或候选含有cd3等。
本发明还保护了特异性结合cd3的核酸适配体在特异性结合cd3领域的应用。
其中,所述特异性结合cd3核酸适配体在如下(b1)-(b2)任一中的应用也属于本发明的保护范围:
(b1)利用上述(a)或(b)及其衍生物激发t细胞活化的信号转导。
(b2)利用上述(a)或(b)及其衍生物阻断t细胞活化的信号转导。
所述特异性结合cd3核酸适配体在如下(c1)-(c4)任一中的应用也属于本发明的保护范围:
(c1)制备用于检测cd3的分子探针;
(c2)制备以cd3分子作为靶点的靶向t细胞的药品或制剂;
(c3)制备以cd3分子作为靶点的促进t细胞活化的药品或制剂。
(c4)制备以cd3分子作为靶点的抑制t细胞活化的药品或制剂。
本发明还提供一种如上所述的特异性结合cd3的核酸适配体的筛选方法。
本发明所提供的特异性结合cd3的核酸适配体的筛选方法,具体可包括如下步骤:
(1)以如下核酸文库为起始核酸文库:
5’-tctcggacgcgtgtggtcgg-n45-ctcgctgcctggccctagagtg-3’,其中n45表示45个连续的n,n为a、t、c或g;
(2)采用基于细胞的指数富集配基系统进化技术对步骤(1)得到的起始核酸文库进行多轮筛选,其中采用293t细胞进行反筛和采用293t-cd3细胞进行正筛。所述293t-cd3细胞为稳定表达cd3的293t细胞。
在本发明的优选实施例中,可以对步骤(1)得到的起始核酸文库进行15轮筛选,其中前两轮采用正筛,第3-15轮中每轮顺次完成反筛和正筛;
所述反筛为:将上轮正筛产物的溶液加入到贴壁生长的293t细胞中,0~5℃孵育30~60min后,收集上清液,记为上清液1作为本轮反筛产物;
所述正筛为:将起始核酸文库或者本轮反筛产物加入到贴壁生长的293t-cd3细胞中,0~5℃孵育1~2h,洗涤后弃上清,收集细胞,95~100℃变性5~10min,离心(如14000rpm离心5min)后收集上清液,记为上清液2;以所得上清液2为模板进行2次pcr扩增(除第1轮筛选的2次pcr扩增均用无标记的引物外,第2-15轮筛选的第一次pcr扩增采用无标记的引物,第二次pcr扩增采用带荧光标记的引物),并用链霉亲和素微球从第二次pcr产物中分离得到fitc标记的单链dna序列作为本轮正筛产物。
(3)从步骤(2)筛选后得到的筛选产物中分离获得特异性结合cd3的核酸适配体。
在所述方法的步骤(2)的正筛中,第2-15轮筛选中利用所述上清液2进行pcr扩增并获得本轮正筛产物的步骤具体包括如下步骤:
(4-1)以所述上清液2作为模板,采用无标记的引物进行pcr扩增,得到第一次pcr产物;以所述第一次pcr产物作为模板,采用带标记的引物进 行pcr扩增,得到第二次pcr产物;上述两次pcr扩增时使用的上游引物fp和下游引物rp分别为:
所述上游引物fp的核苷酸序列为:5’-tctcggacgcgtgtggtcgg-3’,其中第一次pcr扩增时使用的该引物不带标记,第二次pcr扩增时5’端经fitc标记;
所述下游引物rp的核苷酸序列为:5’-cactctagggccaggcagcgag-3’,其中第一次pcr扩增时使用的该引物不带标记,第二次pcr扩增时5’端经生物素标记。
(4-2)利用生物素与链霉亲合素之间的亲和力,从所述第二次pcr产物中分离获得fitc标记的单链dna序列。
上述方法中,可每一轮筛选逐步增加筛选压力,以增进所述核酸适配体的富集程度。所述增加筛选压力可通过以下方式实现:减少核酸文库的物质的量,减少正筛时293t-cd3细胞用量及核酸文库与正筛细胞的孵育时间,增加反筛时293t细胞用量及核酸文库与反筛细胞的孵育时间。例如,每一轮筛选中线性减少核酸文库的物质的量,线性减少正筛时所述293t-cd3细胞的用量,线性减少所述核酸文库与所述293t-cd3细胞的孵育时间,以及相应线性增加所述293t细胞的用量,线性增加所述核酸文库与所述293t细胞的孵育时间。此外,还可以增加筛选过程中洗涤次数和洗涤缓冲液的用量。
在本发明优选实施例中,与本发明核酸适配体特异性结合的cd3为序列表中序列3所示的蛋白质。
本发明以稳定表达cd3分子的293t-cd3细胞为正筛靶标,以不表达cd3分子的293t细胞为反筛靶标,经体外筛选技术,获得具有特异结合293t-cd3的核酸适配体序列,以该序列与cd3分子结合的基础,进一步用于靶向t细胞的药物设计、制备药物或其他制品;该序列可作为靶向t细胞的分子探针。本发明为t细胞的活化及肿瘤的靶向诊断与治疗提供新思路与新工具,具有重要的临床价值。
附图说明
下面将结合附图及实施例对本发明作进一步说明,附图中:
图1为根据本发明优选实施例的特异性结合cd3的核酸适配体的筛选cell-selex技术流程图;
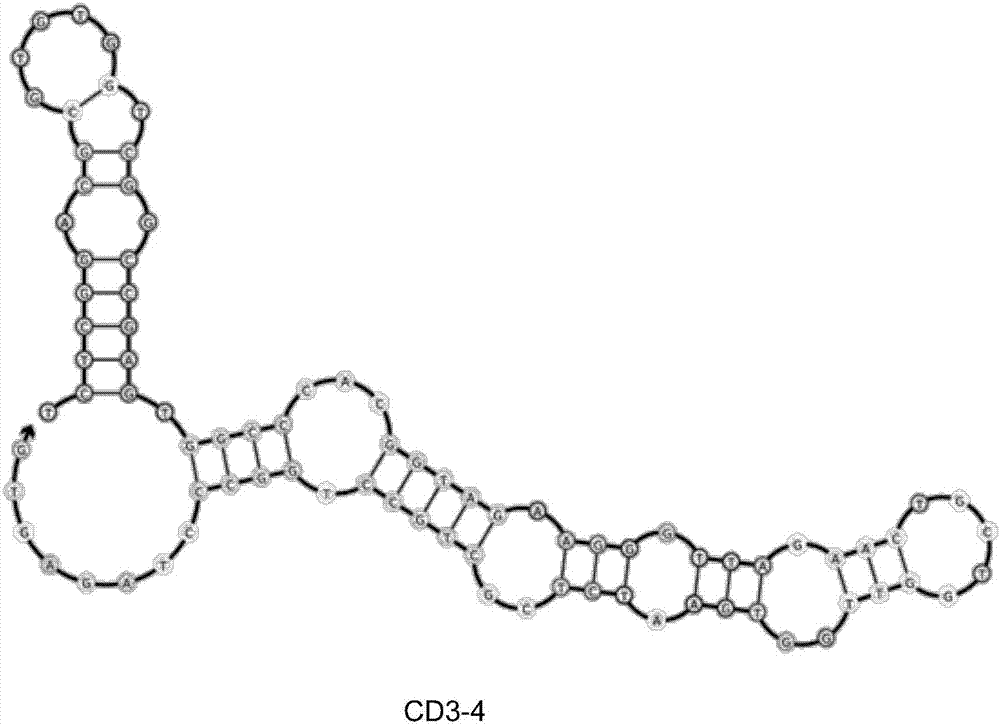
图2为根据本发明优选实施例的特异性结合cd3的核酸适配体(cd3-4)二级结构模拟图;
图3a和3b为根据本发明优选实施例的特异性结合cd3的核酸适配体(cd3-4)分别与293t-cd3细胞及293t细胞结合情况的流式结果;
图4为根据本发明优选实施例的特异性结合cd3的核酸适配体(cd3-4)平衡解离常数(kd值)测定结果图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、特异性结合cd3的核酸适配体的筛选及克隆
一、随机核酸文库的设计与合成
设计合成两端包括若干个固定核苷酸、中间包括45个核苷酸的随机文库如下:
5’-tctcggacgcgtgtggtcgg-n45-ctcgctgcctggccctagagtg-3’,其中n45表示45个连续的随机核苷酸,即n为a、t、c或g。
二、核酸适配体的筛选
1、文库预处理
将步骤一设计合成的随机核酸文库粉末5od使用500μl结合缓冲液(配方:pbs中含有4.5g/l葡萄糖,5mm氯化镁,2mg/mlbsa及0.2mg/ml酵母trna)溶解,均匀混合并加热至95~100℃变性5min,之后立即置于冰上冷却十分钟,使其形成较为稳定的二级结构,再加入500μl~1ml结合缓冲 液(配方见上文)补足筛选所需的1ml体积,得到起始核酸文库的溶液。
2、反筛和正筛
采用cell-selex技术对起始核酸文库进行多轮筛选,其中采用293t细胞进行反筛和采用293t-cd3细胞进行正筛,筛选出特异性结合cd3的核酸适配体。在本发明的优选实施例中,针对在cd3分子在传统的筛选方法的基础上进行了优化。具体地,对预处理后的随机核酸文库进行15轮筛选,其中第1-2轮仅进行正筛,第3-15轮中顺次完成一次反筛和一次正筛为一轮筛选。本发明选择前两轮只进行正筛,是为了使特异性结合的核酸序列富集到一定程度,随后再进行反筛操作,去除非特异性结合的核酸序列。本发明中特异性结合cd3的核酸适配体的筛选cell-selex技术流程图具体如图1所示。
(1)反筛
自第三轮筛选开始,在每轮正筛之前进行反筛操作。向单层生长的293t细胞培养皿中加入上轮正筛产物,将细胞培养皿置于0~5℃震荡孵育30~60min后取出培养皿,收集上清液,并标记为上清液1,作为本轮反筛产物。随后进行正筛操作。前述293t细胞购自美国模式培养物集存库(atcc),编号为
(2)正筛
将起始核酸文库或者本轮反筛产物加入单层生长的293t-cd3细胞中,0~5℃震荡孵育1-2h,用洗涤缓冲液(配方:pbs中含有4.5g/l葡萄糖,5mm氯化镁)洗涤293t-cd3细胞后弃去上清;用细胞刮刀刮下细胞并收集至ep管之中,95~100℃变性5-10min,14000rpm离心5min;保留上清液,记为上清液2。所述293t-cd3细胞为稳定表达cd3的293t细胞。在本实施例中优选采用本实验室构建的过表达目的基因cd3epsilon(ncbiaccessionno.:nm_000733.3)的293t稳定细胞株。以所述上清液2作为模板进行2次pcr扩增,并用链霉亲和素微球从第二次pcr产物中分离得到fitc标记的单链dna序列作为本轮正筛产物。除第1轮筛选的2次pcr扩增均用无标记的引物外,第2-15轮筛选的第一次pcr扩增采用无标记的引物,第二次pcr扩增采用带荧光标记的引物。因此,从第2轮筛选开始,可以测定上清液的荧光 强度(除第1轮筛选没有进行荧光标记外,自第2轮之后的产物均是用带荧光标记的引物进行pcr得到,即产物均带荧光标记)。
具体地,第2-15轮筛选时以所得上清液2为模板进行2次pcr扩增的引物序列为:
fp:5’-tctcggacgcgtgtggtcgg-3’;其中第一次pcr扩增时使用的该引物不带标记,第二次pcr扩增时5’端经fitc标记;
rp:5’-cactctagggccaggcagcgag-3’,其中第一次pcr扩增时使用的该引物不带标记,第二次pcr扩增时5’端经生物素标记。第一轮筛选中2次pcr扩增则均采用上述不带标记的fp和rp。
下面对本发明中正筛时2次pcr扩增的具体过程进行描述:
配制第一次pcr体系(总体积1500μl):10×pcrbuffer150μl,dntpmixture120μl,fp37.5μl,rp37.5μl,模板(上清液)1000μl,rtaq5μl。
按如下条件在pcr仪上进行扩增:94℃预变性5min;94℃变性30sec,53℃退火30sec,72℃延伸30sec,共计10个循环;72℃延伸5min,最后永久保温在4℃环境当中。
配制第二次pcr体系(总体积2000μl):10×pcrbuffer200μl,dntpmixture160μl,fp50μl,rp50μl,模板(第一次pcr产物)200μl,rtaq10μl。
按如下条件在pcr仪上进行扩增:94℃预变性5min;94℃变性30sec,53℃退火30sec,72℃延伸30sec,共计10个循环(该循环数是经过优化后确定的);72℃延伸5min,最后永久保温在4℃环境当中。
用链霉亲和素微球从第二次pcr产物中分离得到fitc标记的单链dna(ssdna)序列(用链霉亲和素球可以除去biotin标记的互补链,从而得到fitc标记的目标链,即2-15轮富集的随机核苷酸文库)。具体为:取50μl链霉亲和素微球,使用100μlpbs清洗3次。将洗好的微球加入到2ml第二次pcr产物中,37℃摇床震荡30min,之后短暂离心,收集上清,上清中即含有fitc标记的ssdna。将得到的ssdna加入浓度为0.2mnaoh溶液用nap-5柱子(通用电气医疗集团,瑞典)脱盐,收集后真空干燥,用于下一轮的筛选。
为了提高核酸适配体的亲和力和特异性,在筛选过程中每一轮筛选逐步增加筛选压力。所述增加筛选压力可通过以下一种或多种方式实现:减少核酸文库的物质的量,减少正筛时293t-cd3细胞用量,减少正筛时核酸文库孵育时间,增加反筛时293t细胞用量,增加反筛时核酸文库孵育时间。
在本发明的一些优选实施例中,可以线性减少核酸文库的物质的量,和/或线性减少正筛时所述293t-cd3细胞的用量,和/或线性减少所述核酸文库与所述293t-cd3细胞的孵育时间,和/或相应线性增加所述293t细胞的用量,和/或线性增加所述核酸文库与所述293t细胞的孵育时间。此外,还可以逐步增加筛选过程中正筛的洗涤次数和洗涤缓冲液的用量。
在本发明的前述实施例1中,也可以同时采用以下方式增加筛选压力:
1)自第1轮筛选开始,逐步减少核酸文库的用量,到第10轮减至200pmol时,维持该用量,直至筛选结束。
2)正筛细胞293t-cd3用量自第5轮筛选开始,由直径为10cm的培养皿减至直径为6cm的培养皿进行筛选;反筛细胞293t用量自第5轮开始,由直径为6cm的培养皿增至直径为10cm的培养皿进行筛选。
3)正筛细胞293t-cd3与核酸文库孵育时间自第1轮至第7轮筛选,由60min逐步线性减至30min;反筛细胞293t-cd3与核酸文库孵育时间自第1轮至第7轮筛选,由30min逐步线性增至60min。
4)如第1轮筛选在正筛时洗涤孵育后的核酸文库与293t-cd3细胞的洗涤次数为1次,洗涤缓冲液的用量为2ml;直至第6-15轮筛选,该洗涤次数增至3次,洗涤缓冲液的用量增至5ml。本申请经过大量的实验与经验总结,通过上述对筛选程序以及筛选压力的优化,成功筛选出了后续证明与cd3分子亲和力非常高的核酸适配体。
3、特异性结合cd3的核酸适配体的获得
经15轮筛选后,以筛选产物为模板通过引物(5’-tctcggacgcgtgtggtcgg-3’和5’-cactctagggccaggcagcgag-3’)进行pcr扩增,将pcr产物进行克隆ta克隆,随机挑取100个克隆进行测序。
将所有100条测序结果进行汇总,对其一级结构与二级结构进行考察,选 择具有最高富集程度以及二级结构有所差异的5条核酸适配体序列进行了验证与考察,并选取其中与cd3结合时亲和力最高的核酸适配体命名为cd3-4。该特异性结合cd3的核酸适配体cd3-4的二级结构模拟图见图2。
本发明获得的特异性结合cd3的核酸适配体cd3-4的核苷酸序列如下:
5’-tctcggacgcgtgtggtcggccgagtggcccacggtagaagggttagaactgctggttggtgaatctcgctgcctggccctagagtg-3’(即序列1)。该核酸适配体cd3-4为单链dna,由87个核苷酸组成,拓扑学结构为直链状;预测的二极结构具有突出的环和茎。
本发明实施例中所采用的293t-cd3细胞中插入的序列为序列表中序列2所示:
atgcagtcgggcactcactggagagttctgggcctctgcctcttatcagttggcgtttgggggcaagatggtaatgaagaaatgggtggtattacacagacaccatataaagtctccatctctggaaccacagtaatattgacatgccctcagtatcctggatctgaaatactatggcaacacaatgataaaaacataggcggtgatgaggatgataaaaacataggcagtgatgaggatcacctgtcactgaaggaattttcagaattggagcaaagtggttattatgtctgctaccccagaggaagcaaaccagaagatgcgaacttttatctctacctgagggcaagagtgtgtgagaactgcatggagatggatgtgatgtcggtggccacaattgtcatagtggacatctgcatcactgggggcttgctgctgctggtttactactggagcaagaatagaaaggccaaggccaagcctgtgacacgaggagcgggtgctggcggcaggcaaaggggacaaaacaaggagaggccaccacctgttcccaacccagactatgagcccatccggaaaggccagcgggacctgtattctggcctgaatcagagacgcatctga
相应地,本发明中针对的cd3分子具体为序列表中序列3所示的蛋白质。该序列3为:
mqsgthwrvlglcllsvgvwgqdgneemggitqtpykvsisgttviltcpqypgseilwq60
hndkniggdeddknigsdedhlslkefseleqsgyyvcyp rgskpedanfylylrarvce120
ncmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerp180
ppvpnpdyepirkgqrdlys200
4、特异性结合cd3的核酸适配体结合能力的测定
将本发明中人工合成的特异性结合cd3的核酸适配体(cd3-4)的3’或5’末端标记上荧光报告基团fitc,分别用洗涤缓冲液溶解制成250nm浓度工作液,再分别与1×106个t细胞0~5℃孵育30~50min,用500μl洗涤缓冲液充分洗涤2~3次,每次均使用1000rpm离心3min。细胞沉淀用500μl磷酸盐缓冲液重悬后,用流式细胞仪检测,计数细胞数量10000个。
图3a和图3b分别为本发明的特异性结合cd3的核酸适配体(cd3-4)分别与293t-cd3细胞及293t细胞结合情况的流式结果。结果显示,该特异性结合cd3的核酸适配体(cd3-4)能较好地特异性结合于293t-cd3细胞,而不与293t细胞结合,证实了该适配体序列对cd3分子具有较好的靶向性及较强的结合能力。
实施例1筛选获得的特异性结合cd3的核酸适配体结合能力考察
对实施例1获得的特异性结合cd3的核酸适配体(cd3-4)进行结合能力的考察。具体操作如下:
将人工合成的特异性结合cd3的核酸适配体(cd3-4)的3’或5’末端标记上荧光报告基团fitc,然后用洗涤缓冲液(配方见上文)溶解,分别制备成0nm、10nm、20nm、50nm、100nm、200nm浓度工作液。取上述各个浓度的dna文库溶液分别与1×105个293t-cd3细胞在冰上震荡孵育30min。用500μl洗涤缓冲液(配方见上文)充分洗涤2-3次,每次均使用1000rpm离心3min。使用结合缓冲液(配方见上文)对细胞沉淀进行重悬,之后进行流式细胞仪上机检测,计数细胞数量10000个。
所得的结果使用sigmaplot软件分析,遵循单点吸附模型公式进行非线性拟合,计算特异性结合cd3的核酸适配体(cd3-4)与293t-cd3细胞的平衡 解离常数(kd值),1/kd即可表示核酸适配体cd3-4与cd3分子的亲和力大小。具体公式如下:y=bmaxx/(kd+x))。
结果显示,该特异性结合cd3的核酸适配体(cd3-4)与293t-cd3细胞的kd值仅为18.56±1.49nm,说明该特异性结合cd3的核酸适配体(cd3-4)与cd3分子具有很强的亲和力。具体结构参见图4。
综上所述,本发明以t细胞表面表达的cd3分子为靶标进行适配体筛选,获得的核酸适配体能特异性地结合t细胞,为t细胞的活化和肿瘤靶向治疗提供了新思路,具有重要的临床价值。
本发明是根据特定实施例进行描述的,但本领域的技术人员应明白在不脱离本发明范围时,可进行各种变化和等同替换。此外,为适应本发明技术的特定场合或材料,可对本发明进行诸多修改而不脱离其保护范围。因此,本发明并不限于在此公开的特定实施例,而包括所有落入到权利要求保护范围的实施例。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法
- 一种基于短链核酸探针和双链特异性核酸内切酶的高特异性microRNA荧光检测方法与流程
- IL‑1‑α和‑β双特异性双重可变结构域免疫球蛋白及其用途的制造方法与工艺
- 一种特异性标记家蚕微孢子虫的核酸探针及其原位荧光杂交检测方法与流程
- 核酸的等位基因特异性扩增的制造方法与工艺
- 一种特异性检测弓形虫核酸的荧光PCR方法和试剂盒与流程
- 一种特异性检测人类微小病毒B19核酸的荧光PCR方法和试剂盒与流程
- 一种特异性结合新城疫病毒的核酸适配体及其筛选方法和应用与流程
- 球形核酸纳米颗粒缀合物的序列特异性细胞摄取的制造方法与工艺
- 一种鸭特异性CpG寡脱氧核苷酸及其应用的制造方法与工艺
- 一种IgE特异性核酸适配子、其应用及适配子药物的制造方法与工艺
- 核酸的等位基因特异性扩增的制造方法与工艺
- 一种特异性检测弓形虫核酸的荧光PCR方法和试剂盒与流程
- 一种特异性检测人类微小病毒B19核酸的荧光PCR方法和试剂盒与流程
- 一种特异性结合新城疫病毒的核酸适配体及其筛选方法和应用与流程
- 球形核酸纳米颗粒缀合物的序列特异性细胞摄取的制造方法与工艺
- 一种IgE特异性核酸适配子、其应用及适配子药物的制造方法与工艺
- 基于核酸适配体特异性检测磺胺嘧啶的生物传感探针试剂盒及其应用的制造方法与工艺
- 一种特异性结合CD3的核酸适配体及其筛选方法和应用与流程
- 一种特异性结合GPC3的核酸适配体及其应用的制造方法与工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 一组特异性结合结核分枝杆菌的核酸适配体及其应用