肿瘤标志物LIMK1及其应用的制作方法
本发明涉及肿瘤标志物LIMK1及其应用,更具体的涉及LIMK1基因及其表达产物在诊治骨肉瘤中的应用。本发明通过荧光定量PCR技术检测骨肉瘤细胞及患者组织,显示LIMK1基因过表达。进一步,设计多组siRNA,沉默LIMK1基因表达。本发明一方面为研究骨肉瘤提供新思路,另一方面为在基因水平诊治骨肉瘤提供了潜在的新靶点。
背景技术:
骨肉瘤是一种临床常见的成骨性恶性肿瘤,约占所有骨肿瘤的20%。其恶性程度高,好发于青少年,易复发和转移,预后较差。随着分子生物学理论和技术水平的提高,尤其是肿瘤分子生物学的发展,骨肉瘤的发生机制在分子水平有了一定的认识。骨肉瘤中e-myc、e-ras、e-fos等癌基因以及p53、Rb、pl6等抑癌基因的异常表达,为骨肉瘤的基因治疗提供了靶向基因选择的理论基础。而基因治疗要想取得突破性的进展,有赖于发现更多更有效的靶点,寻找更具有针对性的新的目的基因。近年来,有关骨肉瘤基因治疗的研究在基因治疗方法、基因载体、载体导入途径和靶向调控等方面取得了一些进展,基因治疗有望成为一种治疗骨肉瘤较理想的方法。
LIM激酶(LIMK)是LIM蛋白家族成员之一,是细胞骨架动力学的重要调节元素。主要作用是参与细胞骨架的重组,具有广泛的生物学效应。
迄今为止,在哺乳动物中已发现两种LIM激酶,LIMK1和LIMK2,它们的氨基酸序列有50%的同源性。在结构上它们都是由两个N末端的LIM结构域与C末端的激酶结构域连接而成。LIMK1穿梭于细胞质与细胞核之间,它在细胞核中的作用尚不清楚,细胞质中的LIMK1主要是在含肌动蛋白的细胞骨架的组装中起作用。LIMK1可以使底物cofilin磷酸化,从而逆转cofilin诱导的肌动蛋白解聚。肌动蛋白细胞骨架的动力机制在肿瘤发生中的作用不容置疑,因而LIMK1作为肌动蛋白细胞骨架的重要上游调控子在癌症防治中的意义值得探讨。
近年来,LIMK1作为肿瘤新的研究热点正受到广泛的关注,有研究报告证明LIMK1在前列腺癌、乳癌等恶性肿瘤的细胞及组织中过表达、活性增强,相关研究发现前列腺癌中与转移相关的染色体基因位点在7ql1.2,而人类LIMK1基因定位在7ql1.23,提示两者具有相关性;但并没有揭示其与骨肉瘤的相关性。
在研究LIMK1介导的信号通路逆转肿瘤侵袭的过程中,通过RT-PCR检测等实验证实了人成骨肉瘤细胞及组织中LIMK1基因过表达;有效沉默LIMK1基因表达,能明显降低骨肉瘤细胞的侵袭能力。本发明提供了一种针对骨肉瘤的诊治靶点,具有重要的临床应用意义。
技术实现要素:
本发明的目的在于提供一种骨肉瘤诊断制剂,所述骨肉瘤诊断制剂通过检测LIMK1基因和/或LIMK1基因表达产物的表达量,可以判断受试者是否患有骨肉瘤。
本发明所述LIMK1诊断制剂采用荧光定量PCR试剂盒、免疫方法检测骨肉瘤组织或细胞中LIMK1基因的表达和/或LIMK1基因表达产物的表达量。所述的荧光定量PCR试剂盒中含有一对特异性扩增LIMK1基因的引物。扩增LIMK1基因的正向引物序列为SEQ ID NO.1,反向引物序列为SEQ ID NO.2;管家基因优选GAPDH,扩增该基因的正向引物序列为SEQ ID NO.3,反向引物序列为SEQ ID NO.4。
进一步,该RCR试剂盒适合于目前存在市场上的所有类型荧光定量基因扩增仪,灵敏度高,定量快速准确、稳定性好,具有良好的应用前景。
进一步,所述荧光定量PCR试剂盒组分包括:特异性引物、内参引物、荧光定量PCR反应液。
所述试剂盒还包含RNA抽提试剂。优选TRIZOLRReagent进行RNA样本提取。
进一步,应用免疫方法检测骨肉瘤细胞和/或组织中LIMK1基因的表达产物。所述免疫检测方法检测骨肉瘤中LIMK1蛋白表达为免疫沉降/免疫印迹技术和/或ELISA和/或胶体金检测方法。优选的,所述免疫方法为蛋白免疫沉淀和免疫印迹技术。所述免疫技术中的抗体可采用市售的LIMK1单克隆抗体。
本发明的目的是提供了一种骨肉瘤检测试剂盒,所述的检测试剂盒检测LIMK1蛋白,进一步,所述试剂盒还包括其他试剂。
本发明的目的在于提供一种治疗骨肉瘤的制剂,所述制剂中含有抑制LIMK1基因的转录或表达的试剂或化合物。
进一步,所述治疗骨肉瘤的制剂中含有激活LIMK1的抑制基因、激活抑制LIMK1表达的蛋白、导入抑制LIMK1转录或表达的siRNA、激活促进LIMK1mRNA降解的microRNA。优选的,所述治疗骨肉瘤的制剂含有抑制LIMK1基因转录或表达的siRNA。
优选的,针对抑制LIMK1基因的转录或表达的siRNA选自下列一组或几组siRNA:SEQ ID NO.5和SEQ ID NO.6、SEQ ID NO.7和SEQ ID NO.8、SEQ ID NO.9和SEQ ID NO.10。更优选的,所述治疗骨肉瘤的制剂含有siRNA序列为SEQ ID NO.9和SEQ ID NO.10。
RNA干涉(RNAi)是1998年发现的沉默基因表达的新技术。RNAi是指由短双链RNA诱导的同源RNA的降解。如果被降解的是细胞内的mRNA,可以抑制相应的基因表达,使细胞出现特定基因缺失表型;如果被降解的是病毒RNA,可以抑制病毒的复制。RNAi是一种广泛的体外基因失活的适用方法,是研究基因功能公认的一种有效工具,可以用于药物靶点筛选,并可能产生基于RNAi的治疗手段,用于治疗肿瘤、病毒感染等疾病。siRNA设计完成后可以采用直接合成法或者构建siRNA表达载体,制备好的siRNA可以通过硫酸钙共沉淀法、电穿孔法、显微注射或基因枪等机械法、阳离子脂质体试剂法等途径转染细胞。
本发明的目的在于提供上述治疗骨肉瘤的制剂在制备骨肉瘤治疗药物或试剂中的应用。
为了实现上述目的,本发明通过分子细胞生物学方法验证了LIMK1基因与骨肉瘤的关系:LIMK1在骨肉瘤细胞及组织中过表达,与骨肉瘤具有很好的相关性,可用于制备骨肉瘤治疗制剂,具有重要的临床应用价值。
本发明的目的在于提供一种骨肉瘤抑制试剂,所述骨肉瘤抑制剂抑制LIMK1基因的表达,进一步,所述的骨肉瘤抑制试剂中含有抑制LIMK1基因表达的siRNA。
本发明的优点和有益效果在于:
(1)本发明首次公开了LIMK1基因表达与骨肉瘤相关,LIMK1基因有望成为诊断骨肉瘤的分子标志物,并为研究骨肉瘤发生、发展的分子机理提供新的思路。
(2)应用siRNA技术可以有效沉默LIMK1基因表达,能明显降低骨肉瘤细胞的侵袭能力。本发明提供了一种针对骨肉瘤的分子水平的治疗靶点,具有重要的临床应用意义。
附图说明
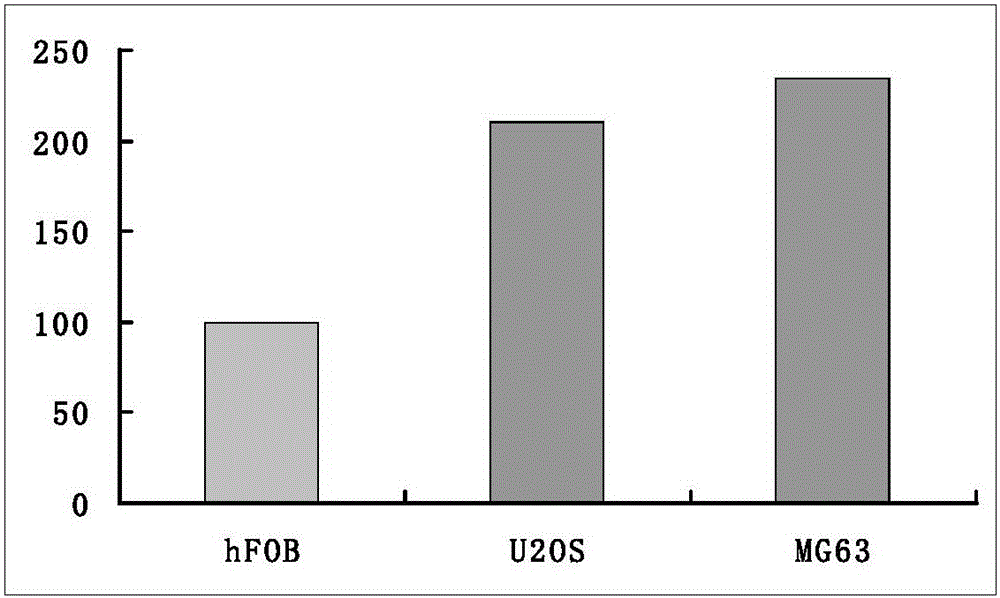
图1是LIMK1在骨肉瘤细胞(U2OS、MG63)及人成骨细胞(hFOB)中的相对表达量图。
图2是LIMK1在骨肉瘤组织及癌旁组织中的相对表达量图。
图3是RNA干扰后各组LIMK1mRNA相对表达水平图;C1组,空白对照组;C2组,转染脂质体组;C3组,转染空载体组;S1,S2,S3组:转染特异性siRNA组。
图4是Boyden小室检测人成骨肉瘤细胞的侵袭能力激光共聚焦观测结果图。
具体实施方式
实施例1:验证LIMK1在骨肉瘤细胞中的表达
为了验证LIMK1在骨肉瘤细胞的表达及特性,常规培养了2种人成骨肉瘤细胞,收集各组细胞样本,同时收集人成骨细胞hFOB细胞样本做为对照组,采用荧光实时定量PCR(qRT-PCR)进行验证,具体操作步骤如下所示:
(1)、RNA提取
①取培养至对数生长期的肿瘤细胞,用预冷的PBS清洗3次。每瓶加入1ml Trizol裂解细胞,冰上水平摇晃5min。用5ml枪将其移至EP管后再用1ml枪头反复抽吸,使细胞完全分散悬浮于Trizol。
②加1/5体积的氯仿(0.2ml),用力振荡离心管,充分混匀,室温下放置5min-10min;
③12000rpm高速离心15min后吸取上层水相(吸70%)到另一新离心管中,注意不要吸到两层水相之间的蛋白物质。移入新管后加入等体积的-20℃预冷异丙醇,充分颠倒混匀,置于冰上10min;
④12000rpm高速离心15min后小心弃掉上清液,加入等体积的75%DEPC乙醇洗涤沉淀(4℃保存);
⑤弃去乙醇液体,室温下放置5min以充分晾干沉淀,加入DEPC处理过的水溶解沉淀;
⑥用Nanodrop2000紫外分光光度计测量RNA纯度及浓度,冻存于-70℃。
(2)、逆转录
用逆转录缓冲液对1μg总RNA进行逆转录合成cDNA。采用20μl反应体系,每个样品取1μg总RNA作为模板RNA,在PCR管中分别加入以下组分:DEPC水,5×逆转录缓冲液,10mmol/L dNTP,0.1mmol/l DTT,30μmmol/l Oligo dT,200U/μl M-MLV RT,模板RNA。42℃孵育1h,72℃10min,短暂离心。
(3)、QPCR扩增检验
采用20μl反应体系,每个样本设置3个平行管,各项操作均于冰上进行,所有扩增反应均重复三次以上以保证结果的可靠性。配制反应体系见表2:
表2荧光实时定量PCR反应体系
扩增引物为:
LIMK1基因扩增引物:
上游引物:5'-TGGACTTTGGCCTCAACGTG-3'(SEQ ID NO.1)
下游引物:5'-CCAGCCAGTGTTCCAGCTTC-3'(SEQ ID NO.2)
内参GAPDH基因扩增引物:
上游引物:5'-GCACCGTCAAGGCTGAGAAC-3'(SEQ ID NO.3)
下游引物:5'-TGGTGAAGACGCCAGTGGA-3'(SEQ ID NO.4)
扩增程序为:95℃30s,(95℃5s;60℃30s)*40个循环,95℃15s,60℃30s,95℃15s。反应结束后分析其扩增曲线和融解曲线,并进行后续PCR定量分析。以管家基因GAPDH为内参,以2-△△Ct法计算目的基因表达量差异。每组设置3个复孔,重复三次实验,计算平均值。
如图1所示为以骨肉瘤细胞U2OS及MG63中LIMK1基因表达结果:qRT-PCR扩增结果稳定,其中LIMK1基因在骨肉瘤U2OS及MG63细胞中高表达分别是成骨细胞hFOB的2.1倍和2.34倍。
实施例2:验证LIMK1基因骨肉瘤组织的表达
本发明收集了6个骨肉瘤组织样本,同时收集了6个癌旁正常组织样本,采用荧光实时定量PCR(qRT-PCR)验证LIMK1基因在骨肉瘤组织中的表达,具体操作步骤如下:
(1、)RNA提取
①收集肿瘤组织后冻存于液氮,取出后把组织放入已预冷的研钵中进行研磨,待组织样本成粉末状后加入Trizol,室温放置5min;
②加1/5体积的氯仿(0.2ml),用力振荡离心管,充分混匀,室温下放置5min-10min;
③12000rpm高速离心15min后吸取上层水相(吸70%)到另一新离心管中,注意不要吸到两层水相之间的蛋白物质。移入新管后加入等体积的-20℃预冷异丙醇,充分颠倒混匀,置于冰上10min;
④12000rpm高速离心15min后小心弃掉上清液,加入等体积的75%DEPC乙醇洗涤沉淀(4℃保存);
⑤弃去乙醇液体,室温下放置5min以充分晾干沉淀,加入DEPC处理过的水溶解沉淀;
⑥用Nanodrop2000紫外分光光度计测量RNA纯度及浓度,冻存于-70℃。
(2)、逆转录
用逆转录缓冲液对1μg总RNA进行逆转录合成cDNA。采用20μl反应体系,每个样品取1μg总RNA作为模板RNA,在PCR管中分别加入以下组分:DEPC水,5×逆转录缓冲液,10mmol/L dNTP,0.1mmol/l DTT,30μmmol/l Oligo dT,200U/μl M-MLV RT,模板RNA。42℃孵育1h,72℃10min,短暂离心。
(3)、QPCR扩增检验
采用20μl反应体系,每个样本设置3个平行管,各项操作均于冰上进行,所有扩增反应均重复三次以上以保证结果的可靠性。配制反应体系见表2:
扩增引物为:
LIMK1基因扩增引物:
上游引物:5'-TGGACTTTGGCCTCAACGTG-3'(SEQ ID NO.1)
下游引物:5'-CCAGCCAGTGTTCCAGCTTC-3'(SEQ ID NO.2)
内参GAPDH基因扩增引物:
上游引物:5'-GCACCGTCAAGGCTGAGAAC-3'(SEQ ID NO.3)
下游引物:5'-TGGTGAAGACGCCAGTGGA-3'(SEQ ID NO.4)
扩增程序为:95℃30s,(95℃5s;60℃30s)*40个循环,95℃15s,60℃30s,95℃15s。
反应结束后分析其扩增曲线和融解曲线,并进行后续PCR定量分析。以管家基因GAPDH为内参,以2-△△Ct法计算目的基因表达量差异。每组设置3个复孔,重复三次实验,计算平均值。
如图2所示为骨肉瘤组织中LIMK1基因表达的结果:qRT-PCR扩增结果稳定,LIMK1基因在骨肉瘤组织中高表达是正常癌旁组织的2.5倍。与体外细胞学实验结果一致。
本发明通过细胞学及组织学验证LIMK1基因在骨肉瘤中过表达,说明LIMK1与骨肉瘤具有很好的相关性。本发明为骨肉瘤的诊断提供了新的靶标,具有很好的临床应用前景。
实施例3 RNAi抑制LIMK1基因表达
1.siRNA构建与合成
siRNA表达载体pSUPER含氨苄青霉素抗性基因。依据NCBI数据库中LIMK1的mRNA全序列Homo sapiens LIM domain kinase 1(LIMK1)(NM_002314.2),根据siRNA设计原则,设计并合成了3对LIMK1的SiRNA的寡聚脱氧核苷酸链(oligo)(LY1、LY2、LY3)(Invitrogen),经BLAST Search检索确认与LIMK1以外的人类已知基因序列无同源性。从5’端到3’端依次为BglⅡ酶切位点,由19个碱基组成的靶序列,茎环结构,能与靶序列结合的互补序列,转录终止子,Hind III酶切位点等六个区域(BglⅡ+Sense+Loop+Antisense+终止信号+Hind III)。同时以pSUPER空载体作为阴性对照。寡聚脱氧核苷酸链(oligo)序列如下:
将合成的正向和反向片段溶解于灭菌水中混合进行退火反应。退火后形成的双链DNA与经BglⅡ和Hind III酶切并回收纯化后的pSUPER质粒连接过夜。连接产物转化DH5α大肠杆菌,在LB Amp培养基上涂板,37℃培养过夜。
PCR鉴定、测序鉴定。提取阳性克隆载体并定量。
2.细胞分组及转染
(1)细胞分组
MG63细胞常规培养,C1组:空白对照组;C2组:转染脂质体组;C3组:转染非特异性的siRNA组;S1,S2,S3组,转染特异性的siRNA组。
(2)转染
按LipofectamineTM2000Transfection Reagent试剂说明书提供的步骤进行。
①转染前一日,胰酶消化收集培养的MG63细胞,使其在转染之日密度达95%,10%胎牛血清的H-DMEM培养;
②转染前,每孔8.0μg质粒DNA稀释到500μl Opti-MEM中;
③500μl Opti-MEM稀释20μl Lipofectamine 2000试剂,稀释后室温放置5min;
④将稀释的质粒DNA和Lipofectamine 2000混合,在室温放置20分钟形成转染复合物;
⑤用PBS轻柔洗三遍贴壁细胞后,加入5ml Opti-MEM
⑥每孔加入1ml转染复合物。4小时之后换10%胎牛血清的H-DMEM中,继续在CO2培养箱中37℃培养24-48h。
3.荧光定量PCR实验检测转染后LIMK1基因表达的变化
提取各组细胞的RNA,测定RNA浓度和纯度,进行逆转录反应,每组DNA模板LIMK1和GAPDH,反应同时进行,实验重复三次。
4.实验结果
如图3所示为各组细胞中LIMK1基因表达的结果:qRT-PCR扩增结果稳定,空白对照组、脂质体转染组、非特异性转染组LIMK1基因的表达基本相似,siRNA1,siRNA2抑制LIMK1基因表达的作用不明显,siRAN3抑制LIMK1基因表达的作用明显,抑制率达到75%。
实施例4 RNA干扰LIMK1基因表达及对骨肉瘤侵袭的影响
2.Boyden小室检测人成骨肉瘤细胞的侵袭能力
(1)pSUPER-LIMK1质粒转染:方法同实施例3(所选质粒为C2及S3组)
(2)条件培养液的制备:H-DMEM(含10%胎牛血清)培养NIH/3T3细胞至细胞汇合,用无血清的培养基洗3次。然后加入新鲜无血清培养基,37℃,5%CO2培养箱培养24~48h。收集培养上清液过滤,即为含趋化因子的条件培养基。
(3)取Matrigel胶,用无血清培养基按1:3比例稀释混匀,以80μl/孔加至Boyden小室的上室聚碳酸酯膜上(整个操作在冰上及无菌条件下进行,所有器皿及试管均事先预冷)。37℃下聚合30分钟。
(4)0.25%胰酶消化收集各组细胞,PBS洗一次,加入1mg/ml罗丹明0.5ml,室温下孵育5分钟,1,000rpm,离心5min。PBS洗后,无血清的培养基调节细胞浓度为2×106/ml。24孔板内加入NIH3T3条件培养液200μl/孔,将制备好的Boyden小室置于其内,上室加入100μl细胞悬液,于37℃,5%CO2条件下培养4小时。
(5)弃去上室中的培养液,并用生理盐水棉签轻轻檫去Matrigel胶,在激光共聚焦显微镜下观察,250×视野下任取5个不重复视野照相,并记数侵袭细胞数量。
(6)实验重复3次,每次至少6个复孔。统计学分析采用SPSSll.5软件包。计量资料均以±s表示,方差齐者采用one一wayANOVA分析,组间两两比较采用LSD法。方差不齐者采用K士uskal一WallisH非参数秩和检验;两组比较采用t检验。以p<0.05为差异具有显著性。
如图3所示为RNA干涉LIMK1基因表达对细胞侵袭影响的实验结果说明:Boydern小室细胞侵袭实验证实转染LIMK1-siRNA3质粒后,细胞迁移及侵袭能力显著下降(抑制率达到75%),同对照组相比较有显著差异。LIMK1对人成骨肉瘤细胞体外迁移及侵袭的影响,为进一步的骨肉瘤的基因治疗提供了新的药物靶点。
- 还没有人留言评论。精彩留言会获得点赞!
- 普适型用于同时检测多种肿瘤标志物的微流控芯片装置的制造方法
- 男性适用的典型肿瘤标志物联合检测用微流控芯片装置的制造方法
- 女性适用的典型肿瘤标志物联合检测用微流控芯片装置的制造方法
- 一种检测口腔癌的标志物及其试剂盒的制造方法与工艺
- microRNA 标志物组及其在制备检测胃癌淋巴结转移试剂盒中的应用的制造方法与工艺
- 基于弹性蛋白酶荧光底物检测乳腺癌肿瘤标志物CA153的酶联免疫试剂盒制备方法与制造工艺
- 检测和评价力量训练效果的miRNA标志物或其组合及其应用的制造方法与工艺
- 一种最优超平面的构建方法、动态优化系统和构建装置与制造工艺
- 癌症标志物及癌症的判定方法与制造工艺
- 检测尿液中单羟酚类代谢物的试剂盒及其制备方法与制造工艺