鉴别ISAV的双重实时荧光RT‑PCR方法及试剂盒与流程
本发明属于生物检查领域,具体涉及一种双重TaqMan实时荧光定量PCR鉴定传染性鲑鱼贫血病毒(ISAV)HPR0和HPRΔ型方法的建立及应用。
背景技术:
鲑鱼类,主要包括三文鱼(Salmon)、鳟鱼(Trout)和鲑鱼(Char)等,传染性鲑鱼贫血症病毒(Infectious salmon anaemia virus,ISAV)属于鲑传贫病毒属(Isavirus),正黏病毒科(Orthomyxoviridae),1986年首次被发现于挪威,随后在欧洲和美洲多国流行,感染后引起大西洋鲑鱼以严重贫血、出血为主要特征的致死性传染病。大西洋鲑鱼,主要指挪威三文鱼,传染性鲑鱼贫血症(Infectious salmon anaemia,ISA)的自然暴发多被记录发生在饲养大西洋鲑鱼中,但野生大西洋鲑鱼(Feral Atlantic salmon)、褐鲑鱼(Brown trout)、海鳟(Sea trout)、爱尔兰虹鳟鱼(Irish Rainbow trout)也可感染该病毒,我国目前尚未出现ISAV感染的报道,但ISAV存在大量潜在感染宿主,入侵其他鱼类栖息地,是不可忽视的隐患。
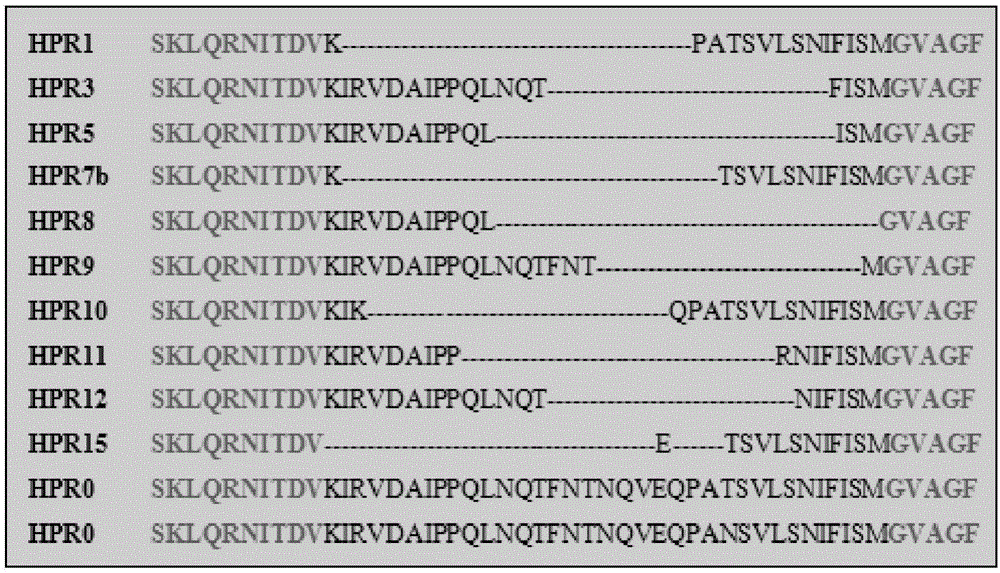
ISAV直径100-130nm,由8条负链RNA片段组成,编码10个蛋白。片段1、2、4编码病毒聚合酶亚基PB2、PB1及PA,片段3编码核蛋白(Nucleoprotein,NP);片段5、6编码融合蛋白(F)和血凝素酯酶蛋白(Haemagglutininesterase,HE);片段7(S7)和片段8(S8)各含两个重叠的ORF,S7的ORF1为非拼接片段,编码十分保守的非结构蛋白(Nonstructural protein,NS),ORF2为拼接片段,编码蛋白及其功能尚未明确;S8的ORF1编码基质蛋白(Matrix protein)、ORF2编码RNA结合结构蛋白(RNA-binding structural protein)。HE蛋白是ISAV的主要致病因子之一,具有受体结合和摧毁双重作用,ISA疾病主要由HE蛋白的高度多态性区域(Highly polymorphic region,HPR)337至372位跨膜氨基酸残基缺失株ISAV引起,该类毒株统称为ISAV-HPRΔ,而非缺失株无致病力或致病力低,称为ISAV-HPR0。ISAV-HPRΔ株有多种亚型,不同亚型在HPR的变异、缺失情况相差较大,而ISAV-HPR0株的HPR相对稳定,变异度较小。
到目前为止,还没有一种能快速鉴定ISAV是否致病的检测方法。
技术实现要素:
本发明目的是提供一种能快速鉴定ISAV是否致病的检测方法。
本发明的技术方案为:双重TaqMan实时荧光定量RT-PCR鉴定传染性鲑鱼贫血病毒的方法,以待鉴定样本的病毒RNA为模版,利用对应传染性鲑鱼贫血病毒HE基因的特异性引物对和探针HE-Probe,对应传染性鲑鱼贫血病毒NS基因的特异性引物对和探针NS-Probe,进行实时荧光定量PCR反应;
所述对应传染性鲑鱼贫血病毒HE基因的特异性引物对的上游引物HE-F序列如SEQ ID NO:1所示,下游引物HE-R序列如SEQ ID NO:2所示,探针HE-Probe的序列如SEQ ID NO:3所示,
SEQ ID NO:1:5’-AAACTTCAGAGGAACATCAC-3’,
SEQ ID NO:2:5’-CTGCTACACCCATAGAAAT-3’,
SEQ ID NO:3:5’-TGAACCAAACATTCAATACAAACCAAG-3’;
所述对应传染性鲑鱼贫血病毒NS基因的特异性引物对的上游引物NS-F序列如SEQ ID NO:4所示,下游引物NS-R序列如SEQ ID NO:5所示,探针NS-Probe序列如SEQ ID NO:6所示,
SEQ ID NO:4:5’-TTCATCTACGAGAAGCCT-3’,
SEQ ID NO:5:5’-CACATTCTGAAGTGAAGTCC-3’,
SEQ ID NO:6:5’-CAATGAGAGAGCTGGAGTTGAGC-3’。
进一步地,探针HE-Probe的5’端和探针NS-Probe的5’端具有不同的荧光报告集团。
进一步地,探针HE-Probe的5’端具有HEX荧光报告基团,3’端具有BHQ1荧光淬灭基团,探针NS-Probe的5’端具有FMA荧光报告集团,3’端具有BHQ1荧光淬灭基团。
进一步地,实时荧光定量PCR反应的条件为:退火温度为60℃,对应鲑鱼HE基因的特异性引物终浓度为0.5μmol/L,对应鲑鱼NS基因的特异性引物终浓度为0.45μmol/L,对应鲑鱼HE基因的引物的探针终浓度为0.4μmol/L,对应鲑鱼NS基因的引物的探针终浓度为0.4μmol/L。
一种鉴定传染性鲑鱼贫血病毒的试剂盒,含有:对应传染性鲑鱼贫血病毒HE基因的特异性引物对和探针HE-Probe,对应传染性鲑鱼贫血病毒NS基因的特异性引物对和探针NS-Probe,
所述对应传染性鲑鱼贫血病毒HE基因的特异性引物对的上游引物HE-F序列如SEQ ID NO:1所示,下游引物HE-R序列如SEQ ID NO:2所示,探针HE-Probe的序列如SEQ ID NO:3所示,
SEQ ID NO:1:5’-AAACTTCAGAGGAACATCAC-3’,
SEQ ID NO:2:5’-CTGCTACACCCATAGAAAT-3’,
SEQ ID NO:3:5’-TGAACCAAACATTCAATACAAACCAAG-3’;
所述对应传染性鲑鱼贫血病毒NS基因的特异性引物对的上游引物NS-F序列如SEQ ID NO:4所示,下游引物NS-R序列如SEQ ID NO:5所示,探针NS-Probe序列如SEQ ID NO:6所示,
SEQ ID NO:4:5’-TTCATCTACGAGAAGCCT-3’,
SEQ ID NO:5:5’-CACATTCTGAAGTGAAGTCC-3’,
SEQ ID NO:6:5’-CAATGAGAGAGCTGGAGTTGAGC-3’,
探针HE-Probe的5’端具有HEX荧光报告基团,3’端具有BHQ1荧光淬灭基团,探针NS-Probe的5’端具有FMA荧光报告集团,3’端具有BHQ1荧光淬灭基团。
当FAM和HEX荧光基团同时被检出时,判定为ISAV-HPR0型,即低致病或无致病力毒株感染;当FAM荧光基团检出,同时HEX荧光基团未检出时,判定为ISAV-HPRΔ型,即致病性毒株感染;当FAM和HEX两种荧光基团均未检出时,判定为非ISAV感染。理论上不存在仅检出HEX荧光基团,而未检出FAM荧光的情况。
本发明与现有技术相比具有如下优点:
本发明针对ISAV的NS基因设计一套特异性探针、引物,用于鉴定ISAV,再根据不同ISAV-HPR0毒株HE基因的HPR的特征,设计一套特异性引物和探针,用于区别ISAV-HPR0和HPRΔ型。两条探针的5’端标记不同的荧光基团,通过建立荧光定量PCR检测方法,实现在同一管中对ISAV进行定量鉴别诊断,为我国大西洋鲑鱼的口岸检疫储备技术,防患于未然,防止该病传入我国,造成经济损失。
附图说明
图1:ISAV-HPR0与部分不同亚型ISAV-HPRΔHPR氨基酸缺失示意图;
图2:双重荧光定量PCR标准曲线;A:ISAV NS基因;B:ISAV HE基因;
图3:特异性试验;A:ISAV-HPR0;B:ISAV-HPRΔ;
图4:双重TaqMan荧光定量PCR灵敏度试验;ISAV NS基因(1-6)、ISAVHE基因(a-f)分别为:1×106、1×105、1×104、1×103、1×102、1×101拷贝/μL。
具体实施方式
1实验材料与方法
1.1主要实验试剂与仪器
荧光定量PCR仪(Bio Rad CFX 96)、超微量分光光度计(NANO DROP2000),PrimeScriptTM RT reagent Kit(Perfect Real Time)、2×Premix Ex TaqTM(Probe qPCR)购于TaKaRa,荧光定量PCR常规耗材购自Bio Rad。
1.2实验材料
参照NCBI登录毒株基因序列(GenBank:AJ306487、FJ178189),由北京擎科新业生物技术有限公司人工合成ISAV S7和ISAV-HPR0HE质粒。大西洋鲑鱼检测样本核酸由四川出入境检验检疫局检验检疫技术中心及深圳出入境检验检疫局动植物检验检疫技术中心保存、提供;传染性胰脏坏死病病毒(IPNV)、传染性造血组织坏死病毒(IHNV)、艾格特维德病毒(VHSV)病毒核酸由四川出入境检验检疫局检验检疫技术中心保存、提供。
1.3引物及探针设计
从NCBI GenBank中下载ISAV HE基因序列数条,利用DNAMAN分析其序列特征及保守区域,根据HPR0和HPRΔ毒株HE基因HPR差异特征及NS基因保守区,利用Oligo 7、Primer 5设计特异性引物、Taq Man探针,引物信息(表1)。
表1:引物信息
1.4双重Taq Man荧光定量PCR的建立及结果判定标准
利用人工合成质粒做模板,进行荧光定量PCR,20μL反应体系为:2×Premix Ex TaqTM(Probe qPCR)10μL,25μmol/L各靶基因上、下游引物及探针各0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8μL(对应终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8μmol/L/条),模板各1μL,ddH2O补足25μL。反应条件:95℃预变性15s,95℃变性15s,退火(53-63℃)15s,延伸时进行荧光信号采集,重复40个循环。通过引物和探针不同浓度的配比,摸索最佳反应条件。
结果判定:当FAM和HEX荧光基团同时被检出时,判定为ISAV-HPR0型,即低致病或无致病力毒株感染;当FAM荧光基团检出,同时HEX荧光基团未检出时,判定为ISAV-HPRΔ型,即致病性毒株感染;当FAM和HEX两种荧光基团均未检出时,判定为非ISAV感染。理论上不存在仅检出HEX荧光基团,而未检出FAM荧光的情况。
1.5标准曲线的绘制
采用超微量分光光度计,测定HE和NS质粒浓度,计算其拷贝数,并进行10倍梯度稀释,用作模板。以选定的最优反应条件进行定量分析,绘制两条标准曲线。
1.6特异性、灵敏度及重复性试验
参照PrimeScriptTM RT reagent Kit使用说明将IPNV、IHNV、VHSV基因组核酸反转录为c DNA,作为模板,验证该方法特异性;灵敏度检测采用已知拷贝数的标准品质粒,10倍梯度稀释,以最优反应体系,测定该双重Taq Man荧光定量RT-PCR其最低检测限度;重复性试验选取101-106拷贝/μL的样本,采用建立方法进行重复性试验,分析Ct值差异。
1.7双重Taq Man荧光定量RT-PCR的应用
用建立好的双重Taq Man荧光定量RT-PCR方法对150份样本进行检测,并与OIE推荐使用检测方法的检测结果进行比较。
2结果
2.1反应体系优化结果
采用单一变量的优化方法,对不同退火温度、引物、探针终浓度的不同配优化结果显示:
当退火温度为53-63℃均能收集到荧光,当退火温度为60℃时,HE、NS基因扩增扩增效率最佳;根据ΔRn最大值和Ct最小值比较可知,HE、NS基因的最佳特异性引物终浓度分别为:0.5、0.45μmol/L;HE、NS基因Taq Man探针浓度最佳终浓度均为0.4μmol/L。
2.2标准曲线
HE、NS标准品质粒混合液的梯度浓度从103-107拷贝/μL的5个线性梯度的检测标准曲线呈等距性和平行性,具有较好的线性关系(图2)。
2.3特异性试验
在双重Taq Man荧光定量PCR体系中,当检测样本为低致病性或无致病性ISAV(HPR0)的阳性核酸样本时,荧光定量PCR结果可见两条扩增曲线(图3中A),阴性对照无扩增。当检测样本为高致病性ISAV(HPRΔ)阳性核酸样本时,ISAV-HPRΔ型HE基因的HPR部分区域缺失,导致HE-Probe Taq Man探针无法与产物特异性结合,故荧光定量PCR结果仅可见一条扩增曲线(图3中B),阴性对照无扩增。以IPNV、IHNV、VHSV基因组核酸为模板扩增结果均显示阴性。
2.4灵敏度试验
以ISAV-HPR0的HE质粒及NS标准品质粒为模板,荧光定量PCR结果显示所建立方法的扩增效率良好,双重荧光定量PCR中HE、NS的最低检测限度分别为1.56×102拷贝/μL、2.31×102拷贝/μL。
2.5重复性试验
重复性试验结果显示批间重复性试验结果显示其变异系数小于1.5%(表2),结果表明本发明所建立方法具有良好的重复性和稳定性。
表2:重复性试验变异系数
2.6双重Taq Man荧光定量RT-PCR的应用及评估
利用本发明所建立的双重Taq Man荧光定量RT-PCR,对150份大西洋鲑鱼样本进行检测,共检出ISAV-HPR0感染样本2份,检出率为1.33%,ISAV-HPRΔ感染样本1份,检出率为0.67%。
采用OIE推荐使用的大西洋鲑鱼ISAV荧光定量检测方法检出阳性样本3份,检出率为2.0%,但不能区分致病性毒株和低(非)致病性毒株,进一步进行测序鉴定,只有1份为ISAV-HPRΔ感染样本,检测结果与本发明方法检测结果一致。
由此可见,采用本发明的方法,可以一次即完成现有的两步检测,提高了检测效率。
表3:两种方法的检测结果
3结论与讨论
本发明针对ISAV NS和HE基因,设计两套特异性引物和探针,建立了可在单管中对ISAV-HPR0和HPRΔ型进行鉴别诊断的双重Taq Man荧光定量PCR检测方法,该方法通过对两种荧光信号的判读,可在约1.5小时内对三文鱼核酸样本完成致病性ISAV和低(无)致病性ISAV的鉴别诊断。双重荧光定量PCR中的各病毒最低检出限度达到102拷贝/μL,本方法灵敏度高,且仅对含有HE或NS基因的质粒具有很好的反应特异性,与其他鲑鱼常见病毒均无交叉反应,特异性良好,统计学分析显示其变异系数小于1.5%,重复性较好。与其他现行的ISAV OIE推荐分型检测方法相比,本方法最大的特点是不需要通过测序,直接通过荧光信息对反应进行定性、定量,且同时进行分析鉴定,快速、便捷、准确、灵敏,大大缩短了检测时间,在进出口检验检疫中应用前景广阔,尤其是大批量或紧急样本检测中具有巨大的潜力。
一种鉴定传染性鲑鱼贫血病毒的试剂盒,含有:对应传染性鲑鱼贫血病毒HE基因的特异性引物对和探针HE-Probe,对应传染性鲑鱼贫血病毒NS基因的特异性引物对和探针NS-Probe,
所述对应传染性鲑鱼贫血病毒HE基因的特异性引物对的上游引物HE-F序列如SEQ ID NO:1所示,下游引物HE-R序列如SEQ ID NO:2所示,探针HE-Probe的序列如SEQ ID NO:3所示,
SEQ ID NO:1:5’-AAACTTCAGAGGAACATCAC-3’,
SEQ ID NO:2:5’-CTGCTACACCCATAGAAAT-3’,
SEQ ID NO:3:5’-TGAACCAAACATTCAATACAAACCAAG-3’;
所述对应传染性鲑鱼贫血病毒NS基因的特异性引物对的上游引物NS-F序列如SEQ ID NO:4所示,下游引物NS-R序列如SEQ ID NO:5所示,探针NS-Probe序列如SEQ ID NO:6所示,
SEQ ID NO:4:5’-TTCATCTACGAGAAGCCT-3’,
SEQ ID NO:5:5’-CACATTCTGAAGTGAAGTCC-3’,
SEQ ID NO:6:5’-CAATGAGAGAGCTGGAGTTGAGC-3’,
探针HE-Probe的5’端具有HEX荧光报告基团,3’端具有BHQ1荧光淬灭基团,探针NS-Probe的5’端具有FMA荧光报告集团,3’端具有BHQ1荧光淬灭基团。
以上所述实施例仅表达了本申请的具体实施方式,其描述较为具体和详细,但并不能因此而理解为对本申请保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本申请技术方案构思的前提下,还可以做出若干变形和改进,这些都属于本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺
- 一种基于荧光定量PCR鉴定啮齿类螺杆菌的引物、试剂盒及鉴定方法与流程
- 一种检测包含潜伏期结核感染的试剂盒及其引物对和探针的制造方法与工艺
- 用于甜瓜果实基因PCR表达分析的内参基因及该内参基因的稳定性验证方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺