一种基于4‑甲氧基苯基取代氟硼二吡咯及二苯胺基芴的双光子荧光染料及其合成方法与流程
技术领域
本发明属于荧光染料技术领域,具体涉及一种基于4-甲氧基苯基取代氟硼二吡咯及二苯胺基芴的双光子荧光染料及其合成方法。
背景技术:
双光子吸收是一种三阶非线性光学效应。具有大的双光子吸收截面的有机材料在三维光存储[1]、双光子荧光成像[2]、双光子光限幅材料[3]以及光动力治疗[4]等领域有着具有广阔的应用前景。在双光子荧光染料研究领域,开发具有较大双光子吸收截面的荧光染料是关键。
氟硼二吡咯是一类性能优良的荧光发色团,其摩尔消光系数大,荧光量子产率高,光稳定性好,对极性和PH耐受性好,且容易进行结构修饰,是一种应用广泛的荧光染料[5],但其缺点是双光子吸收截面较小(一般不高于10 GM),限制了其在双光子荧光材料领域的应用。目前,人们对该类染料的双光子荧光性能的研究还很少。例如,Wang等在氟硼二吡咯的2,6位引入了炔基给电子团,但对其其双光子吸收截面的提高不明显(29-60 GM)[6]。Yilmaz及Sezen等在氟硼二吡咯的1及7位引入给电子基团,使氟硼二吡咯荧光团的双光子吸收截面有所增加[7, 8]。
在双光子吸收化合物的设计与合成中,利用分子内刚性D-π-A-π-D结构增加荧光基团的双光子吸收截面,进而提高双光子吸收及荧光性能,是一种重要的分子设计理念[9]。此外,共轭桥的平面性和刚性具有非常重要的意义,芴环可以看作是具有严格刚性的联苯结构,具有高平面性、高共轭性、良好的光化学与热稳定性,可作为有效的分子内电荷转移的π共轭桥引入到双光子荧光基团中[10]。再者,芳基胺上的氮原子主要采用sp2杂化方式与三个芳香环成键,所以往往具有较强的给电子能力,而且由于芳基的电子离域作用,使得分子即使在电荷分离形式的激发态也可以具有较好的稳定性,而且,众多文献报道采用二芳基胺为电子给体的荧光集团通常都具有较好的发光性质[11]。因此,本发明正是基于以上文献调研基础,以及现有氟硼二吡咯双光子荧光染料开发所存在的不足,设计并合成了一种基于4-甲氧基苯基取代氟硼二吡咯及二苯胺基芴的双光子荧光染料,使氟硼二吡咯的双光子吸收截面有显著提高,并具有较高的荧光量子产率。
技术实现要素:
本发明设计并合成了一种基于4-甲氧基苯基取代氟硼二吡咯及二苯胺基芴的双光子荧光染料,该染料具有相对较高的合成产率、良好的单光子及双光子吸收及荧光性能,为基于氟硼二吡咯的双光子荧光染料的合成及应用提供了新的设计思路,并具有潜在的应用价值。
该双光子荧光染料的结构通式如下:
其中,R为C1-C18的烷基
该类双光子荧光染料TPFD的合成步骤如下:
TPFD的合成步骤如下:
(1)2,6-碘代氟硼二吡咯荧光团1a的合成:以2,4-二甲基吡咯和4-甲氧基苯甲醛为原料,以三氟乙酸(TFA)为催化剂,合成中间产物联二吡咯,再通过DDQ(2,3-二氯-4,5-二氰基苯醌)氧化脱氢,与三氟化硼乙醚配位成环,生成1,3,5,7-四甲基-8-苯基氟硼二吡咯,然后与NIS(碘代丁二酰亚胺)反应实现2,6-位的碘化,得1a。
(2)二苯胺-芴-乙炔化合物2e的合成:以芴为原料,经过溴化、烷基化、Pd(0)催化胺化,Pd(0)和CuI催化Sonogashira交叉偶联反应、脱掉三甲基硅基,即可得到二苯胺-芴-乙炔化合物2e。
(3)目标产物TPFD的合成:2,6-位碘代氟硼二吡咯荧光团1a与二苯胺-芴-乙炔化合物2e进行Sonogashira偶联反应,即可得到目标化合物TPFD。
所述步骤(1)中,氩气保护下,以无水二氯甲烷(DCM)为溶剂,加入2,4-二甲基吡咯与0.4摩尔倍量4-甲氧基苯甲醛,加入几滴三氟乙酸作为催化剂,室温下磁力搅拌6 h后,将0.4摩尔倍量(以2,4-二甲基吡咯为基准)的2,3-二氯-4,5-二氰基苯醌(DDQ)溶于无水二氯甲烷中,加至上述反应液中,继续室温搅拌15 min。然后往上述反应液中加入二异丙基乙胺(DIEA)和三氟化硼乙醚溶液,继续室温搅拌30 min后,加入水淬灭反应,减压浓缩,以二氯甲烷:石油醚 = 1:2为洗脱剂,经硅胶层析色谱柱分离,即可得到氟硼二吡咯荧光团。然后,氟硼二吡咯荧光团再与5摩尔倍量的碘代丁二酰亚胺反应,经硅胶层析色谱柱分离(洗脱剂:二氯甲烷:石油醚 = 1:2),即得到1a。
所述步骤(2)中,芴与2.74倍的液溴(Br2)在干燥氯仿(CHCl3)中避光反应过夜,饱和硫代硫酸钠溶液淬灭反应,在乙醇中重结晶得到2,7-二溴-9H-芴(2a);2a与2.6摩尔倍量溴代烷烃(R-Br),5摩尔倍量KOH,0.1摩尔倍量KI,以二甲基亚砜(DMSO)为溶剂,室温搅拌过夜,反应完毕,以石油醚为洗脱剂,经硅胶层析色谱柱分离即可得到2,7-二溴-9,9-二烷基芴(2b);在氮气氛围下,以无水甲苯为溶剂,2b再与0.5摩尔倍量的二苯胺,5%摩尔倍量的Pd(dba)2,5%摩尔倍量的1,1'-双(二苯基膦)二茂铁(DPPF)和1摩尔倍量的叔丁醇钠(t-BuONa),加热回流,TLC板监测反应进程,反应完毕减压浓缩,以石油醚:二氯甲烷=10:1为洗脱剂,经硅胶层析色谱柱分离,即可得到2-二苯胺-7-溴-9,9-二烷基芴(2c);2c在氮气保护下,与1.5摩尔倍量三甲基硅基乙炔(Trimethylsilylacetylene),4%摩尔倍量的PPh3,2%摩尔倍量的Pd(dba)2和2%摩尔倍量的CuI,以无水三乙胺为溶剂,85 ℃搅拌过夜,TLC板监测反应进程,反应完毕后减压浓缩,过硅胶柱除掉金属盐后,得2d,2d再与稍过量四丁基氟化铵(Tetrabutylammonium fluoride)水合物,以四氢呋喃和甲醇为溶剂,氮气保护下,室温反应8 h,减压浓缩,以二氯甲烷:石油醚=1:2为洗脱剂,经硅胶层析色谱柱分离,即可得到二苯胺-芴-乙炔化合物2e。
所述步骤(3)中,1a与2.6摩尔倍量2e在5%摩尔倍量的Pd2(dba)3 , 10%摩尔倍量的三(2-呋喃基)膦(Tri(2-furyl)phosphine)和10%摩尔倍量的碘化亚铜条件下,以无水DMF:Et3N = 4:1为混合溶剂,60 ℃反应半小时,发生Sonogashira交叉偶联反应,反应完毕后减压浓缩,以石油醚:二氯甲烷=2:1为洗脱剂,经硅胶层析色谱柱分离,即可得到目标产物TPFD。
本发明首次提出将二苯胺基芴通过炔基连接到氟硼二吡咯荧光团的2,6位,进而得到一系列具有分子内刚性结构的基于4-甲氧基苯基取代氟硼二吡咯及二苯胺基芴的双光子荧光染料,该染料与2,6位未取代的氟硼二吡咯荧光团相比,其双光子吸收截面显著提高,且具有较高的荧光量子产率。本发明为基于氟硼二吡咯的双光子荧光染料的合成及应用提供了新的设计思路,并具有潜在的应用价值。
附图说明
图1为双光子荧光染料TPFD的核磁氢谱图;
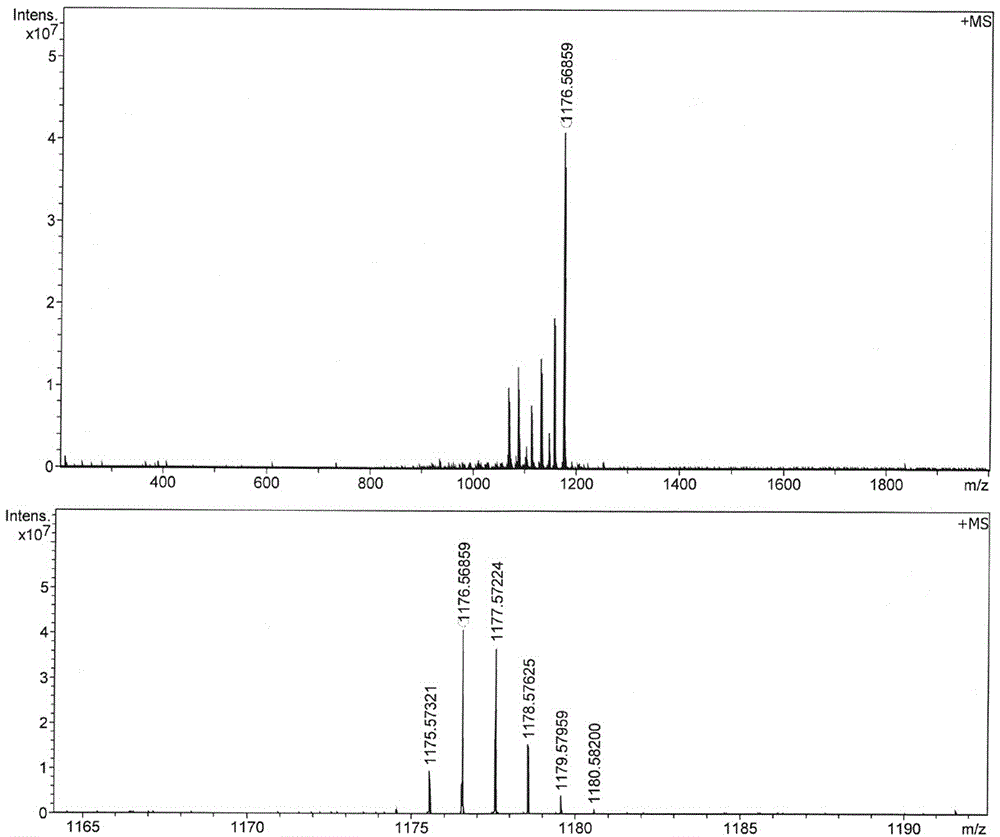
图2为双光子荧光染料TPFD的高分辨质谱图;
图3为双光子荧光染料TPFD及1a在不同激发波长下在甲苯溶液(1×10-4mol/L)中的双光子吸收截面(1a在810-910 nm处无双光子吸收);
图4为双光子荧光染料TPFD在甲苯溶液(1×10-4mol/L)中的双光子诱导荧光强度与激发光功率关系图;
图5为双光子荧光染料TPFD在甲苯溶液中的紫外-可见吸收光谱及荧光发射光谱(强度经归一化,浓度为1×10-5mol/L)。
具体实施方式
本发明通过以下具体实施例作进一步描述,但不限制本发明。
实施例1:2,6-碘代氟硼二吡咯荧光团1a的合成
氩气保护下,在1000 mL三口瓶中加入500 mL二氯甲烷,18.9 mmol 2,4-二甲基吡咯,7.6mmol4-甲氧基苯甲醛和三滴三氟乙酸作为催化剂,室温下磁力搅拌6 h后,将7,9 mmol 2,3-二氯-5,6-二氰基苯醌(DDQ)溶于150 mL二氯甲烷中,加至上述反应液中,继续室温搅拌15 min。然后往上述反应液中加入10 mL二异丙基乙胺(DIEA)和10 mL三氟化硼乙醚溶液,继续室温搅拌30 min后,加入200 mL水淬灭反应,二氯甲烷萃取,分液,无水硫酸钠干燥,真空蒸掉溶剂二氯甲烷,以二氯甲烷:石油醚 = 1:2为洗脱剂,经硅胶层析色谱柱分离,得到橘红色固体,产率为30%。
在100 mL圆底烧瓶中把0.6 mmol上述化合物溶于35 mL二氯甲烷中,加入3 mmol NIS,避光条件室温搅拌12 h,真空蒸发浓缩,经硅胶层析色谱柱分离(洗脱剂:二氯甲烷:石油醚 = 1:2),即得到1a,产率为60%。
实施例2:二苯胺-芴-乙炔化合物2e的合成(R = C2H5)
(1)2a的合成
在250 mL圆底烧瓶中,将5 g芴溶解到50 mL干燥的氯仿中,把4.18 mL (2.74倍)液溴溶于30 mL干燥氯仿溶液中,在恒压滴液漏斗中在0 °C下将上述混合液滴加到反应瓶中。避光条件下搅拌过夜,将饱和Na2S2O3溶液加入反应液中中和过量的液溴,淬灭反应,分液,有机层用水洗涤几次后,在有机相中加入无水MgSO4干燥半小时,过滤除掉无水硫酸镁,真空旋蒸除掉溶剂,在乙醇中重结晶,得到白色固体2a,产率95%。
(2)2b的合成
在50 mL圆底烧瓶中加入5 g 2,7-二溴芴,4.2 g 氢氧化钾,0.26 g 碘化钾,然后加入12 mL二甲基亚砜后放入10 °C的冷肼中,磁力搅拌,逐滴加入3 mL溴乙烷(五分钟的时间),可以看到反应混合液由红色变为浅紫色。滴加完毕,将反应温度升温至20 °C,搅拌过夜,反应完全后加入水以除掉二甲基亚砜并用二氯甲烷萃取几次,静置分层,在收集的有机相中加入无水Na2SO4干燥2 h后,过滤除掉无水硫酸钠,真空蒸发浓缩,然后将所得样品吸附至硅胶上,用石油醚为洗脱剂,经硅胶层析色谱柱分离,得到白色固体2b,产率30%。
(3)2c的合成
在50 mL干燥的史莱克瓶中加入2b (3.8 g, 10 mmol),二苯胺(0.85 g, 5 mmol),Pd(dba)2 (0.14 g, 0.25 mmol, 5%),DPPF (0.14 g, 0.25 mmol, 5%)和叔丁醇钠(0.95 g,10 mmol),在双排管上抽充换气后,氮气保护下加入18 mL刚处理过的无水甲苯,密封反应瓶,在80 °C下加热回流18 h后将温度升至100 °C继续搅拌5 h,TLC板监测反应完全后,冷却至室温,加入水淬灭反应,将反应液转移至分液漏斗中,用乙醚萃取几次,分液收集有机相,用硫酸镁干燥半个小时,过滤除掉硫酸镁,真空蒸发浓缩,将所得油状物吸附至硅胶上,以石油醚:二氯甲烷=10:1为洗脱剂,干法上样,经硅胶层析色谱柱分离,得到黄色固体2c,产率60%。
(4)2d的合成
在50 mL史莱克瓶中加入化合物2c (2.5 mmol),PPh3 (26.2 mg, 0.1 mmol, 4%), Pd(dba)2 (28.7 mg, 0.05 mmol, 2%) 和CuI (10 mg, 0.05 mmol, 2%)在双排管上抽充换气后,氮气保护下加入12 mL无水三乙胺,逐滴加入三甲基硅乙炔(0.53 mL, 3.76 mmol),密封反应体系,在85 °C温度下搅拌过夜,TLC监测反应完全进行后,停止反应,真空蒸发浓缩溶剂三乙胺,将所得油状物吸附至硅胶上,干法上样,以二氯甲烷:石油醚=1:2为洗脱剂,经硅胶层析色谱柱分离,得到油状化合物2d,产率65%。
(5)2e的合成
在50 mL史莱克瓶中加入化合物2d (0.97 g, 2 mmol),氮气保护下加入17 mL 四氢呋喃、3 mL甲醇和0.65 g (2.5 mmol)四丁基氟化铵水合物,密封反应管,室温搅拌8 h,TLC板检测反应进度,反应结束后,真空蒸发浓缩,除掉溶剂后将所得油状物吸附至硅胶上,干法上样,以二氯甲烷:石油醚=1:2为洗脱剂,经硅胶层析色谱柱分离,得到黄色固体化合物2e,产率96%。1H NMR (300 MHz, CDCl3) δ7.58 (d, J = 8.0 Hz, 2H), 7.50 (dd, J = 7.8, 1.5Hz, 1H), 7.46 (br, s, 1H), 7.32-7.27 (m, 4H), 7.18-7.12 (m, 5H), 7.09-7.03 (m, 3H), 3.15 (s, 1H), 1.95 (two sets of diastereotopic quarters, J = 12.8, 7.5 Hz, 4H), 0.38 (t, J = 7.5Hz, 4H).
实施例3:双光子荧光染料TPFD的合成(R = C2H5)
在10 mL史莱克反应管中,加入化合物2e (0.11 g, 0.26 mmol),Pd2(dba)3 (4.58 mg, 5%),三(2-呋喃基)膦(2.32 mg, 10%)和CuI (1.9 mg, 10%),然后加入0.8 mL无水N,N-二甲基甲酰胺(DMF)和0.2 mL刚处理过的三乙胺的混合溶剂,氮气保护下加入化合物1a ( 0.1 mmol),密封反应瓶,在60 °C下反应0.5 h后,TLC板检测原料氟硼二吡咯反应完全后,停止反应,将反应液倒入乙醚中,转移至分液漏斗,用水洗涤几次,静置分层,将收集到的上层有机相用无水MgSO4干燥,布氏漏斗抽滤除去无水硫酸镁,真空蒸发浓缩,将所得蓝色固体溶解在二氯甲烷中,吸附至硅胶上,以石油醚:二氯甲烷=2:1为洗脱剂,经硅胶层析色谱柱分离,以95%的产率得到蓝色固体TPFD。mp 290 °C, 1H NMR (600 MHz, CDCl3) δ 7.56-7.53 (dd, J = 4.8, 8.0 Hz, 4H), 7.43, 7.41 (dd, J = 1.0, 7.8 Hz, 2H), 7.36 (s, 2H), 7.27-7.2 (m, 10H), 7.13-6.99 (m, 18H), 3.91 (s, 3H), 2.7 6 (s, 6H), 1.98-1.84 (m, 8H), 1.62 (s, 6H), 0.34-0.37 (t, J = 7.2 Hz, 12H). 13C NMR (150 MHz, CDCl3) δ 160.5, 158.3, 151.6, 150.5, 147.7, 143.8, 142.4, 141.6, 135.8, 131.7, 130.5, 129.2, 126.6, 125.5, 124.0, 123.5, 122.7, 120.8, 120.7, 119.1, 119.0, 116.3, 114.8, 97.7, 81.6, 56.1, 55.4, 32.6, 13.8, 13.7, 8.6. 19F NMR (564 MHz, CDCl3) δ -146.3 (q, J(11B, F) = 31.6Hz). m/z (FT-ICR-MS MALDI): calculated M+ for C81H69BF2N4 as 1176.5696; found as 1176.5686.
实施例4:双光子荧光染料TPFD的单光子吸收及荧光性能(R = C2H5)
将目标化合物溶解在甲苯中,配置成浓度为1×10-5 mol/L的溶液,并对其紫外吸收光谱和荧光发射光谱进行了测试,结果发现,其最大吸收波长为596 nm,最大荧光发射波长为671 nm,荧光量子产率为0.39。
实施例5:双光子荧光染料TPFD的双光子荧光性能(R = C2H5)
双光子吸收截面测定:采用Ti:sapphire的激光作为激发光源,测定化合物TPFD在甲苯溶液中的双光子荧光性能。所测定溶液的浓度为1×10-4mol/L,激发波长从810 nm到1010 nm,每相隔10 nm作为一个激发波长,并采用荧光参比法,以荧光素为参比,得到了化合物从810 nm到1010 nm的双光子吸收截面(图3)。可以看出,化合物TPFD的双光子吸收截面最高可达到615 GM (1 GM = 1×10-50 cm4 s per photon-molecule)。TPFD的双光子荧光强度岁激发光功率增加未变化的情况如图4所示。由图可知,当用940 nm波长的激光激发时,化合物的荧光强度随激发光强度的增强而增强,且荧光强度与激发光功率的对数成正比关系(斜率约等于2),这证明了TPFD在940 nm波长激发下所发射的荧光确实为双光子诱导荧光机制。
参考文献:
[1] Dvornikov, A. S.; Walker, E. P.; Rentzepis, P. M., Two-Photon Three-Dimensional Optical Storage Memory. The Journal of Physical Chemistry A, 113, 13633-13644.2009.
[2] Barsu, Cyril; Cheaib, Rouba; Chambert, Stephane; Queneau, Yves; Maury, Olivier; Cottet, Davy; Wege, Hartmut; Douady, Julien; Bretonniere, Yann; Andraud, Chantal, Neutral push-pull chromophores for nonlinear optical imaging of cell membranes. Organic & Biomolecular Chemistry, 8, 142-150.2010.
[3] Lin, Tzu-Chau; Huang, Yu-Jhen; Chen, Yong-Fu; Hu, Chia-Ling, Two-photon absorption and effective broadband optical power limiting properties of a multi-branched chromophore containing 2,3-diarylquinoxalinyl moieties as the electron-pulling units. Tetrahedron, 66, 1375-1382.2010.
[4] Kim, Sehoon; Ohulchanskyy, Tymish Y.; Pudavar, Haridas E.; Pandey, Ravindra K.; Prasad, Paras N., Organically Modified Silica Nanoparticles Co-encapsulating Photosensitizing Drug and Aggregation-Enhanced Two-Photon Absorbing Fluorescent Dye Aggregates for Two-Photon Photodynamic Therapy. Journal Of The American Chemical Society, 129, 2669-2675.2007.
[5] Loudet, A.; Burgess, K., BODIPY dyes and their derivatives: Syntheses and spectroscopic properties. Chemical Reviews, 107, 4891-4932.2007.
[6] Wang, Yaochuan; Zhang, Dakui; Zhou, Hui; Ding, Jinliang; Chen, Qiang; Xiao, Yi; Qian, Shixiong, Nonlinear optical properties and ultrafast dynamics of three novel boradiazaindacene derivatives. Journal Of Applied Physics, 108, 033520.2010.
[7] Yılmaz, Halil; Küçüköz, Betül; Sevinç, Gökhan; Tekin, Sezen; Yaglioglu, H. Gul; Hayvalı, Mustafa; Elmali, Ayhan, The effect of charge transfer on the ultrafast and two-photon absorption properties of newly synthesized boron-dipyrromethene compounds. Dyes and Pigments, 99, 979-985.2013.
[8] Tekin, Sezen; Küçüköz, Betül; Yılmaz, Halil; Sevinç, Gökhan; Hayvalı, Mustafa; Gul Yaglioglu, H.; Elmali, Ayhan, Enhancement of two photon absorption properties by charge transfer in newly synthesized aza-boron-dipyrromethene compounds containing triphenylamine, 4-ethynyl-N,N-dimethylaniline and methoxy moieties. Journal of Photochemistry and Photobiology A: Chemistry, 256, 23-28.2013.
[9] Kannan, Ramamurthi; He, Guang S.; Yuan, Lixiang; Xu, Faming; Prasad, Paras N.; Dombroskie, Ann G.; Reinhardt, Bruce A.; Baur, Jeffery W.; Vaia, Richard A.; Tan, Loon-Seng, Diphenylaminofluorene-Based Two-Photon-Absorbing Chromophores with Various π-Electron Acceptors. Chemistry Of Materials, 13, 1896-1904.2001.
[10] Yao, S.; Ahn, H. Y.; Wang, X. H.; Fu, J.; Van Stryland, E. W.; Hagan, D. J.; Belfield, K. D., Donor-Acceptor-Donor Fluorene Derivatives for Two-Photon Fluorescence Lysosomal Imaging. Journal Of Organic Chemistry, 75, 3965-3974.2010.
[11] Fang, Z.; Teo, T. L.; Cai, L. P.; Lai, Y. H.; Samoc, A.; Samoc, M., Bridged Triphenylamine-Based Dendrimers: Tuning Enhanced Two-Photon Absorption Performance with Locked Molecular Planarity. Organic Letters, 11, 1-4.2009.。
- 还没有人留言评论。精彩留言会获得点赞!
- 沙格雷酯中间体2-[2-(3-甲氧基苯基)乙基]苯酚的合成方法
- 一种4,5,6-三氯-n-(2,3-二氟苯基)-2-(3-(三氟甲基)苯氧基)烟酰胺合成方法
- 一种甲基苯基乙烯基乙氧基硅烷的制备方法
- (2e, 6e)-2-(3,5-二甲氧基苯基亚甲基)-6-(4-氯苯基亚甲基)环己酮及其衍生物的新应用
- 一种基于3,4-二甲氧基苯基的取代苯甲酰胺新化合物、制备方法及用图
- 一种n-{[2,5-二乙氧基-4-[3-(3-甲氧基-苯基)-脲基甲基]-苯基}-甲磺酰胺新化合物 ...的制作方法
- 一种n-{[2,5-二乙氧基-4-[3-(4-甲氧基-苯基)-脲基甲基]-苯基}-甲磺酰胺新化合物 ...的制作方法
- 杀真菌的3-{苯基[(杂环基甲氧基)亚氨基]甲基}-杂环衍生物的制作方法
- 一种3-(2-硝基苯甲氧基)-1-(4-氯苯基)-1h-吡唑的绿色合成工艺的制作方法
- 杀真菌的3-{苯基[(杂环基甲氧基)亚氨基]甲基}-杂环衍生物的制作方法
- 苯并菲己烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉金属Zn配合物的合成方法
- 苯并菲己烷氧基桥连十二烷氧基苯基卟啉金属Zn配合物的合成方法
- 一种Meso-四(3,4-二羟基苯基)卟啉锌的制备方法
- 碱性氨基酸修饰氨基四苯基卟啉化合物的新用图
- 使用除草4-氨基-3-氯-6-(4-氯-2-氟-3-甲氧基苯基)吡啶-2-羧酸防治水生杂草的方法
- 苯并菲己烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法
- 一种Meso-四(3,4-二羟基苯基)卟啉钴的制备方法
- 沙格雷酯中间体2-[2-(3-甲氧基苯基)乙基]苯酚的合成方法
- 一种基于一氨基苯基取代卟啉纳米材料的二氧化氮气敏传感器的制造方法