一种代代花萼多糖及其制备方法与应用与流程
本发明属于中药的技术领域,具体涉及一种代代花萼多糖及其制备方法与应用。
背景技术:
多糖是除了蛋白质和核酸以外的一类重要的生物高分子化合物。现代药理研究表明多糖具有多种生理活性,包括抗氧化、抗肿瘤、抗病毒、降血脂、延缓衰老、增强免疫功能等。免疫调节作用是多糖最重要的生物活性功能,一直是人们研究的热点。免疫细菌多糖和人工合成的化合物,其不良反应和副作用已引起人们广泛注意。而大多数高等植物来源的多糖均为无不良反应的物质,不会对机体产生较大的副作用,因此,从植物中分离的多糖在生物医学上引起极大关注。目前已对百余种植物多糖进行了活性相关的研究报道。研究表明植物多糖可通过与免疫细胞表面的多种受体结合、激活不同的信号通路来调控动物机体内的免疫系统,包括:刺激巨噬细胞、T/B淋巴细胞、自然杀伤细胞的分泌或增殖;调节细胞因子的释放;促进抗体的分泌;激活补体系统等。
对这些活性物质的作用机制也在不断发展,其中多糖对非特异性诱导的免疫机制更受到人们的重视。植物多糖是最理想的免疫候选药物。
代代(Citrus aurantium L.var.amara Engl)是芸香科柑橘属植物酸橙的一个变种,代代花是其花蕾的干品,具有良好的药理作用,常用于治疗气郁不舒、脘腹胀痛、积食不化、恶心呕吐等。目前国内外对代代花的研究主要以其挥发油类化合物为主,主要采用水蒸气蒸馏法提炼精油,并广泛应用于化妆品、香精、香料等行业中。而对代代花多糖的研究报道几乎没有。大多数天然活性多糖是无毒副作用的天然绿色产品。随着研究的不断深入,天然多糖越来越成为食品、保健品、医药等领域的研究热点。
技术实现要素:
为了克服现有技术的不足和缺点,本发明的首要目的在于提供一种代代花萼粗多糖和精制多糖的制备方法。
本发明的另一目的在于提供上述制备方法制备得到的代代花萼粗多糖和精制多糖。
本发明的再一目的在于提供上述代代花萼粗多糖和精制多糖的应用。
本发明的目的通过下述方案实现:
一种代代花萼粗多糖的制备方法,包含如下步骤:
(1)将代代(Citrus aurantium L.var.amara Engl)花萼粉碎后过筛,得到代代花萼粗粉;蒸馏水加热回流提取代代花萼粗粉,然后将提取液离心,并将上清液减压浓缩,得到浓缩的代代花萼粗多糖溶液;
(2)将多糖溶液和经过预处理的大孔吸附树脂混合,脱色处理,过滤出多糖溶液,并用水反复洗出树脂中吸附的多糖,将脱色后的多糖溶液合并,减压浓缩,得到浓缩糖液;
(3)在浓缩糖液中加入沉淀剂进行沉淀,然后离心,弃去上清液,收集沉淀物并干燥,得到代代花萼粗多糖(记为CAVAPs)。
步骤(1)中热水回流提取的次数为2~4次;步骤(1)中所述加热回流的温度为75~100℃;所述热水回流每次提取的时间为2~4h;步骤(1)中所述热水回流提取的水料比为15:1~30:1(质量比)。
步骤(1)和(2)中所述减压浓缩的温度为40~60℃。
步骤(1)中所述的离心的转速为3000~5000r/min;所述离心的时间为8~12min;所述过滤的次数为2~4次。
步骤(2)所述脱色处理的条件为于40~60℃水浴2~4h;
步骤(2)中所述大孔吸附树脂选用为D354FD树脂;
步骤(2)中所述大孔吸附树脂的预处理的方法为:将大孔吸附树脂先用蒸馏水浸泡12~24h,然后先用质量分数为3%~5%的盐酸溶液浸泡0.5~3h,蒸馏水洗至中性,再用质量分数为3%~5%的氢氧化钠溶液浸泡0.5~3h,蒸馏水洗至中性,得到经过预处理的大孔吸附树脂。
步骤(3)中所述沉淀剂为无水乙醇或体积分数为90%~100%的乙醇溶液;
步骤(3)中所述沉淀的温度为0~4℃。
步骤(3)中所述沉淀剂的加入量为浓缩糖液体积的3~5倍;步骤(3)中所述沉淀的时间为8~24h。
步骤(3)中所述离心的转速为3000~5000r/min;所述离心的时间为12~15min;步骤(3)中所述干燥的温度为40~60℃,干燥至恒重。
一种代代花萼粗多糖(CAVAPs),通过上述制备方法制备得到。
所述代代花萼精制多糖通过将上述代代花萼粗多糖(CAVAPs)进一步纯化得到;所述代代花萼精制多糖为六种代代花萼精制多糖(记为CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)
所述的代代花萼精制多糖(CP-I)为均一组分,其分子量(Mn)为1.3×104Da;具体为13169Da;
所述的代代花萼精制多糖(CP-II)为均一组分,其分子量(Mn)为7.5×103Da;具体为7538Da;
所述的代代花萼精制多糖(CP-III、CP-IV、CP-V和CP-VI)非均一组分。
所述的代代花萼精制多糖(记为CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)通过如下步骤制备得到:
(1)将经过预处理的DEAE-52树脂于40~60℃旋转蒸发除气泡后转入Z型层析柱中,用恒流泵泵送蒸馏水以使填料装柱均匀,平衡后流速5~10s/滴;
(2)将代代花萼粗多糖配制成多糖溶液,转入层析柱中,依次用蒸馏水、0.05mol/L NaCl、0.1mol/L NaCl、0.15mol/L NaCl、0.2mol/L NaCl和0.3mol/L NaCl溶液洗脱,流速5~10s/滴,分别收集各流份,苯酚-硫酸法跟踪检测洗脱液,测定490nm下的吸光度,绘制洗脱曲线,同一吸收峰内的洗脱液合并;然后旋蒸浓缩,真空冷冻干燥,经过DEAE-52离子交换柱层析后得到六个组分,其中,蒸馏水洗脱得到的精制多糖命名为CP-I,0.05mol/L NaCl洗脱得到的精制多糖命名为CP-II,0.1mol/L NaCl洗脱得到的精制多糖命名为CP-III,0.15mol/L NaCl洗脱得到的精制多糖命名为CP-IV,0.2mol/L NaCl洗脱得到的精制多糖命名为CP-V,0.3mol/L NaCl洗脱得到的精制多糖命名为CP-VI。
步骤(1)中所述的DEAE-52树脂预处理的方法为:将DEAE-52树脂用水4~30℃浸泡12~24h;再用0.5mol/L的盐酸溶液浸泡0.5~2h;0.5mol/L的NaOH溶液浸泡0.5~2h,过滤,水洗至中性,得到经过预处理的DEAE-52树脂;
步骤(2)中所述的旋蒸浓缩的温度为40~60℃;
所述代代花萼粗多糖或精制多糖在制备抗癌、抗氧化、免疫增强药物中的应用。
所述代代花萼粗多糖或精制多糖可作为新型的抗癌、抗氧化、免疫增强药物。
一种免疫增强药物,含有上述代代花萼粗多糖或精制多糖;
本发明的原理:植物来源的多糖具有抗氧化、抗肿瘤和增强免疫功能等多种生物活性。多糖尤其能通过调节巨噬细胞的免疫功能体现出各种有益的药理作用。本发明通过体外实验发现和确证植物粗多糖或精制多糖具有抗氧化、抗肿瘤和免疫增强活性,且使用剂量低,在同样剂量下的毒副作用也较低。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明首次发现代代花萼粗多糖(CAVAPs)对DPPH自由基具有一定的清除和抑制作用;
(2)本发明首次发现代代花萼粗多糖(CAVAPs)对人乳腺癌细胞MCF-7和肺癌细胞HCC827具有一定的增殖抑制作用;
(3)本发明首次发现代代花萼粗多糖(CAVAPs)和精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)能显著增强RAW264.7巨噬细胞NO的释放;
(4)本发明首次发现代代花萼粗多糖(CAVAPs)和精制多糖(CP-II)能显著增强RAW264.7巨噬细胞IL-6及TNF-α的释放;
(5)本发明首次发现代代花萼粗多糖(CAVAPs)和精制多糖(CP-II)能显著增加RAW264.7巨噬细胞iNOS、IL-6、TNF-α和IL-1βmRNA的表达;
(6)本发明首次发现代代花萼粗多糖(CAVAPs)和精制多糖(CP-II)能显著增加RAW264.7巨噬细胞p-ERK,p-JNK,p-P38和p-P65的表达;
(7)代代花萼粗多糖和精制多糖的用药剂量比较低,而且在有效用药剂量范围内毒性较低。
附图说明
图1是实施例4制备得到的代代花萼精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)的离子交换柱层析洗脱曲线图;
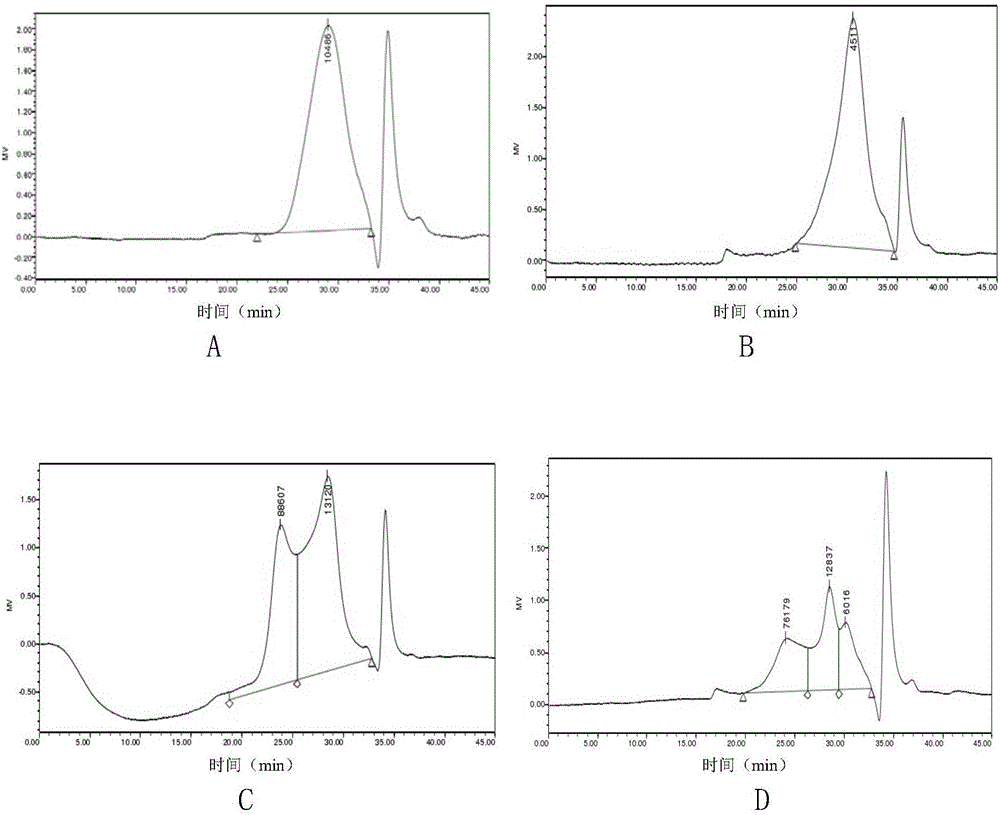
图2是实施例4制备得到的代代花萼精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)的高效凝胶渗透色谱(GPC)图;其中A为代代花萼精制多糖CP-I的GPC图,B为代代花萼精制多糖CP-II的GPC图,C为代代花萼精制多糖CP-III的GPC图,D为代代花萼精制多糖CP-IV的GPC图,E为代代花萼精制多糖CP-V的GPC图,F为代代花萼精制多糖CP-VI的GPC图;
图3是实施例4制备得到的代代花萼精制多糖CP-I和CP-II的葡聚糖凝胶Sephadex G-100柱层析洗脱曲线图;其中A为代代花萼精制多糖CP-I的凝胶柱层析洗脱曲线图,B为代代花萼精制多糖CP-II的凝胶柱层析洗脱曲线图;
图4是实施例4制备得到的代代花萼精制多糖CP-I和CP-II的红外光谱图;其中A为代代花萼精制多糖CP-I的红外光谱图,B为代代花萼精制多糖CP-II的红外光谱图;
图5是实施例1制备的代代花萼粗多糖CAVAPs对DPPH自由基抑制率的曲线图;
图6是实施例1制备的代代花萼粗多糖CAVAPs对人乳腺癌细胞MCF-7的增殖抑制率的曲线图;
图7是实施例1制备的代代花萼粗多糖CAVAPs对肺癌细胞HCC827的增殖抑制率的曲线图;
图8是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)对RAW264.7巨噬细胞存活率的影响图,其中A为代代花萼粗多糖CAVAPs对RAW264.7巨噬细胞存活率的影响图,B为代代花萼精制多糖CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI对RAW264.7巨噬细胞存活率的影响图;
图9是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)对RAW264.7巨噬细胞释放NO的影响图;其中A为代代花萼粗多糖CAVAPs对RAW264.7巨噬细胞释放NO的影响图,B为代代花萼精制多糖CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI对RAW264.7巨噬细胞释放NO的影响图;
图10是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞释放IL-6的影响图;其中A为代代花萼粗多糖CAVAPs对RAW264.7巨噬细胞释放IL-6的影响图,B为代代花萼精制多糖CP-II对RAW264.7巨噬细胞释放IL-6的影响图;
图11是实施例1制备的代代花萼粗多糖CAVAPs或实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞释放TNF-α的影响图;其中A为CAVAPs对RAW264.7巨噬细胞释放TNF-α的影响图,B为CP-II对RAW264.7巨噬细胞释放TNF-α的影响图;
图12是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞iNOS mRNA表达的影响图,其中A为CAVAPs对RAW264.7巨噬细胞iNOS mRNA表达的影响图,B为CP-II对RAW264.7巨噬细胞iNOS mRNA表达的影响图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01;
图13是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞IL-6mRNA表达的影响图,其中A为CAVAPs对RAW264.7巨噬细胞IL-6mRNA表达的影响图,B为CP-II对RAW264.7巨噬细胞IL-6mRNA mRNA表达的影响图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01;
图14是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞TNF-αmRNA表达的影响图,其中A为CAVAPs对RAW264.7巨噬细胞TNF-αmRNA表达的影响图,B为CP-II对RAW264.7巨噬细胞TNF-αmRNA mRNA表达的影响图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01;
图15是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞IL-1βmRNA表达的影响图;其中A为CAVAPs对RAW264.7巨噬细胞IL-1βmRNA表达的影响图,B为CP-II对RAW264.7巨噬细胞IL-1βmRNA mRNA表达的影响图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01;
图16是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞p-ERK蛋白表达的影响图;其中图A-1为CAVAPs的p-ERK蛋白表达曝光图,A-2为CAVAPs的p-ERK蛋白相对表达量图;图B-1为CP-II的p-ERK蛋白表达曝光图,B-2为CP-II的p-ERK蛋白相对表达量图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01;
图17是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞p-JNK蛋白表达的影响图;其中图A-1为CAVAPs的p-JNK蛋白表达曝光图,图A-2为CAVAPs的p-JNK蛋白相对表达量图;图B-1为CP-II的p-JNK蛋白表达曝光图,图B-2为CP-II的p-JNK蛋白相对表达量图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01;
图18是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞p-P38蛋白表达的影响图;其中图A-1为CAVAPs的p-P38蛋白表达曝光图,图A-2为CAVAPs的p-P38蛋白相对表达量图;图B-1为CP-II的p-P38蛋白表达曝光图,图B-2为CP-II的p-P38蛋白相对表达量图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01;
图19是实施例1制备的代代花萼粗多糖CAVAPs和实施例4制备的代代花萼精制多糖CP-II对RAW264.7巨噬细胞p-P65蛋白表达的影响图;其中图A-1为CAVAPs的p-P65蛋白表达曝光图,图A-2为CAVAPs的p-P65蛋白相对表达量图;图B-1为CP-II的p-P65蛋白表达曝光图,图B-2为CP-II的p-P65蛋白相对表达量图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。实施例中,人乳腺癌细胞MCF-7、肺癌细胞HCC827和小鼠巨噬细胞RAW 264.7购自中科院上海生命科学研究院细胞资源中心;代代花萼购于广州清平药材市场,产地为浙江。
实施例1从代代花萼中制备得到代代花萼粗多糖(CAVAPs):
(1)代代花萼粉碎后过20目筛,称取100g,用蒸馏水加热回流提取,其中,水料比为20:1(质量比),回流提取温度为75℃,回流提取时间为4h,回流提取次数3次;然后合并提取液,4000r/min下离心10min,取上层澄清液,滤纸过滤3次,将滤液用旋转蒸发仪在40℃下减压浓缩至200mL,得到多糖溶液;
(2)将D354FD树脂先用蒸馏水浸泡12h,然后依次用质量分数为5%的盐酸溶液、质量分数为5%的氢氧化钠溶液各自浸泡0.5h,200目纱布过滤,蒸馏水洗至中性,得到经过预处理的D354FD树脂;
(3)将步骤(1)制备得到的多糖溶液和200mL经过预处理的D354FD树脂混合,置于50℃恒温水浴锅中恒温水浴3h进行脱色,间隔搅拌,然后用200目的滤布过滤出多糖溶液,并用水反复清洗5次洗出树脂中吸附的多糖,将脱色后的多糖液合并,用旋转蒸发仪在40℃下减压浓缩至200mL,得到浓缩糖液;
(4)在步骤(3)制备得到的浓缩糖液中加入浓缩糖液4倍体积的无水乙醇,边加边磁力搅拌,于4℃条件下醇沉8h,然后4000rpm下离心分离15min,弃去上清液,取出沉淀物于45℃烘干,得到代代花萼粗多糖(CAVAPs)。
实施例2从代代花萼中制备得到代代花萼粗多糖(CAVAPs):
(1)代代花萼粉碎后过20目筛,称取100g,然后蒸馏水加热回流提取,其中,水料比20:1(质量比),回流提取温度为85℃,回流提取时间为3h,回流提取次数2次;然后合并提取液,3000r/min下离心8min,取上层澄清液,滤纸过滤2次,将滤液用旋转蒸发仪在50℃下减压浓缩至200mL,得到多糖溶液;
(2)将D354FD树脂先用蒸馏水浸泡24h,然后依次用质量分数为5%的盐酸溶液、质量分数为5%的氢氧化钠溶液各自浸泡2h,200目纱布过滤,蒸馏水洗至中性,得到经过预处理的D354FD树脂;
(3)将步骤(1)制备得到的多糖溶液和200mL经过预处理的D354FD树脂混合,置于40℃恒温水浴锅中恒温水浴2h进行脱色,间隔搅拌,然后用200目的滤布过滤出多糖溶液,并用水反复清洗4次洗出树脂中吸附的多糖,将脱色后的多糖液合并,用旋转蒸发仪在50℃下减压浓缩至200mL,得到浓缩糖液;
(4)在步骤(3)中制备得到的浓缩糖液中加入3倍体积的体积分数为95%的乙醇,边加边磁力搅拌,于0℃条件下醇沉12h,然后3000rpm下离心分离12min,弃去上清液,取出沉淀物于50℃烘干,得到代代花萼粗多糖(CAVAPs)。
实施例3从代代花萼中制备得到代代花萼粗多糖(CAVAPs):
(1)代代花萼粉碎后过20目筛,称取100g,用蒸馏水加热回流提取,其中,水料比为20:1(质量比),回流提取温度为95℃,回流提取时间为2h,回流提取次数4次,然后合并提取液,5000/min下离心12min,取上层澄清液,滤纸过滤4次,将滤液用旋转蒸发仪在60℃下减压浓缩至200mL,得到多糖溶液;
(2)将D354FD树脂先用蒸馏水浸泡18h,然后依次用质量分数为5%的盐酸溶液、质量分数为5%的氢氧化钠溶液各自浸泡3h,200目纱布过滤,蒸馏水洗至中性,得到经过预处理的D354FD树脂;
(3)将步骤(1)中制备得到的多糖溶液和200mL经过预处理的D354FD树脂混合,置于60℃恒温水浴锅中恒温水浴4h进行脱色,间隔搅拌,之后用200目的滤布过滤出多糖溶液,并用水反复清洗5次洗出树脂中吸附的多糖,将脱色后的多糖液合并,用旋转蒸发仪在60℃下减压浓缩至200mL,得到浓缩糖液;
(4)在步骤(3)制备得到的浓缩糖液中加入5倍体积的体积分数为95%的乙醇,边加边磁力搅拌,于4℃条件下醇沉24h,然后5000rpm下离心分离14min,弃去上清液,取出沉淀物于60℃烘干,得到代代花萼粗多糖(CAVAPs)。
实施例4代代花萼精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)的制备:
(1)DEAE-52预处理:取70g的DEAE-52,用蒸馏水4℃浸泡24h,然后小心将上层水倒出,除去杂质,再用0.5mol/L的盐酸溶液浸泡0.5h,将上层酸液小心倒出,抽滤至干后用蒸馏水洗脱至中性,再用0.5mol/L的NaOH溶液浸泡0.5h,小心倒出上层碱液,抽滤至干后用蒸馏水洗至中性,备用;
(2)将经过预处理的DEAE-52于48℃旋转蒸发除气泡后玻璃棒引流转入2.6×30cm规格的Z型层析柱中,用恒流泵泵送蒸馏水以使填料装柱均匀,平衡后7s/滴;
(3)称取100mg实施例1中制备得到的代代花萼粗多糖(CAVAPs),配制成多糖溶液,玻璃棒引流至层析柱中,依次用蒸馏水、0.05mol/L NaCl、0.1mol/L NaCl、0.15mol/L NaCl、0.2mol/L NaCl和0.3mol/L NaCl溶液洗脱,自动收集各流份,每根管收集大约5mL,苯酚-硫酸法跟踪检测洗脱液,测定490nm处的吸光度,绘制洗脱曲线,同一吸收峰内的洗脱液合并;然后洗脱液40℃旋蒸浓缩,真空冷冻干燥;CAVAPs经过DEAE-52离子交换柱层析后得到六个组分,其中,蒸馏水洗脱得到的精制多糖命名为CP-I,0.05mol/L NaCl洗脱得到的精制多糖命名为CP-II,0.1mol/L NaCl洗脱得到的代代花萼精制多糖命名为CP-III,0.15mol/L NaCl洗脱得到的精制多糖命名为CP-IV,0.2mol/L NaCl洗脱得到的精制多糖命名为CP-V,0.3mol/L NaCl洗脱得到的精制多糖命名为CP-VI,其中,图1为本实施例的离子交换柱层析洗脱曲线图。
实施例5代代花萼精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)的制备:
(1)DEAE-52预处理:取70g的DEAE-52,用蒸馏水20℃浸泡12h,然后小心将上层水倒出,除去杂质,再用0.5mol/L的盐酸溶液浸泡1h,将上层酸液小心倒出,抽滤至干后用蒸馏水洗脱至中性,再用0.5mol/L的NaOH溶液浸泡1h,小心倒出上层碱液,抽滤至干后用蒸馏水洗至中性,备用;
(2)将经过预处理的DEAE-52于48℃旋转蒸发除气泡后玻璃棒引流转入2.6×30cm规格的Z型层析柱中,用恒流泵泵送蒸馏水以使填料装柱均匀,平衡后7s/滴;
(3)称取100mg实施例1中制备得到的代代花萼粗多糖(CAVAPs),配制成多糖溶液,玻璃棒引流至层析柱中,依次用蒸馏水、0.05mol/L NaCl、0.1mol/L NaCl、0.15mol/L NaCl、0.2mol/L NaCl和0.3mol/L NaCl溶液洗脱,自动收集各流份,每根管收集大约5mL,苯酚-硫酸法跟踪检测洗脱液,测定490nm处的吸光度,绘制洗脱曲线,同一吸收峰内的洗脱液合并;然后洗脱液50℃旋蒸浓缩,真空冷冻干燥;CAVAPs经过DEAE-52离子交换柱层析后得到六个组分,其中,蒸馏水洗脱得到的精制多糖命名为CP-I,0.05mol/L NaCl洗脱得到的精制多糖命名为CP-II,0.1mol/L NaCl洗脱得到的精制多糖命名为CP-III,0.15mol/L NaCl洗脱得到的精制多糖命名为CP-IV,0.2mol/L NaCl洗脱得到的精制多糖命名为CP-V,0.3mol/L NaCl洗脱得到的精制多糖命名为CP-VI,其中,本实施例的离子交换柱层析洗脱结果同实施例4。
实施例6代代花萼精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)的制备:
(1)DEAE-52预处理:取70g的DEAE-52,用蒸馏水25℃浸泡20h,然后小心将上层水倒出,除去杂质,再用0.5mol/L的盐酸溶液浸泡0.8h,将上层酸液小心倒出,抽滤至干后用蒸馏水洗脱至中性,再用0.5mol/L的NaOH溶液浸泡0.8h,小心倒出上层碱液,抽滤至干后用蒸馏水洗至中性,备用;
(2)将经过预处理的DEAE-52于48℃旋转蒸发除气泡后玻璃棒引流转入2.6×30cm规格的Z型层析柱中,用恒流泵泵送蒸馏水以使填料装柱均匀,平衡后7s/滴;
(3)称取100mg实施例1中制备得到的代代花萼粗多糖(CAVAPs),配制成多糖溶液,玻璃棒引流至层析柱中,依次用蒸馏水、0.05mol/L NaCl、0.1mol/L NaCl、0.15mol/L NaCl、0.2mol/L NaCl和0.3mol/L NaCl溶液洗脱,自动收集各流份,每根管收集大约5mL,苯酚-硫酸法跟踪检测洗脱液,测定490nm处的吸光度,绘制洗脱曲线同一吸收峰内的洗脱液合并;然后洗脱液60℃旋蒸浓缩,真空冷冻干燥;CAVAPs经过DEAE-52离子交换柱层析后得到六个组分,其中,蒸馏水洗脱得到的精制多糖命名为CP-I,0.05mol/L NaCl洗脱得到的精制多糖命名为CP-II,0.1mol/L NaCl洗脱得到的精制多糖命名为CP-III,0.15mol/L NaCl洗脱得到的精制多糖命名为CP-IV,0.2mol/L NaCl洗脱得到的精制多糖命名为CP-V,0.3mol/L NaCl洗脱得到的精制多糖命名为CP-VI。其中,本实施例的离子交换柱层析洗脱结果同实施例4。
实施例7代代花萼精制多糖CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI的GPC分析
采用高效液相色谱仪分别对实施例4~6制备得到的CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI的分子量及其纯度进行测定。色谱条件:TSK G-5000PXL column(7.8×300mm)和TSK G-3000PXL column(7.8×300mm)串联,流动相为0.02mol/L的KH2PO4缓冲溶液,流速为0.6mL/min,2414示差检测器,柱温35℃。图2是实施例4制备得到的代代花萼精制多糖(CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI)的高效凝胶渗透色谱(GPC)图。
结果分析:
(1)实施例4制备得到的CP-I(图2A)和CP-II(图2B)的GPC图均为单一对称峰,表明CP-I和CP-II都为均一多糖,其分子量(Mn)分别为13169Da和7538Da。实施例4制备得到的CP-III(图2C)、CP-IV(图2D)、CP-V(图2E)和CP-VI(图2F)的GPC图均不是单一对称峰,表明CP-III、CP-IV、CP-V和CP-VI非均一组分。实施例5和6结果同实施例4。
实施例8代代花萼精制多糖CP-I、CP-II、CP-III、CP-IV、CP-V和CP-VI的Sephadex G-100柱层析分析
Sephadex G-100前处理:取一定量的Sephadex G-100于500m L的烧杯中,加入蒸馏水15~20m L/g,于90℃恒温水浴锅中持续加热5h,间歇小心搅拌,待其冷却至室温后待用。
取经上述方法处理的Sephadex G-100一定体积,玻璃棒搅拌均匀后玻璃棒引流至2.6×30cm的Z型层析柱中,用恒流泵泵入蒸馏水使层析柱中的装柱均匀,调节流速至平衡后流速为15s/滴。称取CP-I和CP-II各10mg,配置成2mg/m L的多糖溶液,经葡聚糖凝胶Sephadex G-100柱层析,12min/管,用蒸馏水洗脱,苯酚-硫酸法跟踪检测,绘制洗脱曲线并按照峰收集。图3是实施例4制备得到的代代花萼精制多糖CP-I和CP-II的葡聚糖凝胶Sephadex G-100柱层析洗脱曲线图;其中A为代代花萼精制多糖CP-I的凝胶柱层析洗脱曲线图,B为代代花萼精制多糖CP-II的凝胶柱层析洗脱曲线图。
结果分析:
实施例4制备得到的CP-I(图3A)和CP-II(图3B)葡聚糖凝胶Sephadex G-100凝胶柱层析,苯酚-硫酸法跟踪检测得到的洗脱曲线均为单一对称峰,与高效凝胶渗透色谱一致,进一步证实CP-I和CP-II为均一多糖。实施例5和6结果同实施例4。
实施例9红外光谱扫描
分别取实施例4~6中制备得到的代代花萼精制多糖(CP-I和CP-II)2mg,与KBr混合研细成均匀薄层状,在4000~400cm-1波数范围内进行红外扫描。图4是实施例4制备得到的代代花萼精制多糖CP-I和CP-II的红外光谱图;其中A为代代花萼精制多糖CP-I的红外光谱图,B为代代花萼精制多糖CP-II的红外光谱图。
结果分析:
多糖红外光谱分析结果:
CP-I(图4A)和CP-II(图4B)依次在波数3432cm-1和3448cm-1处的强吸收峰是糖类分子间或分子内的O-H伸缩振动峰,形宽而钝,可知羟基在分子间发生缔合,不是游离的羟基。CP-I和CP-II在波数2896cm-1和2912cm-1处处的吸收峰是次甲基或甲基的C-H振动吸收峰,在1450~1250cm-1吸收峰可能是糖类分子C-H变角振动引起的。由以上三组糖类的特征峰可初步判断CP-I和CP-II为多糖。CP-I和CP-II均在1643cm-1处有较强的吸收峰,表明CP-I和CP-II中均含有-COO基团。同时两种多糖在1300-1000cm-1处的吸收峰表示CP-I和CP-II中的糖环构型为吡喃型(呋喃型糖环在此区间上只有两个强吸收峰),因CP-I和CP-II是吡喃环结构。CP-I和CP-II分别在893cm-1和851cm-1处的吸收峰,表明二者主要以β-D葡萄吡喃糖为主。实施例5和实施例6的检测结果同实施例4。
实施例8代代花萼粗多糖(CAVAPs)对DPPH自由基的抑制作用
标准曲线的制作:准确称取19.7mg DPPH先用少量无水乙醇溶解,再以无水乙醇定容至250ml,配成200μmol/L的标准溶液,置棕色瓶中于冰箱内保存。分别取1.5ml浓度为0,10,20,50,100,150,200μmol/L DPPH标准溶液,和0.5ml无水乙醇混匀后,静置30min,然后在最大吸收波长517nm处测定吸光值。以浓度为横坐标,吸光度值为纵坐标制作DPPH·标准曲线,选择合适的DPPH·浓度作为测定样品中的DPPH·标准溶液实验浓度。
配置不同浓度的样品(实施例1制备得到的代代花萼粗多糖(CAVAPs))和标准品(抗坏血酸VC)溶液,分别取0.5ml样品或标准品溶液,加入1.5ml选择好的合适浓度的DPPH·标准液(现配现用),以无水乙醇代替样品作为空白对照,以无水乙醇代替DPPH溶液作为本底对照,将混合溶液摇匀后静置30min,用比色皿在517nm波长处测定吸光值。样品对DPPH自由基的清除率按如下公式计算:
DPPH清除率(%)=[1-(A样品-A本底对照)/A空白对照]×100%。
测试结果如图5所示,图5是实施例1制备的代代花萼粗多糖(CAVAPs)对DPPH自由基抑制率的曲线图。结果显示由实施例1制备得到的代代花萼粗多糖(CAVAPs)对DPPH自由基具有微弱的清除和抑制作用,但并不显著(图5)。
实施例9代代花萼粗多糖(CAVAPs)对人乳腺癌细胞MCF-7和肺癌细胞HCC827的增殖抑制作用
将人乳腺癌细胞MCF-7和肺癌细胞HCC827细胞以1×105个/ml浓度接种于96孔细胞培养板(100μL/孔),置37℃,5%二氧化碳培养箱中培养。待孔板中的细胞完全贴壁后,加入不同浓度(62.5,,125,250,500和1000μg/m L)的样品溶液100μl。同时设细胞对照组,即加入与样品液等量体积的完全培养液;阳性对照组,加与样品同浓度同体积的五-氟尿嘧啶作为阳性对照。每个浓度设6个平行。在37℃,5%CO2培养箱中继续培养,24h后取出,倒置显微镜观察细胞形态的变化。用注射器小心吸弃96孔板中培养液,用不含钙、镁离子的PBS洗板2次,然后每孔加入5mg/m L的MTT溶液20μL(需关灯操作,MTT见光易分解)和DMEM完全培养液180μL,在37℃,5%CO2培养箱中继续培养4h。小心吸弃孔内的细胞培养液,每孔加入150μL DMSO,振荡10min。用酶联免疫检测仪在波长为490nm下测定其吸光度值。
癌细胞的增值抑制率=(空白对照组吸光度值-样品组吸光度值)/空白对照组的吸光值。
测试结果如图6和7所示;图6是实施例1制备的代代花萼粗多糖(CAVAPs)对人乳腺癌细胞MCF-7的增殖抑制率的曲线图;图7是实施例1制备的代代花萼粗多糖(CAVAPs)对肺癌细胞HCC827的增殖抑制率的曲线图。
由实施例1制备得到的代代花萼粗多糖(CAVAPs)对MCF-7(图6)和HCC827(图7)细胞具有一定程度的抑制作用,且对于MCF-7的增殖抑制作用更强。
实施例10代代花萼精多糖CAVAPs和CP-I、CP-II、CP-III、CP-IV、CIP-V、CP-VI对RAW264.7细胞存活率的影响
将小鼠单核巨噬细胞RAW264.7以1×106个/ml浓度接种于96孔细胞培养板(100μL/孔),置37℃,5%CO2培养箱中培养。待孔板中的细胞完全贴壁后,加入100μL不同浓度的CAVAPs(62.5,125,250,400和500μg/m L)和CP-I、CP-II、CP-III、CP-IV、CIP-V、CP-VI(25,50,100,150,200和250μg/m L),每个浓度设6个平行,同时设细胞空白对照组。在37℃,5%CO2培养箱中继续培养,24h后取出,倒置显微镜下观察细胞的形态变化。用注射器小心吸弃孔内上层培养液,用PBS清洗两遍,再用MTT法进行细胞存活率检测,即每孔加入5mg/m L的MTT溶液20μL和DMEM完全培养液180μL,在37℃,5%CO2培养箱中继续培养4h。然后小心吸弃孔内的上清液,每孔加入150μL DMSO,振荡10min。用酶联免疫检测仪在波长为490nm下测定其吸光度值,根据下面公式计算细胞的存活率:
相对增殖度(PGR)=实验组平均吸光度值/空白对照组吸光度值×100%。
测试结果如图8所示;图8是实施例1制备的CAVAPs和实施例4制备的CP-I、CP-II、CP-III、CP-IV、CIP-V、CP-VI对RAW264.7巨噬细胞存活率的影响图。
由实施例1制备得到的CAVAPs在62.5~500μg/mL对RAW264.7巨噬细胞没有明显的毒性作用(图8A),可用于下一步实验研究;由实施例4制备的CP-I、CP-II、CP-III、CP-IV、CIP-V和CP-VI在25~250μg/mL对RAW264.7巨噬细胞没有明显的毒性作用(图8B),可用于下一步实验研究。
实施例11Griess法检测CAVAPs和CP-I、CP-II、CP-III、CP-IV、CIP-V、CP-VI对RAW264.7细胞释放NO的影响
常规培养细胞,取对数生长期的RAW264.7细胞,吹打细胞成单细胞悬液,显微镜下用血细胞计数板计数后,1000r/min,离心5min去上清,培养基重悬并调整细胞浓度,按20万个/孔的细胞密度接种于24孔培养板,置于37℃,5%CO2培养箱培养,贴壁24h,吸弃上清,按如下分组要求给药,每组设3个复孔:Control组,脂多糖(LPS,终浓度为1μg/mL)组,多糖样品组(实施例1制备得到的CAVAPs(终浓度为16.13、31.25、62.5、125、250和500μg/mL)组,多糖样品组(实施例4制备得到的CP-I、CP-II、CP-III、CP-IV、CIP-V、CP-VI(终浓度为16.13、31.25、62.5、125、200和250μg/mL)组,对照组添加同体积的培养基。给药后,置于37℃,5%CO2培养箱,继续培养24h。分别取各孔细胞上清100μL,相应加入另一新的96孔板中。每孔加50μL Griess试剂A和50μL Griess试剂B,然后置于37℃培养箱中反应10min,立即置板于多标记微孔板检测仪上,在550nm波长下检测各孔吸光度值。
测试结果如图9所示;图9A是实施例1制备的CAVAPs对RAW264.7巨噬细胞释放NO的影响图,图9B是实施例4制备的CP-I、CP-II、CP-III、CP-IV、CIP-V、CP-VI对RAW264.7巨噬细胞释放NO的影响图。CAVAPs和CP-I、CP-II、CP-III、CP-IV、CIP-V、CP-VI都能够显著促进RAW264.7巨噬细胞NO的释放,尤其CP-II效果最好。综合考虑,后续试验选定CAVAPs和CP-II进一步研究。
实施例12Elisa法检测CAVAPs和CP-II对RAW264.7细胞释放IL-6及TNF-α的影响
常规培养细胞,取对数生长期的RAW264.7细胞,吹打细胞成单细胞悬液,显微镜下用血细胞计数板计数后,1000r/min,离心5min去上清,培养基重悬并调整细胞浓度,按20万个/孔的细胞密度接种于24孔培养板,置于37℃,5%CO2培养箱培养,贴壁24h,吸弃上清,按如下分组要求给药,每组设3个复孔:Control组,脂多糖(LPS,终浓度为1μg/mL)组,CAVAPs组(实施例1制备得到的CAVAPs,终浓度为31.25、62.5、125、250、500μg/mL),CP-II组(实施例4制备得到的CP-II,终浓度为31.25、62.5、125、200、250μg/mL),对照组添加同体积的培养基。给药后,置于37℃,5%CO2培养箱,继续培养24h。分别取各孔细胞上清按照小鼠IL-6ELISA试剂盒和小鼠TNF-αELISA试剂盒操作方法检测细胞因子的释放情况。
测试结果如图10~11所示;图10A是实施例1制备的CAVAPs对RAW264.7巨噬细胞释放IL-6的影响图;图10B是实施例4制备的CP-II对RAW264.7巨噬细胞释放IL-6的影响图;图11A是实施例1制备的CAVAPs对RAW264.7巨噬细胞释放TNF-α的影响图;图11B是实施例4制备的CP-II对RAW264.7巨噬细胞释放TNF-α的影响图;
CAVAPs和CP-II都能够显著促进RAW264.7巨噬细胞IL-6及TNF-α的释放(图10~11)。
实施例13CAVAPs和CP-II对RAW264.7细胞iNOS、IL-6、TNF-α和IL-1βmRNA表达的影响
常规培养细胞,取对生长数期的细胞,按100万/孔细胞数接种于6孔板,孵育24h后,吸弃上清,按如下分组要求给药,每组设3个复孔。Control组,脂多糖(LPS,终浓度为1μg/mL)组,CAVAPs组(实施例1制备得到的CAV APs,终浓度为31.25、62.5、125、250、500μg/mL),CP-II组(实施例4制备得到的CP-II,终浓度为31.25、62.5、125、200、250μg/mL),对照组添加同体积的培养基。给药后,置于37℃,5%CO2培养箱,继续培养24h。作用24h后,吸弃细胞上清,PBS洗2次。每孔加入Trizol 1mL,静置5min,吸管吹打至液体无粘稠物,吸取细胞裂解液转入EP管,每管加入0.2mL氯仿,盖上EP管盖,手持用力上下震荡10s,室温静置5min,4℃以12,000r/min离心15min,离心后转移上层水相至另一EP管中,加入0.5mL异丙醇,室温静置10min,4℃离心机以12,000r/min离心10min,小心吸弃去上清,用冷75%乙醇1mL清洗2次,分别4℃条件下以7,500r/min离心5min,小心吸弃上清,空气吹干,约15min,加入0~50μL RNase-free纯水,60℃加热10min溶解沉淀。测定mRNA的纯度和浓度。并用RevertAid First Strand cnthesis Kit(Thermo公司)反转录试剂盒,20μL反应体系,对RNA进行逆转录。采用D yNAmo Flash SYRB Green qPCR Kit(Thermo公司)试剂盒,ABI实时荧光定量PCR仪(Rrism 7500,Applied Biosystems,Foster City,CA,USA)对mRN A进行扩增,扩增后用ABI PRISM 7500SDS软件中Relative Quantification(d dCt)Study法进行自动分析以获得目的基因的相对表达量。相关基因mRNA引物序列为GAPDH(forward,5′-TTTGTCAAGCTCATTTCCTGGTATG-3′,reverse,5′-TGGGATAGGGCCTCTCTTGC-3′).IL-1β(forward,5′-TGAAGGGCTGCTTCCAAACCTTTGACC-3′,reverse,5′–TGTCCATTGAGGTGGAGAGCTTTCAGC-3′),IL-6(forward,5′-TACTCGGCAAACCTAGTGCG-3′,reverse,5′–GTGTCCCAACATTCATATTGTCAGT-3′),iNOS(forward,5′-CGGCAA ACATGACTTCAGGC-3′,reverse,5′-GCACATCAAAGCGGCCATAG-3′)和TNF-α(forward,5′-GGGGATTATGGCTCAGGGTC-3′,reverse,5′-CGAGGCTCCAGTGAATTCGG-3′)。
测试结果如图12~15所示。图12是实施例1制备的CAVAPs(图12A)和实施例4制备的CP-II(图12B)对RAW264.7巨噬细胞iNOS mRNA表达的影响图,图13是实施例1制备的CAVAPs(图13A)和实施例4制备的CP-II(图13B)对RAW264.7巨噬细胞IL-6mRNA表达的影响图,图14是实施例1制备的CAVAPs(图14A)和实施例4制备的CP-II(图14B)对RAW264.7巨噬细胞TNF-αmRNA表达的影响图,图15是实施例1制备的CAVAPs(图15A)和实施例4制备的CP-II(图15B)对RAW264.7巨噬细胞IL-1βmRNA表达的影响图,其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01。
与control组相比,CAVAPs和CP-II可以显著促进iNOS(图12)、IL-6(图13)、TNF-α(图14)和IL-1β(图15)的分泌(P<0.05),并呈现梯度依赖性。
实施例14CAVAPs和CP-II对RAW264.7细胞p-ERK、p-JNK、P-p38和p-P65蛋白表达的影响
常规培养细胞,取对生长数期的RAW264.7细胞,按100万/孔细胞数接种于6孔板,孵育24h后,吸弃上清,按如下分组要求给药,每组设3个复孔。Control组,脂多糖(LPS,终浓度为1μg/mL)组,CAVAPs组(实施例1制备得到的CAVAPs,终浓度为125、250、500μg/mL),CP-II组(实施例4制备得到的CP-II,终浓度为125、200、250μg/mL),对照组添加同体积的培养基。给药后,置于37℃,5%CO2培养箱,继续培养24h。24h后,吸弃细胞上清,并且用预冷的PBS清洗两次,收集细胞至1.5mL离心管中,加入60μL的PIPA裂解液(含磷酸酶抑制剂(PhosSTOP,Roche)和蛋白酶抑制剂(cOmplete ULTRA Tablets,Mini,EDTA-free,EASYpack,Roche)),用1mL的注射器吸取裂解液反复吹打细胞至充分混匀,于冰上裂解40min,并每隔10min于涡旋振荡器上振荡15-20s。于4℃,12000rpm离心20min,将上清转移至新的1.5mL EP管,然后采用BCA法检测蛋白浓度(按照BCA Protein Assay Kit说明书进行):先将浓度为2mg/mL的BSA溶液予超纯去离子水稀释为系列质量浓度(0μg/mL、25μg/mL、125μg/mL、250μg/mL、500μg/mL、1000μg/mL)的标准品溶液,再根据需要配置一定量的工作液(BCA Solution:4%(体积分数)Cupric Sulfate=200:4)。取一块无底物的96孔板,每孔分别加入已稀释好的系列标准品溶液25μL,以及需要检测的蛋白溶液25μL(已稀释10倍),每组均设置复孔。同时加入200μL/孔工作液,轻轻震荡混匀,置于37℃孵育30min后,取出,于酶标仪570nm处检测OD值。根据标准品蛋白溶液所测OD值绘制标准曲线,计算出待测蛋白溶液浓度。根据BCA法测得的蛋白浓度,计算出40μg总蛋白所需蛋白体积,同时加5μL 5×SDS-PAGE上样缓冲液,再补充相应体积的超纯去离子水至总体积为25μL,混匀,充分离心,使液体聚集在底部,100℃金属浴加热变性10min,离心,置于冰上备用。选择10%(体积分数)分离胶和5%(体积分数)浓缩胶,将已变性好的蛋白样品依次加入各泳道,样品两侧的泳道分别加入5μL Marker。电泳槽中加入足够量的TGS缓冲液,电泳条件为:100V,约150min,直至溴酚蓝指示剂跑至距胶下缘约0.5cm时,停止电泳。然后在冰浴中以100V的电压转膜100min。用含5%(质量分数)脱脂奶粉的TBST封闭,缓慢摇荡1h。一抗抗体分别为:GAPDH(14c10)Rabbit mAb、pERK p-JNK、p-P38和NF-Κb p-P65(均购自CST公司),二抗抗体为山羊抗兔(HRP标记),购自聚研生物科技有限公司。按照说明书推荐的稀释比例(1:1000),配制一抗,室温下轻摇孵育4h或4℃静置过夜。一抗孵育结束后,更换二抗,HRP标记的二抗按相应比例稀释(1:2000),室温轻摇1h。二抗结束后,加入发光液(购自BioFuture公司)并利用凝胶成像仪蛋白条带显影。
图16是实施例1制备的CAVAPs和实施例4制备的CP-II对RAW264.7巨噬细胞p-ERK蛋白表达的影响图,图16A-1为实施例1制备的CAVAPs的p-ERK蛋白表达曝光图,16A-2为实施例1制备的CAVAPs的p-ERK蛋白相对表达量,图16B-1为实施例4制备的CP-II的p-ERK蛋白表达曝光图,16B-2为实施例4制备的CP-II的p-ERK蛋白相对表达量;图17是实施例1制备的CAVAPs和实施例4制备的CP-II对RAW264.7巨噬细胞p-JNK蛋白表达的影响图,图17A-1为实施例1制备的CAVAPs的p-JNK蛋白表达曝光图,17A-2为实施例1制备的CAVAPs的p-JNK蛋白相对表达量,图17B-1为实施例4制备的CP-II的p-JNK蛋白表达曝光图,17B-2为实施例4制备的CP-II的p-JNK蛋白相对表达量;图18是实施例1制备的CAVAPs和实施例4制备的CP-II对RAW264.7巨噬细胞p-P38蛋白表达的影响图,图18A-1为实施例1制备的CAVAPs的p-P38蛋白表达曝光图,18A-2为实施例1制备的CAVAPs的p-P38蛋白相对表达量,图18B-1为实施例4制备的CP-II的p-P38蛋白表达曝光图,18B-2为实施例4制备的CP-II的p-P38蛋白相对表达量;图19是实施例1制备的CAVAPs和实施例4制备的CP-II对RAW264.7巨噬细胞p-P65蛋白表达的影响图,图19A-1为p-P65蛋白表达曝光图,19A-2为p-P65蛋白相对表达量,图19B-1为实施例4制备的CP-II的p-P65蛋白表达曝光图,19B-2为实施例4制备的CP-II的p-P65蛋白相对表达量。其中,*:与control组比较,P<0.05;**:与control组比较,P<0.01。
正常组RAW264.7巨噬细胞内磷酸化的ERK、JNK、P38和P65蛋白表达较低,当不同浓度的CAVAPs(终浓度为125、250、500μg/mL)、CP-II(终浓度为125、200、250μg/mL)和LPS(终浓度为1μg/mL)作用细胞24h后,细胞内磷酸化的ERK(图16)、JNK(图17)、P38(图18)和P65(图19)蛋白表达显著上调(P<0.01),从而激活MAPK和NF-κB信号通路。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 华南理工大学
<120> 一种代代花萼多糖及其制备方法与应用
<130> 1
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> GAPDH的forward
<400> 1
tttgtcaagc tcatttcctg gtatg 25
<210> 2
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> GAPDH的reverse
<400> 2
tgggataggg cctctcttgc 20
<210> 3
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> IL-1β的forward
<400> 3
tgaagggctg cttccaaacc tttgacc 27
<210> 4
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> IL-1β的reverse
<400> 4
tgtccattga ggtggagagc tttcagc 27
<210> 5
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> IL-6的forward
<400> 5
tactcggcaa acctagtgcg 20
<210> 6
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> IL-6的reverse
<400> 6
gtgtcccaac attcatattg tcagt 25
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> iNOS的forward
<400> 7
cggcaaacat gacttcaggc 20
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> iNOS的reverse
<400> 8
gcacatcaaa gcggccatag 20
<210> 9
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> TNF-α的forward
<400> 9
ggggattatg gctcagggtc 20
<210> 10
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> TNF-α的reverse
<400> 10
cgaggctcca gtgaattcgg 20
- 还没有人留言评论。精彩留言会获得点赞!