一种桑辛素M‑6‑O‑β‑D‑葡萄糖苷及其制备方法与应用与流程
本发明涉及医药,特别是一种桑辛素M-6-O-β-D-葡萄糖苷(SP-19-1)及其制备方法与应用。
背景技术:
桑白皮为桑科植物桑(拉丁学名:Morus alba L.)的干燥根皮,别名桑根白皮、桑根皮、桑皮、白桑皮,秋末落叶时至次春发芽前采挖根部,刮去黄棕色粗皮,纵向剖开,剥取根皮,晒干。含黄酮类成分:桑素(mulberrin),桑皮色烯素(mulberrochromene),环桑素(cyclomulberrin),环桑皮色烯素(cyclomulberro-chromene),桑根皮素(morusin),环桑皮素(cyclomorusin),氧化二氢桑根皮素(oxydihydromomsin),桑黄酮(kuwanon)A、B、C、D、E、F、G(即albanin F,moracenin B)、H(即albanin G,moracenin A)、I、K、L、Y、Z,桑白皮素(moracenin)C、D,桑根酮(sffnggenone)A~P;又含桑呋喃(mulberrofuran)A、B、C、K、N、0、M、P、Q,桦皮酸;香豆素类:5,7-羟基香豆素(5,7-dihydmxycoumarin)伞形花内酯(umbelliferone)、东莨菪内酯(即东莨菪素,scopoletin)、莨菪内酯等成分。多糖类:粘液素、桑多糖、甲克素、壳聚糖;还含α-及β-香树精、谷固醇、挥发油、鞣质等。具有降压、利尿、镇静镇痛、抗炎、抗菌、抑制血小板聚集、降糖之功效,对人子宫颈癌JTC-26株的抑制率为70%左右,具有诱生干扰素作用。
LPS是内毒素的主要成分,内毒素进入机体后通过诱发过度的炎症反应可引起急性肺损伤(acute lung injury,ALI),LPS诱导的ALI是严重创伤或感染后出现最早、发病率最高的并发症之一,肺血管内皮细胞损伤是LPS导致急性肺损伤的关键环节。因此研究血管内皮的受损及其修复对ALI的治疗和防御具有显著意义。内皮细胞功能失调受损后会分泌多种细胞因子、炎症因子,如趋化因子(MCP-1)、粘附因子(ICAM-1、VCAM-1、E-selectin)、炎症因子(TNF-α、IL-1β、IL-6)等。同时内皮细胞也能够释放各种活性物质,协调血管舒张因子及收缩因子之间的平衡,如缩血管物质ET-1及扩血管物质NO,ET-1/NO平衡的破坏是动脉内皮受损的显著特征。iNOS是一种在炎症因子刺激下产生的一种物质,它的含量可以代表血管损伤的程度,最近的研究表明,活化的AMPK能够显著改善TNF-α诱导内皮细胞损伤中NF-κB的核移位,5-aminoimidazole-4-carboxamide-1-β-d-ribofuranoside(AICAR)也能够通过激活AMPK抑制LPS诱导的炎症反应。但至今未见有从桑白皮中提取有效活性部位桑辛素M-6-O-β-D-葡萄糖苷(简称SP-19-1)并用于制备治疗LPS诱导的HPAEC损伤药物中的应用。
技术实现要素:
针对上述情况,为克服现有技术之缺陷,本发明之目的就是提供一种桑辛素M-6-O-β-D-葡萄糖苷及其制备方法与应用,可有效解决从桑白皮中提取桑辛素M-6-O-β-D-葡萄糖苷(简称SP-19-1),以及在制备治疗LPS诱导的HPAEC损伤药物中的应用问题。
本发明解决的技术方案是,所述的桑辛素M-6-O-β-D-葡萄糖苷是从桑白皮中提取的有效活性成分,分子结构式见图1所示,该桑辛素M-6-O-β-D-葡萄糖苷的制备方法是:
将桑白皮煎煮提取,提取液减压浓缩得干燥物,干燥物加蒸馏水混悬,离心除去不溶物,得上清液;上清液上树脂柱,依次用水、质量浓度30%乙醇梯度洗脱,各个梯度洗脱液浓缩至干,干物用甲醇溶解,再加入硅胶,得载有样品的硅胶;将载有样品的硅胶加入到色谱柱的液面上,进行梯度洗脱,将收集的流份经过TLC分析,合并含有目标成分的流份,减压浓缩,得到含有目标成分的总样A1、A2、A3;总样A3用甲醇溶解,上Toyopearl HW-40柱,用甲醇洗脱,薄层检识,合并含相同的流份,得到子流份A3-1,减压浓缩、干燥,用甲醇溶解,上ODS柱,用甲醇洗脱,薄层检识,合并含相同的流份,减压浓缩,得到目标成分棕色粉末桑辛素M-6-O-β-D-葡萄糖苷(SP-19-1):
该桑辛素M-6-O-β-D-葡萄糖苷对LPS诱导的HPAEC损伤有保护作用,有效用于制备治疗LPS诱导的HPAEC损伤的药物,实现桑辛素M-6-O-β-D-葡萄糖苷在制备治疗LPS诱导的HPAEC损伤药物中的应用。
本发明是从桑白皮中提取的一种有效活性成分桑辛素M-6-O-β-D-葡萄糖苷(简称SP-19-1),其制备方法新颖独特,易操作使用,其制备的桑辛素M-6-O-β-D-葡萄糖苷作为唯一活性部位在制备治疗LPS诱导的HPAEC损伤药物中的应用,开拓了桑白皮的新用途,有良好的经济和社会效益。
附图说明
图1为本发明的桑辛素M-6-O-β-D-葡萄糖苷(简称SP-19-1)的分子结构图。
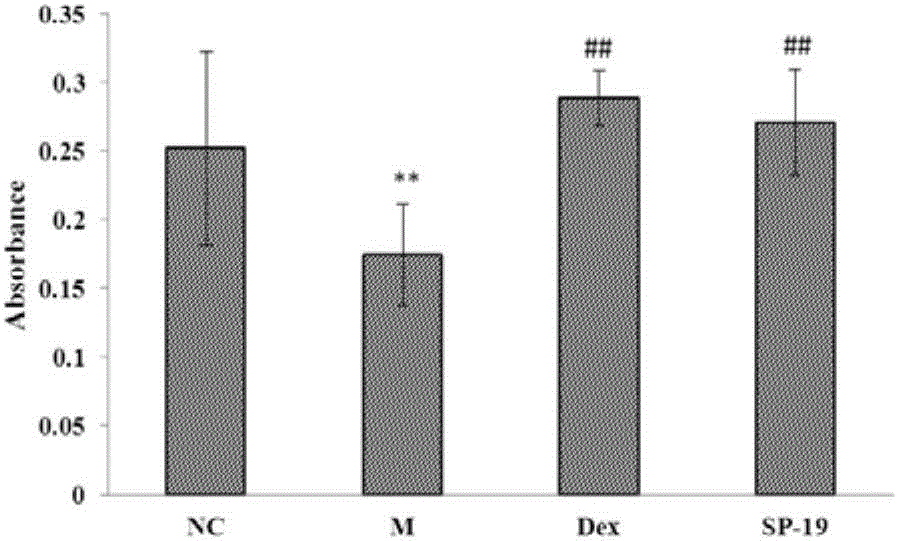
图2为本发明SP-19-1对HPAEC细胞损伤的影响图。
图3为本发明AMPK拮抗剂Compound C对SP-19-1的影响图。
图4为本发明SP-19-1对HPAEC细胞TNF-α的影响图。
图5为本发明SP-19-1对HPAEC细胞IL-1β的影响图。
图6为本发明SP-19-1对HPAEC细胞IL-6的影响图。
图7为本发明SP-19-1对HPAEC细胞ET-1的影响图。
图8为本发明SP-19-1对HPAEC细胞NO的影响图。
图9为本发明SP-19-1对HPAEC细胞iNOS的影响图。
图10为本发明SP-19-1对HPAEC细胞ICAM-1的影响图。
图11为本发明SP-19-1对HPAEC细胞VCAM-1的影响图。
图12为本发明SP-19-1对HPAEC细胞E-selectin的影响图。
图13为本发明SP-19-1对HPAEC细胞MCP-1的影响图。
具体实施方式
以下结合具体情况对本发明的具体实施方式作详细说明。
本发明在具体实施中,所述的桑辛素M-6-O-β-D-葡萄糖苷是从桑白皮中提取的有效活性成分,分子结构式见图1所示,该桑辛素M-6-O-β-D-葡萄糖苷的制备方法是:
将桑白皮2.4kg每次用其重量8-12倍的蒸馏水煎煮提取3次,每次60min,合并提取液,减压浓缩得干燥物,加干燥物重量体积2-3倍的蒸馏水混悬,重量体积是指固体物以g计,液体以mL计,6000r/min离心除去不溶物,得上清液;取7.0L Diaion HP-20大孔吸附树脂填料,用质量浓度95%乙醇浸泡24h装柱,用蒸馏水洗至无醇味,上清液浓缩至50℃相对密度1.2-1.4,上树脂柱,依次用水、质量浓度30%乙醇洗脱,每个梯度洗脱液用量为10个柱体积,流速为2BVh-1,各个梯度洗脱液浓缩至干,得到30%乙醇洗脱组分和粗提物,加入50mL甲醇溶解,再加入过160-200目筛的硅胶40g,45℃减压回收甲醇,得到载有样品的硅胶;取过200-300目筛的硅胶500g,加入二氯甲烷800mL,转移到80cm长×8cm内径的色谱柱中,用二氯甲烷充实柱床,将液面降至距硅胶面5cm处,再将上述载有样品的硅胶加入到色谱柱的液面上,依次加入体积比为100:3、100:5、100:10梯度的二氯甲烷-甲醇系统,每个梯度4L,进行梯度洗脱,流速为10mL·min-1,每100mL作为1个流份收集,将收集的流份经过TLC分析,合并含有目标成分的流份,减压浓缩,得到含有目标成分的总样A1、A2、A3,所述的TLC分析中使用的吸附剂为GF254,展开剂为体积比20:1-5:1的二氯甲烷-甲醇;总样A1用质量浓度30%甲醇溶解,上Toyopearl HW-40C柱,用质量浓度30%甲醇洗脱,流速为1mL·min-1,每2mL为一个流份,薄层检识,合并含相同的流份,得到子流份A1-1、A1-2;总样A2用质量浓度35%甲醇溶解,上Toyopearl HW-40柱,用质量浓度35%甲醇洗脱,流速为1mL·min-1,每2mL为一个流份,薄层检识,合并含相同的流份,得到子流份A2-1、A2-2;总样A3用质量浓度50%甲醇溶解,上Toyopearl HW-40柱,用质量浓度50%甲醇洗脱,流速为1mL·min-1,每2mL为一个流份,薄层检识,合并含相同的流份,得到子流份A3-1;所得各个子流份45℃减压浓缩,得到含有目标成分的样品;子流份A3-1用质量浓度26%甲醇溶解,上ODS柱,用质量浓度26%甲醇洗脱,流速为5mL·min-1,每10mL为一个流份,薄层检识,合并含相同的流份,流份27-43在45℃减压浓缩,得到目标成分棕色粉末桑辛素M-6-O-β-D-葡萄糖苷(SP-19-1):
该桑辛素M-6-O-β-D-葡萄糖苷对LPS诱导的HPAEC损伤有保护作用,有效用于制备治疗LPS诱导的HPAEC损伤的药物,实现桑辛素M-6-O-β-D-葡萄糖苷在制备治疗LPS诱导的HPAEC损伤药物中的应用。
本发明方法从桑白皮中提取的有效活性成分,经液相色谱法测定,其结构式如图1所示,命名为桑辛素M-6-O-β-D-葡萄糖苷(简称SP-19-1),具有对LPS诱导的HPAEC损伤有保护作用,并经实验得到了充分证明,有关资料如下:
材料与方法
1实验材料
1.1细胞
HPAEC细胞株购自中国科学院细胞库。
1.2细胞培养
将HPAEC细胞培养在含体积分数为10%胎牛血清的1640培养基中(含青霉素和链霉素100kU·L-1),置于37℃、5%CO2饱和湿度培养箱中培养,均取对数生长期细胞用于实验。
1.3实验药物:本发明方法制备的桑辛素M-6-O-β-D-葡萄糖苷(简称SP-19-1)。
1.4试剂
脂多糖(sigma);醋酸地塞米松片,国药准字H12020686,生产批号13050102,(天津天药药业股份有限公司);人TNF-α、IL-1β和IL-6ELISA试剂盒(武汉伊莱瑞特生物科技有限公司);ICAM-1、VCAM-1、E-selectin、MCP-1ELISA(武汉伊莱瑞特生物科技有限公司);NO,iNOS试剂盒(南京建成);1640培养基(美国Gibco公司);胰蛋白酶(美国Gibco公司);胎牛血清(美国Gibco公司);水为超纯水;PBS缓冲液等为自配;总蛋白提取试剂盒、BCA法蛋白定量试剂盒(北京普利来基因技术有限公司);其他各种试剂均为市售分析纯。
1.5仪器
Bio Mate 3S紫外分光光度计(Thermo Fisher Scientific);AB204-N万分之一精密分析天平(METTLER TOLEDO);Centrifuge-5804R小型高速低温冷冻离心机(Eppendorf公司);iMARK型酶标仪(美国BIO-RAD)。二氧化碳培养箱(上海STIK);超净工作台(苏净集团);iMARK型酶标仪(美国BIO-RAD公司);Arium 611VF超级组合型超纯水器(SARTORIUS);倒置显微镜(Nikon);PB-10酸度计(德国赛多利斯集团),培养皿、96孔培养板、细胞冻存管(Corning公司)。
2实验方法
2.1 LPS诱导HPAEC细胞损伤模型的建立
将HPAEC细胞培养于含10%胎牛血清的1640培养基中,待细胞贴壁后将原培养基移出,用PBS缓冲液洗一遍,更换不含血清的空白培养基饥饿12h,然后换上含1μg/mL LPS的1640培养基继续培养。24h后即形成HPAEC细胞损伤模型。
2.2 SP-19-1对HPAEC细胞损伤的影响
将HPAEC细胞用含10%胎牛血清的1640培养基接种于96孔板,待细胞完全贴壁后将原培养基移出,用PBS缓冲液洗一遍,更换不含血清的1640培养基饥饿12h后正常组换上新的1640培养基,模型组换上LPS浓度为1μg/mL的培养基,SP-19-1组换上1μg/mL LPS+SP-19-1的培养基,SP-19-1+Compound C组换上1μg/mL LPS+SP-19-1+Compound C(10μM)的培养基。培养24h后,每孔加入MTT溶液(5mg/mL)20μL,37℃继续培养4小时,吸净培养液,每孔加入150μL DMSO,震荡10分钟,使结晶物完全溶解。以DMSO调零,用酶标仪在490nm下测定各孔的吸光度A。
2.3实验分组
实验分为5组,正常对照组(NC);模型组(M)(用含1μg/mL的LPS培养基培养细胞24h);地塞米松组(Dex)(地塞米松,0.5μM);SP-19-1组(1μg/mL LPS+3μM SP-19-1);SP-19-1+C组(1μg/mL LPS+3μM SP-19-1+10μM Compound C)。
2.4 SP-19-1对HPAEC细胞TNF-α、IL-1β、IL-6的影响
取各组细胞的培养基上清液,向预先包被抗体的微孔板中加入标准品、待测样本,经过恒温温浴,加入生物素抗体工作液,恒温温浴温和洗涤后,加入酶结合工作液,恒温温浴温和洗涤后加入底物溶液(TMB),温浴后加终止液终止反应。用酶标仪在450nm波长下检测吸光度(OD)值,通过标准曲线计算样品中这些炎症因子的活性。
2.5 SP-19-1对HPAEC细胞ICAM-1、VCAM-1、E-selectin的影响
各组细胞提取细胞总蛋白,用适当的媒介溶解之后,取制备好的细胞总蛋白溶液,用BCA法测定其蛋白浓度,调整好蛋白浓度,接着向预先包被抗体的微孔板中加入标准品、待测样本,经过恒温温浴,加入生物素抗体工作液,恒温温浴温和洗涤后,加入酶结合工作液,恒温温浴温和洗涤后加入底物溶液(TMB),温浴后加终止液终止反应。用酶标仪在450nm波长下检测吸光度(OD)值,通过标准曲线计算各组中蛋白的表达量。
2.6 SP-19-1对HPAEC细胞趋化因子MCP-1的影响
各组细胞提取细胞总蛋白,用适当的媒介溶解之后,取制备好的细胞总蛋白溶液,用BCA法测定其蛋白浓度,调整好蛋白浓度,接着向预先包被抗体的微孔板中加入标准品、待测样本,经过恒温温浴,加入生物素抗体工作液,恒温温浴温和洗涤后,加入酶结合工作液,恒温温浴温和洗涤后加入底物溶液(TMB),温浴后加终止液终止反应。用酶标仪在450nm波长下检测吸光度(OD)值,通过标准曲线计算各组中蛋白的表达量。
2.7 SP-19-1对HPAEC细胞ET-1的影响
取各组细胞的培养基上清液,向预先包被抗体的微孔板中加入标准品、待测样本,经过恒温温浴,加入生物素抗体工作液,恒温温浴温和洗涤后,加入酶结合工作液,恒温温浴温和洗涤后加入底物溶液(TMB),温浴后加终止液终止反应。用酶标仪在450nm波长下检测吸光度(OD)值,通过标准曲线计算各组中ET-1蛋白的表达量。
2.8硝酸还原酶法检测细胞上清液中NO的含量
取各组细胞的培养基上清液,按照试剂盒的操作检测NO的含量。
2.9细胞上清液中iNOS含量的测定
取各组细胞的培养基上清液,按照试剂盒的操作检测iNOS的含量。
2.10统计方法
实验数据用均数±标准差表示,用SPSS18.0统计软件处理数据,各组间比较采用单因素方差分析(One-Way ANOVA),P<0.05表示有显著性意义,P<0.01表示有极显著性意义。
3结果
3.1 SP-19-1对HPAEC细胞损伤的影响
与空白对照组相比,LPS能显著损伤HPAEC细胞(P<0.01);与模型组相比,SP-19-1组均能改善HPAEC的细胞损伤状况(P<0.01),结果见表1、图2。
表1 SP-19-1对HPAEC细胞损伤的影响(n=3)
注:与正常组相比,*表示P<0.05,**表示P<0.01;与模型组相比,#表示P<0.05,##表示P<0.01。
3.2 AMPK拮抗剂Compound C对SP-19-1的影响
与空白对照组相比,LPS能显著损伤HPAEC细胞(P<0.01);与模型组相比,SP-19-1能改善HPAEC的细胞损伤状况(P<0.01),SP-19-1+C组改善作用消失(P<0.01),结果见表2、图3。
表2 AMPK拮抗剂Compound C对SP-19-1的影响(n=3)
注:与正常组相比,*表示P<0.05,**表示P<0.01;与模型组相比,#表示P<0.05,##表示P<0.01。
3.3 SP-19-1对HPAEC细胞损伤TNF-α、IL-1β、IL-6的影响
与空白对照组相比,模型组TNF-α、IL-1β、IL-6水平极显著性升高(P<0.05或P<0.01);与模型组相比,SP-19-1能降低TNF-α、IL-1β、IL-6的水平(P<0.05或P<0.01),而SP-19-1+C组TNF-α、IL-1β、IL-6水平极显著性升高(P<0.05或P<0.01),SP-19-1降低炎症因子的作用消失,结果见表3、图4-6。
表3 SP-19-1对HPAEC细胞TNF-α、IL-1β、IL-6的影响(n=3)
注:与正常组相比,*表示P<0.05,**表示P<0.01;与模型组相比,#表示P<0.05,##表示P<0.01。
3.4 SP-19-1对HPAEC细胞ET-1,NO,iNOS的影响
与空白对照组相比,模型组ET-1,iNOS水平极显著性升高(P<0.01),NO水平显著降低(P<0.01);与模型组相比,SP-19-1组能降低ET-1,iNOS的水平(P<0.01),升高NO的水平(P<0.01);而SP-19-1+C组ET-1,iNOS水平极显著性升高(P<0.01),NO水平显著降低(P<0.01),SP-19-1降低ET-1,iNOS,升高NO的作用消失,结果见表4、图7-9。
表4 SP-19-1对HPAEC细胞ET-1,NO,iNOS的影响(n=3)
注:与正常组相比,*表示P<0.05,**表示P<0.01;与模型组相比,#表示P<0.05,##表示P<0.01。
3.5 SP-19-1对HPAEC细胞ICAM-1、VCAM-1、E-selectin的影响
与空白对照组相比,模型组ICAM-1、VCAM-1、E-selectin蛋白的表达极显著性升高(P<0.01);与模型组相比,SP-19-1能降低ICAM-1、VCAM-1、E-selectin蛋白的表达(P<0.01或P<0.01),而SP-19-1+C组ICAM-1、VCAM-1、E-selectin蛋白的表达极显著性升高(P<0.01),SP-19-1降低ICAM-1、VCAM-1、E-selectin蛋白表达的作用消失,结果见表5、图10-12。
表5 SP-19-1对HPAEC细胞ICAM-1、VCAM-1、E-selectin的影响(n=3)
注:与正常组相比,*表示P<0.05,**表示P<0.01;与模型组相比,#表示P<0.05,##表示P<0.01。
3.6 SP-19-1对HPAEC细胞MCP-1的影响
与空白对照组相比,模型组MCP-1蛋白的表达极显著性升高(P<0.01);与模型组相比,SP-19-1能降低MCP-1蛋白的表达(P<0.01),而SP-19-1+C组MCP-1蛋白的表达极显著性升高(P<0.01),SP-19-1降低MCP-1蛋白的作用消失,结果见表6、图13。
表6 SP-19-1对HPAEC细胞MCP-1的影响(n=3)
注:与正常组相比,*表示P<0.05,**表示P<0.01;与模型组相比,#表示P<0.05,##表示P<0.01。
结论
急性肺损伤时血管内皮细胞既是受损的主要靶器官,也是活跃的效应细胞,有研究显示肺血管内皮细胞(pulmonary vasculary endothelial cell,PVEC)的改变在急性肺损伤中十分重要。肺血管内皮细胞在LPS、细胞因子、氧自由基等的作用下,其通透性增高,分泌和释放各种炎性介质和细胞因子,使得促炎和抗炎介质失衡。机体出现ALI时多种炎症因子(如TNF-α、IL-1β、IL-6)、黏附分子(ICAM-1、VCAM-1、E-selectin)、趋化因子(MCP-1)的表达均显著升高。在这些介质表达调控中,核转录因子NF-κB的激活和核移位是关键因素,内毒素等作用于血管内皮细胞使胞浆中NF-κB被其抑制因子IκB释放,成为其活性形式并迅速发生核移位,寻找特定靶基因启动子区的κB位点并与之结合,指导下游基因的表达调控。很多研究表明,阻断NF-κB通路对LPS诱导小鼠的急性肺损伤有保护作用,同时AMPK也是炎症调节过程中的一个关键因素。尽管活化的AMPK被证明具有抗炎作用,但是AMPK是否能够改善LPS诱导的HPAEC细胞损伤呢?同时内皮细胞也能够释放缩血管物质ET-1及扩血管物质NO,ET-1/NO平衡的破坏是动脉内皮受损的显著特征。iNOS的含量可以代表血管损伤的程度,故本实验通过检测细胞因子(TNF-α、IL-1β、IL-6),黏附分子(ICAM-1、VCAM-1、E-selectin),趋化因子(MCP-1)的表达,ET-1,NO、iNOS的含量,同时检测AMPK拮抗剂Compound C对其的影响,探讨化合物SP-19-1对LPS诱导的HPAEC细胞损伤的影响,初步揭示其作用机制,为其进一步的开发应用奠定基础。
LPS是细菌内毒素的主要成分,其毒性作用主要通过激发宿主细胞产生过强的反应来体现。从实验结果我们可以看出LPS能够造成HPAEC细胞的损伤,而给予SP-19-1后能够下注改善LPS诱导的细胞损伤。同时为了阐释AMPK拮抗剂Compound C对SP-19-1改善细胞损伤的影响,实验设置了SP-19-1+C组,实验结果显示,加入AMPK拮抗剂Compound C后,SP-19-1改善细胞损伤的活性消失,这也初步证明SP-19-1改善LPS诱导的细胞损伤可能与AMPK/NF-κB通路有关。
LPS引起的HPAEC细胞损伤本质是过度炎症反应,从实验结果我们可以看出模型组TNF-α、IL-1β、IL-6的水平显著升高,给予SP-19-1后TNF-α、IL-1β、IL-6的水平显著下降,而SP-19-1+C组TNF-α、IL-1β、IL-6的水平显著升高,显示SP-19-1降低炎症因子的作用消失。
NO是内皮功能稳定的关键,具有舒张血管、抑制血小板的粘附、抑制平滑肌细胞增殖、聚集以及单核细胞向内皮细胞的粘附等作用。而ET-1是目前所知作用最强的长效血管收缩剂,可以促进平滑肌细胞的增殖和巨噬细胞聚集、粘附。iNOS是一种在炎症因子刺激下产生的一种物质,其含量的多少可以代表血管损伤的程度。实验结果显示,LPS可以诱导HPAEC细胞的损伤,同时引起NO含量的降低,促进ET-1、iNOS的生成,给予SP-19-1后NO含量显著升高,ET-1、iNOS含量降低,而SP-19-1+C组NO含量降低,ET-1、iNOS含量升高,SP-19-1改善作用消失。
炎症反应产生的ICAM-1、VCAM-1、E-selectin、MCP-1等在ALI等疾病的发生发展中起了非常重要的作用,损伤的血管内皮细胞可能通过增加粘附因子、趋化因子的分泌,促进炎性细胞大量粘附于血管内皮管壁并聚集,加速炎症反应,造成血管内皮功能障碍,从实验结果我们可以看出模型组ICAM-1、VCAM-1、E-selectin、MCP-1的表达显著升高。给予SP-19-1后ICAM-1、VCAM-1、E-selectin、MCP-1表达显著降低,而加入AMPK抑制剂后Compound C,SP-19-1降低粘附因子及趋化因子的作用消失。
由上述可以看出,本发明在前期实验的基础上建立LPS诱导的HPAEC细胞损伤模型,筛选SP-19-1药物活性,并通过ELISA方法检测各组细胞上清液中TNF-α、IL-1β、IL-6的水平,ET-1、NO、iNOS的含量,各组细胞中VCAM-1、ICAM-1、E-selectin的水平及MCP-1的表达,同时检测AMPK拮抗剂Compound C对SP-19-1的影响,研究SP-19-1对HPAEC细胞损伤的保护机制,特别是通过研究试验,桑白皮有效单体SP-19-1对脂多糖(lipopolysaccharide,LPS)诱导的人肺动脉内皮细胞(Human pulmonary artery endothelial cells,HPAEC)损伤的保护作用及作用机制。建立LPS诱导的HPAEC细胞损伤模型,检测SP-19-1对其的保护作用,同时检测各组细胞上清液中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)的水平,内皮素(ET-1)、一氧化氮(NO)、一氧化氮合酶(iNOS)的含量,各组细胞的细胞粘附分子-1(vascular cell adhesion molecule-1,VCAM-1)、细胞间粘附分子-1(intercellular adhesion molecule-1,ICAM-1)、E-选择素(E-selectin)的水平及单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的表达,同时检测AMPK拮抗剂Compound C对SP-19-1的影响,探讨SP-19-1对HPAEC损伤的保护机制。实验结果表明,LPS能够造成HPAEC细胞的损伤(P<0.01),与正常组相比,模型组细胞TNF-α、IL-1β、IL-6的水平显著升高(P<0.05或P<0.01),ET-1的水平及iNOS的含量升高(P<0.01),NO的含量减少(P<0.01),粘附分子ICAM-1、VCAM-1、E-selectin及趋化因子MCP-1的水平显著升高(P<0.01)。与模型组相比,SP-19-1能够显著改善HPAEC的细胞损伤状况(P<0.01),降低TNF-α、IL-1β、IL-6的水平(P<0.05或P<0.01),降低ET-1的水平及iNOS的含量(P<0.01),升高NO的含量(P<0.01),降低粘附分子ICAM-1、VCAM-1、E-selectin及趋化因子MCP-1的水平(P<0.01)。SP-19-1对LPS诱导的HPAEC损伤具有保护作用,且其作用机制可能与AMPK/NF-κB通路有关。
总之,SP-19-1能够显著改善LPS引起的HPAEC细胞损伤,降低炎症因子TNF-α、IL-1β、IL-6的水平,升高NO含量,降低ET-1、iNOS含量,降低ICAM-1、VCAM-1、E-selectin、MCP-1表达,而加入AMPK抑制剂Compound C后,SP-19-1改善HPAEC损伤的作用消失,提示SP-19-1对LPS诱导的HPAEC细胞损伤具有保护作用,且其作用机制可能与AMPK/NF-κB有关。有效用于制备治疗LPS诱导的HPAEC损伤的药物,实现桑辛素M-6-O-β-D-葡萄糖苷(简称SP-19-1)在制备治疗LPS诱导的HPAEC损伤药物中的应用,开拓了桑白皮的药用价值和新用途,是治疗LPS诱导的HPAEC损伤药物上的创新,有良好的经济和社会效益。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于单核苷酸多态性的葡萄球菌种水平鉴定和菌株分型一体化方法与流程
- 一种用于检测奶牛乳腺炎性金黄色葡萄球菌青霉素耐药基因的分子标记及其应用的制造方法与工艺
- 用于定量检测灰霉菌的特异引物及其应用的制造方法与工艺
- 一种利用万寿菊花粕提取液为原料发酵生产虾青素的方法与应用与流程
- β‑葡萄糖苷酶在转化淫羊藿总黄酮制备宝霍苷I中的应用的制造方法与工艺
- miR319在培育抗灰霉病植物中的应用的制造方法与工艺
- 一种具有良好热稳定性的葡萄糖氧化酶纳米凝胶的制备方法与流程
- 一种来源于虎眼万年青的尿苷-5’-二磷酸半乳糖差向异构酶,其核苷酸序列及应用的制造方法与工艺
- 一种来源于虎眼万年青的尿苷-5’-二磷酸木糖差向异构酶,其核苷酸序列及应用的制造方法与工艺
- 一种碱性耐盐普鲁兰酶PulA及其基因和应用的制造方法与工艺