一种双齿围沙蚕抗肺癌多肽的制备方法与流程
本发明涉及一种海洋活性多肽,特别涉及一种双齿围沙蚕抗肺癌多肽的制备方法。
背景技术:
肺癌是全球范围内发病率最高的恶性肿瘤,近年来发病率、死亡率逐年上升,已成为肿瘤相关死亡的首要病因。肺癌约80%是非小细胞肺癌,在晚期肺癌中的比例达到总数的40%~50%。目前对于非小细胞肺癌的治疗早期是手术切除,晚期主要是化疗,但化疗的毒副作用及产生的耐药性,影响治疗的有效性,因此寻找精准治疗是热门话题。海洋是一个巨大的药物宝库,从海洋中寻找活性物质已成为热点,并从中分离获得多种活性物质,如肽类、多糖、生物碱、萜类、大环内脂等,有望开发成新型的抗肿瘤药物,如从海兔获得的dolastatin 10已进入临床试验。沙蚕(Nereis)属于环节动物门(Annelida)多毛纲(Polychaeta)沙蚕科(Nereididae),又称为海虫、海蜈蚣、海蚂蟥等,其生物资源丰富,广泛分布在我国沿海地区,近年来人工养殖用于钩鱼的诱饵。沙蚕是一种传统的海洋中药,有清热解毒,消肿止痛,敛疮生肌,主治痈疮肿毒等功效。学者们从沙蚕体内获得了具有良好药理活性的物质。吉林大学从日本刺沙蚕体内分离出一种沙蚕丝氨酸蛋白酶,该蛋白酶抑制血小板聚集,改变血液流变学特性,可作为降纤和溶栓药物,预防和治疗心、脑梗塞,脑动脉、肺动脉血栓形成等疾病。然沙蚕酶解多肽的研究较少,而对非小细胞肺癌A549细胞的抑制活性目前尚未见报道。
技术实现要素:
本发明的目的在于提供一种双齿围沙蚕抗肺癌多肽的制备方法,安全性好,反应条件温和,过程控制容易,所得双齿围沙蚕抗肺癌多肽纯度高,对肺癌细胞A549和H1299有明显的增殖抑制作用,具有较好的医学应用价值。
本发明解决其技术问题所采用的技术方案是:
一种双齿围沙蚕抗肺癌多肽的制备方法,步骤如下:
(1)样品预处理:将双齿围沙蚕解冻后,清洗干净,匀浆,得到匀浆液;
(2)酶解:按照每克匀浆液加1mL纯净水的配比,将匀浆液与纯净水混匀,调节pH至11,加入碱性蛋白酶,酶解后得酶解液;
(3)超滤:酶解液灭活,离心,取上清液,经超滤获得分子量1ku以下、1ku<分子量≤3ku、3ku<分子量≤5ku、5ku<分子量≤8ku以及8ku<分子量≤30ku的五种组分的活性组分,MTT法筛选对肺癌细胞A549增殖抑制率最高的活性组分;
(4)阴离子交换层析:收集步骤(3)获得的对肺癌细胞A549增殖抑制率最高的活性组分,冷冻干燥,经DEAE-Sepharose Fast Flow阴离子交换层析,梯度洗脱,在280nm进行检测,分别收集各洗脱峰并冷冻干燥,MTT法筛选对肺癌细胞A549增殖抑制率最高的阴离子交换层析产物;
(5)Sephadex G25凝胶层析:将步骤(4)获得的对肺癌细胞A549增殖抑制率最高的阴离子交换层析产物采用Sephadex G-25凝胶层析分离纯化,蒸馏水洗脱,在280nm进行检测,分别收集各洗脱峰并冷冻干燥,MTT法筛选对肺癌细胞A549增殖抑制率最高的Sephadex G25凝胶层析产物;
(6)高效液相色谱分离纯化:对步骤(5)获得的对肺癌细胞A549增殖抑制率最高的Sephadex G25凝胶层析产物经滤膜过滤后用采用反相高效液相色谱法分离纯化,收集主峰,冷冻干燥后获得双齿围沙蚕抗肺癌多肽。
本发明首次通过酶解的方法从沙蚕体内提取获得具有抗肺癌作用的多肽,对肺癌细胞A549和H1299有明显的增殖抑制作用,具有较好的医学应用价值。
作为优选,步骤(2)按照每克匀浆液加300U的加酶量加入碱性蛋白酶,50℃酶解6小时得酶解液。
作为优选,步骤(4)DEAE-Sepharose Fast Flow阴离子交换层析的分离条件为:pH 7.2、0.2mM的Tris-HCl缓冲溶液平衡柱子后,将样品配成250mg/mL,每次上样量为2mL,每次上样前过0.22μm的膜。
作为优选,步骤(5)蒸馏水洗脱的洗脱流速为1.1mL/min。
作为优选,步骤(6)反相高效液相色谱法分离纯化的色谱条件:色谱柱:ZORBAX SB-C18分析型色谱柱;检测波长:280nm;流速:0.5mL/min;流动相A为含0.05%三氟乙酸的乙腈,流动相B为含0.05%三氟乙酸的超纯水,采用梯度洗脱方式:20%~100%A洗脱5~20min;平衡时:流动相A与流动相B的流动相体积比为20:80;柱温:25℃;自动进样,进样量:10μL。
本发明的有益效果是:安全性好,反应条件温和,过程控制容易,所得双齿围沙蚕抗肺癌多肽纯度高,对肺癌细胞A549和H1299有明显的增殖抑制作用,具有较好的医学应用价值。
附图说明
图1五种蛋白酶酶解物对A549细胞的抑制率。
图2不同分子量的沙蚕多肽对A549细胞增殖的影响。
图3阴离子DEAE Sepharose Fast Flow洗脱峰。
图4葡聚糖凝胶柱洗脱峰。
图5反相高效液相色谱柱洗脱峰。
图6 PAP对A549细胞活性的影响。
图7 PAP对H1299细胞活性的影响。
图8倒置显微镜下的A549细胞(×200)。
图9倒置显微镜下的H1299细胞(×200)。
图10 A549细胞形态,AO/EB染色(×200)。
图11 H1299细胞形态,AO/EB染色(×200)。
图12 PAP对A549细胞形态变化的影响,24h Hoechst 33258染色(×200)。
图13 PAP对H1299细胞形态变化的影响,24h Hoechst 33258染色(×200)。
图14 A549细胞Annexin V-FITC/PI双染24h。
图15 H1299细胞Annexin V-FITC/PI双染24h。
图16 A549细胞线粒体膜电位的变化24h。
图17 H1299细胞线粒体膜电位的变化24h。
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步的具体说明。
本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
实施例:
1材料与方法
1.1原料
1.1.1样品与试剂
沙蚕购于舟山市水产养殖场,经浙江海洋大学赵盛龙教授鉴定为双齿围沙蚕(Perinereies aibuhitensis),鲜活购买后待用。Folin试剂,上海如吉生物科技发展有限公司;酪氨酸,上海如吉生物科技发展有限公司;胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和胃蛋白酶,北京亚太恒信生物科技有限公司;酪蛋白,北京亚太恒信生物科技有限公司;胎牛血清,杭州四季青生物工程有限公司;1640粉末培养基,Gibco公司;四甲基偶氮唑蓝(MTT),美国sigma公司;二甲基亚砜(DMSO),美国sigma公司;美国sigma公司;JC-1线粒体膜电位检测试剂盒,南京凯基生物发展有限公司;细胞凋亡检测试剂盒,北京贝博生物科技有限公司;其它试剂均为分析纯。
1.1.2细胞
人肺癌A549和H1299细胞株均购自中科院上海细胞库,由本实验室传代培养。
1.2主要仪器与设备
DS-1组织捣碎机,上海标准模型厂;SSW-420-2S恒温水浴锅,上海民仪电子有限公司;GF16RXII日立高速低温离心机,日本HITACHI公司;ALPHA 1-4/LDplus型冷冻干燥机,德国CHRIST公司;BSA124S型电子天平,德国SatoriusAG公司;ZHJH-C1209C型超净工作台,上海智证分析仪器制造公司;Forma3111型CO2培养箱,美国Thermo公司;酶标仪,美国Bio-Rad公司产品;BX2-FLB3荧光显微镜和CCD-NC6051显微摄像,日本OLYMPUS公司;WRO-70型超纯水仪和easy Cyte6 HT-2L流式细胞仪,美国Millipore公司。
1.3方法
1.3.1沙蚕酶解液的制备工艺过程
采用胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和胃蛋白酶五种蛋白酶对原料进行酶解。利用正交试验设计酶解实验,以氨基氮含量和抗肺癌A549细胞增殖活性为指标的影响,考虑到A(温度)、B(pH)、C(料液比)、D(酶解时间)和E(加酶量)这五个因素对指标的影响,每个因素设定四个水平进行L16(45)的正交实验。根据实验结果比较五种酶在不同水解条件下的水解度和抗肿瘤活性,从而确定原料的最佳酶种及最佳的酶解条件。酶解工艺如下:首先将保存在-80℃的沙蚕解冻后进行匀浆,用0.1mol/L的HCL和0.5mol/L的NaOH溶液将匀浆液调到蛋白酶最适pH值,再加入适量蛋白酶,在水浴锅中进行酶解。酶解完成后,在100℃中灭活10min,使蛋白酶失去活性。将酶解液12000r/min离心15min,取上清液测定氨基氮(ANN)含量,将其余酶解液冷冻干燥后测定酶解物的抗肿瘤活性。
1.3.1.1最佳蛋白酶种类的选择
通过上述正交试验结果可知,胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和胃蛋白酶五种蛋白酶酶解沙蚕的最佳酶解条件,在上述最佳酶解条件下,分别对沙蚕进行酶解,12000r/min条件下离心得上清液,冷冻干燥后测定各种蛋白酶酶解物的IR值选择最佳蛋白酶。
1.3.1.2沙蚕多肽的制备
将沙蚕全体洗干净后进行匀浆,按照最佳蛋白酶的最佳酶解条件对沙蚕进行酶解。酶解结束后在100℃下在水浴中灭活10min。冷却后在12000r/min在冷冻高速离心机中离心15min后收集上清液,-20℃冰箱中保存备用。
1.3.1.3酶解多肽的初步分离
酶解获得的上清液用超滤系统进行超滤分离,获得了分子量1ku以下、1ku<分子量≤3ku、3ku<分子量≤5ku、5ku<分子量≤8ku以及8ku<分子量≤30ku的五种组分的活性组分,并命名为PAP-1、PAP-2、PAP-3、PAP-4、PAP-5。将以上组分收集冷冻干燥后,经抗肺癌细胞A549细胞进行细胞增殖抑制活性筛选后,大量收集抗肺癌活性较高的组分,浓缩冷冻干燥,-20℃冰箱中保存备用。
1.3.1.4沙蚕多肽经过阴离子交换柱DEAE Sepharose Fast Flow层析分离
将1.3.1.3步中得到的抑制肺癌细胞A549增殖活性最强的组分用阴离子柱DEAE Sepharose Fast Flow进一步分离。分离条件:0.2mM的Tris-HCl(pH 7.2)缓冲溶液平衡柱子后,将样品配成250mg/mL,每次上样量为2mL,每次上样前过0.22μm的膜。分别用Tris-HCl(pH 7.2)与NaCl溶液(0~1mol/L)进行梯度洗脱,每个浓度洗脱一个柱体积,洗脱速度为5mL/min,在280nm进行检测,分别收集各洗脱峰,并冷冻干燥,-20℃冰箱中保存备用。将干燥后得到的各个峰组分采用MTT法进行A549细胞增殖抑制率测定,确定目标肽所在的洗脱峰,并对该峰大量收集,冷冻干燥,作为进一步分离纯化所用样品。
1.3.1.5沙蚕多肽经过葡聚糖凝胶Sephadex G-25层析分离
将上步中收集到的增殖活性最强的组分进行进一步分离纯化。将冷冻干燥的样品配置成200mg/mL溶液,上样量2mL。离心取上清液,经0.22μm滤膜过滤后,将溶液过Sephadex G-25柱进行层析分离,以蒸馏水为洗脱液将柱平衡和洗脱;调节洗脱流速为1.1mL/min,每管收集3.5min,在280nm处检测吸光度,收集各峰分的洗脱液,将其进行浓缩冷冻干燥。将干燥后得到的各个峰组分采用MTT法进行A549细胞增殖抑制率测定,确定目标肽所在的洗脱峰,并对该峰大量收集,浓缩冷冻干燥,-20℃冰箱中冷冻备用。
1.3.1.6高效液相分离纯化
将上步抑制A549细胞增殖最强的收集的峰分进一步的分离纯化,反相高效液相纯化色谱条件:色谱柱:ZORBAX SB-C18分析型色谱柱(填料粒径5μm 4.6×150mm);检测波长:280nm;流速:0.5mL/min;流动相A为乙腈(含0.05%三氟乙酸),流动相B为超纯水(含0.05%三氟乙酸),采用梯度洗脱方式(20%~100%A洗脱5~20min),平衡时:流动相A与流动相B的流动相体积比为20:80;柱温:25℃;自动进样,进样量:10μL。
1.3.1.7目标肽的N端测序
使用氨基酸测序仪采用N端氨基酸测序法对纯化的多肽的氨基酸序列进行测定,最终以PAP命名该活性多肽。
1.3.2细胞培养
将肺癌细胞A549和H1299在含有双抗溶液(青霉素100IU/mL、链霉素100IU/mL)以及10%胎牛血清的1640培养液中培养。置于37℃、含有5%CO2的培养箱中孵育,待长满80%以上时用含0.25%的胰蛋白酶进行消化传代,取处于对数生长期的细胞进行实验。
1.3.3抗肺癌细胞活性检测
1.3.3.1 MTT法测定细胞抑制活性
配制实验所需要的PBS缓冲液(PH值为7.2)、MTT、适量浓度的沙蚕酶解液。将人肺癌细胞每孔1×105个/mL细胞数接种于96孔培养板中,每孔培养液200μL。常规条件下培养24小时后,分别设置正常对照组、空白对照组和用药组,每组设定3~4个复孔,置常规培养条件下培养一段时间,加入含有10%MTT的200μL的PBS缓冲溶液,在常规培养条件下孵育4小时。实验毕,弃去96孔板中的液体,每孔加入150μL的DMSO,充分震荡10min。置于酶标仪中,490nm处测定吸光值,计算细胞增殖抑制率(IR),计算公式如下:
式中:A1为正常对照组的吸光度;A2为用药组的吸光度;A0为空白对照组的吸光度。
1.3.3.2倒置显微镜下观察细胞形态
将浓度约为1×105/mL的肺癌细胞A549细胞和H1299细胞接种于六孔板的载玻片上,在常规的培养条件下培养24小时,使细胞长到80%左右。弃去培养液,按250mg/L、500mg/L、1000mg/L的药物浓度加入到六孔板中,并设立空白对照组,继续培养24小时,在倒置显微镜下观察并拍照。1.3.3.3 AO/EB荧光染色观察细胞形态
细胞接种与实验分组同上。24h后,取盖玻片,用95%乙醇固定30min。取AO和EB各1mg分别溶解于10mL pH 7.2的PBS缓冲液中,摇匀混合,现配现用,避光保存。观察前于载玻片上滴加50μL PBS和6μL AO/EB混合液,有细胞的一面朝下,荧光显微镜下观察并拍照。
1.3.3.4 Hoechst 33258染色
通过Hoechst 33258荧光染色法观察细胞的凋亡过程中细胞的形态变化,实验操作步骤如下所述,选取对数生长期的肺癌细胞株A549和H1299细胞制成约为1×105/mL个单细胞悬液,均匀接种于六孔细胞培养板中,每孔约2mL,放置于37℃、5%CO2细胞培养条件下24h,分别给予不同浓度的250mg/L、500mg/L和1000mg/L作用细胞,另外设置实验空白对照组,继续进行培养。24h后终止对各组细胞的培养,每孔中给予4%多聚甲醛固定20min,然后再用PBS冲洗,用Hoechst 33258荧光染液(终浓度为0.5~10mg/L)常温染色15min,再次用PBS冲洗,最后置于倒置荧光显微镜下观察PAP作用后的A549和H1299细胞的形态学变化并拍照。1.3.3.5流式细胞仪分析细胞凋亡率
A549细胞和H1299细胞约为1×105/mL接种于25mL的培养瓶中,常规培养24h后分别加入含250mg/L、500mg/L和1000mg/L的PAP的培养液继续培养,设立空白对照组。继续培养24h后,参照凋亡试剂盒中的操作方法进行。胰蛋白酶消化,预冷的PBS悬浮细胞,1000r/min离心5min。去上清,加入1×Annexin V结合液400μL吹打混匀。加入5μL Annexin V-FITC染液,混匀后避光孵育15min后,再加入10μL的PI染液,室温下暗室静置5min后过200目筛子,再用流式细胞仪进行检测。
1.3.3.6细胞线粒体膜电位的检测
A549细胞和H1299细胞约为1×105/mL接种在25mL的培养瓶中,常规培养24h后加入分别含250mg/L、500mg/L和1000mg/L的PAP的培养液继续培养,设立空白对照组。继续培养24h后,细胞膜电位检测参照试剂盒中的操作方法进行。培养结束,胰酶消化细胞转移到离心管中,再用3mL PBS洗涤细胞两次,1000r/min离心5min,收集细胞;取500μL 1×Incubation Buffer,加1μL的JC-1;吸取500μL的JC-1工作液将细胞悬浮,放置于37℃、5%CO2条件下的细胞培养箱中孵育20min;1500r/min离心5min并收集细胞,用1×Incubation Buffer悬浮细胞,重复两次;最后将用1×Incubation Buffer悬浮均匀的细胞过200目筛子,置于流式细胞仪进行检测。
1.3.4数据处理
采用SPSS19.0统计软件,对数据进行分析,结果以x±s表示。
2结果与分析
2.1最佳蛋白酶种类的选择
Trypsin(胰蛋白酶)、Papain(木瓜蛋白酶)、Alcalase(碱性蛋白酶)、Dispase(中性蛋白酶)和Pepsin(胃蛋白酶)五种蛋白酶在最佳酶解条件下,分别对沙蚕进行酶解,12000r/min条件下离心15min得上清液,冷冻干燥后测定各种蛋白酶酶解物的IR值,结果如图1所示,由图1可知,Trypsin(胰蛋白酶)、Papain(木瓜蛋白酶)、Alcalase(碱性蛋白酶)、Dispase(中性蛋白酶)和Pepsin(胃蛋白酶)五种蛋白酶酶解物对H1299细胞增殖的抑制率分别为56.67%、46.29%、62.07%、47.78%、60.51%,其活性大小顺序为:Alcalase>Pepsin>Trypsin>Dispase>Papain。由此可见,在最佳酶解条件下,碱性蛋白酶酶解物的抗肺癌的活性最强。
胰蛋白酶的最佳酶解条件为温度为45℃、pH值为9、料液比为1:3、酶解时间为4h、加酶量为300U/g。木瓜蛋白酶的最佳酶解条件为:温度为55℃、pH值为7、料液比为1:2、酶解时间为4h、加酶量为300U/g。中性蛋白酶的最佳酶解条件为:温度为45℃、pH值为8、料液比为1:1、酶解时间为6h、加酶量为900U/g。胃蛋白酶的最佳酶解条件为:温度为35℃、pH值为1、料液比为1:1、酶解时间为8h、加酶量为300U/g。
2.1.1碱性蛋白酶正交实验结果
以温度、pH值、料液比、时间和加酶量为因素,以ANN和IR值为测量指标进行正交实验,考查了碱性蛋白酶酶解物在不同酶解条件下的水解程度和抗肿瘤活性,其结果如表3。
表1碱性蛋白酶正交实验设计及结果L16(45)
利用极差法对表1进行分析,比较极差R的大小可以看出,影响ANN值的的各因素的主次关系为:A>B>C>E>D。对于ANN值影响最大的因素是A(温度);此时的最佳酶解条件为A2B2C2D3E3,即为:温度为40℃、pH值为9、料液比为1:2、酶解时间为6h、加酶量为900U/g。
影响IR值的的各因素的主次关系为:C>E>A>B>D。对于IR值影响最大的因素是C(料液比);此时的最佳酶解条件为A4B4C1D3E1,即为:温度为50℃、pH值为11、料液比为1:1、酶解时间为6h、加酶量为300U/g。
2.2沙蚕多肽的分离纯化
2.2.1沙蚕多肽的超滤截留
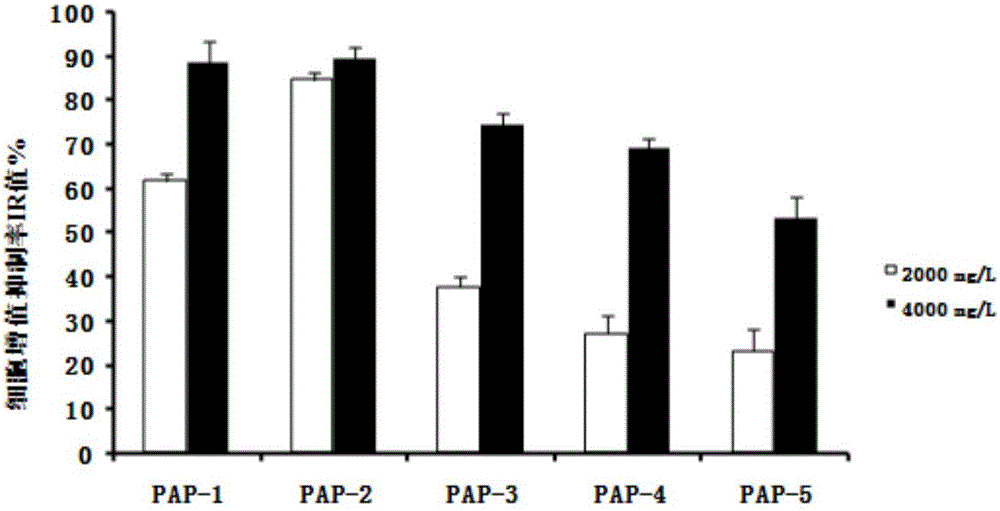
将碱性蛋白酶酶解获得的沙蚕多肽经超滤得到五个组分PAP-1、PAP-2、PAP-3、PAP-4、PAP-5。采用MTT法得到对A549细胞的IR值,结果如图2所示,PAP-2对A549细胞的增殖抑制率最高。故选定PAP-2进行进一步分离纯化。
2.2.2 DEAE Sepharose Fast Flow分离结果
将上述步骤得到的PAP-2经DEAE Sepharose Fast Flow分离得到PAP-2-1、PAP-2-2、PAP-2-3、PAP-2-4四个洗脱峰如下图3所示,以2000mg/L的浓度作用于A549细胞24h后的IR为14.1±2.7%、24.3±3%、41.9±1.5%、46.7±5.0%;4000mg/L对A549细胞的IR值则为28.0±3.0%、49.6±2.2%、79.3±4.1%、77.3±1.8%。故选定PAP-2-3进行进一步分离纯化。
2.2.3 Sephadex G-25分离结果
将上述步骤得到的PAP-2-3经Sephadex G-25分离得到PAP-2-3-1、PAP-2-3-2两个洗脱峰如图4所示,采用MTT法检测对A549细胞的抑制活性。结果显示当两个峰的浓度为1000mg/L时,两个峰的IR值分别是48.2±3.3%,74.4±2.4%;2000mg/L时,IR值分别为75.9±2.1%,95.1±1.8%。峰ⅡPAP-2-3-2的活性最高,故用高效液相色谱仪将峰PAP-2-3-2进一步的分离纯化。
2.2.4活性肽的纯化及其N端氨基酸检测结果
PAP-2-3-2经反相高效液相色谱洗脱纯化,当洗脱时间分别为:4.296min、4.584min、4.968min、5.602min、6.075min时,出现如图5所示的峰Ⅰ、峰Ⅱ、峰Ⅲ、峰Ⅳ、峰V四个洗脱峰,收集峰V(PAP),冷冻干燥备用。经检测,该目标肽的氮端氨基酸序列是Ile-Glu-Pro-Gly-Thr-Val-Gly-Met-Met-Phe(SEQ ID No.1)。
2.3抗肺癌细胞活性研究
2.3.1PAP对A549细胞活性的影响
不同浓度PAP作用后对A549和H1299细胞活性的影响如图6,图7所示,当PAP浓度为250mg/L作用细胞24h时,A549和H1299细胞活性的抑制率分别为17.02%和13.08%,当PAP浓度增加至1000mg/L时,抑制率分别达到83.44%和85.3%,半数抑制浓度率(IC50)分别为662mg/L、665mg/L;随着作用时间的延长,作用48h时,IC50分别为571mg/L、561mg/L;作用72h时,IC50分别为487mg/L、486mg/L。随着PAP浓度的增加和作用时间的延长,抑制指数明显上升,与对照组相比有统计学意义(P<0.05)。
2.3.2倒置显微镜下观察结果
结果如图8、9所示,正常组的A549和H1299细胞生长良好,细胞间排列紧密,形态饱满。PAP作用24h后,如250mg/L组A549和H1299细胞出现细胞间隙增大,轮廓模糊,形态不规则;高浓度1000mg/L组细胞变圆变亮,形态和正常细胞有明显的区别,同时可见在培养液中悬浮着较多的死细胞。
2.3.3 AO/EB荧光观察结果观察细胞形态
PAP作用于A549和H1299细胞24h后,细胞经AO/EB染色,出现了明显的早期凋亡的形态学特征。实验结果如图10、11所示,正常对照组无明显凋亡细胞出现,细胞大小均匀,细胞核形态规则,胞核及胞浆均呈现绿色荧光;250mg/L组细胞出现早期凋亡的现象,胞质及胞核发生了变化,胞质出现空泡,并呈现强黄绿色荧光。随着用药浓度的增加,1000mg/L组早期凋亡的细胞和晚期凋亡的细胞明显增多,细胞核呈固缩状,呈现橘红色荧光。
2.3.4 Hoechst 33258染色检测结果
Hoechst 33258染色可以用来观察沙蚕多肽对肺癌细胞A549和细胞凋亡的形态学变化。如图12、13所示,当不同浓度的沙蚕多肽作用于A549和H1299细胞24h后,可以看到空白对照组呈现均匀的蓝色荧光,沙蚕多肽作用后,可以看见细胞的染色质聚集及边集化明显,而且蓝色的荧光变亮,细胞核断裂皱缩呈现出块状或点状的蓝色荧光,视野中细胞数明显减少,细胞形态学的变化随着药物浓度的增加也显得越明显。
2.3.5流式细胞术检测结果
本实验采用Annexin V-FITC/PI双染的方法检测细胞早期凋亡率。以FITC和PI荧光作双参数点图,细胞分成4个区:左下象限(LL)代表正常细胞;左上象限(UL)代表机械损伤细胞;右下象限(LR)为早期凋亡细胞;右上象限(UR)为凋亡晚期或坏死细胞。如图14所示,对照组A549细胞基本分布在LL区域,早期凋亡率为7.52%,但以不同浓度的PAP作用后,早期凋亡细胞明显增多,当PAP浓度达到1000mg/L时,早期凋亡率达到33.44%。从图15中可见,加以不同浓度的PAP作用于H1299细胞24h后,LR早区域的早期凋亡细胞数量增多,随用药浓度的增加,H1299细胞的早期凋亡率也随之增加。当PH浓度达到1000mg/L时,细胞早期凋亡率达到44.42%。
2.3.6细胞中线粒体膜电位的变化结果
细胞内线粒体对JC-1染料的摄取依赖于线粒体的膜电位,正常情况下A549细胞线粒体的膜电位比较高,呈现出红色荧光。当细胞受到损伤后,线粒体的膜电位就会下降,出现由红色荧光向绿色荧光的转变。当PAP作用A549细胞24h后,如图16所示,右上象限表示为正常线粒体膜电位所占细胞的百分率,右下象限则为线粒体膜电位降低的细胞百分率。如实验结果显示,250mg/L组可使4.91%的细胞呈绿色荧光(即膜电位降低),500mg/L、1000mg/L组分别可使12.91%、26.69%的细胞呈现绿色荧光。当PAP作用H1299细胞24h后,如图17所示,250mg/L组可使8.58%的细胞呈绿色荧光(即膜电位降低),500mg/L、1000mg/L组分别可使11.51%、22.69%的细胞呈现绿色荧光。
3讨论
本发明使用了胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和胃蛋白酶五种酶,以细胞增殖抑制率IR为指标,确定沙蚕多肽的最佳蛋白酶是碱性蛋白酶。为确定碱性蛋白酶的适宜酶解条件范围,试验以酶解物ANN含量为指标,对每个因素分别进行试验,根据单因素试验结果设计正交试验。通过L16(45)正交实验优化酶解工艺,得到沙蚕多肽的关键技术是温度为50℃、pH值为11、料液比为1:1、酶解时间为6h、氨基酸序列为Ile-Glu-Pro-Gly-Thr-Val-Gly-Met-Met-Phe。
本发明采用MTT法对PAP对A549和H1299细胞的增殖抑制活性进行了检测,实验结果表明,沙蚕多肽对于A549和H1299细胞的抑制活性具有时间和剂量依赖关系,即随着PAP浓度的增加和时间的延长,细胞的抑制率明显上升。当浓度为1000mg/L的PAP作用于A549细胞72h后,IR值达到95.08%,IC50为487mg/L;作用于H1299细胞72h后,IR值达到91.36%,IC50为486mg/L。
细胞在形态学上的特征性改变是证明其发生凋亡的有力证据。通过倒置显微镜、荧光染色实验的变化可以很直观地看到细胞早期凋亡的形态学上变化。在本发明中,通过细胞形态学实验,观察到PAP作用后,A549和H1299细胞表现出明显的细胞形态学变化,如细胞间隙变大、形态不规则、体积变小、部分细胞出现空泡及凋亡小体等,随浓度增加效果更加显著。
细胞凋亡是一种由基因调控的高度保守的细胞主动死亡过程,在多细胞有机体的生长发育、维持组织同源性等过程中起重要作用。线粒体膜电位下降是凋亡的早期表现,一旦线粒体膜电位损耗,细胞就会进入不可逆的凋亡过程。通过流式细胞仪对细胞的早期凋亡率和细胞内线粒体膜电位进行检查发现,250mg/L的PAP作用于肺癌细胞A549 24h后,早期凋亡率7.52%,线粒体膜电位出现小幅下降,而1000mg/L的PAP作用后凋亡率达到33.44%,下降率达到26.69%。250mg/L的PAP作用于肺癌细胞H1299 24h后,早期凋亡率4.18%,线粒体膜电位出现小幅下降,而1000mg/L的PAP作用后凋亡率达到39.95%,下降率达到22.91%。细胞的早期凋亡率和,线粒体膜电位下降所占百分率都随药物作用浓度增加明显增加,由此推测肺癌细胞A549和H1299的凋亡与线粒体凋亡信号通路有关。
总之,经碱性蛋白酶提取的沙蚕多肽PAP在体外可以有效抑制A549和H1299细胞的增殖,并具有剂量和时间依赖性,作用24h后A549和H1299细胞即表现出明显的细胞凋亡特征。
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
SEQUENCE LISTING
<110> 浙江海洋大学
<120> 一种双齿围沙蚕抗肺癌多肽的制备方法
<130> 2016.11
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 10
<212> PRT
<213> 双齿围沙蚕
<400> 1
Ile Glu Pro Gly Thr Val Gly Met Met Phe
1 5 10
- 还没有人留言评论。精彩留言会获得点赞!