一种钾离子通道毒素衍生多肽及其制备方法与应用与流程
本发明属于生物技术领域,具体涉及一种钾离子通道毒素衍生多肽及其制备方法与应用。
背景技术:
东亚钳蝎是我国主要的蝎种,是实验研究最为热点的一个蝎种。蝎毒液成分复杂,毒液毒性较低,各成分之间生理活性多样,具有抗癫、抗栓、抗炎、抗肿瘤、中枢镇痛等重要治疗作用。目前很多有药用价值的蝎毒多肽都是从东亚钳蝎中分离得到的。蝎毒多肽按其作用的离子通道进行分类,可分为:Na+通道、K+通道、Cl-通道和Ca2+通道四种。离子通道不仅直接与兴奋细胞有关,还可进一步影响和控制递质释放、肌肉运动、细胞分裂生殖,甚至对学习及维持细胞内环境稳定也起着重要作用。其中,钾离子通道亚型最多,分布最广,几乎存在于所有的真核细胞并发挥着多种至关重要的生物学功能。
多肽药物的研发及多肽先导化合物的发现是一项耗资巨大、风险较高的工程。近年来,以各种理论计算方法和分子模拟技术为基础的计算机辅助设计在各种多肽药物的研发中得到广泛应用。程远国等依据HIV膜融合蛋白gp41的空间结构进行全新设计和合成的抗艾滋病药物西夫韦肽在Ⅰ期、Ⅱ期临床试验中均具有良好的抗病毒效果(Meng Q, Dong T, Chen X, et al. Pharmacokinetics of sifuvirtide in treatment-naive and treatment-experienced HIV-infected patients [J]. J Pharm Sci, 2014, 103 (12): 4038-4047.)。多肽药物的成药性高于一般化学药物,其生物活性高、毒性低、可快速消除、副作用小,越来越多的多肽用于临床治疗。但多肽分子也有不足之处,即稳定性较差,在体内易降解,需要连续给药以维持药效,给患者带来不便。计算机辅助设计可以从源头进行多肽链的设计,在保证药效前提下,用其他氨基酸替代易被酶切割的氨基酸从而延长多肽分子的半衰期。
天然蝎毒产量极低,其中的活性多肽种类繁多且结构极为相似,单组分分离纯化非常困难,严重的制约其进一步开发研究。采用基因工程方法,用简单的原核或真核生物表达宿主生产具有药用价值的活性多肽的方法显得尤为重要。在世界范围内,已经获得蝎毒基因几百条,然而能够成功进行表达产生有效蝎毒成分的基因却仅有十几条。其难点主要是产量太低,无法进行后序工作、形成不可溶的包涵体、不能正确折叠成为有活性的蛋白质、对表达宿主有毒或者与宿主不匹配而完全不能表达等。
技术实现要素:
本发明的目的是在于提供一种根据东亚钳蝎钾离子通道毒素通过计算机辅助设计得到的衍生多肽BmKT4及该多肽的编码序列,该多肽含37个氨基酸,水溶性好,生物活性高。
本发明的另一目的是在于提供钾离子通道毒素衍生多肽BmKT4的制备方法。该方法简单易行,生产成本低廉,纯化简单。
本发明的再一目的是在于提供钾离子通道毒素衍生多肽BmKT4在秀丽线虫产卵及寿命方面的应用。
为了实现上述目的,本发明采用以下技术方案:
一种钾离子通道毒素衍生多肽BmKT4,其氨基酸序列如下所示:
BmKT4:VGINVTCTNSQQCYNPCGDAGMQYGKCTYGKCHCQPQ(SEQ ID NO.1)。
编码所述钾离子通道毒素衍生多肽BmKT4的基因的核苷酸序列优选如下:
gtgggcattaacgtgacctgcaccaacagccagcagtgctataacccgtgcggcgatgcgggcatgcagtatggcaaatgcacctatggcaaatgccattgccagccgcagtga(SEQ ID NO.2)。
所述的钾离子通道毒素衍生多肽BmKT4的制备方法,包括如下步骤:
(1)以上述编码BmKT4的基因(SEQ ID NO.2)为模板设计含有酶切位点的上、下游引物进行PCR扩增。
(2)用限制性内切酶对PCR产物和表达载体pGEX-4T-1分别进行酶切,酶切后的PCR产物和载体通过T4 DNA连接酶连接,构建重组表达载体pGEX-BmKT4。
(3)连接产物转化大肠杆菌Rossetta(DE3)感受态细胞,筛选重组表达载体转化成功的大肠杆菌,得到表达多肽BmKT4的重组大肠杆菌Rossetta(DE3)/pGEX-BmKT4。
(4)重组大肠杆菌Rossetta(DE3)/pGEX-BmKT4通过IPTG(异丙基-β-D-半乳糖苷)诱导及GST亲和层析纯化得到含多肽BmKT4的融合蛋白。
步骤(1)中设计的引物优选如下:
引物P1:5’-GCC GGATCCGATGACGATGACAAG GTGGGCATTAAC-3’(SEQ ID NO.3),该引物含有BamHI限制性内切酶酶切位点和小肠激酶酶切位点;
引物P2:5’-TAT CTCGAG TCACTGCGGCTGGCAATGGCATTTGCC-3’(SEQ ID NO.4),该引物含有XhoI限制性内切酶酶切位点。
GST对底物的亲和力是亚毫摩尔级的,因此谷胱甘肽固化于琼脂糖形成的亲和层析树脂对GST及其融合蛋白的纯化效率很高,可生产大量可溶融合蛋白。由于PCR上游引物中含有小肠激酶酶切位点基因序列,这使得重组大肠杆菌表达获得的融合蛋白谷胱甘肽转移酶-蝎钾离子通道毒素衍生多肽中含有了小肠激酶酶切位点,从而通过小肠激酶酶切就可以分开谷胱甘肽转移酶和钾离子通道毒素衍生多肽BmKT4,以获得不含有额外氨基酸的钾离子通道毒素衍生多肽BmKT4。通过上述方法生产的融合蛋白呈可溶的、非包涵体状态,具有良好的活性。
所述的钾离子通道毒素衍生多肽BmKT4在延长秀丽线虫寿命方面的应用。
所述的钾离子通道毒素衍生多肽BmKT4在提高秀丽线虫产卵数、使秀丽线虫产卵时间提前方面的应用。
本发明具有如下优点和有益效果:本发明的钾离子通道毒素衍生多肽BmKT4水溶性好,生物活性高,能够用于延长秀丽线虫寿命、提高其产卵数、使其产卵时间提前。按照本发明方法制备BmKT4简单易行,生产成本低廉,纯化简单。
附图说明
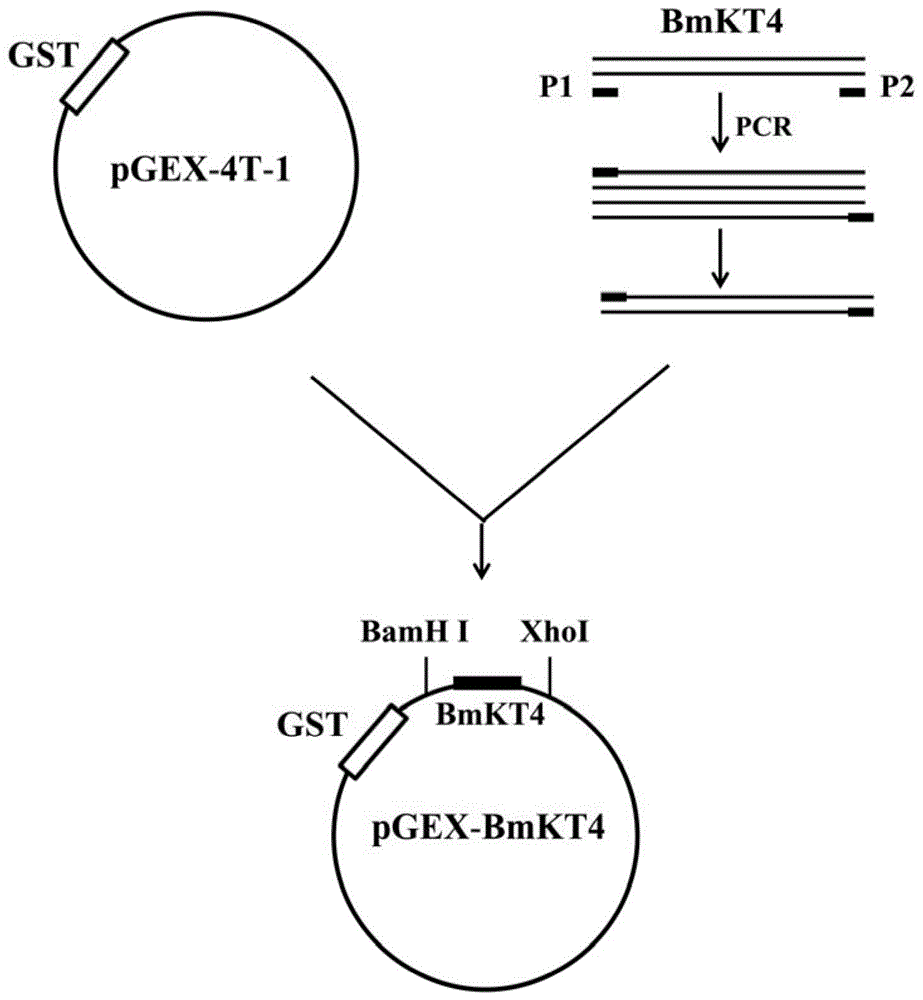
图1是重组表达载体pGEX-4T-1-钾离子通道毒素衍生多肽BmKT4(pGEX-BmKT4)的构建示意图。GST表示谷胱甘肽转移酶;P1是上游引物,含有小肠激酶酶切位点和限制性内切酶BamHI酶切位点;P2是下游引物,含有限制性内切酶XhoI酶切位点。
图2是SDS-PAGE蛋白质电泳图。 泳道1:蛋白质marker (70、55、40、35、25、15 kDa);泳道2:经IPTG诱导的转化空载体pGEX-4T-1的大肠杆菌(Rossetta(DE3)/pGEX-4T-1)全细胞蛋白提取物;泳道3:经IPTG诱导的转化pGEX-BmKT4的大肠杆菌(Rossetta(DE3)/pGEX-BmKT4)全细胞蛋白提取物;泳道4:纯化的GST;泳道5:纯化的融合蛋白GST-BmKT4。
图3是多肽BmKT4延长秀丽线虫寿命的结果图。pGEX-4T-1组喂食秀丽线虫经IPTG诱导的大肠杆菌Rossetta(DE3)/pGEX-4T-1菌体,pGEX-BmKT48组喂食秀丽线虫经IPTG诱导的大肠杆菌Rossetta(DE3)/pGEX-BmKT4菌体,pGEX-BmKT48组秀丽线虫寿命明显延长。
图4是多肽BmKT4促进秀丽线虫产卵的结果图。A为大肠杆菌Rossetta(DE3)/pGEX-4T-1或Rossetta(DE3)/pGEX-BmKT表达的蛋白对秀丽线虫产卵数的影响,B为大肠杆菌Rossetta(DE3)/pGEX-4T-1或Rossetta(DE3)/pGEX-BmKT表达的蛋白对秀丽线虫产卵时间的影响。结果表明多肽BmKT4能明显使秀丽线虫后代数目增加,并且产卵时间提前。
具体实施方式
下面结合具体实施例进一步阐述本发明,应当理解,这些实施例仅用于说明本发明而不用于限制本发明要求保护的范围,下列实施例中未注明的具体实验条件和方法,通常按照常规条件如:J.萨姆布鲁克等主编,科学出版社,1992,分子克隆实验指南(第三版);D.L.斯佩克特等,科学出版社,2001,细胞实验指南等书中所述的条件,或按照制造厂商所建议的条件。野生型秀丽线虫N2,大肠杆菌菌株OP50来自美国明尼苏达大学秀丽线虫遗传中心(Caenorhabditis Genetics Center,USA)。
实施例1 设计引物以及PCR扩增
从构建的蝎毒腺cDNA文库中筛选钾离子通道毒素的cDNA序列,采用计算机辅助设计钾离子通道毒素衍生多肽的cDNA序列和氨基酸序列。设计基于影响多肽与钾离子通道毒素相互作用的诸多因素,如多肽功能残基分布、残基极性,氨基酸稳定性。所设计的钾离子通道毒素衍生多肽BmKT4的氨基酸序列及编码基因的核苷酸序列分别如SEQ ID NO.1和SEQ ID NO.2所示。
人工合成SEQ ID NO.2所示基因片段,以该基因片段为模板,以所设计的上下游引物进行PCR反应。其中,上下游引物如下:
引物P1:5′-GCCGGATCCGATGACGATGACAAGGTGGGCATTAAC-3′,该引物含有BamHI限制性内切酶酶切位点和小肠激酶酶切位点;
引物P2:5′-TATCTCGAGTCACTGCGGCTGGCAATGGCATTTGCC-3′,该引物含有XhoI限制性内切酶酶切位点。
PCR反应体系:0.25μL Taq聚合酶(1U)、2μL dNTPs(10mM)、17.25μL ddH2O、2.5μL 10×buffer、引物(10μM)和模板各1μL,总体积为25μL。PCR反应过程:94℃预变性5min;94℃变性45s、58℃复性45s、72℃延伸90s,循环35次;72℃最后延伸10min。
实施例2 构建重组表达载体(pGEX-BmKT4)
将实施例1中所得PCR产物使用胶回收试剂盒(Omega,USA)回收。用限制性内切酶BamHI、XhoI对回收的PCR产物和表达载体pGEX-4T-1进行酶切。酶切反应:BamHI(14U/μL)和XhoI(20U/μL)各0.5μL,10×buffer 2.5μL,PCR产物或pGEX-4T-1质粒50-100ng,加ddH2O至总体积为25μL,37℃水浴3小时。
酶切产物经胶回收试剂盒回收后用T4 DNA连接酶连接,构建过程见附图1。连接反应:T4 DNA连接酶(1U/μL)1μL,酶切的PCR产物与表达载体pGEX-4T-1的摩尔比为3∶1,10×buffer 2μL,加ddH2O至总体积为20μL,16℃过夜。
实施例3 获得重组大肠杆菌
将实施例2中的连接产物转化入大肠杆菌Rossetta(DE3)感受态细胞中,混匀,冰浴30min,42℃水浴90s(不能摇动),再冰浴1-2min;加500μL LB培养基,37℃摇床温育50min;摇匀菌液,取100μL涂布于氨苄青霉素琼脂平板(LB/AP+)上,待菌液吸干后倒置于37℃培养12~16小时,观察结果。
LB/AP+琼脂平板上挑取单菌落作为模板,以实施例1中的引物P1、P2进行PCR。PCR筛选的阳性克隆子进一步使用限制性酶切反应鉴定。两者都为阳性结果的克隆子进行测序分析。测序引物是针对pGEX-4T-1质粒的通用测序引物。若DNA测序结果与设计的基因序列相符则确定此培养物为所需要的表达蝎钾离子通道毒素衍生多肽BmKT4的重组大肠杆菌Rossetta(DE3)/pGEX-BmKT4。同时构建转化空载体pGEX-4T-1的重组大肠杆菌(Rossetta(DE3)/pGEX-4T-1)做对照。
实施例4 重组蛋白的表达和纯化
在含氨苄青霉素的LB液体培养基中以1∶100的比例接种重组大肠杆菌Rossetta(DE3)/pGEX-BmKT4或Rossetta(DE3)/pGEX-4T-1,37℃培养至OD600=0.5-0.6时加入IPTG(终浓度为1mM)对培养物进行诱导,然后将培养物在30℃培养4小时以进行目的基因的表达。收集菌体,悬浮于1×GST Bind/Wash Buffer(4.3mM Na2HPO4,1.47mM KH2PO4,137mM NaCl,2.7mM KCl,pH 7.3),超声波破细胞(至培养物变清亮为止)。12000rpm离心15分钟,所得上清加入到GST亲和层析介质中充分混合使目的蛋白与GST亲和层析胶充分结合。用1×GST Bind/Wash Buffer洗柱后再用1×Elution Buffer(50mM Tris-HCl,10mM 还原型谷胱甘肽)洗脱目的蛋白。收集从GST亲和层析胶中流出的液体并通过15% SDS-PAGE蛋白质电泳检测(电泳检测结果见附图2)。用超滤管(Millipore,Centricon,USA)将洗脱的BmKT4多肽离心浓缩脱盐,离心速度为4000rpm,温度为4℃。
实施例5 秀丽线虫的同步化过程
秀丽线虫的同步化过程是指用化学裂解的方法将产卵期秀丽线虫虫体裂解开,并通过离心的方法将体内的虫卵与虫体碎片分离开。进而收集到虫卵,并用M9或者S.medium反复冲洗虫卵,尽量去除有害化学物质,再于合适的条件下将虫卵孵化成幼虫。这个过程中有几点是需要注意的。首先是要把握好线虫的生长阶段,一定要是线虫的产卵期才能做同步化实验,而且以线虫产卵12小时后做同步化最适宜。其次,要把握好虫体的数量,以获得足够的后代数量满足实验需要。一般来说,一条产卵期的秀丽线虫做完同步化之后可以获得约20个虫卵。最后,虫卵在摇床中孵化的时间一般需要16h以上,但是不能超过24h,否则孵化出来的幼虫会因为没有食物而进入dauer期,导致实验失败。
(1)待秀丽线虫在NGM固体平板上生长至产卵期后,在无菌环境下用适量M9溶液将虫体冲洗下来,并将虫体混合液转移到1.5mL EP管中,静置于架子上待秀丽线虫自然沉降(约2min)。
(2)吸去上清(若混合液浑浊,则可用M9再洗一遍),留约500μL的液体,然后加入Bleach裂解液(1M NaOH溶液:2% NaClO溶液=1:1,体积比)约0.5mL,盖紧EP管,并迅速上下左右剧烈晃动EP管,以使虫体充分裂解(在显微镜下看不到线虫,约需3~5min),接着4000rpm离心45sec。
(3)吸去上清(尽量吸干净,同时速度要快),然后加入1mL M9溶液,温和的晃动EP管,使沉淀充分重悬起来,再在4000rpm条件下离心45sec。
(4)重复步骤(3)两次,以充分洗去残留NaOH或者NaClO溶液,防止其损伤虫卵。
(5)吸去上清,然后加入1mL S.medium溶液重悬沉淀,使收集到的卵充分的分散开来,避免虫卵结团。
(6)在已灭菌的锥形瓶中加入2mL的S.medium溶液,然后将收集到的1mL虫卵加入其中,封口膜封好,于20℃、110rpm培养约20h(不能超过24h),便可得到同步化的L1期秀丽线虫。
实施例6 多肽BmKT4在延长寿命方面的应用
同步化处理产卵期秀丽线虫得到L1期秀丽线虫后,将培养好的大肠杆菌OP50菌液离心后加入适量菌体到L1期秀丽线虫培养液中,在110rpm、20℃的条件下培养秀丽线虫至L4期。向L4期的秀丽线虫N2培养液中加入5-FUDR至终浓度为75μg/mL,20℃、110rpm继续培养24h。诱导大肠杆菌Rossetta(DE3)/pGEX-4T-1和大肠杆菌Rossetta(DE3)/pGEX-BmKT4表达,8000rpm,1min离心收集菌体。用适量S.medium将菌体分别混悬起来,使其OD570约为0.7,并加入5-FUDR(5mg/mL)至终浓度为75μg/mL,将混合液滴加到96孔板中,每孔90μL。然后加入培养好的L4期的秀丽线虫N2,约15条/孔,每孔10μL,20℃、110rpm培养。在荧光倒置显微镜下每隔2天记录每孔中活着的秀丽线虫总数,作好记录。统计分析发现,BmKT4能显著延长N2线虫的寿命22.5%(见附图3)。
实施例7 多肽BmKT4在提高产卵数、使产卵提前方面的应用
制备NGM固体培养皿,待过夜凝固和稍加晾干表面之后,加入少量的大肠杆菌(诱导表达后的重组大肠杆菌Rossetta(DE3)/pGEX-BmKT4或Rossetta(DE3)/pGEX-4T-1)菌液,干燥。保证每个平皿中有三条同步化的秀丽线虫,20℃恒温培养箱中培养。当线虫从L1期食用表达相应蛋白的大肠干菌生长到L4期末后,每24h把线虫挑出并转接到铺有相同食物的平皿中,继续放入培养箱中培养,重复直至产卵结束为止。孵化出来的虫卵要及时置于20℃的培养箱中待孵化和生长48h时计数后代数目,以便虫体长大而又不至于产卵。计数前将后代线虫培养皿置于50℃烘箱10min至秀丽线虫虫体全部死亡。这样最后在显微镜下计数虫体的个数便是产卵的个数了。统计分析发现,BmKT4能让线虫后代数目增加,且产卵时间提前(见附图4)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 武汉大学
<120> 一种钾离子通道毒素衍生多肽及其制备方法与应用
<130> 1
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 37
<212> PRT
<213> Artificial
<220>
<223> 多肽BmKT4的氨基酸序列
<400> 1
Val Gly Ile Asn Val Thr Cys Thr Asn Ser Gln Gln Cys Tyr Asn Pro
1 5 10 15
Cys Gly Asp Ala Gly Met Gln Tyr Gly Lys Cys Thr Tyr Gly Lys Cys
20 25 30
His Cys Gln Pro Gln
35
<210> 2
<211> 114
<212> DNA
<213> Artificial
<220>
<223> 多肽BmKT4基因的核苷酸序列
<400> 2
gtgggcatta acgtgacctg caccaacagc cagcagtgct ataacccgtg cggcgatgcg 60
ggcatgcagt atggcaaatg cacctatggc aaatgccatt gccagccgca gtga 114
<210> 3
<211> 36
<212> DNA
<213> Artificial
<220>
<223> 引物P1
<400> 3
gccggatccg atgacgatga caaggtgggc attaac 36
<210> 4
<211> 36
<212> DNA
<213> Artificial
<220>
<223> 引物P2
<400> 4
tatctcgagt cactgcggct ggcaatggca tttgcc 36
- 还没有人留言评论。精彩留言会获得点赞!