一种苄叉茚二酮类化合物及其制备与在脂滴特异性成像中的应用的制作方法
本发明属于医用材料领域,具体涉及具有聚集诱导发光性质的化合物及其制备方法和在脂滴特异性荧光成像中的应用。
背景技术:
脂滴不仅是脂类分子和蛋白质的重要贮存场所,而且是一个动态变化的多功能细胞器。脂滴大小和数量在不同细胞中差别很大。由于脂滴不仅可作为能量贮存器,而且在膜的合成、蛋白质降解等生理活动中发挥着重要作用,脂滴与许多疾病密切相关,包括癌症、炎症、病毒感染和肥胖等。
癌细胞具有快速增殖的特点,因此对脂肪酸和膦脂等脂类分子具有高需求,相应的癌细胞内脂滴的含量也明显增加,因此脂滴含量在癌细胞内的高表达可作为癌症的标记物,迫切需要发展脂滴特异性的荧光探针来探究脂滴在癌症中的作用。
为了实现脂滴特异性荧光成像,需要解决以下几个关键问题:(1)为了实现脂滴的高亮度荧光成像,荧光材料需要高浓度聚集在脂滴中,然而传统荧光材料的聚集诱导猝灭的缺陷严重限制了它们在高亮度脂滴荧光成像中的应用;(2)为了降低生产成本,需要发展简易制备的脂滴特异性荧光探针。然而,传统的脂滴特异性荧光探针需要多步合成,难以制备,且成本高昂;(3)脂滴特异性荧光探针应具有大的近红外区的双光子吸收截面,在近红外双光子激发的荧光成像中可有效减少背景噪音,降低光伤害,提高深层穿透能力;(4)脂滴特异性荧光探针分子应具有快速的活细胞穿透能力,便于成像应用;(5)强的光稳定性,便于长期连续观测,然而传统的荧光材料具有易发生光漂白的缺陷,难以用于持续观测。
聚集诱导发光材料作为新一代荧光材料,具有强抗光漂白能力、聚集态高发光效率、大的斯托克位移和低毒性等优点,可有效克服聚集诱导猝灭的缺陷,在生物成像和检测领域日益获得广泛应用,特别适用于细胞器的成像和生理功能探究。
技术实现要素:
为了克服上述现有荧光材料的缺陷,本发明的首要目的在于提供一种具有聚集诱导发光性质的苄叉茚二酮类化合物,该化合物可实现脂滴特异性的单光子和双光子荧光成像。
本发明的另一目的在于提供上述苄叉茚二酮类类化合物的制备方法。
本发明的再一目的在于提供上述苄叉茚二酮类化合物在脂滴特异性荧光成像中的应用,通过特异性荧光成像用以检测脂滴运动变化情况;特别是在近红外双光子激发的细胞脂滴特异性荧光成像中的应用。
本发明的目的通过下述技术方案实现:
一种苄叉茚二酮类化合物,其结构如式I所示:
其中R1为氢、卤素、氰基、硝基、C1-30烷基、芳基、杂芳基;
R2、R3独立地为C1-30烷基、芳基、杂芳基;
所述的烷基为直链或支链烷基;优选为甲基、乙基、丙基、丁基、异丁基、叔丁基;
所述的芳基指具有6-20个碳原子的单环或多环芳族基团,优选为苯基、萘基、蒽基或芘基;
所述的杂芳基指具有1-20个碳原子、1-4个选自N、S、O杂原子的单环或多环杂芳族基团,优选为吡咯基、吡啶基、嘧啶基、咪唑基、噻唑基、吲哚基、氮杂萘基、氮杂蒽基或氮杂芘基;
优选地,R1为氢,R2为苯基、R3为苯基。
上述苄叉茚二酮类化合物的反应方式如下:
式II、式III中各取代基R1、R2、R3的定义与式I的相同;
上述苄叉茚二酮类化合物的制备方法,包括以下步骤:
将式II化合物和式III化合物溶解于有机溶剂中,在惰性气体保护和碱的作用下,回流反应,得到苄叉茚二酮类化合物;
式II化合物的结构为式III化合物的结构为其中R1为氢、卤素、氰基、硝基、直链或支链C1-30烷基、芳基、杂芳基;R2、R3独立地为直链或支链C1-30烷基、芳基、杂芳基。R1、R2、R3的定义与式I的相同。
所述式II化合物和式III化合物的摩尔比为1:1~1:2,优选为1:1.2;所述惰性气体为氮气,所述碱为吗啡啉或哌啶。
所述有机溶剂为乙醇、甲醇、丁醇、乙腈或N,N-二甲基甲酰胺中一种以上,优选为乙醇;所述反应时间为1~12小时;所述反应的温度为有机溶剂沸点-5℃到有机溶剂沸点+5℃,优选为有机溶剂沸点。
所述碱的用量与式II化合物的摩尔比为1:1。
上述的苄叉茚二酮类化合物可以作为脂滴染料用于脂滴的特异性荧光成像,特别是细胞内脂滴的特异性荧光成像;更进一步用于在近红外双光子激发的细胞脂滴特异性荧光成像。
所述细胞为癌细胞;尤其是肺癌细胞。
苄叉茚二酮类化合物具有聚集诱导发光效应,从而可用于对脂滴进行特异性高信噪比荧光成像。通过将苄叉茚二酮类化合物与商用脂滴染料BODIPY493/503Green进行共染实验证实了苄叉茚二酮类化合物对脂滴具有良好的染色效果和特异性。
苄叉茚二酮类化合物在近红外区(800-1000nm)还具有大的双光子吸收截面,可用于脂滴特异性的双光子激发荧光成像,具有高信噪比的优点。
值得注意的是,本发明制备的苄叉茚二酮类化合物的发光不同于传统的荧光成像,而是表现出聚集诱导发光的性质,这意味着即使在高浓度条件下,苄叉茚二酮类也可以进行荧光成像,而且比低浓度下具有更高的发光效率,而传统的荧光染料在高浓度条件下则具有聚集诱导猝灭的现象,因此传统的荧光染料不利于在高浓度条件下进行荧光成像。
需强调的是,在现有技术中,未有文献报道过本发明的苄叉茚二酮类化合可以作为脂滴染料。
在本发明中,“聚集诱导发光”是指荧光化合物在稀溶液中几乎不发光,但在聚集态或固态发出强荧光的现象。例如,在本发明中,由于分子内运动受限和扭曲的分子内电荷转移机制,苄叉茚二酮类化合物在溶液态不发出荧光或发光很弱,但在聚集态发出强荧光。
本发明相对于现有技术具有如下的优点及效果:
1、本发明的新化合物可实现活细胞内脂滴的特异性荧光成像,而且具有易于制备、在近红外区具有大的双光子吸收截面值、红色荧光、成像信噪比高、细胞毒性小、斯托克位移大、光稳定性强、可快速进入活细胞等优点。
2、本发明的新化合物具有聚集诱导发光优势,可有效克服传统荧光染料的聚集诱导猝灭的缺陷。
附图说明
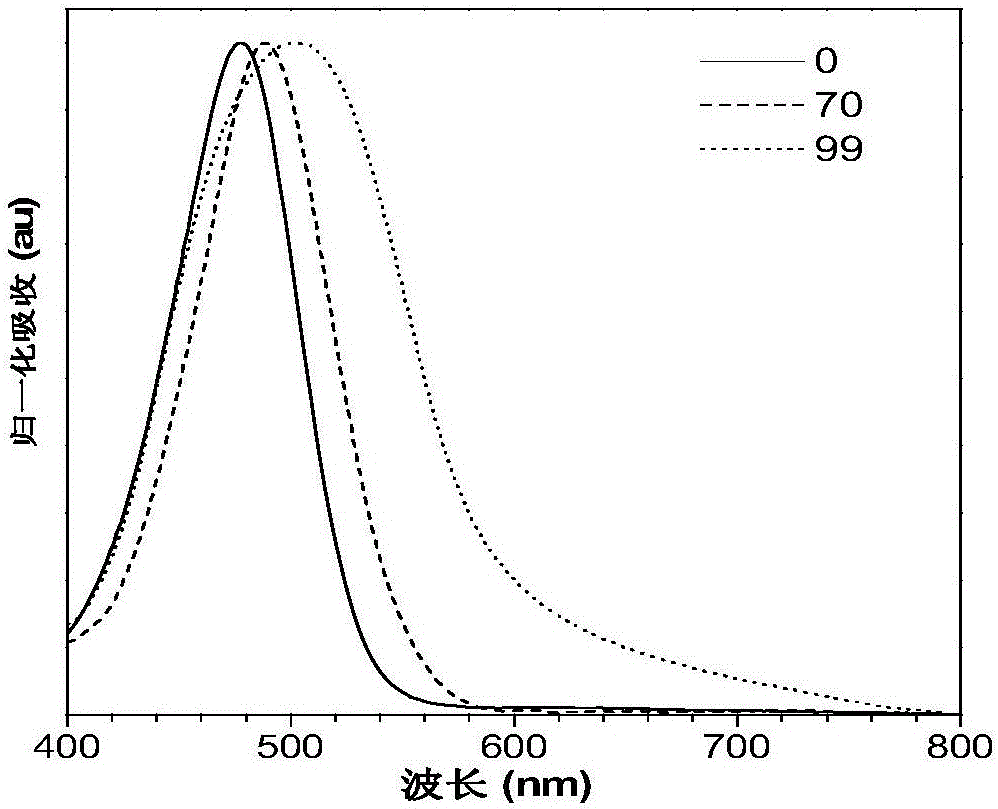
图1为实施例1制备的化合物IND-TPA的紫外吸收和荧光发射光谱图;(A)为化合物IND-TPA在四氢呋喃中的归一化紫外吸收光谱图;(B)为化合物IND-TPA在四氢呋喃和水的混合溶液中不断增加水含量的荧光发射光谱图(10-5mol·L-1);(C)为化合物IND-TPA在四氢呋喃和水的混合溶液中不断增加水含量的最大荧光发射强度与四氢呋喃溶液中最大荧光发射强度的比值变化图;
图2为实施例1制备的化合物IND-TPA在不同水含量的四氢呋喃和水的混合溶液中归一化紫外吸收光谱图(10-5mol·L-1);
图3为实施例1制备的化合物IND-TPA在乙二醇和甘油中的荧光发射光谱图;
图4为实施例1制备的化合物IND-TPA在99%水含量的四氢呋喃和水的混合溶液中的动态光散射粒径分布图;
图5为实施例1制备的化合物IND-TPA对HCC827细胞(A)和A549细胞(B)的细胞毒性实验结果图;
图6为实施例1制备的化合物IND-TPA在HCC827细胞中,与脂滴染料BODIPY493/503Green的共染图;其中,(A)细胞明场图;(B)为IND-TPA在HCC827细胞中的脂滴染色图;(C)为BODIPY493/503在HCC827细胞中的脂滴染色图;(D)为(A)、(B)和(C)的叠加图;(E)为IND-TPA和BODIPY493/503在HCC827细胞中共染的荧光信号变化趋势图;
图7为实施例1制备的化合物IND-TPA在A549细胞中,与脂滴染料BODIPY493/503的共染图;其中,(A)细胞明场图;(B)为IND-TPA在A549细胞中的脂滴染色图;(C)为BODIPY493/503在A549细胞中的脂滴染色图;(D)为(A)、(B)和(C)的叠加图;(E)为IND-TPA和BODIPY493/503在A549细胞中共染的荧光信号变化趋势图;
图8为实施例1制备的化合物IND-TPA在(A)HCC827细胞和(B)A549细胞中,与脂滴染料BODIPY493/503的荧光信号变化相关性图;
图9为实施例1制备的化合物IND-TPA在HCC827和A549细胞中,与脂滴染料BODIPY493/503和细胞核染料Hoechst 33342的共染图;其中,(A)为HCC827细胞的明场图;(B)为IND-TPA在HCC827细胞中的脂滴染色图;(C)为BODIPY493/503在HCC827细胞中的脂滴染色图;(D)为Hoechst 33342在HCC827细胞中的细胞核染色图;(E)为(A)、(B)、(C)和(D)的叠加图;(F)为A549细胞的明场图;(G)为IND-TPA在A549细胞中的脂滴染色图;(H)为BODIPY493/503在A549细胞中的脂滴染色图;(I)为Hoechst 33342在A549细胞中的细胞核染色图;(J)为(F)、(G)、(H)和(I)的叠加图;
图10为实施例1制备的化合物IND-TPA在HCC827细胞中荧光图;其中(A)为化合物IND-TPA在HCC827细胞中,7%的功率的541nm光照下的荧光强度变化图;(B)为化合物IND-TPA在HCC827细胞中,于光照下不同时间的细胞荧光成像图;
图11为实施例1制备的化合物IND-TPA在HCC827细胞中的运动变化监测图,其中(A)为0min的脂滴染色图;(B)为1min的脂滴染色图;(C)为3min的脂滴染色图;(D)为5min的脂滴染色图;(E)为0和1min的脂滴染色叠加图;(F)为1和3min的脂滴染色叠加图;(G)为3和5min的脂滴染色叠加图;(H)为HCC827细胞的明场图;
图12为实施例1制备的化合物IND-TPA双光子吸收截面值图;
图13为实施例1制备的化合物IND-TPA在HCC827细胞中的双光子激发荧光图,激发波长为920nm。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。下面以苄叉茚二酮类化合物2-(4-(二苯胺基)苯亚甲基)-1H-茚-1,3(2H)-二酮为例进行具体说明,其他苄叉茚二酮类化合物也具有聚集诱导发光优势和可实现活细胞内脂滴的特异性荧光成像,在近红外区具有大的双光子吸收截面值、红色荧光、成像信噪比高、细胞毒性小、斯托克位移大、光稳定性强、可快速进入活细胞等特点。
实施例1
苄叉茚二酮类化合物IND-TPA:2-(4-(二苯胺基)苯亚甲基)-1H-茚-1,3(2H)-二酮(R1=氢,R2=R3=苯基)结构式如下:
上述苄叉茚二酮类化合物的制备方法,包括以下步骤:
4-二苯胺基苯甲醛(273mg,1.0mmol),1,3-茚二酮(146mg,1.0mmol)和吗啡啉(85mg,1.0mmol)溶于15mL乙醇中,随后在氮气保护下,回流反应(78℃下反应3小时);待反应结束,恢复至室温后,过滤后真空干燥得到红色固体产物2-(4-(二苯胺基)苯亚甲基)-1H-茚-1,3(2H)-二酮(285mg,产率71%)。有关结构表征数据如下:
1H NMR(DMSO-d6,500MHz):δ8.49(d,J=9.0Hz,2H),7.93–7.89(m,4H),7.71(s,1H),7.48–7.45(m,4H),7.30–7.26(m,6H),6.85(d,J=9.0Hz,2H);13C NMR(CD2Cl2,125MHz):191.3,189.6,152.7,146.6,145.8,142.4,140.0,136.8,134.8,134.5,129.8,126.6,125.7,125.5,125.3,122.8,122.8,118.9;HRMS(ESI):m/z[M+Na]+calcd for C28H19NNaO2,424.1313;found,424.1308。
实施例2
实施例1制备的化合物IND-TPA的光物理性质表征:
将四氢呋喃和水按照不同的体积比(四氢呋喃:水=100:0,90:10,80:20,70:30,60:40,50:50,40:60,30:70,20:80,10:90,1:99)混合,形成含水量(fw)不同的混合液,将化合物IND-TPA溶解到这些混合液中,使化合物的浓度为10-5mol·L-1,随后检测荧光发射光谱和在四氢呋喃中的紫外吸收光谱,结果见图1。图1为实施例1制备的化合物IND-TPA的紫外吸收和荧光发射光谱图;(A)化合物IND-TPA在四氢呋喃中的归一化紫外吸收光谱图;(B)为化合物IND-TPA在四氢呋喃和水的混合溶液中不断增加水含量的荧光发射光谱图(10-5mol·L-1);(C)为化合物IND-TPA在四氢呋喃和水的混合溶液中不断增加水含量的最大荧光发射强度与四氢呋喃溶液中最大荧光发射强度的比值变化图。
从图1可以看出,当不断增加混合溶液体系中的水含量至70%时,化合物IND-TPA的荧光首先减弱,这是由于扭曲的分子内电荷转移效应造成的。进一步在四氢呋喃和水的混合溶剂体系中增加水的比例至99%时,化合物IND-TPA的溶解度降低从而聚集,荧光强度迅速增强,这是由于形成聚集体后,分子内运动受限造成的。
实施例1制备的化合物IND-TPA在不同水含量的四氢呋喃和水的混合溶液中归一化紫外吸收光谱图(10-5mol·L-1)如图2所示。通过对化合物IND-TPA在水含量为70%的四氢呋喃和水的混合溶液中紫外吸收光谱的测定,发现随水含量的增加,化合物IND-TPA的紫外吸收光谱发生明显的红移(见图2),这是具有扭曲的分子内电荷转移性质的化合物所具有的典型特征。在水含量为99%的混合溶液中,化合物IND-TPA的紫外吸收出现明显的拖尾峰,这是由于形成了聚集体造成的。
实施例1制备的化合物IND-TPA在乙二醇和甘油中的荧光发射光谱图如图3所示;实施例1制备的化合物IND-TPA在99%水含量的四氢呋喃和水的混合溶液中的动态光散射粒径分布图如图4所示。通过动态光散射实验证实了纳米聚集体的生成,平均粒径为119.6nm,分散系数为0.164。进一步,通过对化合物IND-TPA在乙二醇(粘度系数η=1.2mPa S)和甘油(粘度系数η=945mPa S)中的荧光发射光谱的测定,随溶剂粘度的增加,分子内运动受到限制,其荧光发射强度明显增强(见图3),荧光寿命由1.09ns增加至1.57ns。
通过测量化合物IND-TPA在四氢呋喃和水的混合溶液(四氢呋喃:水=100:0,30:70,1:99)中的量子产率和荧光寿命(结果见表1),发现相对于在水含量为70%的混合溶液中,化合物IND-TPA在水含量为99%的混合溶液中的量子产率增加了20.4倍,荧光寿命增加了2.2倍,辐射速率增加了9.1倍,非辐射速率降低了2.5倍,清楚证实了其聚集诱导发光性质。而且化合物IND-TPA在聚集态的斯托克位移为3580cm–1,远大于传统的荧光材料,非常有利于其在生物成像中的应用。
表1化合物IND-TPA的光物理性质
实施例3
实施例1制备的化合物IND-TPA的细胞毒性实验:
化合物IND-TPA针对肺癌细胞HCC827和A549的细胞毒性的实验结果如图5所示。该结果表明,化合物IND-TPA在不同浓度下(5,10,20,40,60,80,100μM)都几乎没有细胞毒性。
实施例4
实施例1制备的化合物IND-TPA在脂滴特异性荧光成像中的应用:测试结果如图6~9所示。图6为实施例1制备的化合物IND-TPA在HCC827细胞中,与脂滴染料BODIPY493/503Green的共染图;其中,(A)细胞明场图;(B)为IND-TPA在HCC827细胞中的脂滴染色图;(C)为BODIPY493/503在HCC827细胞中的脂滴染色图;(D)为(A)、(B)和(C)的叠加图;(E)为IND-TPA和BODIPY493/503在HCC827细胞中共染的荧光信号变化趋势图;图7为实施例1制备的化合物IND-TPA在A549细胞中,与脂滴染料BODIPY493/503的共染图;其中,(A)细胞明场图;(B)为IND-TPA在A549细胞中的脂滴染色图;(C)为BODIPY493/503在A549细胞中的脂滴染色图;(D)为(A)、(B)和(C)的叠加图;(E)为IND-TPA和BODIPY493/503在A549细胞中共染的荧光信号变化趋势图;图8为实施例1制备的化合物IND-TPA在(A)HCC827细胞和(B)A549细胞中,与脂滴染料BODIPY493/503的荧光信号变化相关性图;图9为实施例1制备的化合物IND-TPA在HCC827和A549细胞中,与脂滴染料BODIPY493/503和细胞核染料Hoechst 33342的共染图;其中,(A)为HCC827细胞的明场图;(B)为IND-TPA在HCC827细胞中的脂滴染色图;(C)为BODIPY493/503在HCC827细胞中的脂滴染色图;(D)为Hoechst 33342在HCC827细胞中的细胞核染色图;(E)为(A)、(B)、(C)和(D)的叠加图;(F)为A549细胞的明场图;(G)为IND-TPA在A549细胞中的脂滴染色图;(H)为BODIPY493/503在A549细胞中的脂滴染色图;(I)为Hoechst 33342在A549细胞中的细胞核染色图;(J)为(F)、(G)、(H)和(I)的叠加图。
化合物IND-TPA对肺癌细胞HCC827和A549的染色结果如图6所示。为了证实化合物IND-TPA在细胞中所处的位置,进行了与商品化的脂滴染料BODIPY493/503的共染实验。结果发现,化合物IND-TPA可以与脂滴染料BODIPY493/503在HCC827和A549细胞中均有很好的共定位(重叠系数均高达0.96),而且IND-TPA和BODIPY493/503的荧光信号的变化趋势十分相符(图6-图7),相关性很好(图8),表明化合物IND-TPA可以作为脂滴靶向的特异性荧光探针。进一步通过与商品化的脂滴染料BODIPY493/503和细胞核染料Hoechst 33342的共染实验,证明IND-TPA特异性染色脂滴,不会染色细胞核(图9)。
实施例5
实施例1制备的化合物IND-TPA具有强的光稳定性
图10为实施例1制备的化合物IND-TPA在HCC827细胞中荧光图;其中(A)为化合物IND-TPA在HCC827细胞中,7%的功率的541nm光照下的荧光强度变化图;(B)为化合物IND-TPA在HCC827细胞中,于光照下不同时间的细胞荧光成像图(图中灰白色原为红色)。对于IND-TPA在荧光成像中的光稳定性,从图10中可知,通过染色HCC827细胞,在514nm(7%)的激光照射下,连续光照10分钟以上,IND-TPA的荧光强度仅降低了不到20%,证实了其很好的光稳定性(图10)。
实施例6
实施例1制备的化合物IND-TPA在脂滴运动变化监测中的应用:图11为实施例1制备的化合物IND-TPA在HCC827细胞中的运动变化监测图,其中(A)为0min的脂滴染色图;(B)为1min的脂滴染色图;(C)为3min的脂滴染色图;(D)为5min的脂滴染色图;(E)为0和1min的脂滴染色叠加图;(F)为1和3min的脂滴染色叠加图;(G)为3和5min的脂滴染色叠加图;(H)为HCC827细胞的明场图;图12为实施例1制备的化合物IND-TPA双光子吸收截面值图;图13为实施例1制备的化合物IND-TPA在HCC827细胞中的双光子激发荧光图,激发波长为920nm。
具有高信噪比的化合物IND-TPA还可以用于观察脂滴在细胞内的运动,通过不同时间的细胞成像图叠加,可以清楚显示脂滴的位置的变化(图11)。
通过在近红外区检测化合物IND-TPA的双光子吸收截面值,发现其在920nm处,具有最大的双光子吸收截面值为119GM(图12)。
通过在双光子显微镜对IND-TPA的染色效果进行观察,发现IND-TPA可以很好地用于脂滴的双光子荧光成像,具有深层体内成像的应用潜力(图13)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!