金柑FmMLP2蛋白在增强植物抗冻中的应用的制作方法
本发明属于生物技术领域,涉及一种金柑Fm MLP2蛋白在增强植物抗冻中的应用。
背景技术:
低于零摄氏度低温造成的植物的损伤称为冻害。全世界大多数地区都会遇到低于零度低温,造成许多作物遭遇不同程度的冻害,而且往往可能是毁灭性的伤害。因此,植物的分布以及农业生产严重受到0℃以下低温限制。人们通过研究植物的抗冻性来了解植物抗冻的机制,减少冻害对生产引起不良影响,服务于农业生产实践。因而,植物抗冻性一直是人们研究植物抗寒性的重中之重。
通过改造植物的遗传特性,使其具有抵御冻害的能力,从而最大程度免受冻害的影响。近年来,随着生物技术的发展,利用基因工程技术培育转基因植株成为了培育新品种的有效途径。但有关抗冻基因工程育种的研究还比较有限,其主要原因在于缺乏高效的基因资源,或对其相应的基因结构、功能机制缺乏足够的了解。发掘新抗冻基因并深入认识其功能机制已成为必然的趋势。
神秘果素是从产于西非的植物神秘果中分离的一种植物特异性糖蛋白。1995年Masuda等从神秘果中克隆到神秘果素基因,随后Gahloth等从月橘中克隆到神秘果素相似蛋白(miraculin-like protein,MLP)基因,Kuwabara等从粗皮柠檬中克隆出Rlem MLP2(miraculin-like protein 2)和Rlem MLP3基因,金建涛等从金弹中克隆到Fc MLP2。本发明人则从金柑中发现MLP2蛋白,并克隆到Fm MLP2基因。Tsukuda等认为,MLP2会分泌到细胞壁和角质层的间隙,是防御病原体攻击的第一道防线。Goodwin等认为,MLP2基因与病原体的侵害协同表达,产生不同的蛋白酶抑制剂来抵抗由微生物引起的病原体侵害。Isshiki等和Akimitsu等发现MLP2可以抑制柑橘属植物黑腐病病菌孢子萌发的作用。Kuwabara等认为,Rlem MLP2在粗皮柠檬受到害虫或病原菌伤害时,起到一定的防御作用。金建涛等认为,MLP2蛋白可能在植物抗虫、抗病原菌、抗饥饿和延缓植物衰老方面起到一定的作用。由此可以看出,研究MLP2蛋白及其编码基因的功能较多,但还未有增强植物抗冻能力的报道。
技术实现要素:
本发明的目的是,针对上述现有技术的不足,提供金柑Fm MLP2蛋白的新用途,该蛋白的氨基酸序列如序列表SEQ ID No:6所示,所述新用途为SEQ ID No:6所示蛋白在增强植物抗冻能力中的应用。
在上述方法中,所述SEQ ID No:6所示蛋白的编码基因为如下1)或2)或3)的基因:
1)其核苷酸序列是SEQ ID No:5所示的DNA分子;
2)与1)限定的DNA序列至少具有70%、至少具有75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同一性且编码SEQ ID No:6所示蛋白的DNA分子;
3)在严格条件下与1)或2)限定的DNA序列杂交且编码SEQ ID No:6所示蛋白的DNA分子。
所述严格条件为:50℃,在7%SDS、0.5M Na3PO4和1mM ETDA的混合液中杂交,在65℃,0.1×SSC,0.1%SDS中漂洗。
本发明同时提供一种培育抗冻转基因植物的方法,该方法是将编码上述所示蛋白的基因导入目的植物,经过培育后得到转基因植物,该转基因植物的抗冻能力高于目的植物。
上述提及的目的植物可以为双子叶植物,也可以为单子叶植物。
实验证明,Fm MLP2基因与植物抗冻性相关,将Fm MLP2基因在植物体内过表达后,相比野生型对照植株,Fm MLP2基因过表达植株抗冻性显著提高。本发明公开的金柑Fm MLP2蛋白及其编码基因可显著提高植物的抗冻性,为植物抗寒育种工作提供了重要的理论基础和基因资源。
附图说明:
图1是本发明的金柑苗于4℃不同处理时间下的RNA图。
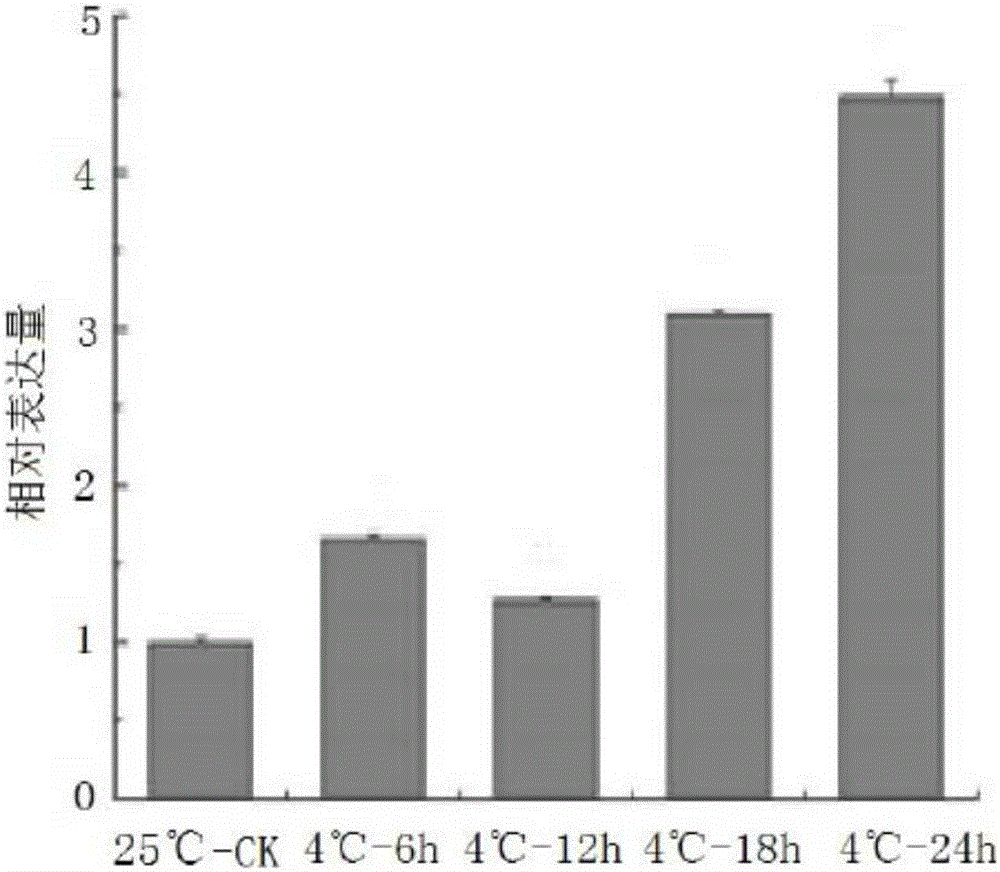
图2是本发明的金柑Fc MLP2基因于4℃不同处理时间下的相对表达量图。
图3是菌液PCR鉴定p1300M-MLP2-1转化农杆菌GV3101凝胶图。
其中:第1泳道是Marker,第2泳道是p1300M空质粒表达载体转化到农杆菌GV3101,第3、4、5、6、7泳道是p1300M-MLP2-1表达载体转化到农杆菌GV3101。
图4是转Fc MLP2基因拟南芥植株PCR鉴定凝胶图。
其中:第1泳道是2K Marker,第2、3泳道是野生型拟南芥植株,第4、5、6、7泳道是转Fc MLP2基因拟南芥植株。
图5是转Fc MLP2基因拟南芥植株与野生型拟南芥植株表型观察对比图。
图6是转Fc MLP2基因拟南芥植株相对电导率图。
图7是野生型拟南芥植株与转Fc MLP2基因拟南芥植株蛋白酶活性相比较图。
图8是转Fc MLP2基因拟南芥植株蛋白质相对含量图。
具体实施方式
本发明将用以下实施例作进一步地说明,但并不限于这些实施例的任一或类似实例。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用方法如无特殊说明均为常规方法。
金柑(Fortunella margarita(Lour.)Swingle):由湖南农业大学提供;参考文献:(Cao,Q,W F Kong,P F Wen,Plant freezening tolerance and genes express in cold acclimation[J].Acta Ecologica sinica,2004,24(4):806-811)。
拟南芥野生型(Col-0生态型):拟南芥野生型种子(Arabidopsis thaliana ecotype Columbia-0),由拟南芥生物研究中心提供。
根癌农杆菌GV3101(Agrobacterium tumefaciens GV3101):由湖南农业大学提供。
大肠杆菌(Escherichia coli)Trans-1 Phage Resistant感受态:购自全式金生物技术有限公司,产品目录号为CD501。
实施例1、运用荧光定量PCR技术对Fc MLP2基因在低温诱导下的金柑叶片中的表达量进行分析
挑选控温(约25℃)大棚生长、长势粗细一致的2年生金柑(Fortunella margarita(Lour.)Swingle)苗若干株作为实验材料,进行低温处理,温度设定为4±0.5℃。
利用北京全式金生物技术有限公司的提RNA试剂盒(目录号:ET121)提取金柑苗总的RNA(见图1),并以总RNA为模板,使用北京全式金生物技术有限公司的反转录试剂盒,除去RNA中的基因组DNA,反转录得到cDNA。
根据GenBank数据库公布的同源蛋白MLP2-1基因序列,设计PCR扩增引物,引物由南京金斯瑞生物科技有限公司合成,设计引物为:Fm MLP2F:5'-ATATTGTCCATTGTCCGAGT-3'(SEQ ID No:1),Fm MLP2R:5'-AAACAGAACATTCAAAGCCG-3'(SEQ ID No:2)。以反转录合成的第一链cDNA为模板,Fm MLP2F和Fm MLP2R为引物,进行RT-PCR反应,RT-PCR反应程序采用两步法,得到PCR扩增产物。PCR反应体系(25.0μL):cDNA 1.0μL、正向引物(10μM)0.2μL、反向引物(10μM)0.2μL、2×SYBR Green I Master5.0μL、无核酸酶水(Nuclease-free H2O)18.6μL。PCR反应程序:95℃预变性5min,95℃10s,60℃30s,40个循环。
Fc MLP2基因于抗冻进程中的表达量分析结果:为了研究Fc MLP2基因在低温下对不同时间处理的响应,对两年生的金柑苗进行4℃低温处理0h、6h、12h、18h和24h,通过荧光定量PCR检测基因的相对表达量(以0h(即图中的25℃)为对照,表达量为1)。检测结果见图2,显示:Fc MLP2-1基因于4℃在0-6h内表达量有所提高,而后到12h时表达量稍微下降,在低温处理的16h-24h内,其表达量逐渐稳步升高。
实施例2、金柑Fc MLP2基因的克隆及分析
利用北京全式金生物技术有限公司的提RNA试剂盒(目录号:ET121)提取金柑苗总的RNA,并以总RNA为模板,反转录得到cDNA(同实施例1)。根据GenBank数据库公布的同源蛋白MLP2-1基因序列和p1300M载体序列,设计PCR扩增特异引物(带有BamH I和Kpn I酶切位点和保护碱基),引物由南京金斯瑞生物科技有限公司合成。正向引物CDS-PF:5'-GGGTACCATGAAGACTTCATTGATAACAACAC-3'(SEQ ID No:3,带下划线部分序列为BamH I和Kpn I限制性内切酶切位点和保护碱基);反向引物CDS-PR:5'-CGGGATCCTTACGCGGTCATTGATATTG-3'(SEQ ID No:4,带下划线部分序列为BamH I和Kpn I限制性内切酶切位点和保护碱基)。再以反转录成的cDNA为模板,在引物CDS-PF和引物CDS-PR的引导下,用常规PCR法扩增金柑Fm MLP2基因的cDNA序列,反应结束后,对PCR扩增产物进行1%琼脂糖凝胶电泳检测,回收并纯化约700bp的DNA片段。PCR反应体系(10.0μL):cDNA 1.0μL、正向引物(10μM)0.2μL、反向引物(10μM)0.2μL、dNTPs(2.5mM each)0.8μL、10×Pfu Buffer 1.0μL、Pfu DNA聚合酶(5U/μL)0.8μL、ddH2O 6.0μL。PCR反应程序如下:94℃3min;94℃30s,58℃30s,72℃1min,30个循环;72℃5min。
将纯化后的DNA片段连接T载体,连接产物转化大肠杆菌Trans-1 Phage Resistant感受态细胞,将感受态细胞均匀地涂到含有Amp抗生素的LB固体培养基上,待平板表面干燥,倒置平板于37℃培养过夜。挑取抗生素平板上长出的阳性单菌落摇菌,用摇好的菌液作为模板进行PCR鉴定,将PCR鉴定为阳性的菌液取1mL送至长沙铂尚生物技术有限公司进行测序。
测序结果表明,上述约700bp的Fm MLP2基因DNA片段含有SEQ ID No:5所示的868bp核苷酸序列,该868bp核苷酸序列为Fc MLP2基因的编码序列,编码具有SEQ ID No:6所示的由236个氨基酸组成的蛋白,该蛋白具有Kuniz型的蛋白结构域。该蛋白在NCBI上的定位号为AF283533_1。
实施例3、构建Fm MLP2基因表达载体及p1300M-MLP2表达载体转化农杆菌GV3101
Fm MLP2基因表达载体的构建:用天根生化科技(北京)有限公司的质粒小提试剂盒提取实施例2的阳性菌液的质粒。采用限制性内切酶BamH I和Kpn I双酶切pGM-Fc MLP2质粒、pCAMBIA1300M载体(p1300M由湖南农业大学提供),将酶切后的p1300M载体片段与MLP2分别进行回收。酶切后的p1300M载体片段需进行去磷酸化。双酶切反应体系(50.0μL):质粒DNA 25.0μL、10×K Buffer 2.5μL、BamH I 0.5μL、Kpn I 0.5μL、ddH2O 21.5μL。去磷酸化反应体系(60μL):酶切产物50.0μL、10×Buffer 5.7μL、Phophatase 1.0μL、ddH2O 3.3μL。
用T4连接酶将双酶切后的p1300M载体片段与MLP2-1进行连接,连接反应体系(10μL):p1300M载体片段2.0μL、MLP2-1 4.0μL、5×T4Buffer 2.0μL、T4连接酶1.0μL、ddH2O 1.0μL,将连接产物用大肠杆菌Trans-1 Phage Resistant感受态进行转化,挑取单菌落进行摇菌,用摇好的菌液作为模板进行PCR鉴定,对菌液PCR鉴定为阳性的菌落进行质粒提取,然后再进行酶切鉴定。选取酶切结果为阳性的菌液1mL送至长沙铂尚生物技术有限公司测序,测序结果显示Fm MLP2基因表达载体p1300M-MLP2-1构建成功。其余部分按等体积加入甘油,保存于-80℃超低温冰箱。
p1300M-MLP2表达载体转化农杆菌GV3101:将构建好的p1300M-MLP2-1表达载体,利用电击法转化到根癌农杆菌GV3101。为了更加准确地定位到是MLP2-1基因对植物生长发育的影响,同时将p1300M空质粒表达载体转化到根癌农杆菌GV3101。经过菌液PCR凝胶电泳成像后发现p1300M-MLP2-1和p1300M空质粒均有一条符合大小的目的条带,见图3,结果表明p1300M-MLP2-1表达载体和p1300M空质粒都已转入到农杆菌GV3101,可进行后续试验。
实施例4、Fm MLP2转基因拟南芥的获得及鉴定
一、转基因拟南芥的获得
利用农杆菌GV3101介导的花序浸润法将p1300M-MLP2-1表达载体和p1300M空质粒整合到哥伦比亚野生型拟南芥基因组中。待植株成熟后收获并干燥其种子,在超净工作台进行无菌消毒后将其均匀的播种在含潮霉素(浓度为50mg/L)的MS固体培养基上进行筛选,观察其生长的状态。2周左右后将生长状态良好,叶片深绿的幼苗移植在土壤中让其在适宜条件中生长。同样的方式连续筛选,当筛选到第3代时发现在含抗性的MS固体培养基上转基因植株都能存活而野生型则全部死掉,表明转基因植株为纯合植株。
二、转基因植株PCR鉴定
提取经抗生素筛选为阳性转基因植株的基因组DNA,同时以野生型(Wild Type)为对照,以CDS-PF/DS-PR为引物,进行PCR鉴定。结果在T1代鉴定到有4株p1300M-MLP2-1转野生型拟南芥植株呈阳性,在PCR鉴定中这些植株依然呈阳性,且经过测序结果分析依然呈阳性(见图4)。
实施例5、Fm MLP2转基因拟南芥功能分析
将转MLP2基因植株在-6℃处理3h,然后将其转移到正常培养的条件下进行恢复,恢复1天和5天之后与野生型拟南芥(Wild Type)进行对照。
1.转基因植株抗冻表型分析
见图5,通过表型分析可以看出,转基因拟南芥比野生型具有明显的抗冻性。
2.转基因植株生理生化指标分析
2.1、测电导率
电导率大小反应了膜的破坏程度,通过数据分析表明,野生型(Wild Type)的电导率大于转基因植株的,说明野生型植株在冷冻过程中膜的破坏程度比较大(见图6)。
2.2、蛋白酶活性
转MLP2-1植株蛋白酶活性受到抑制,而野生型植株(WT)蛋白酶活性相对较高(见图7)。
2.3、蛋白质相对含量
在解冻期,转MLP2-1植株蛋白质含量降低不明显;在恢复期,蛋白含量逐步回升至受冻前水平,植株重新焕发生机。而野生型植株(Wild Type)在解冻期蛋白质含量下降迅速;在恢复期,蛋白含量进一步下降,最后细胞彻底死亡(见图8)。
综合以上结果得出结论:由于转MLP2-1植株蛋白酶活性较低,功能蛋白质含量较高,转基因植株比野生型的更能耐受寒冷的天气,说明MLP2基因具有抗冻功能。
SEQUENCE LISTING
<110> 湖南农业大学
<120> 金柑Fm MLP2蛋白在增强植物抗冻中的应用
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 20
<212> DNA
<213> 人工合成
<400> 1
atattgtcca ttgtccgagt 20
<210> 2
<211> 20
<212> DNA
<213> 人工合成
<400> 2
aaacagaaca ttcaaagccg 20
<210> 3
<211> 32
<212> DNA
<213> 人工合成
<400> 3
gggtaccatg aagacttcat tgataacaac ac 32
<210> 4
<211> 28
<212> DNA
<213> 人工合成
<400> 4
cgggatcctt acgcggtcat tgatattg 28
<210> 5
<211> 868
<212> DNA
<213> 金柑
<400> 5
gccttccagt ggcaaaaaaa tgaagacttc attgataaca acactctcct tccttatcct 60
taccttggcc acgcagcctc tattgggcat ctcatcaaac tctgaacctg tcttagatat 120
cattggtaac aaggtcaaat ccaccctcga gtataaactt atcccagtcc tagatggcgc 180
cggtggattc agcacacacc taggcacaaa tggacagtgt cccttggacg ttatccaatt 240
aagttctcct agcgaaaggg gagataattt aagattactt ccgtacgaca attacaaaat 300
tgtcaaggta tccactgatg tcaacctgag attccccgta aaagtttctg ttaagccctg 360
taatgaagaa ccattgtgga aagttgatag ctatgacgat cccttaattg taaccggcgg 420
aagtgagggc cacccaggag ctgaaacgtt gataaattgg tttaagattg agaaagctgg 480
aaatttttca tatggtggtg tatacaatat tgtccattgt ccgagtgtct gtctatcttg 540
tcctagacgc tgcaacaaaa ttggcgtttc aactaaggat ggcgttcgac gtctgcttct 600
agttggtgat catgaaccgg ctttgaatgt tctgtttttt ccatcagagg aaagctcaag 660
gctacttcaa gctgctaacg caatatcaag gttttttgaa gctgctgaag caatatcaat 720
gaccgcgtaa tgaatgaact tagctgtatc attctaaata atagaccagg ctagtaacct 780
tttatctcta ttacagaata aaaataacac cgcctgtgat ccttttgctg ttgttaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaa 868
<210> 6
<211> 236
<212> PRT
<213> 金柑
<400> 6
Met Lys Thr Ser Leu Ile Thr Thr Leu Ser Phe Leu Ile Leu Thr Leu
1 5 10 15
Ala Thr Gln Pro Leu Leu Gly Ile Ser Ser Asn Ser Glu Pro Val Leu
20 25 30
Asp Ile Ile Gly Asn Lys Val Lys Ser Thr Leu Glu Tyr Lys Leu Ile
35 40 45
Pro Val Leu Asp Gly Ala Gly Gly Phe Ser Thr His Leu Gly Thr Asn
50 55 60
Gly Gln Cys Pro Leu Asp Val Ile Gln Leu Ser Ser Pro Ser Glu Arg
65 70 75 80
Gly Asp Asn Leu Arg Leu Leu Pro Tyr Asp Asn Tyr Lys Ile Val Lys
85 90 95
Val Ser Thr Asp Val Asn Leu Arg Phe Pro Val Lys Val Ser Val Lys
100 105 110
Pro Cys Asn Glu Glu Pro Leu Trp Lys Val Asp Ser Tyr Asp Asp Pro
115 120 125
Leu Ile Val Thr Gly Gly Ser Glu Gly His Pro Gly Ala Glu Thr Leu
130 135 140
Ile Asn Trp Phe Lys Ile Glu Lys Ala Gly Asn Phe Ser Tyr Gly Gly
145 150 155 160
Val Tyr Asn Ile Val His Cys Pro Ser Val Cys Leu Ser Cys Pro Arg
165 170 175
Arg Cys Asn Lys Ile Gly Val Ser Thr Lys Asp Gly Val Arg Arg Leu
180 185 190
Leu Leu Val Gly Asp His Glu Pro Ala Leu Asn Val Leu Phe Phe Pro
195 200 205
Ser Glu Glu Ser Ser Arg Leu Leu Gln Ala Ala Asn Ala Ile Ser Arg
210 215 220
Phe Phe Glu Ala Ala Glu Ala Ile Ser Met Thr Ala
225 230 235
- 还没有人留言评论。精彩留言会获得点赞!