一种α细胞的制备方法及其产物和用途与流程
本发明属于生物医药技术领域,具体涉及一种α细胞的制备方法及其产物和用途。
背景技术:
α细胞,是一类胰腺胰岛中产生高血糖素的细胞,高血糖素有升高血糖的作用。在胰岛中能量稳态由分泌胰岛素的β细胞和分泌胰高血糖素的α细胞维持,其响应于多种营养因子、神经因子和激素因子,调节血糖平衡。在禁食过夜后,一旦葡萄糖降至阈值7以下,血浆胰高血糖素的水平会显著升高,并且逐渐降低,直至血浆葡萄糖升高至正常范围以上。
I型糖尿病,原名胰岛素依赖型糖尿病,多发生在儿童和青少年,也可发生于各种年龄。起病比较急剧,体内胰岛素绝对不足,容易发生酮症酸中毒,必须用胰岛素治疗才能获得满意疗效,否则将危及生命。当前,用于治疗I型糖尿病的常见疗法包括每日施用外源胰岛素,较为少见的疗法包括全胰腺或胰岛移植等。然而,胰岛素注射通常会引起低血糖和/或高血糖发作,而且一旦给药量不准确,还会引发长期并发症。虽然移植隔离的胰岛或整个胰腺以恢复胰岛功能障碍,获得了一些有希望的结果,但是高质量胰岛供体的有限可用性极大地限制了胰岛移植的临床应用。因此,如何获得替代来源的胰岛或胰岛中的α以及β细胞引起了研究人员的关注。
II型糖尿病原名叫成人发病型糖尿病,多在35~40岁之后发病,占糖尿病患者90%以上。II型糖尿病患者体内产生胰岛素的能力并非完全丧失,有的患者体内胰岛素甚至产生过多,但胰岛素的作用效果较差,因此患者体内的胰岛素是一种相对缺乏,可以通过某些口服药物刺激体内胰岛素的分泌。但到后期仍有一些病人需要使用胰岛素治疗。在II型糖尿病中,可能存在α细胞功能障碍,这可能导致异常的胰高血糖素分泌,最后导致糖尿病的低血糖或高血糖。除了维持血浆葡萄糖水平,α细胞还可以保护和转分化成新的β细胞。然而,由于α细胞群体的可及性和数量有限,这些细胞在胰岛内的功能仍然有待研究。
现有的研究已经证明,胰腺腺泡细胞可以经过重编程,诱导为α,β和γ细胞。诱导的体内内分泌细胞分化先前也已经使用胚胎干细胞(ES),诱导多能干细胞(iPS)和人类多能干细胞(hPSC)。然而,这些细胞是功能失调的,并在体外共表达混合胰腺激素,而且在ES/iPS分化期间的动态染色质重塑抑制了内分泌细胞成熟。此外,来自ES和iPS的部分分化细胞在临床使用时,可能产生不可接受的形成肿瘤的风险。因此,迫切需要一种新的方法诱导内分泌细胞再分化,以制备临床所需的α细胞。
技术实现要素:
本发明针对目前高质量胰岛供体不足,特别是可替代来源性的胰岛α细胞匮乏,极大地限制了胰岛移植的临床应用的技术问题,提供了一种新的α细胞的制备方法及其产物和用途,利用本发明所述制备方法所得α细胞不仅具有天然胰岛α细胞的功能,而且具有稳定、高效、致瘤性低等优点。
为了解决上述技术问题,本发明采取的技术方案之一为:一种α细胞的分化诱导方法,该分化诱导方法包括:在体细胞中过表达以下转录因子:Hhex,Foxa3,Gata4,Pdx1和Pax4。
本发明所述转录因子为本领域常规的转录因子,根据分子生物学知识,所述转录因子(transcription factor,TF)是一群能与基因5`端上游特定序列专一性结合,从而保证目的基因以特定的强度在特定的时间与空间表达的蛋白质分子。
本发明中所述转录因子较佳地为Hhex,Foxa3,Gata4,Pdx1和Pax4,其中Hhex的基因bank登录号(Gene Bank ID)为NM_008245;Foxa3的基因bank登录号为NM_008260;Gata4的基因bank登录号为NM_008092;Pdx1的基因bank登录号为NM_008814;Pax4的基因bank登录号为NM_011038。本发明所述制备方法中,较佳地需要在体细胞中同时过表达上述转录因子。
所述转录因子更佳地还包括Hnfla,其基因bank登录号为NM_009327.3。
转录因子的功能在不同物种间是极为保守的,这种保守最直接的反映就是蛋白序列的相似性。比如小鼠和人类的GATA4基因同源性高达96%。因此,本发明所述的转录因子(或其编码基因)的突变体或衍生物也可被用于本发明中,只要所述突变体或衍生物保留了所述转录因子的相同的生物学功能或活性。在本发明的提示下,所述的转录因子或其编码基因的突变体或衍生物是本领域人员易于获得和应用的。
在另一优选例中,过表达转录因子或其突变体的细胞来源于体细胞或胚胎细胞。
在另一优选例中,过表达转录因子或其突变体的细胞是:成纤维细胞,上皮细胞,血液细胞,神经细胞,胚胎细胞,组织或器官来源的细胞,优选地为成纤维细胞。
在另一优选例中,所述的细胞是哺乳动物细胞。
在另一优选例中,所述的哺乳动物包括但不限于鼠、兔、狗、兔、猴、猪、牛、羊、马,人等。
在另一优选例中,所述的细胞是衰老或凋亡途径被破坏(或抑制)的细胞,也包括永生化的细胞。
在另一优选例中,在细胞中过表达所述的转录因子或其突变体的方法是:
(a)提供用于过表达转录因子或其突变体的细胞;
(b)用表达载体将所述的转录因子或其突变体转入(a)的细胞中;
(c)培养(b)获得的细胞,富集获得转入了所述的转录因子或其突变体的细胞,该细胞就是α细胞。
在另一优选例中,(a)中,所述的细胞是哺乳动物细胞。
在另一优选例中,(a)中,将细胞进行体外培养若干代,较佳地为7-9代。
在另一优选例中,所述的表达载体是病毒。更佳地,所述的病毒是慢病毒。
为了解决上述技术问题,本发明采取的技术方案之二为:一种α细胞,该α细胞是由本发明所述的分化诱导方法制备而成。
本发明所述α细胞,是本领域常规α细胞,特指一类胰腺胰岛中产生高血糖素的细胞,高血糖素有升高血糖的作用。其中所述α细胞较佳地为在体细胞中过表达以下转录因子:Hhex,Foxa3,Gata4,Pdx1和Pax4α分化诱导制备所得的α细胞,该α细胞是由本发明所述的分化诱导方法制备而成。
为了解决上述技术问题,本发明采取的技术方案之三为:一种慢病毒载体,所述慢病毒载体中包括以下转录因子:Hhex,Foxa3,Gata4,Pdx1和Pax4。
其中所述慢病毒载体为本领域常规的慢病毒载体,是指包含了包装、转染、稳定整合的必需遗传信息,可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果的病毒载体。所述慢病毒载体可以有效地感染包括神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种体细胞。
本发明所述慢病毒载体较佳地为pWPI慢病毒载体,该慢病毒载体可以在体细胞中过表达转录因子或其他外源性基因,所述转录因子较佳地包括Hhex,Foxa3,Gata4,Pdx1和Pax4,更佳地还包括Hnfla。所述慢病毒载体
为了解决上述技术问题,本发明采取的技术方案之四为:本发明所述的α细胞在制备药物或者体外模型中的用途。
其中所述的制药用途为本领域常规的制药用途,即利用有效剂量的本发明所述α细胞以及药学上可接受的载体制备药物组合物。所述药物组合物可以用于治疗由于α细胞功能紊乱或者缺乏α细胞所产生的疾病,或者相关的疾病。所述疾病较佳地为糖尿病,所述糖尿病较佳地为I型糖尿病和/或II型糖尿病。
其中所述的体外模型是一种在体外进行与胰腺或者糖尿病相关的疾病或药物的研究模型,所述体外模型较佳地包括细胞模型或动物模型。
为了解决上述技术问题,本发明采取的技术方案之五为:一种药物组合物,所述药物组合物包含有效剂量的α细胞以及药学上可接受的载体。
所述药物组合物包含有效量的所述的α细胞,所述有效量较佳地为1×104-1×1012个,更佳地为1×105-1×1010;以及药学上可接受的载体,所述的组合物对于动物没有可见的毒性和副作用。
所述“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。所述“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在组合物中药学上可接受的载体可含有液体,如水、盐水、缓冲液。另外,这些载体中还可能存在辅助性的物质,如填充剂、润滑剂、助流剂、润湿剂或乳化剂、pH缓冲物质等。所述的载体中还可以含有细胞转染试剂。
所述药物组合物在用于给药时,通常包含1×102-1×1010个细胞/kg体重,较佳的1×103-1×108个细胞/kg体重是适合的,这还取决于临床医师的诊断以及患者的症状轻重程度。所述给药为本领域常规的给药途径。
为了解决上述技术问题,本发明采取的技术方案之六为:一种动物模型,所述动物模型体内导入了如本发明所述的α细胞。
其中所述动物模型为本领域常规的人类疾病的动物模型(animal model of human disease)是指各种医学科学研究中建立的具有人类疾病模拟表现的动物。所述动物疾病模型主要用于实验生理学、实验病理学和实验治疗学(包括新药筛选)研究。较佳地,本发明所述动物模型为植入了如本发明所述的α细胞的动物模型。所述动物模型较佳地为哺乳动物模型,更佳地为小鼠动物模型,优选地为裸鼠。所述动物模型的制备方法为本领域常规制备方法,包括导入和/或植入、置入本发明制备所得α细胞等步骤。
为了解决上述技术问题,本发明采取的技术方案之七为:一种用于分化诱导制备α细胞的试剂盒,所述试剂盒包括以下转录因子:Hhex,Foxa3,Gata4,Pdx1和Pax4。
本发明所述试剂盒包含制备α细胞转录因子Hhex,Foxa3,Gata4,Pdx1和Pax4,更佳地还包括Hnfla,在另一优选例中,所述的试剂盒还含有选自以下的一种或多种:
用于过表达转录因子或其突变体的细胞;
转录因子或其突变体的表达载体(如慢病毒);
胰蛋白酶;细胞培养基(如Block’s medium;I型胶原)以及其他分化诱导制备α细胞所需的制剂或材料。
术语:本发明所述“iAlpha”,表示由成纤维细胞中过表达转录因子,分化诱导所得α细胞,也可称为iAlpha细胞、阿尔法样细胞,或TTF-Iα。
本发明所述“TTF”,表示小鼠的尾尖成纤维细胞,也可称为TTF细胞。
本发明所述“islet”,表示原代胰岛细胞,是胰的内分泌部分,是许多大小不等和形状不定的细胞团,散布在胰的各处,可控制碳水化合物的代谢;如胰岛素分泌不足则患糖尿病,也称为胰岛或胰岛细胞。
如本文所用,除非另外说明,所述的“细胞”或“用于过表达转录因子的细胞”是指多种类的细胞,只要其能够在转入所述的转录因子后形成α细胞。较佳地,所述的细胞是哺乳动物体细胞或胚胎细胞;更佳地,所述的细胞是上皮细胞、成纤维细胞、皮肤细胞、血液细胞,神经细胞,胚胎细胞,组织或器官来源的细胞。所述的细胞可以是已经分化或未分化的。相对于同一个体,尽管有不同的体细胞种类,但各种体细胞的基因组序列均是相同的、其主要组成部分也基本相同,因此易于理解各种体细胞均可用于本申请,只要其能够在转入所述的转录因子后形成α细胞。
高等动物的动物体内有大约300种不同的分化细胞。大部分的成体分化细胞与全能干细胞一样,携带有完整的遗传信息。造成不同分化细胞之间的主要区别是细胞的表观遗传修饰的不同,导致细胞特异基因表达的不同。成体细胞的表观遗传修饰是可以被修饰的,从而实现不同细胞间的转化。比如成体细胞已被证明可以被重编程到全能干细胞,最近一些研究发现通过过表达某些基因,也可以实现将小鼠胚胎纤维细胞直接重编程为神经细胞。
如本文所用,所述的“过表达”是指细胞内转录因子的含量(如表达量)超过初始细胞(未转入该外源基因的细胞)的水平;如与初始细胞相比,其含量高20%,较佳地高50%;更佳地高100%以上,如高200%,300%...500%或更高。一种“过表达”的情形是将外源的转录因子的编码基因转入细胞中且发生表达。
如本文所用,所述的“哺乳动物”是脊索动物门(Chordata)脊椎动物亚门(Vertebrata)哺乳纲(Mammalia)的动物。本发明所述的哺乳动物包括人,也包括非人哺乳动物。所述的非人哺乳动物例如是小鼠、大鼠、兔、狗、兔、猿猴、猪、牛、羊、马等等。不管是非人哺乳动物还是人,在基因组的组成、个体的发育、代谢方式、器官解剖、疾病发病机制等方面都非常接近。在进化过程中,一些关键的细胞功能或者调控通路在不同的物种之间是非常保守的。比如细胞增殖、凋亡的信号通路在哺乳动物中基本一致。细胞的衰老途径也是一个非常保守的调控机制。
在本发明的一些实施方式中,以鼠作为模式生物,和人类相比,它无论在基因组的组成、个体的发育、代谢方式、器官解剖、疾病发病机制等都和人类非常接近;因此,本发明列举的一些适用于鼠的情况可以毫无疑义地适用于人等其它哺乳动物。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:(1)本发明揭示了一种新的分化诱导制备α细胞的方法,本方法对糖尿病的研究和治疗以及相关再生医学的应用具有重要作用;
(2)本发明还优化了分化诱导制备α细胞的方法,找到了较佳的转录因子组合,只要在体细胞中过表达本发明所述的转录因子组合,就能够制备具有正常功能的α细胞。利用本发明所述方法制备所得的α细胞不仅具有天然胰岛α细胞的功能,而且具有稳定、高效、致瘤性低等优点,是一种潜在的临床可替代资源。
附图说明
图1为制备所得α细胞为免疫荧光染色分析结果图。
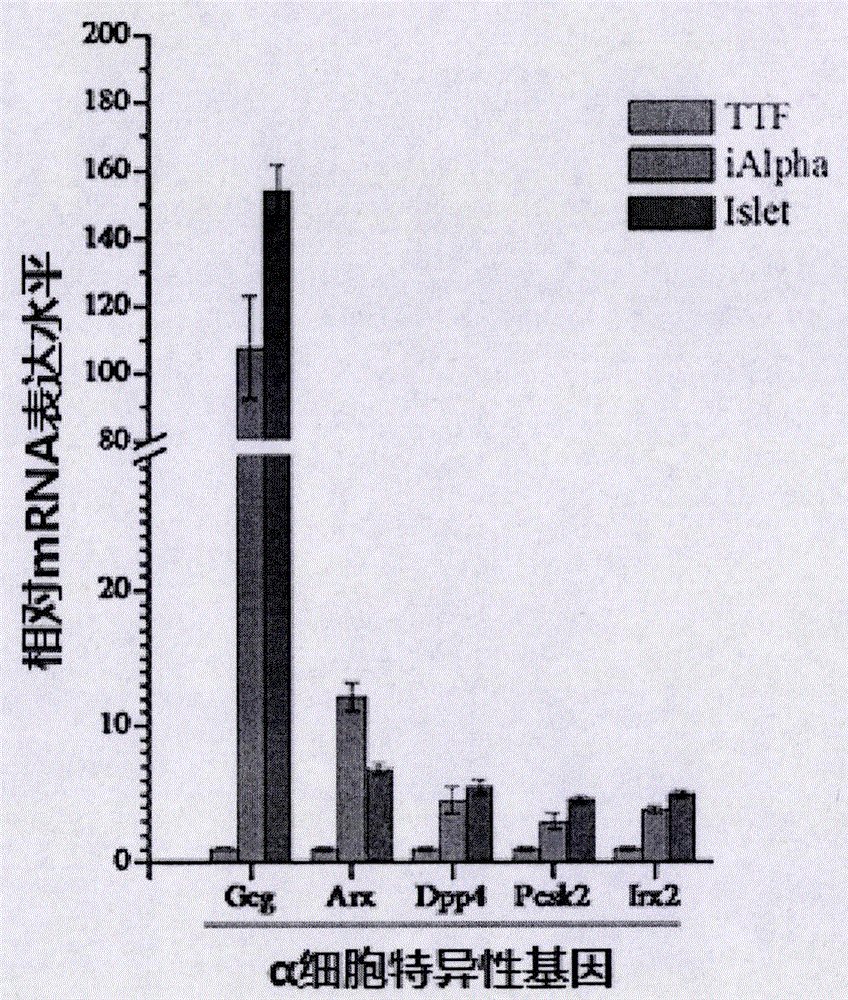
图2为制备所得α细胞中α细胞特异性的转录因子的表达分析结果图。
图3为制备所得α细胞响应葡萄糖的胰高血糖素分泌分析结果图。
图4为制备所得α细胞的微阵列芯片分析结果图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室指南(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。以下的实施例用于为本领域中的普通技术人员提供有关如何实施和使用本发明的完整披露和描述,并且这些例子并非意在对发明人所认为的发明范围进行限制,亦非意指下文的实验是被实施的全部实验而且是仅可实施的实验。
实施例1将成纤维细胞分化诱导,制备α细胞
1、分子克隆以及慢病毒构建
将多克隆位点(如序列表中SEQ ID NO:21所示)插入到慢病毒载体pWPI(购买自Addgene,Cambridge,MA,USA)的PmeI限制性位点中。将启动子(候选基因)的cDNA克隆到修饰的pWPI质粒中。然后将质粒与包装质粒psPAX2(购买自Addgene)和包膜质粒pMD2.G(购买自Addgene)一起导入293FT细胞,具体方法请参见相关质粒产品说明书。48小时后,收集含有慢病毒的培养基并通过0.45-mm滤膜进行过滤。所述启动子(候选基因)的基因信息为:Hhex的基因bank登录号(Gene Bank ID)为NM_008245;Foxa3的Gene Bank ID为NM_008260;Gata4的Gene Bank ID为NM_008092;Pdx1的Gene Bank ID为NM_008814;Pax4的Gene Bank ID为NM_011038。
2、分离培养成纤维细胞
为了分离尾尖成纤维细胞(TTF细胞),从2个月大的p19Arf-/-小鼠的尾部,切下5cm部分的组织。在去除真皮后,将剩余的组织切碎并与0.25%胰蛋白酶(Gibco)在37℃温育15分钟。将处理后的组织碎片置于含有10%FBS(购买自Sigma-Aldrich)的5mL DMEM(购买自Sigma-Aldrich,St.Louis,MO)培养基,并被60-mm胶原I包被的培养皿中进行培养。5天后,将迁移出组织的成纤维细胞转移至新的胶原蛋白涂覆的培养皿进行培养。
3、慢病毒转染
将TTF接种在胶原蛋白I包被的培养皿上,并用表达转录因子的慢病毒感染。然后将细胞在含有0.1μM地塞米松,20μg/mL TGFα,10μg/mL EGF,4.2mg/mL胰岛素,3.8mg/mL人转铁蛋白和5μg/mL亚硒酸钠的Block培养基中培养。感染后14天,用0.01%胰蛋白酶处理细胞并弃去分离的成纤维细胞以富集上皮细胞。
4、分化诱导制备α细胞
在病毒感染前一天,将成纤维细胞以5×103细胞/孔的密度,接种在96孔板中。在每个孔中,加入1×108TU/mL的病毒,以获得80%感染率,其72小时的感染复数(MOI)为20,即得iAlpha细胞,该细胞也可称为:本发明制备所得α细胞。
5、原代胰岛分离和培养
从成年p19Arf-/-鼠收获胰腺,并转移到含有5mL冷胶原酶P(购买自Roche,San Francisco,CA,USA)的15mL管中。在37℃水浴中孵育18-20分钟后,用5mL由包含10%FBS的HBSS组成的猝灭缓冲液洗涤组织,并通过在室温下以300×g离心3分钟来分离组织。用另外10mL冷淬灭缓冲液洗涤组织,在300×g离心3分钟,并用2mL的25%Ficoll(购买自Sigma;F8016)温育。加入23%,21%和13%的Ficoll梯度后,将组织在4℃以2500×g离心20分钟。胰岛层在13%和23%梯度之间可见。收集胰岛并用10mL常规细胞培养基洗涤,以1000×g离心5分钟,并重悬于1mL RPMI 1640-完全培养基(购买自Biowest LLC,Kansas City,MO,USA)中。制备所得原代胰岛细胞为islet或称为islet细胞。
实施例2制备所得α细胞的功能分析及结果
1、动物模型
p19Arf-/-小鼠(由奥地利Research Institute of Molecular Pathology提供,参考文献:Cell.1997Nov 28;91(5):649-59)和裸鼠(购买自上海斯莱克实验动物有限责任公司)维持在无特定病原体的饲养条件下。裸鼠用作iAlpha细胞的接受者以减少移植后的免疫排斥。
2、免疫荧光染色分析及结果
免疫荧光染色方法包括以下步骤:将细胞在室温下用4%多聚甲醛固定15分钟,然后用含有0.2%Triton X-100(购买自Sigma)的PBS孵育15分钟。然后用PBS洗涤细胞三次。在室温下用PBS中的3%牛血清白蛋白(BSA)封闭60分钟后,将细胞与在3%BSA中在4℃稀释的小鼠抗胰高血糖素(购买自Millipore,Billerica,MA)一抗温育过夜,洗涤用PBS洗涤3次,然后在室温下在黑暗中用在3%BSA中稀释的Cy3-缀合的山羊抗小鼠IgG(购买自Jackson Laboratories,Farmington,CT,USA;1:1,000)温育60分钟。用DAPI(购买自Sigma)对细胞核染色。
免疫荧光染色结果如图1所示,图1为实施例1制备所得α细胞为免疫荧光染色分析结果图。该结果表明:本发明制备所得iAlpha细胞均表达胰高血糖素,具备天然来源的α细胞的功能。
3、实时定量Real-PCR分析及结果
利用Trizol(购买自Invitrogen,Carlsbad,CA,USA)从细胞中分离总RNA,根据制造商的说明书,用M-MLV逆转录酶(购买自Promega,Madison,WI,USA)将总共1mg的RNA逆转录成cDNA。用HiFiTaq聚合酶(购买自TransGen Biotech,北京,中国)进行PCR。使用SYBR Premix Ex Taq(购买自TaKaRa Bio,Kusatsu,Japan)在ABI 7500快速实时PCR系统(Applied Biosystems Foster City,CA,USA)上进行定量实时PCR。引物序列如表1所示:
表1 Real-PCR分析引物序列表
为了进一步检测表达胰高血糖素的iAlpha细胞中特定基因的表达情况,利用荧光定量PCR方法(Real-time PCR方法,具体方法请参阅分子克隆技术手册)检测了以下α细胞特异性的转录因子mRNA表达情况,所述转录因子包括:Arx、Dpp4、Pcsk2以及Irx2。所得结果表明:与TTF细胞相比,iAlpha细胞中α细胞特异性的转录因子的表达都有显著增加,其结果如图2所示,图2为制备所得α细胞中α细胞特异性的转录因子的表达分析结果图。以上结果表明,本发明制备所得α细胞能够稳定表达野生型α细胞特异性的基因和转录因子。
为了测定诱导转化所得iAlpha细胞的稳定性,我们分析了在iAlpha细胞中转录因子表达的动态变化情况。分析结果显示:Gata4的mRNA的表达随时间显著降低(全部p<0.001),这可能是由于细胞增殖诱导的稀释;然而,它在iAlpha细胞比TTF相比更高(p<0.001)。与其他分析的时间点(所有p≤0.001)相比,Pax4,Gata6和Wnt3a的mRNA表达在第5天显著更高。此外,Hhex和Irx2的mRNA表达在第7天显著更高(全部p≤0.001),并且FoxA3mRNA表达在第9天显著更高(全部p<0.001)。最后,Pdx1的mRNA表达在第7天和第9天显著更高(全部p<0.001)。
葡萄糖和胰岛素的受体以及α细胞中的胰高血糖素转运蛋白对胰高血糖素感知和分泌至关重要。它们在iAlpha细胞中的表达的分析揭示胰高血糖素转运蛋白,InsR,Glut2和转甲状腺素蛋白(Ttr)mRNA表达显著较高在iAlpha细胞相比TTFs(所有p≤0.008)。此外,与TTF相比,iAlpha细胞和胰岛中的胰高血糖素含量显著更高(p<0.001);然而,胰岛素组中的胰岛素水平显著高于TTF和iAlpha细胞(p<0.001)。上述结果表明,本发明制备所得iAlpha细胞不仅可以稳定表达天然来源α细胞的特异性基因,还可以稳定分泌胰高血糖素,具备天然来源α细胞的功能。
胰高血糖素分泌的分析结果显示,与TTF相比,iAlpha细胞和胰岛对0.4mM葡萄糖的响应显著增加(全部p≤0.02);没有观察到与15mM葡萄糖的差异。然而,仅在胰岛组中观察到响应于KCl和Arg的胰岛素分泌增加(全部p<0.001),结果如图3所示,图3为制备所得α细胞为响应葡萄糖的胰高血糖素分泌分析结果图。胰高血糖素分泌的分析结果表明,本发明制备所得α细胞不仅可以对葡萄糖产生响应,而且可以有效分泌胰高血糖素。
4、酶联免疫检测分析(ELISA)及结果
为了确定胰岛素和胰高血糖素分泌的程度,将本发明制备所得α细胞在不含酚红的培养基中培养。用15mM葡萄糖,30mM KCl和15mM精氨酸刺激不同时间后,收集培养物上清液。根据制造商的说明书,分别通过小鼠胰高血糖素和胰岛素ELISA试剂盒(购买自Alpco diagnostics,Salem,NH,USA)测定上清液中胰高血糖素和胰岛素的量。ELISA测定结果显示,在细胞移植后1周和8周时,小鼠的血浆胰岛素和血浆胰高血糖素均有升高。结果表明,本发明制备所得α细胞可以有效分泌胰高血糖素并诱导胰岛素的分泌增加。
5、微阵列芯片以及信号通路分析及结果
从培养6天的p19Arf-/-TTF、p19Arf-/-胰岛以及本发明制备所得α细胞提取总RNA,进行全小鼠基因组表达微阵列分析(微阵列芯片购买自Agilent,Santa Clara,CA),根据产品说明书进行操作。所得数据通过Gene-Spring(Agilent)标准化,微阵列杂交和分析由上海生物(Shang hai Bio)合作进行。在43,400个注释基因中,选择表达水平在p19Arf-/-TTF和原代胰岛之间至少五倍不同的3,942个基因用于分析。通过Cluster 3.0软件进行样品的分级聚类,用无中心相关相似性度量的平均连接用于样本的聚类。原始数据上传到Gene Expression Omnibus数据库。
微阵列芯片分析结果显示:在总数为43,400的注释基因中,1,079和3,942个基因分别在iAlpha细胞和胰岛细胞中上调了5倍,并且其中694个基因在两者中都有上调,其结果如图4所示,图4为制备所得α细胞的微阵列芯片分析结果图。该结果表明,转导了本发明制备所得α细胞的小鼠,其基因表达模式与正常胰岛基因表达模式具有相似性和一致性。
对通路分析的结果表明,在胰岛中激活的20个通路中,有17个通路都在iAlpha细胞和胰岛细胞中被激活,其结果如表2所示。
表2 细胞中信号通路激活分析结果
上述分析结果表明:TTF细胞被成功诱导转化为α样细胞(iAlpha细胞),而没有被转化为其他胰腺谱系细胞。
6、胰岛素耐受试验(ITT)和葡萄糖耐受检测(GTT)级结果
胰岛素耐受试验(ITT)包括以下步骤:在3小时快速升糖后,通过静脉内注射给小鼠施用人胰岛素100(购买自Eli Lilly and Company,Indianapolis,IN,USA;1IU/kg),并使用Accu-Chek Inform Blood Glucose监测系统进行检测(购买自Roche Diagnostics,Indianapolis,IN,USA)。
葡萄糖耐受检测(GTT)包括以下步骤:12小时禁食后,向小鼠腹膜内(i.p.)给予葡萄糖(1g/kg),并使用Accu-Chek Inform Blood Glucose Monitoring System(购买自Roche Diagnostics)测量血糖水平。
为了验证iAlpha细胞的生理功能,在裸鼠中测试其对刺激的敏感性,在所述裸鼠在肾胶囊中移植1×106个iAlpha细胞或TTF。在移植后第2,4和8周测量体重,比较ITT和GTT结果。在2周时,移植有TTF或iAlpha细胞的裸鼠的体重之间没有显著差异(p>0.05)。相比之下,在4周时,与接受TTF移植的小鼠相比,移植有iAlpha细胞的小鼠的体重显著降低
在2周时,ITT发现延迟的血糖水平降低。具体来说,在0和30分钟,ITT的平均葡萄糖水平在iAlpha细胞中显著高于TTF(p≤0.016)。在4周时,ITT显示在0和30分钟时在iAlpha-和TTF-移植的小鼠中有显著差异(p≤0.01)。此外,GTT显示与在0分钟时接受TTF的小鼠相比,在移植有iAlpha细胞的小鼠中葡萄糖水平较高(p=0.01)。然而,在8周时,组之间ITT和GTT没有显著差异。以上结果证明,iAlpha细胞移植可以有效调控体内的血糖调节。
接下来检测iAlpha细胞移植后的胰岛变化。iAlpha细胞受体的胰岛中的Ki67阳性细胞以及Ins阳性细胞(β-细胞)的比例高于在TTF受体中观察到的比例(Ki67,4.67%±1.65对比0.79%±0.81;Ins,分别为72.89%±0.76与46.57%±0.92;两者p<0.05);然而,胰岛中胰高血糖素阳性细胞(α细胞)的比例降低(分别为12.45%±0.56vs。19.57%±0.41;p<0.05)。这些结果表明iAlpha细胞减少受体胰岛中α-β细胞的比例,这可能是由于α细胞向胰岛β细胞的转分化。以上结果说明,本发明所得iAlpha细胞具有向β细胞的转分化的能力。
7、肿瘤生成检测及结果
人胰腺肿瘤细胞系α-TC(购买自中国科学院细胞库)在与iAlpha细胞相同的培养基中培养,如上所述诱导和富集iAlpha细胞。诱导28天后,通过胰蛋白酶分离细胞并悬浮在PBS中。向7只裸鼠的肾脏中注射5×106个iAlpha细胞和α-TC细胞。注射后4周计数肿瘤数。
显著地,iAlpha细胞在裸鼠移植后8周不形成肿瘤,而α-TC细胞,α肿瘤细胞系形成肿瘤。此外,移植物中的iAlpha细胞为PCNA阴性,表明它们不可能诱导肿瘤形成。以上结果表明,本发明所得iAlpha细胞具有极低的致瘤风险。
8、免疫组织化学分析及结果
将石蜡包埋的4μm厚的胰腺切片在二甲苯中脱蜡并在分级的醇中再水合。载玻片在室温下用高碘酸处理10分钟,然后将它们在5%正常血清中在室温下在潮湿室中温育1小时。对于胰高血糖素,胰岛素和Ki67的免疫组织化学染色,使用多克隆兔抗胰高血糖素抗体(购买自Millipore;1∶100),兔抗小鼠胰岛素抗体(购买自Millipore;1∶200)或兔抗小鼠抗Ki67抗体(购买自Millipore;1∶2000)作为初级抗体。第二抗体是以1∶100稀释的HRP--缀合的山羊抗兔IgG抗体(购买自Dako,Denmark)。所有抗体在0.5%BSA中稀释。根据制造商的说明书,通过DAB液体系统(购买自Dako)显现反应性。切片用苏木精复染。
免疫组织化学分析(棕色染色)结果证实:肾囊中的iAlpha细胞存活,而且表达胰高血糖素,上述结果表明本发明制备所得α细胞能够正常表达胰高血糖素,具有控制血糖代谢的功能。
本发明所有数据表示为平均值和标准偏差(SD)。对于大多数统计学评价,在发明中应用不成对的student t检验来计算统计概率。如果存在≥3组,进行通过Bonferroni方法调整的事后检验的单因素方差分析,用于组比较。使用科学统计程序软件(SPSS,IBM)进行统计计算。对于所有分析,使用来自至少三个独立样品或重复实验的数据。
综上所述,通过本发明阐述的制备方法,可以通过在体细胞中过表达转录因子分化诱导制得α细胞,本发明制备所得α细胞(iAlpha细胞)不仅能够稳定表达天然α细胞的基因和胰高血糖素、调节血糖代谢的功能,还可以诱导胰岛细胞的生成,此外还具有致瘤性低的优点,是一种来源广泛的、高效、稳定以及安全的治疗糖尿病的可替代性临床资源。
应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!