单核铁络合物和使用了其的有机合成反应的制作方法
本发明涉及具有铁-硅键的单核铁络合物,更详细地说,涉及在工业上有用的氢化硅烷化反应、氢化反应和羰基化合物的还原反应的至少1个反应中具有催化活性的单核铁络合物。
背景技术:
使si-h官能性化合物与具有碳-碳双键、碳-碳三键的化合物进行加成反应的氢化硅烷化反应是合成有机硅化合物的有用的手段,也是工业上重要的合成反应。
作为该氢化硅烷化反应的催化剂,已知pt、pd、rh化合物,其中最多使用的催化剂为以speier催化剂、karstedt催化剂为代表的pt化合物。
作为以pt化合物作为催化剂的反应的问题,可列举出使si-h官能性化合物加成于末端烯烃时发生烯烃内部重排的副反应。该体系中,由于对于内部烯烃不显示加成反应性,未反应烯烃在加成生成物中残留,因此为了使反应完成,需要估算因副反应而残留的部分以预先使用过量的烯烃。
另外,根据烯烃的种类,也存在α加成体和β加成体的选择性差的问题。
最大的问题在于作为中心金属的pt、pd、rh都为价格极高的贵金属元素,希望有能够更为低价地使用的金属化合物催化剂,因此进行了为数众多的研究。
例如,已知采用铁-羰基络合物(fe(co)5、fe3(co)12)的反应(非专利文献1),但在该反应中160℃这样的高温下的反应条件或光照射(非专利文献2)是必要的。
也报道了使用了具有环戊二烯基作为配体的铁-羰基络合物的、甲基乙烯基二硅氧烷与甲基氢二硅氧烷的反应例(非专利文献3),但在该反应中脱氢硅烷化反应优先地进行。
在具有吡啶系配体的铁催化剂的反应中(非专利文献4),不仅作为反应助剂需要大量过剩的还原剂(nabhet3),而且虽然phsih3、ph2sih2对于烯烃进行加成,但有用性更高的三烷基硅烷类、烷氧基硅烷类、硅氧烷类对于烯烃的加成反应性缺乏。
也报道了具有双亚氨基吡啶配体的fe络合物(非专利文献5、6),公开了对于烷氧基硅烷类、硅氧烷类在温和的条件下也显示优异的反应性。但是,在使用了该络合物的反应中,存在如下等问题:对于内部烯烃的反应性低,络合物合成时使用由禁水性的钠和毒性高的汞构成、需要注意处置的na汞齐(或者使用禁水性的nabet3h),配位化合物自身的稳定性低,在处理上需要手套箱等特殊的设备,除此以外,必须在氮气氛下进行保存。
另一方面,对于烯烃的氢化反应,有大量的报道。例如,报道了使用了fe(co)5作为催化剂的、采用热反应的氢化(非专利文献7)、采用光反应的氢化(非专利文献8)。但是,对于热反应而言,需要高温(180℃)、高压(28个大气压)条件,并且转换数也低达0.5,不能说具有充分的活性。另外,光反应虽然在室温下也进行,但转换数为33,不充分。
非专利文献9中报道了以有机铝化合物作为反应助剂、使用了铁催化剂的反应例,但转换数为17,催化活性低。
非专利文献10中报道了将格利雅化合物和氯化铁催化剂并用的反应例,但对于该体系而言,虽然在室温下进行反应,但高压(20个大气压)条件是必要的,并且转换数也低达20。
也报道了具有磷系化合物作为配体的铁催化剂(非专利文献11),但对于该体系而言,虽然在室温下在较低压(4个大气压)的条件下进行反应,但反应基质限于苯乙烯和一部分的烯烃化合物,并且转换数也不能说充分。
另外,上述非专利文献5中也报道了具有双亚氨基吡啶配体的fe催化剂的例子,在室温下、较低压(4个大气压)条件下转换数为1814,具有良好的反应性,但对于该反应而言,与上述具有双亚氨基吡啶配体的fe络合物同样地,存在合成时的安全性、化合物的稳定性等问题。
另外,非专利文献12中公开了固定于高分子的铁催化剂,具有可重复再使用的优点,但作为溶剂,水的利用是必需的,适用范围窄。
非专利文献13中公开了固定于有机·无机复合体(mof)的铁催化剂,具有可重复再使用的优点,但需要用强还原剂使催化剂前体活化。
就这些以往的催化剂而言,尚未报道应用于通常认为困难的3~4取代烯烃的氢化反应的例子。
非专利文献14公开了对于通常认为困难的4取代烯烃的氢化反应有效的单核铁络合物,但需要长时间(48小时)的反应时间,并且转换数也低达20。
作为将羰基化合物还原的方法,有在铝、硼的氢化合物、贵金属催化剂存在下使用氢的方法。已知在羰基化合物中对于酮、醛可在温和的条件下进行反应的、稳定且容易处置的氢化物反应剂、氢化用贵金属催化剂,但在酯、酰胺这样的羧酸衍生物的还原中主要采用使用氢化锂铝、硼烷等强力的还原剂的方法(非专利文献15)。但是,这些还原剂由于为着火性、禁水性物质,因此处置上存在难点。另外,将反应后的铝或硼化合物从目标物除去时对处置也需要注意。此外,在羧酸衍生物的还原中需要高温高压的氢。
报道了大量使用在空气中稳定且处置容易的氢硅烷化合物、甲基氢聚硅氧烷作为还原剂的方法,但反应中需要强酸或路易斯酸的添加、高价的贵金属催化剂。最近,报道了以低价的铁作为催化剂的羰基化合物的还原反应,就其中的一部分而言,也出现了适用于对于现有方法而言需要苛刻的条件的酰胺的还原反应的例子。作为具体的铁催化剂的例子,可列举出非专利文献16~21,希望有显示出更高的转换数的高活性催化剂。
另外,作为对于氢化硅烷化反应、氢化反应或羰基化合物的还原反应显示催化活性的金属配位化合物,报道了单核钌络合物(非专利文献22~24)。使用了这些钌络合物的情况下,上述反应可在比较温和的条件下进行,但如上述那样,需要使用了价格更低的金属的催化剂。
现有技术文献
非专利文献
非专利文献1:a.n.nesmeyanov等,tetrahedron,1962,17,61
非专利文献2:m.s.wrighton等,j.organomet.chem.,1977,128,345
非专利文献3:h.nakazawa等,j.am.chem.soc.,2012,134,804
非专利文献4:h.nakazawa等,organometallics,2012,31,3825
非专利文献5:p.j.chirik等,j.am.chem.soc.,2004,126,13794
非专利文献6:p.j.chirik等,science,2012,335,567
非专利文献7:frankel等,j.org.chem.,1964,29,3292
非专利文献8:m.s.wrighton等,j.am.chem.soc.,1976,98,551
非专利文献9:r.e.harmon等,j.chem,rev.,1973,73,21
非专利文献10:l.lefort等,daltontrans.,2010,39,8464
非专利文献11:j.c.peters等,inorg.chem.,2004,43,7474
非专利文献12:r.hudson等,greenchem,2013,15,2141.
非专利文献13:k.manna等,j.am.chem.soc.,2014,136,13182.
非专利文献14:p.j.chirik等,acs.catal.,2012,2,1760
非专利文献15:w.r.brown,organicreactions,1941,6,470
非专利文献16:h.nagashima等,angew.chem.int.ed.,2009,48,9511
非专利文献17:m.beller等,angew.chem.int.ed.,2009,48,9507
非专利文献18:h.nishiyama等,angew.chem.int.ed.,2010,49,9384
非专利文献19:h.nishiyama等,chem.eur.j.,2010,16,3090
非专利文献20:h.nagashima等,chem.commun.,2011,47,6581
非专利文献21:m.beller等,angew.chem.,2012,51,1662
非专利文献22:大串元·砂田祐輔·永島英夫、ジシラメタラサイクル骨格を有する新規ルテニウム錯体の開発と触媒作用、日本化学会第94春季年会予稿集、2014、2pb-039(大串元·砂田祐辅·永岛英夫、具有二硅金属环骨架的新型钌络合物的开发和催化剂作用、日本化学会第94春季年会预备稿集、2014、2pb-039)
非专利文献23:砂田祐輔·井上諒子·大串元·永島英夫、ジシラメタラサイクル骨格を持つ新規ルテニウム錯体の開発と触媒機能、第61回有機金属化学討論会予稿集、2014、2pb-13(砂田祐辅·井上谅子·大串元·永岛英夫、具有二硅金属环骨架的新型钌络合物的开发和催化剂功能、第61次有机金属化学讨论会预备稿集、2014、2pb-13)
非专利文献24:大串元·山本泰士·砂田祐輔·永島英夫、ジシラメタラサイクル骨格を持つ新規ルテニウム錯体の開発と触媒作用、第18回ケイ素化学協会シンポジウム、2014、p43(大串元·山本泰士·砂田祐辅·永岛英夫、具有二硅金属环骨架的新型钌络合物的开发和催化剂作用、第18次硅化学协会专题论文集、2014、p43)
技术实现要素:
发明要解决的课题
本发明鉴于这样的实际情况而完成,目的在于提供在氢化硅烷化反应、氢化反应和羰基化合物的还原反应这三个反应的至少1个反应中可发挥优异的催化活性、具有铁-硅键的单核铁络合物、和使用该络合物在温和的条件下进行各反应的方法。
用于解决课题的手段
本发明人为了实现上述目的进行了深入研究,结果发现具有铁-硅键的规定的单核铁二价络合物在氢化硅烷化反应、氢化反应和羰基化合物的还原反应的至少1个反应中可发挥优异的催化活性,在温和的条件下进行各个反应,完成了本发明。
即,本发明提供:
1.单核铁二价络合物,其特征在于,由式(1)表示,
[化1]
(式中,r1~r6相互独立地表示氢原子、可被x取代的、烷基、芳基、芳烷基、有机氧基、单有机氨基、二有机氨基、单有机膦基、二有机膦基、单有机甲硅烷基、二有机甲硅烷基、三有机甲硅烷基或有机硫基,或者表示r1~r3的任一个与r4~r6的任一个的至少1组一起形成的交联取代基,x表示卤素原子、有机氧基、单有机氨基、二有机氨基或有机硫基,l1表示选自异腈、胺、亚胺、含氮杂环、膦、亚磷酸酯和硫醚中的至少一种的二电子配体,存在多个l1的情况下,2个l1可相互结合,l2表示co配体和上述l1以外的二电子配体,存在多个l2的情况下,2个l2可相互结合,m1表示1~4的整数,m2表示0~3的整数,m1+m2满足3或4。)
2.1的单核铁二价络合物,其中,上述l1表示异腈(其中,存在多个l1的情况下,2个l1可相互地结合),
3.1或2的单核铁二价络合物,其中,上述l2为三有机氢硅烷(其中,存在多个l2的情况下,2个l2可相互结合),
4.1~3的任一项的单核铁二价络合物,其中,上述m1和m2都为2,
5.4的单核铁二价络合物,其中,上述r1~r6相互独立地为可被x取代的、烷基、芳基或芳烷基(x表示与上述相同的含义。),并且上述l2为由h-sir7r8r9和h-sir10r11r12(式中,r7~r12相互独立地表示可被x取代的、烷基、芳基或芳烷基,x表示与上述相同的含义。)表示的三有机氢硅烷,r1~r3的任一个、与r4~r6的任一个的至少1组或r7~r9的任一个的至少1组可一起而形成交联取代基,或者r10~r12的任一个、与r4~r6的任一个的至少1组或r7~r9的任一个的至少1组可一起而形成交联取代基,r1~r3的任一个、与r4~r6的任一个的至少1组或r7~r9的任一个的至少1组一起而形成交联取代基,并且r10~r12的任一个、与r4~r6的任一个的至少1组和r7~r9的任一个的至少1组可一起而形成交联取代基,
6.1~5的任一项的单核铁二价络合物,其中,上述r1~r3的任一个与r4~r6的任一个一起而形成了交联取代基,
7.5的单核铁二价络合物,其中,上述r1~r3的任一个、与r4~r6的任一个或r7~r9的任一个一起而形成了交联取代基,并且r10~r12的任一个、与r4~r6的任一个和r7~r9的任一个中没有参与上述交联取代基的形成的si上的取代基一起而形成了交联取代基,
8.7的单核铁二价络合物,其中,上述r1~r3的任一个、与r4~r6的任一个一起而形成了可被y取代的邻亚苯基(y表示氢原子、卤素原子、碳数1~10的烷基或碳数1~10的烷氧基,存在多个y的情况下它们可彼此相同,也可不同),并且r10~r12的任一个与r7~r9的任一个一起而形成了可被y取代的邻亚苯基(y表示与上述相同的含义。),
9.催化剂,其包含1~8的任一项的单核铁二价络合物,在选自氢化硅烷化反应、氢化反应和羰基化合物的还原反应中的至少1个反应中具有活性,
10.加成化合物的制造方法,其特征在于,在9的催化剂的存在下,使具有脂肪族不饱和键的化合物与具有si-h键的氢化硅烷或有机氢聚硅氧烷进行氢化硅烷化反应,
11.烷烃化合物的制造方法,其特征在于,在9的催化剂的存在下,使具有脂肪族不饱和键的化合物进行氢化,
12.胺化合物的制造方法,其特征在于,在9的催化剂的存在下,用具有si-h键的硅烷或有机氢聚硅氧烷将酰胺化合物还原,
13.醇化合物的制造方法,其特征在于,在9的催化剂的存在下,用具有si-h键的硅烷或有机氢聚硅氧烷将醛化合物、酮化合物或酯化合物还原。
发明的效果
如果使用本发明的单核铁络合物作为催化剂,进行含有脂肪族不饱和基团的化合物和具有si-h基的硅烷或者聚硅氧烷的氢化硅烷化反应,则可以在室温~100℃以下的条件下进行加成反应。与工业上特别有用的聚硅氧烷以及三烷氧基硅烷和二烷氧基硅烷的加成反应良好地进行。进而,在公知文献中屡次示出在该反应中与对不饱和基团的加成反应相比,通过脱氢硅烷化反应生成含有不饱和基团的化合物的反应优先进行,但如果使用本发明的催化剂,则对不饱和基团的加成反应优先地进行。
氢化反应能够在室温~100℃和氢气1~20个大气压左右的温和的条件下进行,并且对于采用以往的方法困难的多取代烯烃的氢化也有效。
在羰基化合物的还原反应中,通过使酰胺化合物、醛化合物、酮化合物、酯化合物与处理容易的具有si-h基的硅烷或聚硅氧烷反应,从而能够得到目标的还原化合物。
附图说明
图1为实施例1中得到的铁络合物a的1h-nmr波谱图。
图2为实施例1中得到的铁络合物a的13c-nmr波谱图。
图3为表示实施例2中得到的铁络合物b的结构的图。
图4为实施例2中得到的铁络合物b的1h-nmr波谱图。
图5为实施例3中得到的铁络合物c的1h-nmr波谱图。
具体实施方式
以下对本发明更详细地说明。
本发明涉及的单核铁络合物如由式(1)表示那样,是具有2个fe-si键、并且一氧化碳(co)以外的二电子配体(l1,l2)(l1为1个以上并且l1和l2的合计为3个或4个)配位于fe的二价络合物。
[化2]
式(1)中,r1~r6相互独立地表示氢原子、可被x取代的、烷基、芳基、芳烷基、有机氧基、单有机氨基、二有机氨基、单有机膦基、二有机膦基、单有机甲硅烷基、二有机甲硅烷基、三有机甲硅烷基、或有机硫基,或者表示r1~r3的任一个与r4~r6的任一个的至少1组在一起而成的交联取代基,x表示卤素原子、有机氧基、单有机氨基、二有机氨基、或有机硫基。
作为烷基,可以为直链、分支链、环状的任一种,另外,对其碳数也无特别限定,优选为碳数1~30的烷基,更优选为碳数1~10的烷基,作为其具体例,可列举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基、正十三烷基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、正十九烷基、正二十烷基等直链或分支链烷基;环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基等环烷基等。
作为芳基,对其碳数也无特别限定,优选为碳数6~30的芳基,更优选为碳数6~20的芳基,作为其具体例,可列举出苯基、1-萘基、2-萘基、蒽基、菲基、邻-联苯基、间-联苯基、对-联苯基等。
作为芳烷基,对其碳数也无特别限定,优选为碳数7~30的芳烷基,更优选为碳数7~20的芳烷基,作为其具体例,可列举出苄基、苯基乙基、苯基丙基、萘基甲基、萘基乙基、萘基丙基等。
作为有机氧基,并无特别限定,可列举出ro(r表示取代或未取代的、碳数1~30的烷基、碳数6~30的芳基或碳数7~30的芳烷基。)所示的烷氧基、芳氧基、芳烷氧基等。
作为烷氧基,并无特别限定,优选碳数1~30、特别地碳数1~10的烷氧基,作为其具体例,可列举出甲氧基、乙氧基、正丙氧基、异丙氧基、环丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基、正戊氧基、正己氧基、正庚氧基、正辛氧基、正壬氧基、正癸氧基等。
作为芳氧基,并无特别限定,优选碳数6~30、特别地碳数6~20的芳氧基,作为其具体例,可列举出苯氧基、1-萘氧基、2-萘氧基、蒽氧基、菲氧基等。
作为芳烷氧基,并无特别限定,优选碳数7~30、特别地碳数7~20的芳烷氧基,可列举出苄氧基、苯基乙氧基、苯基丙氧基、1或2-萘基甲氧基、1或2-萘基乙氧基、1或2-萘基丙氧基等。
作为有机硫基,可列举出用硫原子将上述有机氧基的氧原子置换了的基团等。
作为单有机氨基,并无特别限定,优选由rnh2(r表示与上述相同的含义。)表示的基团,r中的优选的碳数与上述烷氧基、芳氧基、芳烷氧基同样。作为其具体例,可列举出甲基氨基、乙基氨基、正丙基氨基、异丙基氨基、正丁基氨基、异丁基氨基、仲丁基氨基、叔丁基氨基、正戊基氨基、正己基氨基、正庚基氨基、正辛基氨基、正壬基氨基、正癸基氨基、正十一烷基氨基、正十二烷基氨基、正十三烷基氨基、正十四烷基氨基、正十五烷基氨基、正十六烷基氨基、正十七烷基氨基、正十八烷基氨基、正十九烷基氨基、正二十烷基氨基等直链或分支链单烷基氨基;环丙基氨基、环丁基氨基、环戊基氨基、环己基氨基、环庚基氨基、环辛基氨基、环壬基氨基等单环烷基氨基;苯胺基、1或2-萘基氨基等单芳基氨基;苄基氨基、苯基乙基氨基、苯基丙基氨基、1或2-萘基甲基氨基等单芳烷基氨基等。
作为二有机氨基,并无特别限定,优选由r2nh(r相互独立地表示与上述相同的含义。)所示的基团,r中的优选的碳数与上述烷氧基、芳氧基、芳烷氧基同样。作为其具体例,可列举出二甲基氨基、二乙基氨基、二正丙基氨基、二异丙基氨基、二正丁基氨基、二异丁基氨基、二仲丁基氨基、二叔丁基氨基、二正戊基氨基、二正己基氨基、二正庚基氨基、二正辛基氨基、二正壬基氨基、二正癸基氨基、二正十一烷基氨基、二正十二烷基氨基、二正十三烷基氨基、二正十四烷基氨基、二正十五烷基氨基、二正十六烷基氨基、二正十七烷基氨基、二正十八烷基氨基、二正十九烷基氨基、二正二十烷基氨基、n-乙基甲基氨基、n-异丙基甲基氨基、n-丁基甲基氨基等直链或分支链二烷基氨基;二环丙基氨基、二环丁基氨基、二环戊基氨基、二环己基氨基、二环庚基氨基、二环辛基氨基、二环壬基氨基、环戊基环己基氨基等二环烷基氨基;n-甲基苯胺基、n-乙基苯胺基、n-正丙基苯胺基等烷基芳基氨基;二苯基氨基、4,4′-二萘基氨基、n-苯基-1或2-萘基氨基等二芳基氨基;二苄基氨基、双(苯基乙基)氨基、双(苯基丙基)氨基、双(1或2-萘基甲基)氨基等二芳烷基氨基等。
作为单有机膦基,并无特别限定,优选由rph(r表示与上述相同的含义。)表示的单有机膦基,r中的优选的碳数与上述烷氧基、芳氧基、芳烷氧基同样。作为其具体例,可列举出甲基膦基、乙基膦基、正丙基膦基、异丙基膦基、正丁基膦基、异丁基膦基、仲丁基膦基、叔丁基膦基、正戊基膦基、正己基膦基、正庚基膦基、正辛基膦基、正壬基膦基、正癸基膦基、正十一烷基膦基、正十二烷基膦基、正十三烷基膦基、正十四烷基膦基、正十五烷基膦基、正十六烷基膦基、正十七烷基膦基、正十八烷基膦基、正十九烷基膦基、正二十烷基膦基等直链或分支链单烷基膦基;环丙基膦基、环丁基膦基、环戊基膦基、环己基膦基、环庚基膦基、环辛基膦基、环壬基膦基等单环烷基膦基;苯基膦基、1或2-萘基膦基等单芳基膦基;苄基膦基等单芳烷基膦基等。
作为二有机膦基,并无特别限定,优选由r2p(r相互独立地表示与上述相同的含义。)表示的二有机膦基,r中的优选的碳数与上述烷氧基、芳氧基、芳烷氧基同样。作为其具体例,可列举出二甲基膦基、二乙基膦基、二-正丙基膦基、二-异丙基膦基、二-正丁基膦基、二-异丁基膦基、二-仲丁基膦基、二-叔丁基膦基、二-正戊基膦基、二-正己基膦基、二-正庚基膦基、二-正辛基膦基、二-正壬基膦基、二-正癸基膦基、二-正十一烷基膦基、二-正十二烷基膦基、二-正十三烷基膦基、二-正十四烷基膦基、二-正十五烷基膦基、二-正十六烷基膦基、二-正十七烷基膦基、二-正十八烷基膦基、二-正十九烷基膦基、二-正二十烷基膦基等直链或分支链二烷基膦基;二环丙基膦基、二环丁基膦基、二环戊基膦基、二环己基膦基、二环庚基膦基、二环辛基膦基、二环壬基膦基等二环烷基膦基;环己基苯基膦基等烷基芳基膦基;二苯基膦基、双(1或2-萘基)膦基等二芳基膦基;二苄基膦基、双(苯基乙基)膦基、双(1或2-萘基甲基)膦基等二芳烷基膦基等。
作为单有机甲硅烷基,并无特别限定,优选由rsih2(r表示与上述相同的含义。)表示的单有机甲硅烷基,r中的优选的碳数与上述烷氧基、芳氧基、芳烷氧基同样。作为其具体例,可列举出甲基甲硅烷基、乙基甲硅烷基、正丙基甲硅烷基、异丙基甲硅烷基、正丁基甲硅烷基、异丁基甲硅烷基、仲丁基甲硅烷基、叔丁基甲硅烷基、正戊基甲硅烷基、正己基甲硅烷基、正庚基甲硅烷基、正辛基甲硅烷基、正壬基甲硅烷基、正癸基甲硅烷基、正十一烷基甲硅烷基、正十二烷基甲硅烷基、正十三烷基甲硅烷基、正十四烷基甲硅烷基、正十五烷基甲硅烷基、正十六烷基甲硅烷基、正十七烷基甲硅烷基、正十八烷基甲硅烷基、正十九烷基甲硅烷基、正二十烷基甲硅烷基等直链或分支链单烷基甲硅烷基;环丙基甲硅烷基、环丁基甲硅烷基、环戊基甲硅烷基、环己基甲硅烷基、环庚基甲硅烷基、环辛基甲硅烷基、环壬基甲硅烷基等单环烷基甲硅烷基;苯基甲硅烷基、1或2-萘基甲硅烷基等单芳基甲硅烷基;苄基甲硅烷基、苯基乙基甲硅烷基、苯基丙基甲硅烷基、1或2-萘基甲基甲硅烷基等单芳烷基甲硅烷基等。
作为二有机甲硅烷基,并无特别限定,优选由r2sih(r相互独立地表示与上述相同的含义。)所示的基团,r中的优选的碳数与上述烷氧基、芳氧基、芳烷氧基同样。作为其具体例,可列举出二甲基甲硅烷基、二乙基甲硅烷基、二-正丙基甲硅烷基、二-异丙基甲硅烷基、二-正丁基甲硅烷基、二-异丁基甲硅烷基、二-仲丁基甲硅烷基、二-叔丁基甲硅烷基、二-正戊基甲硅烷基、二-正己基甲硅烷基、二-正庚基甲硅烷基、二-正辛基甲硅烷基、二-正壬基甲硅烷基、二-正癸基甲硅烷基、二-正十一烷基甲硅烷基、二-正十二烷基甲硅烷基、二-正十三烷基甲硅烷基、二-正十四烷基甲硅烷基、二-正十五烷基甲硅烷基、二-正十六烷基甲硅烷基、二-正十七烷基甲硅烷基、二-正十八烷基甲硅烷基、二-正十九烷基甲硅烷基、二-正二十烷基甲硅烷基、乙基甲基甲硅烷基、异丙基甲基甲硅烷基、丁基甲基甲硅烷基等直链或分支链二烷基甲硅烷基;二环丙基甲硅烷基、二环丁基甲硅烷基、二环戊基甲硅烷基、二环己基甲硅烷基、二环庚基甲硅烷基、二环辛基甲硅烷基、二环壬基甲硅烷基、环戊基环己基甲硅烷基等二环烷基甲硅烷基;(甲基)苯基甲硅烷基、(乙基)苯基甲硅烷基、(正丙基)苯基甲硅烷基等烷基芳基甲硅烷基;二苯基甲硅烷基、双(1或2-萘基)甲硅烷基、苯基-1或2-萘基甲硅烷基等二芳基甲硅烷基;二苄基甲硅烷基、双(苯基乙基)甲硅烷基、双(苯基丙基)甲硅烷基、双(1或2-萘基甲基)甲硅烷基等二芳烷基甲硅烷基等。
作为三有机甲硅烷基,并无特别限定,优选由r3si(r相互独立地表示与上述相同的含义。)表示的基团,r中的优选的碳数与上述烷氧基、芳氧基、芳烷氧基同样。作为其具体例,可列举出三甲基甲硅烷基、三乙基甲硅烷基、三-正丙基甲硅烷基、三-异丙基甲硅烷基、三-正丁基甲硅烷基、三-异丁基甲硅烷基、三-仲丁基甲硅烷基、三-叔丁基甲硅烷基、三-正戊基甲硅烷基、三-正己基甲硅烷基、三-正庚基甲硅烷基、三-正辛基甲硅烷基、三-正壬基甲硅烷基、三-正癸基甲硅烷基、三-正十一烷基甲硅烷基、三-正十二烷基甲硅烷基、三-正十三烷基甲硅烷基、三-正十四烷基甲硅烷基、三-正十五烷基甲硅烷基、三-正十六烷基甲硅烷基、三-正十七烷基甲硅烷基、三-正十八烷基甲硅烷基、三-正十九烷基甲硅烷基、三-正二十烷基甲硅烷基、乙基二甲基甲硅烷基、二异丙基甲基甲硅烷基、二丁基甲基甲硅烷基等直链或分支链三烷基甲硅烷基;三环丙基甲硅烷基、三环丁基甲硅烷基、三环戊基甲硅烷基、三环己基甲硅烷基、三环庚基甲硅烷基、三环辛基甲硅烷基、三环壬基甲硅烷基等三环烷基甲硅烷基;(甲基)二苯基甲硅烷基、(乙基)二苯基甲硅烷基、(正丙基)二苯基甲硅烷基等烷基芳基甲硅烷基;三苯基甲硅烷基、三(1或2-萘基)甲硅烷基、二苯基-1或2-萘基甲硅烷基等三芳基甲硅烷基;三苄基甲硅烷基、三(苯基乙基)甲硅烷基、三(苯基丙基)甲硅烷基、三(1或2-萘基甲基)甲硅烷基等三芳烷基甲硅烷基等。
应予说明,上述各取代基的r上的至少1个氢原子可被取代基x取代,作为x,可列举出卤素原子、有机氧基、单有机氨基、二有机氨基、或有机硫基等,作为有机氧基、单有机氨基、二有机氨基、有机硫基,可列举出与上述同样的基团。
作为卤素原子,可列举出氟、氯、溴、碘原子,优选氟原子,作为优选的氟取代烷基,可列举出三氟丙基、九氟己基、十七氟癸基等。
上述各取代基中,r1~r6相互独立地优选可被x取代的、碳数1~30的烷基、碳数6~30的芳基、碳数7~30的芳烷基,更优选碳数1~10的烷基、碳数6~10的芳基。
另外,作为r1~r3的任一个与r4~r6的任一个的至少1组结合而成的交联取代基,只要是可将二个si原子交联的取代基,则并无特别限定,例如可列举出-o-、-s-、-nh-、-nr-(r与上述相同。)、-pr-(r与上述相同。)、-nh-(ch2)k-nh-(k表示1~10的整数。)、-nr-(ch2)k-nr-(k与上述相同。r相互独立地与上述相同。)、-ph-(ch2)k-ph-(k与上述相同。)、-pr-(ch2)k-pr-(k与上述相同。r相互独立地与上述相同。)、-c=c-、碳数1~10的亚烷基、碳数6~30的亚芳基、碳数7~30的亚芳烷基、-(ch2o)k-(k与上述相同。)、-(ch2)k-o-(ch2)k-(k相互独立地与上述相同。)、-o-(ch2)k-o-(k与上述相同。)、-r′-o-(ch2)k-o-r′-(r′相互独立地表示碳数1~10的亚烷基、碳数6~30的亚芳基、或碳数7~30的亚芳烷基,k与上述相同。)、-(ch2s)k-(k与上述相同。)、-(ch2)k-s-(ch2)k-(k相互独立地与上述相同。)、-s-(ch2)k-s-(k与上述相同。)、-r′-s-(ch2)k-o-r′-(r′相互独立地表示与上述相同的含义,k与上述相同。)、-sir2-(r相互独立地与上述相同。)、-(ch2)k-sir2-(ch2)k-(r相互独立地表示与上述相同的含义,k相互独立地与上述相同。)等。
作为碳数1~10的亚烷基,可列举出亚甲基、亚乙基、亚丙基、三亚甲基、四亚甲基、五亚甲基、六亚甲基等。
作为碳数6~30的亚芳基,可列举出邻-亚苯基(1,2-亚苯基)、1,2-亚萘基、1,8-亚萘基、2,3-亚萘基等。
作为碳数7~30的亚芳烷基,可列举出-(ch2)k-ar-(ar表示碳数6~20的亚芳基,k与上述相同。)、-ar-(ch2)k-(ar和k与上述相同。)、-(ch2)k-ar-(ch2)k-(ar表示与上述相同的含义,k相互独立地与上述相同。)等。
应予说明,对于上述亚烷基、亚芳基、亚芳烷基,它们的氢原子的至少1个可被取代基x(x与上述相同。)取代。
如果将交联取代基表示为z,则将2个硅原子连接的z的数为1~3,具有这样的交联取代基z的单核铁络合物由下述式表示。
[化3]
(式中,r1、r2、r5、r6、l1、l2、m1和m2表示与上述相同的含义,z表示交联取代基。)
作为具体的具有交联取代基的二硅金属环结构,可列举出由下述式表示的结构,但并不限定于这些。
[化4]
(式中,me意味着甲基。)
式中,r1、r2、r4和r5表示与上述相同的含义,r17~r20(取代基x)相互独立地表示氢原子、卤素原子、碳数1~10的烷基、或碳数1~10的烷氧基,r25~r30(取代基x)相互独立地表示氢原子或碳数1~20的未取代或取代的一价烃基,r17~r20和r25~r30优选为氢原子。
作为一价烃基的具体例,可列举出烷基、芳基、芳烷基等,作为这些的具体例,可列举出与上述同样的基团。
应予说明,作为烷基、烷氧基、卤素原子,可列举与上述同样的基团。
l1表示配体中所含的2个电子配位于铁的、选自异腈、胺、亚胺、含氮杂环、膦、亚磷酸酯和硫醚中的至少1种的二电子配体。
本发明中,二电子配体l1的配位数m1表示1~4的整数,优选为2。再有,m1为2~4的情况下,2个l1可相互结合。
作为异腈,例如可列举出由rnc(r相互独立地表示与上述相同的含义。)表示的异腈。
作为胺,可列举出由r3n(r相互独立地表示与上述相同的含义。)表示的叔胺。
作为亚胺,可列举出由rc(=nr)r(r相互独立地表示与上述相同的含义。)表示的亚胺。
作为含氮杂环,例如可列举出吡咯、咪唑、吡啶、嘧啶、噁唑啉、异噁唑啉等。
作为膦,例如可列举出由r3p(r相互独立地表示与上述相同的含义。)表示的膦。
作为亚磷酸酯,例如可列举出由(ro)3p(r相互独立地表示与上述相同的含义。)表示的亚磷酸酯。
作为硫醚,例如可列举出由rsr(r相互独立地表示与上述相同的含义。)表示的硫醚。
这些中,作为二电子配体l1,更优选为选自异腈、含氮杂环和亚磷酸酯中的至少1种,特别优选具有与一氧化碳相同的电子配置的异腈。
作为异腈的具体例,如上述那样,可列举出由rnc(r相互独立地表示与上述相同的含义。)表示的异腈,特别地,优选r为取代或未取代的、碳数1~10的烷基、碳数6~20的芳基或碳数7~20的芳烷基的异腈,更优选r为碳数6~10的芳基的异腈,进一步优选r为具有碳数1~10的烷基等取代基的苯基的异腈。
作为可使用的异腈,可列举出甲基异腈、乙基异腈、正丙基异腈、环丙基异腈、正丁基异腈、异丁基异腈、仲丁基异腈、叔丁基异腈、正戊基异腈、异戊基异腈、新戊基异腈、正己基异腈、环己基异腈、环庚基异腈、1,1-二甲基己基异腈、1-金刚烷基异腈、2-金刚烷基异腈等烷基异腈;苯基异腈、2-甲基苯基异腈、4-甲基苯基异腈、2,4-二甲基苯基异腈、2,5-二甲基苯基异腈、2,6-二甲基苯基异腈、2,4,6-三甲基苯基异腈、2,4,6-三叔丁基苯基异腈、2,6-二异丙基苯基异腈、1-萘基异腈、2-萘基异腈、2-甲基-1-萘基异腈等芳基异腈;苄基异腈、苯基乙基异腈等芳烷基异腈等,但并不限定于这些。
作为含氮杂环的具体例,如上述那样,其中,优选吡啶环。
作为可使用的含有吡啶环的化合物,可列举出吡啶、2-甲基吡啶、3-甲基吡啶、4-甲基吡啶、2,6-二甲基吡啶等吡啶类,2,2′-联吡啶、4,4′-二甲基-2,2′-联吡啶、5,5′-二甲基-2,2′-联吡啶、4,4′-二乙基-2,2′-联吡啶、4,4′-二-叔丁基-2,2′-联吡啶等联吡啶类等,但并不限定于这些。
作为亚磷酸酯,如上述那样,可列举出由(ro)3p(r相互独立地表示与上述相同的含义。)表示的亚磷酸酯,特别地,优选r为取代或未取代的、碳数1~10的烷基、或碳数6~20的芳基的亚磷酸酯,进一步优选r为碳数1~10的烷基的亚磷酸酯。
作为可使用的亚磷酸酯化合物,可列举出亚磷酸三甲酯、亚磷酸三乙酯、亚磷酸三异丙酯、亚磷酸三正丁酯、三(2-乙基己基)亚磷酸酯、亚磷酸三正癸酯、4-甲基-2,6,7-三氧杂-1-磷杂双环[2.2.2]辛烷(三羟甲基乙烷环状亚磷酸酯)、4-乙基-2,6,7-三氧杂-1-磷杂双环[2.2.2]辛烷(三羟甲基丙烷亚磷酸酯)等亚磷酸三烷基酯类、甲基二苯基亚磷酸酯等烷基芳基亚磷酸酯类、亚磷酸三苯酯等亚磷酸三芳基酯类等,但并不限定于这些。
另一方面,l2表示co和l1以外的二电子配体,作为二电子配体,只要为co配体和l1以外,则并无特别限定,能够使用作为金属络合物的二电子配体以往使用的任意的配体,典型地,包含氮、氧、硫、磷等的非共有电子对(孤对电子)的、胺、亚胺、含氮杂环、膦、亚磷酸酯、砷烷、醇、硫醇、醚、硫醚等的化合物;包含π电子的、烯烃、炔烃;包含孤对电子和π电子两者的、醛、酮、腈、异腈等的化合物;通过抓氢相互作用结合的、分子状氢(h-h键中所含的σ电子进行配位)、氢硅烷(si-h键中所含的σ电子进行配位)等。
作为上述胺、亚胺、含氮杂环、膦、亚磷酸酯、硫醚和异腈,可列举出与上述l1中例示的胺、亚胺、含氮杂环、膦、亚磷酸酯、硫醚和异腈同样的胺、亚胺、含氮杂环、膦、亚磷酸酯、硫醚和异腈。
作为砷烷,例如可列举出由r3as(r相互独立地表示与上述相同的含义。)表示的砷烷。
作为醇,例如可列举出由roh(r表示与上述相同的含义。)表示的醇。
作为硫醇,可列举出用硫原子将上述醇的氧原子置换的产物。
作为醚,例如可列举出由ror(r相互独立地表示与上述相同的含义。)表示的醚。
作为酮,例如可列举出由rcor(r相互独立地表示与上述相同的含义。)表示的酮。
作为烯烃,例如可列举出乙烯、丙烯、1-丁烯、2-丁烯、1-戊烯、2-戊烯、环戊烯、1-己烯、环己烯、1-庚烯、1-辛烯、1-壬烯、1-癸烯等碳数2~30的烯烃。
作为炔烃,例如可列举出乙炔、丙炔、1-丁炔、2-丁炔、1-戊炔、2-戊炔、1-己炔、1-庚炔、1-辛炔、1-壬炔、1-癸炔等碳数2~30的炔烃。
作为氢硅烷,例如可列举出三有机氢硅烷,具体地,可列举出三(碳数1~30有机基)氢硅烷,更具体地,可列举出由r1r2r3sih(r1~r3表示与上述相同的含义。)表示的氢硅烷。
本发明中,就二电子配体l2而言,从催化活性的方面出发,与铁比较弱地结合是有利的,因此在上述例示的配体中,特别地,更优选硫醇、硫醚、三有机氢硅烷,特别地,更进一步优选由sihr7r8r9和sihr10r11r12(r7~r12相互独立地表示可被x取代的、烷基、芳基或芳烷基,x表示与上述相同的含义。)表示的2个三有机氢硅烷。
其中,作为烷基、芳基、芳烷基的具体例,可列举出与前面例示的基团同样的基团,分别优选碳数1~10的烷基、碳数6~20的芳基、碳数7~20的芳烷基,更优选碳数1~10的烷基、碳数6~20的芳基。
再有,本发明中,二电子配体l2的配位数m2表示0~3的整数,优选为2。另外,m1+m2满足3或4,优选为4。再有,m2为2或3的情况下,2个l2可相互地结合。作为其代表例,可列举出乙二胺、乙二醇二甲基醚、1,3-丁二烯、由下述式表示的配体,但并不限定于这些。
不过,本发明的单核铁络合物中,l1和l2中的3个不会结合而成为包含3个配位性2电子官能团的配体例如η6-亚芳基结构。
[化5]
(式中,me意味着甲基,ph意味着苯基。r7、r9、r10、r11和z表示与上述相同的含义。)
应予说明,在式(1)的单核铁络合物中,例如,l1为2个、l2为2个(将它们区别为l2a、l2b)的情况下,存在由下述式表示的配位结构异构体,本发明的单核铁络合物包含这些全部的配位结构异构体。
[化6]
(式中,r1~r6和l1表示与上述相同的含义,l2a和l2b表示与上述l2相同的含义。)
另外,l2为由sihr7r8r9和sihr10r11r12(r7~r12表示与上述相同的含义。)表示的三有机氢硅烷的情况下,构成单核铁络合物的4个硅原子的2个以上可通过上述的交联取代基z连接。硅原子的组合可以是具有硅-铁共价键的硅原子之间、用si-h配位的硅原子之间、硅-铁共价键与用si-h配位的硅原子的组合的任一者。这种情况下,连接2个硅原子的z的数为1~3,另一方面,络合物全体中所含的z的总数为1~12。
如果使用1个配位结构来表示具有这样的交联取代基z的单核铁络合物的情况下,可列举出由下述式表示的结构,但并不限定于这些,另外,如上述那样,也存在这以外的配位结构异构体,在这种情况下也存在具有同样的交联取代基z的结构。
[化7]
(式中,r1~r12、l1和z表示与上述相同的含义。)
作为具体的具有二硅金属环结构的单核铁络合物的结构,可列举出由下述式(不包括l1地表示)所示的结构,但并不限定于这些。
[化8]
(式中,me意味着甲基。)
特别地,本发明中,优选2个l1进行配位、且作为二电子配体的三有机氢硅烷的si-h抓氢配位的单核铁络合物。如果使用1个配位结构来方便地表示这样的铁络合物,则可列举出由式(2)表示的结构,如上述那样,本发明中可以是这以外的配位结构异构体。
[化9]
(式中,l1表示与上述相同的含义。)
式(2)中,r1~r12表示与上述相同的含义,r1~r6相互独立地优选可被x(x表示与上述相同的含义。)取代的、烷基、芳基或芳烷基。
在此,作为烷基、芳基、芳烷基的具体例,可列举出与前面例示的基团同样的基团,各自优选碳数1~10的烷基、碳数6~20的芳基、碳数7~20的芳烷基,更优选碳数1~10的烷基、碳数6~20的芳基。
上述式(2)中,构成单核铁络合物的4个硅原子的2个以上可用交联取代基连接,具体地,r1~r3的任一个、与r4~r6的任一个的至少1组或r7~r9的任一个的至少1组可一起,或者r10~r12的任一个、与r4~r6的任一个的至少1组或r7~r9的任一个的至少1组可一起而形成亚烷基、亚芳基、亚芳烷基这样的交联取代基,或者r1~r3的任一个、与r4~r6的任一个的至少1组或r7~r9的任一个的至少1组可一起而形成亚烷基、亚芳基、亚芳烷基这样的交联取代基,并且,r10~r12的任一个、与r4~r6的任一个的至少1组和r7~r9的任一个的至少1组可一起而形成亚烷基、亚芳基、亚芳烷基这样的交联取代基。
在此,作为亚烷基、亚芳基、亚芳烷基的具体例,可列举出与前面例示的基团同样的基团,各自优选碳数1~10的亚烷基、碳数7~20的亚芳基、碳数7~20的亚芳烷基,更优选碳数1~6的亚烷基、碳数7~20的亚芳基。
如果使用典型的配位结构来表示本发明中能够优选使用的单核铁络合物,可列举出由式(3)或(4)表示的单核铁络合物,具体地,可列举出由式(5)~(10)表示的单核铁络合物,更具体地可列举出由a~c表示的单核铁络合物,并不限于这些,另外,如上述那样,这些的配位结构异构体也能够优选地使用。
[化10]
(式中,r1、r2、r4、r5、r7、r8、r10、r11、r17~r20和l1表示与上述相同的含义。)
[化11]
(式中,r1、r2、r4、r5、r6、r7、r10、r11和r17~r20表示与上述相同的含义,me表示甲基。)
[化12]
(式中,me意味着甲基。)
本发明的单核铁络合物能够将公知的有机合成反应组合而制造。
例如,上述铁络合物a~c能够在氩气等非活性气体气氛下、有机溶剂中使具有环己二烯基、环辛二烯基等环二烯烃基和烯丙基、2-甲基烯丙基等烯基作为配体的铁-烯烃络合物、与1,2-双(二甲基甲硅烷基)苯等双甲硅烷基化合物和叔丁基异腈等异腈化合物、亚磷酸酯化合物、或联吡啶化合物反应而得到。
这种情况下,就双甲硅烷基化合物的使用量而言,相对于铁-烯烃络合物,能够设为1~10摩尔倍左右,优选2~5摩尔倍。
就异腈化合物、亚磷酸酯化合物、联吡啶化合物的使用量而言,相对于铁-烯烃络合物,能够设为1~10摩尔倍左右,优选2~5摩尔倍。
另外,作为有机溶剂,只要不对反应产生影响,则能够使用各种溶剂类,例如,能够使用戊烷、己烷、庚烷、辛烷、环己烷等脂肪族烃类;二乙基醚、二异丙基醚、二丁基醚、环戊基甲基醚、四氢呋喃、1,4-二噁烷等醚类;苯、甲苯、二甲苯、均三甲苯等芳香族烃类等。
反应温度优选在有机溶剂的熔点到沸点的范围适当地设定,优选10~100℃,更优选30~80℃。
反应时间通常为1~48小时左右。
反应结束后,将溶剂馏除后,采用重结晶法等公知的精制法能够得到目标物,但也可不将制备的铁络合物分离而用作目标反应的催化剂。
本发明的单核铁络合物如已述那样,在氢化硅烷化反应、氢化反应、羰基化合物的还原反应的任一个以上的反应中发挥催化活性,也存在在2个反应中发挥催化活性的情形、在全部3个反应中都发挥催化活性的情形。
使用本发明的单核铁络合物作为催化剂,进行含有脂肪族不饱和键的、烯烃化合物、硅烷化合物或有机聚硅氧烷化合物等具有脂肪族不饱和键的化合物、与具有si-h键的、硅烷化合物或有机聚硅氧烷化合物的氢化硅烷化反应的情况下,对催化剂的使用量并无特别限定,如果考虑在室温~100℃左右的温和的条件下进行反应而高收率地得到目标物,优选使催化剂的使用量为0.005摩尔%以上。
使用本发明的单核铁络合物作为催化剂,进行用氢气将含有脂肪族不饱和键的烯烃化合物还原而得到饱和化合物的反应的情况下,对催化剂的使用量也无特别限定,如果考虑在室温下并且氢压为1个大气压左右的温和的条件下进行反应,高收率地得到目标物,优选使催化剂的使用量为0.05摩尔%以上。
使用本发明的单核铁络合物作为催化剂,用含有si-h基的硅烷或硅氧烷将羰基化合物还原的情况下,对催化剂的使用量也无特别限定,如果考虑在温和的条件下进行反应,高收率地得到目的物,优选使催化剂的使用量为0.1摩尔%以上。
作为可供于还原反应的羰基化合物,可列举出具有酰胺、醛、酮、酯、羧酸、羧酸盐(例如钠盐、钾盐等)基等的化合物,通过在本发明的铁络合物催化剂的存在下使它们与含有si-h基的硅烷或硅氧烷反应,从而能够诱导为各自对应的胺、醇化合物。
应予说明,在任一反应中,对催化剂使用量的上限都无特别限制,但从经济的观点出发,为5摩尔%左右。
实施例
以下列举实施例,对本发明更具体地说明,但本发明并不受下述的实施例限制。
就铁络合物的合成而言,使用史兰克技术或手套箱,在氩气氛下进行全部的操作,过渡金属化合物的制备中使用的溶剂全部在采用公知的方法进行了脱氧、脱水后使用。
烯烃的氢化硅烷化反应、氢化反应以及酰胺的还原反应和溶剂精制全部在非活性气体气氛下进行,各种反应中使用的溶剂等全部使用了预先采用公知的方法进行精制、干燥、脱氧的溶剂。
使用日本电子(株)制jnm-eca600、jnm-la400进行了1h、13c-nmr的测定,使用日本分光(株)制ft/ir-550进行了ir测定,使用perkinelmer制2400ii/chn进行了元素分析,使用rigakucorporation制varimax、mokα线0.71069埃进行了x射线结晶结构解析。
应予说明,以下所示的化学结构式中,按照惯用的表示法省略了氢原子。另外,me表示甲基。
(1)铁络合物的合成
[实施例1]铁络合物a的合成
[化13]
(式中,me意味着甲基。)
在氩气氛下、在100ml的史兰克管中装入(η6-1,3,5,7-环辛四烯)(η4-1,3,5,7-环辛四烯)铁(0)络合物(40mg,0.15mmol)和2,4,6-三甲基苯基异腈(66mg、0.45mmol),向其中加入经脱气·脱水的己烷(40ml),在室温下搅拌了1小时。然后,加入1,2-双(二甲基甲硅烷基)苯(64mg,0.33mmol),将反应容器内置换为氢气氛后,使用高压汞灯(ushio电机(株)制造,um-453b-a(450w))边进行光照射边在室温下搅拌了48小时。反应结束后,减压干燥,使得到的干燥物溶解于甲苯(10ml),通过离心分离将副产的少量的黑色不溶物除去。然后,在减压下使甲苯溶液干燥,得到了由上述式代表性地表示的铁络合物a(36mg/0.05mmol/35%)。
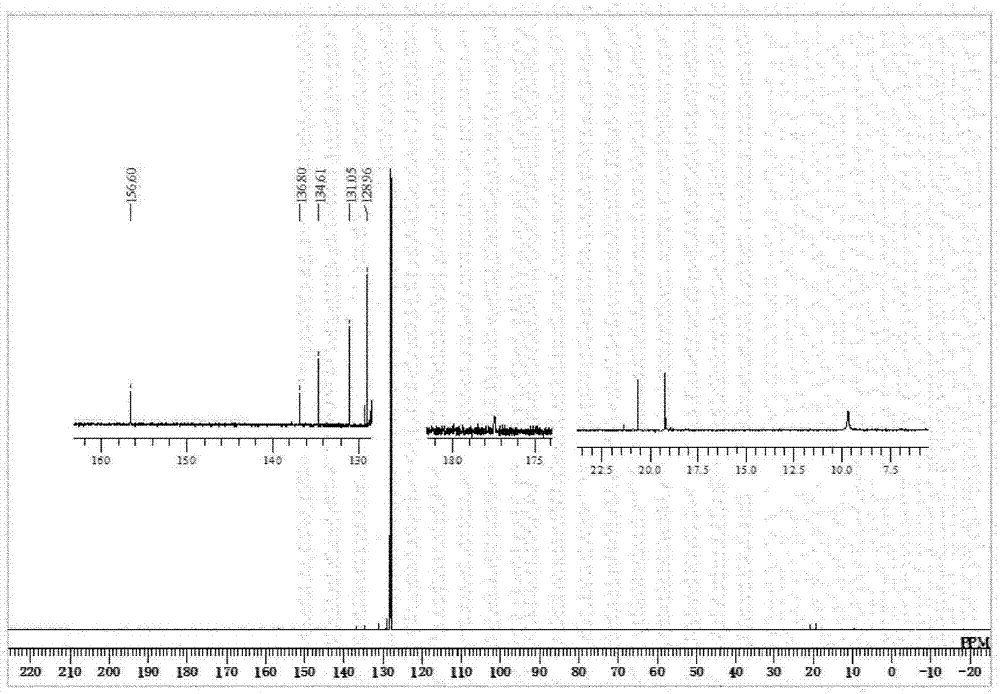
将得到的铁络合物a的1h-nmr的测定结果示于图1,将13c-nmr的测定结果示于图2。
1h-nmr(c6d6,600mhz)δ=-11.54(s,jsi-h=14.7hz,2h,si-h),0.90(s,24h,sime2),1.82(s,6h,me),1.91(s,12h,c6h3me2),6.30(s,4h,c6h2),7.29-7.33(m,4h,c6h4),7.71-7.75(m,4h,c6h4).
13c-nmr(c6d6,150mhz)δ=9.70(s,sime2),19.2(s,c6h2me3),20.7(s,c6h2me3),129.0(s,ph),129.3(s,ph),131.1(s,ph),131.6(s,ph),134.6(s,ph),136.8(s,ph),156.6(s,ipsoofc6h4),177.5(s,cn-mes).
ir(kbr颗粒):ν=1958(νsi-h),2056(νfe-cn)cm-1
c40h56n2fesi4的分析计算值:c,65.54;h,7.70;n,3.82测定值:c,65.32;h,7.48;n,3.67
[实施例2]铁络合物b的合成
[化14]
(式中,me意味着甲基。)
在氩气氛下、在100ml的史兰克管中装入(η6-1,3,5,7-环辛四烯)(η4-1,3,5,7-环辛四烯)铁(0)络合物(100mg,0.38mmol)和2,6-二甲基苯基异腈(149mg、1.14mmol),向其中加入经脱气·脱水的己烷(60ml),在室温下搅拌了1小时。然后,加入1,2-双(二甲基甲硅烷基)苯(162mg,0.83mmol),将反应容器内置换为氢气氛后,使用高压汞灯(ushio电机(株)制造,um-453b-a(450w))边进行光照射边在室温下搅拌了48小时。反应结束后,减压干燥,使得到的干燥物溶解于甲苯(10ml)中,通过离心分离将副产的少量的黑色不溶物除去。然后,在减压下使甲苯溶液干燥,得到了由上述式代表性地表示的铁络合物b(115mg/0.16mmol/43%)。
将得到的铁络合物b的结构示于图3中,将1h-nmr的测定结果示于图4。
1h-nmr(c6d6,600mhz)δ=-11.48(s,jsi-h=16.1hz,2h,si-h),0.90(s,24h,sime2),1.94(s,12h,c6h3me2),6.53-6.58(m,4h,c6h3me2),6.62-6.66(m,2h,c6h3me2),7.31-7.35(m,4h,c6h4),7.71-7.76(m,4h,c6h4).
ir(kbr颗粒):ν=1960(νsi-h),2052(νfe-cn)cm-1
c38h52n2fesi4的分析计算值:c,64.74;h,7.43;n,3.97测定值:c,64.56;h,7.24;n,3.87
[实施例3]铁络合物c的合成
[化15]
(式中,me意味着甲基。)
在氩气氛下、在100ml的史兰克管中装入(η6-1,3,5,7-环辛四烯)(η4-1,3,5,7-环辛四烯)铁(0)络合物(50mg,0.19mmol)和金刚烷基异腈(92mg,0.57mmol),向其中加入经脱气·脱水的己烷(50ml),在室温下搅拌了1小时。然后,加入1,2-双(二甲基甲硅烷基)苯(80mg,0.42mmol),将反应容器内置换为氢气氛后,使用高压汞灯(ushio电机(株)制造,um-453b-a(450w))边进行光照射边在室温下搅拌了48小时。反应结束后,减压干燥,使得到的干燥物溶解于甲苯(5ml)中,通过离心分离将副产的少量的黑色不溶物除去。然后,在减压下使甲苯溶液干燥,得到了由上述式代表性地表示的铁络合物c(55mg/0.07mmol/38%)。
将得到的铁络合物c的1h-nmr的测定结果示于图5中。
1h-nmr(c6d6,600mhz)δ=-11.57(s,jsi-h=13.1hz,2h,si-h),0.88(s,24h,sime2),1.08-1.16(m,12h,ch2),1.47-1.49(m,12h,ch2),1.51-1.55(m,6h,ch),7.32-7.35(m,4h,c6h4),7.79-7.84(m,4h,c6h4).
ir(kbr颗粒):ν=1987(νsi-h),2073(νru-cn)cm-1
(2)使用了铁络合物的氢化硅烷化
[化16]
[实施例4]使用了铁络合物a的苯乙烯的采用1,1,1,3,3-五甲基二硅氧烷的氢化硅烷化反应
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入了作为催化剂的铁络合物a(7.3mg,0.01mmol)。在其中加入苯乙烯(104mg,1.0mmol),进而加入了1,1,1,3,3-五甲基二硅氧烷(163mg,1.1mmol)后,将溶液在50℃下搅拌了23小时。冷却后,加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。将这些结果作为条目1示于表1中。
1,1,1,3,3-五甲基-3-[(1e)-2-苯基乙烯基]-二硅氧烷(表1,(ii)的化合物)
1h-nmr(400mhz,cdcl3)δ=0.11(s,6h,si(ch3)2),0.22(s,9h,si(ch3)3),6.42(d,jh-h=19.3hz,1h,-ch=ch-),6.93(d,jh-h=19.3hz,1h,-ch=ch-),7.24-7.29(m,1h,c6h5),7.31-7.39(m,2h,c6h5),7.43-7.47(m,2h,c6h5).
乙基苯(表1,(iii)的化合物)
1h-nmr(400mhz,cdcl3)δ=1.26(t,2h,jh-h=7.7hz,ch3),2.67(q,2h,jh-h=7.7hz,ch2),7.16-7.24(m,3h,c6h5),7.27-7.33(m,2h,c6h5).
[实施例5]使用了铁络合物b的苯乙烯的采用1,1,1,3,3-五甲基二硅氧烷的氢化硅烷化反应
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入了作为催化剂的铁络合物b(7.1mg,0.01mmol)。向其中加入苯乙烯(104mg,1.0mmol),进而加入了1,1,1,3,3-五甲基二硅氧烷(163mg,1.1mmol)后,将溶液在50℃下搅拌了23小时。冷却后,加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。将这些结果作为条目2示于表1中。
[实施例6]使用了铁络合物c的苯乙烯的采用1,1,1,3,3-五甲基二硅氧烷的氢化硅烷化反应
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入了作为催化剂的铁络合物c(7.7mg,0.01mmol)。向其中加入苯乙烯(104mg,1.0mmol),进而加入1,1,1,3,3-五甲基二硅氧烷(163mg,1.1mmol),加入了二甲氧基乙烷(3.6mg,0.04mmol)后,将溶液在80℃下搅拌了24小时。冷却后,加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。将这些结果作为条目3示于表1。
1,1,1,3,3-五甲基-3-(2-苯基乙基)-二硅氧烷(表1,(i)的化合物)
1h-nmr(400mhz,cdcl3)δ=-0.03(s,6h,si(ch3)2),-0.02(s,9h,si(ch3)3),0.775-0.81(m,2h,sich2),2.52-2.57(m,2h,ch2c6h5),7.09-7.13(m,2h,c6h5),7.17-7.22(m,3h,c6h5).
[表1]
a相对于铁,在4当量的二甲氧基乙烷存在下进行反应。
(3)使用了铁络合物的1-辛烯的氢化反应
[化17]
[实施例7]使用了铁络合物a的1-辛烯的氢化反应
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(3.7mg,0.005mmol),溶解于二甲氧基乙烷(2ml)。在该溶液中加入了1-辛烯(112mg,1.0mmol)。然后,将史兰克管内用氢置换,将溶液在1个大气压的氢气氛下、80℃下搅拌了2小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目1示于表2中。
1h-nmr(cdcl3,400mhz)δ=0.88(t,jhh=7.2hz,6h,ch3),1.16-1.36(m,12h,-(ch2)6-).
13c-nmr(100mhz,cdcl3)δ=14.27,22.86,29.48,32.10.
[实施例8]使用了低催化剂浓度的铁络合物a的氢化反应
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(3.7mg,0.005mmol),溶解于二甲氧基乙烷(2ml)。在该溶液中加入了1-辛烯(1.12g,10mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在20个大气压的氢气氛下、80℃下搅拌了6小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目2示于表2中。
[实施例9]使用了铁络合物b的氢化反应
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物b(3.5mg,0.005mmol),溶解于二甲氧基乙烷(2ml)。在该溶液中加入了1-辛烯(112mg,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了30分钟。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目3示于表2中。
[表2]
(4)使用了铁络合物的苯乙烯的氢化
[化18]
[实施例10]使用了铁络合物a的苯乙烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(3.7mg,0.005mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了苯乙烯(114μl,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了10小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,通过1h、13c-nmr波谱确认了其结构。将这些结果作为条目1示于表3中。
1h-nmr(cdcl3,400mhz)δ=1.13(t,jhh=7.2hz,3h,ch2ch3),2.54(q,jhh=7.2hz,2h,ch2ch3),7.02-7.11(m,3h,c6h5),7.11-7.20(m,2h,c6h5).
13c-nmr(100mhz,cdcl3)δ=15.6,28.8,125.6,127.8,128.3,144.3.
[实施例11]使用了铁络合物b的苯乙烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物b(3.5mg,0.005mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了苯乙烯(114μl,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了10小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目2示于表3中。
[实施例12]使用了铁络合物c的苯乙烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物c(3.8mg,0.005mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了苯乙烯(114μl,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了24小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目3示于表3。
[表3]
(5)使用了铁络合物a的烯烃的氢化
[化19]
[实施例13]甲基-10-十一碳烯酸酯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(7.3mg,0.01mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了甲基-10-十一碳烯酸酯(198mg,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了2小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目1示于表4。
1h-nmr(cdcl3,400mhz)δ=0.88(t,3h,jh-h=7.4hz,-ch3),1.17-1.35(m,14h,-ch2-),1.53-1.67(m,2h,-ch2-),2.30(t,2h,jh-h=7.7hz,-ch2c(=o)-),3.66(s,3h,ome).
13c-nmr(100mhz,cdcl3)δ=14.25,22.83,25.12,29.31,29.40,29.45,29.60,29.70,32.04,34.28,51.57,174.50
[实施例14]反式-1,2-二苯基乙烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(7.3mg,0.01mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了反式-1,2-二苯基乙烯(180mg,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了2小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目2示于表4中。
1h-nmr(cdcl3,400mhz)δ=2.93(s,4h,ch2),7.12-7.23(m,6h,c6h5),7.24-7.32(m,4h,c6h5).
13c-nmr(cdcl3,100mhz)δ=37.9,125.9,128.3,128.5,141.8.
[实施例15]环戊烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(7.3mg,0.01mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了环戊烯(88.4μl,1.0mmol)。将得到的溶液转移至高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了2小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目3示于表4中。
1h-nmr(cdcl3,400mhz)δ=1.52(s,10h,ch2).
13c-nmr(cdcl3,100mhz)δ=25.9.
[实施例16]1-甲基-1-环己烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(7.3mg,0.01mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了1-甲基-1-环己烯(118μl,1.0mmol)。将得到的溶液转移至高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了2小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目4示于表4中。
1h-nmr(cdcl3,400mhz)δ=0.86(d,jhh=5.8hz,3h,ch3),1.04-1.28(m,4h,ch2),1.28-1.39(m,1h,ch),1.54-1.72(m,6h,ch2).
13c-nmr(cdcl3,100mhz)δ=22.9,26.3,26.4,32.7,35.4.
[实施例17]2,3-二甲基丙烯酸乙酯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入铁络合物a(7.3mg,0.01mmol)作为催化剂,使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了2,3-二甲基丙烯酸乙酯(128mg,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了2小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目5示于表4中。
1h-nmr(cdcl3,400mhz)δ=0.93-0.96(m,6h,me),1.28(t,3h,och2ch3),2.00-2.04(m,1h,chandch2c(=o)),4.19(q,2h,och2ch3).
13c-nmr(100mhz,cdcl3)δ=14.6,22.9,26.0,43.6,60.3,173.5.
[实施例18](±)-柠檬烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(7.3mg,0.01mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了(±)-柠檬烯(136mg,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了10小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,通过1h、13c-nmr波谱确认了其结构(反式:顺式=1:1)。将这些结果作为条目6示于表4中。
1h-nmr(cdcl3,400mhz)δ=0.847(d,2h,jhh=6.8hz,反式异构体的ch(ch3)2),0.859(d,3h,jhh=6.8hz,反式异构体的ch3),0.860(d,2h,jhh=6.8hz,顺式异构体的ch(ch3)2),0.909(d,3h,jhh=6.8hz,顺式异构体的ch3),0.87-1.09(m,2h,ch和ch2),1.18-1.58(m,6h,ch和ch2),1.62-1.77(m,3h,ch2).
13c-nmr(cdcl3,100mhz)δ=19.5.20.0,20.4,22.9,25.5,29.3,29.7,31.6,33.0,33.1,35.8,43.2,44.0.
[实施例19]α-甲基-1,2-二苯基乙烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(7.3mg,0.01mmol),使其溶解于dme(2ml)。在该溶液中加入了α-甲基-1,2-二苯基乙烯(194mg,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了10小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目7示于表4。
1h-nmr(cdcl3,400mhz)δ=1.30(d,3h,jhh=6.8hz,ch3),2.78-2.91(m,1h,ch(me),2.98-3.08(m,1h,ch2ph),7.12-7.40(m,10h,ph).
13c-nmr(cdcl3,100mhz)δ=21.2,42.0,45.1,125.9,126.1,127.0,128.1,128.3,129.4,141.0,147.2.
[实施例20]2,3-二甲基-2-丁烯的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(7.3mg,0.01mmol),使其溶解于二甲氧基乙烷(2ml)。在该溶液中加入了2,3-二甲基-2-丁烯(84mg,1.0mmol)。将得到的溶液转移到高压釜内,将高压釜内用氢置换。然后,将溶液在10个大气压的氢气氛下、80℃下搅拌了6小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目8示于表4中。
1h-nmr(cdcl3,400mhz)δ=0.84(d,jh-h=6.7hz,12h,ch3),1.40(septet,jh-h=6.7hz,12h,ch).
13c-nmr(100mhz,cdcl3)δ=19.4,33.7.
[实施例21]2,3-二甲基-1h-茚的氢化
在20ml的史兰克管中加入磁搅拌子,边减压至5pa边加热干燥后,将史兰克管内置换为氩气氛。在该史兰克管中加入作为催化剂的铁络合物a(7.3mg,0.01mmol),使其溶解于dme(2ml)。在该溶液中加入了2,3-二甲基-1h-茚(144mg,1.0mmol)。将得到的溶液转移至高压釜内,将高压釜内用氢置换。然后,将溶液在20个大气压的氢气氛下、80℃下搅拌了10小时。加入茴香醚(108mg,1.0mmol)作为内标,测定1h-nmr波谱,确定了生成物的结构和收率。对于得到的化合物,采用1h、13c-nmr波谱确认了其结构。将这些结果作为条目9示于表4。
1h-nmr(cdcl3,400mhz)δ=0.94(d,3h,j=6.9hz,ch3chch2),1.14(d,3h,j=7.2hz,ch3ch),2.49-2.61(m,2h),2.94(m,1h),3.17,(quintet,1h,j=6.9hz,ch3ch),7.06-7.24(m,4h,c6h4).
13c-nmr(cdcl3,100mhz)δ=14.5,15.0,37.8,39.2,42.6,123.5,124.3,126.0,126.1,142.8,149.0.
[表4]
(6)使用了铁络合物的酰胺的还原
[化20]
[实施例22]使用了铁络合物a的n,n-二甲基甲酰胺的还原
边将nmr管减压至5pa边加热干燥后,加入作为催化剂的铁络合物a(18mg,0.025mmol),用注射器加入了重苯0.4ml。然后,加入二甲基苯基硅烷(30mg,0.22mmol),加入了n,n-二甲基甲酰胺(36.5mg,0.5mmol)后,在减压下将nmr管烧断而真空封管。将溶液在120℃下搅拌了10小时后,采用1h-nmr波谱确认了胺的生成。将这些结果作为条目1示于表5。
1h-nmr(cdcl3,400mhz)δ=2.12(s,9h,nme3).
[实施例23]使用了铁络合物b的n,n-二甲基甲酰胺的还原
边将nmr管减压至5pa边加热干燥后,加入作为催化剂的铁络合物b(18mg,0.025mmol),用注射器加入了重苯0.4ml。然后,加入二甲基苯基硅烷(30mg,0.22mmol),加入了n,n-二甲基甲酰胺(36.5mg,0.5mmol)后,在减压下将nmr管烧断而真空封管。将溶液在120℃下搅拌了10小时后,采用1h-nmr波谱确认了胺的生成。将这些结果作为条目2示于表5中。
[表5]
(7)使用了铁络合物b的醛的还原反应
[实施例24]4-甲氧基苯甲醛的还原
边将nmr管减压至5pa边加热干燥后,加入作为催化剂的铁络合物b(18mg,0.025mmol),用注射器加入了重苯0.4ml。然后,加入了1,1,3,3-四甲基二硅氧烷(101mg,0.75mmol)、4-甲氧基苯甲醛(68mg,0.5mmol)、作为内标物质的六甲基苯(32.4mg,0.05mmol)后,在减压下将nmr管烧断而真空封管。将溶液在60℃下搅拌了10小时后,采用1h-nmr波谱确认了醇的甲硅烷基醚体的生成(收率94%)。对于得到的醇的甲硅烷基醚体,采用1h、13c-nmr波谱确认了其结构。
1h-nmr(cdcl3,400mhz)δ=0.12(s,6h,sime2),0.18(d,6h,jsi-h=3.9hz,si(h)me2),3.79(s,3h,ome),4.70(s,2h,ch2),4.73(sept,1h,jsi-h=3.9hz,sih),6.86-6.89(m,2h,c6h4),7.20-7.23(m,2h,c6h4).
13c-nmr(cdcl3,99.5mhz)δ=-0.99,0.74,55.21,64.01,113.76,128.20,132.91,158.95。
- 还没有人留言评论。精彩留言会获得点赞!