半胱氨酸蛋白酶的制作方法
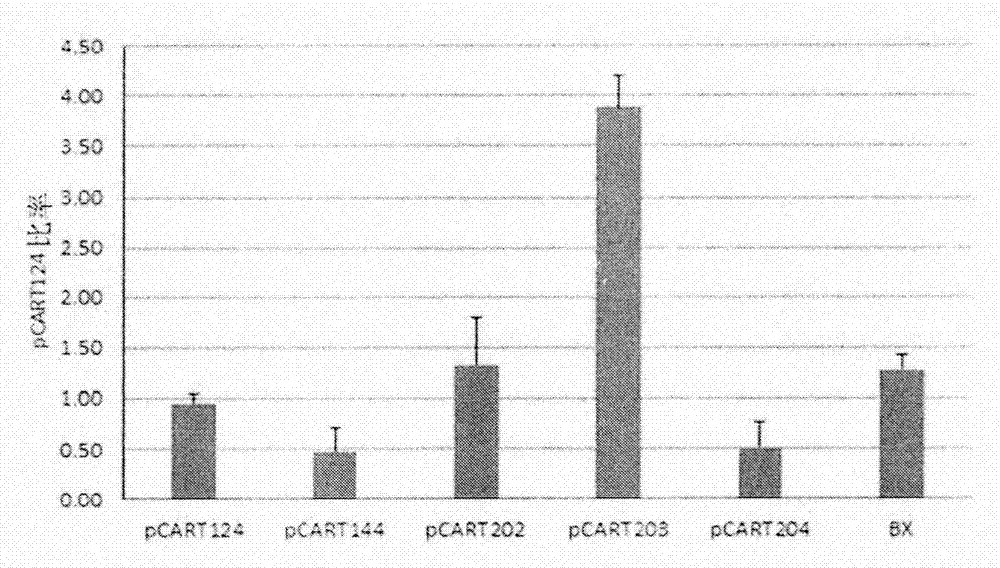
本发明涉及显示igg半胱氨酸蛋白酶活性的新型多肽及其活体内和活体外用途。该多肽的用途包括用于预防或治疗由igg介导的疾病和病症的方法,以及用于分析igg的方法。
背景技术:
:ides(化脓性链球菌的免疫球蛋白g降解酶,immunoglobuling-degradingenzymeofs.pyogenes)是由人类病原体化脓性链球菌生成的细胞外半胱氨酸蛋白酶。ides最初是从血清型m1的a群链球菌菌株分离的,但现在已经在所有测试的a群链球菌菌株中识别到ides基因。ides具有非常高程度的底物特异性,同时其唯一识别的底物是igg。ides催化人igg所有亚类重链的下铰链区中的单次蛋白水解切割。ides还催化各种动物中igg的一些亚类的重链的等效切割。ides通过两阶段机制有效地将igg切割至fc和f(ab′)2片段。在第一阶段中,将一个(第一)igg重链切割以产生具有非共价结合的fc分子的单切割的igg(scigg)分子。scigg分子实际上是保留原始igg分子的剩余(第二)重链的中间产物。在该机制的第二阶段中,该第二重链被ides切割以释放f(ab′)2片段和同二聚体fc片段。这些是在生理条件下通常观察到的产物。在还原条件下,f(ab′)2片段可以解离成两个fab片段,并且同二聚体fc可以解离成其组分单体。技术实现要素:已经显示ides的igg切割能力具有活体外实用性,例如在用于生产fab和fc片段的方法中,可用于分析igg。参见例如,wo2003051914和wo2009033670。还已经显示ides具有作为治疗剂的活体内实用性,因为它能够在活体内切割介导疾病的或者其他方面不需要的igg分子。参见例如,wo2003051914、wo2006131347和wo2013110946。ides可用作针对任何完全地或部分地由igg介导的疾病或病症的治疗。许多自身免疫疾病完全地或部分地由igg介导,捐赠器官的急性排斥反应正是如此。然而,ides是免疫原性蛋白。也就是说,当ides用作治疗剂时,接受ides的受试者的免疫系统将经常对其进行应答。免疫系统对ides的反应将通常涉及对ides特异性的抗体的产生。这些抗体在本文中可称为对ides特异性的抗药物抗体(ada)或“ides特异性ada”。一般来说,对ides的免疫应答(特别是ides特异性ada的产生)可能会引起两种相关类型的问题。首先,可能减少ides的效力,例如由于ada结合,可能需要较高或重复剂量来达到相同的效果。具有这种效果的ada可以被称为“中和ada”。其次,可能存在不想要的或甚至有害的并发症,诸如由ada与ides的免疫复合物触发的高度炎症应答。在给定的受试者中对ides特异性的ada数量越高,则这些问题的可能性就越大。患者中ides特异性ada分子的存在和数量可以通过任何合适的方法(诸如试剂特异性capfeia(immunocap)测试或对来自患者的血清样品进行的滴度测定)来测定。高于临床医生确定的阈值,患者中ides特异性ada分子的数量可能妨碍了ides的施用,或表明需要更高剂量的ides。这样较高的剂量可进而导致患者中ides特异性ada分子的数量增加,从而妨碍了ides的进一步施用。ides是化脓性链球菌的毒力因子,化脓性链球菌对常见的感染如扁桃体炎和链球菌性咽喉炎(strepthroat)负有责任。因此,大多数人类受试者在这种情况下已经遇到了ides,并且可能在血流中具有抗ides抗体。在来自随机人类受试者(可能由于先前的链球菌感染)的血清样品中以及在ivig(静脉内免疫球蛋白,intravenousimmunoglobulin)制品中常规检测到ides特异性ada,ivig制品是从数千个供体的汇集血清中提取的igg的制品。即使在初始施用ides之前,受试者不具有ides特异性ada,这样的分子也可能将在随后产生。因此,对于任何给定的受试者,与ides的免疫原性相关的问题可能对使用ides作为治疗造成障碍。这些问题可能需要增加ides的剂量和/或排除完全使用ides的治疗,特别是如果需要重复施用。对于这类问题的现有解决方案涉及例如治疗剂的聚乙二醇化以降低治疗剂的免疫原性、或者治疗剂与免疫抑制剂共同施用。本发明人采用了完全不同的方法。本发明人分析了ides的序列,并将其与蛋白idez的序列进行比较,idez与ides具有大约66%的同一性。idez是由马链球菌兽疫亚种(streptococcusequissp.zooepidemicus)(一种主要在马中发现的细菌)产生的igg半胱氨酸蛋白酶。由于idez不是人类病原体,所以人类受试者在其血浆中通常不具有针对该蛋白质的抗体。然而,idez具有针对人igg的igg半胱氨酸蛋白酶活性水平,该水平远低于ides的水平。本发明人研究了idez序列中的位置,提高了其对人igg的活性,而不会引起免疫原性的显著增加。作为本次研究的起点,发明人使用了idez的序列和由发明人设计的新型杂合序列的序列这二者,该新型杂合序列与ides具有81.7%的同一性以及与idez具有81%的同一性。该杂合序列在本文中可以称为ides/z。ides的全序列作为ncbi参考序列号wp_010922160.1是公众可获得的,并在本文中作为seqidno:1提供。该序列包括n末端甲硫氨酸,接着是28个氨基酸的分泌信号序列。n末端甲硫氨酸和信号序列(于n末端的总共29个氨基酸)通常被去除以形成成熟的ides蛋白,其序列作为genbank登录号adf13949.1是公众可获得的,并在本文中作为seqidno:2提供。idez的全序列作为ncbi参考序列号wp_014622780.1是公众可获得的并且其在本文中作为seqidno:3提供。该序列包括n末端甲硫氨酸,接着是33个氨基酸的分泌信号序列。n末端甲硫氨酸和信号序列(于n末端的总共34个氨基酸)通常被去除以形成成熟的idez蛋白,其序列在本文中作为seqidno:4提供。由发明人设计的ides/z杂合物的序列具有基于idez的n末端部分,而没有n末端甲硫氨酸和信号序列(于n末端的总共34个氨基酸)。该序列在本文中作为seqidno:5提供。本发明人已经能够识别idez和ides/z杂合物的序列中的位置,当如本文所述的进行修饰时,导致新型多肽,该新型多肽相对于idez具有增加的针对人igg的igg半胱氨酸蛋白酶活性。本发的明多肽的对人igg的igg半胱氨酸蛋白酶活性优选地至少与ides的针对人igg的igg半胱氨酸蛋白酶活性一样高。本发明的多肽在切割igg分子的第一链上可能比第二链更有效(见图18中的示意图),特别是当igg是igg2同种型时。本发明的多肽在切割igg1上可能比igg2更有效。本发明的多肽通常比ides具有更低的免疫原性,并且可优选地不比idez或ides/z具有更多的免疫原性。除非另有说明,对本文公开的多肽中氨基酸位置的编号的所有提及均基于从n末端开始的seqidno:3中相应位置的编号。因此,由于seqidno:4和5缺少seqidno:3的n末端甲硫氨酸和33个氨基酸信号序列,因此将在seqidno:4和5的n末端的天冬氨酸(d)残基称为位置35,如这个seqidno:3中的相应位置一样。应用该编号方案,ides的igg半胱氨酸蛋白酶活性的最关键残基是位置102处的半胱氨酸(c)(从seqidno:4和5的n末端起的第68个残基)。可能对igg半胱氨酸蛋白酶活性重要的其他残基是seqidno:3的位置92处的赖氨酸(k)、位置272处的组氨酸(h)以及位置294和296中的每一处的天冬氨酸(d)。这些分别是从seqidno:4的n末端起第58个、第238个、第260个和第262个残基以及从seqidno:5的n末端起的第58个、第238个、第258个和第260个。根据本发明,因此提供了具有igg半胱氨酸蛋白酶活性并包含序列seqidno:4或5的变体的多肽,所述变体:(a)与seqidno:4或5至少50%同一;(b)在所述变体序列中对应于seqidno:3的位置102的位置处具有半胱氨酸(c);以及任选地(c)在所述变体序列中对应于seqidno:3的位置92、272、294和296的位置处分别具有赖氨酸(k)、组氨酸(h)、天冬氨酸(d)和天冬氨酸(d);其中所述多肽在切割人igg上比idez更有效和/或所述多肽在切割人igg上至少与ides一样有效。优选地,seqidno:4或5的所述变体:(1)在所述变体中对应于seqidno:3的位置138的位置处具有带正电荷的氨基酸,任选地其中所述带正电荷的氨基酸是精氨酸(r)或赖氨酸(k);和/或(2)在所述变体中对应于seqidno:3的位置139的位置处具有带正电荷的氨基酸,任选地其中所述带正电荷的氨基酸是精氨酸(r)或赖氨酸(k);和/或(3)不包括连续序列ddyqrnateayakevphqit;和/或(4)具有以下修饰中的至少之一:i.在所述变体中对应于seqidno:3的位置64和65的位置处亮氨酸(l)和苏氨酸(t)残基的缺失;ii.在所述变体中对应于seqidno:3的位置70的位置处苏氨酸(t)代替精氨酸(r);iii.在所述变体中对应于seqidno:3的位置71的位置处酪氨酸(y)的缺失;iv.在所述变体中对应于seqidno:3的位置72的位置处谷氨酰胺(q)代替天冬酰胺(n);v.在所述变体中对应于seqidno:3的位置73的位置处甘氨酸(g)代替天冬酰胺(n);vi.在所述变体中对应于seqidno:3的位置67的位置处丙氨酸(a)代替谷氨酸(e);vii.在所述变体中对应于seqidno:3的位置68的位置处天冬酰胺(n)代替谷氨酰胺(q)。(4)中的至少一种修饰通常选自以上选项i.至vii.。本发明的多肽可以包含氨基酸序列seqidno:4或5的变体,该变体具有选项i.至vii.的修饰中的至少两种、三种、四种、五种、六种或全部7种。本发明还提供编码或表达本发明的多肽的多核苷酸、表达载体或宿主细胞。本发明还提供一种治疗或预防受试者中由igg抗体介导的疾病或病症的方法,所述方法包括向受试者施用治疗或预防有效量的本发明的多肽。该方法通常可以包括向受试者多次施用所述多肽。本发明还提供了一种活体外处理取自患者的血液的方法,典型地是患有由igg抗体介导的疾病或病症的患者,该方法包括使血液与本发明的多肽接触。本发明还提供了一种用于改善治疗或治疗剂对受试者益处的方法,所述方法包括(a)向受试者施用本发明的多肽;以及(b)随后将所述治疗或所述治疗剂施用于受试者;其中:-所述治疗是器官移植或者所述治疗剂是抗体,基因疗法(诸如病毒载体),对缺陷性内源性因子(诸如酶、生长或凝血因子)的替代,或者细胞治疗;-所施用的所述多肽的量足以切割存在于受试者血浆中的基本上所有igg分子;以及-步骤(a)和步骤(b)由足以切割存在于受试者血浆中基本上所有igg分子的时间间隔分隔。本发明还提供一种生成igg的fc片段、fab片段或f(ab′)2片段的方法,该方法包括将igg与本发明的多肽(优选地在活体外)接触。还提供了用于实施根据本发明的方法的试剂盒。附图说明图1和图2示出了确定与对照相比,本发明的多肽的效价(对igg切割的效力)的代表性测定的结果。图3示出了用于可视化由igg1与本发明的多肽或对照一起孵育产生的切割产物的代表性sds-page凝胶的结果。图4示出了用于可视化由ivig与本发明的多肽或对照一起孵育产生的切割产物的代表性sds-page凝胶的结果。图5示出了用于可视化由igg1与本发明更多的多肽或对照一起孵育产生的切割产物的代表性sds-page凝胶的结果。图6示出了用于可视化由igg2与本发明的多肽或对照一起孵育产生的切割产物的代表性的sds-page凝胶的结果。图7示出了用于可视化由ivig与本发明的多肽或对照一起孵育产生的切割产物的代表性sds-page凝胶的结果。图8和图9示出了确定与对照相比,本发明的多肽被ides特异性抗体识别的水平的代表性竞争测定的结果。图10和图11示出了确定与对照相比,本发明的多肽被ides特异性抗体识别的水平的代表性滴定测定结果。图12示出了由不同的igg半胱氨酸蛋白酶多肽切割igg1的代表性滴定曲线。图13示出了由不同的igg半胱氨酸蛋白酶多肽切割igg2的代表性滴定曲线。图14示出了用于可视化由igg与本发明的多肽或对照一起孵育产生的切割产物的代表性sds-page的结果。图15示出了用于可视化由igg与本发明的多肽或对照一起孵育产生的切割产物的代表性sds-page的结果。图16示出了用于可视化由ivig与本发明的多肽或对照一起孵育产生的切割产物的代表性sds-page的结果。图17示出了用于可视化由ivig与本发明的多肽或对照一起孵育产生的切割产物的代表性sds-page的结果。图18由本发明的多肽切割免疫球蛋白的示意图。图19示出了用本发明的多肽或对照的ada结合位点的代表性的%竞争的结果。图20示出了用本发明的多肽或对照的ada结合位点的进一步代表性的%竞争的结果。图21示出了用于测定本发明的多肽在活体内切割人igg的效力的代表性效力elisa的结果。图22示出了用于可视化由本发明的多肽在活体内产生的igg切割产物的代表性sds-page的结果。序列的简要说明seqidno:1是包括n末端甲硫氨酸和信号序列的ides全序列。还被公开为ncbi参考序列号wp_010922160.1seqidno:2是缺少n末端甲硫氨酸和信号序列的ides成熟序列。还被公开为genbank登录号adf13949.1seqidno:3是包括n末端甲硫氨酸和信号序列的idez的全序列。还被公开为ncbi参考序列号wp_014622780.1。seqidno:4是缺少n末端甲硫氨酸和信号序列的idez的成熟序列。seqidno:5是发明人设计的杂合ides/z的序列。n末端基于缺少n末端甲硫氨酸和信号序列的idez。seqidno:6至25是本发明的示例性多肽的序列。seqidno:26是本文中用作对照的ides多肽的序列。包括具有附加的n末端甲硫氨酸和组氨酸标签的序列seqidno:2(内部参照pcart124)。seqidno:27是本文中用作对照的idez多肽的序列。包括具有附加的n末端甲硫氨酸和组氨酸标签的序列seqidno:4(内部参照pcart144)。seqidno:28是本文中用作对照的ides/z多肽的序列。包括具有附加的n末端甲硫氨酸和组氨酸标签的序列seqidno:5(内部参照pcart145)。seqidno:29是连续序列pltpeqfrynn,其对应于seqidno:3的位置63-73。seqidno:30是连续序列ppanftqg,其对应于seqidno:1的位置58-65。seqidno:31是连续序列ddyqrnateayakevphqit,其对应于seqidno:3的位置35-54。seqidno:32是连续序列dsfsanqeirysevtpyhvt,对应于seqidno:1的位置30-49。seqidno:33至55是编码本文公开的多肽的核苷酸序列。具体实施方式应当理解,所公开的产品和方法的不同应用可以根据本领域的具体需要进行调整。还应当理解,本文使用的术语仅用于描述本发明的具体实施方式的目的,而不是限制性的。此外,在本说明书和所附权利要求书中使用的情况下,除非内容另有明确指示,否则单数形式“一(a)”、“一(an)”和“该”包括复数指示物。因此,例如,提及“一种多肽”包括“多个多肽”等。“多肽”在本文中以其最广泛的含义用于指两个或更多个亚基氨基酸、氨基酸类似物或其他肽模拟物的化合物。因此,术语“多肽”包括短肽序列以及还包括更长的多肽和蛋白质。如本文所用,术语“氨基酸”是指天然和/或非天然或合成的氨基酸(包括d或l光学异构体二者),以及氨基酸类似物和肽模拟物。术语“患者”和“受试者”可互换使用,并且通常是指人。除非另有说明,提及igg通常是指人igg。本文引用的所有出版物、专利和专利申请,无论是上文还是下文,均通过引用整体并入本文。多肽的功能特征本发明涉及具有igg半胱氨酸蛋白酶活性的新型多肽,其中所述多肽在切割人igg上比idez更有效。本发明的多肽针对人igg的igg半胱氨酸蛋白酶活性优选地至少与ides针对人igg的igg半胱氨酸蛋白酶活性一样高。此外,本发明的多肽通常比ides具有更低的免疫原性,并且可优选地不超过idez或ides/z的免疫原性。在相对于本发明的多肽的对照或比较的上下文中,“ides”、“idez”和“ides/z”分别是指由氨基酸序列seqidno:2、4和5组成的多肽。可替换地或此外,当用作对照或比较时,“ides”、“idez”和“ides/z”可以分别指包含氨基酸序列seqidno:2、4和5的序列的多肽,其具有在n末端附加的甲硫氨酸(m)残基和/或在c末端的标签,以帮助在标准细菌表达系统中表达和从标准细菌表达系统分离。合适的标签包括组氨酸标签,其可以直接连接到多肽的c末端或者通过任何合适的接头序列(诸如3个、4个或5个甘氨酸残基)间接连接。组氨酸标签通常由六个组氨酸残基组成,尽管它可以比此更长(通常高达7个、8个、9个、10个或20个氨基酸)或更短(例如5个、4个、3个、2个或1个氨基酸)。本文使用的示例性ides多肽的序列是作为seqidno:22而被提供的对照。该多肽包含具有附加的n末端甲硫氨酸和组氨酸标签的序列seqidno:2,并且在本文中可以称为pcart124。本文使用的示例性idez多肽的序列是作为seqidno:23而被提供的对照。该多肽包含具有附加的n末端甲硫氨酸和组氨酸标签的序列seqidno:4,并且在本文中可以称为pcart144。本文使用的示例性ides/z多肽的序列是作为seqidno:24而被提供的对照。该多肽包含具有附加的n末端甲硫氨酸和组氨酸标签的序列seqidno:5,并且在本文中可以称为pcart145。igg半胱氨酸蛋白酶活性可以通过任何合适的方法来评估,例如通过将多肽与含有igg的样品一起孵育并确定igg切割产物的存在。在存在或不存在抑制剂(诸如中和抗体)的情况下可以评估效力。然而,本文中的效力通常是指在不存在这种抑制剂的情况下评估的效力,除非另有说明。合适的方法在实施例中描述。多肽在切割igg上的效力在本文中可称为多肽的“效价(potency)”。本发明的多肽的效价优选地为在同一种测定中测量的idez的效价的至少2.0倍大。可替换地,本发明的多肽的效价优选地至少等于在同一种测定中测量的ides的效价。本发明的多肽的效价可以为在同一种测定中测量的ides的效价的至少1.5倍、2.0倍、2.5倍、3.0倍、4.0倍、4.5倍、5.0倍、6.0倍、7.0倍、7.5倍或8.0倍大。本发明的多肽的效价优选地为在同一种测定中测量的ides的效价的至少2.0倍,更优选地至少3.0或4.0倍,以及最优选地至少8.0倍大。本发明的多肽通常比ides具有更低的免疫原性,因此相对于idez的效价已增加的效价和/或与ides的效价相当的效价是针对人igg的半胱氨酸蛋白酶活性的可接受的最低标准。然而,相对于ides的效价增加是理想的提高。这种效价增加通常将使得较低剂量的本发明的多肽的使用与更高剂量的ides具有相同的治疗效果。较低剂量还可以允许本发明的多肽相对于ides的更多数目的重复施用。这是因为较低剂量的使用减少了与治疗剂的免疫原性相关的问题,因为免疫系统对于以较低浓度存在的试剂不太有可能应答或将对其应答较少。用于评估多肽在切割igg上的效力的测定,即用于评估多肽的效价的测定,是本领域熟知的,并且可以使用任何合适的测定。合适的测定包括基于elisa的测定,诸如实施例中描述的测定。在这种测定中,测定板的孔通常将用抗体的靶(诸如牛血清白蛋白(bsa))包被。然后将待测试的多肽的样品加入到孔中,随后是靶特异性抗体的样品,该抗体是在该实施例中对bsa特异性的抗体。允许多肽和抗体在适合于igg半胱氨酸蛋白酶活性的条件下相互作用。在适当的间隔后,将洗涤测定板,并将在适合与靶特异性抗体结合的条件下加入特异性结合该靶特异性抗体的检测抗体。检测抗体将结合于在每个孔中已与靶结合的任何完整靶特异性抗体。洗涤后,存在于孔中的检测抗体的量将与结合到该孔的靶特异性抗体的量成比例。检测抗体可以直接地或间接地缀合到标记物或另一报告体系(诸如酶)上,使得可以确定残留在每个孔中的检测抗体的量。在孔中存在的所测试的多肽的效价越高,则完整的靶特异性抗体将保留得越少,并因此将存在越少的检测抗体。通常,在给定测定板上的至少一个孔将包括ides取代待测试的多肽,使得所测试的多肽的效价可以直接与ides的效价进行比较。还可以包括idez和ides/z进行比较。其他测定可以通过直接可视化和/或定量由所测试的多肽切割igg而产生的igg片段来确定所测试的多肽的效价。这种类型的测定也在实施例中描述。这样的测定通常将igg样品与在滴定系列中以不同浓度的测试多肽(或与作为对照的ides、idez和ides/z中的一种或多种)一起孵育。然后使用凝胶电泳(例如通过sds-page)分离以各浓度孵育产生的产物。然后完整igg和由igg的切割产生的片段可以通过尺寸来识别,并通过用合适染料染色的强度来定量。切割片段的数量越大,则以给定浓度的所测试的多肽的效价就越高。本发明的多肽通常以比idez和/或ides更低的浓度(在滴定系列中的较低点)产生可检测量的切割片段。这种类型的测定还可以能够识别在切割igg分子的第一或第二重链上更有效的测试多肽,因为也可以确定由每个切割事件产生的不同片段的数量。本发明的多肽在切割igg分子的第一链上可能比第二链更有效(参见图18中的示意图),特别是当igg是igg2同种型时。本发明的多肽可以在切割igg1上比igg2更有效。也可以使这种类型的测定适应于确定ides特异性ada的存在可以降低本发明的多肽的效价的程度。在该适应性测定中,当将igg样品与测试多肽(或与作为对照的ides)一起孵育时,包含与反应介质一起的含有ides特异性ada的血清或ivig制品。优选地,本发明的多肽的效价不受ada的存在的影响,或者在同一种测定中相比于ides的效价,本发明的多肽的效价被ada的存在所降低得更少。换言之,优选地,ides特异性ada对本发明的多肽的中和效应与在同一种测定中所测量的ides特异性ada对ides的中和效应相同或较之更低。如上所述,本发明的多肽通常比ides具有更低的免疫原性。也就是说,当以相等的剂量或浓度存在并且在同一种测定中测量时,本发明的多肽可以导致与ides相同的免疫应答或优选地较之更低的免疫应答。本发明的多肽的免疫原性通常不超过在同一种测定中所测量的ides的免疫原性的50%、不超过45%、不超过40%、不超过35%、不超过30%或不超过25%。优选地,本发明的多肽的免疫原性不超过在同一种测定中所测量的ides的免疫原性的25%。用于评估多肽的免疫原性的测定也是本领域熟知的,并且可以使用任何合适的测定。用于评估多肽的免疫原性相对于ides的免疫原性的优选测定涉及评估对ides特异性的ada还与本发明的多肽结合的程度。实施例中描述了这种类型的测定。一种这样的测定涉及对ides与测试多肽之间对于结合ides特异性ada的竞争的测试。通常,将测定板的孔用ides包被,随后施用含有ides特异性ada(例如ivig制品)和测试多肽(或作为对照的ides)的溶液的预孵育混合物。预孵育是在igg半胱氨酸蛋白酶活性的抑制剂(例如碘乙酸(ihac))存在的情况下和高盐浓度下进行的,使得仅允许蛋白质与ada之间的高亲和力结合。允许已预孵育的混合物与ides包被的孔相互作用。任何不结合测试多肽的ides特异性ada将与孔上的ides结合。在合适的间隔后,将洗涤测定板,并在适合结合的条件下加入特异性结合igg的检测抗体。检测抗体将与每个孔中已结合于ides的任何ada结合。洗涤后,存在于孔中的检测抗体的量将与已结合于测试多肽的ada的量成反比。检测抗体可以直接地或间接地缀合到标记物或另一报告体系(诸如酶)上,使得可以确定残留在每个孔中的检测抗体的量。通常,给定测定板上的至少一个孔将用ivig和ides的预孵育混合物代替待测试的多肽进行测试,使得ada与所测试的多肽的结合可直接地与对ides的结合进行比较,也可包括idez和/或ides/z作为进一步对照。另一种合适的测定包括测试不同浓度的ides特异性ada(例如ivig制品)的滴定系列相比于作为对照的ides和/或idez与测试多肽结合的程度。优选地,相对于可检测到与ides结合的ada的浓度,本发明的多肽将需要更高的ada结合浓度以成为可检测到的。实施例中描述了这样的测定。这样的测定通常包括用测试多肽或对照包被测定板的孔,随后用来自滴定系列的不同浓度的ides特异性ada与每个孔一起孵育。孵育是在igg半胱氨酸蛋白酶活性的抑制剂(例如碘乙酸(ihac))存在的情况下并在高盐浓度下进行的,使得仅允许蛋白质与ada之间的高亲和力结合。在合适的间隔后,将洗涤测定板,并在适合结合的条件下加入特异性结合iggf(ab′)2的检测抗体。检测抗体将与每个孔中已结合测试多肽或ides的任何ada结合。洗涤后,存在于孔中的检测抗体的量将与已结合于测试多肽或对照的ada的量成正比。检测抗体可以直接地或间接地缀合到标记物或另一报告体系(诸如酶)上,使得可以测定残留在每个孔中的检测抗体的量。给定测定板上的至少一个孔将与作为空白的缺乏ada的缓冲液一起孵育,以建立用于检测测试孔中的结合的阈值水平。多肽的结构特征本节列出了本发明的多肽的结构特征,其此外适用于前面部分中概述的功能特征。本发明的多肽通常具有至少100个、150个、200个、250个、260个、270个、280个、290个、300个或310个氨基酸的长度。本发明的多肽通常具有不大于400个、350个、340个、330个、320个或315个氨基酸的长度。应当理解,上述列出的下限中的任一者可以与上述列出的上限中的任一者组合,以提供本发明的多肽的长度范围。例如,多肽可以具有100个至400个氨基酸的长度,或具有250个至350个氨基酸的长度。多肽优选地具有290个至320个氨基酸的长度,最优选地具有300个至315个氨基酸的长度。本发明的多肽的一级结构(氨基酸序列)基于idez或ides/z的一级结构,具体分别为氨基酸序列seqidno:4或5。本发明的多肽的序列包含氨基酸序列seqidno:4或5的变体,其与氨基酸序列seqidno:4或5至少50%同一。变体序列可以与序列seqidno:4或5至少60%、至少70%、至少80%、至少85%、优选至少90%、至少95%、至少98%或至少99%同一。该变体除了包括本文所识别的一种或多种特定修饰外可以与序列seqidno:4或5相同。可以在seqidno:4或5所示序列的至少50个、至少100个、至少200个、至少300个或更多个连续氨基酸的区域上,或更优选地在seqidno:4或5的全长上测量相对于序列seqidno:4或5的同一性。可以使用任何合适的算法来计算氨基酸同一性。例如,pileup和blast算法可用于计算同一性或排齐序列(诸如识别等同或相应序列(通常在其默认设置上),例如,如在altschuls.f.(1993)jmolevol36:290-300;altschul,s,f等人(1990)jmolbiol215:403-10中描述的。用于进行blast分析的软件可通过国家生物技术信息中心(http://www.ncbi.nlm.nih.gov/)公开获得。该算法包括首先通过在查询序列中识别长度为w的短字符来识别高得分序列对(hsp),该短字符与数据库序列中相同长度的字符比对时匹配或满足一些正值阈值得分t。t被称为相邻字得分阈值(neighbourhoodwordscorethreshold)(altschul等人,同上)。这些初始命中相邻字符(initialneighbourhoodwordhit)作为用于启动搜索以找到包含它们的hsp的种子。只要可以增加累积比对得分,则命中字符(wordhit)沿着每个序列在两个方向上扩展。在以下情况下,命中字符在每个方向上的扩展停止:累积比对分数自其最大实现值下降量x;由于一个或多个负面得分残基比对的积累,累积得分达到零或以下;或者达到任一序列的结束。blast算法参数w、t和x决定了比对的灵敏度和速度。blast程序使用字长(w)为11,blosum62评分矩阵(参见henikoff和henikoff(1992)proc.natl.acad.sci.usa89:10915-10919)比对(b)为50,期望值(e)为10,m=5,n=4,以及两条链的比较作为默认值。blast算法对两个序列之间的相似性进行统计分析;参见例如,karlin和altschul(1993)proc.natl.acad.sci.usa90:5873-5787。由blast算法提供的一种相似性度量是最小总和概率(p(n)),其提供了两个多核苷酸或氨基酸序列之间的匹配偶然发生的概率的指示。例如,如果第一序列与第二序列比较的最小和概率小于约1,优选小于约0.1,更优选小于约0.01,以及最优选小于约0.001,则将一个序列被认为与另一序列相似。可替换地,uwgcg软件包提供了可用于计算同一性的bestfit程序(例如在其默认设置上使用)(devereux等人(1984)nucleicacidsresearch12,387-395)。本发明的多肽的序列包含seqidno:4或5的氨基酸序列的变体,其中相对于序列seqidno:4或5进行修饰,诸如氨基酸添加、缺失或取代。除非另有说明,修饰优选为保守氨基酸取代。保守取代用类似化学结构、类似化学性质或类似侧链体积的其他氨基酸代替氨基酸。引入的氨基酸可能具有与其代替的氨基酸相似的极性、亲水性、疏水性、碱度、酸度、中性或电荷。可替换地,保守取代可以引入另一芳族或脂族的氨基酸,代替预先存在的芳族或脂族的氨基酸。保守的氨基酸变化是本领域公知的,并且可以根据如下表a1中所限定的20种主要氨基酸的性质进行选择。当氨基酸具有相似的极性时,这可以通过参考表a2中氨基酸侧链的亲水尺度(hydropathyscale)来确定。表a1-氨基酸的化学性质丙氨酸(a)脂肪族、疏水性、中性甲硫氨酸(m)疏水性、中性半胱氨酸(c)极性、疏水性、中性天冬酰胺(n)极性、亲水性、中性天冬氨酸(d)极性、亲水性、带电荷(-)脯氨酸(p)疏水性、中性谷氨酸(e)极性、亲水性、带电荷(-)谷氨酰胺(q)极性、亲水性、中性苯丙氨酸(f)芳香族、疏水性、中性精氨酸(r)极性、亲水、带电(+)甘氨酸(g)脂肪族、中性丝氨酸(s)极性、亲水性、中性组氨酸(h)芳族、极性、亲水、带电(+)苏氨酸(t)极性、亲水性、中性异亮氨酸(i)脂族、疏水、中性缬氨酸(v)脂肪族、疏水性、中性赖氨酸(k)极性、亲水性、带电荷(+)色氨酸(w)芳香族、疏水性、中性亮氨酸(l)脂族、疏水、中性酪氨酸(y)芳香族、极性、疏水性表a2-亲水尺度本发明的多肽的氨基酸序列包含氨基酸序列seqidno:4或5的变体。然而,氨基酸序列seqidno:4或5中的某些残基优选地保留在所述变体序列中。例如,所述变体序列通常保留已知是igg半胱氨酸蛋白酶活性所需的某些残基。因此,在本发明的多肽的氨基酸序列中必须保留seqidno:3的位置102处的半胱氨酸(seqidno:4或5的第68个残基)。任选地,还保留了seqidno:3的位置92处的赖氨酸(k)、位置272处的组氨酸(h)以及位置294和位置296的每个位置的天冬氨酸(d)。这些分别是自seqidno:4的n末端的第58个、第238个、第260个和第262个残基以及自seqidno:5的n末端的第58个、第236个、第258个和第260个残基。因此,本发明的多肽通常包含氨基酸序列seqidno:2的变体,其在所述变体序列中对应于seqidno:3的位置102的位置处具有半胱氨酸(c);以及任选地在所述变体序列中对应于seqidno:3的位置92、位置272、位置294和位置296的位置处分别具有赖氨酸(k)、组氨酸(h)、天冬氨酸(d)和天冬氨酸酸(d)。从上述结构限制开始,发明人通过评估ides的三维模型识别了用以调整ides的功能特性的修饰的具体位置。发明人已经确定:(1)用带正电荷的氨基酸替代seqidno:3的位置138处的天冬酰胺(n)增强了包含该变化的多肽的效价。因此,本发明的多肽可以包含氨基酸序列seqidno:4或5的变体,其在所述变体中对应于seqidno:3的位置138的位置处具有带正电荷的氨基酸。常见的带正电荷的氨基酸在上表a1中被确定。带正电荷的氨基酸优选为精氨酸(r)或赖氨酸(k)。因此,本文中可以由术语“n138r/k”来识别该特定修饰。(2)用带正电荷的氨基酸替代seqidno:3的位置139处的天冬酰胺(n)增强了包含该变化的多肽的效价。因此,本发明的多肽可以包含氨基酸序列seqidno:4或5的变体,其在所述变体中对应于seqidno:3的位置139的位置处具有带正电荷的氨基酸。常见的带正电荷的氨基酸在上表a中被确定。带正电荷的氨基酸优选为精氨酸(r)或赖氨酸(k)。因此,本文中可以由术语“n139r/k”来识别该特定修饰。(3)使seqidno:3的n末端的前20个残基缺失可以增强包含该变化的多肽的效价和/或可以降低免疫原性而不会不利地影响效价。seqidno:3的n末端的前20个残基由连续的序列ddyqrnateayakevphqit组成。因此,本发明的多肽可以包含不包括连续序列ddyqrnateayakevphqit的氨基酸序列seqidno:4或5的变体。也就是说,seqidno:4或5的n末端的前20个残基可以不存在于seqidno:4或5的所述变体中。seqidno:4和5的前20个残基对应于seqidno:3的位置35-54。因此,本文中可以由术语“d35_t54del”来识别该特定修饰。(4)对应于seqidno:3的位置63-73的区域对于本发明的多肽的igg半胱氨酸蛋白酶活性是重要的。该区域中的修饰主要提高多肽切割第二igg重链的能力,但这些修饰还增强了第一igg重链的切割。具体地,修饰该区域内有利于ides的等同区域中的相应残基(或与相应残基具有相似特征的氨基酸)的一个或多个残基增加了本发明的多肽的效价。ides中的等同区域对应于seqidno:1的位置58-65。以下比对显示了seqidno:3的位置63-73与seqidno:1的位置58-65比较。63pltpeqfrynn73(idez的区域,seqidno:3)58p--panft-qg65(ides的区域,seqidno:1)“-”表示不存在残基因此,本发明的多肽可以包含氨基酸序列seqidno:4或5的变体,该变体可以具有以下修饰中的至少之一:i.在所述变体中对应于seqidno:3的位置64和65的位置处亮氨酸(l)和苏氨酸(t)残基的缺失;ii.在所述变体中对应于seqidno:3的位置70的位置处苏氨酸(t)代替精氨酸(r);iii.在所述变体中对应于seqidno:3的位置71的位置处酪氨酸(y)的缺失;iv.在所述变体中对应于seqidno:3的位置72的位置处谷氨酰胺(q)代替天冬酰胺(n);v.在所述变体中对应于seqidno:3的位置73的位置处甘氨酸(g)代替天冬酰胺(n);vi.在所述变体中对应于seqidno:3的位置67的位置处丙氨酸(a)代替谷氨酸(e);vii.在所述变体中对应于seqidno:3的位置68的位置处天冬酰胺(n)代替谷氨酰胺(q)。来自以上选项i.至vii.的至少一种修饰通常选自选项i.至v。本发明的多肽可以包含氨基酸序列seqidno:4或5的变体,该变体具有i.至v的修饰中的至少两种、三种、四种或全部五种。优选地,所述变体具有所有四种修饰ii.至v.中的至少一种、两种、三种,并任选地还存在修饰i.。在特别优选的所述变体中,存在所有的修饰i.至v.。因此总而言之,本发明的多肽包含序列seqidno:4或5的变体,所述变体:(a)与seqidno:4或5至少50%同一;(b)在所述变体序列中对应于seqidno:3的位置102的位置处具有半胱氨酸(c);以及任选地(c)在所述变体序列中对应于seqidno:3的位置92、272、294和296的位置处分别具有赖氨酸(k)、组氨酸(h)、天冬氨酸(d)和天冬氨酸(d)。优选地,seqidno:4或5的所述变体:(1)在所述变体中对应于seqidno:3的位置138的位置处具有带正电荷的氨基酸,任选地其中所述带正电荷的氨基酸是精氨酸(r)或赖氨酸(k);和/或(2)在所述变体中对应于seqidno:3的位置139的位置处具有带正电荷的氨基酸,任选地其中所述带正电荷的氨基酸是精氨酸(r)或赖氨酸(k);和/或(3)不包括连续序列ddyqrnateayakevphqit;和/或(4)具有以下修饰中的至少之一:i.在所述变体中对应于seqidno:3的位置64和65的位置处亮氨酸(l)和苏氨酸(t)残基的缺失;ii.在所述变体中对应于seqidno:3的位置70的位置处苏氨酸(t)代替精氨酸(r);iii.在所述变体中对应于seqidno:3的位置71的位置处酪氨酸(y)的缺失;iv.在所述变体中对应于seqidno:3的位置72的位置处谷氨酰胺(q)代替天冬酰胺(n);v.在所述变体中对应于seqidno:3的位置73的位置处甘氨酸(g)代替天冬酰胺(n);vi.在所述变体中对应于seqidno:3的位置67的位置处丙氨酸(a)代替谷氨酸(e);vii.在所述变体中对应于seqidno:3的位置68的位置处天冬酰胺(n)代替谷氨酰胺(q)。其中(4)的至少一种修饰通常选自选项i.至v,并且其中优选地选项ii.至v.中的全部任选地还与选项i一起存在。本发明的多肽通常包含氨基酸序列seqidno:4或5的变体,该变体包括以上所列的修饰(1)至(4)中的至少一种、两种、三种或全部四种。所述变体可以包括修饰(1)至(4)中的两种或三种的任何组合。优选的变体包括修饰(1)和(2)中的至少一种以及修饰(3)。可替换地,变体可以不包括以上所列的(1)至(3)的修饰中任一种。发明人还确定了对序列seqidno:4或5的某些其他修饰,其可以被可替换地应用或除上述修饰的任何组合之外也可被应用,可以增加本发明的多肽的效价和/或者可以降低本发明的多肽被ides特异性ada的识别。因此,可替换地或除以上所列的修饰之外,本发明的多肽可以包含:(a)序列seqidno:4的变体,其中在对应于seqidno:3的位置84、93、95、97、137、140、147、150、162、165、166、171、174、205、226、237、239、243、250、251、254、255、282、288、312、315、347、349的一个或多个位置处进行取代,和/或其中对应于seqidno:3的位置36至53的连续序列被seqidno:2的位置31至48的连续序列替代(该变化可称为“seq2的s31_v48替代的d36_i53”);或者(b)序列seqidno:5的变体,其中在对应于位置77、93、95、99、140、141、147、150、162、171、174、175、176、177、206、224、237、241、242、245、246、249、253、267、280、286、310、311、313、344、345、346、347的一个或多个位置处进行取代。所述变体(a)可以包含在所列出的位置中的的全部或者所列出的位置中一个或多个的任何组合的取代,但是通常包括在这些位置中不超过十二个、十一个或十个的取代。所述变体(b)可以包括在所列出的位置中的全部或者所列出的位置中一个或多个的任何组合的取代,但通常包括在这些位置中不超过三十个的取代。取代通常用具有不同性质的另一种氨基酸来替代现有的氨基酸。例如,不带电荷的氨基酸可以被带电荷的氨基酸替代,反之亦然。处于这些位置的优选取代在下表b1和b2中使用单个字母代码而列出:表b1-变体aseqidno:4中现有的氨基酸seqidno:3中的位置优选的替代h84na93td95nk97af137iq140ea147ed150rn162er165kd166en171ya174tn205kd226nl237fn239en243kk250sq251et254ee255kn282de288ka312kh315kk347qs349n表b2-变体b表b1和b2中的每种取代在本文可以使用通过组合从左到右的每行的第一列、第二列和第三列中的条目而获得的项来提及。例如,表b1的第一行中的取代在本文中可以称为“h84n”,第二行中的取代可以被称为“a93t”,依此类推。表b1中的具体修饰“d226n”和表b2中的“d224n”旨在破坏idez和ides/z的序列中已知的细胞粘附基序,其为seqidno:3的位置224-226处的连续rgd序列。下表c1和c2总结了对生产本发明某些示例性多肽的氨基酸序列进行的修饰。表c1表c2seqidno:1至5中的每一个的氨基酸序列全长在下面再现,随后是表c1和c2中所描述的本发明的每个示例性多肽的氨基酸序列。seqidno:1mrkrcystsaavlaavtlfvlsvdrgviadsfsanqeirysevtpyhvtsvwtkgvtppanftqgedvfhapyvanqgwyditktfngkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfngeqmfdvkeaidtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfingyrlsltnhgptpvkegskdprggifdavftrgdqsklltsrhdfkeknlkeisdlikkeltegkalglshtyanvrinhvinlwgadfdsngnlkaiyvtdsdsnasigmkkyfvgvnsagkvaisakeikednigaqvlglftlstgqdswnqtnseqidno:2dsfsanqeirysevtpyhvtsvwtkgvtppanftqgedvfhapyvanqgwyditktfngkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfngeqmfdvkeaidtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfingyrlsltnhgptpvkegskdprggifdavftrgdqsklltsrhdfkeknlkeisdlikkeltegkalglshtyanvrinhvinlwgadfdsngnlkaiyvtdsdsnasigmkkyfvgvnsagkvaisakeikednigaqvlglftlstgqdswnqtnseqidno:3mktiaypnkphslsaglltaiaifslassnityaddyqrnateayakevphqitsvwtkgvtpltpeqfrynnedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:4ddyqrnateayakevphqitsvwtkgvtpltpeqfrynnedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:5ddyqrnateayakevphqitsvwtkgvtpltpeqfrynnedvfhapyvanqgwyditkafdgkdnllcgaatagnmlhwwfdqnkdqikryleehpekqkinfngdnmfdvkkaidtknhqldsklfnyfkekafpglsarrigvfpdhvidmfingyrlsltnhgptpvkegskdprggifdavftrgnqsklltsrhdfknknlndistiikqeltkgkalglshtyanvsinhvinlwgadfnaegnleaiyvtdsdsnasigmkkyfvgvnahghvaisakkiegenigaqvlglftlstgqdswqklsseqidno:6(pcart197)ddyqrnateayakevphqitsvwtkgvtpltpeqfrynnedvihapylanqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifrnqelfdlkeairtkdsqtnsqlfeyfrdkafpylsarqlgvmpdlvldmfingyylnvfktqstdvkrpyqdkdkrggifdavftrgnqttlltarhdlknkglndistiikeeltkgralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginkhghvaisakkiegenigaqvlglftlssgkdiwqklnseqidno:7(pcart198)ddyqrnateayakevphqitsvwtkgvtpltpeqfrynnedvihapylahqgwyditktfngkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnneelfdlkaaidtkdsqtnsqlfnyfkekafpnlstrqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgnqttlltarhdfkekglkdistiikqeltegralalshtyanvsishvinlwgadfdaegnlkaiyvtdsdanasigmkkyfvginahgkvaisakkiegenigaqvlglftlssgkdiwqqlsseqidno:8(pcart200)dsfsanqeirysevtpyhvtsvwtkgvtpltpeqfrynnedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:9(pcart201)svwtkgvtpltpeqfrynnedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:10(pcart202)ddyqrnateayakevphqitsvwtkgvtpltpeqftqgedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:11(pcart203)ddyqrnateayakevphqitsvwtkgvtppeqftqgedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:12(pcart204)ddyqrnateayakevphqitsvwtkgvtppeqfrynnedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:13(pcart206)ddyqrnateayakevphqitsvwtkgvtppeqftqgedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiiinnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:14(pcart207)ddyqrnateayakevphqitsvwtkgvtppeqftqgedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifrnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:15(pcart208)ddyqrnateayakevphqitsvwtkgvtppeqftqgedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiiirnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:16(pcart210)ddyqrnateayakevphqitsvwtkgvtppeqftqgedvihapylanqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifrnqelfdlkeairtkdsqtnsqlfeyfrdkafpylsarqlgvmpdlvldmfingyylnvfktqstdvkrpyqdkdkrggifdavftrgnqttlltarhdlknkglndistiikeeltkgralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginkhghvaisakkiegenigaqvlglftlssgkdiwqklnseqidno:17(pcart217)svwtkgvtppeqftqgedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifrnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgnqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:18(pcart219)ddyqrnateayakevphqitsvwtkgvtppeqftqgedvihapylahqgwyditkafdgadnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifrnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgnqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:19(pcart226)svwtkgvtppeqftqgedvihapylahqgwyditkafdgadnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifrnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgnqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:20(pcart229)ddyqrnateayakevphqitsvwtkgvtppeqftqgedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifrnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgnqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsseqidno:21(pcarti91)ddyqrnateayakevphqitsvwtkgvtpltpeqftqgedvfhapyvanqgwyditkafdgkdnllcgaatagnmlhwwfdqnkdqikryleehpekqkinfngenmfdvkkaidtknhqldsklfnyfkekafpylsakhlgvfpdhvidmfingyrlsltnhgptpvkegskdprggifdavftrgnqsklltsrhdfknknlndistiikqeltkgkalglshtyanvrinhvinlwgadfnaegnleaiyvtdsdsnasigmkkyfvgvnahghvaisakkiegenigaqvlglftlstgqdswqklsseqidno:22(pcart192)ddyqrnateayakevphqitsvwtkgvtpltpeqftqgedvfhapyvanqgwyditkafdgkdnllcgaatagnmlhwwfdqnkdqikryleehpekqkinfrgenmfdvkeairtknhqldsklfeyfkekafpylsakhlgvfpdhvidmfingyrlsltnhgptpvkkgskdprggifdavftrgnqsklltsrhdfknknlndistiikseltngkalglshtyanvrinhvinlwgadfnaegnleaiyvtdsdsnasigmkkyfvgvnkhghvaisakkiegenigaqvlglftlstgqdswqklnseqidno:23(pcarti93)ddyqrnateayakevphqitsvwtkgvtpltpeqftqgedvfhapyvanqgwyditktfngkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfngeqmfdvkeaidtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfingyrlsltnhgptpvkegskdprggifdavftrgnqsklltsrhdfkeknlkeisdlikqeltegkalglshtyanvrinhvinlwgadfdaegnlkaiyvtdsdsnasigmkkyfvgvnaagkvaisakkiegenigaqvlglftlstgqdswnqtsseqidno:24(pcart194)ddyqrnateayakevphqitsvwtkgvtpltpeqftqgedvfhapyvanqgwyditktfngkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfrgeqmfdvkeairtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfingyrlsltnhgptpvkkgskdprggifdavftrgnqsklltsrhdfkeknlkeisdlikeeltkgkalglshtyanvrinhvinlwgadfdaegnlkaiyvtdsdsnasigmkkyfvgvnkagkvaisakkiegenigaqvlglftlstgqdswnqtnseqidno:25(pcart205)ddyqrnateayakevphqitsvwtkgvtppeqftqgedvihapyvanqgwyditkafdgkdnllcgaatagnmlhwwfdqnkdqikryleehpekqkinfrgeqmfdvkkaidtknhqldsklfnyfkekafpglsarrigvfpdhvidmfingyrlsltnhgptpvkegskdprggifdavftrgnqsklltsrhdfknknlndistiikqeltkgkalglshtyanvsinhvinlwgadfnaegnleaiyvtdsdsnasigmkkyfvgvnahghvaisakkiegenigaqvlglftlstgqdswqkls本发明的多肽可以包含seqidno:6至25中任一者的序列,主要由seqidno:6至25中任一者的序列组成或由其组成。seqidno:6至25中的每一个可以任选地包括在n末端的附加的甲硫氨酸和/或在c末端的组氨酸标签。组氨酸标签优选地由六个组氨酸残基组成。组氨酸标签优选地通过3×甘氨酸或5×甘氨酸残基的接头连接到c末端。多肽的生产本文公开的多肽可以通过任何合适的手段生产。例如,多肽可以使用本领域已知的标准技术(诸如fmoc固相化学、boc固相化学法或通过溶液相肽合成法)直接合成。可替换地,多肽可以通过用编码所述多肽的核酸分子或载体来转化细胞(通常为细菌细胞)来产生。在细菌宿主细胞中通过表达产生多肽在下面描述并在实施例中举例说明。本发明提供了编码本发明的多肽的核酸分子和载体。本发明还提供了包含这种核酸或载体的宿主细胞。提供了作为seqidno:33至55的编码本文公开的多肽的示例性多核苷酸分子。这些序列中的每一个包括在3′端的n末端甲硫氨酸的密码子(atg),以及在5′端的终止密码子(taa)之前,包括3×糖接头和6×组氨酸标签的密码子,其可任选地被排除。术语“核酸分子”和“多核苷酸”在本文中可互换使用,并且是指任何长度的核苷酸的聚合形式,要么是脱氧核糖核苷酸或核糖核苷酸,要么是它们的类似物。多核苷酸的非限制性实例包括基因、基因片段、信使rna(mrna)、cdna、重组多核苷酸、质粒、载体、任何序列的已分离的dna、任何序列的已分离的rna、核酸探针和引物。本发明的多核苷酸可以以分离的或基本上分离的形式提供。所谓基本上分离,这意味着多肽与任何周围介质的分离可能是基本的但不是全部的。多核苷酸可以与不干扰其预期用途的载体或稀释剂混合,并仍然被认为是基本上分离的。“编码”所选择的多肽的核酸序列是当被置于适当调节序列的控制下时(例如在表达载体中)被转录(在dna的情况下)和被翻译(在mrna的情况下)成多肽的核酸分子。编码序列的界限由处于5′(氨基)末端的起始密码子和处于3′(羧基)末端的翻译终止密码子而确定。出于本发明的目的,这样的核酸序列可以包括但不限于来自病毒的、原核的或真核的mrna的cdna,来自病毒的或者原核的dna或rna的基因组序列,以及甚至合成的dna序列。转录终止序列可以位于编码序列的3′。多核苷酸可以按照本领域众所周知的方法合成,如通过举例在sambrook等人(1989,molecularcloning-alaboratorymanual;coldspringharborpress)中所描述的。本发明的核酸分子可以以表达盒的形式提供,表达盒包括与所插入的序列可操作地连接的控制序列,从而允许活体内表达本发明的多肽。这些表达盒进而通常在载体(例如,质粒或重组病毒载体)内提供。这样的表达盒可以直接施用于宿主受试者。可替换地,可将包含本发明多核苷酸的载体施用于宿主受试者。优选地,使用遗传载体制备和/或施用多核苷酸。合适的载体可以是能够携带足够量的遗传信息并允许表达本发明的多肽的任何载体。因此,本发明包括包含这样的多核苷酸序列的表达载体。这样的表达载体在分子生物学领域中被常规构建,并且可以例如涉及使用质粒dna和适当的启始子(initiator)、启动子、增强子和可能是必需的并且位于正确的方向的其他元件,诸如例如聚腺苷酸化信号,以允许表达本发明的肽。其他合适的载体对于本领域技术人员是显而易见的。这方面的另一举例,我们参考sambrook等人。本发明还包括已被修饰以表达本发明的多肽的细胞。这样的细胞通常包括原核细胞(诸如细菌细胞),例如大肠杆菌。可以使用常规方法培养这样的细胞以产生本发明的多肽。可以将多肽衍生或修饰以帮助其生产、分离或纯化。例如,当通过在细菌宿主细胞中重组表达来产生本发明的多肽时,多肽的序列可以包括在n末端的附加的甲硫氨酸(m)残基以提高表达。作为另一实例,本发明的多肽可以通过加入能够直接并特异性结合到分离手段的配体来进行衍生或修饰。可替换地,多肽可以通过加入结合对的一个成员来进行衍生或修饰,并且分离手段包括通过加入结合对的另一成员来进行衍生或修饰的试剂。可以使用任何合适的结合对。在用于本发明的多肽通过加入结合对的一个成员来进行衍生或修饰的优选实施方式中,多肽优选为组氨酸标签的或生物素标签的。典型地,在基因水平上包括组氨酸或生物素标签的氨基酸编码序列,并且多肽在大肠杆菌中重组表达。组氨酸或生物素标签通常存在于多肽的任一端,优选地存在于c末端。它可以直接连接到多肽,或者通过任何合适的接头序列(诸如3个、4个或5个甘氨酸残基)间接连接。组氨酸标签通常由六个组氨酸残基组成,尽管它可以比此更长,通常高达7个、8个、9个、10个或20个氨基酸或者更短,例如5个、4个、3个、2个或1个氨基酸。多肽的氨基酸序列可以被修饰为包括非天然存在的氨基酸,例如以增加稳定性。当通过合成方法产生多肽时,可以在生产过程中引入这些氨基酸。多肽还可以在合成或重组生产后进行修饰。还可以使用d-氨基酸产生多肽。在这些情况下,氨基酸将以c至n方向相反的顺序被连接。这在生产此类多肽的技术中是常规的。许多侧链修饰是本领域已知的,并且可以对所述多肽的侧链做出,使多肽保留本文可能指定的任何进一步所需的活性或特性。还将理解,多肽可以被化学修饰,例如翻译后修饰。例如,它们可以被糖基化、磷酸化或包含修饰的氨基酸残基。多肽可以被聚乙二醇化。本发明的多肽可以是基本上分离的形式。它可以与不会干扰预期用途的载体(carrier)或稀释剂(如下所述的)混合,并仍然被认为是基本上分离的。它还可以是基本上纯化的形式,在这种情况下,它在制品中将通常包含至少90%,例如至少95%、98%或99%的蛋白质。包含多肽的组合物和制剂另一方面,本发明提供包含本发明的多肽的组合物。例如,本发明提供包含本发明的一种或多种多肽和至少一种药学上可接受的载体或稀释剂的组合物。在与组合物的其他成分相容的意义上,一种或多种载体必须是“可接受的”,并且对施用组合物的受试者无害。通常,载体和最终组合物是无菌的和无热原的。合适的组合物的配制可以使用标准的药物制剂化学和方法学来进行,所有这些对于相当熟练的技术人员来说都是容易获得的。例如,试剂可以与一种或多种药学上可接受的赋形剂或媒介物组合。辅助物质(诸如润湿剂或乳化剂)、ph缓冲物质、还原剂等可以存在于赋形剂或媒介物中。合适的还原剂包括半胱氨酸、硫代甘油、硫代内酯素、谷胱甘肽等。赋形剂、媒介物和辅助物质通常是在接受组合物的个体中不诱导免疫应答的药用剂,并且其可以被施用而没有不适当的毒性。药学上可接受的赋形剂包括但不限于液体(诸如水)、盐水、聚乙二醇、透明质酸、甘油、硫代甘油和乙醇。其中还可以包括药学上可接受的盐,例如,无机酸盐诸如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;和有机酸盐,诸如乙酸盐、丙酸盐、丙二酸盐、苯甲酸盐等。在remington′spharmaceuticalsciences(mackpub.co.,n.j.1991)中获得药学上可接受的赋形剂、媒介物和辅助物质的详细讨论。这样的组合物可以以适于推注施用(bolusadministration)或连续施用的形式制备、包装或出售。可注射组合物可以以单位剂型制备、包装或销售,诸如在含有防腐剂的安瓿或多剂量容器中。组合物包括但不限于悬浮液、溶液、在油性或水性媒介物中的乳剂、糊剂和可植入的缓释或可生物降解制剂。这样的组合物还可以包含一种或多种另外的成分,包括但不限于悬浮剂、稳定剂或分散剂。在用于肠胃外施用的组合物的一个实施方式中,活性成分以干燥(例如,粉末或颗粒)形式提供,用于以合适的媒介物(例如,无菌无热原的水)复原,之后肠胃外施用已复原的组合物。组合物可以以无菌可注射的水性或油性悬浮液或溶液的形式制备、包装或销售。这种悬浮液或溶液可以根据已知技术配制,并且除了活性成分之外,还可以包含另外的成分,诸如本文所述的分散剂、润湿剂或悬浮剂。例如可以使用无毒性肠胃外可接受的稀释剂或溶剂(诸如水或1,3-丁二醇)来制备这种无菌可注射制剂。其他可接受的稀释剂和溶剂包括但不限于林格氏溶液、等渗氯化钠溶液和固定油(诸如合成的单甘油酯或二甘油酯)。有用的其他肠胃外施用的组合物包括那些包括以微晶形式、在脂质体制品中或作为可生物降解聚合物体系的组分的活性成分的组合物。用于持续释放或植入的组合物可以包含药学上可接受的聚合性或疏水性材料,诸如乳液、离子交换树脂、微溶性聚合物或微溶盐。组合物可以适合于通过任何合适的途径施用,包括例如皮内、皮下、经皮、肌内、动脉内、腹膜内、关节内、骨内或其他合适的施用途径。优选的组合物适于通过静脉输注施用。多肽的使用方法本发明提供了本发明的多肽在各种方法中的用途。例如,本发明的多肽可为生物技术提供有用的工具。该多肽可用于igg(特别是人igg)的特异性活体外切割。在这种方法中,可以在允许发生特异性半胱氨酸蛋白酶活性的条件下将多肽与含有igg的样品一起孵育。可以验证特异性切割,并使用任何合适的方法(诸如在wo2003051914和wo2009033670中描述的那些方法)分离切割产物。因此,该方法可以特别用于产生fc和f(ab′)2片段。然后可以通过在用本发明的多肽切割igg所产生的f(ab′)2片段上进行还原步骤(例如在2-巯基乙醇胺或半胱胺中)来制备fab片段。该方法还可用于检测或分析样品中的igg或从样品中除去igg。用于检测样品中igg的方法通常包括在允许igg特异性结合和切割的条件下将多肽与样品一起孵育。igg的存在可以通过检测特异性igg切割产物来验证,其可以随后被分析。根据本发明的多肽还可以用于治疗或预防。在治疗应用中,将多肽或组合物以足以治愈、减轻或部分阻止病症或其一种或多种症状的量施用于已经患有疾患或病症的受试者。这种治疗性疗法可能导致疾病症状的严重程度降低,或者无症状期的频率或持续时间的增加的疾病。足以实现此目的的量被定义为“治疗有效量”。在预防性应用中,将多肽或组合物以足以预防或延缓症状的发展的量施用于尚未表现出疾患或病症的症状的受试者。这样的量被定义为“预防有效量”。通过任何合适的手段受试者可能被确定为有发展疾病或病症的风险。因此,本发明还提供了用在人或动物体的治疗中的本发明的多肽。本文还提供了预防或治疗受试者的疾病或病症的方法,该方法包括以预防或治疗有效量向受试者施用本发明的多肽。多肽可与免疫抑制剂共同施用。多肽优选通过静脉输注施用,但可以通过任何合适的途径施用,包括例如皮内、皮下、经皮、肌内、动脉内、腹膜内、关节内、骨内或其他合适的施用途径。施用的所述多肽的量可以在0.01mg/kgbw至2mg/kgbw之间,在0.04至2mg/kgbw之间,在0.12mg/kgbw至2mg/kgbw之间,优选地在0.24mg/kg至2mg之间/kgbw,以及最优选地在1mg/kg至2mg/kgbw之间。多肽可以多次施用于同一受试者,条件是受试者血清中能够结合于多肽的ada的数量不超过临床医生所确定的阈值。受试者血清中能够结合于多肽的ada的数量可以通过任何合适的方法确定,诸如试剂特异性capfeia(immunocap)测试或滴度测定。本发明的多肽可特别用于治疗或预防由致病性igg抗体介导的疾病或病症。因此,本发明提供了用于治疗或预防由致病性igg抗体介导的疾病或病症的本发明的多肽。本发明还提供了治疗或预防由致病性igg抗体介导的疾病或病症的方法,包括向个体施用本发明的多肽。该方法可以包括重复施用所述多肽。本发明还提供了用于在制造用于治疗或预防由致病性igg抗体介导的疾病或病症(特别是全部或部分由致病性igg抗体介导的自身免疫性疾病)的药物中的应用的本发明的多肽。致病性抗体通常可以对抗原是特异性的,在全部或部分由抗体介导的自身免疫性疾病中靶向该抗原。表d列出了这些疾病和相关抗原的列表。本发明的多肽可用于治疗这些疾病或病症中的任何一种。该多肽对于治疗或预防全部或部分由致病性igg抗体介导的自身免疫性疾病特别有效。表d在另一实施方式中,本发明的多肽可用在改善治疗或治疗剂对受试者的益处的方法中。该方法包括两个步骤,其在本文中被称为步骤(a)和步骤(b)。步骤(a)包括向受试者施用本发明的多肽。所施用的多肽的量优选足以切割存在于受试者血浆中的基本上所有的igg分子。步骤(b)包括随后向受试者施用所述治疗或治疗剂。通过时间间隔将步骤(a)和(b)分隔,该时间间隔优选足以发生切割存在于受试者血浆中的基本上所有的igg分子。所述间隔通常可以是至少30分钟和最多21天。益处得到改善的治疗剂通常是用于治疗癌症或其他疾病而被施用的抗体。治疗剂可以是ivig。在本实施方式的情况下,本发明可以替代地描述为提供用于治疗受试者中的癌症或其他疾病的方法,该方法包括(a)向受试者施用本发明的多肽;以及(b)随后向受试者施用治疗有效量的作为用于所述癌症或所述其他疾病的治疗的抗体;其中:-所施用的所述多肽的量足以切割存在于受试者血浆中的基本上所有的igg分子;以及-通过至少2小时和最多21天的时间间隔将步骤(a)和步骤(b)分隔。换言之,本发明还提供了用于在这种方法中用于治疗癌症或其他疾病的用途的多肽。本发明还提供了该试剂在制造用于通过这种方法治疗癌症或其他疾病的药物中的用途。癌症可能是急性淋巴细胞白血病,急性骨髓性白血病,肾上腺皮质癌,艾滋病相关癌症,艾滋病相关淋巴瘤,肛门癌,阑尾癌,儿童小脑或大脑星形细胞瘤,基底细胞癌,肝外胆管癌,膀胱癌,骨癌,骨肉瘤/恶性纤维组织细胞瘤,脑干神经胶质瘤(glioma),脑癌,脑肿瘤(小脑星形细胞瘤),脑肿瘤(脑星形细胞瘤/恶性神经胶质瘤),脑肿瘤(室管膜瘤),脑肿瘤(成神经管细胞瘤),脑肿瘤(幕上原始神经外胚层肿瘤),脑肿瘤(视觉通路和下丘脑神经胶质瘤),乳腺癌,支气管腺瘤/类癌,伯基特淋巴瘤(burkittlymphoma),类癌肿瘤,胃肠道类癌肿瘤,未知原发癌,中枢神经系统淋巴瘤,小脑星形细胞瘤,大脑星形细胞瘤/恶性神经胶质瘤,宫颈癌,慢性淋巴细胞性白血病,慢性骨髓性白血病慢性骨髓增生性疾病,结肠癌,皮肤t细胞淋巴瘤,促结缔组织增生性小圆细胞瘤,子宫内膜癌,室管膜瘤,食管癌,尤文氏肿瘤家族中的尤文氏肉瘤,儿童颅外生殖细胞瘤,性腺外生殖细胞瘤,肝外胆管癌,眼癌(眼内黑色素瘤),眼癌(视网膜母细胞瘤),胆囊癌,胃的(胃)癌,胃肠癌类肿瘤,胃肠道间质瘤(gist),生殖细胞肿瘤(颅外的、性腺外的或卵巢的),妊娠滋养细胞肿瘤,脑干神经胶质瘤,神经胶质瘤,儿童大脑星形细胞瘤,儿童视觉通路和下丘脑神经胶质瘤,胃类癌,毛细胞白血病,头颈癌,心脏癌,肝细胞(肝)癌,霍奇金淋巴瘤,下咽癌,下丘脑和视觉通路胶质瘤,眼内黑色素瘤,胰岛细胞癌(内分泌胰腺),卡波西肉瘤,肾癌(肾细胞癌),喉癌,白血病,急性淋巴母细胞性白血病(也称为急性淋巴细胞性白血病),急性髓细胞白血病(也称为急性骨髓性白血病),慢性淋巴细胞白血病(也称为慢性淋巴细胞性白血病),慢性骨髓细胞性白血病(也称为慢性骨髓性白血病),毛细胞白血病,唇和口腔癌,脂肪肉瘤,肝癌(原发性),非小细胞肺癌,小细胞肺癌,淋巴瘤,艾滋病相关的淋巴瘤,伯基特淋巴瘤,皮肤t细胞淋巴瘤,霍奇金淋巴瘤,非霍奇金淋巴瘤(除了霍奇金的所有淋巴瘤的旧分类),原发性中枢神经系统淋巴瘤,巨球蛋白血症,华氏巨球蛋白血症,骨的恶性纤维性组织细胞瘤/骨肉瘤,成神经管细胞瘤,黑色素瘤,眼内(眼)黑色素瘤,merkel细胞癌,成人恶性间皮瘤,间皮瘤,转移性鳞状细胞颈癌伴隐匿原发灶(metastaticsquamousneckcancerwithoccultprimary),口癌(mouthcancer),多发性内分泌肿瘤综合征,多发性骨髓瘤/浆细胞肿瘤,蕈样肉芽肿,骨髓增生异常综合征,骨髓增生异常/骨髓增生性疾病,慢性骨髓性白血病,成人急性骨髓性白血病,儿童急性骨髓性白血病,骨髓瘤,多发(骨髓癌)骨髓增生性疾病,鼻腔和鼻旁窦癌,鼻咽癌,神经母细胞瘤,非霍奇金淋巴瘤,非小细胞肺癌,口腔癌(oralcancer),口咽癌,骨肉瘤/骨骼恶性纤维组织细胞瘤,卵巢癌,卵巢上皮癌(表面上皮间质肿瘤),卵巢生殖细胞瘤,卵巢低度恶性潜能肿瘤,胰腺癌,胰腺癌(胰岛细胞),鼻旁窦和鼻腔癌,甲状旁腺癌,阴茎癌,咽癌,嗜铬细胞瘤,松果体星形细胞瘤,松果体生殖细胞瘤,成松果体细胞瘤和幕上原始神经外胚层肿瘤,垂体腺瘤,血浆细胞瘤形成/多发性骨髓瘤,胸膜肺母细胞瘤,原发性中枢神经系统淋巴瘤,前列腺癌,直肠癌,肾细胞癌(肾癌),肾盂和输尿管移行细胞癌,视网膜母细胞瘤,横纹肌肉瘤,唾液腺癌,肉瘤,尤文氏家族肿瘤,卡波西肉瘤,软组织肉瘤,子宫肉瘤,塞泽里综合征,皮肤癌(非黑色素瘤),皮肤癌(黑色素瘤),皮肤癌(默克尔细胞),小细胞肺癌,小肠癌,软组织肉瘤,鳞状细胞癌,转移性鳞状细胞颈癌伴隐匿原发灶,胃癌,幕上原始神经外胚层肿瘤,t细胞淋巴瘤,皮肤的癌症-见蕈样肉芽肿和塞泽里综合征,睾丸癌,喉癌,胸腺瘤,胸腺瘤和胸腺癌,甲状腺癌,甲状腺癌,肾盂和输尿管移行细胞癌,滋养细胞肿瘤,输尿管和肾盂移行细胞癌,尿道癌,子宫癌(子宫内膜),子宫肉瘤,阴道癌,视觉通路和下丘脑神经胶质瘤,外阴癌,华氏巨球蛋白血症和肾母细胞瘤(肾癌)。癌症优选为前列腺癌、乳腺癌、膀胱癌、结肠癌、直肠癌、胰腺癌、卵巢癌、肺痛、子宫颈癌、子宫内膜癌、肾(肾细胞)痛、食管癌、甲状腺癌、皮肤癌、淋巴瘤、黑色素瘤或白血病。步骤(b)中施用的抗体优选地对与一种或多种以上癌症类型相关的肿瘤抗原是特异性的。用于该方法的抗体的感兴趣的靶包括cd2、cd3、cd19、cd20、cd22、cd25、cd30、cd32、cd33、cd40、cd52、cd54、cd56、cd64、cd70、cd74、cd79、cd80、cd86、cd105、cd138、cd174、cd205、cd227、cd326、cd340、muc16、gpnmb、psma、cripto、ed-b、tmeff2、epha2、ephb2、fap、av整联蛋白、间皮素、egfr、tag-72、gd2、ca1x、5t4、α4β7整联蛋白、her2。其他靶是细胞因子(诸如白介素il-i至il-13),肿瘤坏死因子α&β,干扰素α、β和γ,肿瘤生长因子β(tgf-β),集落刺激因子(csf)和粒细胞单核细胞集落刺激因子(gmcsf)。参见humancytokines:handbookforbasic&clinicalresearch(aggrawal等人编辑,blackwellscientific,boston,ma,1991)。其他靶是激素、酶以及细胞内和细胞间信使(诸如腺苷酸环化酶、鸟苷酸环化酶和磷脂酶c)。其他感兴趣的靶是白细胞抗原,诸如cd20和cd33。药物也可能是感兴趣的靶。靶分子可以是人类的、哺乳动物的或细菌的。其他靶是来自微生物病原体(病毒和细菌二者)以及肿瘤的抗原,诸如蛋白质、糖蛋白和碳水化合物。u.s.4,366,241中还描述了其他靶。可以将抗体直接地或间接地接附到细胞毒性部分或接附到可检测标记。使用本领域已知的各种方法中的一种或多种通过一种或多种施用途径可以施用抗体。施用的途径和/或方式将根据期望的结果而变化。针对抗体的优选施用途径包括静脉内、肌内、皮内、腹膜内、皮下、脊髓或其他肠胃外施用途径,例如通过注射或输注。本文所用的短语“肠胃外施用”是指通常通过注射而不是肠内施用和局部外用(topicaladministration)的施用方式。可替换地,抗体可以通过非肠胃外途径施用,诸如局部外用、表皮或粘膜施用途径。局部施用(localadministration)也是优选的,包括肿瘤周围、接近肿瘤(juxtatumoral)、肿瘤内、病灶内、病灶周围、腔内灌注(intracavityinfusion)、囊内(intravesicle)施用和吸入。本发明的抗体的合适剂量可由熟练的医生确定。可以改变抗体的实际剂量水平,以获得对特定患者、组合物和施用方式实现所期望的治疗响应有效而对患者无毒的活性成分的量。所选择的剂量水平将取决于多种药代动力学因素,包括所采用的特定抗体的活性,施用途径,施用时间,抗体排泄速率,治疗持续时间,与所采用的特定组合物组合使用的其他药物、化合物和/或材料,所治疗患者的年龄、性别、体重、病症、一般健康状况和先前病史等医学领域众所周知的因素。抗体的合适剂量可以是例如在待治疗患者的约0.1μg/kg至约100mg/kg体重的范围内。例如,合适的剂量可以是每天约1μg/kg至约10mg/kg体重或每天约10μg/kg至约5mg/kg体重。可以调节剂量方案以提供最佳期望的响应(例如,治疗响应)。例如,可以施用单次推注,或者该方法的步骤(b)可以包括随时间施用的几个分开的剂量,或者可以根据治疗情况的紧急程度所指示的按比例减少或增加剂量,只要不超过步骤(a)和步骤(b)之间所需的间隔。以便于剂量的施用和均匀性的剂量单位形式配制肠胃外组合物是特别有利的。本文所用的剂量单位形式是指适合作为待治疗受试者的单位剂量的物理上离散的单位;每个单位含有与所需药物载体相关联的被计算以产生所需治疗效果的预定量的活性化合物。步骤(b)的抗体可以与化疗或放射治疗组合施用。该方法可以进一步包括施用额外的抗癌抗体或其他治疗剂,其可以作为组合治疗的一部分与步骤(b)的抗体一起在单一组合物中或在单独的组合物中施用。例如,步骤(b)的抗体可以在其他药剂之前、之后或同时施用。抗体可以是阿巴伏单抗(abagovomab)、阿昔单抗(abciximab)、actoxumab(阿克托虚单抗)、阿达木单抗(adalimumab)、阿德木单抗(adecatumumab)、阿非莫单抗(afelimomab)、阿夫土珠单抗(afutuzumab)、培化阿珠单抗(alacizumabpegol)、ald518、阿仑单抗(alemtuzumab)、阿利库单抗(alirocumab)、喷替酸阿妥莫单抗(altumomabpentetate)、阿麦妥昔单抗(amatuximab)、麻安莫单抗(anatumomabmafenaox)、安芦珠单抗(anrukinzumab)、阿泊珠单抗(apolizumab)、阿西莫单抗(arcitumomab)、阿塞珠单抗(aselizumab)、阿替奴单抗(atinumab)、阿利珠单抗(atlizumab)(=托珠单抗(tocilizumab))、阿托木单抗(atorolimumab)、巴匹珠单抗(bapineuzumab)、巴利昔单抗(basiliximab)、巴土昔单抗(bavituximab)、贝妥莫单抗(bectumomab)、贝利木单抗(belimumab)、benralizumab(贝瑞伐单抗)、柏替莫单抗(bertilimumab)、贝索单抗(besilesomab)、贝伐单抗(bevacizumab)、bezlotoxumab(贝兹罗图单抗)、比西单抗(biciromab)、bimagrumab(比麦芦单抗)、比伐单抗默坦辛(bivatuzumabmertansine)、兰妥莫单抗(blinatumomab)、骨硬化素单抗(blosozumab)、本妥西单抗维多汀(brentuximabvedotin)、briakinumab(布雷奴单抗)、布罗达单抗(brodalumab)、卡那单抗(canakinumab)、美坎珠单抗默坦辛(cantuzumabmertansine)、坎妥珠单抗拉夫坦辛(cantuzumabravtansine)、卡普拉西珠单抗(caplacizumab)、卡罗单抗喷地肽(capromabpendetide)、carlumab(卡鲁单抗)、卡妥索单抗(catumaxomab)、cc49、西利珠单抗(cedelizumab)、培舍珠单抗(certolizumabpegol)、西妥昔单抗(cetuximab)、ch.14.18(chimerichuman/murineanti-gangliosideg(d2)monoclonalantibody,嵌合人/鼠抗神经节苷脂g(d2)单抗)、泊西他珠单抗(citatuzumabbogatox)、西妥木单抗(cixutumumab)、clazakizumab(克拉扎珠单抗)、克立昔单抗(clenoliximab)、clivatuzumabtetraxetan(克立瓦妥珠单抗特他坦)、可那木单抗(conatumumab)、扣西珠单抗(concizumab)、克雷内珠单抗(crenezumab)、cr6261、达西妥珠单抗(dacetuzumab)、达克珠单抗(daclizumab)、达洛妥珠单抗(dalotuzumab)、达拉妥木单抗(daratumumab)、德美西珠单抗(demcizumab)、地诺单抗(denosumab)、地莫单抗(detumomab)、阿托度单抗(dorlimomabaritox)、卓齐妥单抗(drozitumab)、度利戈妥单抗(duligotumab)、度匹鲁单抗(dupilumab)、度斯吉妥单抗(dusigitumab)、依美昔单抗(ecromeximab)、艾库组单抗(eculizumab)、埃巴单抗(edobacomab)、依决洛单抗(edrecolomab)、依法珠单抗(efalizumab)、依夫单抗(efungumab)、依洛妥珠单抗(elotuzumab)、艾西莫单抗(elsilimomab)、依纳伐妥珠单抗(enavatuzumab)、培戈赖莫单抗(enlimomabpegol)、依诺珠单抗(enokizumab)、依诺替库单抗(enoticumab)、恩西妥昔西单抗(ensituximab)、西-依匹妥莫单抗(epitumomabcituxetan)、依帕珠单抗(epratuzumab)、厄利珠单抗(erlizumab)、厄马索单抗(ertumaxomab)、埃达珠单抗(etaracizumab)、依托珠单抗(etrolizumab)、依伏罗库单抗(evolocumab)、艾韦单抗(exbivirumab)、法索单抗(fanolesomab)、法拉莫单抗(faralimomab)、法勒珠单抗(farletuzumab)、法西奴单抗(fasinumab)、fbta05、非维珠单抗(felvizumab)、非扎奴单抗(fezakinumab)、芬克拉妥珠单抗(ficlatuzumab)、芬妥木单抗(figitumumab)、弗拉伏妥单抗(flanvotumab)、芳妥珠单抗(fontolizumab)、佛拉鲁单抗(foralumab)、佛拉韦芦单抗(foravirumab)、夫苏木单抗(fresolimumab)、弗拉奴单抗(fulranumab)、弗妥昔单抗(futuximab)、加利昔单抗(galiximab)、甘尼妥单抗(ganitumab)、甘特芦单抗(gantenerumab)、加韦莫单抗(gavilimomab)、吉妥珠单抗奥佐米星(gemtuzumabozogamicin)、吉沃珠单抗(gevokizumab)、吉瑞妥昔单抗(girentuximab)、格列姆巴妥木单抗维多汀(glembatumumabvedotin)、戈利木单抗(golimumab)、戈米昔单抗(gomiliximab)、gs6624、伊巴珠单抗(ibalizumab)、伊莫单抗替坦(ibritumomabtiuxetan)、伊克芦库单抗(icrucumab)、伊戈伏单抗(igovomab)、英西单抗(imciromab)、英加妥珠单抗(imgatuzumab)、英克勒库单抗(inclacumab)、英达妥昔单抗拉夫坦辛(indatuximabravtansine)、英利昔单抗(infliximab)、英妥木单抗(intetumumab)、伊诺莫单抗(inolimomab)、伊珠单抗奥佐米星(inotuzumabozogamicin)、伊匹木单抗(ipilimumab)、伊妥木单抗(iratumumab)、伊托珠单抗(itolizumab)、伊克塞珠单抗(ixekizumab)、凯利昔单抗(keliximab)、拉贝珠单抗(labetuzumab)、兰帕珠单抗(lampalizumab)、来金珠单抗(lebrikizumab)、来马索单抗(lemalesomab)、乐地单抗(lerdelimumab)、来沙木单抗(lexatumumab)、利韦单抗(libivirumab)、利格珠单抗(ligelizumab)、林妥珠单抗(lintuzumab)、利利单抗(lirilumab)、罗戴西珠单抗(lodelcizumab)、罗伏妥珠单抗默坦辛(lorvotuzumabmertansine)、鲁卡妥木单抗(lucatumumab)、鲁米昔单抗(lumiliximab)、马帕妥木单抗(mapatumumab)、马司莫单抗(maslimomab)、马利木单抗(mavrilimumab)、马妥珠单抗(matuzumab)、美泊利单抗(mepolizumab)、美替木单抗(metelimumab)、米拉珠单抗(milatuzumab)、明瑞莫单抗(minretumomab)、米妥莫单抗(mitumomab)、莫加木珠单抗(mogamulizumab)、莫罗木单抗(morolimumab)、莫他珠单抗(motavizumab)、莫西妥莫单抗假单胞菌外毒素(moxetumomabpasudotox)、莫罗单抗-cd3(muromonab-cd3)、他那可单抗(nacolomabtafenatox)、那米鲁单抗(namilumab)、他那莫单抗(naptumomabestafenatox)、纳那妥单抗(narnatumab)、那他珠单抗(natalizumab)、奈巴库单抗(nebacumab)、奈昔木单抗(necitumumab)、奈瑞莫单抗(nerelimomab)、耐斯伐库单抗(nesvacumab)、尼妥珠单抗(nimotuzumab)、尼伏鲁单抗(nivolumab)、诺莫单抗默喷坦(nofetumomabmerpentan)、阿托珠(obinutuzumab)、奥卡拉妥珠单抗(ocaratuzumab)、奥瑞珠单抗(ocrelizumab)、奥度莫单抗(odulimomab)、奥法木单抗(ofatumumab)、奥拉妥单抗(olaratumab)、奥洛珠单抗(olokizumab)、奥马珠单抗(omalizumab)、奥纳妥珠单抗(onartuzumab)、莫奥珠单抗(oportuzumabmonatox)、奥戈伏单抗(oregovomab)、奥替库单抗(orticumab)、奥特利昔珠单抗(otelixizumab)、奥昔鲁单抗(oxelumab)、奥扎尼珠单抗(ozanezumab)、奥左拉珠单抗(ozoralizumab)、帕吉巴昔单抗(pagibaximab)、帕利珠单抗(palivizumab)、帕木单抗(panitumumab)、帕诺库单抗(panobacumab)、巴萨妥珠单抗(parsatuzumab)、帕考珠单抗(pascolizumab)、帕特克珠单抗(pateclizumab)、帕曲妥单抗(patritumab)、培妥莫单抗(pemtumomab)、培拉珠单抗(perakizumab)、培妥珠单抗(pertuzumab)、培克珠单抗(pexelizumab)、皮地珠单抗(pidilizumab)、皮那妥珠单抗维多汀(pinatuzumabvedotin)、平妥莫单抗(pintumomab)、普拉库鲁单抗(placulumab)、泊拉妥珠单抗维多汀(polatuzimabvedotin)、泊尼珠单抗(ponezumab)、普立昔单抗(priliximab)、普立托昔单抗(pritoxaximab)、普立妥木单抗(pritumumab)、pro140、奎利珠单抗(quilizumab)、雷妥莫单抗(racotumomab)、雷得妥单抗(radretumab)、雷韦单抗(rafivirumab)、雷莫芦单抗(ramucirumab)、雷珠单抗(ranibizumab)、雷西库单抗(raxibacumab)、瑞加韦单抗(regavirumab)、瑞利珠单抗(reslizumab)、利妥木单抗(rilotumumab)、利妥昔单抗(rituximab)、罗妥木单抗(robatumumab)、罗度单抗(roledumab)、罗莫索珠单抗(romosozumab)、罗利珠单抗(rontalizumab)、罗维珠单抗(rovelizumab)、鲁利珠单抗(ruplizumab)、沙马珠单抗(samalizumab)、沙里鲁单抗(sarilumab)、沙妥莫单抗喷地肽(satumomabpendetide)、司库奴单抗(secukinumab)、司里班妥单抗(seribantumab)、司托昔抗(setoxaximab)、司韦单抗(sevirumab)、西罗珠单抗(sibrotuzumab)、西法木单抗(sifalimumab)、西妥昔单抗(siltuximab)、西妥珠单抗(simtuzumab)、西利珠单抗(siplizumab)、西芦库单抗(sirukumab)、索兰珠单抗(solanezumab)、索利托单抗(solitomab)、索耐珠单抗(sonepcizumab)、松妥珠单抗(sontuzumab)、司他木鲁单抗(stamulumab)、硫索单抗(sulesomab)、苏韦珠单抗(suvizumab)、他巴鲁单抗(tabalumab)、他卡妥珠单抗(tacatuzumabtetraxetan)、他度珠单抗(tadocizumab)、他利珠单抗(talizumab)、他尼珠单抗(tanezumab)、帕他莫单抗(taplitumomabpaptox)、替非珠单抗(tefibazumab)、阿替莫单抗(telimomabaritox)、替妥莫单抗(tenatumomab)、替奈昔单抗(teneliximab)、替利珠单抗(teplizumab)、替妥木单抗(teprotumumab)、tgn1412、替昔木单抗(ticilimumab)(=曲美木单抗(tremelimumab))、替拉珠单抗(tildrakizumab)、替加珠单抗(tigatuzumab)、tnx-650、托珠单抗(tocilizumab)(=阿利珠单抗(atlizumab))、托拉珠单抗(toralizumab)、托西莫单抗(tositumomab)、特拉罗奴单抗(tralokinumab)、曲妥珠单抗(trastuzumab)、trbs07、曲加珠单抗(tregalizumab)、曲美木单抗(tremelimumab)、妥可妥珠单抗西莫白介素(tucotuzumabcelmoleukin)、妥韦单抗(tuvirumab)、优利妥昔单抗(ublituximab)、优瑞鲁单抗(urelumab)、优托珠单抗(urtoxazumab)、优特克单抗(ustekinumab)、伐利昔单抗(vapaliximab)、伐特珠单抗(vatelizumab)、维多珠单抗(vedolizumab)、维妥珠单抗(veltuzumab)、维帕莫单抗(vepalimomab)、维森库单抗(vesencumab)、维西珠单抗(visilizumab)、伏洛昔单抗(volociximab)、伏司妥珠单抗马佛多汀(vorsetuzumabmafodotin)、伏妥昔单抗(votumumab)、扎芦木单抗(zalutumumab)、扎木单抗(zanolimumab)、扎妥昔单抗(zatuximab)、齐拉木单抗(ziralimumab)或阿左莫单抗(zolimomabaritox)。优选的抗体包括那他珠单抗(natalizumab)、维多珠单抗(vedolizumab)、贝利木单抗(belimumab)、阿塞西普(atacicept)、阿法赛特(alefacept)、奥特利昔珠单抗(otelixizumab)、替利珠单抗(teplizumab)、利妥昔单抗(rituximab)、奥法木单抗(ofatumumab)、奥瑞珠单抗(ocrelizumab)、依帕珠单抗(epratuzumab)、阿仑单抗(alemtuzumab)、阿巴西普(abatacept)、依库丽单抗(eculizamab)、奥马珠单抗(omalizumab)、卡那单抗(canakinumab)、美泊利单抗(meplizumab)、瑞利珠单抗(reslizumab)、托珠单抗(tocilizumab)、优特克单抗(ustekinumab)、briakinumab(布拉吉单抗)、依那西普(etanercept)、英夫利西单抗(inlfliximab)、阿达木单抗(adalimumab)、培舍珠单抗(certolizumabpegol)、戈利木单抗(golimumab)、曲妥珠单抗(trastuzumab)、吉妥珠单抗(gemtuzumab)、奥佐米星(ozogamicin)、伊莫单抗(ibritumomab)、替坦(tiuxetan)、tostitumomab(托西替莫单抗)、西妥昔单抗(cetuximab)、贝伐单抗(bevacizumab)、帕木单抗(panitumumab)、地诺单抗(denosumab)、伊匹木单抗(ipilimumab)、本妥西单抗(brentuximab)和维多汀(vedotin)。益处得到改善的治疗通常是器官移植。器官可以选自肾脏、肝脏、心脏、胰腺、肺或小肠。待治疗的受试者可以优选地被致敏或高度被致敏。“被致敏”是指受试者已经发展出针对人类主要组织相容性(mhc)抗原(也称为人白细胞抗原(hla))的抗体。抗hla抗体源自于异源致敏的b细胞,并通常存在于以前通过输血、先前移植或怀孕而已致敏的患者中(jordan等人,2003)。潜在的移植受体是否被致敏可以通过任何合适的方法来确定。例如,可以使用群体反应性抗体(pra)测试来确定受体是否被致敏。pra得分>30%通常被认为是指患者是“高度免疫学风险”或“被致敏”。可替换地,可以进行交叉匹配测试,其中将潜在移植供体的血液样品与预期受体的血液样品混合。正交叉匹配意味着受体具有与供体样品起反应的抗体,表明受体被致敏并且不应该发生移植。交叉匹配测试通常在马上移植前作为最后检查而进行。由于急性抗体介导的排斥的风险,针对潜在供体的mhc抗原的高滴度抗体(即供体特异性抗体(dsa))的存在是对移植的直接禁忌症。简而言之,对供体mhc抗原的致敏化阻碍了合适供体的识别。正交叉匹配测试是移植的明确障碍。由于等待肾移植的患者的大约三分之一患者被致敏,同时多达15%的患者高度被致敏,这导致等待移植的患者的积累。在美国,2001-2002年期间肾移植等候名单上的中位数时间对于群体反应性抗体(pra)得分为0-9%的那些为1329天,对于pra为10-79%的那些为1920天,以及对于pra为80%或以上的那些为3649天(optn数据库,2011)。对克服dsa障碍的一种被接受的策略是应用血浆置换或免疫吸附,其通常与例如静脉注射γ-球蛋白(ivig)或利妥昔单抗组合,以将dsa的水平降低到可以考虑移植的水平(jordan等人,2004;montgomery等人,2000;vo等人,2008a;vo等人,2008b)。然而,血浆置换、免疫吸附和ivig治疗由于它们涉及长时间的重复治疗而具有效率低下和需要严格的规划的缺点。当来自死亡供体的器官变得可用时,必须在几小时内移植,因为长时间的冷缺血时间是肾移植术中延迟移植物功能和同种异体移植物丢失(allograftloss)的最重要的危险因素之一(ojo等人,1997)。相比之下,本发明的方法允许在潜在的移植受体中快速、短时间和安全地去除dsa。在就要移植前施用本发明的多肽具有使高度被致敏的患者有效脱敏的能力,从而允许移植并避免急性抗体介导的排斥。在移植前单一剂量的多肽将使成千上万个具有供体特异性igg抗体的患者的移植成为可能。在该实施方式的情况中,该方法可以替代地描述为一种用于治疗受试者的器官衰竭的方法,该方法包括(a)向受试者施用本发明的多肽以及(b)随后将替换器官移植到该受试者中;其中:-所施用的所述多肽的量足以切割存在于受试者血浆中的基本上所有igg分子;以及-通过至少2小时和最多21天的时间间隔将步骤(a)和(b)分隔。换言之,该实施方式可以被描述为一种用于防止受试者中移植器官的排斥(特别是急性抗体介导的移植排斥)的方法,该方法包括在器官移植前至少2小时和最多21天向受试者施用本发明的多肽,其中施用的所述多肽的量足以切割存在于受试者血浆中的基本上所有igg分子。本发明还提供了本发明的多肽在此种治疗器官衰竭或预防移植排斥(特别是急性抗体介导的移植排斥)的方法中的用途。本发明还提供了本发明的多肽在制造通过这种方法来治疗器官衰竭或预防移植排斥的药物中的用途。在该实施方式中,本发明的方法可另外包括在移植时或紧接在移植之前进行的步骤,该步骤包括患者中的t细胞和/或b细胞的诱导抑制。所述诱导抑制通常可包括施用有效量的杀死或抑制t细胞的剂,和/或施用有效量的杀死或抑制b细胞的试剂。杀死或抑制t细胞的剂包括莫罗单抗(muromonab)、巴利昔单抗、达克珠单抗、抗胸腺细胞球蛋白(atg)抗体和淋巴细胞免疫球蛋白、抗胸腺细胞球蛋白制品(atgam)。已知利妥昔单抗杀死或抑制b细胞。实施例除非另有说明,否则所用的方法是标准生物化学和分子生物学技术。合适的方法教科书的实例包括sambrook等人,molecularcloning(分子克隆),alaboratorymanual(实验室手册)(1989)和ausubel等人,currentprotocolsinmolecularbiology(现代分子生物学)(1995),johnwileyandsons,inc.(约翰·威利父子公司)。实施例1-多肽的设计、生产和纯化分析成熟的ides分子,并识别适合突变的区域。在某些情况下,使用计算机评估(insilicoassessment)来估计突变的可能结果。已经决定在每个多肽的序列上,编码每个多肽的cdna是在genecust,卢森堡依照所引入的突变数来确定通过起始序列的定点突变或通过合成而产生。对cdna进行测序,并框内转移到具有c末端6×组氨酸标签的pet9a表达载体(novagene),该6×组氨酸标签通过短的甘氨酸接头(3×甘氨酸)连接到c末端。加入n末端甲硫氨酸以改善细菌表达。将质粒转化(热休克)到大肠杆菌bl21(de3)(stratagene)中并接种在含有30μg/ml卡那霉素的lb琼脂糖平板上。挑取单个菌落,并在37℃、250rpm下开始过夜培养(3mllb-培养基)。第二天制备甘油储备液,并用过夜培养物接种补充有30μg/ml卡那霉素和防沫剂的10mltb-培养基并生长至od0.6-0.8(37℃,300rpm)。此时,加入iptg(1mm),并继续培养1小时,之后通过离心收获细菌。将沉淀物在pbs中洗涤并在-20℃冷冻。使用细菌裂解的冻融方案(每次在1mlpbs中三次冷冻/融化循环),并使用ni-nta预包装的旋转柱(pierce)纯化蛋白质。纯化后,洗脱的蛋白质用10mmdtt激活,之后更换缓冲液(在mwco9kmilliporecfg设计中为3体积的pbs)。使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)无污染的12%的tgxtm预制凝胶(biorad)sds-page来评价每种蛋白质的纯度和稳定性。下表总结了每个测试的多肽相对于成熟的idez或ides/z的变化,不包括n末端甲硫氨酸和组氨酸标签。因此,本文所述实验中使用的每种多肽的序列通常包含表中所指示的seqidno的序列,加上额外的n末端甲硫氨酸和通过短的甘氨酸接头连接到c末端的组氨酸标签。作为对照,使用如上所述的相同的方法生产了ides、idez和ides/z的变型(version)。这些变型在本文中分别称为pcart124、pcart144和pcart145。pcart124包含序列seqidno:2的加上额外的n末端甲硫氨酸和通过短的甘氨酸接头连接到c末端的组氨酸标签。以下提供了pcart124的序列:mdsfsanqeirysevtpyhvtsvwtkgvtppanftqgedvfhapyvanqgwyditktfngkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfngeqmfdvkeaidtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfingyrlsltnhgptpvkegskdprggifdavftrgdqsklltsrhdfkeknlkeisdlikkeltegkalglshtyanvrinhvinlwgadfdsngnlkaiyvtdsdsnasigmkkyfvgvnsagkvaisakeikednigaqvlglftlstgqdswnqtnggghhhhhh(seqidno:26)pcart144包含seqidno:4的序列加上额外的n末端甲硫氨酸和通过短的甘氨酸接头连接到c末端的组氨酸标签。以下提供了pcart144的序列:mddyqrnateayakevphqitsvwtkgvtpltpeqfrynnedvihapylahqgwyditkafdgkdnllcgaatagnmlhwwfdqnkteieaylskhpekqkiifnnqelfdlkaaidtkdsqtnsqlfnyfrdkafpnlsarqlgvmpdlvldmfingyylnvfktqstdvnrpyqdkdkrggifdavftrgdqttlltarhdlknkglndistiikqeltegralalshtyanvsishvinlwgadfnaegnleaiyvtdsdanasigmkkyfvginahghvaisakkiegenigaqvlglftlssgkdiwqklsggghhhhhh(seqidno:27)pcart145包含seqidno:5的序列加上额外的n末端甲硫氨酸和通过短的甘氨酸接头连接到c末端的组氨酸标签。以下提供了pcart145的序列:mddyqrnateayakevphqitsvwtkgvtpltpeqfrynnedvfhapyvanqgwyditkafdgkdnllcgaatagnmlhwwfdqnkdqikryleehpekqkinfngdnmfdvkkaidtknhqldsklfnyfkekafpglsarrigvfpdhvidmfingyrlsltnhgptpvkegskdprggifdavftrgnqsklltsrhdfknknlndistiikqeltkgkalglshtyanvsinhvinlwgadfnaegnleaiyvtdsdsnasigmkkyfvgvnahghvaisakkiegenigaqvlglftlstgqdswqklsggghhhhhh(seqidno:28)使用自动多步色谱纯化还独立地生产缺乏标签的ides至gmp标准,用作另外的对照。该多肽在本文中称为bx1001865。以下提供了用于生产每种测试的多肽以及pcart124、pcart144和pcart145的cdna序列。每个cdna序列包括在3′端的用于n末端甲硫氨酸的密码子(atg)和在5′端的终止密码子(taa)之前用于甘氨酸接头和组氨酸标签的密码子。pcart124(ides;seqidno:33)atggatagtttttctgctaatcaagagattagatattcggaagtaacaccttatcacgttacttccgtttggaccaaaggagttactcctccagcaaacttcactcaaggtgaagatgtttttcacgctccttatgttgctaaccaaggatggtatgatattaccaaaacattcaatggaaaagacgatcttctttgcggggctgccacagcagggaatatgcttcactggtggttcgatcaaaacaaagaccaaattaaacgttatttggaagagcatccagaaaagcaaaaaataaacttcaatggcgaacagatgtttgacgtaaaagaagctatcgacactaaaaaccaccagctagatagtaaattatttgaatattttaaagaaaaagctttcccttatctatctactaaacacctaggagttttccctgatcatgtaattgatatgttcattaacggctaccgccttagtctaactaaccacggtccaacgccagtaaaagaaggtagtaaagatccccgaggtggtatttttgacgccgtatttacaagaggtgatcaaagtaagctattgacaagtcgtcatgattttaaagaaaaaaatctcaaagaaatcagtgatctcattaagaaagagttaaccgaaggcaaggctctaggcctatcacacacctacgctaacgtacgcatcaaccatgttataaacctgtggggagctgactttgattctaacgggaaccttaaagctatttatgtaacagactctgatagtaatgcatctattggtatgaagaaatactttgttggtgttaattccgctggaaaagtagctatttctgctaaagaaataaaagaagataatataggtgctcaagtactagggttatttacactttcaacagggcaagatagttggaatcagaccaatggcggtggccatcatcaccatcaccactaapcart144(idez;seqidno:34)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccactaacacccgagcagtttcgatataataacgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttaacaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggagatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart145(ides/z;seqidno:35)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttcgctataacaacgaagatgtgtttcatgcgccgtatgtggcgaaccagggctggtatgatattaccaaagcgtttgatggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaagatcagattaaacgctatctggaagaacatccggaaaaacagaaaattaactttaacggcgataacatgtttgatgtgaaaaaagcgattgataccaaaaaccatcagctggatagcaaactgtttaactattttaaagaaaaagcgtttccgggcctgagcgcgcgccgcattggcgtgtttccggatcatgtgattgatatgtttattaacggctatcgcctgagcctgaccaaccatggcccgaccccggtgaaagaaggcagcaaagatccgcgcggcggcatttttgatgcggtgtttacccgcggcaaccagagcaaactgctgaccagccgccatgattttaaaaacaaaaacctgaacgatattagcaccattattaaacaggaactgaccaaaggcaaagcgctgggcctgagccatacctatgcgaacgtgagcattaaccatgtgattaacctgtggggcgcggattttaacgcggaaggcaacctggaagcgatttatgtgaccgatagcgatagcaacgcgagcattggcatgaaaaaatattttgtgggcgtgaacgcgcatggccatgtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcaccggccaggatagctggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart197(seqidno:36)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttcgctataacaacgaagatgtgattcatgcgccgtatctggcgaaccagggctggtatgatattaccaaagcgtttgatggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaaaccgaaattgaagcgtatctgagcaaacatccggaaaaacagaaaattatttttcgcaaccaggaactgtttgatctgaaagaagcgattcgcaccaaagatagccagaccaacagccagctgtttgaatattttcgcgataaagcgtttccgtatctgagcgcgcgccagctgggcgtgatgccggatctggtgctggatatgtttattaacggctattatctgaacgtgtttaaaacccagagcaccgatgtgaaacgcccgtatcaggataaagataaacgcggcggcatttttgatgcggtgtttacccgcggcaaccagaccaccctgctgaccgcgcgccatgatctgaaaaacaaaggcctgaacgatattagcaccattattaaagaagaactgaccaaaggccgcgcgctggcgctgagccatacctatgcgaacgtgagcattagccatgtgattaacctgtggggcgcggattttaacgcggaaggcaacctggaagcgatttatgtgaccgatagcgatgcgaacgcgagcattggcatgaaaaaatattttgtgggcattaacaaacatggccatgtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcagcggcaaagatatttggcagaaactgaacggcggtggccatcatcaccatcaccactaapcart198(seqidno:37)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttcgctataacaacgaagatgtgattcatgcgccgtatctggcgcatcagggctggtatgatattaccaaaacctttaacggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaaaccgaaattgaagcgtatctgagcaaacatccggaaaaacagaaaattatttttaacaacgaagaactgtttgatctgaaagcggcgattgataccaaagatagccagaccaacagccagctgtttaactattttaaagaaaaagcgtttccgaacctgagcacccgccagctgggcgtgatgccggatctggtgctggatatgtttattaacggctattatctgaacgtgtttaaaacccagagcaccgatgtgaaccgcccgtatcaggataaagataaacgcggcggcatttttgatgcggtgtttacccgcggcaaccagaccaccctgctgaccgcgcgccatgattttaaagaaaaaggcctgaaagatattagcaccattattaaacaggaactgaccgaaggccgcgcgctggcgctgagccatacctatgcgaacgtgagcattagccatgtgattaacctgtggggcgcggattttgatgcggaaggcaacctgaaagcgatttatgtgaccgatagcgatgcgaacgcgagcattggcatgaaaaaatattttgtgggcattaacgcgcatggcaaagtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcagcggcaaagatatttggcagcagctgagcggcggtggccatcatcaccatcaccactaapcart200(seqidno:38)atggatagctttagcgcgaaccaggaaattcgctatagcgaagtgaccccgtatcatgtgaccagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttcgctataacaacgaagatgtgattcatgcgccgtatctggcgcatcagggctggtatgatattaccaaagcgtttgatggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaaaccgaaattgaagcgtatctgagcaaacatccggaaaaacagaaaattatttttaacaaccaggaactgtttgatctgaaagcggcgattgataccaaagatagccagaccaacagccagctgtttaactattttcgcgataaagcgtttccgaacctgagcgcgcgccagctgggcgtgatgccggatctggtgctggatatgtttattaacggctattatctgaacgtgtttaaaacccagagcaccgatgtgaaccgcccgtatcaggataaagataaacgcggcggcatttttgatgcggtgtttacccgcggcgatcagaccaccctgctgaccgcgcgccatgatctgaaaaacaaaggcctgaacgatattagcaccattattaaacaggaactgaccgaaggccgcgcgctggcgctgagccatacctatgcgaacgtgagcattagccatgtgattaacctgtggggcgcggattttaacgcggaaggcaacctggaagcgatttatgtgaccgatagcgatgcgaacgcgagcattggcatgaaaaaatattttgtgggcattaacgcgcatggccatgtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcagcggcaaagatatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart201(seqidno:39)atgagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttcgctataacaacgaagatgtgattcatgcgccgtatctggcgcatcagggctggtatgatattaccaaagcgtttgatggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaaaccgaaattgaagcgtatctgagcaaacatccggaaaaacagaaaattatttttaacaaccaggaactgtttgatctgaaagcggcgattgataccaaagatagccagaccaacagccagctgtttaactattttcgcgataaagcgtttccgaacctgagcgcgcgccagctgggcgtgatgccggatctggtgctggatatgtttattaacggctattatctgaacgtgtttaaaacccagagcaccgatgtgaaccgcccgtatcaggataaagataaacgcggcggcatttttgatgcggtgtttacccgcggcgatcagaccaccctgctgaccgcgcgccatgatctgaaaaacaaaggcctgaacgatattagcaccattattaaacaggaactgaccgaaggccgcgcgctggcgctgagccatacctatgcgaacgtgagcattagccatgtgattaacctgtggggcgcggattttaacgcggaaggcaacctggaagcgatttatgtgaccgatagcgatgcgaacgcgagcattggcatgaaaaaatattttgtgggcattaacgcgcatggccatgtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcagcggcaaagatatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart202(seqidno:40)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccactaacacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttaacaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggagatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart203(seqidno:41)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttaacaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggagatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart204(seqidno:42)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccacccgagcagtttcgatataataacgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttaacaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggagatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart206(seqidno:43)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcattattaacaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggagatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart207(seqidno:44)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttcgtaaccaagagctatttgatttgaaacctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggagatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart208(seqidno:45)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcattattcgtaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggagatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart210(seqidno:46)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgccggaacagtttactcaaggtgaagatgtgattcatgcgccgtatctggcgaaccagggctggtatgatattaccaaagcgtttgatggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaaaccgaaattgaagcgtatctgagcaaacatccggaaaaacagaaaattatttttcgcaaccaggaactgtttgatctgaaagaagcgattcgcaccaaagatagccagaccaacagccagctgtttgaatattttcgcgataaagcgtttccgtatctgagcgcgcgccagctgggcgtgatgccggatctggtgctggatatgtttattaacggctattatctgaacgtgtttaaaacccagagcaccgatgtgaaacgcccgtatcaggataaagataaacgcggcggcatttttgatgcggtgtttacccgcggcaaccagaccaccctgctgaccgcgcgccatgatctgaaaaacaaaggcctgaacgatattagcaccattattaaagaagaactgaccaaaggccgcgcgctggcgctgagccatacctatgcgaacgtgagcattagccatgtgattaacctgtggggcgcggattttaacgcggaaggcaacctggaagcgatttatgtgaccgatagcgatgcgaacgcgagcattggcatgaaaaaatattttgtgggcattaacaaacatggccatgtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgttaccctgagcagcggcaaagatatttggcagaaactgaacggcggtggccatcatcaccatcaccactaapcart217(seqidno:47)atgtctgtatggaccaaaggtgttacaccacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttcgtaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggaaaccagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart219(seqidno:48)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatggggcggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttcgtaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggaaatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart226(seqidno:49)atgtctgtatggaccaaaggtgttacaccacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatggggcggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttcgtaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggaaatcagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart229(seqidno:50)atggacgattaccaaaggaatgctacggaagcttatgccaaagaagtaccacatcagatcacttctgtatggaccaaaggtgttacaccacccgagcagtttactcaaggtgaagatgtgatccatgcgccatatcttgctcatcaaggctggtacgatatcaccaaggccttcgatgggaaggataatctcttgtgtggcgcagcaacggcaggtaatatgctgcattggtggtttgatcaaaataaaacagagattgaagcctatttaagtaaacaccctgaaaagcaaaaaatcatttttcgtaaccaagagctatttgatttgaaagctgctatcgataccaaggacagtcaaaccaatagtcagctttttaattattttagagataaagcctttccaaatctatcagcacgtcaactcggggttatgcctgatcttgttctagatatgtttatcaatggttactacttaaatgtgtttaaaacacagtctactgatgtcaatcgaccttatcaggacaaggacaaacgaggtggtattttcgatgctgttttcaccagaggaaaccagacaacgctcttgacagctcgtcatgatttaaaaaataaaggactaaatgacatcagcaccattatcaagcaagaactgactgaaggaagagcccttgctttatcacatacctacgccaatgttagcattagccatgtgattaacttgtggggagctgattttaatgctgaaggaaaccttgaggccatctatgtcacagactcagatgctaatgcgtctattggtatgaaaaaatattttgtcggcattaatgctcatggacatgtcgccatttctgccaagaaaatagaaggagaaaacattggcgctcaagtattaggcttatttacgctttccagtggcaaggacatttggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart191(seqidno:51)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttacccagggcgaagatgtgtttcatgcgccgtatgtggcgaaccagggctggtatgatattaccaaagcgtttgatggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaagatcagattaaacgctatctggaagaacatccggaaaaacagaaaattaactttaacggcgaaaacatgtttgatgtgaaaaaagcgattgataccaaaaaccatcagctggatagcaaactgtttaactattttaaagaaaaagcgtttccgtatctgagcgcgaaacatctgggcgtgtttccggatcatgtgattgatatgtttattaacggctatcgcctgagcctgaccaaccatggcccgaccccggtgaaagaaggcagcaaagatccgcgcggcggcatttttgatgcggtgtttacccgcggcaaccagagcaaactgctgaccagccgccatgattttaaaaacaaaaacctgaacgatattagcaccattattaaacaggaactgaccaaaggcaaagcgctgggcctgagccatacctatgcgaacgtgcgcattaaccatgtgattaacctgtggggcgcggattttaacgcggaaggcaacctggaagcgatttatgtgaccgatagcgatagcaacgcgagcattggcatgaaaaaatattttgtgggcgtgaacgcgcatggccatgtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcaccggccaggatagctggcagaaactgagcggcggtggccatcatcaccatcaccactaapcart192(seqidno:52)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttacccagggcgaagatgtgtttcatgcgccgtatgtggcgaaccagggctggtatgatattaccaaagcgtttgatggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaagatcagattaaacgctatctggaagaacatccggaaaaacagaaaattaactttcgcggcgaaaacatgtttgatgtgaaagaagcgattcgcaccaaaaaccatcagctggatagcaaactgtttgaatattttaaagaaaaagcgtttccgtatctgagcgcgaaacatctgggcgtgtttccggatcatgtgattgatatgtttattaacggctatcgcctgagcctgaccaaccatggcccgaccccggtgaaaaaaggcagcaaagatccgcgcggcggcatttttgatgcggtgtttacccgcggcaaccagagcaaactgctgaccagccgccatgattttaaaaacaaaaacctgaacgatattagcaccattattaaaagcgaactgaccaacggcaaagcgctgggcctgagccatacctatgcgaacgtgcgcattaaccatgtgattaacctgtggggcgcggattttaacgcggaaggcaacctggaagcgatttatgtgaccgatagcgatagcaacgcgagcattggcatgaaaaaatattttgtgggcgtgaacaaacatggccatgtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcaccggccaggatagctggcagaaactgaacggcggtggccatcatcaccatcaccactaapcart193(seqidno:53)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttacccagggcgaagatgtgtttcatgcgccgtatgtggcgaaccagggctggtatgatattaccaaaacctttaacggcaaagatgatctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaagatcagattaaacgctatctggaagaacatccggaaaaacagaaaattaactttaacggcgaacagatgtttgatgtgaaagaagcgattgataccaaaaaccatcagctggatagcaaactgtttgaatattttaaagaaaaagcgtttccgtatctgagcaccaaacatctgggcgtgtttccggatcatgtgattgatatgtttattaacggctatcgcctgagcctgaccaaccatggcccgaccccggtgaaagaaggcagcaaagatccgcgcggcggcatttttgatgcggtgtttacccgcggcaaccagagcaaactgctgaccagccgccatgattttaaagaaaaaaacctgaaagaaattagcgatctgattaaacaggaactgaccgaaggcaaagcgctgggcctgagccatacctatgcgaacgtgcgcattaaccatgtgattaacctgtggggcgcggattttgatgcggaaggcaacctgaaagcgatttatgtgaccgatagcgatagcaacgcgagcattggcatgaaaaaatattttgtgggcgtgaacgcggcgggcaaagtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcaccggccaggatagctggaaccagaccagcggcggtggccatcatcaccatcaccactaapcart194(seqidno:54)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgctgaccccggaacagtttacccagggcgaagatgtgtttcatgcgccgtatgtggcgaaccagggctggtatgatattaccaaaacctttaacggcaaagatgatctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaagatcagattaaacgctatctggaagaacatccggaaaaacagaaaattaactttcgcggcgaacagatgtttgatgtgaaagaagcgattcgcaccaaaaaccatcagctggatagcaaactgtttgaatattttaaagaaaaagcgtttccgtatctgagcaccaaacatctgggcgtgtttccggatcatgtgattgatatgtttattaacggctatcgcctgagcctgaccaaccatggcccgaccccggtgaaaaaaggcagcaaagatccgcgcggcggcatttttgatgcggtgtttacccgcggcaaccagagcaaactgctgaccagccgccatgattttaaagaaaaaaacctgaaagaaattagcgatctgattaaagaagaactgaccaaaggcaaagcgctgggcctgagccatacctatgcgaacgtgcgcattaaccatgtgattaacctgtggggcgcggattttgatgcggaaggcaacctgaaagcgatttatgtgaccgatagcgatagcaacgcgagcattggcatgaaaaaatattttgtgggcgtgaacaaagcgggcaaagtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcaccggccaggatagctggaaccagaccaacggcggtggccatcatcaccatcaccactaapcart205(seqidno:55)atggatgattatcagcgcaacgcgaccgaagcgtatgcgaaagaagtgccgcatcagattaccagcgtgtggaccaaaggcgtgaccccgccggaacagtttactcaaggtgaagatgtgattcatgcgccgtatgtggcgaaccagggctggtatgatattaccaaagcgtttgatggcaaagataacctgctgtgcggcgcggcgaccgcgggcaacatgctgcattggtggtttgatcagaacaaagatcagattaaacgctatctggaagaacatccggaaaaacagaaaattaactttcgcggcgaacagatgtttgatgtgaaaaaagcgattgataccaaaaaccatcagctggatagcaaactgtttaactattttaaagaaaaagcgtttccgggcctgagcgcgcgccgcattggcgtgtttccggatcatgtgattgatatgtttattaacggctatcgcctgagcctgaccaaccatggcccgaccccggtgaaagaaggcagcaaagatccgcgcggcggcatttttgatgcggtgtttacccgcggcaaccagagcaaactgctgaccagccgccatgattttaaaaacaaaaacctgaacgatattagcaccattattaaacaggaactgaccaaaggcaaagcgctgggcctgagccatacctatgcgaacgtgagcattaaccatgtgattaacctgtggggcgcggattttaacgcggaaggcaacctggaagcgatttatgtgaccgatagcgatagcaacgcgagcattggcatgaaaaaatattttgtgggcgtgaacgcgcatggccatgtggcgattagcgcgaaaaaaattgaaggcgaaaacattggcgcgcaggtgctgggcctgtttaccctgagcaccggccaggatagctggcagaaactgagcggcggtggccatcatcaccatcaccactaa实施例2-效价(igg切割效力)的评估elisa使用基于elisa的效价测定法来测定酶活性。elisa的原理是用抗体靶(bsa)包被多滴定板(multititreplate)的孔,然后在孔中孵育不同浓度的具有抗bsa抗体的igg半胱氨酸蛋白酶多肽(测试或对照),之后使用检测抗体检测结合于孔的抗bsa抗体的数量。孔中给定的igg半胱氨酸蛋白酶多肽的浓度越高,则就有越少的完整抗bsa多肽将要结合于孔,给出较低的信号。类似地,当以相同浓度存在时,效价更高的igg半胱氨酸蛋白酶多肽比效价更低的igg半胱氨酸蛋白酶多肽将产生更低的信号。参照物idesbx1001865是在1∶2稀释步骤中制备作为从320nm降至0.16nm的滴定系列,以允许绘制该测定的标准校准曲线。将对多种已知浓度的每种测试多肽的该测定中达到的结果针对校准曲线的线性部分进行比较,以确定达到相同效价的参照物ides的浓度。将每个多肽的已知浓度除以来自曲线的参照物ides的已确定的等同浓度,产生了作为相对于参照物idesbx1001865的效价的倍数变化的得分。例如,如果5nm测试多肽在校准曲线上达到相当于10nm参照物ides的结果,则测试多肽具有参照物idesbx10018652倍大的效价。相对于参照物idesbx1001865的效价的倍数变化的平均得分是从以不同浓度的每种测试多肽获得的所有得分计算的,只要它们落在校准曲线的线性部分内即可。然后将该平均得分与对于pcart124参照物ides获得的平均得分进行比较,pcart124参照物ides被包括在每个板上以使板之间进行比较。将pcart124的平均得分除以测试多肽的平均得分以产生“pcart124比率”,其有效地成为每种多肽相对于ides的效价的倍数变化。然后在条形图上该pcart124比率可以是可视的。简要概括实验室方案:将多滴定板(多滴度板,multititreplate)的孔用bsa(10μg/ml)包被过夜,然后用pbs-t洗涤,并用pbs中2%的鱼皮明胶封闭1小时。idesbx1001865多肽在1∶2稀释步骤中在具有0.1%明胶的pbs中制备来作为从320nm降至0.16nm的滴定系列。然后在具有0.1%明胶的pbs中,制备在15、7.5、3.75和1.9nm中的每一种的测试多肽和pcart124对照。将50μl多肽样品与作为底物的50μl的兔抗bsa(acris,#r1048p,10nm)加入到每个孔中。将板在室温下孵育1小时,然后用pbs-t洗涤。将生物素化的山羊抗兔fc特异性抗体(30000倍稀释的)作为检测抗体加入,并孵育30分钟。洗涤板,加入40000倍稀释的sa-辣根过氧化物酶(hrp;pierce)并孵育30分钟。洗涤板并使用tmbonecomponent(tmb一组分)作为hrp的显色底物显影7分钟,用0.5m的h2so4终止。在λ=450nm处测量吸光度(od)。针对每种测试多肽和针对pcart124确定相对于bx1001865的效价的倍数变化的平均得分。然后如上所述的来计算每个测试多肽的“pcart124比率”。pcart191、192、193、194、197、198、200和201的“pcart124比率”结果与pcart124的结果一起示于图1中。这里所示的本发明的所有示例性多肽获得相对于ides对照(pcart124)至少相当的效价。pcart194、197、200和201都获得高得多的效价,甚至超出pcart197和pcart201的对照高达8.0倍的提高。有趣的是,pcart200和201都涉及对n末端的修饰。此外,pcart194和197各自具有n138r/k修饰。在对应于seqidno:3的位置139的位置处改变为带正电荷的氨基酸(positiveaminoacid)预期产生与n138r/k取代相似的结果。位置138和139位于跨越seqidno:3的位置134至144的β发夹结构的环中。根据本文所获得的结果,位置138和139中的任一者或两者中改变为带正电荷的氨基酸预期增加igg半胱氨酸蛋白酶活性。pcart202、203和204的结果示于图2中。特别是pcart203的效价为ides的约3.5倍。pcart202的效价为ides的1倍到1.5倍。pcart204具有与pcart144相当的效价。igg切割图案的可视化通过在sds-page上显现由不同底物中每种多肽的滴定系列所产生的切割产物,进一步评价了不同pcart多肽的效力。为了测试在纯igg底物中的效力,阿达木单抗(修美乐(humira))用于igg1并且地诺单抗(xgeva)用于igg2。为了在更复杂的生理环境中测试效力,一些多肽还在ivig(octagam)中滴定。这容许评估中和抗ides抗体对多肽活性的影响。将每个多肽的切割图案与相同底物中的ides(bx1001865和pcart124)的切割图案进行比较。方案如下:对于纯igg测试,将每个测试多肽或对照在具有0.05%bsa作为支持蛋白的pbs中以1∶3的步骤滴定系列(从6.7μg/ml降低至0.04ng/ml)稀释。将各浓度的25μl转移到多滴定板上,并通过加入25μl的修美乐或xgeva(2mg/ml)开始切割反应。因此,多肽的每个起始浓度在孔中以1∶2稀释,得到从3.3μg/ml降低至0.02ng/ml的滴定系列。对于ivig测试,将每个测试多肽或对照在具有0.05%bsa作为支持蛋白的pbs中以1∶2的步骤滴定系列(从30μg/ml降低至0.015ng/ml)稀释。将每种浓度的25μl转移至多滴定板上,并通过加入25μl的10mg/ml的ivig开始切割反应。因此,多肽的每个起始浓度在孔中以1∶2稀释,得到从15μg/ml降低至0.0075ng/ml的滴定系列。将板在37℃下孵育1.5小时。将样品在2×sds上样缓冲液中1∶4混合,并在92℃加热5分钟。将10μl上样在聚丙烯酰胺凝胶(15-孔4-20%的tgxtm预制凝胶(biorad))上,按照标准方案将其读数。图3示出了对于pcart202、203和204相比于两个ides对照(pcart124和bx1001865)和idez(pcart144),用igg1底物产生的切割图案。酶浓度以1∶3步骤稀释系列从3.33μg/ml(泳道1)降低到0.02ng/ml(泳道12)。完整的阿达木单抗(无酶)示于泳道13中。右侧的箭头表示来自igg的不同切割产物。箭头1:完整的igg;箭头2:scigg(单切割的igg-由第一igg重链切割产生);箭头3:f(ab′)2片段(由第二igg重链的切割产生)。加入垂直线以便于在第一igg重链切割处和在第二igg重链切割处的比较,其中完整的igg在第一igg重链切割处变为scigg(泳道6和7之间)以及其中scigg在第二igg重链切割处变为f(ab′)2片段(泳道2和3之间)。酶idez(pcart144)具有较低的第1和第2igg重链的切割效力。在两条重链的切割中,ides(bx1001865和pcart124)的效力为pcart144的约3倍(即一个滴定步骤)。对于ides(bx1001865和pcart124)以1.5ng/ml泳道8)的切割等于以4.6ng/ml(泳道7)的pcart144(idez)切割。bx1001865和pcart124以4.6ng/ml(泳道7)显示强烈的scigg条带(箭头2),而pcart144以该浓度(泳道7)仅具有弱的scigg条带(箭头2)。重要的是,与idez(pcart144)相比,pcart202和pcart203都显示出增加的igg切割效价(泳道7和泳道3),导致更强烈的scigg条带(箭头2)和更强烈的f(ab′)2条带(箭头3)。对于酶pcart204没有观察到增加的效力。pcart202在切割第二重链中的效力显示与ides(bx1001865和pcart124)(比较泳道3)大致相同。pcart202不如ides有效,但对于第一igg重链切割(比较泳道7)比pcart144更有效。在主要第二重链切割中酶pcart203具有比ides更高的效力,与以0.37μg/ml(泳道3)的bx1001865和pcart124(箭头3和2)相比导致更强烈的f(ab′)2条带(箭头3)和较弱的scigg条带(箭头2)。因此,总体图3示出,与pcart144(idez)相比,具有在pcart202和pcart203二者中可见的以下修饰r70t、y71del、n72q、n73g的修饰idez序列增加了第二igg重链切割的效力。此外,引入l64_t65del修饰还增加了第一重链切割的效力,见pcart203。图4示出了对于pcart202、203和204相比于两个ides对照(pcart124和bx1001865)和idez(pcart144),用ivig底物产生的切割图案。酶浓度以1∶2步骤稀释系列从30μg/ml(泳道1)降低至0.015ng/ml(泳道12)。完整的ivig(无酶)示于泳道13中,但pcart203的图像除外,其不存在该泳道。右侧的箭头表示来自igg的不同切割产物。箭头1:完整的igg;箭头2:scigg(单切割的igg-由第一igg重链切割产生);箭头3:f(ab′)2片段(由第二igg重链的切割产生)。加入垂直线以便于在第一igg重链切割处和在第二igg重链切割处的比较,其中完整的igg在第一igg重链切割处变为scigg(泳道6和7之间)以及其中scigg在第二igg重链切割处变为f(ab′)2片段(泳道2和3之间)。与ides(bx1001865和pcart124)相比,酶pcart144(idez)显示出对第一igg重链(泳道6)的切割更有效,导致更强烈的scigg条带(箭头2)和完整igg的较弱条带(箭头1)。这可能是由于中和抗ides抗体对pcart144(idez)的结合水平(相比于其对ides的识别)较低。如对pcart202、pcart203和pcart204可见的,对于所有idez衍生的酶(泳道6),第一重链切割中增加的效力是真实的。pcart202、pcart203和pcart204的0.94ng/ml浓度(泳道6)导致强烈的scigg条带(箭头2),以大部分igg被单切割,而相同浓度的ides导致小于50%的scigg(泳道6)。然而,与ides(bx1001865和pcart124)相比,pcart144(idez)在第二重链的切割中更差。这导致与ides相比来自泳道5(1.9ng/ml的酶)以及还有泳道4和3中的更强烈的scigg条带(箭头2),对于ides,切割已经以下一滴定步骤(泳道4,3.75μg/ml)继续到f(ab′)2条带(箭头3)。值得注意的是,pcart203显示出在第二切割位点(泳道2、3和4)与ides(bx1001865和pcart124)相当的能力,以及在第一切割位点(泳道7)比ides和idez(pcart144)二者更高的切割效力。酶pcart203显示以0.5ng/ml(泳道7)的igg切割,并且以约0.9ng/ml(泳道6)已主要产生scigg(箭头2)。这相当于与ides相比2倍的增加的效力,ides以0.9ng/ml(泳道6)开始切割,并以1.9ng/ml(泳道5)具有主导性scigg条带。总体图4示出,具有修饰l64_t65del、r70t、y71del、n72q和n73g的修饰性idez即使在中和ada存在的情况下也增加了对人igg的切割效力。与ides相比,这在pcart203中清楚可见。图5示出了对于pcart205、206、207、208和210相比于两个ides对照(pcart124和bx1001865)和idez(pcart144),用igg1底物产生的切割图案。酶浓度以1∶3步骤稀释系列从3.33μg/ml(泳道1)降低到0.02ng/ml(泳道12)。右侧的箭头表示来自igg的不同的切割产物。箭头1:完整的igg;箭头2:scigg(单切割的igg-由第一igg重链切割产生);箭头3:f(ab′)2片段(由第二igg重链的切割产生)。加入垂直线以便于在第一igg重链切割处和在第二igg重链切割处的比较,其中完整的igg在第一igg重链切割处变为scigg(泳道6和7之间)以及其中scigg在第二igg重链切割处变为f(ab′)2片段(泳道2和3之间)。酶pcart205显示出与pcart144(idez)相比在两个igg重链(泳道6和3)的切割上增加的能力,导致与pcart144(idez)相比(泳道6和3)更强烈的scigg条带(箭头2,泳道6)和完整igg的非常弱的条带(箭头1,泳道6)和更强烈的f(ab′)2条带(箭头3,泳道3)。然而,在该实验中没有中和ada的情况中(与图4中所示的情况相反),ides(pcart124)对纯igg1的切割活性高于pcart205。多肽pcart207和pcart210都显示出与ides(pcart124)和idez(pcart144)二者相比增加的igg切割效力(第一次切割的泳道7和第二次切割的泳道3)。与ides(pcart124)相比,最有效的酶pcart207显示了在两种igg重链的切割上大约3倍的增加效力。以14ng/ml(泳道6)获得对于pcart124的到scigg(箭头2)的完全转化,而对于pcart207,以4.6ng/ml(泳道7)已经看到单个的scigg条带(箭头2)。在第二重链的切割上可见pcart207的效力与pcart124相比更大的增加。对于以41ng/ml(泳道4)的pcart207看到比pcart124以0.37μg/ml(泳道3)显示的更强烈的f(ab′)2条带(箭头3)。pcart207和pcart210相对于idez序列共享以下修饰:l64_t65del、r70t、y71del、n72q、n73g、n138r。因此总体图5示出,这些变化增加了人igg1的切割效力。图6示出了对于pcart203、205、206、207、208和210相比于两个ides对照(pcart124和bx1001865)和idez(pcart144),用igg2底物产生的切割图案。酶浓度以1∶3步骤稀释系列从3.33μg/ml(泳道1)降低到0.02ng/ml(泳道12)。右侧的箭头表示来自igg的不同的切割产物。箭头1:完整的igg;箭头2:scigg(单切割的igg-由第一igg重链切割产生);箭头3:f(ab′)2片段(由第二igg重链的切割产生)。加入垂直线以便于在第一igg重链切割处和在第二igg重链切割处的比较,其中完整的igg在第一igg重链切割处变为scigg(泳道6和7之间)以及其中scigg在第二igg重链切割处变为f(ab′)2片段(泳道2和3之间)。与pcart144(idez)相比,酶pcart203和酶pcart207都显示出切割效力大约3倍的增加。pcart144以0.12μg/ml(泳道4)的浓度显示单一强烈的scigg条带(箭头2),相比之下,以更低的41ng/ml(泳道5)浓度的pcart203和pcart207显示主导性scigg条带(箭头2)。pcart203和pcart207在第一和第二igg重链(泳道6和泳道2)的切割效力上与ides(bx1001865和pcart124)是相当的。然而,在本实验中没有中和ada的情况中(与图4中所示的情况相反),ides(pcart124)对纯igg2的两个重链的切割活性高于pcart206、pcart208和pcart210中的每一者。这一点可以从即使以pcart206和pcart208的酶3.3μg/ml(泳道1)的最高浓度存在的单个强烈的scigg条带(箭头2)看出。衍生自ides/z杂合体(pcart145)的pcart205在纯人igg2的切割(第一切割位点的泳道5和第二切割位点的泳道2)中具有与idez(pcart144)大致相同的效力,两者都导致以0.12μg/ml(泳道4)的单个scigg条带(箭头2)和以3.3μg/ml(泳道1)的最高浓度的主导性f(ab′)2条带。总体而言,图6示出了idez的最佳修饰(即其导致在切割igg2中效力的最高增加)是在pcart203和pcart207中发现的那些修饰。这些酶与pcart207共享修饰l64_t65del、r70t、y71del、n72q、n73g,另外具有n138r修饰。图7示出了对于pcart207、208和210相比于ides对照(bx1001865),用ivig底物产生的切割图案。酶浓度以1∶2步骤稀释系列从30μg/ml(泳道1)降低至0.015ng/ml(泳道12)。完整的ivig(无酶)示于泳道13中。右侧的箭头表示来自igg的不同的切割产物。箭头1:完整的igg;箭头2:scigg(单切割的igg-由第一igg重链切割产生);箭头3:f(ab′)2片段(由第二igg重链的切割产生)。加入垂直线以便于在第一igg重链切割处和在第二igg重链切割处的比较,其中完整的igg在第一igg重链切割处变为scigg(泳道6和7之间)以及其中scigg在第二igg重链切割处变为f(ab′)2片段(泳道2和3之间)。与ides(bx1001865)相比,pcart207、pcart208和pcart210在第一igg重链的切割(泳道6)中都显示了增加的效力。ides(bx1001865)以1.9ng/ml(泳道5)的浓度已主要产生了scigg(箭头2)。对于pcart207和pcart210二者以0.9ng/ml(泳道6)以及对于pcart208以仅0.5ng/ml(泳道7)获得了相似的结果。在pcart208的情况下,这是第一重链的切割效力上大约4倍的增加。在第二重链的切割中,pcart208显示出提高的切割效力,导致以1.9ng/ml(泳道5)的主导性f(ab′)2条带(箭头3),而ides(bx1001865)以相同浓度仅产生scigg(箭头2)。总体而言,图7示出,与ides相比,pcart207、pcart208和pcart210在抗ides中和抗体(ada)存在的情况下具有对人igg切割的增加的效力。对于pcart206获得了类似的结果(数据未示出)。pcart206、207、208和210都共享以下相对于idez序列的修饰:l64_t65del、r70t、y71del、n72q和n73g。此外,pcart207、208和210还共享n138r修饰。因此,图7还证实了这些不同的修饰在中和ada存在的情况下增加了对人igg切割的效力。实施例3-免疫原性的评估竞争性抗ides抗体测定该测定是基于测试多肽与ides之间对于与抗ides抗体结合的竞争。测试酶和ivig的预孵育将使得抗ides抗体与测试的pcart酶能够结合。此后,将ivig-酶混合物加入到ides包被的板中,并且不结合测试多肽的任何抗ides抗体将反而与板上的ides结合。所有结合孵育在抑制igg切割的2mm碘乙酸(ihac)的存在下以及在使得仅发生高亲和力结合的高盐中进行。洗涤后,使用生物素化的山羊抗人f(ab′)2特异性f(ab′)2片段作为检测物。由ivig中抗ides抗体对测试多肽的差的识别将导致ivig中抗ides抗体与板的高度结合,产生高信号。由ivig中的抗ides抗体对测试多肽的良好识别将产生相反结果。详细方案如下:将参照物ides(bx1001865)在多滴定板(5μg/ml)上包被过夜,然后用pbs-t洗涤,并用在补充有2mmihac和1mnacl的pbs中的2%的bsa封闭1小时。在补充有0.1%bsa、2mmihac和1mnacl的pbs中,用逐步稀释的测试多肽和20μg/mlivig来制备混合板。将混合板在室温下于振荡器上孵育1小时。孵育后,将封闭溶液从ides包被的板中弃去,并将来自混合板的50μl每种混合物转移到已包被的板的孔中。在振荡器上于室温下孵育1小时后,用pbs-t洗涤板,并加入检测物,即生物素化的山羊抗人f(ab′)2-特异性f(ab′)2片段(20000倍稀释的)。孵育30分钟后,洗涤板,以及加入40000倍稀释的sa-hrp(pierce)并孵育30分钟。洗涤板并使用tmbonecomponent(tmb一组分)作为hrp的显色底物显影7分钟,用0.5m的h2so4终止。在λ=450nm处测量吸光度(od)。将结果求倒数(1/od值),并以与pcart124相比较的比率(1/(测试多肽/pcart124))表示以在条形图中可视化。pcart191、192、193、194、197、198、200和201的结果示于图8中。pcart202、203和204的结果示于图9中。与ides相比,所有测试的多肽显示出在抗ides抗体识别上的显著降低。显示出最少降低的多肽(pcart193)以比ides低约60%的水平被识别。剩余的测试多肽比ides低70%或甚至低80%。抗ides滴度测定该测定基于比较ivig稀释滴度。将不同的测试多肽和对照ides(bx10018865和pcart124)包被在微滴定板上。通过加入滴定量的ivig(从40至0.625μg/ml的1∶2步骤稀释系列,即以对应于1∶250降低至1∶16000稀释血清的滴度)到板中来评价抗ides抗体对测试多肽或对照的结合。稀释缓冲液是高盐浓度,因此仅发生高亲和力结合,并包括2mmihac以抑制igg切割且在高盐中使得仅发生高亲和力结合。在每个实验中设置临界od值为空白的约3倍。每个测试的多肽的记录结果是得到高于临界的最低od值(抗-ides抗体的最低结合)的ivig的稀释滴度。换言之;具有被抗ides抗体(ada)低识别的多肽需要较少稀释的ivig,并且被ada高度识别的酶需要更地多稀释的ivig。简言之,方案如下:将参照物ides和每个测试酶在多滴定板上包被过夜(2μg/ml),用pbs-t洗涤,并用在补充有2mmihac的pbs中的2%的bsa封闭1小时。弃去封闭溶液,并加入50μl的ivig的逐步稀释液(稀释缓冲液:pbs1mnacl+0.1%bsa+2mmihac),并在室温下于振荡器上孵育1小时。用pbs-t洗涤板和加入检测物即生物素化的山羊抗人f(ab′)2特异性f(ab′)2片段(20000倍稀释的),并孵育30分钟。洗涤板,以及加入40000倍稀释的sa-hrp(pierce)并孵育30分钟。洗涤板并使用tmbonecomponent(tmb一组分)作为hrp的显色底物显影7分钟,用0.5m的h2so4终止。在λ=450nm处测量吸光度(od)。pcart202、203和204的结果示于图10中。对于被抗ides抗体识别,所有三个测试多肽均得分为3倍的稀释度,比ides低。pcart205、206、207、208和210的结果示于图11中。对于被抗ides抗体识别,除了pcart206以外所有都得分为3倍的稀释度,到比ides低。pcart206得分为2倍的稀释度,低于ides。总体而言,测试的多肽比ides具有明显较低的免疫原性。概要测试多肽在切割人igg上通常比idez更有效,和/或至少与ides切割人igg一样有效,并且通常也比ides具有更低的免疫原性。实施例4-效价的评估效价elisa为了呈提(address)人igg1和igg2的切割能力,建立了两种基于elisa的效价测定。一种测量igg1切割的测定和另一种测量igg2切割的测定。对于测试的不同的igg半胱氨酸蛋白酶多肽计算了ec50(半数最大有效浓度)值。这些测定的原理是用f(ab)2片段包被多滴定板的孔,该f(ab)2片段针对对fab区具有特异性的人igg抗体。然后将滴定浓度的igg半胱氨酸蛋白酶多肽(测试或对照)与人igg1抗体(修美乐)或人igg2抗体(xgeva)在孔中一起孵育。使用针对对抗体的fc部分具有特异性的人igg的检测抗体来测量与孔结合的完整的或单切割的人igg(修美乐或xgeva)的量。在孔中给定的igg半胱氨酸蛋白酶多肽的浓度越高,则越少的完整人igg抗体将与孔结合,从而得到较低的信号。类似地,当存在相同浓度时,效价更高的igg半胱氨酸蛋白酶多肽将产生比效价更低的igg半胱氨酸蛋白酶多肽更低的信号。在igg1(修美乐)和igg2(xgeva)测定中,为ides对照(pcart124)和所有测试的igg半胱氨酸蛋白酶多肽制备了滴定剂量-响应曲线。还计算了每个测试变体的ec50值,代表观察到多肽在对igg分子的第二重链切割上最大效果的50%的浓度,即igg的一半被单切割和半数被完全切割的浓度。较低的ec50值代表更有效的igg半胱氨酸蛋白酶。由于igg的fc部分仍然存在并且可以通过fc特异性检测抗体来检测,所以在该测定中,第一igg重链的切割即igg至scigg是不可见的(图18)。实验室方案的简要概括:将多滴定板的孔用山羊抗人fab特异性f(ab)2片段(0.5μg/ml)(jackson#109-006-097)包被过夜(+2-8℃),然后用pbs+0.05%吐温20(pbs-t)洗涤,并在pbs-t(封闭缓冲液)中的0.45%鱼明胶中于室温下封闭45-120分钟。将对照ides(pcart124)和待测试的igg半胱氨酸蛋白酶多肽制备为在封闭缓冲液中具有80μg/ml的起始浓度的以1∶4稀释步骤的滴定系列。将等体积(25μl)浓度为0.5μg/ml的人igg1(修美乐)和滴定量的igg半胱氨酸蛋白酶多肽加入到孔中,并在37℃的控制温度环境下振荡孵育2小时,然后用pbs-t洗涤。将生物素化的小鼠抗人iggfc特异性(m-a-higgbioii,lot:c0013-zc43c,southernbiotech)(600ng/ml)抗体与strep-sulfo(200ng/ml)混合并加入到多滴定板中。将板用铝带密封并在+25℃下振荡孵育1小时。然后将板在pbs-t中洗涤,并向每个孔中加入150μl的2倍稀释的read缓冲液t(msd读数缓冲液t,货号r92tc-2)。立即在板读数器(读板仪,酶标仪,platereader)即msd(mesoscalediscovery)quickplexsq120model1300上对板读数。在凝胶上可视的效力测定:如实施例2中对igg1(修美乐)、igg2(xgeva)的切割以及人igg库ivig(octagam)的切割所述那样进行测定。结果效价elisa测试的igg半胱氨酸蛋白酶在效价测定中所得的剂量-响应曲线示于图12(igg1切割)和图13(igg2切割)中。与ides对照pcart124(表1)相比,在这里测试的本发明示例性多肽的pcart207、217、219在切割igg1(图12)的两个重链上均具有提高的效价(降低的ec50值),具有对于pcart219为1.4倍、对于pcart217为3.2倍以及对于pcart207为差不多4.0倍的效价倍数提高。pcart226显示出比ides(pcart124)略低的效价,具有ec50为0.6倍的差异(表1)。对于igg2的切割(图13),与原始ides(pcart124)相比,所有测试的多肽在第二igg重链的切割上显示出更低的效价,具有更高的ec50值(表1)和低于1倍的差异。然而,所有测试的多肽比pcart144(seqidno:27)(数据未显示)效价更高,pcart144(seqidno:27)是本发明的igg半胱氨酸蛋白酶多肽所衍生于的序列。在凝胶上可视的效力测定在凝胶上可视的igg1(图14a)和igg2(图14b)的切割清楚地显示了第一重链切割和第二重链切割(图中的垂直线标记了通过bx1001865和pcart124切割的第一和第二igg重链切割)。图中的*表示近似的ec50值,即其中igg的50%被单切割(scigg)且50%被完全切割(f(ab′)2)的浓度。来自凝胶的数据总结在表2(igg1切割)和表3(igg2切割)中。igg1(修美乐)的第一重链的切割对于ides(pcart124和bx1001865),pcart207和217为大约相同1.5ng/ml,但对于pcart219和226需要稍高的浓度(约为4.6)以获得显著的scigg条带(表2)。然而,对于igg1的第二重链切割pcart207、217和219都显示出比ides(pcart124和bx1001864)更高的效力(表2),在切割上为约3倍(一个滴定步骤)效力,ides为约370ng/ml和pcart207、217和219为约120ng/ml。在igg2(xgeva)的切割(图14b)上,pcart207、217、219均显示一个滴定步骤(1∶3)低的效力,并且与ides相比pcart226在第一和第二重链的切割上具有约两个滴定步骤(1∶6)低的效力(表3)。pcart229在igg1(修美乐)的第一(4.6ng/ml)和第二(370ng/ml)igg重链的切割上显示出与ides(bx1001865和pcart124)大致相同的效力(图15a和表4),而pcart229对igg2(xgeva)的切割在第一和第二igg重链切割上具有比ides低约一个滴定步骤(1∶3)的效力(图15b和表4)。还将igg半胱氨酸蛋白酶多肽pcart207、217、219和226在人igg库ivig(octagam)中滴定,用ides(bx1001865)作为对照(图16)。与ides相比,它们全部都在ivig的第一igg重链的切割上显示出更高的效力。pcart207、217、219和226全都需要0.75μg/ml以实现第一次切割,而ides(bx1001865)需要1.5μg/ml来产生scigg(图16和表5)。在第二次切割中,pcart207和217均比ides(bx1001865)更有效,用3μg/ml浓度主要产生f(ab′)2片段,而ides需要约6μg/ml(图16和表5)。与ides相比,pcart219和226在igg库ivig的第二次切割中效果较差。与图16中测试的多肽相比,用具有1∶2稀释度从30μg/ml开始的更广泛的滴定谱分析了pcart229对ivig的切割(图17)。对于ides(bx1001865和pcart124)和pcart229,可以看到相同的效力(图17),用1.9μg/ml浓度产生scigg和7.5μg/ml以得到f(ab′)2片段(表6)。实施例4的附图总结图12.由不同igg半胱氨酸蛋白酶多肽切割igg1(修美乐)的滴定曲线。图13.由不同igg半胱氨酸蛋白酶多肽切割igg2(xgeva)的滴定曲线。图14.使用滴定(1∶3稀释度从3300ng/ml开始的)量的pcart207、217、219和226与在同一切割实验中作为对照的bx1001865和pcart124(原始ides)通过sds-page分析的igg切割。a:修美乐(igg1)的切割和b:xgeva(地诺单抗)(igg2)的切割。垂直线标记了对引起第一和第二igg重链切割所需的ides(bx1001865和pcart124)浓度(其中切割产物的量超过未切割的产物占主导地位)。图中的*标记本实验中的近似ec50值。图15.使用滴定(1∶3稀释度从3300ng/ml开始的)量的pcart229与在同一切割实验中作为对照的bx1001865和pcart124(原始ides)通过sds-page分析的igg切割。a:修美乐(igg1)的切割和b:xgeva(地诺单抗)(igg2)的切割。垂直线标记了对引起第一和第二igg重链切割所需的ides(bx1001865和pcart124)浓度(其中切割产物的量超过未切割的产物占主导地位)。图16.使用滴定(1∶2稀释度从6μg/ml开始的)量的测试的igg半胱氨酸蛋白酶多肽和在同一切割实验中作为对照的ides(bx1001865)通过sds-page分析的ivig切割。图17.使用滴定量(1∶2稀释度从30μg/ml开始的)的pcart229与在同一切割实验中作为对照的bx1001865和pcart124(原始ides)通过sds-page分析的ivig切割。图18.由本发明的多肽切割免疫球蛋白的示意图。igg的酶切割分两步进行。首先,完整igg的一条重链被切割并产生单切割的igg(scigg)。其次,下一个重链被切割并且fc-部分被释放。fc部分仍然接附到scigg分子中的fab部分,并且由于效价elisa中的检测抗体识别igg分子的fc部分,所以该测定将不区分完全igg与scigg。讨论与结论修美乐效价elisa中pcart207、217、219的较低的ec50值显示在igg1的第二次切割(从scigg至f(ab′)2)上与pcart124(原始ides)相比效价提高。在修美乐效价elisa中和在通过sds-page分析的修美乐效力测定中都显示了pcart226在igg1切割上的活性略低。在xgeva效价elisa中证明,所有测试的多肽pcart207、217、219和226在igg2的两个igg重链的切割上与ides(pcart124)相比具有较低的效价。然而,当可视化凝胶上的切割时,很明显的是,pcart207在第一igg重链切割上与ides(bx1001865和pcart124)具有大致相同的活性,而在第二次切割上与ides相比,pcart207的效力低约3倍(一个滴定步骤)。对于在igg1的切割上具有高效力的pcart229可见相同的图案,其与ides的活性相当,但是对于igg2的切割具有较低效力,主要是切割第二igg重链。通过分析凝胶上的igg切割,第一重链的切割(从igg到scigg)变得明显,在使用fc特异性检测抗体的效价elisa中这种切割是不可视的。igg的大多数fc介导的作用已经在单切割的分子中丧失(数据未显示),其在主要焦点是使致病性igg分子失能的临床情况中是重要的。ivig是含有约65-70%的igg1、35-30%的igg2和共享约1%的igg3/igg4的人igg库。人ivig自然也含有来自igg供体早期暴露于化脓性链球菌的抗ides抗体,其中一些抗体将是中和性的,即这些ides特异性抗体与ides的结合将减弱或完全破坏idesigg蛋白酶活性。由不同的igg半胱氨酸蛋白酶多肽进行的ivig切割的结果因此显示了人血清中而且在中和抗ides抗体存在下以约为其正常比率的所有四种人igg亚类的总体切割。通常,与igg1相比,测试的所有igg半胱氨酸蛋白酶多肽在igg2切割上具有较低的效力。pcart207、217和219在切割igg1上比ides更有效,但在主要切割igg2的第二重链上效率较低。图16中以pcart207、217、219和226的最高剂量(6μg/ml)和在图17的pcart229中看到的scigg条带最可能代表igg库即ivig中的igg2分子(图14a与14b以及15a与15b的比较)。表1.通过效价elisa测量的ec50(ng/ml)和与原始ides(pcart124)相比效价的倍数差异。表2.凝胶上显示的igg1(修美乐)切割的数据(图14a)。实现第一次和第二次igg切割所需的多肽的浓度(ng/ml),其中切割的产物在量上超过未切割的产物而占优势。大约ec50值(在图14a中的*)。表3.凝胶上显示的igg2(xgeva)切割的数据(图14b)。实现第一次和第二次igg切割所需的多肽的浓度(ng/ml),其中切割的产物在量上超过未切割的产物而占优势。大约ec50值(在图14b中的*)。表4.通过凝胶上显示的pcart229对igg1(修美乐)切割和igg2(xgeva)的数据(图15)。实现第一次和第二次igg切割所需的多肽的浓度(ng/ml)(其中切割的产物在量上超过未切割的产物而占优势)。表5.凝胶上显示的pcart207、217、219和226对ivig切割的数据(图16)。实现第一次和第二次igg切割所需的多肽的浓度(ng/ml),其中切割的产物在量上超过未切割的产物而占优势。表6.凝胶上显示的pcart229对ivig切割的数据(图17)。实现第一次和第二次igg切割所需的多肽的浓度(ng/ml),其中切割的产物在量上超过未切割的产物而占优势。实施例5-adaelisa,即对于ada-ides结合位点的竞争性elisa。使用基于elisa、mesoscalediscovery(msd)的测定,对于本发明的“ada”修饰的多肽(pcart207、217、219和226)测量了针对ides的抗药物抗体(ada)结合位点。elisa的原理是用原始组氨酸标签的ides(pcart124)包被多滴定板的孔。由于早期的化脓性链球菌感染,大多数人在其血清中具有针对ides的抗体。这里使用两种不同的临床人血清库作为ada检测的标准品。第一个库是来自100个个人的血清库的正常人血清,称为人血清库1191807,第二个库是来自ii期研究13-hmedides-02中患者的血清库,称为ii期库-2。这些患者已经以0.24-0.5mg/kg体重的剂量范围施用ides一次,并从而在他们的血清中具有诱导水平(约50倍)的抗ideaada。该竞争性adaelisa的概述是将ides(pcart124)包被在微滴定板的底部。将人血清库与有待测试ada识别位点的多肽或与阳性对照ides(pcart124)以1∶100的摩尔比(具有测试多肽的100倍过量)一起预孵育。从标准曲线估计用于预孵育的两种不同血清库的浓度,以提供与原始ides约80%的结合。如果在所测试的多肽中ada结合位点已经被消除,则这些多肽不能与ada与孔底部的原始ides的结合相竞争,即低信号表现出与原始ides(pcart124)的强ada相似性以及高信号表现出与原始ides的弱ada相似性。在标准曲线的线性部分实现约80%结合的两种标准品的浓度为约200ngada(ides)/ml。在竞争性预孵育中,两种标准品的浓度分开使用,并且igg半胱氨酸蛋白酶多肽的浓度以ada浓度的100倍的比例使用,包括在150kda的抗体与大约35kda的idez之间的摩尔重量差异,即4.2倍,提供100乘以200ng/ml除以4.2,即提供大约5μg/ml的测试多肽。含有200ng/mlada的标准血清与ides(pcart124)或测试的多肽在室温(rt)下一起预孵育1小时。作为最大ada结合的对照,将相同浓度的标准品在没有ides(pcart124)或任何其他igg半胱氨酸蛋白酶的情况下进行预孵育并作为80%结合-最大值来使用。标准曲线的最低水平被用作竞争计算范围的下限值。将与ides(pcart124)或测试的多肽一起预孵育的标准品的平均得分减去80%标准结合值除以80%标准结合值减去下限值提供%竞争值。具有最低%竞争的igg半胱氨酸蛋白酶多肽意味着与原始ides(pcart124)相比,大多数ada结合表位已被消除。实验室方案的简要概括:多滴定板的孔用pcart124(1μg/ml)包被过夜,用pbs-t洗涤3次,并用pbs中的0.45%鱼皮明胶和2mm的半胱氨酸蛋白酶抑制剂碘化乙酸(ihac)封闭1小时。两种标准品都是在pbs中的0.45%鱼皮明胶和2mmihac中以1∶3稀释步骤作为滴定系列(从5000ngada(ides)/ml到2.5ngada(ides)/ml))来制备,以便容许绘制用于测定的标准校准曲线,并在标准曲线的线性部分以及最大和最小部分处均进行测量。在封闭板的同时,将标准品与ides(pcart124)或测试的多肽在室温(rt)下一起预孵育1小时,即使用200ng/ml的ada(标准品)和5μg/ml的ides对照(pcart124)或待测试的igg半胱氨酸蛋白酶多肽的在竞争步骤中的样品。将pcart124包被的板洗涤3次,并然后将50μl预孵育的样品或50μl标准品加入到多滴定板的每个孔中。将板在室温(rt)下孵育2小时,并然后用pbs-t洗涤。加入山羊抗人f(ab)特异性f(ab)2片段-bio(jackson#109-066-097,0.65mg/ml)(1000倍稀释的)作为检测抗体以及加入封闭缓冲液中的链霉亲和素-磺基(streptavidin-sulfo)(msd货号:r32ad-1或r32ad-5)(2000倍稀释的)在室温(rt)下于黑暗中孵育1小时。将板洗涤3次,加入4倍稀释的read缓冲液t(读数缓冲液t)(msd读数缓冲液t(4x)),并在platereader(板读数器)msd(mesoscalediscovery)quickplexsq120model1300上直接分析该板。结果与讨论pcart207、217、219和226的ides-ada结合位点的百分比(%)封闭示于图19和图20中,并且将原始idespcart124用作100%相似的阳性对照。与原始ides(pcart124)相比,所有测试的igg半胱氨酸蛋白酶多肽pcart207、217、219和226在人血清中占据较少的ada结合位点。已经用ides治疗一次的患者(ii期库-2)已经发展出更多的ides特异性ada,并且与来自健康志愿者的血清库(人血清库1191807)(图19)相比,pcart207、217和219的识别最小(图20)。实施例6-评估octagam(人ivig)小鼠模型中的活体内效力在本研究中,用人ivig(octagam)腹膜内(i.p.)注射balb/c小鼠。人ivig的浓度以900mg/kg的剂量施用,以与人igg血浆浓度(10mg/ml)相关。0天腹膜内(i.p.)注射人ivig。注射人ivig之后的24小时(第1天),将pbs、ides对照(bx1001865和pcart124)或待测试的igg蛋白酶pcart207、pcart217、pcart219和pcart226以1mg/kg的剂量静脉内(i.v.)施用。两小时后,收集血清样品,并处死小鼠。效力elisa测定的原理是用针对具有对fab区域的特异性人igg抗体的f(ab′)2片段包被多滴定板的孔。然后加入来自用ivig和ides对照(bx1001865和pcart124)或测试的igg半胱氨酸蛋白酶多肽处理的小鼠的血清。使用针对人igg(ivig)的该抗体的fc部分具有特异性的检测抗体来测量与孔结合的完整或单切割的人igg(ivig)的量。检测到的完整人igg抗体(ivig)的浓度越低,预期igg半胱氨酸蛋白酶多肽越有效。实验室方案的简要概括:将多滴定板的孔用山羊抗人fab特异性f(ab)2片段(0.5μg/ml)(jackson#109-006-097)包被过夜(+2-8℃),然后用pbs+0.05%吐温20(pbs-t)洗涤,并在pbs-t中的2%bsa(封闭缓冲液)中于rt(室温)下封闭45-120分钟。使用人血清蛋白校准品(dako#x0908)作为标准品,并以0.5-300ng/ml的范围加入。将从用ivig和不同igg半胱氨酸蛋白酶多肽处理的小鼠中取出的血清样品解冻并在封闭缓冲液中稀释100000倍,然后加入到测定多滴定板中。将板在室温(rt)下振荡孵育2小时,然后用pbs-t洗涤。将生物素化的小鼠抗人iggfc特异性(600ng/ml)(jackson#109-066-098)抗体与链霉亲和素-磺基(strep-sulfo)(200ng/ml)(msd#r32ad-1)混合并加入到多滴定板中。将板用铝带密封,并在室温(rt)下振荡孵育1小时。然后将板在pbs-t中洗涤,并向每个孔中加入150μl的2倍稀释的读数缓冲液t(msd#r92tc-2)。在板读数器msd(mesoscalediscovery)quickplexsq120model1300上直接分析该板。凝胶上可视的效力为了将小鼠中活体内的人igg切割可视化,将10μl血清在90μl的pbs中以1∶10稀释。然后将10μl稀释的血清与30μl的4倍sds-page上样缓冲液混合。使用5μl的igg内部标记(in-housemarker)来显示不同的igg片段(igg、scigg和f(ab′)2)。将样品在92℃下加热3分钟(thermomixercompact,eppendorf),并在4-20%的tgx,stain-freetm凝胶(货号456-8096,biorad)上样10μl之前将其短暂离心。凝胶在200v下跑样40分钟。结果和结论通过以效力elisa研究血清中人igg的水平以及通过以sds-page分析igg的降解来比较ides(bx1001865和pcart124)和pcart207、217、219和226对人ivig(octagam)的活体内切割。在ivig小鼠中使用ides(bx1001865和pcart124)以及不同的igg半胱氨酸蛋白酶pcart207、pcart217、pcart219和pcart226进行的处理清楚地显示了在该小鼠模型中对人igg的活体内切割(表7和图21)。对于ides对照(bx1001865),pcart207和pcart217显示了完整的切割,在凝胶上没有可视的scigg条带但有显著的f(ab′)2条带(图22)。在该小鼠模型中pcart219和pcart226显示出较低的效力,其中两小时后在小鼠血清中仍然存在scigg分子(图22c)。然而,不能在凝胶上检测到完整的ivig,表明图21中对于pcart219和pcart226而言由检测抗体识别的igg-fc的更高浓度(更高的条)来自scigg而不是完整的igg。pcart207组中的小鼠编号:2以及pcart219组中的小鼠编号:4没有接受ivig注射(图22b和图22c),因此在这些动物的凝胶上没有igg切割片段是可视的。蛋白质条带图案将代表balb/c小鼠血清中的背景蛋白质。这表明本发明的多肽在活体内模型中切割igg。表7.通过效力elisa对使用ides(bx1001865和pcart124/测试的igg半胱氨酸蛋白酶处理的小鼠的血清中人igg的活体内切割的分析(平均值±stdev(估算样本的标准偏差))。平均值(mg/ml)stdev(估算样本的标准偏差)对照(pbs)6.580.80bx10018650.300.05pcart1240.390.12pcart2070.660.03pcart2170.780.05pcart2190.990.18pcart2261.800.85当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1