微筛选装置、方法和产品与流程
相关申请本申请要求于2015年2月22日提交的第62/119,251号美国临时申请、于2015年2月25日提交的第62/120,803号美国临时申请、于2015年11月11日提交的第62/250,478号美国临时申请以及于2016年1月21日提交的第62/281,545号美国临时申请的权益,每个申请以其整体内容通过引用并入本文。本公开涉及使用微阵列测定目标化合物。
背景技术:
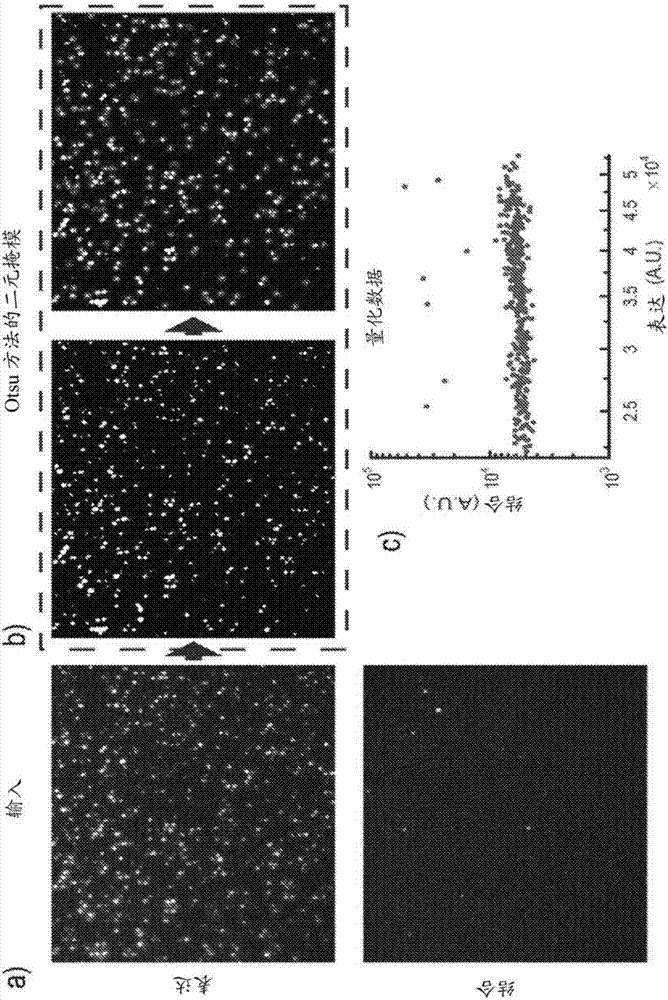
:高通量测量已经开始洞悉生物系统的内在复杂性和密集互连性。例如,全基因组测序已经产生了关于作为疾病病理生理学基础的关键基因和突变的丰富信息,dna微阵列允许仔细分析各种癌症的转录模式,且大规模蛋白质组学方法有助于在细胞响应各种生长因素中研究信号网络。然而,快速询问数百万种蛋白质变体与跨越一系列生物物理和生物化学测量的功能读数的序列-结构-活性关系的能力仍然是高通量生物学中关键的未满足的需求。在这里,我们描述了一种我们开发的用户友好的、具有成本效益的技术,用于满足这一需求,并通过对以下三种不同的蛋白质类的新发现的应用展示其功能和广度:抗体治疗学、荧光蛋白生物传感器和酶。蛋白质工程师非常依赖定向进化,这是一种强大的组合筛选方法,其使用选择性压力来逐步发展具有改善性能的蛋白质。使用这种方法,筛选库以识别具有所需特征的蛋白质,诸如对目标靶标的高亲和力、稳定性、表达或酶促活性。维持基因型到表型的联系是任何定向进化努力的根本需求;蛋白质变体必须保持与其相对应的dna序列相关联,以在筛选后识别。这个要求在用于筛选蛋白质结合配偶体的测定中最容易实现。作为实例,蛋白质变体与微生物细胞表面或噬菌体组分或翻译装置的基因融合允许使用荧光激活细胞分选(facs)或淘选方法(panningmethod)从大蛋白质库(107-1014变体)快速识别靶标结合物。利用空间分离的蛋白质分析方法,诸如在微量滴定板中测试单个酶变体,已将蛋白质工程应用扩展到结合相互作用之外,但是在典型筛选中通常将通量限制在103-105个变体。由于典型蛋白质的氨基酸搜索空间所具有的广阔的理论多样性,这些相对较小的库尺寸是限制性的。用于测定微量滴定板中蛋白质功能的机器人处理系统已经减轻了劳动力,但是仍然是相对低通量的(例如,每天100,000个测定),并且需要成大量的成本过高的材料和试剂。最近,批量生产的或与微流控芯片组合的油水乳液液滴已经在高通量酶工程应用中取得了成功,然而,该技术在实施中可能具有挑战性,并且不容易使动力学参数在实验过程中实时的达到瞬时测量。技术实现要素:在一个方面,本公开涉及一种系统,其包括阵列,该阵列包括多个包括开放的第一端和开放的第二端的不同的腔体;与腔体相关联的电磁辐射吸收材料;以及被配置为将电磁辐射传送至电磁辐射吸收材料的脉冲二极管激光器。在该系统的各种实施方式中,腔体可以是熔融的毛细管。阵列可以被处理以抑制在腔体之间的电磁辐射的传播。电磁辐射吸收材料可以抑制腔体之间的电磁辐射传播。阵列可以由包括在氢气氛中还原的铅玻璃的不透明材料构成。电磁辐射吸收材料可以是铅-硅酸盐层。脉冲二极管激光器可以被配置为将电磁辐射传送到与腔体的表面相关联的材料。所述表面可以位于腔体中的液体的弯月面处。脉冲二极管激光器可以被配置为将脉冲间隔为10至100毫秒的脉冲长度为1-10毫秒的2-20个脉冲的电磁辐射传送到阵列。在本公开的系统的另一实施方式中,电磁辐射吸收材料可以包括腔体中的颗粒。颗粒可以是磁性的。系统可以包括用于在腔体的液体内容物的表面处积聚颗粒的磁体。在本公开的系统的另一实施方式中,该系统包括用于捕获来自阵列的腔体提取内容物的可加热捕获表面。本公开的另一方面涉及一种用于提取微腔阵列的腔体内容物的方法。该方法包括将来自脉冲二极管激光器的电磁辐射聚焦在与腔体相关联的电磁辐射吸收材料上。电磁辐射吸收材料可以是腔体中的微粒,或者阵列可由包含已在氢气氛中还原的铅玻璃的不透明材料构成。在本公开方法的各种实施方式中,激光可被聚焦在与腔体中的液体接触的材料的表面处。例如,激光器的焦点可以被引导至位于液体的弯月面的材料处的电磁辐射。电磁辐射在材料处的聚焦可包括将电磁辐射施加到辐射吸收材料,以避免加热不与材料接触的液体。在本发明的系统的另一方面,多个不同的腔体包括开放的第一端和开放的第二端,其中基本上所有的多个腔体的开放的第一端共同地包括多孔平面亲水表面,并且基本上所有的多个腔体的开放的第二端包括多孔平面疏水表面。仍在另一方面,本公开涉及一种包括多个不同腔体的阵列,该腔体包括开放的第一端和开放的第二端,其中基本上所有的多个腔体的开放的第一端共同地包括第一多孔平面表面,并且基本上所有的多个腔体的开放的第二端包括第二多孔平面。吸收基质可以覆盖第一表面。所述基质可以包括液体、营养物和试剂中的一种或多种。覆盖物可以被配置为与阵列的腔体内容物交换液体、营养物和试剂中的至少一种。覆盖物可以是琼脂糖基质。更进一步地,本发明涉及具有多个不同腔体的微腔阵列,该腔体包括至少一个开放端,和用于收集提取自阵列的内容物的可加热捕获表面。本公开还包括防止微腔阵列的内容物质量传递到捕获表面的方法,其中所述方法包括加热捕获表面。仍在另一方面,本公开涉及一种用于维持从微腔阵列提取的细胞的存活力的方法。该方法包括将包含细胞的腔体内容物从阵列的至少一个腔体提取到捕获表面上,以及使捕获表面与包含维持细胞存活力的培养基的培养基质接触。培养基质可以包括琼脂糖。一方面,本公开涉及针对具有产生感兴趣分子的目标表型的细胞筛选具有多个细胞基因型的细胞库的方法。该方法包括用细胞库装载微腔阵列;在允许生产目标分子的条件下培养阵列;对阵列成像以识别包含具有目标表型的细胞的腔体;以及通过将来自脉冲二极管激光器的电磁辐射引导至与腔体相关联的辐射吸收材料处,提取包含具有目标表型的细胞的腔体内容物。在本公开方法的各种实施方式中,电磁辐射的引导包括将电磁辐射施加到辐射吸收材料,以避免加热未与材料接触的腔体中的样品液体。细胞可在阵列中扩展并且可选自哺乳动物细胞、酵母细胞和细菌细胞。本公开的方法还可包括培养所提取的腔体内容物以产生第二代细胞库。所提取的内容物可被扩展装载到阵列上。该方法可包括(1)从包括目标表型的基因的细胞中提取dna,(2)在将突变引入基因中的条件下扩增该dna;(3)创建包括扩增的dna的第二代细胞库,和(4)重复装载、培养和从阵列中提取细胞的方法步骤。在本公开方法的各个方面,目标表型可以是产生结合剂的细胞,诸如抗体、抗体片段、配体、小分子或受体。目标分子可以是具有目标发射强度和目标发射光谱中的至少一个的荧光蛋白,并且扫描可以包括识别发出目标发射强度和目标发射光谱中的至少一个的腔体。目标表型可以是产生具有酶活性的蛋白质、缺乏酶活性抑制的蛋白质和/或在酶抑制剂存在下具有活性的蛋白质的细胞。另一方面,本公开涉及一种用于改造荧光蛋白质中的目标性质的方法。目标性质可以是发射光谱、发射强度、斯托克斯位移和吸收光谱中的一个或多个。该方法包括创建产生荧光蛋白的突变形式的细胞库,以及筛选产生具有目标性质的突变形式的细胞库。筛选方法包括用细胞库装载微腔阵列;在允许产生突变形式的条件下温育阵列;对阵列成像以识别包含产生突变形式的细胞的腔体;和提取包含产生突变形式的细胞的腔体内容物。更进一步地,本发明涉及一种用于测量由具有用于产生蛋白酶的突变形式的多种基因型的细胞库产生的蛋白质酶库成员的酶动力学的方法。该方法包括用细胞库装载微腔阵列;在允许产生目标酶的条件下,在蛋白酶的底物存在下温育阵列;以选定的间隔对阵列成像;测量阵列的一个或多个腔体的酶活性差异。在各种实施方式中,细胞库可以是酵母细胞库或细菌细胞库。蛋白质酶可以展示在细胞的表面上,或蛋白质酶可能由细胞分泌。该方法还可包括添加酶的抑制剂。在本公开方法的另外的实施方式中,该方法包括提取包含具有目标表型的细胞的腔体内容物。该方法可包括将电磁辐射引导至与腔体相关联的电磁辐射吸收材料处。电磁辐射源可以是脉冲二极管激光器。附图说明图1示出了根据泊松统计学的本公开的微腔装载的示例性实施方式的结果。图2示出了根据本公开的示例性方法使用otsu方法将蛋白质表达和结合的原图像转换为二元掩模的转化实例。图3a和3b示出了与带有导电涂层的透明玻璃转换板相关联的微细管阵列的示例性实施方式。图4和图5示出了使用聚焦于样品和微腔壁之间的界面并将电磁辐射传送至该界面的激光器从微腔阵列的腔体中提取内容物的示例性过程。图6a-6d示出了本公开的示例性实施方式和方法的概述。图7示出了实验结果以显示使用本公开的示例性系统在不同激光功率和珠粒浓度下的提取效率。图8示出了本公开的示例性系统和方法中磁珠对荧光测量的影响。图8,图a)示出了存在或不存在磁珠的情况下微腔中荧光强度的直方图。图8,图b)示出了两种条件下的荧光和明场图像。图9示出了本公开系统的实例。图10a-10d显示了使用本公开的示例性系统和方法高通量筛选结合蛋白质的结果。图11示出了使用本公开的示例性系统和方法来自模拟库筛选的散点图。图12示出了遍及gas6结合scfv(单链抗体)的天然库筛选的流式细胞术散点图。图13示出了利用本公开的示例性系统和示例性方法用于改造橙色调荧光蛋白的阵列的图像。图14示出了根据本公开的方法展示表达gfp的空间分离的大肠杆菌培养物的生长的实验结果。图15a说明了ddfp技术。称为ddfp-a和ddfp-b的弱或非荧光蛋白单体可逆地结合形成特征色调的明亮荧光异二聚体。发色团由星暴表示。图15b描述了用于从ddrfp模板生成ddofp的工程策略。图16a示出了根据本公开方法的大肠杆菌库的筛选的量化。图16b示出了根据本公开方法的迭代定向进化的实例。图17示出了ddofp[seqidno:1]的a拷贝及其亲本ddrfp[seqidno:2]的序列对照。初始的m66t突变被圈出。以三轮定向进化获得的突变以灰色突出展示。图18示出了ddofp的归一化吸收(左)和发射(右)光谱。图19示出了ddofp填充ddyfp和ddrfp之间的光谱间隙。图20示出了ddofp和ddofp-a的ph依赖性的发射数据图表。图21示出了在碱性磷酸酶(ap)突变体的高通量筛选中使用的荧光ddao产物的pka的测定。图22a和22b示出了根据本公开的方法用于量化酶动力学的产物校准曲线。图23示出了根据本公开通过将可变浓度的产品标准品装载到单个微腔阵列上的离散点上,然后测量阵列上每个腔体的荧光强度来在平台上生成校准曲线。图24示出了使用来自大肠杆菌的荧光标记磷酸盐结合蛋白来量化ap反应中无机磷酸盐污染水平的校准曲线。图25示出了酵母展示的wtap与从大肠杆菌收获的纯化酶的磷酸盐抑制数据图表的比较。图26示出了与从大肠杆菌收获的纯化酶相比,展示在酵母表面上的wtap的动力学。图27示出了根据本公开方法的来自时间分辨的酶测定法的代表性快照。图28示出了对应于图27中的快照的微腔的定量。图29示出了根据本公开的方法测量的酵母展示的wt碱性磷酸酶和具有降低的催化效率的r166s点突变体的单细胞动力学数据图表。图30示出了碱性磷酸酶倾向差错pcr库中的估计突变频率。图31示出了根据本公开方法量化随机突变的ap库的筛选。图32示出了wt酶和从图31所示的库筛选分离的三种最活跃的变体的相对速率。图33示出了酵母展示的wtap和人工进化的n197s-t148p-s175r三重突变体的单细胞动力学数据图表。图34示出了根据本公开的方法的wt酶和从筛选分离的三种改进变体的磷酸盐抑制曲线。图35示出了人工进化的d101g突变体中降低的磷酸盐抑制的结构基础。图36示出了作为ddaop浓度函数的酵母展示的wtap和分离自μscale筛选的三种变体的动力学。图37示出了在酵母表面上展示的ap突变体的表达数据图表。图38示出了根据本公开的方法来自时间分辨的酶测定和图像定量的代表性图像。图39示出了根据本公开的示例性方法的微细管的图片和含有表达npp的酵母细胞的微腔的反应速率。图40示出了根据本公开的方法的细胞存活力实验的结果。图41示出了根据本公开的示例性系统和方法通过荧光强度测量的在微腔中的表达gfp的大肠杆菌生长。图42a示出了根据本公开的示例性方法的酵母展示的ax1变体与gas6竞争物的平衡结合滴定。图42b示出了根据本公开的示例性方法,在过量竞争物的情况下作为温育时间函数的自酵母展示的ax1的gas6的动力学解离。图43示出了根据本公开的方法gas6粘合剂的酵母表面展示的倾向差错axligi库的筛选。图44示出了与在荧光活化细胞分选(facs)流式细胞术分析中观察到的相比,根据本公开的示例性方法中荧光测量中毛细血管间存活力的评估。具体实施方式在各种实施方式中,本公开涉及筛选生物元素的大型种群用于确定存在或不存在生物元素亚群或单一元素。本公开的实施方式可用于从数百万或数十亿生物元素的异质群体中发现、表征和选择特定的相互作用。作为实例,本公开涉及能够分析空间分离的单克隆或其产物的密集阵列的多功能技术平台(本文称为μscale(微腔单细胞分析和激光提取))。靶细胞在分析后使用精确但温和的基于激光的提取技术分离。这个基于微腔的平台能够对静态荧光信号和瞬态荧光信号进行成像,能在数分钟的时间范围内对数百万种细胞产生的蛋白质变体进行功能分析。本公开的方法包括识别和分离生物细胞,包括但不限于表达或产生蛋白质、碳水化合物、酶、肽、激素、受体的细胞系;产生抗体的其它细胞系;基因工程细胞;和活化细胞。此外,本公开包括用于识别展示目标肽的病毒宿主的生物细胞的方法。此外,本公开可用于筛选各种生物活性,包括但不限于,表面受体蛋白质的表达、酶生产和肽生产。此外,本公开可用于筛选各种测试剂以确定测试剂对所需生物活性的影响。本领域技术人员应容易地理解期望分离和筛选的其它类型的细胞、期望检测的其它类型的生物活性和待筛选的特定测试剂。本公开的实施方式可用于单细胞和细胞培养物的高通量分析。在一些实施方式中,本公开提供了探测例如细胞与细胞的相互作用、单细胞生长和信号传导动力学、基因表达差异和重组宿主细胞表达水平的方法和装置。定义除非另有定义,本文使用的技术和科学术语具有与本领域普通技术人员通常理解的相同的含义。本文提供了一些术语的扩展和说明。本文提及的所有出版物、专利申请、专利和其它参考文献(如果没有另外指出)都明确地通过引用并入本文。如本文所使用的,单数形式“a”、“an”和“the”包括复数指示物,除非上下文另有明确规定。本文所用的术语“结合配偶体”、“配体”或“受体”可以是大量不同分子中的任一种或聚集体,并且这些术语可互换使用。在各种实施方式中,结合配偶体可与待检测的分析物缔合或结合。蛋白质、多肽、肽、核酸(核苷酸、寡核苷酸和多核苷酸)、抗体、糖、多糖、脂质、受体、测试化合物(特别是通过组合化学产生的化合物)可以各自是结合配偶体。术语“生物细胞”或“细胞”是指来自包括但不限于昆虫、微生物、真菌(例如,酵母)或动物(例如,哺乳动物)细胞的生物体的任何细胞。生物细胞还可以宿主和任选地展示目标病毒或具有目标基因型的病毒。本文所用的术语“生物元素”是指任何生物细胞或生物活性分子。生物活性分子的非限制性实例包括蛋白质、核酸、肽、抗体、抗体片段、酶、激素和小分子。“分析物”通常是指样品中的目标元素,例如生物样品中的目标生物元素。本文所用的术语“结合(bind)”或“连接(attach)”包括可以是永久的或暂时的任何物理连接或紧密缔合。这些缔合的非限制性实例是氢键、疏水力、范德华力、共价键和/或离子键。这些相互作用能促进目标分子和待测分析物之间的物理连接。“结合”相互作用可以是简单的,如在结合导致化学反应发生的情况下,诸如例如当结合组分是酶并且分析物是该酶的底物时。由结合剂和分析物之间的接触产生的特异性结合反应也在该定义范围内。这样的反应是例如抗体和例如蛋白质或肽的相互作用的结果,使得相互作用取决于蛋白质上特定结构(例如,抗原决定簇或表位)的存在。特异性结合相互作用也能发生在其它分子之间,包括例如蛋白质-蛋白质相互作用、蛋白质-小分子相互作用、抗体-小分子相互作用和蛋白-碳水化合物相互作用。这些相互作用中的每一种可发生在细胞表面。如本文所用的术语“样品”以其最广泛的含义使用,并且包括环境和生物样品。环境样本包括来自环境的材料,诸如土壤和水。生物样品可以是动物,包括人、流体(例如,血液、血浆、血清、尿液、唾液)、固体(例如,粪便)、组织、液体食物(例如,牛奶)和固体食物(例如,蔬菜)。例如,可以通过支气管肺泡灌洗(bal)收集肺部样品,其包含源自肺组织的流体和细胞。生物样品的其它实例可以包括细胞、组织提取物、体液、从细胞分离的染色体或染色体外元件、基因组dna、rna、cdna等。现在转到本公开的各个方面,本公开的阵列包括包含在极密多孔阵列中的反应腔体。作为示例,本文考虑的微阵列可以通过捆绑数百万或数十亿个腔体或孔(诸如,二氧化硅毛细管的形式)并通过热过程将它们熔融在一起来制造。这种熔融过程可以包括以下步骤,包括但不限于:i)加热在张力下拉伸成单包层纤维的毛细管单拉伸玻璃;ii)通过捆扎、加热和拉伸从单拉伸玻璃制造毛细管多拉伸单毛细管;iii)通过额外的捆扎、加热和拉伸从多拉伸单毛细管制造毛细管多重拉伸多毛细管;iv)通过以压块堆叠从多重拉伸多毛细管制造拉伸玻璃的块组件;v)通过用热和压力处理从块组件制造块压块;以及vi)通过以精确的长度(例如,1mm)切割块压块来制造块形成块。在一个实施方式中,将毛细管切割成约1毫米高度,从而形成多个微孔,其内径在约1.0微米至500微米之间。在一个实施方式中,微孔范围在约10微米至1毫米长之间。在一个实施方式中,微孔范围在约10微米至1厘米长之间。在一个实施方式中,微孔范围在约10微米至100毫米长之间。在一个实施方式中,微孔范围在约0.5毫米至1厘米长之间。非常高密度的微孔阵列可以用于本公开的各个方面。在示例性实施方式中,每个微孔能具有5μm直径和约66%的开放空间(即,表示每个微腔的内腔)。在一些阵列中,开放的阵列的比例在约50%至约90%范围之间,例如约60至75%范围之间,更特别地约67%。在一个实例中,具有5微米直径微腔和约66%开放空间的10×10cm阵列具有约3.3亿微孔。微腔的内径可以在约1.0微米和500微米之间的范围内。在一些阵列中,每个微孔的内径可以在约1.0微米与300微米之间的范围内;任选地在约1.0微米和100微米之间;进一步可选地在约1.0微米和75微米之间;还进一步任选地在约1.0微米至50微米之间;还进一步任选地在约5.0微米至50微米之间。在一些阵列中,阵列的开放面积包括多达90%的开放面积(oa),使得当腔体尺寸在10微米至500微米之间变化时,每厘米阵列的微孔数量在458和1,146,500之间变化。在一些阵列中,阵列的开放面积包括约67%的开放面积,使得当腔体尺寸在10微米至500微米之间变化时,每平方厘米阵列的微孔数量在341和853,503之间变化。作为实例,腔体尺寸为1微米且开放面积多达90%时,阵列的每平方厘米将容纳多达约11,466,000个微孔。在一个特定的实施方式中,微腔阵列可通过粘合数十亿二氧化硅毛细管然后通过热处理将它们熔融在一起来制造。之后,切出切片(0.5mm以上)以形成非常高纵横比的玻璃微孔阵列板。参见国际申请pct/ep2011/062015(wo2012/007537),其全部内容通过引用并入本文。许多有用的阵列诸如可商购自hamamatsuphotonicsk.k.(日本),incom,inc.(马萨诸塞州),photonistechnologies,s.a.s.(法国)inc.等。在一些实施方式中,阵列的微腔在一端封闭,固体基质连接到阵列上。在某些实施方式中,阵列的腔体的侧壁是不透射电磁辐射的,或者腔体涂覆有防止电磁辐射在阵列的腔体之间传播的材料。合适的涂层不应干扰腔体内的结合反应或向腔体施加力。示例性涂层包括金、银和铂的溅射纳米层。在另一个实例中,阵列的毛细管壁由多个层组成,其中该壁的一个或多个层由低折射率材料制成,其防止或大大减少阵列的腔体之间的电磁辐射传播。由多个层组成的阵列的示例性实施方式来自incom,inc.(charlton,massachusetts)。在特定的实施方式中,在湿或干燥氢气氛下或处于该条件下制备阵列,以便抑制或阻止电磁辐射通过阵列的传播。例如,碱掺杂的硅酸盐玻璃的阵列可在在氢气氛中被还原以使阵列的所有表面(包括腔体的壁)变成不透明的、变暗或变黑,使得电磁辐射在阵列的腔体之间的传播被禁止或阻止。该方法能产生可能为几百埃厚的硅酸铅层,而不是简单的涂层。在一个实例中,阵列由photonisusainc.(sturbridge,massachusetts)的resistiveglassproduct制造。阵列的其它示例性实施方式包括表2中所示出的那些。表2在本公开的一个方面,阵列的腔体具有促进将溶液自发吸收入腔体中的亲水表面。在另一方面,可以处理阵列的表面以赋予疏水性。结合这些方面,阵列的一个表面可以是疏水性的,另一个表面可以是亲水的。例如,阵列的顶表面和底表面被不同地处理以赋予在顶部的亲水特性和在底部的疏水特性。可以依次对阵列进行处理,首先用试剂赋予疏水性,然后用试剂在相反的一侧赋予亲水性。因此,本公开涉及一种包括多个不同腔体的阵列,所述腔体包括开放的第一端和开放的第二端,其中基本上所有的多个腔体的开放的第一端共同地包括多孔平面亲水表面,而基本上所有的多个腔体的开放的第二端包括多孔平面疏水表面。这些表面包括腔体的开放端和腔体之间的间隙空间。根据本领域已知的技术,可以使用电晕处理赋予亲水特性。例如,可以使用手持式特斯拉线圈(例如,电工技术产品bd-20ac),使得在阵列表面上方几毫米处的几个缓慢的穿过玻璃阵列表面(10-30秒的总暴露)的经过足以赋予适当的亲水特性。此外,阵列可以用疏水剂诸如聚硅氧烷或包含聚硅氧烷的组合物进行处理。作为实例,疏水剂是羟基封端的聚二甲基硅氧烷。在一个特定的实施方式中,疏水剂是防水剂。为了提供具有相反的亲水和疏水表面的阵列,可处理一个表面或整个阵列以赋予亲水特性。此后,亲水表面被保护,例如通过施加密封剂,并且用疏水剂处理相反的表面。在某些实施方式中,密封剂选自用于该目的的可商购胶带,例如-high-performancesurestarttmpackagingtape(catno.a8142-6)。在施加疏水剂之后,去除密封带,提供具有相反的亲水和疏水表面的阵列。在特定的实施方式中,亲水表面对应于阵列的顶部,其可以装载样品,而疏水表面对应于阵列的底部。在各方面,本公开涉及用于筛选具有多种基因型的细胞库以获得具有目标表型的细胞的方法,诸如产生具有目标表型的蛋白质或其它分子的细胞。通常,该方法可用于筛选能够在阵列中存活和/或繁殖的所有细胞类型,例如哺乳动物、真菌、细菌和昆虫。目标表型可以包括导致可检测结果的任何生物过程,包括但不限于多肽和核酸的产生、分泌和/或展示。具有与可检测表型相关联的多个基因型的细胞库能通过涉及倾向差错pcr、基因表达的随机激活、噬菌体展示、基于突出部的dna嵌段改组、随机诱变、体外dna改组、位点特异性重组的方法,以及本领域技术人员通常已知的其它方法生成。阵列可设计成使得一些或所有腔体包含分析物的待筛选的单个生物元素。因此,根据阵列的设计和待识别的所需分析物来计算细胞的非均相混合物的浓度。在蛋白质生产细胞被筛选的实施方式中,该方法能够消除克隆竞争并筛选出更加多样的细胞。可以通过将含有多个细胞(诸如异质细胞群)的溶液与阵列接触来装载阵列。在一个实施方式中,将抗体展示或分泌细胞例如大肠杆菌或酵母的混合物均匀地装载到所有微腔中,包括在阵列的上侧放置500μl液滴并将其铺展在所有的微孔上。例如,在500μl的液滴中大约109个细胞的初始浓度导致在每个微腔中大约3个细胞(或亚种群)。在一个实施方式中,每个微孔具有介于20-80pl之间的近似体积(取决于介于250μm至1mm的玻璃毛细管板的厚度)。一旦微腔被装载并被温育过夜,每个微腔应该包含约2,000-3,000个细胞/微腔。在一个实施方式中,可以将细胞培养长达48小时或更长时间,而不损失存活力,以便最大化增殖产率。所述多个细胞可以是动物细胞、植物细胞和/或微生物细胞,例如细菌或酵母细胞。细胞可以分泌或展示至少一种目标化合物,诸如对结合配偶体具有亲和性的目标重组化合物。在各种实施例中,如果在大约5000μl溶液中存在大约109个细胞,则平均来说,对于具有约3-4×106个微孔的阵列,假设腔体体积为50皮升,每个微孔应当具有约10个细胞。确切的数字将取决于阵列中腔体的体积和溶液中细胞的浓度。作为实例,每个微孔的体积可以在约20至80皮升之间。含有细胞种群和/或细胞库的样品可能需要在分配到阵列之前的准备步骤。在一些实施方式中,这些制备步骤包括温育时间。温育时间将取决于筛选的设计和被筛选的细胞。示例性时间包括5分钟、1小时、3小时、6小时、12小时、1天、2天和3天或更长时间。在添加和/或装载到阵列上之前,可以在培养基中扩展异质的细胞种群。对于某些应用,可以在指数生长阶段期间将含有细胞的培养基装载到阵列中。每个腔体可具有允许细胞复制的一定体积的培养基。例如,20皮升可提供足够的培养基以允许腔内的大多数单细胞多次复制。阵列能够任选地在任何温度、湿度和时间下温育以使细胞扩展并产生靶标蛋白质或其它感兴趣的生物元素。温育条件可以根据本领域常规的实验设计来确定。在一个实施方式中,本公开的方法考虑了异质细胞种群的悬浮液的浓度,并且阵列的尺寸被布置成使得1-1000个生物元素,任选地1-500个生物元素,进一步任选地1-100个生物元素还进一步任选地1-10个生物元素,还进一步任选地1-5个生物元素,分布到阵列的至少一个微腔中。装载到阵列上的含细胞体积的体积将取决于若干变量,包括例如期望的应用、非均相混合物的浓度和/或生物元素的期望稀释度。在一个具体的实施方式中,阵列表面上的期望体积为每平方毫米约1微升。确定浓度条件使得生物元素以任何所需的方式或稀释度分布。在具体的实施方式中,浓度条件被设定为使得在阵列的大多数腔体中仅存在单一元素。这可实现对单个元素进行最精确的筛选。能够容易地计算这些浓度条件。举例来说,在细胞筛选中,如果蛋白质生成细胞与腔体的比率为约1至3,则具有109个腔体的阵列可用3×108个不同的蛋白质生成细胞在6ml(6ml=20皮升/孔×3×108个腔体)体积中装载,并且绝大多数腔体将至多包含单克隆。在某些其它实施方式中,在每个孔中不需要单细胞。对于这些实施方式,设定异质种群的浓度,使得多于一个细胞见于每个孔中。例如,当阵列正确装载时,细胞应按照泊松分布随机分布到阵列中。根据该分布,通过以下等式计算在微细管中装载k个细胞的概率p,其中λ是体积浓度(微细管体积中的平均细胞数):对于每个微细管的单一细胞(k=1),等式变为:p(1,λ)=λe-λ(式2)然后,为了最大化微细管一个细胞/微细管的分数,方程2的局部最大值必须为零。取等式2的导数:p′(1,λ)=e-λ-λe-λ=e-λ(1-λ)=0在本实例中,当λ=1时,装载样品的浓度应等于每个微细管体积1个细胞。表3总结了不同微细管阵列的λ列的管的装载样品的浓度。表3装载混合物的浓度根据以下等式与每微细管的平均细胞数、λ和微细管体积(v毛细管)相关:图1示出了以三个浓度装载到阵列中的荧光珠,对应于每微细管3、1和1/3颗粒的平均值(λ=3、1、1/3)。计数20,000微细管的含量,将各条件的累积分布函数(cdf)绘制为红线。尽管细胞按照泊松分布而随机分布到阵列中,但是观察到的平均值和预期的平均值有二到三倍的差异,这可能是由于微细管的高纵横比使得一些颗粒不能进入成像平面。因此,可以使用高于计算的样品浓度来克服所观察到的平均值和预期的平均值之间的差异。在其它实施方式中,含有异质种群和/或细胞库的样品可能需要加入阵列后的制备步骤,例如温育。在其它实施方式中,在温育期间,扩展每个腔体内的每个细胞(经细胞生长、经噬菌体繁殖、经蛋白质表达和释放等)。该温育期间能允许细胞表达或展示目标表型,或允许病毒复制。将细胞装载到阵列之后,可向阵列中添加或从其除去附加的分子或颗粒,而不会干扰细胞。例如,可添加可用于检测细胞的任何生物反应性分子或颗粒。可通过将包含分子或颗粒的液体试剂引入阵列的顶部而将这些附加的分子或颗粒添加到阵列中,例如通过如本文所述关于添加细胞的逐滴加入。为了从包含生物元素的阵列中除去特定的分子,可制备不含被选择的待要除去的分子但是包含以期望浓度存在在腔体阵列中的所有剩余的分子的溶液。如前所述,将液滴添加到阵列中。在腔体阵列的内容物与该溶液的液滴平衡之后,阵列中所选择的分子的浓度将降低。降低量取决于添加的液滴的体积和阵列中包含的总体积。为了进一步降低所选择的分子的浓度,可在从阵列的顶部除去第一滴然后加入第二滴液体后重复该步骤。液体可从阵列的顶部除去,例如用纸或移液管吸干阵列。作为另一个实例,流体保持性和可透性覆盖物可放置在阵列上以将水分、营养物质或其它生物分子添加、保持或交换到阵列。本文进一步描述了流体保持性和可透性覆盖物。在某些实施方式中,可包含颗粒和一种或多种生物元素。可将颗粒与一种或多种生物元素组合,之后将该组合引入阵列的微腔中,或者可在引入一种或多种生物元素之前或之后在微腔中提供颗粒。在某些实施方式中,可提供合适浓度的颗粒和一种或多种生物元素,以在微腔腔体的底部积聚,同时为一种或多种生物元素留下足够的体积时。溶液中颗粒的浓度取决于具体的颗粒。例如,在与一种或多种生物元素组合之后,颗粒的制备可提供1mg/ml至100mg/ml的终浓度。在某些实施方式中,溶液中的颗粒提供2.5mg/ml至50mg/ml的终浓度。一旦识别出目标腔体或多个腔体,能够用本文所述的装置和方法提取腔体的内容物。可进一步分析或扩展腔体内容物。根据本文的方法,可用阵列重新筛选来自腔体或多个腔体的扩展细胞种群。例如,如果种群中的生物元素的数量超过阵列中的腔体数量,则可在每个孔中用多于一个元素筛选种群。然后可提取提供正信号的腔体的内容物以提供亚群。可立即筛选亚群,或者当亚群是细胞时,可扩展亚群。可重复筛选过程,直到阵列的每个腔体仅包含单一元素。筛选也能够用于检测和/或提取指示期望的分析物位于其中的腔体。在选择腔体之后,可以使用其它常规技术来分离感兴趣的各个分析物,诸如提供更高水平蛋白质生产的技术。在某些实施方式中,在将样品添加到腔体之后,用膜密封阵列的顶部,以便减少培养基从腔体的蒸发。一种或多种基本上气体和/或液体不可渗透的膜可用于在将样品添加到腔体之后密封阵列的表面。例如,典型的食品服务型塑料包装诸如聚偏氟乙烯(pvdf)是合适的。在另一个实施方式中,膜允许水蒸汽与孔中的液体的顶部液体层平衡,这有助于防止蒸发。例如,与微腔阵列的顶表面接触放置的膜,在水放置在膜的顶部时,将捕获每个单个孔内的腔体内容物,但是允许水或培养基流入腔体中。有用的膜的实例是硝酸纤维素和膜。使用具有非常小孔(例如,10-100nm)的多孔形式的聚四氟乙烯膜(例如,织物)可获得类似的布置,其将捕获腔体中的任何细胞,但允许水、培养基和其它试剂进入腔体中。在某些实施方式中,阵列的顶部被半透性组合物覆盖,其允许将液体和试剂输送到阵列的腔体,同时还防止腔体内容物的蒸发。类似地,覆盖物能够允许液体和试剂与腔体内容物交换。在一个方面,如上所述,将一个或多个样品引入阵列之后,将半渗透性组合物层压到微腔阵列的顶表面上。在一些实施方式中,半渗透性组合物是流体保持性和可透性的,并且能够储存足够体积的液体,以允许组合物赋予阵列内容物和/或与其交换流体、营养物和生物反应性分子。因此,所述组合物能够保留和赋予流体,并且在一些方面,组合物维持阵列腔体中的流体和组合物中的流体之间的生物活性分子浓度的平衡。在一个方面,所述组合物是或包括与微腔阵列的表面接触的聚合物凝胶。在某些实施方式中,聚合物凝胶选自聚丙烯酰胺、琼脂或琼脂糖。本领域技术人员将意识到在本公开的实施方式中有用的其它合适的聚合物。此外,聚合物凝胶中的聚合物浓度可根据不同的实施方式和不同的应用而变化。例如,琼脂糖的聚合物浓度可以包括0.2%-10%容积重量。在一个方面,琼脂糖可以包括0.2、0.5、0.8、1、2、3、4、5、6、7、8、9或10%的琼脂糖容积重量。在各种实施方式中,聚合物凝胶层的厚度在0.1-10mm之间。在特定的方面,聚合物凝胶层厚度为0.1、0.25、0.5、0.75、1、2、3、4、5、6、7、8、9或10mm。在各个方面,流体保持性和可透性覆盖物足够厚以便在期望的时间段内避免阵列的腔体内容物蒸发。流体保持性和可透性覆盖物的液相可以包括参与生物过程的溶液。例如,液相可以包括合适的水性缓冲溶液,例如,磷酸盐缓冲盐水溶液、tris缓冲盐水溶液或非缓冲水相。在各种实施方式中,液相可以包括细胞培养基,以在几小时或几天的过程中向腔体中的细胞提供营养物或生物反应性分子。在一个方面,液相可以包括裂解缓冲液。在一个方面,覆盖物允许覆盖物与腔体之间的自由扩散。因此,在某些实施方式中,使用半透性凝胶将所需分子均匀地传送到所有微腔中。在某些方面,凝胶用于稀释或“洗涤”已经在微腔中的不需要的分子。在某些实施方式中,使用基于细胞培养基的凝胶来提供微腔之间的接触桥,这允许生长因子在细胞之间而不是细胞本身转移。在某些方面,使用基于细胞培基物的凝胶来研究细胞之间的旁分泌信号传导。在其它实施方式中,目标分子梯度可浸渍在凝胶中,这将允许将不同的刺激提供给处于阵列的不同位置的微腔。富含营养的凝胶的使用允许在阵列的腔体内生长细胞,例如阵列中的细菌、酵母和哺乳动物细胞。对于每种细胞类型,可以使用改良或不改良的特定物种的标准培养基。在特定的实施方式中,代替磷酸盐缓冲液的hepes(例如,25mm)或代替某些诱导培养基中的磷酸盐缓冲液的tris-hclph7.5(例如,25mm)可导致更高的蛋白质表达。hepes或tris-hcl取代的诱导培养基,相比于含有较高浓度磷酸盐缓冲液的诱导培养基或补充有2g/l葡萄糖或20g/l棉子糖五水合物的诱导培养基,导致在酵母中的更高的蛋白质表达水平因此,在一个方面,本发明涉及一种包括多个不同腔体的阵列,腔体包括开放的第一端和开放的第二端,其中基本上所有的多个腔体的开放的第一端共同地包括第一多孔平面表面,以及基本上所有的多个腔体的开放的第二端包括第二多孔平面表面,以及用于第一表面的覆盖物,该第一表面将水分、营养物或生物反应性分子中的至少一种赋予腔体的内容物。所述阵列的培养基输注液和可透性覆盖物的具体实例如下:1)1%琼脂糖凝胶与水和1%琼脂糖凝胶与磷酸盐缓冲盐水,以保持微腔中细胞的内容物/渗透压。该凝胶可用于确保细胞保留在阵列的底部。2)1%琼脂糖凝胶与酵母生长培养基以在48小时内生长酵母。3)1%琼脂糖凝胶与酶反应缓冲液,以确保酶反应保持适当缓冲。4)1%琼脂糖凝胶与酶反应缓冲液和反应底物以将反应底物均匀地传送到腔体。5)1%琼脂糖凝胶与哺乳动物细胞培养基以向哺乳动物细胞转送营养物质。6)1%琼脂糖凝胶与桥接腔体的哺乳动物细胞培养基,允许腔体的内容物影响远处腔体中的细胞。在本文所述的各种实施方式中,1.5mm层的1%琼脂糖和水可放置在阵列顶部。诸如琼脂糖之类的透明凝胶适用于明场成像,因为其不会阻挡位于阵列上方的光源。此外,流体保持性和可透性覆盖物可在阵列中的细胞温育和/或扩展期间进行更换。在该实施方式中,通过将顶部的覆盖物更换为含有试剂或其它化合物的新覆盖物,将营养物或其它试剂添加或洗出。例如,通过从包含生长培养基的覆盖物转换到含底物的凝胶,用于酶反应的底物可以在精确的时间(例如,细胞生长之后)包埋至覆盖物中并添加到反应中。在温育、添加组分和/或另一制备步骤之后,扫描阵列以识别包含具有目标表型的细胞的腔体,其可以包括寄宿(hosting)展示目标表型的病毒的细胞。例如,根据定量宽视野显微镜的既定准则,可以测量从阵列检测到的荧光信号的毛细血管间变异性。微细管填充过程的被动特性导致均匀弯月面水平跨越整个阵列。这种均匀性与装载细胞的重力沉降相结合,简化了成像焦点平面的建立,而不需要自动对焦。更确切地说,焦点可以设置在阵列上的三个远距离间隔的点上,例如角落。从这三点可以计算微细管阵列的平面如图2所示,原始输入灰度图像可以通过阈值(otsu方法)借助最小亮度和阈值水平的可选用户输入转换为二进制图像。用于表达和结合的原输入图像如图a)所示。图b)示出了otsu方法的阈值。特征可以通过尺寸(最小和最大)和圆度(偏心率)过滤。通过用户定义参数的特征被突出显示。图c)示出了可将经过滤的二元掩模应用于原图像,并且可以量化并绘制荧光值。以额外的计算速度为代价可进行背景减除以改善定量。特征滤波可消除大部分荧光碎片,并且空间分离和直接成像可以为单个单细胞的询问提供足够的时间。这种能力使研究人员能够区分荧光碎片和细胞,减少假阳性率。定量宽视野显微镜的优化可导致光学渐晕,这是一种可能由于相机传感器尺寸增加而导致的图像边缘亮度的降低。为了补偿,可裁剪图像以消除具有渐晕的区域。这可通过要求更多的图像来覆盖给定的区域来降低成像速度。此外,平视野校正可用于需要绝对量化的情况。按照wolf等人建立的方案{methodscellbiol.(2013)114:337-67),可拍摄四个图像:均匀的荧光参考(h平),无荧光区域的暗图像(h暗),样品中无荧光区域的暗图像(s暗)和样本图像(s图像)。平视野校正图像可通过以下等式得到:微腔内容物的提取基于从与腔体阵列相关联的检测器接收到的光学信息,识别具有期望特性的靶标腔体,并提取其内容用于进一步表征和扩展。所公开的方法保持腔体中的生物元素的完整性。因此,本文公开的方法提供了自多达数十亿个靶标生物元素的种群的生物元素的靶标种群的展示和独立回收。这对于对细胞进行筛选的实施方式是特别有利的。例如,来自每个腔体的信号被扫描以定位目标结合事件。这识别出目标腔体。可使用各种方法提取含有所需克隆的每个腔体。对于所有提取技术,提取的细胞或材料可以通过培养或扩增反应扩展,并识别用于蛋白质、核酸或其它生物元素回收。如上所述,也考虑了多轮筛选。在每次筛选之后,可以如本文所述提取一个或多个目标腔体。然后可再次筛选每个腔体的内容物,直到达到期望的特异性。在某些实施方式中,所需的特异性将是每孔的单生物元素。在这些实施方式中,在腔体仅包括单一元素之前,可以在每一轮筛选之后进行提取。在一个实施方式中,所述方法包括通过压力喷射来分离位于微腔中的细胞。例如,分离的微腔阵列被塑料膜覆盖。在一个实施方式中,该方法还提供能够透过塑料膜形成孔的激光器,从而暴露空间上寻址的微孔。随后,暴露于压力源(例如,空气压力)使得内容物从空间寻址的微腔排出。参见wo2012/007537。另一个实施方式涉及从微腔阵列中的单个微腔提取包含生物元素的溶液的方法。在该实施方式中,微腔与电磁辐射吸收材料相关联,使得材料在腔体内或涂覆或覆盖微腔。通过将电磁辐射聚焦在微腔处,产生样品或材料或两者的扩展或将至少部分样品从微腔排出的蒸发,发生提取。电磁辐射源可以与激发荧光标记的源相同或不同。该源能够发射多个波长的电磁辐射,以便适应材料和标记的不同吸收光谱。在一些实施方式中,使所选择的微腔经受聚焦的电磁辐射能导致电磁辐射吸收材料的扩展,其将样品内容物排出到用于收集被排出的内容物的底物上。在一些实施方式中,激光器应该具有足够的光束质量,使得其能被聚焦成直径大致等于或小于孔直径的光斑尺寸。例如,当阵列材料能够吸收电磁辐射时,例如当阵列制造成带有或涂覆有电磁辐射吸收材料时,激光光斑直径可小于毛细管直径,而激光聚焦于材料-样品界面。在一些实施方式中,阵列本身的材料,没有任何涂层,诸如深色或黑色的毛细管阵列,能够用作电磁辐射吸收材料。例如,如本文进一步所述,阵列可由已在氢气氛中还原的铅玻璃构成。在各种实施方式中,激光的焦点可以是腔体直径的90%、80%、70%、60%、50%、40%、30%、20%、10%、9%、8%、7%、6%、4%、4%、3%、2%或1%。在一个方面,电磁辐射聚焦在电磁辐射吸收材料上,导致激光能量的线性吸收和液体样品在材料/液体界面处的气蚀。电磁辐射引起阵列的电磁辐射吸收材料的强烈局部加热,引发与材料接触的薄层流体的爆炸性蒸发和扩展,而不加热腔体内容物的其余部分。在大多数应用中,将电磁辐射引导至材料应避免加热在辐射的焦点处的不与材料接触的液体,以避免加热微腔的液体内容物并影响细胞中的生物材料。因此,尽管电磁辐射焦点附近的非常薄的液体层被加热以引起液体的爆炸性蒸发和扩展,但破坏弯月面所需的能量的量不足以引起整个液体内容物的温度的显著升高。在一个方面,激光聚焦在与弯月面本身相邻的阵列的腔体的材料上,导致弯月面的破坏而不加热腔体内的液体内容物,除了与激光焦点相邻的弯月面的部分处少量液体的蒸发相关联的加热。在某些实施方式中,通过激发在微腔中的一个或多个颗粒来实现从阵列腔体中的提取,其中激发能量聚焦在颗粒上。因此,一些实施方式在腔体中采用能量吸收颗粒,和能够将电磁辐射谨慎地传送到阵列的每个腔体中的颗粒的电磁辐射源。在某些实施方式中,在微腔内的溶液的温度最小或不增加的情况下将能量转移到颗粒。在某些方面,脉冲序列重复地搅动腔体中的磁珠以破坏弯月面,将样品内容物排出到底物上以收集排出的内容物。来自电磁辐射源的电磁辐射发射光谱必须使得其与腔体相关联的电磁辐射吸收材料的吸收光谱中存在至少一部分重叠。在某些实施方式中,来自微腔阵列的单个腔体通过一系列短激光脉冲而不是单一大脉冲来提取。例如,激光脉冲发生于约300和650之间,更特别是约349nm、405nm、450nm或635nm的波长处。激光的峰值功率可以在例如约50mw和100mw之间。此外,激光的脉冲长度可以是从大约1ms到大约100ms。在某些实施方式中,激光的总脉冲能量在约10μj至约10mj之间,例如,10、25、50、100、500、1000、2500、5000、7500或10,000μj。在某些实施方式中,激光束腰部的聚焦光斑的直径在约1μm至约20μm之间,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20μm。在特定的示例性实施方式中,激光以下述进行脉冲:75mw峰值功率,1毫秒脉冲长度,10毫秒脉冲间隔,2微米直径光束脉冲,每次提取总共10个脉冲。在一些实施方式中,选择目标腔体,然后通过聚焦20-30%强度功率的349nm固态紫外激光器来提取。在一个实例中,源是在约50纳秒脉冲中发射约1微焦耳至约1毫焦耳脉冲的三倍频、脉冲固态nd:yag或nd:yv04激光源。在另一实例中,源是二极管泵浦的q开关nd:ylftritonuv349nm激光器(spectra-physics)。例如,激光器可以具有大约15-25毫秒的总操作时间,在大约2-3khz以大约8-18纳秒的脉冲宽度传送35-55个脉冲串,光束直径约为4-6微米,且总功率输出为80-120μj。在一个特定的实例中,激光器可以具有大约15-20ms的总操作时间,在大约2.5khz以约为10-15ns的脉冲宽度传送约41-53个脉冲串,光束直径约为5μm,且总功率输出为100μj。根据本公开,可以使用具有快门和脉冲激光源两个连续波激光器。在一些实施方式中,二极管激光器可以用作电磁辐射源。在某些实施方式中,二极管激光器的焦点具有在约1微米至约10微米之间的束腰直径,例如,1、2、3、4、5、6、7、8、9或10微米的直径。二极管激光器的峰值功率可以在约20mw至约200mw的峰值功率之间,例如,约20mw、40mw、60mw、80mw、100mw、110mw、120mw、130mw、140mw、150mw、160mw、170mw、180mw、190mw或200mw的峰值功率。二极管激光器可在约300和约2000nm之间的波长下使用,例如,约405nm、450nm或635nm波长。在其它实施方式中,在约800nm、980nm、1300nm、1550nm或2000nm波长处使用红外二极管激光器。对于任何给定的样品,较长的波长预期具有较低的光毒性。在某些实施方式中,二极管激光器在约2-20个脉冲之间脉冲,例如,2、4、6、8、10、12、14、16、18和20个脉冲,脉冲长度约为1至10毫秒,例如,1、2、3、4、5、6、7、8、9和10毫秒,并且具有大约10毫秒至100毫秒的脉冲间隔,例如,10、20、30、40、50、60、70、80、90和100毫秒。在示例性实施方式中,二极管激光器是在635nm波长下工作的峰值功率为170mw的oclarohl63133dg激光器。在另一示例性实施方式中,二极管激光器是在450nm工作的osrampl450b激光器。在其它示例性实施方式中,将二极管激光器或triton激光器聚焦到1至10微米的直径。激光器在10毫秒至100毫秒的时间段内发射10到50个脉冲串。每个单独的脉冲具有1毫秒(二极管激光器)或10纳秒(triton激光器)的时间持续。总脉冲串能量约为100微焦耳。激光能量在微细管中的体积内被吸收,该毛细管中的体积大致为直径大致等于激光束腰直径以及由激光束的吸收长度确定的高度的圆柱体。如果磁珠在毛细管中,则激光脉冲能量被珠粒吸收,主要是加热直接暴露于激光器的珠粒表面。紧邻该表面的液体发生爆炸性蒸发,从而推动毛细管内的珠粒。珠粒的爆炸性运动以及附近液体的蒸发会破坏弯月面并排空毛细管。如果阵列本身的材料吸收光,则激光能量主要沉积在激光入射时的毛细管壁的部分中。如果足够的激光能量在足够短的时间内被吸收在该吸收体积中,则热量将不会有时间扩散到周围液体。吸收体积中的液体将通过激光脉冲爆炸性蒸发,导致一部分样品快速扩展,其破坏弯月面并排空微细管的内容物,并且到达吸收体积外部的周围液体的热扩散将被最小化。在特定的实例中,单独的激光脉冲具有大约1毫秒的持续时间,并且束腰直径约为10微米。在该实例中,单一激光脉冲将加热激光束的吸收区域内的液体的体积,并且在脉冲期间,热量将仅在吸收区域外扩散几微米。在激光脉冲期间沉积的能量使得吸收区域中的液体的温度突然上升到蒸发温度的很多倍。液体在该吸收区域爆炸性蒸发,而周围区域基本保持在其原始温度。吸收区域内液体的爆炸性蒸发破坏了弯月面,液体从微细管排出,而从吸收材料到周围培养基的热扩散可忽略不计,导致可忽略地或不加热微细管总液体内容物。描述在短时间内物质内的热传播距离的方程式是:其中d是特征热扩散距离,α是热扩散系数,τ是能量沉积时间或激光脉冲长度。对于水α=0.143mm2/s,τ=1毫秒,这个等式得到约10微米的预测扩散长度。在由10微米束腰直径且10微米高度确定的近似吸收圆柱体体积中沉积的100微焦的总脉冲能量将使该体积中液体的温度升高到液体的蒸发温度许多倍,导致在该体积中液体的爆炸性扩展。veritas激光器提供大约40个、5ns脉冲串,每个脉冲间隔大约500微秒。每个脉冲引起在吸收体积中液体的爆炸性扩展,从而推动珠粒(如果存在)并破坏弯月面。二极管激光器类似地传送十个1ms脉冲的脉冲串,间隔几毫秒,其以类似的方式与毛细管中的液体相互作用。在两种情况下在脉冲串中使用多个脉冲,与使用单一高能量脉冲相比,提高了提取效率。当使用微球时,直径为d的均匀球体的热弛豫时间(tr)的等式为:只要激光脉冲小于约300ns(这取决于珠粒的直径而变化),就会有吸热材料的热限制和快速局部加热。在另外的示例性实施方式中,可以使用以下参数:1)激光器参数a.veritas激光器i.tritonuv349nm激光器(二极管泵浦q开关nd:ylf激光器,spectra-physics)ii.总操作时间:18±2ms(n=5次测量),在2.5khz传送一串46.6±5.9脉冲iii.脉冲宽度:10-15nsiv.光束直径:5μmv.总功率:100μj2)吸收材料a.超顺磁性氧化铁掺杂微珠i.直径约1um(可在100nm-10um范围内)热弛豫时间:b.黑色毛细管壁(例如,在氢气氛中由还原碱性掺杂的硅酸盐玻璃制成的铅-硅酸盐层)。腔体内的材料可以是,例如,如上所述的结合测定中使用的颗粒。因此,颗粒可以具有允许颗粒响应于力以在表面积累的性质,并且还包括电磁辐射吸收材料,例如颗粒。在各种实施方式中,在检测到表面上的信号(通过持续或重新施加力)之后,当颗粒积聚在表面时,能量被施加到颗粒,或者去除力,使得颗粒返回到样品溶液。或者,腔体包括不参与结合反应但是提供如本文所述的内容物提取的颗粒或其它材料。这些颗粒可以被功能化,使得它们独立于测定的结合反应而结合到微腔的壁上。能够使用类似的材料来涂覆或覆盖微腔,特别是高膨胀材料,例如涂料(akzonobel,sweden)。在另一个实施方式中,可以结合到阵列的一侧的粘合剂层的形式提供材料,使得每个腔体结合到膨胀层。将电磁辐射聚焦在微腔能导致电磁辐射吸收材料膨胀,这导致腔体的至少部分液体体积被排出。当材料被加热以引起腔体内容物的快速膨胀时,内容物的一部分可以膨胀到高达,例如1600倍,这导致其余内容物的剩余的一部分从腔体排出。在不发生材料或腔体内容物的快速膨胀的情况下,加热可引起内容物的蒸发,其可通过将内容物冷凝在底物上来收集。例如,底物可以是位于或邻近腔体的开口处的疏水性微柱。随着样品蒸发并冷凝在弯月面外部的毛细管壁上,内容物的排出也可发生,这导致弯月面破裂并释放毛细管的内容物。微腔可在两端打开,内容物通过静水压力保持就位。在提取过程中,可覆盖腔体的一个端部以防止内容物从腔体的错误端部排出。腔体可以与例如上述塑料膜或聚合物凝胶涂层相同的方式被覆盖。此外,膨胀材料可以作为层结合到阵列的一侧。在一些实施方式中,捕获表面包括吸湿层,腔体的内容物在该吸湿层上排出。吸湿层吸引水并防止光学表面的变形,从而允许腔体内容物的清晰成像。在某些实施方式中,层是吸湿组合物,诸如金缕梅酊剂——一种含甘油的溶液,或磷酸盐缓冲盐水与牛血清白蛋白和山梨糖醇的溶液,其浓度例如为0.1%容积体积bsa和1m山梨糖醇。该层可例如通过铺展、擦拭或喷涂施加,并且应当在表面上产生均匀的分散体。通常,该层的厚度约为10-100μm,只要该层不会使通过该层的em辐射发生变形,并且不会接触上述阵列。在另一个实施方式中,一旦一个或多个腔体的细胞内容物已被提取到捕获表面上,该表面可与培养基质接触以允许腔体内容物转移到基质中。一旦内容物已被转移到基质中,可使细胞在该基质上增殖。基质可以是允许细胞生长和复制的任何固体、半固体或凝胶型培养基(例如,琼脂糖)。可以根据需要培养培养基。捕获表面可在接触后立即去除,或者在数分钟、数小时、数天或数周内适当地去除,以确保基质中细胞培养物的存活力。或者,可以将细胞直接提取到生长基质上,假定基质具有足够的透明度,以允许提取激光穿透基质而没有足以将能量转移到如本文所述的阵列的聚焦。根据本公开的分析物的检测在一些实施方式中需要使用能够向样品施加电磁辐射的装置,特别是到诸如微阵列的腔体阵列。该装置还必须能够检测从样品,特别是样品腔体发射的电磁辐射。在一个实施方式中,所述装置的电磁辐射源是宽谱源或具有与样品中至少一个标记的波长匹配的波长的单色光源。在另一实施方式中,电磁辐射源是激光器,诸如连续波激光器。在又一个实施方式中,电磁源是固态紫外激光器。其它合适的电磁辐射源的非限制性列表包括:氩激光器、氪、氦氖、氦镉和二极管激光器。在一些实施方式中,电磁源是一个或多个连续波激光器、弧光灯或led。在一些实施方式中,所述装置包括多个(一个或多个)电磁源。在其它实施方式中,多个电磁(em)辐射源发射相同波长的电磁辐射。在其它实施例中,多个电磁源发射不同的波长以便适应可能在样品中的各种标记的不同吸收光谱。在一些实施方式中,多个电磁辐射源包括在349nm波长下工作的tritonuv激光器(二极管泵浦的q开关nd:ylf激光器,spectra-physics),聚焦光束直径为5μm,以及脉冲持续时间为20ns。仍在另外的实施方式中,多个电磁辐射源包括具有xf410qmaxfitc和xf406qmax红色滤光器组(omegaoptical)的x-cite120照明系统(exfophotonicsolutionsinc.)。在示例性实施方式中,二极管激光器是在635nm的波长下工作的峰值功率为170mw的oclarohl63133dg激光器。在另一个示例性实施方式中,二极管激光器是在450nm下工作的osrampl450b激光器。所述装置还包括检测器,其接收来自样品阵列中的标记的电磁(em)辐射。检测器能够识别发射来自一个或多个标记的电磁辐射的至少一个腔体(例如,微腔)。在一个实施方式中,检测到在暴露于电磁辐射之后由荧光标记发射的光(例如,紫外线、可见光或红外光)。检测器或多个检测器能够捕获来自荧光部分的光子爆发的振幅和持续时间,并进一步将光子爆发的振幅和持续时间转换为电信号。在一些实施方式中,检测器或多个检测器是倒置的。一旦颗粒或元素被标记以使其可检测到,或者如果颗粒具有使其可检测的固有特征,则可以使用本领域中已知的任何合适的检测机制,而不脱离本公开的范围,例如,ccd相机、视频输入模块相机、超高速扫描相机、辐射热测量计、光电二极管、光电二极管阵列、雪崩式二极管和产生顺序信号的光电倍增管及其组合。可以检测电磁辐射的不同特征,包括:发射波长、发射强度、爆发量(裂解量,burstsize)、爆发持续时间、荧光极化及其任何组合。作为一个实例,与本公开兼容的检测器是具有20x平面萤石物镜(数值孔径:0.45,cfi,wd:7.4,nikon)和orca-er冷却的ccd相机(hamamatsu)的倒置荧光显微镜。检测过程也可以是自动的,其中装置包括自动检测器,诸如激光扫描显微镜。在一些实施方式中,所公开的装置可包括至少一个检测器;在其它实施方式中,该装置可包括至少两个检测器,并且每个检测器可被选择和配置为检测由标记发射的特定波长范围下的光能。例如,可使用两个单独的检测器来检测已经用不同标记标出的颗粒,其在用电磁源激发时将发射具有不同光谱能量的光子。通过改变腔体中的弯月面的高度,从微腔阵列的腔体蒸发使得微腔的内容物的测量复杂化。特别地,如果该表面处于较低的温度,则在腔体和任何附近的表面之间发生由于腔体中的液体的蒸发而产生的质量传递。这种蒸发改变腔体中的弯月面的高度,其使细胞在腔体中的位置升高,并且可使激光提取更困难,而且还可将信号产生元素(例如,细胞、珠粒)升高到显微镜的聚焦平面之外。为了解决液体离开阵列的质量传递,微腔阵列可以邻近或位于一个或两个透明玻璃板之间,每个玻璃板的一个表面涂覆有透明导电涂层。例如,图3a示出了具有在阵列下方的单一玻璃板30的保持器20中的微细管阵列10的俯视图。为了清楚起见,未示出阵列上方的第二个板,但可能存在。可使用板上的透明涂层(未示出)来均匀地加热玻璃板以便控制它们的温度。涂层可以是,例如,在光谱的可见光区域是透明的氧化铟钛(ito)。涂层的透明度允许激发光从上方(例如,明场)或下方(例如,倒置显微镜的落射荧光)传送。经涂覆的玻璃板还允许如本文所述的捕获表面(未示出)在板之间插入,其预备用于收集从阵列的毛细管提取的内容物。捕获表面附近的板加热捕获表面以防止腔体的内容物在表面上冷凝。图3b示出了保持器20和板30的仰视图。导电条可施加到玻璃板的两个相对边缘40上的涂层。这些导电条可以是例如带有导电粘合剂的铜带、导电环氧树脂线或沉积的导电层(例如,金、银、钛等)。施加到条上的电压导致电流穿过涂层。由于涂层具有有限的电阻,电流会导致玻璃板表面的欧姆加热。如果流经板的电流是均匀的,则板上的加热应均匀。可用热电偶、热敏电阻或其它温度探头测量玻璃板表面的温度,并可使用反馈电路来稳定温度。可通过观察底部或顶部玻璃板上的冷凝和增加的温度来确定适当量的加热以消除任何冷凝。或者,可通过聚焦于腔体中的细胞或磁珠以及升高或降低的温度来测量弯月面的高度,以将弯月面降低到孔的底部。在各个方面,本公开涉及用于检测、识别和/或表征目标分析物或目标细胞过程的试剂盒。在一些实施方式中,除了检测试剂和缓冲液之外,试剂盒含有对分析物特异性的抗体,诸如目标蛋白质。在其它实施方式中,试剂盒含有用于检测mrna或cdna的特异性的试剂(例如,寡核苷酸探针或引物)。在各种实施方式中,试剂盒包含进行检测测定所必需的所有组分,包括所有对照物、用于进行测定的说明、以及用于分析和呈现m磁性颗粒的任何必需的软件,试剂盒中提供的m磁性颗粒可用分析物的结合配偶体功能化。标记可以与分析物或其它样品组分的结合配偶体缀合。试剂盒还可包括第二、第三或第四(等待)组颗粒,其被功能化以结合样品中的第二、第三或第四分析物等,或预备用于阵列的微腔之间样品组分的归一化。用于防止通过光或其它不利条件下的试剂降解的稳定剂(例如,抗氧化剂)也可以是试剂盒的一部分。尽管说明材料通常包括书面材料或印刷材料,但不限于此。本公开考虑了任何能够存储这些说明并将其传递给终端用户的媒质。这种媒质包括但不限于电子存储媒质(例如,磁盘、磁带、磁片盒、芯片),光学媒质(例如,cdrom)等。这样的媒质可以包括提供这种说明材料的互联网站的地址。在一个实施方式中,本公开涉及包括识别新的治疗药物的方法。例如,可针对分泌或表面展示各种疑似对结合配偶体具有亲和力的化合物的多种细胞筛选已知参与疾病状况的药物结合配偶体(例如,抗体、生物受体和/或酶)。包含展示或分泌具有最高结合亲和力的化合物的细胞的微腔能够用合适的报告系统识别。已识别的微腔内容物能够被提取并用于后续的发展。在另一个实施方式中,细胞存活力或相互作用可以在化合物诸如治疗化合物的存在下进行筛选。可以进一步分析在化合物存在下在目标活性存在的情况下具有存活力的细胞。在一个实施方式中,本公开涉及确定抗原-抗体结合的方法,使得每个细胞产生抗体并将抗体分泌到微腔中。抗体可以是重组抗体和/或单克隆抗体。细胞或多个细胞可产生多于一种抗体或相同抗体的多拷贝。在一个实施方式中,本公开考虑包括识别诊断抗体的方法。例如,可筛选出分泌疑似对结合配偶体具有亲和力的各种抗体的多个细胞的已知参与疾病状况的结合配偶体(即,例如,抗原和/或表位)。能用合适的报告系统识别包含展示或分泌具有最高结合亲和力的化合物的细胞的微腔。在一个实施方式中,本公开涉及包括识别蛋白质-蛋白质相互作用的方法。针对结合配偶体,可筛选出多个分泌或表面展示疑似对已知参与疾病状况的结合配偶体(即,例如,蛋白质和/或肽)具有亲合力的各种蛋白质和/或肽的细胞。包含展示和分泌具有最高结合亲和力的化合物的细胞的微腔能用合适的报告系统(reportersystem)识别。作为实例,本公开涉及识别临床靶标生长停滞特异性6(gas6)的蛋白质结合体的方法,gas6结合ax1受体酪氨酸激酶并介导免疫功能、血液凝固和肿瘤细胞侵袭以及转移。根据该方法,可筛选酵母展示的单链可变片段(scfv)的天然库,以鉴定以高亲和力结合gas6的变体。在一个实施方式中,本公开涉及包括识别蛋白质-核酸相互作用的方法。针对分泌或表面展示疑似对结合配偶体具有亲和力的各种蛋白质和/或肽能够筛选核酸,后者为已知参与疾病状况的结合配偶体(例如,脱氧核糖核酸和/或核糖核酸和/或somamer和/或适体)。包含展示和分泌具有最高结合亲和力的化合物的细胞的微腔能用合适的报告系统识别。在一个实施方式中,本公开涉及包括识别蛋白质-碳水化合物相互作用的方法。针对分泌或表面展示疑似对结合配偶体具有亲和力的各种凝集素、蛋白质和/或肽的多种细胞能够筛选碳水化合物,后者为已知参与疾病状态的结合配偶体(即例如寡糖和脂糖或蛋白糖)。包含展示或分泌具有最高结合亲和力的化合物的细胞的微腔可用合适的报告系统识别。在一个实施方式中,所公开的方法用于检测蛋白质分析物或具有所需特征(例如,荧光)的蛋白质。特定分析物蛋白质的检测可直接在阵列的腔体中进行。生物化学传感可使用标准检测技术完成,该技术包括夹心免疫测定或类似的结合或杂交反应。例如,本公开涉及一种用于改造在荧光蛋白质中的目标性质的方法。目标性质可以是发射光谱或发射强度、斯托克斯偏移和吸收光谱或吸收强度中的至少一个。在一个特定的实例中,本发明的方法可用于筛选表达具有特定的荧光吸收光谱、发射光谱和/或消光系数的蛋白质的细胞库。在一个特定的实施方式中,蛋白质是二聚化依赖性橙色荧光蛋白(ddofp),其具有至少一个图17中鉴定的突变。在某些实施方式中,本公开提供了用于进行酶活性的高通量分析的方法和装置。在一个方面,所述实施方式提供了测定添加到微腔阵列中的酶的动力学的方法。例如,将编码多种酶变体的基因导入添加到微腔阵列中的细胞,并在其中表达。还提供了用于酶的底物,其中微腔中酶的活性可通过检测(直接或间接经由偶联测定)从每个孔的产物的形成或底物的消耗随时间来监测。在一些实施方式中,选择具有特定的动力学性质的酶变体,从微腔阵列中提取,并将其分离用于随后的分析、扩展和任选的其它选择步骤。可以在微腔中温育之前或期间加入酶活性的调节剂,以对特定的酶活性施加选择压力。因此,本公开的实施方式可用于鉴定对调节剂表现出抗性或受其刺激的酶变体。在一个实例中,本公开涉及一种用于测量由细胞库产生的蛋白质酶库成员的酶动力学的方法,该细胞库具有用于产生蛋白酶的突变形式的多种基因型。该方法包括用细胞库装载微腔阵列,并且在允许产生目标酶的条件下,在蛋白酶底物的存在下温育阵列。阵列可以以选定的间隔成像,以提供酶活性的时间分辨分析。可根据被分析的酶和底物系统来选择时间段。例如,时间段可以是秒钟、分钟或小时,并且可以以任何数量的间隔测量来自阵列的一个或多个腔体的信号;例如2、3、4、5、6、7、8、9、10、15、20、40、60、80或100个间隔。在特定的实例中,酶是碱性磷酸酶(ap),而调节剂是抑制ap活性的无机磷酸盐。根据本公开的方法,可通过将细胞装载到阵列中并在无机磷酸盐存在下筛选ap活性的微腔来筛选表达ap变体的细胞库。根据本公开的方法鉴定的ap变体具有以下突变中的至少一个:d101g、i16v、n145i、d294g、n197s、t148p和s175r。特别地,变体可以是d101g,或者可以是i16v-n145i-d294g和n197s-t148p-s175r中的一种。此外,ap变体的其余部分可以与野生型ap至少90、91、92、93、94、95、96、97、98或99%相同。已知d101位置对于将与磷酸根离子配位的r166残基定位在ap活性位点内是重要的。因此,在本公开的方法中未披露的d101g突变可能改变r166的定位,这会降低酶对无机磷酸盐的亲和力。在一个实施方式中,分析物是核酸。例如,可通过任何合适的方法测量dna或mrna表达。例如,rna表达通过特异性结构的酶切割检测(测定,thirdwavetechnologies;参见例如第5,846,717、6,090,543;6,001,567;5,985,557和5,994,069号美国专利;其中每一个都通过引用并入本文)。通过使用结构特异性酶切割经由重叠寡核苷酸探针杂交形成的复合物,测定法检测特异性核酸(例如,rna)序列。在另一实施方式中,通过与寡核苷酸探针杂交来检测rna(或相应的cdna)。使用用于杂交和检测的各种技术的各种杂交测定是可用的(例如,测定,pebiosystems,fostercitymcalif;参见例如第5,962,233和5,538,848号美国专利,其中每一种通过引用并入本文)。此外,逆转录酶pcr(rt-pcr)可用于检测rna的表达。例如,具有竞争性模板方法的标准化混合物的定量逆转录酶pcr在第5,639,606、5,643,765和5,876,978号美国专利(其各自通过引用并入本文)中描述。本文公开的检测可用于分离任何类型的生物细胞,包括但不限于表达或产生蛋白质、碳水化合物、酶、肽、激素、受体的细胞系;产生抗体的其它细胞系;基因工程细胞;和/或活化的细胞。此外,本公开可用于筛选各种生物学活性,包括但不限于表面受体蛋白的表达、酶生产和肽生产。此外,本公开可用于筛选各种测试剂以确定测试剂对所需生物活性的影响。本领域技术人员将容易地意识到筛选期望被分离和筛选的其它类型的细胞、期望被检测的其它类型的生物活性和待筛选的特定测试剂。生物细胞是转化的生物细胞。可通过任何已知的方法,使用任何已知的载体,诸如质粒或病毒,进行细胞的转化。生物细胞可以是微生物、真菌、哺乳动物、昆虫或动物细胞。微生物细胞可以是细菌细胞,诸如大肠杆菌细胞。在一个实施方式中,动物细胞包括罕见的生物化学化合物。在一个实施方式中,该罕见的生化化合物选自蛋白质、肽、激素、核酸、碳水化合物。在另一个实施方式中,生物细胞产生和/或表达荧光蛋白。在又一实施方式中,生物细胞产生与荧光蛋白(例如,gfp)融合的蛋白质。因此,本公开的实施方式涉及用于筛选具有多种基因型的细胞库以获得具有用于产生目标分子的目标表型的细胞的方法。该方法包括用细胞库装载微腔阵列,并在允许产生目标分子的条件下温育阵列。可对阵列进行成像,以识别包含具有目标表型的细胞的一个或多个腔体。可通过将来自脉冲二极管激光器的电磁辐射引导至与腔体相关联的辐射吸收材料处来提取腔体的内容物。在一些实施方式中,样品液体中的细胞数导致每个腔体中不同的细胞种群。在提取和扩展特定腔体的内容物之后,可在随后的步骤中筛选所得的种群以识别感兴趣的特定细胞。图4和图5示出了在阵列的腔体提取之前和之后示例性阵列的之前和之后的荧光和明场图像。白色箭头表示提取前和提取后相同的腔体。如图5所示,腔体的提取产生来自单一腔体的两个目标细胞。在其它实施方式中,样品液体中的细胞数小于阵列中腔体的数量,导致在每个腔体中仅装载一个或更少的细胞。因此,从每个腔体具有多于一个细胞的初次筛选中提取的腔体中的内容物,随后在腔体内容物扩展并且以低浓度装载到阵列上之后筛选腔体内容物可识别来自大量不同细胞种群的具有目标表型的单细胞。此外,库可通过以下方式富集:(1)从包含目标表型的基因的细胞中提取dna,(2)在向基因中引入随机突变的条件下扩增dna;(3)创建包含扩增的dna的第二代细胞库,和(4)用第二代库重复上述步骤。在库的初次筛选或富集过程中,可将多个细胞添加到任何特定的腔体中。可根据本公开的方法提取细胞内容物并进一步分析或富集细胞内容物。最终,每个腔体具有一个细胞允许鉴定特定的基因型。提取可以谨慎地将电磁辐射引导至含有产生具有目标表型的蛋白质的细胞的腔体,其中在提取之前将电磁辐射引导至腔体不加热液体。在该方法的各个方面,目标表型是细胞表面结合剂。在另一方面,目标表型是具有目标吸收或发射强度、目标吸收或发射光谱以及目标斯托克斯位移中的至少一种的荧光蛋白质。并且,目标表型可以是具有酶活性的蛋白质、缺乏酶活性抑制的蛋白质、以及在酶抑制剂存在下具有活性的蛋白质的生产。本公开的某些实施方式提供了用于一种或多种生物元素的生长的方法和装置。在一些实施方式中,将适于生长的培养基中的细胞引入至阵列的微腔。然后将阵列在支持细胞生长的条件下温育,例如,在合适的温度、湿度和气氛气体组成下。在一些实施方式中,处理微腔阵列的表面以支持添加到阵列中的细胞的生长。颗粒在各种实施方式中,阵列的腔体装载有作为支持结合反应的固体表面和/或作为有助于提取腔体内容物的能量吸收材料的颗粒。合适的颗粒容易地商购获得,且可根据本文公开的方法使用各种各样的颗粒。在各种实施方式中,颗粒是部分或完全不透明的。在某些实施方式中,颗粒吸收电磁辐射,例如,颗粒的吸收效率为至少约10%,例如,25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100%。在各种实施方式中,颗粒的尺寸范围从纳米级至腔体的横截面尺寸的约三分之一。例如,当微腔直径约为20微米时,颗粒的直径可以为约0.01至7微米。在其它实施方式中,取决于所用腔体的尺寸,粒径范围为约0.01微米至约50微米。在各种实施方式中,颗粒的尺寸范围为约0.1至15微米、约0.5至10微米和约1至约5微米。在某些实施方式中,颗粒包含金属或碳。合适金属的非限制性实例包括金、银和铜。其它金属材料适用于如本领域技术人员所熟知的结合和检测测定。在一个实施方式中,颗粒是磁性的,使得磁力可以用于在每个反应腔体的表面聚集颗粒,例如,在第2014/011690号美国专利公开中描述的微腔的弯月面,其全部内容通过引用并入本文。在本公开的一些方面,颗粒的表面化学可以是功能化的以预备用于与样品组分结合,如本领域技术人员所熟知的。例如,颗粒与链霉抗生物素蛋白、生物素、寡聚(dt)、蛋白a和g、靶标蛋白质和/或任何其它连接体多肽偶联。链霉抗生物素蛋白-生物素相互作用的非常高的结合亲和力被用于广泛的应用中。链霉抗生物素蛋白涂覆的颗粒将结合生物素化的核酸、抗体或其它生物素化的配体和靶标。生物素化的抗原也是可以连接到颗粒上用于筛选分析物的试剂的有用实例。在具体的实施方式中,颗粒是与几种不同配体偶联的颗粒(invitrogen,carlsbad,ca)。例如,寡聚(dt)、蛋白a和蛋白g、靶标蛋白质(his、flag)、二级抗体和/或链霉抗生物素蛋白。(partno.112-05d,invitrogen,carlsbad,ca)。在一些实施方式中,可使用具有不同磁介电常数的颗粒来提供作用在颗粒上的磁力的独立控制。在其它实施方案中,可以使用颗粒的其它性质来扩展在每个腔体中完成的测定的多重能力。当添加到样品中时,颗粒结合到所需的靶标(细胞、致病微生物、核酸、肽、蛋白质或蛋白质复合物等)。这种相互作用取决于在颗粒表面的配体的特异性亲和力。或者,可将与酶底物缀合的颗粒添加到样品中,其中样品中的酶/分析物猝灭底物发荧光的能力或激活待荧光的底物(例如,酶介导的底物切割)。另一实施方式使用具有不同形状、密度、尺寸、电荷、磁介电常数或光学涂层的磁性颗粒。这允许将不同的探针(即,结合配偶体)放置在不同的颗粒上,且可以通过调节磁场或其它力如何以及何时施加而分别探测颗粒。也可使用沉降速率依照尺寸、形状和密度来分离颗粒,并扩展在每个腔体中完成的测定的多重能力。在一示例性实施方式中,颗粒包含平均直径约1微米(例如,约100nm至约10微米)的超顺磁性氧化铁掺杂微珠。在某些实施方式中,颗粒用于混合腔体的内容物。例如,磁性颗粒在温育步骤期间经受交替或间歇的磁场。颗粒的移动和沉降导致反应腔体的内容物的混合。可以使用对待检测的分子(例如,标记物)形式具有必需特异性的任何合适的结合配偶体。如果分子,例如标记物,具有几种不同的形式,结合配偶体的各种特异性是可能的。合适的结合配偶体是本领域已知的,并且包括抗体、适体、凝集素和受体。有用和通用型的结合配偶体是抗体。用于检测本文公开的样品中的分析物的方法允许同时测试每孔的两种或更多种不同的抗原。因此,在一些实施方式中,同时的阳性和阴性筛选能够发生在相同的孔中。这种筛选设计提高了初次命中的选择性。在某些实施方式中,所测试的第二抗原可以是对照抗原。对照抗原的使用可用于在阵列中的各种腔体上标准化生物元素浓度。非限制性实例将使用对目标分析物具有特异性的第一抗原,以及对所有蛋白质(诸如n-或c-末端表位标签)具有非特异性的第二抗原。因此,能够通过将信号与总蛋白质浓度进行比较来定量目标腔体的结果。在一些实施方式中,第二抗原与不同于第一颗粒的第二颗粒缔合。颗粒能够改变以下特性中的至少一种:形状、尺寸、密度、磁介电常数、电荷和光学涂层。因此,由于样品中存在或不存在第二分析物,第二标记可与第二颗粒缔合,并使用如下所述的动力进行加工。在另一个实施方式中,颗粒非特异性地结合样品组分。例如,可将颗粒功能化以非特异性地结合样品中的所有蛋白质,这允许在阵列中的样品间归一化蛋白质含量。抗体本文所用的术语“抗体”是宽泛的术语,并且以其常规含义使用,包括但不限于指天然存在的抗体以及非天然存在的抗体,包括例如,单链抗体,嵌合、双功能和人源化抗体,以及其抗原结合片段。应当理解,产生抗体的分子的表位或区域的选择将决定其例如对于各种形式的分子,如果存在,或者对于总体(例如,全部或基本上全部的分子)的特异性。生产抗体的方法是公识的。本领域技术人员将认识到许多方法可用于生产抗体,例如,如在antibodies,alaboratorymanual,edharlowanddavidlane,coldspringharborlaboratory(1988),coldspringharbor,n.y.中所述的。本领域技术人员还将理解,模拟抗体的结合片段或fab片段可通过各种方法从基因信息制备(antibodyengineering:apracticalapproach(borrebaeck,c,ed.),1995,oxforduniversitypress,oxford;j.immunol.149,3914-3920(1992))。分子的单克隆和多克隆抗体,例如,蛋白质和标记物,也可商购(randdsystems,minneapolis,minn.;hytestltd.,turk,finland;abeaminc.,cambridge,mass.,usa,lifediagnostics,inc.,westchester,pa.,usa;fitzgeraldindustriesinternational,inc.,concord,mass.,usa;biospacific,emeryville,calif)。在一些实施方式中,抗体是多克隆抗体。在其它实施方式中,抗体是单克隆抗体。捕获结合配偶体和检测结合配偶体对,例如,捕获和检测抗体对,可用于本公开的实施方式中。因此,在一些实施方式中,使用异构测定方案,其中通常使用两个结合配偶体,例如,两种抗体。一个结合配偶体是通常固定在颗粒上的捕获配偶体,另一个结合配偶体是检测结合配偶体,通常具有附着的可检测标记。这样的抗体对可以从若干商业来源获得,诸如biospacific,emeryville,calif。也可通过本领域熟知的方法设计和制备抗体对。在特定的实施方式中,抗体是生物素化的或生物素标记的。在一个实施方式中,存在非特异性地结合目标分析物的所有成员的第二成像组分。因此,可读取该信号以归一化从腔体到孔的荧光量。一个实例是在n-或c-末端表位标签处结合所有蛋白质的抗体。标记物可用于标记结合配偶体以使其能够在颗粒混合物中检测或识别的几种策略是本领域公知的。标记物可以通过任何已知的方式连接,包括利用非特异性或特异性相互作用的方法。此外,标记物可以直接或通过结合配偶体实现。来自部分(moiety)的发射(例如,荧光)应足以允许使用本文所述的检测器进行检测。通常,本公开的组合物和方法利用高度荧光的部分,例如,当在该部分的激发波长处被电磁辐射源刺激时能够发射电磁辐射的部分。若干部分适用于本公开的组合物和方法。通过电磁辐射以外的能量可激活的标记物在本公开中也是有用的。这样的标记物可通过例如电、热或化学反应(例如,化学发光标记物)来激活。而且,许多酶促活化的标记物是本领域技术人员公知的。通常,该部分的荧光涉及量子效率和缺乏光漂白的组合,其足以使该部分在所公开的检测器中高于背景水平检测到,且具有测定的所需检测限度、精确度和准确度所必需的一致性。此外,所述部分具有与其在选择的测定中的用途一致的性质。在一些实施方式中,所述测定是免疫测定,其中荧光部分连接于抗体;所述部分必须具有使其不与其它抗体或蛋白质聚集的性质,或者不经历与测定所需的精确度和准确度一致的聚集。在一些实施方式中,荧光部分染色分子,其具有以下的组合:1)高吸收系数;2)高量子产率;3)高光稳定性(低光漂白);和4)与所标记的目标分子(例如,蛋白质)的相容性,以便其可利用本公开的分析仪和系统(例如,不引起目标蛋白质的沉淀或该部分已经连接的蛋白质的沉淀)进行分析。荧光部分可以包括单个实体(量子点或荧光分子)或多个实体(例如,多个荧光分子)。应当理解,当本文使用的术语“部分(moiety)”是指一组荧光实体,例如多个荧光染料分子,每个单独的实体可以单独地连接到结合配偶体,或者这些实体可以连接在一起,只要所述实体作为一组提供足够的荧光来检测。在一些实施方式中,荧光染料分子包含至少一个取代的吲哚(indolium)环体系,其中吲哚环的3-碳上的取代基含有化学活性基团或共轭物质。实例包括alexafluor分子。在一些实施方式中,标记物包含第一类型和第二类型的标记物,诸如两种不同的alexa染料(invitrogen),其中第一类型和第二类型的染料分子具有不同的发射光谱。用于荧光部分的有用荧光实体的非包含性列表包括:alexa488、alexa532、alexa555、alexa647、alexa700、alexa750、荧光素、b-藻红蛋白、别藻蓝蛋白、pbxl-3、atto590和qdot605。标记物可以通过本领域已知的任何方法连接至颗粒或结合配偶体,包括吸收、共价结合、生物素/链霉抗生物素蛋白或其它结合对。此外,标记物可以通过连接体连接。在一些实施方式中,标记物被分析物切割,从而从颗粒释放标记物。或者,分析物可以防止连接体的切断。实施例实施例1:微阵列单细胞分析和激光提取图6a-6d描述了本公开的一个方面(本文称为“μscale”)的微阵列的总体概念和工作流程。图6a示出了平台工作流程。1)在细菌或酵母细胞中表达的蛋白质变体库与不透明的磁珠混合。2)将混合物以一浓度移入阵列中,该浓度导致微腔内的平均单细胞占有率。进行各种生物化学测定,有或没有细胞生长,使用荧光作为读数。3)阵列经由荧光显微镜成像。4)定量每个微腔的荧光强度,并使用基于激光的提取方法从阵列中分离所需的克隆,作为单细胞或批量池(bulkpool)。5)使提取的细胞在液体或固体培养基中培养。6)裂解细胞,回收质粒用于表征和/或是生成新库以进行附加轮次的进化。图6b示出了基于激光的提取方法的图示。为了提取目标微腔,定位和脉冲激光,破坏微腔的表面张力并将其内容物排空到阵列下方的捕获表面上。图6c示出了装载有荧光颗粒的两个相邻微腔的提取。在左图中,要提取的第一和第二微腔分别用深色或浅色圈画出。第二个图显示了成功提取第一个微腔,而不会干扰相邻微腔(由深色箭头指示)。第三个图示出了阵列下方的捕获表面上的分离颗粒。最后一个图显示了第二次成功的微腔提取(由浅色箭头指示)。图6d示出了在μscale平台中进行的三种不同测定的图示。左,用荧光抗体预染色的酵母表面展示的scfv库的结合相互作用。中,在微腔内培养的大肠杆菌克隆中表达的荧光蛋白变体。右,将底物转化为荧光产物的酵母表面展示的酶变体库的实时动力学测量。数百万个空间分离制造的高纵横比(1mm厚,10微米或20微米直径)的微腔的致密玻璃-底物阵列装载有与磁性颗粒混合的细胞悬浮液。将悬浮液施加到阵列的顶部并通过毛细作用填充微腔。微腔阵列在底部开封;液体样品通过表面张力保持在适当位置。填充过程的被动特性导致整个阵列的均匀弯月面水平。除其它优点之外,这种均匀性与装载的细胞的重力沉降相结合简化了成像焦点平面的建立,而不需要自动聚焦。每个微腔可按照泊松分布理论用单一细胞或颗粒装载,如图1所示。将荧光珠以三个浓度装载到阵列中,该三个浓度对应于每个腔3、1和1/3个颗粒的平均值(λ=3、1、1/3)。计数大约25,000个腔体的内容物,并且将每个条件的累积分布函数(cdf)以红线绘图。与泊松分布的最大似然拟合(λ=0.79、0.43和0.15)重叠于数据之上,为黑线。尽管分布密切遵循泊松统计,然而观察到的平均值和预期的平均值相差2-3倍。这种差异可能源于微腔的高纵横比;一些颗粒可能不会总是进入成像平面。脉冲uv激光与磁性颗粒相互作用以破坏单个微腔内的表面张力而不影响其最近邻(图6b和6c)。激光提取将微腔的内容物排空到阵列下方的捕获表面,其可成像以确认提取并进行额外的形态学研究。为了精化提取技术,激光强度是变化的,且滴定磁珠浓度以建立一系列实现完全提取效率的条件,如图7所示。对于每次提取,激光捕获显微解剖(lcm)显微镜的triton切割激光器在一系列不同激光功率(范围为激光制造商设定的最大电流的5%-20%)下脉冲10毫秒。对每种条件进行30次提取。误差条图代表每个条件的二项式采样误差。在下列实验中提取的细胞的存活力在表4中示出。表4可开发在阵列的腔体内进行各种生物化学测定方法。例如,将表达目标蛋白质的细胞装载到微腔阵列中,微腔阵列可以保持在潮湿的环境中,以允许在几天内进行时间分辨的实验测量或细胞扩展。根据定量宽视野显微镜的既定准则,测量从阵列检测到的荧光信号的毛细管间变化性,并发现其与其他高通量方法相当。在μsacle和guavaeasycyte流式细胞仪(millipore)(n=10,000)上分析荧光珠(sphero,fp-4052-2,spherotech)。对于μsacle测量,将荧光珠装载到不含磁性颗粒的20微米微腔阵列中。通过其各自分布的平均值归一化两个种群。通过流式细胞术和μscale分析的珠荧光的变化系数分别为0.15和0.14。为了覆盖整个微腔阵列,阵列以大约10,000微腔/秒的速率在多个位置和多个波长处成像。使用标准图像处理功能分析所得到的图像。由于细胞以高分辨率成像,有希望的候选物能够经由量化度量(大小、圆度和荧光强度)或目视检查来区别于细胞碎片和其它假荧光信号。使用采用落射光配置的带通滤波的高强度弧光灯照明的高数值孔径显微镜物镜对微腔进行成像。使用高灵敏度、冷却的ccd相机通过高通滤波器检测荧光发射。开发了一种算法,以大约10,000微腔/秒的速率对多个波长下的荧光发射进行成像和分析。然后可以通过如本文所述的激光提取(称为单细胞提取)来回收目标的单细胞,或者可使用用户选择的标准来指定待要提取的细胞种群(称为批量提取),采用批量选择方法。微粒对荧光强度的影响。磁性微粒可能是不透明的,并赋予细胞悬浮液棕色。为了确定磁珠对荧光强度和明场成像的影响,在存在和不存在用于提取的磁性颗粒(n=10,000)的情况下,在μscale上分析荧光珠(sphero,fp-4052-2,spherotech)。如图8所示,图a,归一化“带珠”种群的平均值为0.83,表明磁珠部分阻塞微腔的荧光强度。具有和不具有磁性颗粒的荧光珠分布的变化系数分别为0.2和0.14,表明使用磁珠进行提取并不显著增加μscale上荧光测量的变化性。图8的图b示出了磁珠的存在降低了荧光强度并遮蔽了明场图像。这些微粒的添加在有限程度上均匀地遮挡了荧光信号,并且防止了微腔内容物的明场成像。图9示出了围绕自动倒置荧光显微镜和电磁辐射源(诸如uv激光器或二极管激光器)并入的示例性平台。示例性仪器具有明场和荧光成像功能。3轴平台允许激光器与所需微腔的快速对准。可用具有适当荧光照明系统和激光源的多种自动倒置显微镜来重新构建类似的配置。将样品(由黑色箭头表示的珠粒赋予的棕色)装载到微腔阵列中并放入保持器中,然后使用仪器进行分析。提取盖玻片放置在保持器下方进行样品回收。微阵列实验可以使用适用于硬件和软件修改的veritas激光捕获显微解剖(lcm)显微镜(arcturus)进行,以实现微腔的筛选应用。在一个实施方式中,该系统包含具有电动级的倒置荧光显微镜和tritonuv激光器(二极管泵浦q开关nd:ylf激光器,spectra-physics)。激光系统使用的波长为349nm,聚焦光束直径为5微米,脉冲持续时间为20纳秒。对于荧光成像,使用120照明系统(exfophotonicsolutionsinc.)以及xf410qmaxfitc和xf406qmax红色滤光镜组(omegaoptical)。使用orca-r2冷却ccd相机(hamamatsu),以20x平面萤石物镜(数值孔径:0.45,cfi,wd:7.4,nikon)获得所有图像。开发了控制lcm显微镜和激光以及用于自动图像定量微腔的软件。该软件套件自动扫描阵列,获取每个微腔的多色荧光和明场图像。为了量化每个微腔,使用otsu的方法进行图像分割,以划定所选择的彩色图像的阈值,从而创建二进制掩模。该二进制掩模用于量化每个目标区域的荧光强度。一旦所需的微腔被鉴定出,该软件允许用户以两种不同的方式回收细胞:单细胞分选和集中分选(pooledsorting)。在单细胞分选中,软件返回到选定的微腔,允许用户进行进一步的检查并将所需细胞提取到无菌捕获表面上,导致分隔的克隆种群。在集中分选中,建立了分选门,且软件自动将任意指定的微腔的内容物提取到单个捕获表面上,创建了富集细胞的种群。微腔阵列制备、装载和提取。将来自incom,inc.(10和20微米腔体直径,1mm厚)的微腔阵列在乙醇中灭菌并干燥。用特斯拉线圈(bd-20acelectro-technicproducts)电晕处理阵列的负载侧1分钟以生成亲水表面,这有利于装载。在装载侧,将一片透明的包装带施加到腔体的开口的顶部并使之平整。将阵列倒置,并通过将少量的防水剂施加到一次性毛巾上并使其风干1分钟,用该毛巾涂覆防水剂。然后将毛巾用于抛光阵列表面上的腔体的开口。除去粘合带,并将特斯拉处理重新施加于阵列的装载侧。为了实现含有单细胞的孔的最大分数,根据泊松统计(在20μm阵列中约3,200细胞/μl和在10μm阵列中约12,800个细胞/μl),在装载之前将细胞悬浮液稀释。每个蛋白质工程应用的具体负载条件在随后的实施例中描述。简言之,将细胞悬浮液与磁珠(lifetechnologies,37002d)混合至10mg/ml的最终珠粒浓度并移入阵列中。将1%重量/体积的琼脂糖的约2毫米板重叠在阵列上以防止蒸发。使用lcm系统中的tritonuv激光器提取所需腔体的内容物。如图7所示,调整激光功率,使得单个脉冲的提取效率为100%。在这里描述的示例性实施方式中,提取参数包括以下内容:激光器操作18±2ms(n=5次测量),在2.5khz传送脉冲串,且总能量为大约100μj。将腔体内容物提取到玻璃盖玻片上,然后将其置于酵母或细菌生长培养基(液体培养基或琼脂平板)中以繁殖所提取的细胞。在每个实验之后,通过用强力的蒸馏水流除去其内容物来清洗阵列,然后在1mnaoh中短暂超声处理并保存在100%乙醇中。实施例2:蛋白质结合相互作用的高通量筛选axligi模拟库筛选。将编码人类axlig1(氨基酸ala19-pro131)和非结合ax1变体(e59r,t77r)的dna克隆到nhei和bamhi限制性位点之间的pct酵母展示质粒中(kariolis,m.s.etal.,nat.chem.biol.1-10(2014))。通过电穿孔将质粒dna转化到酿酒酵母菌株eby100中进行酵母表面展示研究。可溶性gas6用freestylemax293expressionsystem(invitrogen)在人胚胎肾(hek)细胞中重组表达,并如前所述(kariolis,m.s.etal,nat.chem.biol.1-10(2014))纯化。先前描述了酵母表面展示的天然scfv库(个变体)(deventer,j.a.van&wittrup,k.d.,yeastsurfacedisplayforantibodyisolation:libraryconstruction,libraryscreening,andaffinitymaturation.1131,151-181(humanapress,2014))。将含有pct展示质粒的所有酵母细胞在选择性培养基中培养并如前所述诱导(chao,g.etal,nat.protoc.1,755-68(2006))。对于ax1ig1模拟库,展示野生型和非结合性ax1变体的诱导酵母细胞以确定的细胞比例混合,1野生型:10个非结合性,1:100,1:1,000,1:10,000和1:100,000。将大约(3-6×106)个酵母细胞(取决于模拟库)在室温下用含1mg/mlbsa的磷酸盐缓冲盐水(pbsa)中的1nm纯化的生长停滞特异性蛋白6(gas6)温育6小时。用gas6温育后,将酵母洗涤并在含1:250稀释的鸡抗-c-myc抗体(250;lifetechnologies,a21281)的pbsa中在4℃下重悬浮45分钟。为了检测gas6结合,将酵母洗涤并在含1:100稀释的小鼠抗hisigghilytefluor555(anaspec,61250-h555)的pbsa中在4℃下重新悬浮45分钟。为了增强结合信号,将酵母洗涤并重悬浮于pbsa中,然后在4℃下加入1:100稀释的山羊抗小鼠igghilytefluor555(anaspec,as-28175-05-h555)30分钟。最后,为了检测c-myc表达,将酵母洗涤并在含1:100稀释的抗山羊抗鸡iggalexafluor488(lifetechnologies,al1039)的pbsa中在4℃下重悬浮30分钟。将标记的酵母稀释至约12800细胞/μl,装载在10μm阵列上,并用475/40nm激发/510nm长通路发射滤光片分析gas6结合以及用525/45nm激发/565nm长通路发射滤光片分析c-myc细胞表面表达。经由单细胞分选提取野生型酵母或非结合性变体,并在sd-caa琼脂平板上培养。为了鉴定所提取的细胞,使用zymoprep试剂盒(zymoresearchcorporation)回收质粒dna,通过pcr扩增,并通过sanger测序(sequetech)进行测序。表5示出了由野生型(wt)和非结合ax1克隆组成的模拟库的富集比率。进行了一系列模拟库提取,以量化分选效率。富集比率定义为:其中η是富集比率,n+,0是野生型细胞的初始数,n+,1是分选后的野生型细胞数,n-,0和n-,x分别是非结合细胞的等效值。表5μscale区分在其表面上展示野生型或非结合性ax1受体结构域的酵母(kariolis,m.s.etal,nat.chem.biol.10,977-83(2014))。图10a示出了两参数散点图(左),其中每个点表示一微腔,以及野生型axl种群(r)和非结合性ax1变体种群(b)的显微镜图像(右)。创建并筛选野生型:非结合性克隆比例跨越1:10至1:100,000的酵母展示的ax1变体的模拟库。通过用于ax1表达(通过针对c末端c-myc表位标签的抗体测量)和gas6结合(如针对gas6上的六组氨酸标签通过抗体所测量的)的双色荧光分析来分析酵母。对于每个模拟库,从阵列中提取、培养并通过dna回收和测序认定数种单独的酵母细胞,其展示出表达野生型ax1或非结合性ax1变体的细胞的预测荧光强度。图10b示出了代表性模拟库筛选(野生型:非结合性变体比例=1:10,000)的散点图。所提取的腔体经鉴定为野生型axl(灰色轮廓点)和非结合性axl变体(黑点)。图11示出了ax1野生型:非结合性之比呈现为1:1(a)、1:10(b)、1:100(c)、1:1,000(d)、1:10,000(e)和1:100,000(f)。所提取的腔体被指示为红点(鉴定为野生型)和蓝点(鉴定为非结合性突变体)。所有受体结合性(野生型)提取物落入散点的封闭区域内,以及除了一个非结合性突变体外的所有非结合性突变体都落在封闭区域外(单封闭非结合体由左下图中的箭头表示(1:1000野生型:非结合性比率))。在六个模拟库中,39个提取中的37个被正确地鉴定为野生型ax1,在最严格的条件下达到100,001的富集比(表4),该值与基于乳状液的筛选方法相比有利(参见,例如zinchenko,a.etal.,anal.chem.86,2526-33(2014);fischlechner,m.etal.,nat.chem.6,791-796(2014))。另外,选择为非粘合体的所有19个提取被鉴定为非结合性的ax1变体。因此,这些模拟库筛选验证了μscale能够区分表达配体结合的蛋白变体的细胞的能力,特别是在大量非功能性克隆种群中的稀有功能性克隆。scfv天然库筛选。应用μscale平台来筛选酵母展示的单链可变片段的天然库以识别以高亲和力结合gas6的变体。生长酵母展示的scfv库并诱导其用于如前所述的表达(deventer,j.a.van&wittrup,k.d.,yeastsurfacedisplayforantibodyisolation:libraryconstruction,libraryscreening,andaffinitymaturation.1131,151-181(humanapress,2014))。在μscale筛选之前,库经历两轮磁激活细胞分选(macs)以减少理论多样性:对不结合his标签分离珠的细胞的负选择(10103d,lifetechnologies)和对结合gas6涂覆磁珠的细胞的正选择。两种分选根据制造商的说明(his-tagisolation&pulldownprotocol方案)进行,并在先前描述的分选后建立模型(chao,g.etal.,nat.protoc.1,755-68(2006))。通过用饱和量的his标记的gas6在旋转器上在4℃下温育2小时,制备gas6涂覆的磁珠(4mg)。使用的磁性支架(mpc-s,dynal),利用结合/洗涤缓冲液(50mm磷酸钠(ph8.0)、300mmnacl和0.01%tween-20水溶液),洗涤这些珠粒,以除去未缀合的gas6。对于分类1,用pull-down缓冲液(3.25mm磷酸钠(ph7.4)、70mmnacl和0.01%tween-20水溶液)洗涤8×109个酵母细胞,并用未涂覆的his标签在pull-down缓冲液中在4℃下温育2小时。温育后,将细胞和珠粒置于磁性支架中,收集未结合的细胞;将这些非结合酵母转移到新鲜管中,并所制备的gas6涂覆的珠粒在4℃下温育2小时。使用磁性支架,用结合/洗涤缓冲液洗涤数次酵母和珠粒。用his-洗脱缓冲液(150mm咪唑、25mm磷酸钠(ph8.0)、150mmnacl和0.005%tween-20水溶液)从磁珠中洗脱gas6结合的酵母细胞,并在sd-caa中生长。使用此方案,macs将库减少到约2×106个变体,这相当于原始库大小的0.4%。μscale用于macs还原的scfv库的两轮顺序筛选。将酵母在含有33nmgas6(分类1)或10nmgas6(分类2)的pbsa中在室温下温育2小时。用gas6温育后,将细胞在含有1:250稀释的鸡抗-c-myc抗体(lifetechnologies,a21281)的pbsa中在4℃下染色30分钟。细胞在含有1:100稀释的小鼠抗-his标签igghilytefluor488(anaspec,61250-h488)的pbsa中在4℃下染色30分钟。最后,在1:100稀释的羊抗小鼠iggalexafluor488(lifetechnologies,al1001)和羊抗鸡iggalexafluor555(lifetechnologies,a21437)的pbsa中在4℃下进行二次标记30分钟。将标记的酵母稀释至约12800细胞/μl,并装载在10μm阵列上,并使用上述激发/发射参数分析gas6结合。对于第1轮的μscale,在单个池内自动提取具有最高gas6结合/c-myc表达比率的143个腔体,创建富含对gas6具有结合亲和力的种群。在第2轮的μscale中,经由单细胞分选提取前15个腔体。第2轮后,使用zymoprep试剂盒(zymoresearchcorporation)回收、pcr扩增和测序(sequetech)质粒dna。通过将105诱导的酵母细胞用不同浓度的可溶性gas6/pbsa200(在pbs中的0.1%bsa+200mmnacl)在室温下温育2小时来测量所得scfv克隆的gas6结合亲和力。将细胞在含有1:250稀释的鸡抗-c-myc抗体(lifetechnologies,a21281)的pbsa200中在4℃下染色15分钟。在含有1:100稀释的小鼠抗-his标签igghilytefluor488(anaspec,61250-h488)和羊抗鸡igype(santacruzbiotechnology,sc-3730)的pbsa200中在4℃下进行二次抗体标记30分钟。通过流式细胞术(facscalibur,bdbiosciences)测量标记细胞的结合和表达信号。报告的kd误差相当于1-σ(68%)估计结合亲和力的置信区间,并且使用来自每个拟合点的三个独立实验的数据用参数引导方法计算。使用该程序,使用流式细胞术来监测每个分选步骤的进程。起始的scfv库(7x108转化体)没有示出任何可辨别的与gas6的结合。图12示出了gas6结合scfv的天然库筛选中的流式细胞术散点图。首先使用磁激活细胞分选(macs)清除非特异性结合scfv库,随后使用gas6涂覆的磁珠进行一轮macs,其将理论库大小减小到2.8×106个克隆。图12,图a)示出了用0nmgas6染色的初始scfv天然库(库大小:7×108)。图b)示出了用33nmgas6染色的初始scfv天然库。图c)示出了macs后的scfv库(库大小:2.8x106)。在μscale平台上,使用两轮筛选,所得到的scfv变体池富集了gas6的结合体。图10c示出了用于gas6结合体的酵母表面展示的scfv天然库的μscale筛选的轮次的散点图。分类1:用户绘制的框(左)的自动集中提取,分类2:手动单细胞提取(右)。灰点,所提取的克隆;框出的灰色点,对gas6具有最高的亲和力的克隆。在第一轮中,将相对低浓度的gas6(33nm)加入到库中并使其达到平衡。经由集中提取法选择含有具有最高gas6结合水平的酵母的约150个微腔,归一化为scfv表达量(图10c,左)。培养该提取的酵母池,重新诱导scfv表达,并通过流式细胞术进行分析,其中特异性结合gas6但没有特异性结合基于抗体的检测试剂的酵母种群是明显的。图12,图d)示出了在经由自动提取(库大小:143)的第一次μscale分类后分离的scfv库。在更严格的选择压力(10nmgas6)下进行第二个μscale筛选。在该筛选中,经由单细胞提取和测序(图10c,右)和图12,图e)分离了15个微腔,其示出了经由单细胞提取的第二次μscale分类后分离的gas6结合scfv克隆。对筛选的回顾性检查显示,具有最高观察gas6结合水平(归一化为scfv表达)的5个微腔是相同的克隆(图10c,右)。图10d示出了由μscale识别的酵母展示scfv的gas6结合曲线,由所结合gas6的分数相对加入的浓度表达。所得scfv变体与gas6结合,kd为130±30nm,与来自scfv天然库的其它结合剂相当。误差条图对应于三个独立测量的标准偏差。实施例3:ax1受体的亲和力成熟:倾向差错库分类gas6/ax1用作模型系统以分离用作肿瘤转移的有效抑制剂的高亲和力ax1变体。蛋白质工程策略包括库生成和筛选的两轮迭代:随机生成的axl突变的初始库和从第一个库回收的变体衍生的重组axl突变的第二个库。使用gas6涂覆的磁珠的一轮macs将理论库大小降低至3.5×106克隆,且阵列以产生每微细管平均4个细胞的浓度装载。培养、诱导所得的ax1变体池,并将其用100pmgas6培育15小时以允许平衡结合。将库稀释至12,600个细胞/μl,浓度达到每20μm直径的毛细管平均4个细胞,并用两种颜色的落射荧光成像。为了富集gas6结合体,我们单独提取含有相对于axl表达水平具有最高gas6结合水平的酵母的30个微细管,并分别增殖每个微细管的内容物(图34)。在30个提取物中的22个有至少一个细胞生长,产生总计30个克隆。当来自这些酵母克隆的质粒dna被测序时,观察到一些突变共识,特别是d87g和v92a突变。为了结合有益的突变并去除中性或有害突变,使用从库克隆分离的dna作为模板,通过交错延伸技术(step)生成第二个库。我们使用动力学解离速率测定筛选了该第二个库,以分离延长的时间段后保持与gas6配体结合的axl突变体,从而选择具有较慢解离速率的变体。用饱和水平的gas6培育酵母展示ax1库,对其洗涤以除去未结合的配体,并在抗体染色之前使其在过量野生型ax1ig1fc存在下解离24小时。即使在解离24小时后,该库的一个亚组保持了高结合水平,这在μscale上清楚地观察到。我们提取了40个独立的微细管,其相对于ax1表达水平呈现出最高的gas6结合,并单独增殖每个微细管的内容物。我们从30次提取中回收至少一个细胞,产生42个总克隆。图43示出了gas6结合体的酵母表面展示倾向差错的axligi库的筛选。用100pm的gas6培育该库15小时以允许平衡结合。分别提取30个微细管。22/30提取物生长,产生30个克隆。(b)在step之后,我们在抗体染色之前进行动力学解离速率分类24小时。从该库中,单独提取30个微细管。23/30提取物增长,产生45个克隆。在测序来自提取的酵母克隆的质粒dna后,我们观察到强共有突变,特别是a72v、d87g、v92a和v1261突变。d87g和v92a的突变是先前表征的axlig1变体中亲和力的关键驱动因素。除了d87g和v92a之外,在我们以前的工作中通过facs筛选,也从原始的倾向差错pcr库中鉴定出点突变a72v,后者在随后的研究中被发现是对gas6结合的主要贡献者(单独地以及与d87g和v92a组合地)。为验证最终的克隆,我们用μsale筛选最常出现的酵母展示变体进行了结合测定。酵母表面展示的wtax1ig1结合gas6,kd为500±300pm,以及结合解离速率(koff)为4670±190s-1(n=3技术重复)。所有工程axligl变体表明改善了与gas6的结合,其亲和力比wtax1紧密了约3倍,以及动力学解离速率慢50倍。参见表6和图42a和b(误差条图代表三个技术重复的标准偏差)。表6测量的结合亲和力之间的相似性可以反映在酵母结合测定中的限制,而不是真实的蛋白质结合相互作用。使用解离常数(kd)描述结合亲和力,解离常数为等于占据其结合配偶体一半所需的配体浓度的平衡常数。解离常数为缔合速率(kon)与解离速率的比率:当测量细胞相关的结合亲和力时,研究者必须意识到两个常见问题:配体消耗和平衡时间。进行结合测定时的常见假设是配体的可溶性浓度保持恒定。换句话说,假设只有一小部分游离配体结合其结合配偶体。确保少于十分之一的配体从溶液中除去是一个很好的做法。然而,对于高亲和力蛋白质,存在大部分配体结合其结合配偶体的风险,从而消耗游离配体浓度。例如,5×105个酵母细胞,每个表达5×105拷贝的高亲和力(kd=10pm)结合体,将从10pm配体溶液结合约1.25×109个配体。为了防止在这种情况下配体消耗,必须使用至少2.1ml的反应体积,增加所需的总蛋白质的量。对于超过2.5ml的反应体积,必须使用大(15ml或50ml)的管。在这些管中旋转和倾析样品显然更加费力,且容易出错。尽管如此,为了确保适当的反应条件,我们优化了防止配体耗尽所需的体积,使用高达50ml的反应体积。可以使用缔合和解离速率并结合配体浓度来估计蛋白质相互作用而接近平衡所需的时间。如果可溶性蛋白质浓度对酵母展示蛋白质摩尔过量(为了防止配体消耗),接近平衡的时间常数(τ)为τ=(kon*[l]0+koff)-1,其中[l]0是配体的初始浓度。为了进一步表征我们的axl变体和gas6之间的结合相互作用,我们测量了它们的酵母动力学解离速率。我们观察到wtaxl与我们的工程变体(engineeredvariant)之间存在巨大差异。对于wtaxl,酵母结合的gas6水平在6小时内快速解离为背景水平,但是我们的ax1变体在48小时后保留了10%以上的初始gas6结合水平。值得注意的是,a72v/v92a变体(koff=7.1×10-6s-1)比其他两个变体的解离速率(koff=1.4×10-5s-1)慢2倍。以前表征的axlig1变体都具有大约2×107m-1s-1的动态缔合速率,表明亲和力增强是较慢的解离速率的结果。有趣的是,这些速率值比典型的抗体片段58的速率值高100倍。通过这些快速的缔合速率值,我们可以看出,对于最低的配体浓度([l]0=10pm),变体和gas6之间的反应在6小时内将达到99%的平衡结合(4.6τ)。即使对于理论[l]0=1pm条件,所有反应在48小时内达到99%的平衡结合,这是实验中使用的平衡时间。尽管采取这些措施来确保精确的结合亲和力测量,由于酵母展示结合的固有限制,酵母展示的ax1变体的结合亲和力可能被低估。例如,以前使用动力学排除测定(kinexa)的工作示出,gas6分别以33±0.6pm和12.0±0.2pm的亲和力结合可溶性野生型ax1或v92a突变体。尽管我们仔细考虑了测定条件,但由于酵母展示实验的固有限制,酵母展示的ax1变体的亲和力可能被低估。例如,以前使用动力学排除测定(kinexa)的工作示出,gas6分别以33±0.6pm和12.0±0.2pm的亲和力结合可溶性野生型ax1或v92a突变体。axlig1平衡分类使从macs分离的酵母在sd-caa基本酵母培养基(20g葡萄糖;6.7gdifco酵母氮碱;5g细菌酪蛋白氨基酸;5.4gna2hpc4;8.56gnah2po4*h2o;溶解在去离子水以达到1升的体积)中生长,并通过在sg-caa培养基(如sd-caa般制备,只是使用20g取代葡萄糖的半乳糖)中培养来被诱导在其表面上表达ax1。将展示axl变体的酵母在含有100pmgas6的pbsa(磷酸盐缓冲盐水+1mg/mlbsa)中在室温下培育15小时。用gas6培育后,细胞在含有1:200稀释的鸡抗-c-myc抗体(thermofisherscientific,a21281)的pbsa中在4℃下染色45分钟。然后将细胞在含有1:100稀释的小鼠抗-his标签igghilytefluor555(anaspec,61250-h555)的pbsa中在4℃下培育45分钟。然后,在含有1:100稀释的兔抗小鼠igghilytefluor555(anaspec,28164-h555)的pbsa中在4℃下对gas6进行另外的二次标记45分钟,随后在1:100稀释的羊抗鸡igyalexafluor488(thermofisherscientific,al1039)中在4℃下对c-myc进行二次标记45分钟。将标记的酵母稀释至约12,600细胞/μl,并装载到20μm毛细管阵列中,并使用上述激发/发射参数分析gas6结合和c-myc表达。单独提取具有最高gas6结合/c-myc表达比率的三十种微细管。将提取的酵母在sd-caa琼脂平板上生长,并通过如下所述的菌落pcr和测序分析其含有的质粒。axligi动力学解离分类用dna改组的库转化的酵母细胞在sd-caa最小酵母培养基中生长,并通过在sg-caa培养基中培养被诱导在其表面表达ax1。将酵母展示的库在含有2nmgas6的pbsa中在室温下培育3小时,用pbsa洗涤两次以除去未结合的gas6,然后用过量(100nm)野生型ax1fc竞争物在室温下培育24小时。荧光抗体标记和微细管阵列装载以类似于上述μscale平衡分类的方式进行。对于μscale动力学解离速率分类,分别提取具有最高gas6结合/c-myc表达比率的40个毛细管。将提取的酵母在sd-caa琼脂平板上生长,并通过菌落pcr和测序分析其含有的质粒。实施例4:荧光蛋白的细胞生长和高通量筛选方法细胞在微腔阵列中的生长。在产生每微腔体平均1个细菌的大肠杆菌浓度下装载20μm直径的微腔阵列,在37℃下在含有0.2%阿拉伯糖的lb培养基中培育并连续成像。将4000个微腔培养物的绿色荧光作为时间的函数定量,得到图41所示的观察到的生长曲线。根据拟合的指数曲线,观察到的倍增时间为52.8±0.5分钟(通过4000次拟合时间进展中的例子重采样估计不确定性),紧密匹配56±5分钟(n=5次生物学重复)的大量培养中的倍增时间。在随后时刻微腔之间的荧光强度的高度变化反映了生长动力学中细胞与细胞的异质性。荧光蛋白库构建和筛选。ddfp技术涉及两个暗fp单体的可逆缔合以形成荧光异二聚体。命名成分fp单体的惯例是ddfp-a和ddfp-b。ddfp-a单体具有猝灭的发色团,而ddfp-b单体缺乏发色团。我们将非共价复合物称为ddfp-ab(例如,ddofp-ab),而将基因融合的串联二聚体称为tdfp-ab。将tdrfp-ab克隆到xhoi和ecori限制性位点之间的pbad表达质粒(其中ddrfp-b是串联基因融合中的5'配偶体),并用作工程ddofp-ab的模板。首先,通过定点诱变将m66t引入ddrfp-a。使用以下倾向差错的pcr反应条件随机诱变ddrfp-a(m66t)基因创建倾向差错库:0.15或0.075mmm1ci2、10ng模板、200μmdatp、200μmdgtp、1mmdttp、1mmdctp,4mmmgcl2。使用taq聚合酶对每个反应进行40个循环的pcr扩增,扩延温度为68℃。将突变基因库克隆3'至ddrfp-b,构建串联fp变体库,并转化到dh10b电感受态大肠杆菌中,用于在μscale平台内生长和筛选。为了产生高度荧光的ddofp,使用μscale筛选3个连续的大肠杆菌库,在每轮筛选之间对分离的dna进行倾向差错pcr。在每个库循环中,在转化后在37℃下摇晃下在lb培养基中过夜生长细胞以允许大肠杆菌恢复。然后将培养物在表达培养基(补充有氨苄青霉素(100μg/ml)和阿拉伯糖(0.1%)的lb)中稀释至约3,200细胞/μl,装载在20μm阵列上,并在37℃下在用湿润的kimwipe密封的petri培养皿中培育过夜。过夜生长后,用525/45nm激发/565nm长通路发射滤光片分析阵列的荧光强度。对于μscale第1轮,自动提取10个腔体为大量种群,用于通过如上所述的倾向差错pcr创建下一个库。对于μscale第2轮,经由单细胞分选提取12个腔体。使用具有最高荧光信号的4个克隆在与上述相同的条件,创建第三代倾向差错库。对于μscale第3轮和最后一轮,经由单细胞分选提取前10个腔体。为了评估每个库筛选后的蛋白质特性,将提取的细胞在37℃下摇晃下在表达培养基中培育过夜。使用b-per(pierce)提取荧光蛋白,并使用bioteksynergyh4板读数器收集光谱。ddofp光谱性质。在进行光谱分析之前,使用金属螯合ni-nta色谱纯化所有蛋白质,并在pbs中透析。用bioteksynergyh4板读数器记录发射光谱。在variancary50uv/vis分光光度计上使用1cm石英微量池进行吸光度测量。碱性发色团变性法用于测定ε值。mcitrine(φ=0.76)用作ddofp量子产率确定的参考。通过在所需ph的缓冲液中培育纯化的蛋白质并用96孔bioteksynergyh4平板读数器获得发射光谱来进行ph滴定。在pbs中制备1μm荧光蛋白溶液,并用所需ph的通用缓冲液1:10稀释。通过混合等体积的0.04mh3bo3、0.04mch3cooh和0.04mh3po4制备该通用缓冲溶液。通过向制备的储备溶液中加入1mnaoh将ph调节至所需值。通过将实验数据与以下等式拟合来确定pka:其中f是荧光,a和b是定义基线的变量,以及nh是希尔系数。将平均整体发射峰强度归一化并绘制为ph的函数。使用μscale来工程新的荧光蛋白变体,扩展可用的生物传感器的调色板并展示该平台与大肠杆菌库的相容性。常规地,通过筛选在琼脂培养皿上生长的个体大肠杆菌菌落来改造荧光蛋白以识别所需的色调和/或亮度(ai,h.-w.,etal,nat.protoc.9,910-28(2014))。尽管如此,这种低通量方法依赖于基本光学和费力的菌落采拾,这是耗时的、主观的,并且阻碍了最理想的变体的回收。我们首先建立了从微腔阵列中的个体大肠杆菌细胞培养空间分离的培养物的能力。表达荧光蛋白的大肠杆菌悬浮液以获得每孔单细胞的浓度加载到阵列中,在37℃下培育,并以各种间隔成像。所产生的时间过程示出了可靠的克隆扩展和荧光蛋白生产。大肠杆菌生长被限制在腔体内,形成了分离培养物的密集阵列。图13示出了表达gfp的空间分离的大肠杆菌培养物的生长。图像描绘了20μm阵列的一小部分,该阵列的每个微腔装载有单个细菌细胞,在37℃下培养指定的时间并连续成像。图14反映了通过整合每孔的总gfp发射来监测生长。误差条图表示测量腔体(n=177)的+/-标准偏差。使用μscale生成二聚化依赖性荧光蛋白(ddfp)的亮色调偏移的新颜色变体(图15a)。使用红色二聚体依赖性蛋白(称为ddrfp)作为模板,引入蓝移位突变(m66t),其最初消除荧光(shaner,n.c.etal,nat.biotechnol.22,1567-72(2004);alford,s.c,etal,acssynth.biol.1,569-75(2012))。图15b示出了用于从ddrfp模板生成ddofp的工程策略。m66t突变引入到ddrfp(星爆)的a拷贝中,生成大量非荧光色调偏移变体。在大肠杆菌中表达的蛋白质库的三轮诱变和μscale筛选产生了ddofp,除了m66t以外其还有5个突变。为了拯救和增强荧光,通过对倾向差错pcr突变产生并在大肠杆菌中表达的库进行μscale筛选,我们进行了三轮独立的定向进化。对于第1和第2轮的定向进化,分离出大约一打表现出弱荧光的克隆,并将其用于产生用于随后一轮诱变的基因模板混合物。到第3轮,库的一小部分显示出显著高于库平均值的荧光水平。图16a反映了10个具有最亮荧光的腔体,其被提取、培育和表征。选择最亮的荧光蛋白变体用于进一步分析。库变体的观察到的荧光强度的分布以线迹显示。10个最亮的细胞处于该分布上尾部(阴影)。除了原始的m66t突变外,这个第三轮变体,称为二聚化依赖型橙色荧光蛋白(ddofp),获得了5个突变,相对于来自第2轮的最佳突变体和“亲本”m66t克隆而言荧光强度显著增加。如图16b所示,迭代定向进化示出了荧光强度的增加。该图描绘了表达m66t的大肠杆菌粗裂解物、第二轮变体和ddofp(来自第3轮)的荧光发射光谱。插图描述了上述表达fp变体的大肠杆菌的细胞团块的色调增加。图17示出了ddofp[seqidno:1]的a拷贝及其亲本ddrfp[seqidno:2]的序列比对。最初的m66t突变被圈出。用三轮定向进化获得的突变突出显示为灰色和下划线。图18示出了ddofp分别在535nm和565nm具有吸收和发射最大值,填充了ddrfp和ddyfp变体之间的光谱间隙。图19示出了ddgfp、ddyfp、ddofp(虚线)和ddrfp的归一化发射光谱。ddgfp、ddyfp和ddrfp的参考光谱来自alford,s.c,etal,acssynth.biol.1,569-75(2012)andalford,s.c,etal,chem.biol.19,353-60(2012)。此外,ddofp呈现出与其它ddfps相当的亮度和对比度(表7),使其成为基于ddfp的生物传感应用的合适模块。表7ddofp和ddofp-a的光谱性质的汇总ecqy亮度pkaddofp-a322000.0825767.9ddofp645000.31199956.9图20示出了ddofp和ddofp-a的ph依赖性发射谱图。将平均整体发射峰强度归一化并绘制为ph的函数。ddofp-a和tdofp的pka值分别测定为7.9和6.9。误差条图表示三个独立实验的±标准偏差。实施例5:高通量动力学测量和筛选改进的酶催化剂碱性磷酸酶蛋白质构建体的制备。将用于动力学比较的大肠杆菌野生型碱性磷酸酶(wtap)基因和r166s变体克隆到nhei和bamhi限制性位点之间的pct酵母展示质粒中。随后,通过电穿孔将质粒dna转化到酿酒酵母eby100中进行酵母表面展示研究。如前所述(andrews,l.d.,etal.,biochemistry53,6811-9(2014)),也从大肠杆菌sm547de3细胞表达和纯化wtap和r166s突变体的可溶型。用pct显示质粒转化的酵母细胞在选择性培养基中生长并如上所述诱导。酵母诱导培养基用500μmzncl2和500μmmgcl2补充,以提供所需的金属离子用于催化。为了量化酵母表面展示酶的水平,进行与每个酶融合的c末端c-myc标签的抗体标记。洗涤大约8x104个诱导的酵母细胞,并在室温下在旋转器上重新悬浮于含有1:250稀释的鸡抗-c-myc抗体(lifetechnologies,a21281)的pbsa中45分钟。培育后,将酵母洗涤并在室温下在旋转器上重新悬浮于含有1:100稀释羊抗鸡iggalexafluor488(lifetechnologies,al1039)的pbsa中30分钟。然后在guavaeasycyte流式细胞仪(millipore)上检测c-myc表达水平。ddao产物pka的测量。对7-羟基-9h-(1,3-二氯-9,9-二甲基吖啶-2-酮(ddao)进行ph滴定,以确定产物荧光的ph依赖性。1μm的ddao储备溶液在milli-q水中制备并用1mhcl和1mnaoh滴定以调节溶液的ph。使用bioteksynergyh4板读数器,在每个滴定步骤的等份试样上进行在590/660nm的激发/发射荧光测量。数据拟合到henderson-hasselbalch等式中产生的ddao产物的pka为5。因此,随后的酶测定在ph8(高出产物pka3个单位)进行,以消除由ddao氮的质子化引起的荧光猝灭。图21示出了滴定的结果,误差条图对应拟合pka值的1-σ(68%)置信区间的,并且通过使用数据的例子重采样通过自举来确定。碱性磷酸盐活性的分析。将诱导的酵母细胞稀释至约3200细胞/μl的终浓度,在ap反应缓冲液(100mmmopsph8.0、0.5mnacl、1mmmgcl2,100μmznso4、0.2%bsa、1mm甘露糖)中洗涤两次(参见alford,s.c,etal,acssynth.biol.1,569-75(2012);alford,s.c,etal,chem.biol.19,353-60(2012)),并在即将分析前重新悬浮于含有不同浓度的ddaop和无机磷酸盐的ap反应缓冲液中。将反应混合物装载到96孔微量滴定板或μscale阵列上,分别用于批量(bulk)和单细胞实验。通过在bioteksynergytmh4板读数器分光光度计上测量590/660nm激发/发射的荧光时间进程,其允许荧光信号与ddao浓度的线性相关在0-3μm范围内,进行批量动力学测定。图22a和22b示出了作为biotek板读数器分光光度计上的产品浓度的函数所测量ddao产品的发射光谱,并将定量峰值发射以得到右侧的校准线。荧光获取参数如下:灵敏度=100,带宽=9.0nm。对于在μscale平台上的动力学测量,利用600/60nm激发/655nm长通路发射滤光片以设定的间隔采集一系列图像,以针对阵列中每个腔体生成单细胞反应时间进程。μscale滤光片组和相机在板读数器的相当的动态范围内检测到产物形成与荧光的线性相关性。图23示出了类似于在μscale平台上生成的图22a和22b的校准曲线,其通过将可变浓度的产物标准物装载到单微腔阵列上的分离点上,然后测量阵列上每个腔体的荧光强度得到。误差条图反映了在每个点上所有腔体内的标准偏差,并用于使用加权最小二乘法拟合校准线。在这两种情况下,使用每个动力学时间序列的线性区来估计反应速率。使用50pm的有效酶浓度(假设每个细胞展示约104个酶拷贝15,45)用于从动力学数据反向计算速率常数。ap反应中无机磷酸盐污染物的测量。在ap动力学测定中使用的所有试剂中的无机磷酸盐含量使用来自大肠杆菌(lifetechnologies,pv4406)的荧光标记的磷酸盐结合蛋白(pbp)进行定量,如前所述(brune,m.,etal.,biochemistry33,8262-71(1994))。简言之,100μl每个样品与100μl的1μmpbp在磷酸盐传感器检测缓冲液(20mmtrishclph7.6、0.05%tritonx-100)中混合,并且立即读出在bioteksynergytmh4板读数器分光光度计上以在430/450nm激发/发射处混合物的荧光。当测量ap反应缓冲液中的磷酸盐含量时,将缓冲液以1:20在水中稀释,然后用传感器培育,以便最小化浓缩的mops和盐溶液对pbp结合热力学的干扰。在-80℃下将pbp存储液以10μm试样储存在磷酸盐传感器储存储缓冲液(10mmtrishclph7.6、50mmnacl)中,并在使用前单独解冻。如图24所示,使用标准曲线将荧光测量值转化为磷酸盐浓度,该标准曲线拟合为双态结合等温形式f=fmin+(fmax-fmin)*(1+kd/[pi])-1。误差条图反映了三次测量的标准偏差。双态结合等温线拟合作为实线重叠在数据上方。结合参数确定为:fmin=14200+/-500rfu,fmax=85000+/-1000rfu,和kd=0.94+/-0.05μm。碱性磷酸酶库构建和筛选。使用倾向差错pcr,利用以下反应条件随机突变wtap基因[genbank登录号m13345]:0.1mmmncl2、10ngwt模板、200μmdatp、200μmdgtp、1mmdttp、1mmdctp、4mmmgcl2。如上所述进行pcr扩增。将突变的ap插入dna和nhel/bamhi消化的pct质粒以5:1的重量比电穿孔至eby100酵母中,并经由同源重组在体内组装(chao,g.etal,nat.protoc.1,755-68(2006))。通过稀释铺板,库大小估计为约107。μscale用于筛选在测定条件下具有改善的活性的突变体的倾向差错ap库。已诱导的酵母细胞在ap反应缓冲液中洗涤两次,在含有1μmddaop和15μm无机磷酸盐的ap反应缓冲液中以约3,200细胞/μl重新悬浮,并装载到阵列中。30分钟的反应时间后,如ap动力学研究中所述分析每个腔体的荧光强度。单独提取具有最高荧光强度的15个腔体,并在sd-caa琼脂平板上生长。如上所述测量来自提取细胞的酵母显示的ap变体的动力学参数。为了对三种改进的突变体进行基因分型,使用zymoprep试剂盒(zymoresearchcorp.)回收质粒dna,将其转化到dh10b电转化感受态大肠杆菌中,使用质粒小剂量试剂盒(thermoscientific)分离,并测序。使用碱性磷酸酶作为模型系统。使用底物9h-(1,3-二氯-9,9-二甲基吖啶-2-酮-7-基)磷酸盐(ddaop)测量催化活性。酵母显示的野生型(wt)碱性磷酸酶的michaelis-menten动力学和磷酸盐抑制是从大肠杆菌收获的纯化酶的测量值的两倍内。此外,在酵母显示的构建体中保留了wt碱性磷酸酶与先前表征的r166s突变体之间的动力学差异,其表现为ddaop底物的表观二级速率常数(kcat/km)显著降低(o'brien,p.j.&herschlag,d.,biochemistry40:5691-5699(2001))。图25示出了与从大肠杆菌收获的纯化酶相比,展示在酵母表面上的wtap的动力学。利用50pm纯化酶或来自诱导的sgcaa培养物的6.4×105个细胞的反应在96-孔微量滴定板中以200μl的规模运行。误差条图对应于三次独立测量的标准偏差。与标准michaelis-menten模型的拟合作为实线重叠在数据上方。相对于对应genbank登录号m13345的核苷酸序列的wt大肠杆菌蛋白质序列,描述新的序列变体。图26示出了在400nmddaop浓度下运行的反应结果(比wtap的表观km低10倍)。误差条图对应于三个独立测量的标准偏差。与竞争性抑制模型的拟合作为实线重叠在数据上方。表8示出了酵母展示的构建物和纯化的ap构建体所获得的动力学参数的比较。对于用酵母展示酶进行的底物滴定,通过假设每个酵母细胞具有与平均104个展示蛋白质拷贝,将初始速率转化为酶变换。误差对应于拟合参数的1-σ(68%)置信区间,并且利用参数引导方法使用针对每个拟合点的三次独立测量的数据来估计。表8μscale用于测量酵母展示的wt碱性磷酸酶和r166s突变体的单细胞反应时间进程,证明该平台可提供关于酶变体活性的时间分辨的动力学信息。酵母展示的酶和积累产物7-羟基-9h-(1,3-二氯-9,9-二甲基吖啶-2-酮(ddao)所具备的强大的空间分离在阵列中的每个反应时间进程的整个长度内保持,从而使得能够对来自不活跃/较少活性的邻近物体或空腔的含有高活性酵母展示酶的腔体进行容易的和定量的动力学识别。图27示出了来自时间分辨的酶测定的代表性快照。具有展示活性酶的酵母细胞的四个微腔用白色编号表示,而附近的空腔用“x”标出用于比较。为清晰起见,图像对比度被人为提高。图28示出了对应于图27中的快照的微腔的量化。标记对应于图27,表示具有展示活性酶的酵母细胞的四个微腔和用于比较的附近的空腔。观察到在每个微腔中产物的恒定积累,这使得能够通过线性回归计算反应速率。在阵列中在20分钟或3小时反应(分别对wt和r166s)的进程中定量约5,000个用于wt碱性磷酸酶和r166s变体的单细胞痕迹。定义微腔阵列中各突变体的活性分布的时间进程斜率的直方图如图29所示。特别地,单细胞动力学图表示出了具有降低的催化效率的酵母展示的wt碱性磷酸酶和r166s点突变体。在20μm阵列中进行反应,每个微腔中装载单酵母细胞,使用10μmddaop底物、单细胞动力学。显著地,尽管各克隆种群中细胞与细胞间的酶活性存在变化性(可能是由于蛋白质表达水平的异质性),然后基于反应动力学,μscale平台清楚地描绘了来自wt酶酶的r166s突变体。接下来,为了证明μscale鉴定改善的酶变体的能力,针对1μmddaop(比wt碱性磷酸酶的表观km低4倍)并且在添加至每个反应的15μm无机磷酸盐的存在下(比wt碱性磷酸酶测量的ki高4倍),筛选随机突变的碱性磷酸酶库(约107个转化体)。这些条件对库施加选择性压力以富集增加酶对抑制剂的耐受性的序列,这是酶工程的许多不同子领域中的共同目标(参见,例如alberstein,m.,etal.,plantj.69,57-69(2012);yang,j.-s.,etal,ploscomput.biol.8,el002612(2012);hu,x.,etαι.,αρρι.microbiol.biotechnol.87,1773-82(2010))。转化以及从0.2至6的od600传代3次之后,将整分试样的酵母epcr库进行酶制备(zymoprepped)并转化到dh10b大肠杆菌细胞中。挑取20个克隆并用sanger测序来获取基因型,产生图30所示的突变率分布。在所测试的筛选条件下相对于wt碱性磷酸酶参考物具有增强的活性的十五个推定的匹配,经由单细胞提取分离、培育和在上述相同条件下大批重新筛选。图31示出了随机突变的ap库的μscale筛选的定量。峰示出了筛选期间观察到的单细胞酶活性的分布。从该阵列中提取该分布上尾部处的十五个最活跃的细胞(如虚竖线所示),对其扩增并重新筛选以进一步富集改进的酶变体。选择三种变体用于测序和更详细的表征,这是基于它们在大量生物化学测定中相对于wt碱性磷酸酶的高度显著的速率加速。图32示出了wt酶和从μscale库筛选分离的三种最活跃的变体的相对速率。在与筛选中使用的条件相同的条件下,用酵母展示的构建体在大量生物化学测定中测量速率。图33示出了酵母展示的wtap和人工进化的n197s-t148p-s175r三重突变体的单细胞动力学特征。在不存在无机磷酸盐的情况下用5μmddaop进行反应,并使用与epcr库筛选相同的程序在μscale平台上进行分析。已知d101位置对于定位与ap活性位点内磷酸根离子配位的r166残基是重要的。因此,在我们的筛选中发现的d101g突变可能改变r166的定位,其降低酶对无机磷酸盐的亲和力。图34示出了wt酶和从μscale筛选分离的三种改进变体的磷酸盐抑制曲线。三种变体之一呈现出对无机磷酸盐的显著降低的敏感性,其表观ki比wt酶的高10倍。使用至少比各突变体的表观km低10倍的底物浓度运行反应。与竞争性抑制模型的拟合作为实线重叠在数据的上方。在所有实验中,误差条图对应于三次独立测量的标准偏差。图35示出了人工进化的d101g突变体中减少的磷酸盐抑制的结构基础。wtap(pdb1alk)的活性位点具有结合的无机磷酸盐(p)。活性位点锌离子示为(z),d101和r166残基呈现为棒状,所有其它蛋白质残基都用丝带表示。在磷酸盐存在下,该d101g突变体相对于wt酶的改进的性能在可溶性表达和从大肠杆菌的纯化后得到保留(表8)。如图36所示,其它两个变体表现出比wt碱性磷酸酶更高的基础活性的水平,其可通过这些突变体的增强的酵母表面表达来部分解释。在图36中,与标准michaelis-menten模型的拟合作为实线重叠在数据上方。图37示出了在展示在酵母表面上的ap突变体的表达图表。经由与各酶融合的c末端myc标签的抗体标记测量蛋白质展示水平,并使用流式细胞术定量。两种变体都不能以来自大肠杆菌的活性形式纯化,表明这些克隆所获得的有益突变对酵母表面环境是特异性的,并且与溶液中同型二聚体的适当折叠不相容。表9示出了使用来自大肠杆菌的荧光标记的磷酸结合蛋白测量ap反应中的无机磷酸盐污染物。使用图23中的校准曲线将荧光测量值转化为磷酸盐浓度。误差反映了两个独立制备的样品的标准偏差。测定的检测限度为10nmpi。表9样品[pi](nm)ap反应缓冲液292±70.5μmddaop(在milli-qh2o中)<105μmddaop(在milli-qh2o中)<1050μmddaop(在milli-qh2o中)<1050pmwtap(纯化的)<10表10示出了使用来自大肠杆菌的荧光标记的磷酸结合蛋白测量碱性磷酸酶反应中的无机磷酸盐水平。使用图23中的校准曲线将荧光测量值转化为磷酸盐浓度(见方法)。使用参数引导方法,从校准曲线的不确定性传播误差。测定的检测限度为10nmpi。表10样品[pi]ap反应缓冲液1.8±0.2μm0.2%bsa(在milli-qh2o中)150±10nm0.5μmddaop(在milli-qh2o中)<10nm5μmddaop(在milli-qh2o中)<10nm50μmddaop(在milli-qh2o中)<10nm50pmwt酶(纯化的)<10nm表11示出了在酵母展示和纯化的酶形式中wtap和从μscale分离的三种变体的相对速率。所有反应在15μm加入的无机磷酸盐存在下使用1μmddaop进行。使用新鲜转化的细胞,以3200细胞/μl的细胞密度进行所有酵母测定。使用50pm酶进行与wtap和d101g突变体的纯化酶反应,而使用50nm酶进行与i16v-n145i-d294g和n197s-t148p-s175r三重突变体的反应(其速率相应地成比例)。表11突变体krel(酵母展示)krel(纯化的蛋白质)wt1.00+/-0.071.00+/-0.03d101g10.39+/-0.0749+/-6i16v-n145i-d294g6.4+/-0.10.0039+/-0.0006n197s-t148p-s175r19.2+/-0.50.011+/-0.002表12示出了通过原子发射光谱法(aes)测量的wt碱性磷酸酶以及从μscale筛选分离的两个三重突变体中的金属离子和磷含量。碱性磷酸酶单体的预期zn/mg/蛋白质化学计量为2:1:1.3。此外,wt碱性磷酸酶以1:1化学计量比在活性位点与无机磷酸盐结合表达。在wt碱性磷酸酶样品中与这些值的偏差可能反映了样品制备和蛋白质浓度测定中的错误。在i16v-n145i-d294g和n197s-t148p-s175r三重突变体的活性位点缺乏显著的金属占有有助于解释这些变体的较差活性。aes数据以及wt碱性磷酸酶(pdb1alk)的晶体结构支持一种模型,在该模型中n145和t148处的突变破坏了可溶性蛋白质的折叠,并因此破坏了其与有效催化所需的金属辅因子结合的能力。表12突变体zn/蛋白质mg/蛋白质p/蛋白质wt2.500.820.85i16v-n145i-d294g0.080.010.62n197s-t148p-s175r0.080.010.10表达酶活性的归一化ap超家族中另一种经过充分研究的酶是核苷酸焦磷酸酶/磷酸二酯酶(npp),其催化磷酸二酯水解。作为该超家族的其它成员,npp是含有两个zn2+基序的双金属酶。npp通常作为跨膜蛋白发现于真核细胞表面上,在该表面上它们作用于细胞外磷酸二酯。npp从柑橘溃疡病菌中分离出来,并且在其天然环境下没有该酶的功能数据。基于其过表达和体外磷酸二酯酶活性而选择该酶。该npp变体是使酵母表面展示容易的单体。对于npp,使用底物双(4-甲基伞形基)磷酸酯(bis-mup)测量催化活性,其在水解时产生两个荧光4-甲基伞形酮(mu)。与ap底物(ddaop)不同,bis-mup在切割前不是荧光的,其产物具有窄的荧光激发和发射光谱。由于这一性质,可确定酵母表面蛋白表达水平的定量。通过用c末端c-myc荧光标记的二级抗体将酵母细胞染色,酶活性可用表达进行归一化,这可以降低测定的噪音。在该实验中,使用黑色、氢燃烧玻璃阵列。黑色玻璃壁防止微腔之间的荧光串扰,消除了在透明玻璃阵列中观察到的“光晕”效应。此外,黑色阵列能够在不添加磁性微珠的情况下进行提取。没有微珠,图像质量和测量灵敏度显著提高。染色表达酵母,并测定酵母展示npp的单细胞反应时间进程。随时间监测反应后,每个微细管的反应速率通过线性回归计算并对npp表达绘制该速率。图38中的图a)示出了描绘突出显示的数据(圆圈)的图像的图片。显示了含有展示活性酶的酵母细胞(白色数字)的三个微腔和附近空毛细管(虚线圆圈),用于比较。图38,图b)也示出了图像的量化。图39描绘了通过线性回归计算并对c-myc标签表达绘制的含有表达npp的酵母细胞的每个微腔的反应速率。图片描绘突出显示的数据(圆圈)的图像。实施例6:培养基质上的细胞的提取和生长将阵列培养的酵母细胞直接提取到培养基质或捕获表面上。将表面捕获的细胞转移到培养基质或培养基中。测量细胞的存活力。材料:sd-caa培养基10g葡萄糖3.35g不含氨基酸的氮碱2.5g酪蛋白氨基酸2.7g无水na2hpo44.28gnah2po4*h2o在500ml的h2o中sd-caa琼脂平板91g山梨醇7.5g琼脂3.35g不含氨基酸的氮碱2.5g酪蛋白氨基酸2.7g无水na2hpo44.28gnah2po4*h2o在500ml的h2o中sg-caa培养基10g半乳糖3.35g不含氨基酸的氮碱2.5g酪蛋白氨基酸2.7g无水na2hpo44.28gnah2po4*h2o在500ml的h2o中酵母生长和蛋白质诱导:具有pct-con2质粒的酿酒酵母在sd-caa培养物中培养并在30℃下生长24小时至od600=3-6。将细胞离心并重新悬浮于sg-caa中,达到最终od600=1。然后将细胞再生长24小时至最终od600=7。sg-caa中的生长诱导pct-con2在酵母细胞表面上表达蛋白质。酵母染色和装载:为了提高可见性,诱导的酵母用靶向c-myc标签的荧光抗体染色,c-myc标签经由pct-con2质粒在酵母表面展示。将酵母与抗cmyc抗体培育30分钟,然后用555染料标签的抗cmyc抗体的二次抗体进行又30分钟的培育。标记后,将酵母细胞稀释至计算浓度,以产生单一细胞/核(对于20um孔阵列的3200细胞/ul)并铺展在微孔阵列上。捕获表面的制备和提取:为了制备捕获表面,将20ul的水合流体(甘油)均匀地铺展在18mm×24mm的玻璃盖玻片上。然后将该盖玻片置于在孔阵列下约1mm处。利用适当的激光强度,将选定的孔直接提取到培养基质或捕获表面上。然后将细胞培养2天或直到形成菌落形式。图40示出了测试的不同类型的单细胞提取结构的全部结果的条形图:(1)facs至sd-caa示出了通过facs分选的细胞直接进入在96孔板(每孔一个细胞)的sd-caa培养培养基中的结果;(2)sd-caa琼脂是直接从阵列提取到琼脂涂覆的捕获表面的细胞的结果;(3)h.流体到sd-caa琼脂是提取到涂覆有水合流体(甘油)的捕获表面上并且翻转到琼脂sd-caa琼脂基质上的细胞的结果;(4)h.流体至0.3mlsd-caa示出了提取到捕获表面(含水合流体)上然后直接转移到sd-caa培养培养基中的细胞的结果;(5)玻璃至0.5mlypd至5mlsdcaa示出了捕获到未涂覆的玻璃捕获表面上,转移至ypd培养基(sigma-aldrich),然后将培养基转移至sd-caa培养基的细胞的结果;(6)玻璃至5mlsd-caa示出了捕获到未涂覆的玻璃表面上,直接转移到5mlsd-caa培养基中的细胞的结果;(7)玻璃至0.3mlsd-caa示出了捕获到未涂覆的玻璃表面上,直接转移到0.3mlsd-caa培养基中的细胞的结果。最高的单细胞存活力来自将细胞提取到涂覆的捕获表面上并将细胞立即放置转移到含有sd-caa培养基的琼脂上的组合。尽管本文已经示出和描述了本公开的优选实施方式,但是对于本领域技术人员显而易见的是,这些实施方式仅以示例的方式提供。在不背离本公开的情况下,本领域技术人员将会想到许多变化、改变和替换。应当理解,在实施本公开时可以采用本文所述的本发明的实施方式的各种替代方案。所附权利要求旨在限定本公开的范围,并且在这些权利要求及其等同物的范围内的方法和结构因此应被覆盖。序列表<110>里兰斯坦福初级大学理事会<120>微筛选装置、方法和产品<130>15-300-us1<150>62/119251<151>2015-02-22<150>62/120803<151>2015-02-25<150>62/250478<151>2015-11-03<150>62/281545<151>2016-01-21<160>2<170>patentinversion3.5<210>1<211>224<212>prt<213>人工序列<220><223>ddofp<400>1valilelysgluphemetargphelysvalargleugluglysermet151015asnglyhisgluphegluilegluglygluglygluglyargprotyr202530gluglythrglnthralalysleulysvalthrlysglyglyproleu354045prophealatrpaspileleuserproglnilethrtyrglyserlys505560alatyrvallyshisproalaaspvalproasptyrmetlysleuser65707580pheprogluglyphelystrpgluargvalmethisphegluaspgly859095glyleuvalthrvalthrglnaspthrserleuglnaspglythrleu100105110iletyrlysvallysmetargglythrasnpheproproaspglypro115120125valmetglnarglysthrleuglytrpasptyrserthrgluargleu130135140tyrprogluasnglyvalleulysglygluleuleuglyargleulys145150155160leulysaspglyglyleutyrleuvalgluphelysthriletyrmet165170175alalyslysprovalglnleuproglytyrtyrphevalaspthrlys180185190leuaspilethrserhisasngluasptyrthrilevalgluglntyr195200205gluargsergluglyarghishisleuglymetaspgluleutyrlys210215220<210>2<211>231<212>prt<213>人工序列<220><223>ddrfp<400>2metvalserlysserglugluvalilelysgluphemetargphelys151015valargleugluglysermetasnglyhisgluphegluileglugly202530gluglygluglyargprotyrgluglythrglnthralalysleulys354045valthrlysglyglyproleuprophealatrpaspileleuserpro505560glnilemettyrglyserlysalatyrvallyshisproalaaspval65707580proasptyrmetlysleuserpheprogluglyphelystrpgluarg859095valmethisphegluaspglyglyleuvalthrvalthrglnaspthr100105110serleuglnaspglythrleuiletyrlysvallysmetargglythr115120125asnpheproproaspglyprovalmetglnlyslysthrleuglytrp130135140asptyralathrgluargleutyrprogluaspglyvalleulysgly145150155160gluleuleuglyargleulysleulysaspglyglyleuasnleuval165170175gluphelysthriletyrmetalalyslysprovalglnleuprogly180185190tyrtyrphevalaspthrlysleuglyilethrserhisasngluasp195200205tyrthrilevalgluglntyrgluargsergluglyarghishisleu210215220glymetaspgluleutyrlys225230当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1