用于治疗靶向聚集的肽的创伤性脑损伤的方法与流程
本发明涉及创伤性脑损伤的预防、减轻、治疗和诊断。
背景技术:
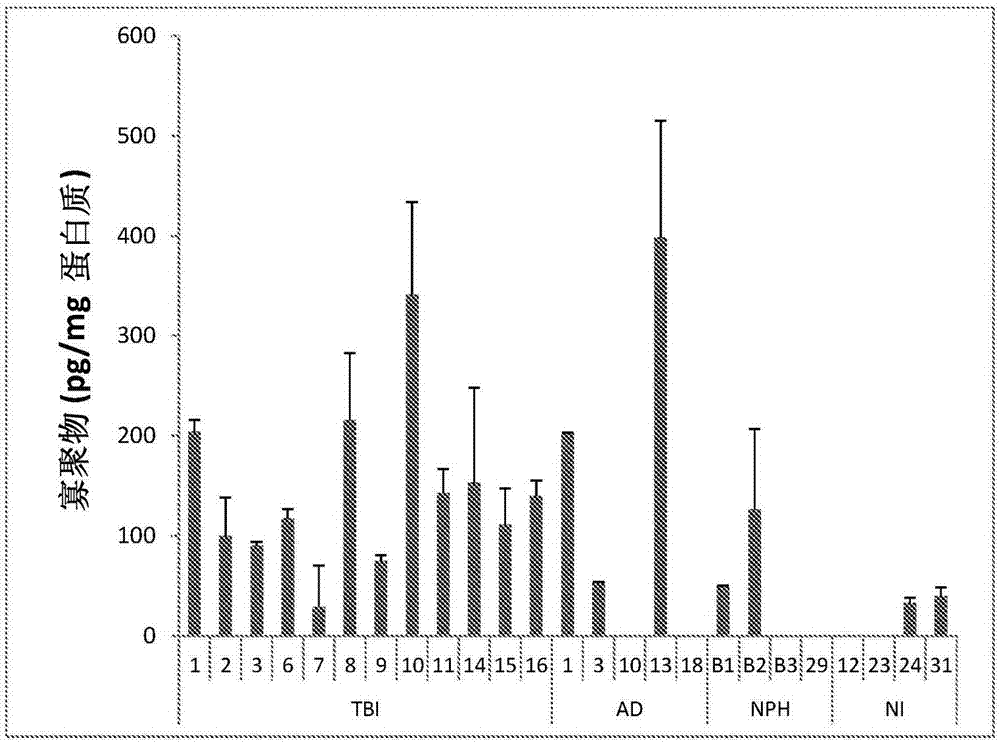
:急性脑损伤(缺血性或出血性)涵盖了一组常见病症,其包括例如创伤性脑损伤(tbi)、缺氧和中风,从而导致严重的病理后果。tbi是15和30岁之间的人中最常见的致死和致残原因。最严重的损伤可以导致长期无意识的病症。10至15%的重度tbi患者处于植物状态允许离开急救护理(levin等人,1991archneurol;48:580-5)。23项欧洲报告中来自丹麦、瑞典、芬兰、葡萄牙、德国的全国性研究和来自挪威、瑞典、意大利、瑞士、西班牙、丹麦、爱尔兰、英国和法国内部的区域性研究的发现报道了每100,000人中约235人的总住院加致死tbi发病率(tagliaferri等人,actaneurochir(wien).2006;148:255-68)。在该研究中,报道了每100,000人中约15人的平均死亡率。对创伤性脑损伤病理发生的不完全理解使得无法建立严格的事件时间顺序。最常提出的细胞机制是弥漫性轴索损伤,其与几个生理学过程中的变化有关。改变的蛋白质稳态是其中最显而易见的,这是因为经常在组织病理学水平观察到不同的蛋白聚集。有趣地,由于两种条件中相同的蛋白聚集体,在特发性神经变性和由于损伤的神经变性途径之间存在重叠。已在1/3不具有先前存在的临床痴呆病或认知缺陷症状的致死性tbi患者中发现了处于aβ斑和轴索内aβ沉积形式的淀粉状蛋白-β(aβ)(roberts等人,jneurolneurosurgpsychiatry.1994;57:419-25)。不考虑他们的年龄,早在严重脑损伤后2小时,在30%存活者的脑中可溶性aβ肽水平的升高并且淀粉状斑的沉积是明显的(ikonomovic等人,expneurol2004;190:192-203)。在重症监护室中,脑内微渗析通常用于在神经外科手术程序后监控患者。除了其它应用,脑微渗析已在临床上用于检测代谢病变的早期病征,其可以提供急性脑损伤后继发性损害的早期危险病征。微渗析导管同时已用于测量aβ水平。当患者神经学状态改善时,aβ的脑间质液水平增加。当患者临床稳定时,aβ水平保持稳定(magnoni等人,archneurol2010;67:1068-73)。还出现了当患者神经学状态恶化时,aβ浓度降低。脑中aβ的间质液水平还与代谢变化有关:aβ的低间质液水平与高大脑乳酸盐-丙酮酸盐比值以及低大脑葡萄糖水平有关。像一些其它蛋白一样,aβ具有自结合的能力并且可以形成不同的组装体,其范围从二聚体至具有不同尺寸的寡聚物,包括原纤维(其是较大的可溶性寡聚物)至不溶性原纤维聚集体。先前,将脑中淀粉状斑中aβ原纤维的形成和积累与神经退行性疾病(具体地阿尔茨海默氏病)相联系。然而,由于脑的生化分析已显示aβ的非原纤维形式的浓度与突触丧失和痴呆病的存在良好相关,因此近期数据表明了aβ的非原纤维和可溶性毒性物质更重要的作用。因此,大量工作已集中在基于靶向一种或多种aβ物质,包括可溶性以及不溶性物质的治疗剂,用于阿尔茨海默氏病的疗法的发展上。在大多数情况下,所提议的治疗剂特异性较差并且靶向单体和/或多种可溶性聚集体以及不溶性聚集体形式。因此,过去几年中已在文献中公开了以不同特异性程度靶向不同aβ形式的大量抗体。wo02/03911描述了在某些神经退行性疾病,具体地阿尔茨海默氏病的发展中特别重要的aβ原纤维,并且如wo05/123775和wo07/108756中所公开的,产生了对aβ原纤维具有高亲合力和选择性的抗体。这种抗体现已处于阿尔茨海默氏病治疗的临床试验中。技术实现要素:在一个实施方式中,本发明涉及预防、减轻或治疗个体中创伤性脑损伤的方法。方法包括向所述个体施用治疗有效的和生理学可用的量的能够减少脑中一种或多种肽的一种或多种聚集形式的量的试剂。在另一个实施方式中,本发明涉及能够减少脑中一种或多种肽的一种或多种聚集形式的量的试剂,用于预防、减轻或治疗创伤性脑损伤的用途。在另一个实施方式中,本发明涉及用于在创伤性脑损伤之后判断个体的并发症的风险的方法,其包括检测个体的脑中创伤性脑损伤事件产生的倾向于聚集的一种或多种肽的一种或多种聚集形式,其中脑中这些聚集体水平的增加表示并发症风险增加。参考详细说明,本发明的其它实施方式、方面和优势将是显而易见的。附图说明图1a和图1b示出了如实施例中描述的原纤维和寡聚物aβ的结合。图1a示出了通过mab158夹层elisa检测的患者样品中原纤维aβ的水平。每个柱代表了对两种不同情况实施的两次elisa实验的平均值和标准偏差(sd)。图1b示出了通过mab82e1夹层elisa检测的患者样品中寡聚物aβ的水平。每个柱代表了对两种不同情况实施的两次elisa实验的平均值和sd。不存在柱表示值低于测定的检测限。图2a和图2b示出了如实施例中描述的单体aβ40和42的结合。图2a示出了通过中区mab4g8检测的总单体aβx-40和x-42的水平(n末端截短和全长单体,其中至少分别存在氨基酸40和42)。每个柱代表了对两种不同情况实施的两次elisa实验的平均值和sd。来自阿尔茨海默氏病(ad)样品组的值中的6个超出范围,并且作为替代在每个柱的上方显示为每mg总蛋白中多至数千pg。图2b示出了通过n末端mab6e10检测的全长单体aβ1-40和1-42的水平。每个柱代表来自1次elisa实验的平均值,并且sd示出了elisa重复孔之间的变化。来自ad样品组的值中的4个超出范围,并且作为替代在每个柱的上方显示为每mg总蛋白中多至数千pg。在大部分样品中,aβ38(其中至少存在氨基酸x-38的aβ肽)的水平低于检测(数据未显示)。具体实施方式脑中的某些肽已被鉴别为易于由于急性脑损伤而趋于聚集。所形成的聚集体,具体地毒性聚集体对生命机能损伤提供了严重作用,该生命机能损伤是急性期中已存在的最常见的结果。根据本发明提供了用于急性治疗和诊断的靶向这些肽的前体、肽本身或其聚集形式的方法和方式。因此,为了达到消除或显著减少脑中聚集体的量的目标,对于疗法的一些可能性是可用的。具体地,本发明的实施方式、方法和试剂靶向淀粉状蛋白-β(aβ)、α-突触核蛋白和/或τ肽和/或τ肽衍生物,例如,p-τ,和/或这些肽的寡聚形式,如原纤维。在本发明公开内,原纤维是指较大的可溶性寡聚物。在具体的实施方式中,原纤维具有大于100kda表观分子量。在更具体的实施方式中,原纤维具有大于100kda的表观分子量,并且具有直径4-11nm且长度小于200nm的曲线结构。例如,通过walsh等人,thejournalofbiologicalchemistry,272(35):22364-22372(1997)和walsh等人,thejournalofbiologicalchemistry,274(36):25945-25952(1999)描述了这些原纤维,以上两篇文献均作为参考并入本文。在更具体的实施方式中,本发明的方法和试剂靶向神经毒性的aβ原纤维。根据本发明具体的实施方式,通过使用抗包含这种肽的一种或多种物质的抗体实现了对创伤性脑损伤的预防、减轻、治疗和/或诊断。在本发明中,将使用术语肽,而科学文献有时将它们称为蛋白质。根据本发明,脑中某些靶标肽的聚集形式的消除或至少显著减少在新的医学指征,即具有急性脑损伤事件的情况中提供了有效疗法。脑中这些靶标肽的特征在于对急性脑损伤事件响应的聚集体的形成。在这些条件下倾向于聚集的肽组包括淀粉样肽,具体地aβ肽、α-突触核蛋白和τ肽。在下文中,将主要通过以由于急性脑损伤事件而倾向于聚集的淀粉样肽aβ(脑中肽组的一个成员)举例说明本发明。然而,本发明还涵盖了由于急性脑损伤事件以类似方式倾向于聚集的其它肽。可以通过一些不同方式获得所述消除或显著减少。通常该肽,例如aβ,是体内表达的受体,例如,淀粉样前体蛋白(app)的一部分,并且通过一种或多种酶而被切割掉。通过在(例如)app的表达水平或切割水平引起aβ的产生,则可以经历聚集反应的物质数目减少。影响aβ系统中这些过程的物质是(例如)α-分泌酶激动剂、β-分泌酶和γ-分泌酶的拮抗剂。还可以通过aβ降解酶,例如,通过胰岛素降解酶(ide)、脑啡肽酶等的刺激实现aβ肽的减少。还可以通过抑制聚集过程的物质实现肽的聚集形式的消除或至少显著减少,照此(即)使肽单体完全不倾向于聚集或防止低分子量聚集体经历进一步聚集而成为最可能的较大的毒性聚集体,具体地,原纤维,即较大的可溶性寡聚物。例如,这可以通过施用结合至肽单体和/或低分子量聚集体的物质,从而防止它们进一步聚集来实现。当然还可以通过施用用于从系统中消除物质的靶向这些聚集形式中的一种或多种的物质来实现聚集形式的消除,例如,通过分裂为氨基酸和/或单体或毒性较小的小聚集体。设计对aβ、α-突触核蛋白或τ肽的聚集形式具有高亲合力的抗体的使用是特别受关注的。在具体的实施方式中,本发明涉及设计对具体地原纤维,例如,aβ、α-突触核蛋白或τ肽的原纤维具有高亲合力的抗体的使用。根据本发明的其它方面,可以通过抗体-介导的小胶质细胞的摄取来消除毒性寡聚或原纤维形式。根据本发明的其它方面,例如,通过施用破坏或阻断原纤维上毒性位点的物质,降低了寡聚形式,具体地,原纤维的毒性。因此,在一个实施方式中,防止、减轻和/或治疗创伤性脑损伤的方法包含向个体施用有效量的用于减少肽的一种或多种聚集形式的量的试剂,例如,通过对急性脑损伤后倾向于聚集的肽或它们的聚集形式特异的抗体。在本发明的具体实施方式中,将抗aβ或aβ的聚集形式的抗体用于减少肽的一种或多种聚集形式的量,以增加觉醒和/或行为反应,以避免长时间的无意识病症和/或以改变恢复或改善功能结局的速度。目标是回到清醒、自觉意识,避免植物状态和/或改善认知。在具体的实施方式中,开始在急性期内作为静脉内输注、静脉内或皮下注射或者直接递送至脑室或者鞘内施用抗体。可以延长施用并在住院神经修复期内使用以进一步改善恢复。已知在急性脑损伤事件后倾向于聚集并且处于单体、寡聚物和原纤维形式时是根据本发明的方法的靶标的肽可以以不同长度出现,例如,由于与产生有关的“未完成的”切割反应或者由于在某一阶段不同的酶的作用。再次通过来自aβ系统的实例,大多数情况下,全长肽aβ肽为1-39、1-40、1-41、1-42和1-43。然而,在肽的一个或两个末端(n末端和/或c末端)的截短是非常常见的,并且1-28、3-40/42、11-40/42、17-40/42和24-35正是可以在体内系统中出现的具有不同长度的aβ的几个实例。另外,如上,截短肽可以聚集成寡聚物、原纤维和原纤维形式,这表示aβ的体内聚集形式可以含有全长和截短形式的不同组合和量。截短的aβ的聚集形式,包括原纤维也是本发明方法的靶标。在wo05/123775和wo2011/001366中公开了抗这些截短的原纤维的抗体,以上专利以其全部内容作为参考并入本文,并且抗体适合于在本发明方法中使用。倾向于聚集的肽的其它变体可以包括突变形式,其中肽序列中的一个或多个氨基酸改变为不同的氨基酸。flemish(a21g)、arctic(e22g)、dutch(e22q)、italian(e22k)和iowa(d23n)突变是熟知的且鉴定的。具体地,已发现对于聚集而言,由于易于形成相当稳定且毒性的aβ原纤维,arctic的突变是所关心的。抗这些突变体的聚集形式,包括其原纤维的抗体也适合于在本发明的方法中使用。脑中的另一种肽是α-突触核蛋白,其在一定条件下也会聚集以提供不同的寡聚物形式、原纤维和原纤维。这种肽及其聚集形式与帕金森氏症和具有路易氏小体的痴呆病的发展密切相关。如在aβ的情况下,工作集中在发展靶向多种α-突触核蛋白聚集物质的疗法上。在wo2011/104696中公开了靶向α-突触核蛋白原纤维的一些抗体,该专利以其全部内容作为参考并入本文,并且抗体也适合于在本发明方法中使用。根据本发明的一个方面,提供了一种方法,其中用靶向这些肽中的一种或多种和/或已从这些肽形成的聚集体的试剂治疗患有急性脑损伤事件或怀疑是急性脑损伤事件受害者的人。在具体的实施方式中,靶向可溶性和/或不溶性聚集形式。施用试剂以使其在脑中发挥作用并且如果全身施用,则试剂必须穿过血脑屏障。可能的施用是直接进入脑实质。在本发明的具体实施方式中,试剂是靶向原纤维的抗体。在本发明更具体的实施方式中,试剂是靶向aβ原纤维的抗体。适合的药物候选的实例是wo07/108756中公开的基于mab158的人源化抗体,其提供了抗体的详细公开内容并且以其全部内容作为参考并入本文。靶向倾向于聚集的肽和/或其一种或多种聚集形式的抗体应对这些物质中的一种或多种具有高亲合力。在具体的实施方式中,抗体对一种或多种原纤维具有高亲合力。高亲合力定义为elisa法的ic50(抑制50%测定信号所需的抗体浓度)小于10-7m,小于10-8m,小于10-9m,小于10-10m或测定为10-11m。在更具体的实施方式中,除对肽物质中的一种或多种的高亲合力之外,抗体属于igg类,例如,igg1或igg4亚类或其组合或突变,并且在更具体的实施方式中,除了保留了高fc受体结合和低c1(c1q)结合外,抗体在所靶向的肽物质的清除中有效并且具有低炎症风险。在用于治疗个体中创伤性脑损伤的方法的一个实施方式中,与对照相比,聚集体的量减少了至少30%、40%、50%、60%、70%、80%或90%,该方法包括向个体施用治疗有效的且生理学可用的量的减少个体脑中由于创伤性脑损伤事件而倾向于聚集的肽的一种或多种聚集形式的量的试剂。甚至低至1%的减少也可能具有显著的临床益处。据信从创伤性脑损伤事件至根据本发明的治疗的时间范围应尽可能短。这表示怀疑有创伤性脑损伤的患者到达医院的急救单元时应立即根据本发明进行治疗,并且至少在其中由创伤性脑损伤事件所引起的肽聚集体的水平增加的时期内进行治疗。据信在多年后,脑中可溶性aβ原纤维增加的水平将导致痴呆病,具体地,阿尔茨海默氏病。为此,本发明还与使用减少可能导致痴呆病和阿尔茨海默氏病的神经变性的试剂的tbi的长期/预防性治疗有关。例如,具有tbi的晚期并发症风险的个体可以是预防性治疗的受试者。当然,单独或与该类脑病的常规特征结合,由于脑损伤事件的聚集体形成具有诊断或可能更准确地预测价值。创伤性脑损伤事件之后脑中该类聚集体的形成表示严重并发症的风险。对于风险的诊断/预测,可以注射靶向肽聚集体中的一种或多种的标记物质,例如,标记抗体,并且可以(例如)通过pet或mri技术测量聚集体的位置和量。例如,可以使用荧光、磁性或放射性标记的抗体。作为另外一种选择,可以收集体液样品组织用于体外分析。具体地,抗一种或多种聚集形式,例如,原纤维的抗体在这类方法中具有重要性。在本发明的一个方面,提供了预防、减轻或治疗个体中创伤性脑损伤的方法,其包括向个体施用治疗有效的和生理学可用的量的能够减少个体脑中一种或多种肽的一种或多种聚集形式的量的试剂。在该方面的一个实施方式中,创伤性脑损伤是急性脑损伤事件的结果。在该方面的一个实施方式中,创伤性脑损伤是物理脑损伤事件的结果。在该方面的一个实施方式中,创伤性脑损伤是由中风或缺氧所引起的脑损伤的结果。在该方面的一个实施方式中,一种或多种肽选自由aβ肽、α-突触核蛋白肽和τ-肽组成的组。在该方面的一个实施方式中,肽的一种或多种聚集形式是处于原纤维形式的聚集的aβ肽。在该方面的一个实施方式中,试剂是抗体。在具体的实施方式中,抗体结合aβ原纤维。在该方面的一个实施方式中,创伤性脑损伤是轻度创伤性脑损伤。在该方面的一个实施方式中,创伤性脑损伤是中度创伤性脑损伤。在该方面的一个实施方式中,创伤性脑损伤是重度创伤性脑损伤。在该方面的一个实施方式中,个体是载脂蛋白e4等位基因(apolipoproteine4allele)的携带者。在该方面的一个实施方式中,个体具有载脂蛋白e3/e4或者载脂蛋白e4/e4基因型。在本发明的一个方面,提供了能够减少脑中一种或多种肽的一种或多种聚集形式的量的试剂,用于在预防、减轻或治疗创伤性脑损伤中的用途。在具体的实施方式中,试剂是用于在预防、减轻或治疗创伤性脑损伤中使用的药剂。在该方面的一个实施方式中,创伤性脑损伤是急性脑损伤事件的结果。在该方面的一个实施方式中,创伤性脑损伤是物理脑损伤事件的结果。在该方面的一个实施方式中,创伤性脑损伤是由中风或缺氧所引起的脑损伤的结果。在该方面的一个实施方式中,一种或多种肽选自由aβ肽、α-突触核蛋白肽和τ-肽组成的组。在该方面的一个实施方式中,肽的一种或多种聚集形式是处于原纤维形式的聚集的aβ肽。在该方面的一个实施方式中,试剂是抗体。在具体的实施方式中,抗体结合aβ原纤维。在该方面的一个实施方式中,所述创伤性脑损伤是轻度创伤性脑损伤。在该方面的一个实施方式中,所述创伤性脑损伤是中度创伤性脑损伤。在该方面的一个实施方式中,所述创伤性脑损伤是重度创伤性脑损伤。在该方面的一个实施方式中,用于用途的试剂用于作为载脂蛋白e4等位基因的携带者的个体。在该方面的一个实施方式中,用于用途的试剂用于具有载脂蛋白e3/e4或者载脂蛋白e4/e4基因型的个体。在本发明的一个方面,提供了用于预测创伤性脑损伤后个体中并发症风险的方法,其包括检测个体脑中由于创伤性脑损伤事件而倾向于聚集的一种或多种肽的一种或多种聚集形式,其中脑中这些一种或多种聚集体增加的水平表示增加的并发症风险。在该方面的一个实施方式中,一种或多种肽选自由aβ肽、α-突触核蛋白肽和τ-肽组成的组。在该方面的一个实施方式中,肽的一种或多种聚集形式是处于原纤维形式的聚集的aβ肽。在该方面的一个实施方式中,肽的一种或多种聚集形式是通过抗体可检测的。在该方面的一个实施方式中,肽的一种或多种聚集形式是通过结合aβ原纤维的抗体可检测的。在该方面的一个实施方式中,方法还包括载脂蛋白基因型的确定。以下非限制性实施例说明了本发明的某些方面。实施例1uppsala的地区伦理委员会(regionalethicalcommittee)批准了人死后脑材料的使用(决议号2009/089)。从参与本研究的所有受试者(或他们的亲属)获得了书面知情同意。本实施例研究了12位重度tbi受试者。来自uppsala脑库的5个死后ad颞叶皮层脑样品(ad1(swedish突变携带者)、ad3、ad10、ad13和ad18)和4个神经学完整的(ni)对照样品(ubb12、ubb23、ubb24和ubb31),以及具有正常压力性脑积水(nph)的患者(n=4)也包含在本研究中。下表1中提供了12位重度tbi受试者的特征:表1*凝血病^^在ccx之前,在再次手术时实施dc**在初级医院进行asdh和dc的初次手术,ccx+修正的dc二次手术***初次手术用于asdh,在再次手术时进行ccx缩写:dc=去骨瓣减压术,m=男性;f=女性;l=左侧;r=右侧;t=颞叶;f=前额叶;p=顶叶,ccx=皮质挫伤移除;gms=格拉斯哥昏迷量表的汽车组分;spr=运动相关的;mva=汽车事故;hbo=被物体击打;thi=胸部损伤;efx=四肢骨折;ffx=面部骨折,gos=格拉斯哥结局量表;aβ=β-淀粉状蛋白,aa=淀粉状蛋白血管病;app=淀粉样前体蛋白;as=轴索肿胀。方法使用杜恩斯(dounce)匀浆器(2×10冲程),根据生产商(completemini,roche),在重量:体积为1:10的添加了蛋白酶抑制剂的tris缓冲盐水(20mm的tris,137mm的nacl)中将活组织切片和脑样品在冰上均质化。将样品在4℃以16000×g离心1h,并将上清液定义为tbs提取物。aβ1-42肽购自americanpeptidecompany,ca,usa(批次号#12077006t)。将冷冻干燥的肽在10mm的naoh中溶解至100μm。通过将aβ1-42肽在含有0.3m的nacl的0.1m磷酸盐缓冲液(ph7.4)中稀释至50μm制备aβ1-42原纤维。将制剂在37℃培育30min,然后以16000×g离心5min使潜在的大聚集体成粒。如前,通过尺寸排阻色谱(superdex75柱,gehealthcare,瑞典),以0.08ml/min的流速在0.05m的磷酸盐缓冲液,0.15m的nacl,ph7.4中从单体进一步纯化上清液,并在孔隙部分中收集原纤维(nilsberthc等人,(2001)natneurosci4,887-893;walshdm等人,(1997)jbiolchem272,22364-22372;sehlind等人,(2012)plosone7,e32014)。将用于确定总蛋白含量的常规测定用于产生对aβ-数据归一化的数据集(bca蛋白质测定试剂盒,#23227,pierce)。aβ原纤维的测定先前在englundh等人(2007jneurochem103,334-345)中的mab158夹层elisa特异性检测aβ原纤维而无aβ单体的干扰。将原纤维-选择性单克隆小鼠抗体mab158(igg2a,bioarcticneuroscience,stockholm,sweden)在无菌pbs(ph7.5)中以2mg/ml的浓度配置并且抗体先前已进行鉴定。用2μg/mlmab158在pbs中的溶液在+4℃涂覆elisa板过夜并用1%bsa中pbs中的溶液封闭1h。将tbs提取液稀释5倍并在22℃,振荡(600rpm)培育2h(重复2次),然后加入生物素化的mab158(0.5μg/ml)并将板再培育1h。将抗生蛋白链菌素-hrp(mabtech,瑞典1:5000)用作检测试剂(1h培育)。用tmb底物使板显色,并在25min后通过加入2m的h2so4终止反应。在450nm测量光密度,并使用4-参数方程,根据aβ42原纤维标准曲线计算样品浓度。将数据与总蛋白数据集一起再次计算,并作为每个样品中每mg总蛋白的pg原纤维表示。aβ寡聚物/原纤维(ols)的测定mab82e1夹层elisa检测aβ寡聚物/原纤维(二聚体至原纤维)而不结合aβ单体(tuckers等人,(2015)jalzheimer’sdis.2015;43(2):575-88,补充图4)。mab82e1是检测β-分泌酶切割的aβpp的n-末端的抗体(ibl,japan)。在本发明描述的mab82e1夹层elisa中,将纯mab82e1用于捕获并且相同的生物素化的抗体用于检测。mab82e1的夹层elisa规程在本质上与以上mab158夹层elisa相同,除了elisa板的涂层和检测是在0.25μg/ml的mab82e1浓度下进行的。使用4-参数方程,根据aβ42原纤维标准曲线计算样品浓度。将数据与总蛋白数据集一起再次计算,并作为每个样品中每mg总蛋白的pg寡聚物表示。单体aβ38、40和42在三合一(三重)孔形式中测量aβ38、aβ40和aβ42的全长和截短形式(mab6e10检测,产品目录号k15200e-2和mab4g8检测,产品目录号k15199e-2)的两种不同的免疫测定试剂盒得自mesoscalediscovery(rockville,md,usa)。在10-倍稀释和加入至2个重复孔中之前,通过在1%sds中煮沸使tbs提取物变性和单体化。将相同最终浓度的sds(0.1%)加入至与试剂盒一起提供的aβ标准品中,并且该程序已显示不干扰测定(数据未显示)。将数据再次计算,并作为每个样品中每mg总蛋白的pgaβ表示。hama分析人抗小鼠抗体(hama)存在于10-20%未实验处理的血清样品中并且可以潜在地在夹层elisa法中交联抗体,从而导致假阳性信号(koshida等人,2010)。为了处理hama,在存在hama缓冲液(365j2,mabtech,sweden)的情况下并通过用不相关的小鼠igg(015-000-003,jacksonimmunoresearch,westgrove,pa,usa)涂覆elisa板进行mab158和mab82e1elisa。载脂蛋白e基因分型基本如hixsonandvernier(jlipidres1990,mar;31(3):545-8)中的描述并对引物序列稍作修改来进行载脂蛋白e(apoe)基因分型。使用商品化试剂盒(qiaampdnaminikit,产品目录号51304),从25mg脑组织制备基因组dna。使用正向apoe引物(agacgcgggcacggctgtccaaggagc)(seqidno:1)和反向apoe引物(tcgcgggccccggcctggtacactgc)(seqidno:2)并加入5%dmso,如生产商使用taq聚合酶(thermoscientific,产品目录号ab0908)对40ng的dna进行pcr扩增。完成35轮pcr循环:变性,95℃-1min;退火,95℃-1min和延伸72℃-1.5min。根据生产商使用限制酶hhai(thermoscientific,产品目录号10819870)切割244bppcr产物并将消化片段在高分辨率4%metaphortm琼脂糖凝胶(lonza,产品目录号50181)上分离。结果创伤性脑损伤(tbi)是确定的阿尔茨海默氏病(ad)的风险因素。ad脑中的标志性病理发现是淀粉状蛋白-β(aβ)的不溶性斑,尽管最近的证据表明可溶性和神经毒性aβ寡聚物(ols)和原纤维(pfs)可能是导致认知障碍和神经变性的更重要原因。意外地,先前在tbi患者亚组中在数小时内观察到了aβ斑,并在重度tbi之后持续长达几年。然而,潜在的神经毒性aβols和pfs在tbi中的作用尚未确立。将酶联免疫吸附测定(elisa)用于评价的12位重度tbi患者(平均49.6岁,范围在19-74岁之间)中在损伤后第1周内由于危急生命的脑肿胀和/或颅内压升高通过手术切除的脑组织中aβ寡聚物和原纤维(ols)的存在。将来自ad患者的死后脑组织(n=5)和来自具有正常压力性脑积水的患者的皮层活组织检查(n=4)和来自死于不相关原因的神经学完整的(ni)患者的死后脑组织(n=4)用作对照。tbi组织的亚组的免疫组织化学(n=9)示出了3/9位tbi患者中的aβ斑。当与对照组相比时,tbi患者中aβols(中值129(范围29-342)相对于0(范围0-0)pg/mg总蛋白,p<0.01)和pfs(中值17.5(范围0-626)相对于0(范围0-0)pg/mg总蛋白,p<0.01)水平升高。与ad患者(中值ols27,范围0-399,p=0.16和pfs0,范围0-78,p=0.37)相比,在tbi中脑组织中的aβols和pfs的水平也较高(中值ols129,范围29-342和pfs17.5,范围0-626pg/mg总蛋白)。具有aβ斑的免疫组织化学证据的患者具有最高的aβpfs水平。我们得到以下结论:人tbi引起损伤脑组织中可溶性aβ寡聚物和原纤维的快速积累。可溶性aβ物质的诱导可以加剧继发性脑损伤并有助于tbi之后ad风险的增加。下表2中提供了apoe基因分型的结果。表2患者#apoe基因型#1e3/e3#2e3/e3#3e3/e3#6e3/e4#7e3/e3#8e3/e4#9e2/e4#10e3/e4#11e3/e3#14e3/e4#15e3/e3#16e3/e3在三个单独的实验中进行pcr扩增和hhai限制并且结果类似。具有高aβ原纤维水平的12位tbi患者中有4位(图1a)被鉴别为具有e3/e4基因型。剩余8位患者中,具有低或不可检测的aβ原纤维水平的7位患者具有e3/e3基因型,具有低或不可检测的aβ原纤维水平的1位患者具有e2/e4基因型。e3/e4基因型是ad组中最常见的基因型并且在脑积水对照中,4位患者中有1位携带了e3/e4基因型,该频率类似于在一般人群中所预期的(http://www.alzgene.org/meta.asp?geneid=83)。数据表明了携带e3/e4基因型和在创伤性脑损伤后不久通过高aβ原纤维水平进行响应之间的联系。平行于hama缓冲液和/或不相关的小鼠igg涂层,使用标准环境进行的mab158和mab82e1elisa结果表明观察结果正确并且不是测定中hama活性的结果(数据未显示)。从本研究得到以下结论:在12位tbi患者中的4位中(33%),与对照脑相比,有可能测量aβ原纤维水平的升高。在相同的4位tbi患者中,与对照脑相比,检测到可溶性aβ42水平的升高。在12位tbi患者中的11位中,与对照脑相比,测量了aβ寡聚物水平的升高。可溶性aβ42是主要的n-末端截短形式。本文的具体实施例和实施方式在本质上仅是示例性的并且不意欲限制权利要求所限定的本发明。参考本说明书,其它实施方式和实施例及其优势对于本领域的技术人员将是显而易见的并且在所主张的本发明的范围内。序列表<110>生命北极神经科学公司(bioarcticneuroscienceab)<120>用于治疗创伤性脑损伤的方法<130>4011827-202309<150>us62/195,183<151>2015-07-21<150>us62/288,813<151>2016-01-29<160>2<170>patentin3.5版<210>1<211>27<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<223>引物(primer)<400>1agacgcgggcacggctgtccaaggagc27<210>2<211>26<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<223>引物(primer)<400>2tcgcgggccccggcctggtacactgc26当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1