一种三唑类抗真菌药的晶型及其制备方法与流程
本发明涉及一种三唑类抗真菌药物的晶型及其制备方法,属于药物化学领域。
背景技术:
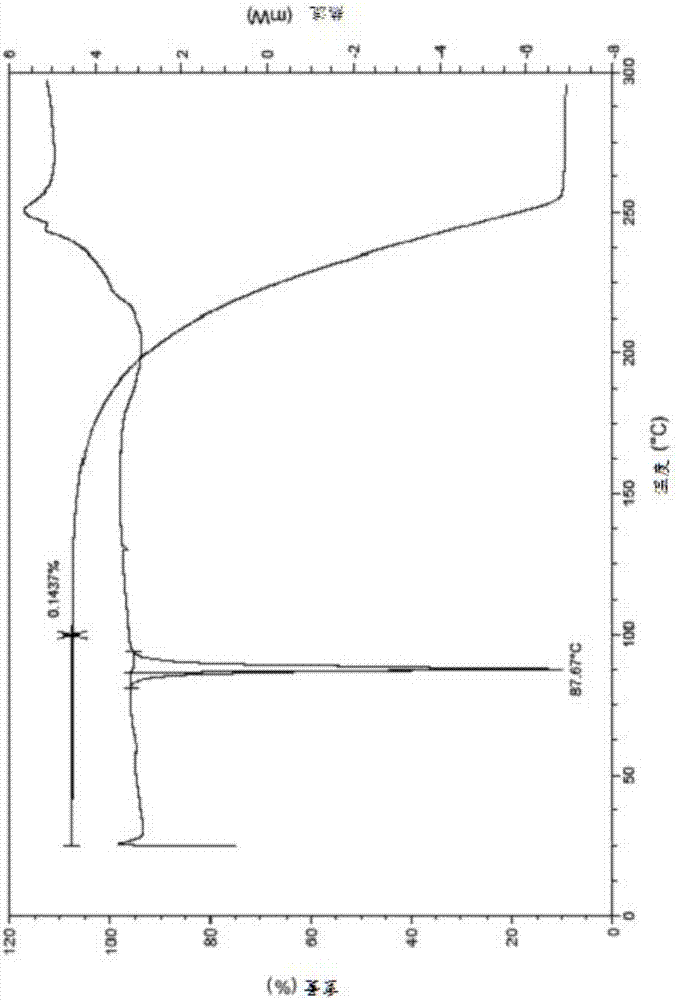
:艾氟康唑(efinaconazole),一种三唑类局部抗真菌药物。在美国,所述药品被用于局部治疗由红色毛癣菌和须发癣菌引起的甲癣;在日本,所述药品用于治疗由毛癣菌属造成的甲癣;其结构如下式(1)所示:药物多晶型是药品研发中的常见现象,是影响药品质量的重要因素。同一药物的不同晶型在外观、流动性、溶解度、储存稳定性、生物利用度等理化性质方面可能会有显著不同,可能存在极大差异,会对药物的储存转移、应用、稳定性、疗效等产生不同的影响;为了得到有效的利于生产或利于药物制剂的晶型,需要对药物的结晶行为进行全面的考察,以得到满足生产要求的晶型。技术实现要素:发明概述本发明第一方面提供了艾氟康唑的两种新晶型。本发明第二方面提供了所述艾氟康唑晶型的制备方法。术语定义本发明意图涵盖所有的替代、修改和等同技术方案,它们均包括在如权利要求定义的本发明范围内。本领域技术人员应认识到,许多与本文所述类似或等同的方法和材料能够用于实践本发明。本发明绝不限于本文所述的方法和材料。在所结合的文献、专利和类似材料的一篇或多篇与本申请不同或相矛盾的情况下(包括但不限于所定义的术语、术语应用、所描述的技术等等),以本申请为准。应进一步认识到,本发明的某些特征,为清楚可见,在多个独立的实施方案中进行了描述,但也可以在单个实施例中以组合形式提供。反之,本发明的各种特征,为简洁起见,在单个实施方案中进行了描述,但也可以单独或以任意合适的子组合提供。除非另外说明,本发明所使用的所有科技术语具有与本发明所属领域技术人员的通常理解相同的含义。本发明涉及的所有专利和公开出版物通过引用方式整体并入本发明。除非另外说明,应当应用本文所使用的下列定义。出于本发明的目的,化学元素与元素周期表cas版,和1994年第75版《化学和物理手册》一致。此外,有机化学一般原理可参考"organicchemistry",thomassorrell,universitysciencebooks,sausalito:1999,和"march'sadvancedorganicchemistry”bymichaelb.smithandjerrymarch,johnwiley&sons,newyork:2007中的描述,其全部内容通过引用并入本文。术语“包含”或“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。术语“晶型”用来描述固体化合物的存在状态,描述晶体内部的离子、原子或分子组成、对称性质与周期排列规律的多种参量集合体。术语“基本上如图所示”是指基本上纯净的某种“晶型”其x-射线粉末衍射图中至少50%,或至少60%,或至少70%,或至少80%,或至少90%,或至少95%,或至少99%的峰出现在所给出的x-射线粉末衍射图中。当样品中某种晶型的含量逐渐降低时,其x-射线粉末衍射图中的一些归属于该晶型的衍射峰可能会由于仪器的检测灵敏度的因素而变少。术语“相对强度”是指将归属于某一晶型的一组衍射峰中的第一强峰的强度定义为100%时,其它峰的强度与第一强峰的强度的比值。在本发明的上下文中,x-射线粉末衍射图中的2θ(又称2theta或衍射峰)值均以度(°)为单位。当提及图谱和/或图中数据,术语“衍射峰”是指本领域的技术人员不会归属于背景噪音的一个特征。所述晶型的x-射线粉末衍射峰,其x-射线粉末衍射图谱的2θ或衍射峰的量度有实验误差,在一台机器和另一台机器之间以及一个样品和另一个样品之间,x-射线粉末衍射图谱的2θ或衍射峰的量度可能会略有差别,所述实验误差或差别的数值可能是+/-0.2个单位或+/-0.1个单位或+/-0.05个单位,因此所述2θ或衍射峰的数值不能视为绝对的。所述晶型的差示扫描量热曲线(dsc)有实验误差,在一台机器和另一台机器之间以及一个样品和另一个样品之间,吸热峰的位置和峰值可能会略有差别,实验误差或差别的数值可能小于等于5℃,或小于等于4℃,或小于等于3℃,或小于等于2℃,或小于等于1℃,因此所述dsc吸热峰的峰位置或峰值的数值不能视为绝对的。所述晶型的热重分析曲线(tga)有实验误差,在一台机器和另一台机器之间以及一个样品和另一个样品之间,吸热曲线或失重率可能会略有差别,实验误差或差别的数值可能小于等于0.004%或0.003%或0.002%或0.001%,因此所述热重分析曲线或其失重率不能视为绝对的。在本发明上下文中,无论是否使用“大约”或“约”等字眼,所有在此公开了的数字均为近似值。每一个数字的数值有可能会出现1%,2%,或5%等差异。当大约用来形容x-射线粉末衍射峰的2θ(又称2theta或衍射峰)值时,大约表示所述2θ值可能有+/-0.2个单位或+/-0.1个单位或+/-0.05个单位差异。“室温”是指温度在大约20℃-35℃或大约23℃-28℃或大约25℃。术语“良溶剂”可以是单一溶剂或混合溶剂,指艾氟康唑在该单一溶剂或混合溶剂中的溶解度大于1g/l,或大于2g/l,或大于3g/l,或大于4g/l,或大于5g/l,或大于6g/l,或大于7g/l,或大于8g/l,或大于9g/l,或大于10g/l,或大于15g/l,或大于20g/l,或大于30g/l,或大于40g/l,或大于50g/l,或大于60g/l,或大于70g/l,或大于80g/l,或大于100g/l。在一些实施例中,艾氟康唑在良溶剂中的溶解度比不良溶剂大;在一些实施例中,良溶剂和不良溶剂对艾氟康唑的溶解度之差大约为10%,20%,30%,40%,50%,60%,70%,80%或90%;在一些实施例中,良溶剂对艾氟康唑的溶解度比不良溶剂大,大于10%,20%,30%,40%,50%,60%,70%,80%或90%。术语“不良溶剂”是指能促进溶液达到过度饱和状态或结晶的溶剂。在一些实施例中,艾氟康唑在不良溶剂中的溶解度小于0.001g/l,或小于0.01g/l,或小于0.1g/l,或小于0.2g/l,或小于0.3g/l,或小于0.4g/l,或小于0.5g/l,或小于0.6g/l,或小于0.8g/l,或小于1g/l,或小于2g/l,或小于3g/l,或小于4g/l,或小于5g/l,或小于6g/l,或小于7g/l,或小于8g/l,或小于9g/l,或小于10g/l。发明详述第一方面,发明人通过研究开发了艾氟康唑的晶型i,晶型ii。艾氟康唑的晶型i,具有如下特性:其x-射线粉末衍射图中在2θ为7.75,12.58,15.27,15.48,16.79,18.98度的位置有峰。一些实施例中,艾氟康唑的晶型i的x-射线粉末衍射图中在2θ为7.75,10.65,12.58,15.27,15.48,16.79,18.98,20.20,23.87,26.38,33.88度的位置的一处或多处有峰。一些实施例中,艾氟康唑的晶型i的x-射线粉末衍射图中在2θ为7.75,10.65,12.58,15.27,15.48,16.79,18.98,20.20,21.29,23.87,24.57,26.38,27.34,33.88度的位置的一处或多处有峰。一些实施例中,艾氟康唑的晶型i的x-射线粉末衍射图中在2θ为7.75,10.65,12.58,15.27,15.48,16.79,18.98,20.20,21.29,23.87,24.57,25.41,26.11,26.38,27.34,30.22,33.88度的位置的一处或多处有峰。一些实施例中,艾氟康唑的晶型i的x-射线粉末衍射图基本上如图1所示,其中,在2θ为15.48度的峰的相对强度大于50%,或大于70%,或大于80%,或大于90%,或大于99%。艾氟康唑的晶型i,还具有如下特性:其差示扫描量热曲线(dsc)在84℃-89℃处具有吸热峰。在一具体实施方式中,其差示扫描量热曲线(dsc)在84℃-88℃处具有吸热峰,吸热峰峰顶值为约88℃。在一些实施方式中,艾氟康唑的晶型i的差示扫描量热曲线(dsc)如图2所示。晶型i的dsc揭示其加热到约84℃开始熔解。所述艾氟康唑晶型i不吸湿,不含结晶溶剂或结晶水,为非溶剂合物或非水合物。在一些实施方式中,艾氟康唑晶型i的热重分析曲线(tga)如图2所示。所述艾氟康唑的晶型i为具有良好外观和流动性的粉末,在溶解性、稳定性、流动性等方面具有良好的性能,有利于储存、转移、生产工艺中操作,适于制备成其外用制剂。艾氟康唑的晶型ii,具有如下特性:其x-射线粉末衍射图中在2θ为7.68,11.41,13.82,16.05,16.71,17.84,20.19度的位置有峰。一些实施例中,艾氟康唑的晶型ii的x-射线粉末衍射图中在2θ为7.68,11.41,13.82,15.38,16.05,16.71,17.84,18.92,20.19度的位置的一处或多处有峰。一些实施例中,艾氟康唑的晶型ii的x-射线粉末衍射图中在2θ为7.68,11.41,13.82,15.38,16.05,16.71,17.84,18.92,20.19,23.12,23.54,26.14度的位置的一处或多处有峰。一些实施例中,艾氟康唑的晶型ii的x-射线粉末衍射图中在2θ为7.68,11.41,13.82,15.38,16.05,16.71,17.84,18.92,20.19,23.12,23.54,26.14,27.27,30.19,31.87度的位置的一处或多处有峰。一些实施例中,艾氟康唑的晶型ii的x-射线粉末衍射图基本上如图3所示,其中,在2θ为15.38度的峰的相对强度大于50%,或大于70%,或大于80%,或大于90%,或大于99%。艾氟康唑的晶型ii,还具有如下特性:其差示扫描量热曲线(dsc)在84℃-89℃处具有吸热峰。在一具体实施方式中,其差示扫描量热曲线(dsc)在84℃-88℃处具有吸热峰,吸热峰峰顶值为约85℃。在一些实施方式中,艾氟康唑的晶型ii的差示扫描量热曲线(dsc)如图4所示。晶型ii的dsc揭示其加热到约82℃开始分解。所述艾氟康唑晶型ii不吸湿,不含结晶溶剂或结晶水,为非溶剂合物或非水合物。在一些实施方式中,艾氟康唑晶型ii的热重分析曲线(tga)如图4所示。所述艾氟康唑的晶型ii为具有良好流动性的粉末,在溶解度、流动性等方面具有良好的性能,有利于储存、转移、生产工艺中操作,适于制备成其外用制剂。第二方面,本发明提供了制备前述艾氟康唑晶型i或晶型ii的方法。具体地,一种制备艾氟康唑晶型i的方法包括:将艾氟康唑溶解于良溶剂中,然后置于空气中在室温下挥发溶剂或减压蒸干溶剂后析出晶体,收集晶体得到晶型i。在一些实施例中,所述良溶剂为甲醇、乙醇、三氟乙醇、正丙醇、正丁醇、仲丁醇、异丁醇、丙酮、乙酸乙酯、乙腈、乙酸异丙酯、甲酸乙酯、甲酸丁酯、乙酸甲酯、乙醚、异丙醚和乙二醇二甲醚中的一种或多种。在一些实施方式中,所述良溶剂优选为三氟乙醇、甲酸乙酯、甲酸丁酯、乙酸甲酯和乙二醇二甲醚中的一种或多种。在一些实施方式中,所述良溶剂相对于艾氟康唑的用量为1ml/g-50ml/g。在一些实施方式中,所述良溶剂相对于艾氟康唑的用量优选为2ml/g-30ml/g。一种制备艾氟康唑晶型i的方法包括:将艾氟康唑溶解于良溶剂中,升温至50℃-70℃,然后加入不良溶剂,析出晶体,收集晶体,除去溶剂,得到晶型i。在一些实施方式中,所述良溶剂为甲醇、乙醇、无水乙醇、三氟乙醇、正丙醇、正丁醇、仲丁醇、异丁醇、丙酮、乙酸乙酯、乙腈、乙酸异丙酯、甲酸乙酯、甲酸丁酯、乙酸甲酯、乙醚、异丙醚和乙二醇二甲醚中的一种或多种;所述不良溶剂为水,正己烷,正戊烷,环己烷和正庚烷中的一种或多种。在一些实施方式中,所述良溶剂优选为三氟乙醇、甲酸乙酯、甲酸丁酯、乙酸甲酯和乙二醇二甲醚中的一种或多种。在一些实施方式中,所述良溶剂相对于艾氟康唑的用量为1ml/g-50ml/g。在一些实施方式中,所述良溶剂相对于艾氟康唑的用量优选为2ml/g-30ml/g。在一些实施方式中,所述不良溶剂为水、环己烷、正戊烷和正庚烷中的一种或多种。在一些实施方式中,所述不良溶剂优选为正戊烷,正庚烷中的一种或两种。在一些实施方式中,所述不良溶剂优选为水。在一些实施方式中,所述不良溶剂相对于艾氟康唑的用量为1ml/g-50ml/g。在一些实施方式中,所述不良溶剂相对于艾氟康唑的用量优选为5ml/g-20ml/g。在一些实施方式中,所述良溶剂与不良溶剂的体积比为1:6~1:0.5。在一些实施方式中,所述良溶剂与不良溶剂的体积比优选为1:5~1:1。具体地,一种制备艾氟康唑晶型ii的方法包括:将艾氟康唑溶解于异丙醇、四氢呋喃、甲基叔丁基醚、正戊醇、丁酮、二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种溶剂中,然后置于空气中在室温下挥发溶剂,收集晶体得到晶型ii。一种制备艾氟康唑晶型ii的方法包括:将艾氟康唑溶解于丙酮、丁酮、二氯甲烷、二氯乙烷、四氢呋喃和甲基叔丁基醚中的一种或多种溶剂中,然后室温减压蒸干溶剂后析出晶体,收集晶体得到晶型ii。一种制备艾氟康唑晶型ii的方法包括:将艾氟康唑溶解于丙酮、丁酮、二氯甲烷、二氯乙烷、四氢呋喃和甲基叔丁基醚中的一种或多种溶剂中,然后喷雾干燥,收集晶体得到晶型ii。一种制备艾氟康唑晶型ii的方法包括:将艾氟康唑溶解于良溶剂中,控制低温温度反应,然后加入不良溶剂,析出晶体,收集晶体,除去溶剂,得到晶型ii。在一些实施方式中,所述良溶剂为甲醇、乙醇、三氟乙醇、正丙醇、正丁醇、仲丁醇、异丁醇、丙酮、乙酸乙酯、乙腈、乙酸异丙酯、甲酸乙酯、甲酸丁酯、乙酸甲酯、乙醚、异丙醚和乙二醇二甲醚中的一种或多种。在一些实施方式中,所述良溶剂相对于艾氟康唑的用量为1ml/g-100ml/g。在一些实施方式中,所述良溶剂相对于艾氟康唑的用量优选为5ml/g-60ml/g。在一些实施方式中,所述不良溶剂为水,正己烷,正戊烷,环己烷和正庚烷中的一种或多种。在一些实施方式中,所述不良溶剂优选为水,正己烷,正戊烷和正庚烷中的一种或多种。在一些实施方式中,所述不良溶剂相对于艾氟康唑的用量为1ml/g-100ml/g。在一些实施方式中,所述不良溶剂相对于艾氟康唑的用量优选为10ml/g-50ml/g。在一些实施方式中,所述良溶剂与不良溶剂的体积比为1:8~1:0.2。在一些实施方式中,所述良溶剂与不良溶剂的体积比优选为1:5~1:1。在一些实施方式中,所述低温温度为-15℃-25℃。在一些实施方式中,所述低温温度优选为-5℃-15℃。附图说明图1示艾氟康唑晶型i的x-射线粉末衍射图。图2示艾氟康唑晶型i的差示扫描热曲线及热重分析图(dsc&tga)。图3示艾氟康唑晶型ii的x-射线粉末衍射图。图4示艾氟康唑晶型ii的差示扫描热曲线及热重分析图(dsc&tga)。具体实施方式为了使本领域的技术人员更好地理解本发明的技术方案,下面进一步披露一些非限制实施例对本发明作进一步的详细说明。本发明所使用的试剂均可以从市场上购得或者可以通过本发明所描述的方法制备而得。本发明中,g表示克,ml表示毫升,l表示升,h表示小时,min表示分钟。仪器参数除非参数中另行规定,以下所有分析都在室温下进行。x-射线粉末衍射(xrpd)在装配有自动化3*15零背景样品架的透射反射样品台的荷兰panalyticalempyreanx-射线衍射仪上收集x-射线粉末衍射(xrpd)图案。所用辐射源为(cu,kα,kα11.540598;kα21.544426;kα2/kα1强度比例:0.50),其中电压设定在45kv,电流设定在40ma.x-射线的束发散度,即样品上x-射线约束的有效尺寸,为10mm.采用θ-θ连续扫描模式,得到3°~40°的有效2θ范围。取适量样品在环境条件(约18℃~32℃)下于零背景样品架圆形凹槽处,用洁净的载玻片轻压,得到一个平整的平面,并将零背景样品架固定。将样品以0.0168°的扫描步长在3~40°2θ±0.2°范围内产生传统的xrpd图案。用于数据收集的软件为datacollector,数据用dataviewer和highscoreplus分析和展示。差示扫描量热法(dsc)dsc测量在tainstrumentstm型号q2000中用密封盘装置进行。将样品(约1~3mg)在铝盘中称量,用tzero压盖,精密记录到百分之一毫克,并将样品转移至仪器中进行测量。仪器用氮气以50ml/min吹扫。在室温到300℃之间以10℃/min的加热速率收集数据。以吸热峰向下进行绘图,数据用tauniversalanalysis分析和展示。热重分析法(tga)在tainstrumentsq500上采集tga数据。使用认证的镍校准仪器的温度。通常将8-12mg样品加载到预称重的铂金坩埚上,并以10℃/min从室温加热至300℃。在样品上方保持60ml/min的氮气清扫。在tga图中,横坐标表示温度(temperature,℃),纵坐标表示失重的百分含量(weight(%))。实施例1制备晶型i将0.30g的艾氟康唑粗品加入1ml无水乙醇中,置于60℃油浴中搅拌得到澄清溶液后,再缓慢滴加入5ml水,恒温搅拌30分钟,降温析出白色固体,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.23g。经测定为晶型i,其x射线粉末衍射图谱与图1基本一致,其dsc-tga图谱与图2基本一致。实施例2制备晶型i将0.30g的艾氟康唑粗品加入2ml三氟乙醇中,置于50℃油浴中搅拌得到澄清溶液后,再缓慢滴加入6ml水,恒温搅拌30分钟,降温析出白色固体,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.20g。经测定为晶型i,其x射线粉末衍射图谱与图1基本一致,其dsc-tga图谱与图2基本一致。实施例3制备晶型i将0.30g的艾氟康唑粗品加入1ml甲酸乙酯中,置于50℃油浴中搅拌得到澄清溶液后,再缓慢滴加入5ml正戊烷,恒温搅拌30分钟,降温析出白色固体,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.21g。经测定为晶型i,其x射线粉末衍射图谱与图1基本一致,其dsc-tga图谱与图2基本一致。实施例4制备晶型i将0.30g的艾氟康唑粗品加入1ml乙二醇二甲醚中,置于70℃油浴中搅拌得到澄清溶液后,再缓慢滴加入5ml正庚烷,恒温搅拌30分钟,降温析出白色固体,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.19g。经测定为晶型i,其x射线粉末衍射图谱与图1基本一致,其dsc-tga图谱与图2基本一致。实施例5制备晶型i将0.30g的艾氟康唑粗品加入1ml甲酸乙酯中,置于60℃油浴中搅拌得到澄清溶液后,再缓慢滴加入15ml正庚烷,恒温搅拌30分钟,降温析出白色固体,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.22g。经测定为晶型i,其x射线粉末衍射图谱与图1基本一致,其dsc-tga图谱与图2基本一致。实施例6制备晶型i将0.30g的艾氟康唑粗品加入到5ml甲醇和水(甲醇:水=1:1,体积比)混合溶剂中,置于常温下进行混悬搅拌,30分钟后抽滤获得白色固体,并置于干燥箱内室温真空干燥,得到白色晶体约0.20g。经测定为晶型i,其x射线粉末衍射图谱与图1基本一致,其dsc-tga图谱与图2基本一致。实施例7制备晶型i将0.10g的艾氟康唑粗品加入3ml乙醇中,置于常温下搅拌自然挥发,24小时析出白色固体,并置于干燥箱内室温真空干燥,得到白色晶体约0.08g。经测定为晶型i,其x射线粉末衍射图谱与图1基本一致,其dsc-tga图谱与图2基本一致。实施例8制备晶型ii将0.20g的艾氟康唑粗品加入1ml无水乙醇中,置于5℃低温槽中搅拌得到澄清溶液后,再缓慢滴加入5ml水,析出白色固体,恒温搅拌30分钟,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.18g。经测定为晶型ii,其x射线粉末衍射图谱与图3基本一致,其dsc-tga图谱与图4基本一致。实施例9制备晶型ii将1.01g的艾氟康唑粗品加入50ml二氯甲烷中,常温搅拌得到澄清溶液后,再进行喷雾干燥,得到白色晶体。经测定为晶型ii,其x射线粉末衍射图谱与图3基本一致,其dsc-tga图谱与图4基本一致。实施例10制备晶型ii将0.20g的艾氟康唑粗品加入5ml丙酮中,于常温下进行减压旋转蒸发,析出白色固体,继续旋蒸30分钟,取出样品后置于干燥箱内室温真空干燥,得到白色晶体约0.15g。经测定为晶型ii,其x射线粉末衍射图谱与图3基本一致,其dsc-tga图谱与图4基本一致。实施例11制备晶型ii将0.20g的艾氟康唑粗品加入1ml正丙醇中,置于低温槽中控温‐5℃‐15℃,搅拌得到澄清溶液后,再缓慢滴加入5ml水,析出白色固体,恒温搅拌30分钟,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.15g。经测定为晶型ii,其x射线粉末衍射图谱与图3基本一致,其dsc-tga图谱与图4基本一致。实施例12制备晶型ii将0.10g的艾氟康唑粗品加入2ml丙酮中,置于低温槽中控温‐5℃‐15℃,搅拌得到澄清溶液后,再缓慢滴加入5ml正己烷,析出白色固体,恒温搅拌30分钟,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.05g。经测定为晶型ii,其x射线粉末衍射图谱与图3基本一致,其dsc-tga图谱与图4基本一致。实施例13制备晶型ii将0.10g的艾氟康唑粗品加入2ml乙酸乙酯中,置于低温槽中控温‐5℃‐15℃,搅拌得到澄清溶液后,再缓慢滴加入3ml正庚烷,析出白色固体,恒温搅拌30分钟,抽滤并置于干燥箱内室温真空干燥,得到白色晶体约0.06g。经测定为晶型ii,其x射线粉末衍射图谱与图3基本一致,其dsc-tga图谱与图4基本一致。实施例14引湿性测试按照现行中国药典的引湿性试验指导原则,设计实验,考察各种晶型的引湿性,结果如下表1所示:表1:晶型的引湿性考察结果结果表明晶型i和ii均几乎无引湿性。实施例15溶解性测试实验方法:取小烧瓶,加入水和乙醇(水:乙醇=1:3,体积比)的混合溶剂,加入各晶型样品,至固体不再溶解视为饱和,随后用注射器精确取一定量上层清液过滤后置于称量瓶中挥发至干,记录称量瓶前后重量。计算出溶质的重量,然后计算出室温下的溶解度。实验结果:温度晶型溶解度25℃晶型i87.43mg/ml25℃晶型ii193.15mg/ml实施例16稳定性考察根据中国药典2010年版附录xixc的原料药与药物制剂稳定性试验指导原则,对晶型i,晶型ii的样品使用双层pe袋封口包装后进行加速实验。放置条件:40℃±2℃,相对湿度:75%±5%,恒温恒湿箱;和30℃±2℃,相对湿度:65%±5%恒温恒湿箱;放置时间:1个月;在第3、15、30天时分别检测dsc,x-射线粉末衍射,hplc检测有关物质和含量。检测结果:dsc和x-射线粉末衍射检测显示放置1个月后晶型i,晶型ii样品的晶型无变化;hplc检测发现各样品的有关物质和含量变化不超过0.05%,无明显变化。本发明的方法已经通过较佳实施例进行了描述,相关人员明显能在本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1