一种鱼肠道微生物宏基因组总DNA的提取方法及试剂盒与流程
本发明涉及DAN提取领域,尤其涉及一种鱼肠道微生物宏基因组文库构建总DNA的提取方法及试剂盒。
背景技术:
目前传统的微生物研究手段只能培养0.1%~1%的环境微生物,这将无法整体分析和利用微生物群落的构成和功能。宏基因组文库技术可以避开对微生物纯培养的限制,直接从环境中获得DNA分子,通过测序或者文库筛选,为人类进一步利用微生物资源提供了重要手段。DNA的提取与纯化是宏基因组文库构建的第一步,也是最关键的一步。
鱼肠道微生物具有非常重要的研究价值,可以用于研究鱼类健康和营养代谢、获得新型酶制剂等。常规DNA提取主要参照粪便DNA提取法。但是由于在文库构建过程中获得高纯度和高质量的DNA,应尽量避免鱼类体表微生物、鱼类肠道组织和食物的污染,同时还要避免鱼类消化道消化液对DNA的降解。因而,常规DNA提取方法满足不了鱼肠道微生物宏基因组文库构建的要求。所以,现有技术有待于更进一步的改进和发展。
技术实现要素:
鉴于上述现有技术的不足,本发明的目的在于提供的一种鱼肠道微生物宏基因组总DNA的提取方法及试剂盒,在节约成本的前提下,提取高纯度DNA。
为解决上述技术问题,本发明方案包括:
一种用于鱼肠道微生物宏基因组总DNA提取方法的试剂盒,其包括:
溶液A:100mM/L Tris-HCl,1mM/L EDTA,pH 8.0;
溶液B:100mM/L Tris-HCl,20mM/L EDTA,100mM/L NaCl,0.1g/L PVP,100mM/L异硫氰酸胍,0.1%Triton-X100,0.1mM PMSF,1%(v/v)β-巯基乙醇,pH 8.5;
溶液C:100mM/L Tris-HCl,1mM/L EDTA,0.9%NaCl,5mM/L DTT,pH 8.0;
溶液D:50mg/ml蛋白酶K,20mg/ml溶菌酶,100mM/L Tris-HCl,100mM/L NaCl,0.1%SDS,pH 8.0;
溶液E:50%Tris-HCl饱和酚(pH 8.0),48%氯仿,2%异戊醇;
溶液F:96%氯仿,4%异戊醇;
溶液G:异丙醇;
溶液H:70%乙醇。
使用所述试剂盒之鱼肠道微生物宏基因组总DNA的提取方法,其包括以下步骤:
步骤一,将新鲜的样品鱼击昏,用吸水纸吸干样品鱼体表液体,用75%的酒精擦拭样品鱼体表面,置于-20℃冰箱内进行冷冻15-30分钟;
步骤二,使用溶液A配制琼脂糖凝胶溶液,在保温箱内使其平衡到65℃;
步骤三,迅速取出上述步骤一得到的样品鱼,使用步骤二得到的琼脂糖凝胶溶液涂渍样品鱼体表,对样品鱼体表微生物进行固定;冷却后使用灭菌手术剪迅速对鱼体进行解剖,分离得到鱼肠道;
步骤四,使用无菌过滤器吸取对应量的溶液B缓慢注入上述步骤三得到的鱼肠道,重复洗脱3次,将冲洗得到的鱼肠道内容物收集得到鱼肠道内容物溶液;
步骤五,将上述步骤四得到的鱼肠道内容物溶液置于三角瓶中,加入玻璃珠漩涡震荡10-15分钟,得到悬浊液;
步骤六,将8层80目尼龙网纱置于布氏漏斗上,抽滤上述步骤五得到的悬浊液,使用对应量的溶液B清洗沉淀物,并收集滤液;
步骤七,将步骤六所得的滤液在10000rpm条件下离心10分钟并收集沉淀,然后用溶液C重悬沉淀,重复3次,得到下菌体沉淀备用;
步骤八,使用溶液A配置浓度为1%的低熔点琼脂糖凝胶,平衡其温度到45℃;将步骤七得到的菌体沉淀预热到45℃后,向其中加入该1%的低熔点琼脂糖凝胶,混合均匀后注入模具,并在4℃下凝固12小时,得到凝胶;
步骤九,将步骤八得到的凝胶浸入溶液D中,37℃下恒温震荡清洗12小时;
步骤十,将清洗后的凝胶放入低熔点琼脂糖电泳槽中,使用1%的低熔点琼脂糖凝胶进行封闭,在60v条件下电泳10分钟,并在紫外灯下迅速切下琼脂,得到琼脂糖凝胶;
步骤十一,将步骤十切下的琼脂糖凝胶加入等体积的溶液A后,加热到65℃融化,并立即加入等体积溶液E,摇晃混匀,在12000rpm条件下离心5分钟,得到水相;
步骤十二,将步骤十一得到的水相移到另一1.5mL Eppendorf管中,加入相同体积的溶液F,在12000rpm条件下离心5分钟,得到相应水相,
步骤十三,将步骤十二得到的相应水相移到另一1.5mL Eppendorf管中,加入2倍体积预冷溶液G,在-80℃条件下静置沉淀12小时,然后在进行10000rpm条件下离心10分钟;然后向其中加入少量的溶液H重复洗涤2次,得到DNA沉淀;
步骤十四,将步骤十三得到的DNA沉淀在室温下进行干燥,去除酒精对实验结果的影响,然后加入相应量的溶液A溶解得到相应DNA。
本发明提供的一种鱼肠道微生物宏基因组总DNA的提取方法及试剂盒,有效避免了宿主、宿主体表微生物、食物组织DNA的污染,得到的DNA片段没有RNA、蛋白质、多糖、酚类等物质的污染,简化了后期实验的处理,DNA分子链的完整性比常规方法显著提升。所获得的DNA可满足宏基因组文库构建、宏基因组文库测序、PCR分析等实验要求。
附图说明
图1为本发明中提取的小黄鱼肠道微生物总DNA的电泳图;
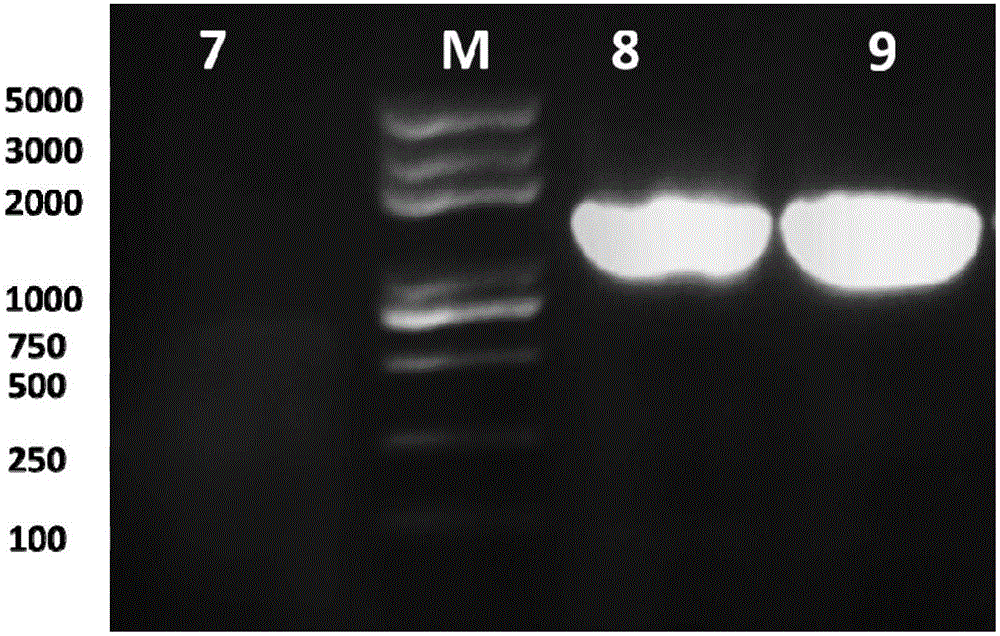
图2为本发明中使用试剂盒进行16S-rRNA基因PCR扩增的电泳图。
具体实施方式
本发明提供了一种鱼肠道微生物宏基因组总DNA的提取方法及试剂盒,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
本发明提供了一种用于鱼肠道微生物宏基因组总DNA提取方法的试剂盒,其包括:
溶液A:100mM/L Tris-HCl,1mM/L EDTA,pH 8.0;
溶液B:100mM/L Tris-HCl,20mM/L EDTA,100mM/L NaCl,0.1g/L PVP,100mM/L异硫氰酸胍,0.1%(v/v)Triton-X100,0.1mM PMSF,1%(v/v)β-巯基乙醇,pH 8.5;
溶液C:100mM/L Tris-HCl,1mM/L EDTA,0.9%NaCl,5mM/L DTT,pH 8.0;
溶液D:50mg/ml蛋白酶K,20mg/ml溶菌酶,100mM/L Tris-HCl,100mM/L NaCl,0.1%SDS,pH 8.0;
溶液E:50%Tris-HCl饱和酚(pH 8.0),48%氯仿,2%异戊醇;
溶液F:96%氯仿,4%异戊醇;
溶液G:异丙醇;
溶液H:70%乙醇。
其更为具体的是:
溶液A为Tris、EDTA的混合溶液,混合溶液中Tris浓度为100mM/L,EDTA浓度为1mM/L,用盐酸调整pH到8.0。
溶液B为Tris、EDTA、NaCl、PVP、异硫氰酸胍、PMSF、β-巯基乙醇的混合溶液,混合溶液中Tris浓度为100mM/L,EDTA浓度为20mM/L,NaCl浓度为100mM/L,PVP浓度为0.1g/L,异硫氰酸胍浓度为100mM/L,PMSF浓度为100mM/L,Triton-X100浓度为0.1%(v/v),β-巯基乙醇浓度为1%(v/v),用盐酸调整pH到8.5。
溶液C为Tris、EDTA、NaCl的混合溶液。混合溶液中Tris浓度为100mM/L,EDTA浓度为1mM/L,NaCl浓度为0.9%,DTT浓度为5mM/L,用盐酸调整pH到8.0。
溶液D为蛋白酶K、溶菌酶、Tris、NaCl、SDS的混合溶液,其中蛋白酶K浓度为50mg/mL,溶菌酶浓度为20mg/mL,Tris100mM/L,NaCl浓度为100mM/L,SDS浓度为0.1%,用盐酸调整pH到8.0。
溶液E为Tris饱和酚(pH 8.0)、氯仿和异戊醇混合溶液。Tris饱和酚(pH 8.0)体积分数为50%,氯仿体积分数为48%,异戊醇体积分数为2%。
溶液F为氯仿异戊醇混合溶液,氯仿体积分数为96%,异戊醇体积分数为4%。溶液G为异丙醇,溶液H为70%乙醇水溶液。
其具体的作用如下:溶液A用于配置琼脂糖凝胶溶液,在此环境下,微生物DNA可以保持稳定。溶液B用于鱼肠道内容物的冲洗和收集,该试剂可以灭活或抑制DNA酶、蛋白酶等酶的活性,降低内容物中细菌菌体的降解。溶液C用于稀释引起肠道微生物细胞裂解和DNA水解的酶及其抑制剂,稳定肠道微生物细胞。溶液D用于对胶块中的微生物细胞进行裂解。溶液E使融化的胶块中的蛋白质发生变性并使其与DNA分离,萃取部分糖、脂类等杂质。溶液F使残留Tris酚溶解到有机相中,进一步去除杂质。溶液G的作用是沉淀DNA。溶液H的作用是清洗和沉淀DNA。
本发明还提供了一种使用上述试剂盒之鱼肠道微生物宏基因组总DNA的提取方法,其包括以下步骤:
步骤一,将新鲜的样品鱼击昏,用吸水纸吸干样品鱼体表液体,用75%的酒精擦拭样品鱼体表面,置于-20℃冰箱内进行冷冻15-30分钟;
步骤二,使用溶液A配制琼脂糖凝胶溶液,在保温箱内使其平衡到65℃;
步骤三,迅速取出上述步骤一得到的样品鱼,使用步骤二得到的琼脂糖凝胶溶液涂渍样品鱼体表,对样品鱼体表微生物进行固定;冷却后使用灭菌手术剪迅速对鱼体进行解剖,分离得到鱼肠道;
步骤四,使用无菌过滤器吸取对应量的溶液B缓慢注入上述步骤三得到的鱼肠道,重复洗脱3次,将冲洗得到的鱼肠道内容物收集得到鱼肠道内容物溶液;
步骤五,将上述步骤四得到的鱼肠道内容物溶液置于三角瓶中,加入玻璃珠漩涡震荡10-15分钟,得到悬浊液;
步骤六,将8层80目尼龙网纱置于布氏漏斗上,抽滤上述步骤五得到的悬浊液,使用对应量的溶液B清洗沉淀物,并收集滤液;
步骤七,将步骤六所得的滤液在10000rpm条件下离心10分钟并收集沉淀,然后用溶液C重悬沉淀,重复3次,得到下菌体沉淀备用;
步骤八,使用溶液A配置浓度为1%的低熔点琼脂糖凝胶,平衡其温度到45℃;将步骤七得到的菌体沉淀预热到45℃后,向其中加入该1%的低熔点琼脂糖凝胶,混合均匀后注入模具,并在4℃下凝固12小时,得到凝胶;
步骤九,将步骤(8)得到的凝胶浸入溶液D中,37℃下恒温震荡清洗12小时;
步骤十,将清洗后的凝胶放入低熔点琼脂糖电泳槽中,使用1%的低熔点琼脂糖凝胶进行封闭,在60v条件下电泳10分钟,并在紫外灯下迅速切下琼脂,得到琼脂糖凝胶;
步骤十一,将步骤十切下的琼脂糖凝胶加入等体积的溶液A后,加热到65℃融化,并立即加入等体积溶液E,摇晃混匀,在12000rpm条件下离心5分钟,得到水相;
步骤十二,将步骤十一得到的水相移到另一1.5mL Eppendorf管中,加入相同体积的溶液F,在12000rpm条件下离心5分钟,得到相应水相,
步骤十三,将步骤十二得到的相应水相移到另一1.5mL Eppendorf管中,加入2倍体积预冷溶液G,在-80℃条件下静置沉淀12小时,然后在进行10000rpm条件下离心10分钟;然后向其中加入少量的溶液H重复洗涤2次,得到DNA沉淀;
步骤十四,将步骤十三得到的DNA沉淀在室温下进行干燥,去除酒精对实验结果的影响,然后加入相应量的溶液A溶解得到相应DNA
为了更详尽的描述本发明,以下列举更为详尽的实施例进行说明。
(1)将新鲜的小黄鱼击昏,用吸水纸吸干体表液体,用75%的酒精擦拭鱼体表面,置于-20℃冰箱内进行冷冻15-30分钟;
(2)使用溶液A配制琼脂糖凝胶溶液,在保温箱内使其平衡到65℃;
(3)迅速取出上述步骤(1)得到的鱼体,使用步骤(2)得到的琼脂糖凝胶溶液涂渍鱼体表,对其体表微生物进行固定,冷却后使用灭菌手术剪迅速对鱼体进行解剖,小心分离得到鱼肠道;
(4)使用无菌过滤器吸取5mL的溶液B缓慢注入上述步骤(3)得到的鱼肠道,重复洗脱3次,将冲洗得到的鱼肠道内容物收集得到鱼肠道内容物溶液;
(5)将上述步骤(4)得到的鱼肠道内容物溶液置于三角瓶中,加入玻璃珠漩涡震荡10-15分钟,得到悬浊液;
(6)将8层80目尼龙网纱置于布氏漏斗上,抽滤上述步骤(5)得到的悬浊液,使用15mL的溶液B清洗沉淀物,并收集滤液;
(7)将步骤(6)所得的滤液在10000rpm条件下离心10分钟并收集沉淀,然后用溶液C重悬沉淀,重复3次,得到下菌体沉淀备用;
(8)使用溶液A配置浓度为1%的低熔点琼脂糖凝胶,平衡其温度到45℃;将步骤(7)得到的菌体沉淀预热到45℃后,向其中加入该1%的低熔点琼脂糖凝胶,混合均匀后注入模具,并在4℃下凝固12小时,得到凝胶;
(9)将步骤(8)得到的凝胶浸入溶液D中,37℃下恒温震荡清洗12小时;
(10)将清洗后的凝胶放入低熔点琼脂糖电泳槽中,使用1%的低熔点琼脂糖凝胶进行封闭,在60v条件下电泳10分钟,并在紫外灯下迅速切下琼脂,得到琼脂糖凝胶;
(11)将步骤(10)切下的琼脂糖凝胶加入等体积的溶液A后,加热到65℃融化,并立即加入等体积溶液E,摇晃混匀,在12000rpm条件下离心5分钟,得到水相;
(12)将步骤(11)得到的水相移到另一1.5mL Eppendorf管中,加入相同体积的溶液F,在12000rpm条件下离心5分钟,得到相应水相;
(13)将步骤(12)得到的相应水相移到另一1.5mL Eppendorf管中,加入2倍体积预冷溶液G;
(14)在-80℃条件下静置沉淀12小时,然后在进行10000rpm条件下离心10分钟;
(15)然后向其中加入少量的溶液H重复洗涤2次,得到DNA沉淀;
(16)将步骤(15)得到的DNA沉淀在室温下进行干燥,去除酒精对实验结果的影响;
(17)加入100μL的溶液A溶解得到相应DNA。
如图1以及表1所示的,表1为使用nanodrop超微量风光光度计分析样品浓度及纯度结果。
表1
其中,样品1:为本发明试剂盒提取样品;M:分子量标marker;样品2:为SDS法提取样品;样品3:为CTAB法提取样品;样品4:为柱层析试剂盒1提取样品;样品5:为柱层析试剂盒2提取样品;样品6:为柱层析试剂盒3提取样品。表明:使用常规SDS和CTAB法提取得到的DNA发生了严重降解,不能达到宏基因组研究的要求;使用柱层析DNA提取试剂盒法获得的DNA样品条带弥散,也有一定程度的降解和蛋白污染。使用本试剂盒提取的DNA样品条带清晰,降解量少,没有蛋白质污染和RNA残留,所获得的DNA的纯度和质量高。
其更为具体的如图2所示的,其中,样品7为空白,样品8为以小黄鱼肠道DNA样品增得到的16s rRNA基因,样品9为以黑鱼肠道DNA样品扩增得到的16s rRNA基因;M:分子量标marker。从图2中可以看出,用该土壤DNA可以扩增出明亮的,预期大小的专一目的条带,表明使用该DNA提取方法和试剂盒提取的鱼肠道DNA满足普通PCR扩增要求。使用该DNA提取方法和试剂盒提取黑鱼和小黄鱼肠道微生物DNA,通过illumina高通量测序分别获得了5.11G和5.20G的测序数据,使用SoapAligner软件进行分析后发现,宿主和挠足类生物DNA仅占测序数据的0.01%和0.03%。表明该提取方法可以有效避免鱼体本身和食物DNA的污染。
当然,以上说明仅仅为本发明的较佳实施例,本发明并不限于列举上述实施例,应当说明的是,任何熟悉本领域的技术人员在本说明书的教导下,所做出的所有等同替代、明显变形形式,均落在本说明书的实质范围之内,理应受到本发明的保护。
- 还没有人留言评论。精彩留言会获得点赞!