快速检测硫离子的络合物及其定量分析方法和应用与流程
本发明涉及一种快速检测硫离子的络合物及其定量分析方法和应用,属于环境保护领域。
背景技术:
随着生物、化学化工、医药及环境学科的迅速发展,阴离子在这些领域中的应用越来越广泛,对阴离子的识别与传感也成为研究的热点。然而,与为数较多的阳离子传感器相比,阴离子传感器的发展较为缓慢。传统阴离子传感器的设计主要是基于主-客体间的弱相互作用,因此存在对目标分子的检测灵敏度较低、专一性不强等不足,尤其是在水相中,强的溶剂化作用使主-客体之间的相互作用变弱,导致检测灵敏度降低。这些因素极大地限制了此类传感器的发展,因此,对阴离子传感器的设计更具挑战性。
环境污染的监测及其防治已成为全球性关注的热点之一。由于煤及含硫物质的使用越来越多,大量硫化物进入水和空气中,对环境造成的污染越来越严重。硫可与多种金属形成硫化物和硫酸盐,广泛存在于自然界中。因此,硫离子的检测已受到人们的高度关注,设计合成水溶性好、生物相容性好、能够快速、定量、高灵敏度和高选择性地检测硫离子的化学传感器仍是当务之急。近年来,以光信号为输出信号的荧光化学传感器和比色化学传感器颇受人们的青睐。荧光技术作为一种新兴的检测手段,具有灵敏度高、响应速度快、检出限低等特点,可广泛应用于生物化学、细胞生物学和分析化学等相关领域。而比色法作为一种传统的检测方法,具有简单易行,无需精密仪器等特点。因此,同时利用荧光法和比色法的双通道传感器能够结合这两种方法的优点,实现对被分析物的高效检测。目前文献报道的硫离子化学传感器中,能够同时实现荧光和比色双通道检测硫离子的报道却很少,尤其是生物细胞中硫离子的荧光成像分析更是鲜有报道。
武汉大学李振等人报道了基于二氧四胺大环化合物的硫离子荧光传感器,测试条件为体积比为3:1的h2o-ch3oh混合溶液。但是,该化合物作为硫离子荧光检测器,检出限为700nm,对于痕量检测有一定局限;并且,该化合物不能成功应用于细胞内硫离子的荧光成像分析,故该文件中仅考察了传感体系对硫离子的荧光光谱响应。
技术实现要素:
本发明是针对现有技术的不足而提供一种快速检测硫离子的络合物及其定量分析方法和应用,可以在水溶液中高灵敏度、高选择性地检测硫离子,对硫离子具有荧光-比色双通道响应,作为荧光传感器表现出明显的荧光增强响应,响应速度快、检测限低,可成功地应用于生物细胞中硫离子的荧光成像以及待测样品中硫离子浓度的准确定量。
本发明所采用的技术方案为:
一种快速检测硫离子的络合物,它为香豆素衍生物与铜离子的络合物,其结构式如下所示,缩写为c1-cu。
上述络合物c1-cu作为荧光传感器、比色传感器可用于对硫离子检测。尤其是,该络合物可通过荧光增强的方式,用于hela细胞中硫离子的荧光成像。而且,随着硫离子浓度的增大,hela细胞的荧光逐渐增强。
本发明还提供一种快速检测及定量分析硫离子的方法,采用香豆素衍生物-铜离子络合物作为硫离子荧光传感器,用来测定溶液中的硫离子浓度。该方法主要包括如下步骤:
1)配制c1-cu络合物的溶液;
2)配制水溶性的硫化盐溶液;
3)将步骤1)所述的香豆素衍生物-铜离子络合物的溶液置于石英比色皿中,用荧光分光光度计测试其发射光谱;然后向该香豆素衍生物-铜离子络合物的溶液中滴加不同浓度的水溶性硫化盐溶液,利用荧光分光光度计分别测试其发射光谱,并总结归纳荧光强度与硫化盐溶液浓度的关系,以荧光强度为纵坐标,以硫离子浓度为横坐标,绘制标准曲线;
4)向步骤1)所述的香豆素络合物-铜离子络合物的溶液中定量滴加待测硫离子溶液,然后测定其荧光强度,根据步骤3)所得标准曲线,计算待测溶液的硫离子浓度。
按上述方案,所述香豆素衍生物-铜离子络合物溶液的具体配制方法为:
a.用有机溶剂配制浓度范围为5×10-4~1×10-1mol/l化合物c1的母液,用hepes缓冲溶液和有机溶剂的混合液稀释到2×10-6mol/l;其中,化合物c1的结构如下所示;
b.向步骤a所得化合物c1的溶液中加入1×10-4~1×10-1mol/l浓度范围的水溶性铜盐溶液,得到络合物c1-cu的溶液。
按上述方案,步骤a中所述的有机溶剂可以是二甲基亚砜、乙腈、四氢呋喃和丙酮等;所述的hepes缓冲溶液和有机溶剂的混合液中,二者的体积比范围为5:(5~95),hepes缓冲溶液的ph范围为6~9。
按上述方案,步骤b中,水溶性铜盐可以是cucl2和cu(no3)2等。
按上述方案,所述水溶性的硫化盐溶液可以是na2s和k2s等,其溶液浓度范围为1×10-6~2×10-1mol/l。
本发明的主要原理:c1-cu络合物溶液在400~700nm波长范围内几乎无荧光,当其中加入硫离子后,硫离子捕获络合物中的铜离子形成更稳定的硫化铜,化合物c1被释放出来,而化合物c1在490nm有很强的荧光发射峰,以此作为本发明快速检测硫离子的基础。本发明的香豆素衍生物-铜离子络合物对硫离子的传感过程如下所示:
进一步地,随着硫离子浓度的增大,捕获更多的铜离子,使越来越多的化合物c1被释放出来,体系在490nm的发射峰逐渐增强,且荧光强度变化与体系中硫离子的浓度呈现良好的线性关系。同时,溶液的紫外-可见吸收光谱也有明显的变化:加入过量的硫离子之后,最大吸收峰蓝移了15nm,溶液由暗黄色变成了黄绿色。络合物c1-cu具有较高的选择性,对于除硫离子之外的其他阴离子无明显的光谱响应。重要的是,络合物c1可通过荧光增强的方式,成功地用于hela细胞中硫离子的荧光成像。
本发明主要是解决硫离子化学传感器中存在种种局限性,如合成复杂、操作繁琐、在水溶性中检测灵敏度低、选择性差、响应速度慢、生物相容性差的问题。与现有技术相比,本发明的有益效果是:
1、本发明所述快速检测硫离子的络合物作为荧光传感器,用于水溶液中对硫离子检测时,表现出明显的荧光增强响应,检出限低达90nm,检测灵敏度高,响应速度快;
2、本发明所述快速检测硫离子的络合物作为荧光传感器,其荧光强度的变化与硫离子浓度呈现良好的线性关系(r2=0.9906),可准确地定量待测样品中硫离子的浓度。
3、本发明所述快速检测硫离子的络合物对硫离子具有超高的选择性,对于除硫离子之外的其他阴离子无明显的光谱响应,且即使在其他阴离子存在下也能高效地识别出硫离子。
4、本发明所述快速检测硫离子的络合物具有荧光和比色双重响应,既能实现准确地定量分析,又可实现对硫离子的方便、快捷的“裸眼”检测。
5、本发明所述化合物c1具有低毒性、良好的水溶性和生物相容性,可成功地应用于生物细胞中硫离子的荧光成像分析。
附图说明
图1是本发明实施例1中的c1-cu络合物溶液对硫离子的荧光滴定图,化合物c1的浓度为2×10-6mol/l,铜离子浓度为5×10-6mol/l,硫离子浓度范围为0~7×10-6mol/l。
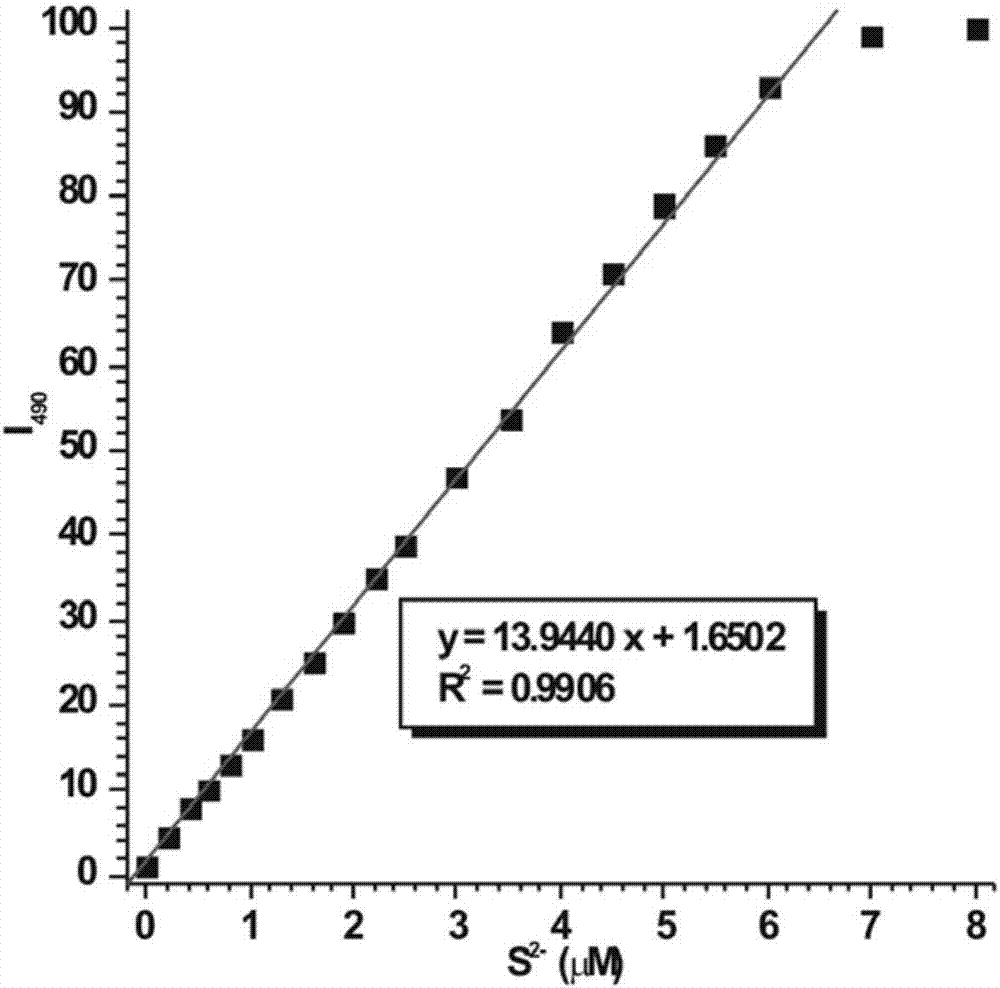
图2为本发明实施例1中建立的标准曲线,化合物c1的浓度为2×10-6mol/l,铜离子浓度为5×10-6mol/l,硫离子浓度范围为0~8×10-6mol/l。
图3是本发明实施例2中的c1-cu络合物溶液对硫离子的紫外-可见吸收光谱滴定图,化合物c1的浓度为7×10-6mol/l,铜离子浓度为1×10-5mol/l,硫离子浓度范围为0~1×10-5mol/l。
图4为本发明实施例3中的c1-cu络合物溶液对常见阴离子的识别响应图,化合物c1的浓度为2×10-6mol/l,铜离子浓度为5×10-6mol/l,cn-和i-离子浓度为1×10-5mol/l,其他阴离子浓度为5×10-5mol/l。
图5为本发明实施例4中的c1-cu络合物对生物细胞中硫离子的荧光成像图,化合物c1的浓度为2×10-5mol/l,铜离子浓度为2×10-5mol/l,硫离子浓度范围为0~1.5×10-4mol/l。
具体实施方式
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明不仅仅局限于下面的实施例。
本发明实施例中所用的原料均为已知化合物,可由市场购得,或按照现有技术的方法合成得到。化合物c1按照文献报道方法合成得到,经表征分析证实所得产物与其结构式相符,为
实施例1
一种快速检测硫离子的络合物及其定量分析和应用,采用香豆素衍生物-铜离子络合物作为硫离子荧光传感器,用来检测溶液中的硫离子。该方法主要包括如下步骤:
1)配制浓度为10mm、ph为7.4的hepes缓冲溶液;配制化合物c1的dmso溶液,浓度为2×10-5mol/l。取1ml上述c1的dmso溶液置于10ml比色管中,用hepes缓冲溶液定容,得到浓度为2×10-6mol/l、以hepes-dmso体积比为9:1为溶剂的c1溶液。
然后在上述化合物c1的溶液中加入浓度为1×10-2mol/l的cu(no3)2·3h2o水溶液5μl(对总体积的影响可忽略不计),得到络合物c1-cu的溶液。
2)用去离子水配制浓度为3.0×10-3mol/l的na2s水溶液。
3)取3ml步骤1)中配制的络合物c1-cu溶液置于石英比色皿中,在室温条件下,激发波长为420nm,用荧光分光光度计测试其发射光谱。然后,在该溶液中依次加入体积(单位:μl)为0.2、0.2、0.2、0.2、0.2、0.3、0.3、0.3、0.3、0.3、0.5、0.5、0.5、0.5、0.5、0.5、0.5和1.0的步骤2)中配制的na2s水溶液(对总体积的影响忽略不计),在相同条件下连续测试荧光光谱。如图1所示,在490nm处从下到上的滴定曲线依次表示体系中s2-浓度(单位:10-6mol/l)为0.0、0.2、0.4、0.6、0.8、1.0、1.3、1.6、1.9、2.2、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0和7.0时体系的荧光光谱。从图1中可以看到,随着s2-浓度的增加,位于490nm处的荧光发射光谱逐渐增强。并且,当体系中s2-离子浓度仅为2×10-7mol/l时,荧光发射增强了7倍;当硫离子浓度为7×10-6mol/l时,荧光发射强度达到最大值,与原来相比增大了125倍。因此,本发明所述络合物c1-cu可以实现对硫离子的高灵敏度检测,检出限低达9×10-8mol/l。
然后,以490nm处的荧光强度为纵坐标,以硫离子浓度为横坐标,绘制标准曲线。如图2所示,在0~6×10-6mol/l浓度范围内,荧光强度与硫离子浓度呈现出良好的线性关系(r2=0.9906),模拟得到的线性方程为y=13.9440x+1.6502(y表示490nm处的荧光强度,x表示硫离子的浓度,单位为10-6mol/l)。
4)用去离子水配制浓度为2.0×10-3mol/l的na2s水溶液,作为待测溶液;然后,在相同的测试条件下,向3ml步骤1)配制的络合物c1-cu溶液中,滴加上述待测溶液4.5μl(对总体积的影响忽略不计),利用荧光分光光度计测定该溶液在490nm处的荧光强度。平行测定三次的平均荧光强度值y=45.08,根据步骤3)所得标准曲线,计算得出体系中的硫离子浓度值x=3.11×10-6mol/l,由此换算得到待测溶液中的硫离子浓度为2.07×10-3mol/l。
可见,通过本发明所述方法测试荧光强度后所得计算值与真实值的差较小,表明本发明的方法可实现硫离子的准确定量分析。
实施例2
本发明的络合物c1-cu的溶液对s2-的紫外-可见吸收光谱滴定,包括如下步骤:
1)配制浓度为10mm、ph为7.4的hepes缓冲溶液;配制化合物c1的dmso溶液,浓度为7×10-5mol/l。取1ml上述c1的dmso溶液置于10ml比色管中,用hepes缓冲溶液定容,得到浓度为7×10-6mol/l、以hepes-dmso体积比为9:1为溶剂的c1溶液。
然后在上述化合物c1的溶液中加入浓度为2×10-2mol/l的cu(no3)2·3h2o水溶液5μl(对总体积的影响可忽略不计),得到络合物c1-cu的溶液。
2)用去离子水配制浓度为6.0×10-3mol/l的na2s水溶液。
3)取3ml步骤1)中配制的络合物c1-cu溶液置于石英比色皿中,在室温条件下,用紫外-可见分光光度计测试该溶液的吸收光谱。然后,在该溶液中依次加入体积(单位:μl)为0.5、0.5、0.5、0.5、0.5、0.5、0.5、0.5、0.5和0.5的步骤2)中配制的na2s水溶液(对总体积的影响忽略不计),在相同条件下连续测试吸收光谱的变化。如图3所示,在465nm处从上到下的滴定曲线依次表示体系中s2-浓度(单位:10-6mol/l)为0.0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0时体系的吸收光谱。
从图3中可以看到,随着体系中硫离子浓度的逐渐增大,体系的最大吸收峰由465nm逐渐蓝移至450nm;相应地,溶液由暗黄色变为黄绿色。重要的是,这一变化过程肉眼可见,无需借助任何仪器便可方便、快捷地检测硫离子。上述实验结果表明,本发明的络合物c1-cu,亦可作为比色传感器,实现对硫离子的“裸眼”检测。
实施例3
本发明的化合物c1-cu的溶液对常见阴离子的光谱响应,主要包括以下步骤:
1)配制浓度为10mm、ph为7.4的hepes缓冲溶液;配制化合物c1的dmso溶液,浓度为2×10-5mol/l。取1ml上述c1的dmso溶液置于10ml比色管中,用hepes缓冲溶液定容,得到浓度为2×10-6mol/l、以hepes-dmso体积比为9:1为溶剂的c1溶液。
然后在上述化合物c1的溶液中加入浓度为1×10-2mol/l的cu(no3)2·3h2o水溶液5μl(对总体积的影响可忽略不计),得到络合物c1-cu的溶液。
2)分别配制na2so3,nahso3,na2so4,na2s2o3·5h2o,nan3,nacn,kclo3,naf,nacl,kbr,ki,naio3,na2hpo4·12h2o,na3po4,naoac·3h2o,na2co3,nahco3,nascn和nano2的去离子水溶液,浓度均为1×10-2mol/l。
3)取3ml步骤1)中配制的络合物c1-cu溶液置于石英比色皿中,在室温条件下,激发波长为420nm,用荧光分光光度计测试其发射光谱。然后,在该溶液中分别加入3μl步骤2)中配制的nacn和ki水溶液,以及15μlna2so3,nahso3,na2so4,na2s2o3·5h2o,nan3,kclo3,naf,nacl,kbr,naio3,na2hpo4·12h2o,na3po4,naoac·3h2o,na2co3,nahco3,nascn和nano2水溶液(对总体积的影响忽略不计),在相同条件下分别测试其荧光光谱。
如图4所示,纵坐标表示490nm的荧光强度,横坐标表示各种阴离子,其中s2-离子浓度为7×10-6mol/l,cn-和i-离子浓度为1×10-5mol/l,其他阴离子浓度为5×10-5mol/l。比较图4柱状图的高度可以看出,本发明的络合物c1-cu对其他常见阴离子的荧光光谱响应远远小于对硫离子的响应,本发明所述技术方案可实现对硫离子的高选择性检测。
实施例4
本发明的络合物c1-cu对生物细胞中硫离子的荧光成像分析,主要包括以下步骤:
1)hela细胞用含有10%胎牛血清(nbs)和1%青霉素-链霉素的dmem培养液常规培养。将密度为5×104cell/well的细胞直接接种到24-孔板中,在二氧化碳培养箱内(5%二氧化碳/95%空气),温度保持在37℃培养24小时。
2)配制浓度为2×10-4mol/l化合物c1的dmso溶液,在细胞成像实验中取该母液100μl,加入到1ml的pbs缓冲液中,得到最终浓度为2×10-5mol/l的c1溶液(溶剂为pbs/dmso,10/1,v/v)。
3)用去离子水配制浓度为10mm的磷酸缓冲溶液(pbs),ph值为7.12;用去离子水配制浓度为2×10-3mol/l的cu(no3)2·3h2o溶液;用去离子水配制浓度为1×10-2mol/l的na2s溶液。
4)将接种在24-孔板上的细胞用步骤3)中配制的磷酸缓冲溶液洗三次,然后加入1ml步骤2)中配制的c1的溶液预培养20分钟之后,加入10μl步骤3)中配制的cu(no3)2·3h2o溶液继续培养20分钟。在上述细胞溶液中分别加入体积为5、5和5(单位:μl)的步骤3)中配制的硫离子溶液,利用荧光显微镜,考察络合物c1-cu在生物细胞检测中的应用。
如图5所示,从a到d依次表示硫离子浓度为0、50、100、150μm的荧光显微照片,激发波长为460-490nm(绿光通道),从e到h依次为对应的明场照片。由图5可看出,用硫离子培养20分钟之后,细胞表现出明显的绿色荧光;而且,随着硫离子浓度的增大,荧光强度逐渐增强。而在对照实验中,只用化合物c1和铜离子培养而没有加硫离子,细胞则几乎没有荧光(图5a)。从e到h图中的明场图片可以看到清晰的细胞轮廓,表明细胞在荧光成像实验中状态良好。上述细胞成像实验结果与荧光滴定实验结果一致,表明络合物c1-cu可以穿透细胞膜,实现生物细胞内s2-离子的检测。
以上所述仅是本发明的优选实施方式,应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干改进和变换,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!