一种从土霉菌渣中提取蛋白质的方法与流程
本发明属于固体废弃物处理处置及资源回收领域,具体涉及一种用酸/热联合法破碎消化土霉素菌渣提取蛋白质的方法。
背景技术:
我国是世界上最大的抗生素原料药生产国与出口国,据统计,2013年抗生素产量达12.12万t,包括青霉素工业盐、头孢菌素、土霉素和链霉素等。即使按生产1t的抗生素产生菌渣8t计(实际可能超过此值),我国抗生素菌渣年产生也将达到100万t以上。
抗生素菌渣为生产抗生素提纯后剩余的发酵残渣,被列入2008年实施的《国家危险废物名录》,被禁止用做动物饲料、饲料添加剂和生产有机肥。但抗生素菌渣(干基)中有机质含量高达90%以上,具有较高生物质能,具有极大的资源潜力。如果不对抗生素菌渣中的有机质加以有效利用,这将与当前循环经济和科学发展的时代要求严重背离。2012年3月7日起实施的《制药工业污染防治技术政策》中提出了“鼓励开发发酵菌渣在生产工艺中的再利用技术、无害化处理技术、综合利用技术”的政策建议。
研究表明,抗生素菌渣内蛋白质含量约占干基的20%~60%。因此,对抗生素菌渣中蛋白质进行提取并加以合理应用,不仅使抗生素菌渣得到资源化处理,回收有用资源,而且也能有效达到抗生素菌渣的减量化要求,降低抗生素菌渣的处理规模和成本。目前,国内外对于抗生素菌渣蛋白质的提取还未见诸报道。
技术实现要素:
本发明的目的是实现对四环类抗生素—土霉素菌渣中的蛋白质提取。本发明采用酸-热联合工艺,将菌渣进行溶胞处理,使蛋白质溶出,从而实现蛋白质固体从菌渣中分离提纯,实现菌渣的资源化、减量化处理。
本发明的利用酸-热联合工艺提取土霉素菌渣中蛋白质的方法,包括以下步骤进行:
一、土霉素菌渣搅匀均质预处理:调节制药厂原菌渣(含水率≤60~80)的含水率为90wt%~99wt%,放入打浆机中搅拌5~10分钟,进行搅匀均质预处理;
二、酸-热联合处理土霉素菌渣:调节预处理后菌渣溶液的pH至1~3,搅拌均匀后放入恒温反应器,调节反应温度至80℃~120℃,反应时间2h~6h,使菌渣细胞破碎、蛋白质溶出;
三、溶解性蛋白质提取液分离:将酸-热联合处理后菌渣溶液静沉冷却至室温,然后放入离心机进行固液离心分离,调节离心机转速为3500r/min~4500r/min,控制离心时间为5~30min,将离心管中的蛋白质提取液与剩余残渣离心分离,最后得到溶解性蛋白质提取液;
四、等电点法沉淀蛋白质:将离心分离得到的溶解性蛋白质提取液进行pH调节,利用等电点法沉淀提纯蛋白质,调节蛋白质提取液pH至5~7,反应沉淀时间5~10分钟;
五、蛋白质的分离:将沉淀后蛋白质提取液放入离心机进行固体蛋白质提纯分离,控制离心机转速3500r/min~4500r/min,控制离心时间为5~30min,将离心管中的白色胶体物质与上清液分离,将白色胶体物质在50℃~60℃下干燥1~2d,得蛋白质。
优选地,步骤一中土霉素菌渣的含水率为92-96wt%,放入打浆机中搅拌8分钟。
优选地,步骤二中调节预处理后菌渣溶液的pH至2,调节反应温度至120℃,反应时间2h。
优选地,步骤四中调节溶解性蛋白质提取液pH为6。
优选地,离心机转速均为4000r/min,离心时间均为20min。
本发明的优点和有益效果:
1、采用本发明方法从土霉素菌渣中提取蛋白质具有能耗低、费用低、操作方便、时间短暂等特点;当处理条件为含水率为94%、反应pH为2.0、反应温度为80℃、反应时间为2h时,菌渣中蛋白质溶出浓度为6376.93mg/L;等电点沉淀蛋白质时,当pH=6.0,蛋白质沉淀效率最大为92.73%。2、本方法考虑到土霉素菌渣本身pH值<2~4的固有性质,同时考虑到传统热处理工工艺的成熟应用,采用酸-热联合法进行土霉素菌渣的预处理和蛋白质提取,设备简单易操作,且用药量少,处理成本低。
3、本发明方法适用于土霉素菌渣蛋白质的提取,利用该方法提取蛋白质可大幅降低菌渣中悬浮物质的含量,降低菌渣固体物质的量,有利于土霉素菌渣的资源化、减量化处理处置。
附图说明
图1 酸-热联合法提取土霉素菌渣中蛋白质流程示意图。
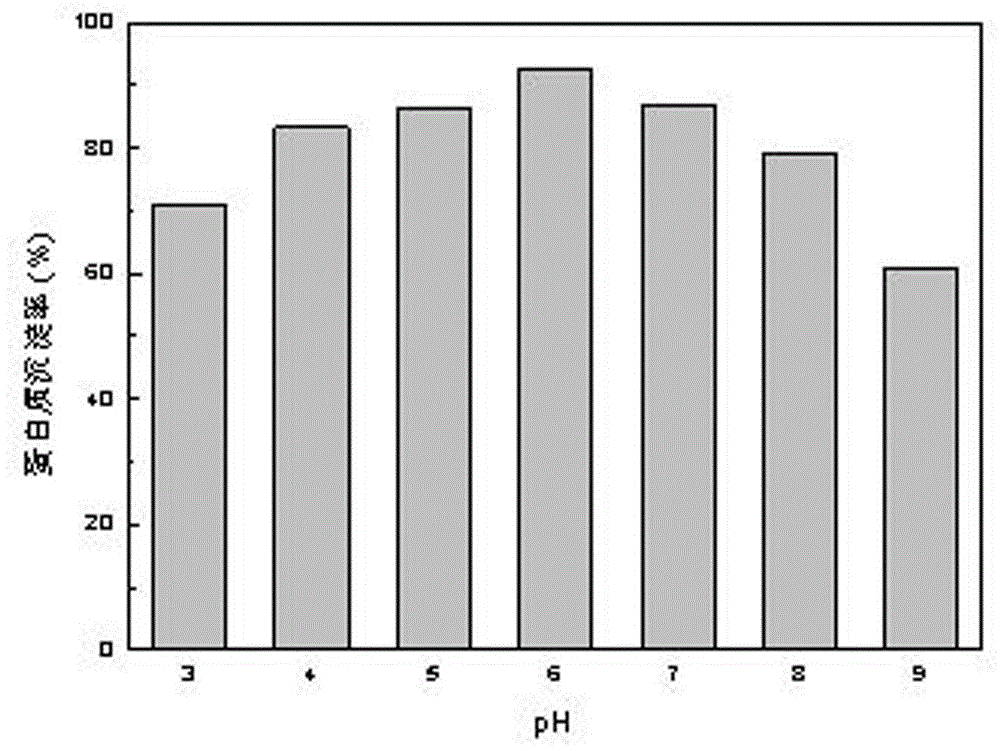
图2不同pH条件下蛋白质沉淀率。
具体实施方式
实施例1土霉素菌渣搅匀均质预处理和酸-热联合处理
土霉素菌渣土霉素菌渣搅匀均质预处理:调节制药厂原菌渣(含水率≤60~80)的含水率为90wt%~99wt%,放入打浆机中搅拌8分钟,进行搅匀均质预处理;
酸-热联合处理土霉素菌渣:调节预处理后菌渣溶液的pH至1~3,搅拌均匀后放入恒温反应器,调节反应温度至80℃~120℃,反应时间2h~6h,使菌渣细胞破碎、蛋白质溶出。
蛋白质溶液的提取与检测:将酸-热联合处理后菌渣混合液放入离心机中,调节离心机转速为4000r/min,控制离心时间为10min,将离心管中的蛋白质提取液与剩余残渣离心分离,最后得到溶解性蛋白质提取液。
蛋白质提取液中蛋白质浓度的测定:采用考马斯亮蓝法进行溶液中蛋白质浓度测定。具体反应条件和反应结果如表1所示。
表1 反应时间和反应结果
。
实施例2溶解性蛋白质提取液分离
溶解性蛋白质提取液分离:将酸-热联合处理后菌渣溶液静沉冷却至室温,然后放入离心机进行固液离心分离,调节离心机转速为4000r/min,控制离心时间为20min,将离心管中的蛋白质提取液与剩余残渣离心分离,最后得到溶解性蛋白质提取液。实验中离心机转速与离心时间,可在权利要求范围内自行调节,不同的离心条件下,实验结果基本一致。
实施例3等电点法沉淀蛋白质和蛋白质的分离
当处理条件为含水率为94%、反应pH为2.0、反应温度为120℃、反应时间为2h时,菌渣中蛋白质溶出浓度为6376.93mg/L,利用等电点法进行蛋白质沉淀分离。
等电点法沉淀蛋白质:将离心分离得到的溶解性蛋白质提取液进行pH调节,利用等电点法沉淀提纯蛋白质,用1mol/LNaOH溶液调节离心上清液pH值至3.0、4.0、5.0、6.0、7.0、8.0、9.0,反应沉淀时间8分钟;
蛋白质的分离:将沉淀后蛋白质提取液放入离心机进行固体蛋白质提纯分离,控制离心机转速4000r/min,控制离心时间为18min,将离心管中的白色胶体物质与上清液分离,测定二次上清液的蛋白质浓度,通过计算得各pH下的蛋白质沉淀率,实验结果如图2所示,将白色胶体物质在55℃下干燥1.5d,得蛋白质。
由图2易得,随着pH的增大,蛋白质沉淀效率先上升再下降,当pH为6.0时,蛋白质沉淀效率最大为92.73%。通过调节溶液的pH,可以改变溶液的电荷性质,使蛋白质表面的双电层与水化膜受到破坏,引起蛋白质分子间引力增大,从而造成蛋白质在溶液中溶解度下降,导致蛋白质沉淀析出。
- 还没有人留言评论。精彩留言会获得点赞!