一种基因缺失突变的高通量筛选方法与流程
本发明涉及哺乳动物细胞突变检测筛选技术领域,尤其涉及一种基因缺失突变的高通量筛选方法。
背景技术:
目前癌症已被公认为是全球范围内严重危害人类健康的头号杀手。而环境污染物通过诱导基因突变,导致遗传物质的不可逆损伤对癌症的发生是必需的。因此对环境污染物的遗传毒性尤其是其致突性的客观评价对于人类癌症的早期预警具有重要指导意义。近年来,AL细胞已被广泛用于环境污染物如石棉、有机污染物、重金属、辐射、纳米材料等的致突性及相关机理研究。AL细胞是中国仓鼠CHO细胞gly-A突变株与正常人成纤维细胞杂交后所得永生化细胞,含有一整套中国仓鼠CHO-K1染色体和一条人的11号染色体。而11号染色体包含多个癌基因和抑癌基因,其突变与人类多种常见高发性癌症有关。人的11号染色体可编码多种细胞表面蛋白,其中包括CD59基因(旧称为MIC1基因)编码的CD59细胞表面抗原(旧称为S1抗原)。传统的AL细胞基因突变检测和筛选技术原理为:野生型AL细胞CD59基因正常表达时在细胞表面形成CD59抗原,在兔血清补体存在的情况下,该抗原与特异性抗体E7.1结合后,导致野生型细胞裂解而无法生存;突变细胞因不能表达CD59蛋白,无法与抗体和补体作用而得以存活,在培养皿上形成一个个肉眼可见的突变细胞克隆群。克隆数目越多,则说明污染物的致突性越强。为了进一步研究环境污染物致CD59基因突变的类型和大小,该技术又利用位于人11号染色体长臂或短臂上的5个标记基因(WT、PTH、CAT、RAS以及APO-A1)引物对突变细胞克隆的突变图谱进行了分析。这5个基因的物理图谱位置与CD59基因接近,并且编码区有可用的PCR引物。由于AL细胞中仅含有一条人的11号染色体,突变细胞中这5个基因PCR产物对应条带的出现与否意味着在CD59基因缺失基础上,含有该基因的特定DNA片段的存在或缺失,从而可根据缺失基因物理图距判断基因缺失突变的程度。该技术主要包含以下步骤:
1)将处理后细胞制成单细胞悬液,以合适的密度重新种植到细胞培养皿中(处理组细胞须根据细胞存活率增大接种量),连续培养7天,使处理后的存活细胞有足够的时间从生长暂时停滞状态中恢复,同时,也使突变细胞繁殖的后代细胞表面不再残留CD59抗原;
2)收集细胞,将5×104细胞接种于含有2ml F12完全培养液的60mm培养皿中;CO2培养箱中孵育2小时待细胞贴壁后,加入新融化的0.2%抗体和1.5%(体积百分比)补体;每次实验都设有同批对照组,包括抗体单独处理组、补体单独处理组、空白对照等;
3)连续培养细胞10天左右,直至形成肉眼可见的单细胞克隆;
4)在无菌条件下,利用特制的克隆环圈定单克隆,在胰蛋白酶的酶解作用下,收集单克隆中所含的细胞。为了确保所分析的细胞是来自独立单细胞克隆,每个培养皿中仅分离一个,偶尔至多两个完全分开的单细胞克隆;
5)将分离的悬浮细胞移至培养皿中,连续培养,直至获得所需的细胞数目;
6)提取以上所获突变细胞DNA,利用聚合酶链式反应(PCR)对WT、PTH、CAT、RAS以及APO-A1等5个标记基因进行扩增;
7)取10μl扩增产物用3%琼脂糖凝胶电泳分析拍照,并根据标记基因条带的有无绘制遗传突变图谱进行对比分析。
该实验体系虽较成熟,且其检测灵敏度也比HGPRT实验和细菌的Ames实验高出许多,但仍存在一些弊端,比如前期突变实验操作繁琐,且需考虑补体自身对细胞的杀伤力;后期突变细胞克隆培养需10-12天,周期长,且不同突变程度的细胞表型一致,均形成类似的克隆群而不易区分;该方法受培养皿面积和种植细胞数目限制,仅能获得有限的单突变细胞克隆群;挑取单细胞克隆过程很容易造成不同单克隆之间的污染,对实验操作人员的技术要求非常高,而为了确保所分析的细胞是来自独立单细胞克隆,每个培养皿中仅分离一个或两个单细胞克隆,这又极大增加了工作量;传统实验中的兔血清补体价格昂贵,抗体制备成本高,且抗体补体用量较多,细胞培养皿等器材耗费较多等。
技术实现要素:
本发明的目的在于克服现有技术的不足,在流式细胞微孔板分选技术的基础上,结合特异性荧光抗体,提供了一种快速、准确的基因缺失突变的高通量筛选方法。
本发明是通过以下技术方案实现的:一种基因缺失突变的高通量筛选方法,包括如下步骤:
(1)细胞处理及连续培养
培养两皿AL细胞至对数生长期分为对照组和处理组,即一皿不做任何处理,另一皿用1-4μg/mL亚砷酸钠连续处理12-48小时,再将对照组和处理组AL细胞各以(2.0-5.0)×105/ml细胞密度重新种植到培养皿中,连续培养6-8天;
(2)细胞收集
收取对照组和处理组AL细胞,酶解消化,悬浮于F12完全培养基中,清洗后各制成浓度为±106细胞/100μl的单细胞悬液;
(3)与荧光抗体的结合
加入80-120μl预冷的流式细胞缓冲液重悬细胞后,加入荧光标记的CD59特异性抗体,3-5℃避光反应30-60分钟后,再用预冷的流式细胞缓冲液清洗离心,去除未结合的抗体;
(4)制备上样悬液
重悬步骤(3)中所得的两组AL细胞于预冷的流式细胞缓冲液后,获取上样悬液;
(5)细胞分选
将制备得到的上样悬液送入流式细胞分选仪中,使用流式细胞微孔板分选技术进行单细胞分选;
(6)细胞扩增和图谱分析
将分选获得的单细胞突变子进行连续培养,扩增后对其突变图谱进行分析。
作为本发明的优选方式之一,所述步骤(1)中AL细胞包括野生型AL细胞、由野生型AL细胞发展的各种缺陷型细胞以及构建的细胞系。
作为本发明的优选方式之一,所述步骤(2)中酶解消化所用的为胰蛋白酶,为质量含量为0.25%的胰蛋白酶和0.02%EDTA溶于PBS缓冲液制得。
作为本发明的优选方式之一,所述步骤(3)中荧光抗体的添加量为:相对±106细胞/100μl的单细胞悬液,每100μl加入10-20μl荧光抗体。
作为本发明的优选方式之一,所述步骤(5)中使用流式细胞微孔板分选技术进行单细胞分选的具体步骤如下:
a、建立前向散射FSC/侧向散射SSC散点图,通过初步设定门P1,排除死细胞和细胞碎片,找到目标细胞群;
b、建立SSC-W/FSC-W散点图,通过二次设定门P2,排除双联体细胞;
c、建立PE-A/FSC-A荧光分析点图,根据对照细胞群位置设定阴阳性界定门,界定门以下为阴性CD59﹣细胞群,界定门以上为阳性CD59﹢细胞群。
d、对阴性CD59﹣细胞群区域进一步精确设门,利用流式细胞微孔板分选技术对精确设门区进行单细胞分选。
作为本发明的优选方式之一,所述步骤(5)中根据界定门分选获得的两类细胞群用于连续培养或作为流式检测CD59基因突变技术中的阳性CD59﹢和阴性CD59﹣对照细胞。
作为本发明的优选方式之一,所述步骤(5)中使用流式细胞微孔板分选技术进行单细胞分选时,使用的微孔板为流式细胞分选仪系统限定的多孔细胞培养平板。
作为本发明的优选方式之一,所述步骤(5)中利用流式细胞微孔板分选技术进行单细胞分选时,可进行多板孔板的连续分选,最终所获的AL细胞为不同类型和程度突变引发CD59﹣表型的单细胞。
作为本发明的优选方式之一,所述步骤(6)中突变图谱分析方法为:对每个单细胞突变子克隆11号染色体上与CD59基因物理图谱位置接近的APO-A1、CAT、WT9、PTH和RAS五个标记基因进行多重PCR扩增,分析各突变细胞的突变图谱,进一步鉴定CD59基因突变的类型和突变程度。
作为本发明的优选方式之一,所述单细胞突变子的前期扩增培养采用条件培养基,获取方法为:待正常野生型AL细胞长满至培养皿底65-75%时收集其培养基,经3500-4500rpm离心15-25min,0.22μm无菌微孔滤器过滤除去杂质、细胞碎片后分装冻存,培养单细胞突变子时在新鲜F12完全培养基中加入45-55%的上述培养基即为条件培养基;所述流式细胞缓冲液采用的配方为:质量比为1%的牛血清白蛋白,10mM叠氮钠溶解于磷酸盐缓冲液PBS,pH=7.0。
本发明使用的AL细胞来源由THEODORE T.PUCK等在Genetics of Somatic Mammalian Cells:Lethal Antigens as Genetic Markers for Study of Human Linkage Groups中披露,Proc.Nat.Acad.Sci.USA Vol.68,No.12,pp.3102-3106,December 1971。哺乳动物体细胞的遗传学:致命抗原作为遗传标记来研究人类连锁基因群。期刊Proc.Nat.Acad.Sci.全称为《美国国家科学院院刊》,简称PNAS。这篇文章发表于1971年11月PNAS杂志上第12期68卷,页码3102-3106。
本发明相比现有技术的优点在于:
(1)灵敏度高:传统突变实验中的免疫反应需考虑补体自身对细胞的杀伤力;且不同突变程度的细胞表型一致,均形成类似的克隆群而不易区分;同时传统实验适合大片断缺失突变检测,点突变不易检测到,灵敏度低;而本发明采用CD59基因特异性荧光抗体直接标记的方法可避免补体毒性等问题;此外不同突变程度的细胞表现出不同强弱的荧光亮度,点突变也可通过弱荧光检测到,极大地提高了检测的精确性和灵敏度;
(2)高通量化:一般传统方法受培养皿面积和种植细胞数目限制,仅能获得有限的单突变细胞克隆群,而采用流式分选技术则不受这些限制,微孔板每孔可对应收集一种突变类型的单细胞突变子,并可进行多板孔板的连续分选;同时流式检测量每秒最高可达1×104个细胞,每板分选可在3-5分钟内完成,体现了流式细胞微孔板分选技术的高通量化和高效性;
(3)周期短:传统技术中前期突变实验操作繁琐,后期突变细胞克隆的生长需10-12天,且挑取单细胞克隆过程很容易造成单克隆之间的相互污染,因此对实验操作人员的技术要求非常高;而本方法从收集细胞、与特异性荧光蛋白结合、微孔板分选,整个过程仅需约3小时,简单快速,且仪器的客观性和准确性高,从而有效避免了人为误差;
(4)实验费用低:传统突变实验中所使用的兔血清补体价格昂贵,抗体制备成本高,且抗体补体用量较多;细胞培养皿等器材耗费较多。而本方法中每次使用的荧光抗体量非常少,在极大程度上节省了实验费用;同时利用微孔板来收集和培养单细胞突变子可显著降低细胞培养费用。
附图说明
图1是实施例1中的一种基因缺失突变的高通量筛选方法的FSC/SSC散点图;
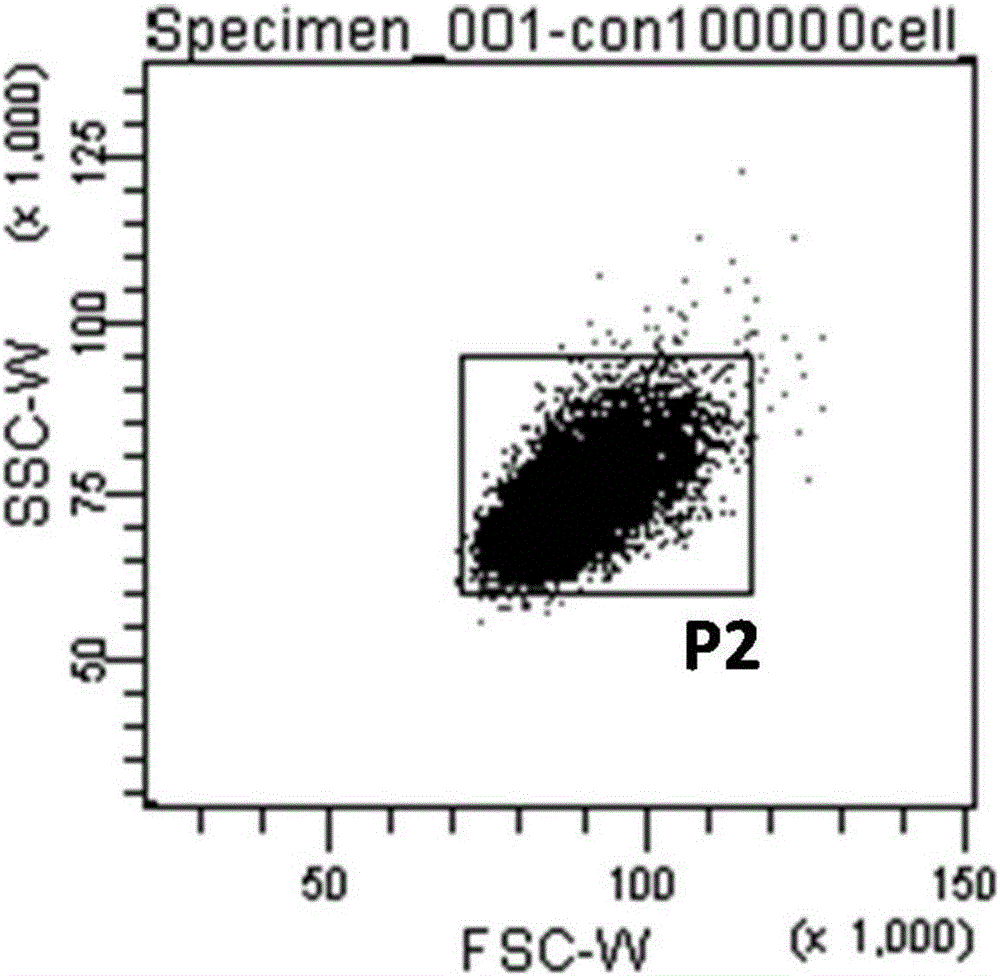
图2是实施例1中的一种基因缺失突变的高通量筛选方法的SSC-W/FSC-W散点图;
图3是实施例1中的一种基因缺失突变的高通量筛选方法的PE-A/FSC-A阴性细胞群荧光分析点图;
图4是实施例1中的一种基因缺失突变的高通量筛选方法的PE-A/FSC-A阳性细胞群荧光分析点图;
图5是实施例1中的一种基因缺失突变的高通量筛选方法的流式微孔板技术分选单细胞突变子的模型和参数设置图;
图6是实施例1中的一种基因缺失突变的高通量筛选方法的分选获得的单细胞突变子的扩增培养图(图中字母序号a至h,依次表示其扩增过程中细胞形态变化趋势);
图7是实施例1中的一种基因缺失突变的高通量筛选方法的不同单细胞突变子的基因突变谱图。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
本实施例的一种基因缺失突变的高通量筛选方法,适用于各类环境污染物如石棉、有机污染物、重金属、辐射等的致突性分析,包括如下步骤:
(1)细胞处理及连续培养
正常培养两皿AL细胞(包括野生型AL细胞、由野生型AL细胞发展的各种缺陷型细胞以及构建的细胞系)至对数生长期分为对照组和处理组,即一皿不做任何处理,另一皿用2μg/mL亚砷酸钠连续处理24小时(诱发突变),再将对照组和处理组AL细胞各以2.0×105/ml细胞密度重新种植到培养皿中,连续培养7天,使处理后的存活细胞有足够的时间从生长暂时停滞状态中恢复,同时,也使突变缺陷型AL细胞繁殖的后代细胞表面不再残留CD59抗原;
(2)细胞收集
收取对照组和处理组AL细胞,胰蛋白酶酶解消化,悬浮于F12完全培养基中,清洗后各制成浓度为±106细胞/100μl的单细胞悬液;其中,胰蛋白酶由质量含量为0.25%的胰蛋白酶和0.02%EDTA溶于PBS缓冲液制得;
(3)与荧光抗体的结合
加入100μl预冷的流式细胞缓冲液(质量比为1%的牛血清白蛋白,10mM叠氮钠溶解于磷酸盐缓冲液PBS,含有钙、镁离子,pH=7.0)重悬细胞后,加入荧光标记的CD59特异性抗体,4℃避光反应45分钟后,再用预冷的流式细胞缓冲液清洗离心,去除未结合的抗体;其中,荧光抗体的添加量为:通常一个实验样本为±106细胞/100μl的单细胞悬液,每100μl单细胞悬液加入15μl荧光抗体;
(4)制备上样悬液
重悬步骤(3)中所得的两组AL细胞于预冷的流式细胞缓冲液后,获取上样悬液;
(5)细胞分选
将制备得到的上样悬液送入BD FACS AriaTMⅢCell Sorter型号的流式细胞分选仪中,使用流式细胞微孔板分选技术并采用流式细胞分选仪系统限定的48孔或96孔细胞培养平板进行单细胞分选,具体方法如下:
a、如图1所示,在流式细胞仪上获取数据时,建立前向散射FSC/侧向散射SSC散点图,SSC用来检测细胞内部颗粒度,FSC用来检测细胞的大小;通过初步设定门P1,排除死细胞和细胞碎片,找到目标细胞群,并调节各个光电倍增管装置以确定所有要分析的细胞群都在点图的可视范围内,具体如下:通过设置和调节FSC阈值,将大部分的细胞碎片、气泡和激光背景噪的干扰排除在分析区域之外(都应该设在FSC-low/SSC-low区域),接下来在FSC/SSC点图中圈出目标细胞群的周围区域(P1),这个区域可以被称为“P1-FSC/SSC”,P1设门主要是根据细胞最集中的部分圈定其范围,排除周围过大过小的分散的细胞颗粒或碎片杂质;
b、建立SSC-W/FSC-W散点图,通过二次设定门P2,排除双联体细胞,保证最后进行荧光检测和分选的细胞是单个细胞,如图2所示,W指收集信号的宽度;SSC-W/FSC-W全称为侧向散射角-宽度/前向散射角-宽度散点图,宽度(如SSC-W)常用来区分双联体细胞;由于双联体细胞所得到的信号会比单个细胞大,反应在SSC-W/FSC-W图上即为纵坐标和横坐标值较大较离散的点状区域,因此根据细胞的大小和颗粒度的宽度二次设门P2来排除双联体;
c、建立PE-A/FSC-A荧光分析点图,如图3和图4所示,根据对照细胞群位置设定阴阳性界定门,界定门以下为阴性CD59﹣细胞群,即图3中Q4区;界定门以上为阳性CD59﹢细胞群,即图4中Q2区;这两群细胞中必然包含一些假阳性/假阴性的细胞或杂质,可通过精确调节界定门以上或以下的分选区域,以及调节分选模式来获得高纯度的阳性和阴性对照细胞;PE为抗体偶联的染料-藻红蛋白;A为荧光脉冲的面积,面积积分比荧光脉冲的高度H更能准确反应检测指标的含量;PE-A/FSC-A全称为荧光染料-荧光脉冲面积/细胞大小-荧光脉冲面积分析点图;
阴阳性界定门是根据阳性和阴性对照细胞群分别占收集细胞的百分比划分的,通过设置和调节PE对应的FL2荧光通道的电压值和四象限门位置,使检测到的阳性和阴性细胞纯度都分别达到99.9%及以上,这时对应的象限门位置就是划分阴阳性对照细胞的界定门;
d、图5表示利用流式微孔板分选技术进行单细胞突变子的96孔板分选;图中根据对照细胞设定的界定门以上Q2部分为CD59﹢的阳性细胞群,界定门以下Q4部分为CD59﹣的阴性细胞群,Q4部分原则上均可作为分选区域,但也可能包含一些假阴性的细胞,因此可通过如下操作来提高分选精度:调节分选精确模式为“单细胞(single cell)”分选;微调界定门位置,使Q4阴性区域缩小;对Q4区域进一步精确设门(方框P3所示);图5中的P3部分即为最终进行单细胞分选区域;
该分选技术还可进行多板96孔板的连续分选,可批量获得不同突变类型和突变程度的CD59﹣表型单细胞突变子;
(6)细胞扩增
将分选获得的单细胞突变子进行连续培养,扩增至单细胞克隆群(如图6所示);
单细胞突变子的前期扩增培养采用条件培养基,条件培养基的获取方法为:待正常野生型AL细胞长满至培养皿底70%时收集其培养基,经4000rpm离心20min,0.22μm无菌微孔滤器过滤除去杂质、细胞碎片后分装冻存,培养单细胞突变子时在新鲜F12完全培养基中加入50%的上述培养基即为条件培养基;条件培养基中含有细胞因子等活性物质,可有效提高单细胞体外培养的成功率;
(7)突变图谱分析
对扩增后的每个单细胞克隆群11号染色体上与CD59基因物理图谱位置接近的APO-A1、CAT、WT9、PTH和RAS五个标记基因进行多重PCR扩增,对比分析对照组(自发突变)和处理组(诱发突变)细胞的基因突变图谱;
如图7所示,对照组中60%(18/30)的CD59﹣自发突变子其五个标记基因都没有发生可检测的变化,只有40%的突变子发生较小片段DNA缺失,如与CD59基因物理图谱位置最接近的CAT和WT9基因的缺失突变,而砷处理组则只有10%(3/30)的突变子保留所检测的全部标记基因;即90%的突变子至少有一个另外的标记基因缺失,其中23%(7/30)的突变细胞失去其染色体长臂的APO-A1基因,这也说明砷处理相对自发突变而言更容易诱导大片段DNA缺失突变,即突变程度非常严重;这与Tom k.Hei等利用传统克隆方法所得结果类似,从而说明本发明方法在灵敏度高、高通量化、实验周期短和实验费用低等优点的基础上,结果依然具有可靠性和准确性。
Tom k.Hei等的文章:Mutagenicity of arsenic in mammalian cells:Role of reactive oxygen species砷对哺乳动物细胞的致突性:活性氧的作用。Proc.Natl.Acad.Sci.USA Vol.95,pp.8103–8107,July 1998,期刊Proc.Nat.Acad.Sci.全称为《美国国家科学院院刊》,简称PNAS;该文章发表于1998年7月PNAS杂志上第95卷,页码8103-8107。
实施例2
本实施例的一种基因缺失突变的高通量筛选方法,适用于各类环境污染物如石棉、有机污染物、重金属、辐射等的致突性分析,包括如下步骤:
(1)细胞处理及连续培养
正常培养两皿AL细胞(包括野生型AL细胞、由野生型AL细胞发展的各种缺陷型细胞以及构建的细胞系)至对数生长期分为对照组和处理组,即一皿不做任何处理,另一皿用1μg/mL亚砷酸钠连续处理48小时(诱发突变),再将对照组和处理组AL细胞各以3.0×105/ml细胞密度重新种植到培养皿中,连续培养6天,使处理后的存活细胞有足够的时间从生长暂时停滞状态中恢复,同时,也使突变缺陷型AL细胞繁殖的后代细胞表面不再残留CD59抗原;
(2)细胞收集
收取对照组和处理组AL细胞,胰蛋白酶酶解消化,悬浮于F12完全培养基中,清洗后各制成浓度为±106细胞/100μl的单细胞悬液;其中,胰蛋白酶由质量含量为0.25%的胰蛋白酶和0.02%EDTA溶于PBS缓冲液制得;
(3)与荧光抗体的结合
加入80μl预冷的流式细胞缓冲液(质量比为1%的牛血清白蛋白,10mM叠氮钠溶解于磷酸盐缓冲液PBS,含有钙、镁离子,pH=7.0)重悬细胞后,加入荧光标记的CD59特异性抗体,3℃避光反应30分钟后,再用预冷的流式细胞缓冲液清洗离心,去除未结合的抗体;其中,荧光抗体的添加量为:通常一个实验样本为±106细胞/100μl的单细胞悬液,每100μl单细胞悬液加入10μl荧光抗体;
(4)制备上样悬液
重悬步骤(3)中所得的两组AL细胞于预冷的流式细胞缓冲液后,获取上样悬液;
(5)细胞分选
将制备得到的上样悬液送入BD FACS AriaTMⅢCell Sorter型号的流式细胞分选仪中,使用流式细胞微孔板分选技术并采用流式细胞分选仪系统限定的48孔或96孔细胞培养平板进行单细胞分选,具体方法如下:
a、在流式细胞仪上获取数据时,建立前向散射FSC/侧向散射SSC散点图,SSC用来检测细胞内部颗粒度,FSC用来检测细胞的大小;通过初步设定门P1,排除死细胞和细胞碎片,找到目标细胞群,并调节各个光电倍增管装置以确定所有要分析的细胞群都在点图的可视范围内,具体如下:通过设置和调节FSC阈值,将大部分的细胞碎片、气泡和激光背景噪的干扰排除在分析区域之外(都应该设在FSC-low/SSC-low区域),接下来在FSC/SSC点图中圈出目标细胞群的周围区域(P1),这个区域可以被称为“P1-FSC/SSC”,P1设门主要是根据细胞最集中的部分圈定其范围,排除周围过大过小的分散的细胞颗粒或碎片杂质;
b、建立SSC-W/FSC-W散点图,通过二次设定门P2,排除双联体细胞,保证最后进行荧光检测和分选的细胞是单个细胞,W指收集信号的宽度;SSC-W/FSC-W全称为侧向散射角-宽度/前向散射角-宽度散点图,宽度(如SSC-W)常用来区分双联体细胞;由于双联体细胞所得到的信号会比单个细胞大,反应在SSC-W/FSC-W图上即为纵坐标和横坐标值较大较离散的点状区域,因此根据细胞的大小和颗粒度的宽度二次设门P2来排除双联体;
c、建立PE-A/FSC-A荧光分析点图,根据对照细胞群位置设定阴阳性界定门,界定门以下为阴性CD59﹣细胞群,界定门以上为阳性CD59﹢细胞群;这两群细胞中必然包含一些假阳性/假阴性的细胞或杂质,可通过精确调节界定门以上或以下的分选区域,以及调节分选模式来获得高纯度的阳性和阴性对照细胞;PE为抗体偶联的染料-藻红蛋白;A为荧光脉冲的面积,面积积分比荧光脉冲的高度H更能准确反应检测指标的含量;PE-A/FSC-A全称为荧光染料-荧光脉冲面积/细胞大小-荧光脉冲面积分析点图;
阴阳性界定门是根据阳性和阴性对照细胞群分别占收集细胞的百分比划分的,通过设置和调节PE对应的FL2荧光通道的电压值和四象限门位置,使检测到的阳性和阴性细胞纯度都分别达到99.9%及以上,这时对应的象限门位置就是划分阴阳性对照细胞的界定门;
d、对阴性CD59-细胞群区域进一步精确设门,利用流式细胞微孔板分选技术对精确设门区进行单细胞分选;该分选技术还可进行多板96孔板的连续分选,可批量获得不同突变类型和突变程度的CD59﹣表型单细胞突变子;
(6)细胞扩增
将分选获得的单细胞突变子进行连续培养,扩增至单细胞克隆群;
单细胞突变子的前期扩增培养采用条件培养基,条件培养基的获取方法为:待正常野生型AL细胞长满至培养皿底65%时收集其培养基,经3500rpm离心15min,0.22μm无菌微孔滤器过滤除去杂质、细胞碎片后分装冻存,培养单细胞突变子时在新鲜F12完全培养基中加入45%的上述培养基即为条件培养基;条件培养基中含有细胞因子等活性物质,可有效提高单细胞体外培养的成功率;
(7)突变图谱分析
对扩增后的每个单细胞克隆群11号染色体上与CD59基因物理图谱位置接近的APO-A1、CAT、WT9、PTH和RAS五个标记基因进行多重PCR扩增,对比分析对照组(自发突变)和处理组(诱发突变)细胞的基因突变图谱;
实施例3
本实施例的一种基因缺失突变的高通量筛选方法,适用于各类环境污染物如石棉、有机污染物、重金属、辐射等的致突性分析,包括如下步骤:
(1)细胞处理及连续培养
正常培养两皿AL细胞(包括野生型AL细胞、由野生型AL细胞发展的各种缺陷型细胞以及构建的细胞系)至对数生长期分为对照组和处理组,即一皿不做任何处理,另一皿用4μg/mL亚砷酸钠连续处12小时(诱发突变),再将对照组和处理组AL细胞各以5.0×105/ml细胞密度重新种植到培养皿中,连续培养8天,使处理后的存活细胞有足够的时间从生长暂时停滞状态中恢复,同时,也使突变缺陷型AL细胞繁殖的后代细胞表面不再残留CD59抗原;
(2)细胞收集
收取对照组和处理组AL细胞,胰蛋白酶酶解消化,悬浮于F12完全培养基中,清洗后各制成浓度为±106细胞/100μl的单细胞悬液;其中,胰蛋白酶由质量含量为0.25%的胰蛋白酶和0.02%EDTA溶于PBS缓冲液制得;
(3)与荧光抗体的结合
加入120μl预冷的流式细胞缓冲液(质量比为1%的牛血清白蛋白,10mM叠氮钠溶解于磷酸盐缓冲液PBS,含有钙、镁离子,pH=7.0)重悬细胞后,加入荧光标记的CD59特异性抗体,5℃避光反应60分钟后,再用预冷的流式细胞缓冲液清洗离心,去除未结合的抗体;其中,荧光抗体的添加量为:通常一个实验样本为±106细胞/100μl的单细胞悬液,每100μl单细胞悬液加入20μl荧光抗体;
(4)制备上样悬液
重悬步骤(3)中所得的两组AL细胞于预冷的流式细胞缓冲液后,获取上样悬液;
(5)细胞分选
将制备得到的上样悬液送入BD FACS AriaTMⅢCell Sorter型号的流式细胞分选仪中,使用流式细胞微孔板分选技术并采用流式细胞分选仪系统限定的48孔或96孔细胞培养平板进行单细胞分选,具体方法如下:
a、在流式细胞仪上获取数据时,建立前向散射FSC/侧向散射SSC散点图,SSC用来检测细胞内部颗粒度,FSC用来检测细胞的大小;通过初步设定门P1,排除死细胞和细胞碎片,找到目标细胞群,并调节各个光电倍增管装置以确定所有要分析的细胞群都在点图的可视范围内,具体如下:通过设置和调节FSC阈值,将大部分的细胞碎片、气泡和激光背景噪的干扰排除在分析区域之外(都应该设在FSC-low/SSC-low区域),接下来在FSC/SSC点图中圈出目标细胞群的周围区域(P1),这个区域可以被称为“P1-FSC/SSC”,P1设门主要是根据细胞最集中的部分圈定其范围,排除周围过大过小的分散的细胞颗粒或碎片杂质;
b、建立SSC-W/FSC-W散点图,通过二次设定门P2,排除双联体细胞,保证最后进行荧光检测和分选的细胞是单个细胞,W指收集信号的宽度;SSC-W/FSC-W全称为侧向散射角-宽度/前向散射角-宽度散点图,宽度(如SSC-W)常用来区分双联体细胞;由于双联体细胞所得到的信号会比单个细胞大,反应在SSC-W/FSC-W图上即为纵坐标和横坐标值较大较离散的点状区域,因此根据细胞的大小和颗粒度的宽度二次设门P2来排除双联体;
c、建立PE-A/FSC-A荧光分析点图,根据对照细胞群位置设定阴阳性界定门,界定门以下为阴性CD59﹣细胞群,界定门以上为阳性CD59﹢细胞群;这两群细胞中必然包含一些假阳性/假阴性的细胞或杂质,可通过精确调节界定门以上或以下的分选区域,以及调节分选模式来获得高纯度的阳性和阴性对照细胞;PE为抗体偶联的染料-藻红蛋白;A为荧光脉冲的面积,面积积分比荧光脉冲的高度H更能准确反应检测指标的含量;PE-A/FSC-A全称为荧光染料-荧光脉冲面积/细胞大小-荧光脉冲面积分析点图;
阴阳性界定门是根据阳性和阴性对照细胞群分别占收集细胞的百分比划分的,通过设置和调节PE对应的FL2荧光通道的电压值和四象限门位置,使检测到的阳性和阴性细胞纯度都分别达到99.9%及以上,这时对应的象限门位置就是划分阴阳性对照细胞的界定门;
d、对阴性CD59﹣细胞群区域进一步精确设门,利用流式细胞微孔板分选技术对精确设门区进行单细胞分选;该分选技术还可进行多板96孔板的连续分选,可批量获得不同突变类型和突变程度的CD59﹣表型单细胞突变子;
(6)细胞扩增
将分选获得的单细胞突变子进行连续培养,扩增至单细胞克隆群;
单细胞突变子的前期扩增培养采用条件培养基,条件培养基的获取方法为:待正常野生型AL细胞长满至培养皿底75%时收集其培养基,经4500rpm离心25min,0.22μm无菌微孔滤器过滤除去杂质、细胞碎片后分装冻存,培养单细胞突变子时在新鲜F12完全培养基中加入55%的上述培养基即为条件培养基;条件培养基中含有细胞因子等活性物质,可有效提高单细胞体外培养的成功率;
(7)突变图谱分析
对扩增后的每个单细胞克隆群11号染色体上与CD59基因物理图谱位置接近的APO-A1、CAT、WT9、PTH和RAS五个标记基因进行多重PCR扩增,对比分析对照组(自发突变)和处理组(诱发突变)细胞的基因突变图谱;
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种构建Hi‑C高通量测序文库的方法与制造工艺
- 桑葚病原菌高通量鉴定及种属分类方法及其应用与制造工艺
- 基于高通量测序技术检测乳腺癌/卵巢癌易感基因的多重PCR特异性引物、试剂盒及方法与制造工艺
- 基于高通量测序检测人EGFR基因变异的质控方法及试剂盒与制造工艺
- 基于高通量测序技术的小麦病原微生物检测方法及其应用与制造工艺
- 一种基于二代高通量测序技术的地中海贫血症的基因检测试剂盒的制造方法与工艺
- 一种基于集群的高通量数据分析方法与制造工艺
- 高通量双折射干涉成像光谱仪装置及其成像方法与制造工艺
- 高通量测序检测人循环肿瘤DNA EGFR基因的捕获探针及试剂盒的制造方法与工艺
- 一种高通量测序检测无创亲子鉴定的方法与制造工艺