一株高效转化甘草酸生产GAMG的东乡野生稻内生真菌及其应用的制作方法
本发明涉及生物转化领域,具体涉及一株高效转化甘草酸生产GAMG的东乡野生稻内生真菌及其在转化甘草酸生产GAMG中的应用方法。
背景技术:
甘草酸(Glycyrrhizitic acid,GL),又名甘草皂苷,是药用甘草中的主要活性成分之一。甘草皂苷是由一分子的五环三萜类皂苷通过糖苷键与两分子的葡萄糖醛酸连接而成。甘草酸经β-D-葡萄糖醛酸苷酶水解作用后,除去远端的一个葡萄糖醛酸基就生成单葡萄糖醛酸基甘草次酸(GAMG)。
单葡萄糖醛酸基甘草次酸(Glycyrrhetinic acid mono-Glucuronide,GAMG),又称甘草次苷,是一种天然的甜味剂,不仅具有高甜度、低热量的优良特性,还能增加食品原有的风味,被作为甜味剂和食品添加剂,广泛应用于食品行业。GAMG具有和甘草酸相似的抗炎、抗病毒、抗肿瘤、抗消化道溃疡、抗过敏、保肝、降血脂和镇咳祛痰等药理作用,并且GAMG具有更好的吸收率和生物利用度。现代药理学研究表明,GL和GAMG在体内具有相同的代谢途径。因此,GAMG可以发挥与GL相似的药理学作用,作为甘草酸类药物更有效的替代品,GAMG具有不可比拟的优势。
目前,生产GAMG的方法主要包括两大类,分别是化学法和生物法。应用传统的化学方法生产GAMG,具有键的选择性低、可调控性差、反应路线长、收率低等缺点,且对设备的要求高,很难实现真正的工业化生产。与传统的化学方法相比,生物转化的方法具有操作简单、反应条件温和、键的选择性强、反应速率快、副产物少等优点。因此,应用微生物转化方法生产GAMG,不仅能够节约成本,而且还能实现GAMG的定向合成,提高GAMG的产率。根据一系列相关的研究报道可知,用于生物转化合成GAMG的菌株主要集中于青霉属、曲霉属、木霉属、根霉属等,利用内生真菌转化GL成GAMG的报道不多。专利ZL201410225800.3报道利用内生真菌DX-SES3(Microsphaeropsis arundinis)将甘草转化成甘草次苷,转化率为80.5%,但其生成甘草次苷吸附在菌体表面,利用乙醇洗涤就能获得纯度为89.4%的成品,该专利的优点是产物的分离简单,绿色环保。专利201410057606.9报道内生真菌Aspergillus flavus DX-SEL2高效转化甘草变成甘草次苷,转化率90.5%,甘草次苷产率为85.3%,该工艺转化率高,产物也比较容易纯化。如何从丰富的真菌资源中发现更多具有专一性、高效性转化的菌株,是响应可持续发展的生产要求,也是实现工业化生产的重要前题。本发明从禾本科植物东乡野生稻抽穗期的茎组织中分离筛选出能高效转化甘草酸生产GAMG的球毛壳菌Chaetomium globosum DX-THS3,以期为实现GAMG的工业化生产奠定基础。
技术实现要素:
本发明的目的是提供一株高效转化甘草酸生产GAMG的东乡野生稻内生真菌,并利用该菌株高效转化甘草酸生产GAMG,以实现GAMG的高效定向转化、副产物少、低耗能、高产物得率的可持续生产要求。
本发明中,高效转化甘草酸生产GAMG的东乡野生稻内生真菌,其分类命名为球毛壳菌Chaetomium globosum DX-THS3,是从东乡野生稻抽穗期活体的茎组织中采用内生真菌分离纯化技术分离获得,已保藏于中国典型培养物保藏中心,保藏地址为湖北省武汉市武汉大学,保藏日期为2016年1月4日,保藏号为CCTCC NO:M 2016005。
所述的球毛壳菌Chaetomium globosum DX-THS3的形态特征为:在PDA培养基上28℃培养3天,菌落直径为40~43mm,5天菌落直径为71~72mm,7天长满整个培养皿;菌丝初期为白色,呈丝状,不易挑取;菌落干燥,不透明,与培养基结合紧密,边缘不平整,成熟后为绒毡状,黑色,菌体产生的色素部分分泌在培养基中,使培养基背面呈黑色,菌落以接种块为中心在培养基上以黑色同心圆分布。在光学显微镜下,可观察到该菌株的菌丝,菌丝丰富且为有隔菌丝,未观察到孢子结构(如图1、图2所示)。
所述的球毛壳菌Chaetomium globosum DX-THS3的基因登录号为KF558876,它的ITS碱基序列:
TTCCGTAGGGTGAACCTGCGGAGGGATCATTACAGAGTTGCAAAACTCCCTAAACCATTGTGAACGTTACCTATACCGTTGCTTCGGCGGGCGGCCCCGGGGTTTACCCCCCGGGCGCCCCTGGGCCCCACCGCGGGCGCCCGCCGGAGGTCACCAAACTCTTGATAATTTATGGCCTCTCTGAGTCTTCTGTACTGAATAAGTCAAAACTTTCAACAACGGATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCGCCAGCATTCTGGCGGGCATGCCT GTTCGAGCGTCATTTCAACCATCAAGCCCCCGGGCTTGTTGTGTTGGGGACCTGCGGCTGCCGCAGGCCCTGAAAAGCAGTGGCGGGCTCGCTGTCGCACCGAGTAGCATACATCTCGCTCTGGTCGCGCCGCGGGTTCCGGCCGTTAAACCACCTTTTAACCCAAGGTGACCTCGGATCAGGTAGGAAGACCCGCTGAACTTACGCATATCAATAAGCGAGGGA
所述的球毛壳菌Chaetomium globosum DX-THS3可以应用于生产GAMG,其应用方法包括以下步骤:
步骤一、将球毛壳菌Chaetomium globosum DX-THS3接种到PDA斜面培养基上活化5~7天,再用接种环挑取一环斜面种子接入到已灭菌的摇瓶种子培养基中,置于温度为28~30℃、转速为120~160r/min的摇床中,连续培养3~5天,即至菌体的对数生长期;
步骤二、按照1~10%(w/v)的接种量把上述培养好的种子接种至含甘草酸的转化培养基中,转化生产GAMG至含量基本恒定;
步骤三、从发酵液中分离纯化GAMG。
优选的是,步骤一中种子培养基的成分及配比为:葡萄糖5.0~20g/L,KH2PO4 1.2~3.2g/L,NH4NO3 2.0~5.0g/L,NaCl 0.5~1.0g/L,酵母粉0.05~0.3g/L,MgSO4·7H2O 0.25~0.5g/L,CaCl2 0.011~0.11g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69mg/L,H3BO3 0.03mg/L,纯水1000mL,调节pH 5.0~7.0,121℃高压蒸汽下灭菌30min。
优选的是,步骤二中转化培养基的成分及配比为:甘草酸(甘草酸盐或甘草提取物)1~5g/L,KH2PO4 1.2~3.2g/L,蛋白胨2.0~5.0g/L,NaCl 0.5~1.0g/L,MgSO4·7H2O 0.25~0.5g/L,CaCl2 0.011~0.11g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69mg/L,H3BO3 0.03mg/L,纯水1000mL,调节pH 5.0~7.0,121℃高压蒸汽下灭菌30min;其中甘草酸(甘草酸盐或甘草提取物)是菌体产β-D-葡萄糖醛酸苷酶的诱导剂。
优选的是,步骤二中培养条件为:温度28~36℃、转速120~180r/min。
优选的是,步骤三中GAMG的分离纯化包含以下步骤:
布氏漏斗抽滤,收集发酵液,用石油醚等体积萃取两次,每次2小时,水相用氯仿等体积萃取两次,每次2小时,水相继续用乙酸乙酯等体积的萃取两次,每次2小时。得到的乙酸乙酯相减压浓缩即为GAMG粗品,然后再用反相硅胶柱层析及制备液相等方法进一步分离纯化得到GAMG。
本发明的有益效果主要体现在:公开了一株高效转化甘草酸生产GAMG的东乡野生稻内生真菌,该高效转化甘草酸生产GAMG的东乡野生稻内生真菌可以用来转化甘草酸生产GAMG;在本发明的应用方法中,用微生物菌体所合成的β-D-葡萄糖醛酸苷酶作为该水解反应的催化剂,具有操作简单、专一性强、产率高、副产物少、低能耗等优点。
附图说明
图1为本发明所述球毛壳菌Chaetomium globosum DX-THS3的菌落形态;
图2为本发明所述球毛壳菌Chaetomium globosum DX-THS3在光学显微镜下的菌丝形态;
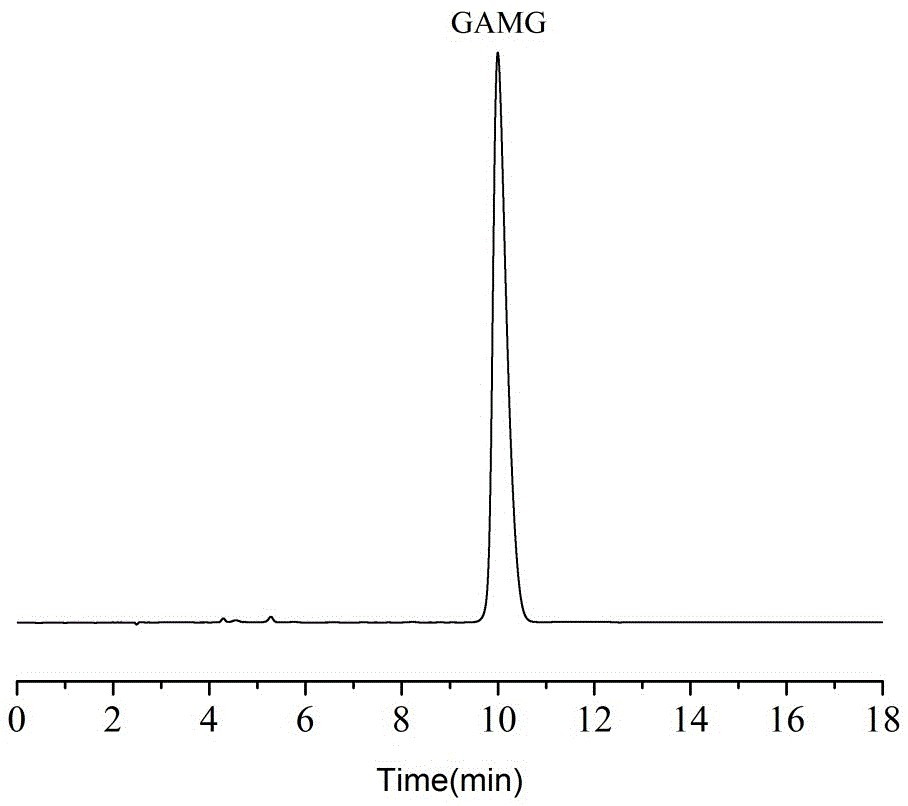
图3为本发明所述球毛壳菌Chaetomium globosum DX-THS3转化甘草酸转化液的HPLC检测;
图4为分离纯化后的GAMG的HPLC液相图;
图5为本发明所述球毛壳菌Chaetomium globosum DX-THS3转化甘草酸所得的GAMG分离纯化后经ESI-MS检测所得的谱图。
具体实施方式
以下结合实例对本发明进行详细说明。
实施例1
本发明所述球毛壳菌Chaetomium globosum DX-THS3的分离:
(1)采集完整的东乡野生稻,回到实验室立即处理。根部、茎部和叶子均采用75%的酒精浸泡5min,进行初步灭菌,再用0.1%升汞浸泡8min,接着用无菌水漂洗组织表面的灭菌方式。
(2)将上述处理好的茎用用已灭菌的剪刀将其两头都减掉,再将去掉两头的茎纵剖,一分为二,再剪成0.1cm×0.5cm的小块。将它们分别置于外加60μg/L链霉素和0.5g/L重铬酸钾的PDA培养基上,置于28℃的培养箱中培养。为了检查表面灭菌的效果,设置对照组检验灭菌的效果。对照Ⅰ:将已灭菌的根、茎和叶子不减去两头和边缘,然后将它们的表面与固体平板接触后取出,并将培养皿放入培养箱中培养;对照Ⅱ:最后一次洗涤用无菌水接入培养基中。每个处理重复3次。
(3)发现接种组织长出的菌落,用接种针前端挑取菌丝前端,再接种到另一个培养基上。每天观察一次,如果长出菌落,立即挑出。
(4)挑出的真菌形成菌落后,用接种针挑取菌丝前端,再接种到另一个培养基上,如此反复纯化4次,将菌种接种到斜面培养基上4℃保存。
实施例2
本发明所述球毛壳菌Chaetomium globosum DX-THS3的筛选:
(1)平板初筛:将上述分离纯化得到的东乡野生稻内生真菌活化,之后接种到甘草酸(甘草酸盐或甘草提取物)作为唯一碳源的固体筛选培养基中,对照组用葡萄糖作为唯一碳源。置于28℃的培养箱中,连续培养7天,筛选出能在甘草酸为唯一碳源的培养基上生长良好的菌株。
所述固体筛选培养基的组成及配比为:甘草酸氨盐1.0g/L,KH2PO4 2.2g/L,NH4NO33.0g/L,NaCl 0.5g/L,酵母粉0.05g/L,MgSO4·7H2O 0.25g/L,CaCl2 0.011g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69mg/L,H3BO3 0.03mg/L,琼脂粉20g/L,纯水1000mL,调节pH 5.0~7.0,121℃高压蒸汽下灭菌30min。
(2)摇瓶复筛:将上述平板初筛出来的菌株接种到摇瓶种子培养基中,置于温度为28℃、转速为120r/min的摇床中,连续培养3~5天。然后,按1%(w/v)的接种量把上述培养好的种子接种至甘草酸为唯一碳源的摇瓶筛选培养基中,并设置两个对照组:一是液体筛选培养基中不接入菌种(以检测甘草酸再培养基中是否会发生分解),二是将菌种转接到以葡萄糖为唯一碳源的液体筛选培养基中。置于温度为28℃、转速为120r/min的摇床中,连续培养5天,过滤,收集发酵液,用TLC、HPLC的方法检测发酵液中的转化产物。
摇瓶种子培养基组成:葡萄糖20g/L,KH2PO4 2.2g/L,NH4NO3 3.0g/L,NaCl 0.5g/L,酵母粉0.05g/L,MgSO4·7H2O 0.25g/L,CaCl2 0.011g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69mg/L,H3BO3 0.03mg/L,纯水1000mL,调节pH 5.0~7.0,121℃高压蒸汽下灭菌30min。
摇瓶筛选培养基组成:甘草酸氨盐1.0g/L,KH2PO4 2.2g/L,NH4NO3 3.0g/L,NaCl 0.5g/L,酵母粉0.05g/L,MgSO4·7H2O 0.25g/L,CaCl2 0.011g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69mg/L,H3BO3 0.03mg/L,纯水1000mL,调节pH 5.0~7.0,121℃高压蒸汽下灭菌30min。
实验结果表明:球毛壳菌Chaetomium globosum DX-THS3能高效转化甘草酸生产GAMG(如图3),甘草酸的转化率[(起始GL的摩尔浓度-转化后GL的摩尔浓度)/起始GL的摩尔浓度×100%]为88.7%,GAMG的转化率[转化后GAMG的摩尔浓度/起始GL的摩尔浓度×100%]为86.4%。
实施例3
球毛壳菌Chaetomium globosum DX-THS3转化甘草提取物生产GAMG:
将活化后的球毛壳菌Chaetomium globosum DX-THS3接种到种子培养基中,置于温度为28℃、转速为120r/min的摇床中,连续培养3天,按照1~10%(w/v)的接种量把上述培养好的种子接种至含甘草酸的转化培养基中,置于温度为28℃、转速为120r/min的摇床中,连续培养7天。离心除去菌体,收集发酵液,并用0.22μm的微孔滤头,最后经HPLC检测转化产物。
所述种子培养基的组成及配比为:葡萄糖20g/L,KH2PO4 1.2~3.2g/L,NH4NO3 2.0~5.0g/L,NaCl 0.5~1.0g/L,酵母粉0.05~0.3g/L,MgSO4·7H2O 0.25~0.5g/L,CaCl20.011~0.11g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69mg/L,H3BO3 0.03mg/L,纯水1000mL,调节pH 5.0~6.0。
所述转化培养基的组成及配比为:甘草提取物5g/L,KH2PO4 1.2~3.2g/L,蛋白胨2.0~5.0g/L,NaCl 0.5~1.0g/L,MgSO4·7H2O 0.25~0.5g/L,CaCl2 0.011~0.11g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69~2.50mg/L,H3BO3 0.03~0.05mg/L,纯水1000mL,调节pH 5.0~6.0。
转化结束后,抽滤除去菌体得滤液并检测转化产物,由检测结果可知,甘草酸的转化率为:88.7%,GAMG的转化率为:86.4%。
所得滤液用等体积的石油醚除去发酵液中脂溶性成分,接着用等体积的氯仿除去极性较小的杂质,水相继续用等体积的乙酸乙酯萃取3次,得到的乙酸乙酯相减压浓缩即得GAMG的粗品。再利用中压柱层析对GAMG粗品进行进一步地分离,得到GAMG的纯品,其纯度为99.4%(如图4)。
实施例4
球毛壳菌Chaetomium globosum DX-THS3转化甘草酸钾盐生产GAMG:
将活化后的球毛壳菌Chaetomium globosum DX-THS3接种到培养基中,置于温度为28℃、转速为120r/min的摇床中,连续培养5天。
所述培养基的组成及配比为:葡萄糖10g/L,KH2PO4 1.2~3.2g/L,NH4NO3 2.0~5.0g/L,NaCl 0.5~1.0g/L,酵母粉0.05~0.3g/L,MgSO4·7H2O 0.25~0.5g/L,CaCl20.011~0.11g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69mg/L,H3BO3 0.03mg/L,纯水1000mL,调节pH 5.0~6.0。
向连续培养5天后的培养液中添加甘草酸钾盐至3g/L,置于温度28℃、转速为120r/min的摇床中,连续培养7天。离心除去菌体,收集发酵液,并用0.22μm的微孔滤头,最后经HPLC检测转化产物。
转化结束后,抽滤除去菌体得滤液并检测转化产物,由检测结果可知,甘草酸的转化率为:85.4%,GAMG的转化率为:84.9%。
实施例5
球毛壳菌Chaetomium globosum DX-THS3转化甘草酸钠盐生产GAMG。
将活化后的球毛壳菌Chaetomium globosum DX-THS3接种到培养基中,置于温度为30℃、转速为135r/min的摇床中,连续培养4天。
所述培养基的组成及配比为:葡萄糖10g/L,KH2PO4 1.2~3.2g/L,NH4NO3 2.0~5.0g/L,NaCl 0.5~1.0g/L,酵母粉0.05~0.3g/L,MgSO4·7H2O 0.25~0.5g/L,CaCl20.011~0.11g/L,ZnSO4·7H2O 2.87mg/L,MnSO4·H2O 1.69mg/L,H3BO3 0.03mg/L,纯水1000mL,调节pH 5.0~6.0。
向连续培养4天后的培养液中添加甘草酸钠盐至2g/L,置于温度30℃、转速为135r/min的摇床中,连续培养6天。离心除去菌体,收集发酵液,并用0.22μm的微孔滤头,最后经HPLC检测转化产物。
转化结束后,抽滤除去菌体得滤液并检测转化产物,由检测结果可知,甘草酸的转化率为:80.3%,GAMG的转化率为:75.9%。
SEQUENCE LISTING
<110> 江西科技师范大学
<120> 一株高效转化甘草酸生产GAMG的东乡野生稻内生真菌及其应用
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 574
<212> DNA
<213> 球毛壳菌DX-THS3 (Chaetomium globosum DX-THS3)
<400> 1
ttccgtaggg tgaacctgcg gagggatcat tacagagttg caaaactccc taaaccattg 60
tgaacgttac ctataccgtt gcttcggcgg gcggccccgg ggtttacccc ccgggcgccc 120
ctgggcccca ccgcgggcgc ccgccggagg tcaccaaact cttgataatt tatggcctct 180
ctgagtcttc tgtactgaat aagtcaaaac tttcaacaac ggatctcttg gttctggcat 240
cgatgaagaa cgcagcgaaa tgcgataagt aatgtgaatt gcagaattca gtgaatcatc 300
gaatctttga acgcacattg cgcccgccag cattctggcg ggcatgcctg ttcgagcgtc 360
atttcaacca tcaagccccc gggcttgttg tgttggggac ctgcggctgc cgcaggccct 420
gaaaagcagt ggcgggctcg ctgtcgcacc gagtagcata catctcgctc tggtcgcgcc 480
gcgggttccg gccgttaaac caccttttaa cccaaggtga cctcggatca ggtaggaaga 540
cccgctgaac ttacgcatat caataagcga ggga 574
- 还没有人留言评论。精彩留言会获得点赞!