一种二维共轭苯并二呋喃类有机小分子光伏材料及其制备方法和应用与流程
本发明涉及光伏材料技术领域,具体涉及一种二维共轭苯并二呋喃类有机小分子光伏材料及其制备方法和应用。
背景技术:
苯并二杂环(苯并二噻吩和苯并二呋喃)类聚合物在太阳能电池领域表现出了非常优异的性能[boliu,xuewenchen,yuehuihe,yongfangli,xinjunxu,luxiao,lidongli,andyingpingzou.journalofmaterialschemistrya,2013,1,570-577;boliu,xuewenchen,yingpingzou,luxiao,xinjunxu,yuehuihe,lidongli,andyongfangli.macromolecules,2012,45,6898-6905.]。尤其是在苯并[1,2-b;3,4-b]二噻吩(bdt)或苯并[1,2-b;3,4-b]二呋喃(bdf)的主链上引入噻吩二维共轭侧链后,光伏性能得到明显的提高[longye,shaoqingzhang,wenchaozhao,huifengyao,andjianhuihou.chemistryofmaterials.2014,26,3603-3605.]。例如:中国科学院化学研究所侯剑辉研究员课题组用4,8-二烷基噻吩基-苯并[1,2-b;3,4-b]二噻吩二锡与噻吩并[3,4-b]噻吩二溴聚合,得到了一种苯并二噻吩类聚合物光伏材料,这类bdt基光伏材料在300~750nm范围内对太阳光具有很好的吸收,其中,pbt-3f获得了高达8.6%的能量转换效率[maojiezhang,xiaguo,shaoqingzhang,jianhuihou.advancedmaterials,2014,26,1118-1123.];本课题组用二维共轭bdf与烷氧链修饰的苯并噻二唑共聚,得到的聚合物显示出了良好的光伏性能,能量转换效率为6.0%[boliu,beibeiqiu,xuewenchen,luxiao,yongfangli,yuehuihe,lihuijiang,andyingpingzou.polymerchemistry,2014,5,5002-5008]。二维共轭苯并[1,2-b;3,4-b]二呋喃是一个重要的电子给体单元,但是将其作为电子给体单元与其他稠杂环电子受体单元偶联后应用于有机小分子太阳能电池领域还未见报道。相对于烷氧基柔性侧链,在bdf主链引入二维共轭噻吩侧链,增加了π电子的离域,扩大了共轭范围,有利于拓宽bdf类材料的吸收光谱和提高载流子迁移率,预期获得更高的能量转换效率。
本发明采用stille偶联的方法合成了一系列二维共轭bdf基的a-π-d-π-a型有机小分子光伏材料,对它们进行了光学、电化学等表征,并对其在太阳能电池上的应用进行了研究。
技术实现要素:
有鉴于此,本发明的目的在于提出一种二维共轭苯并二呋喃类有机小分子光伏材料及其制备方法和应用,该有机小分子光伏材料为碳-碳单键连接的二维共轭bdf类有机小分子材料,且可作为电子给体材料用于太阳能电池上。
基于上述目的,本发明提供的一种二维共轭苯并二呋喃类有机小分子光伏材料,该有机小分子光伏材料的结构如式(ⅰ)所示:
其中,r为烷基。
式(ⅰ)所示的化合物为4,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-烷氧基-3,6-呋喃基-2-吡咯并吡咯二酮)。
在本发明中,优选的,r为8~12个碳原子的直链或支链烷烃。
在本发明中,进一步优选的,所述r选自以下基团中的一种:
在本发明中,当
当
当
本发明提供的一种二维共轭bdf类有机小分子光伏材料具有良好的可加工性,并且经过初步尝试证明具有较好的光电转换特性,作为有机小分子太阳能电池的电子给体材料有着广阔的应用前景。
进一步的,本发明还提供了一种所述的二维共轭苯并二呋喃类有机小分子光伏材料的制备方法,包括以下步骤:
1)氩气保护下,无水四氢呋喃注入到2-异辛基噻吩中,滴加正丁基锂,反应1~2小时后,将苯并二呋喃-4,8-二酮加入到反应体系中,45~55℃再反应1~2小时,冷却至室温后,将sncl2·2h2o溶解到盐酸溶液中并滴加至上述反应液中,继续反应1~2小时后将混合物倒入水中,萃取,旋干溶剂,经硅胶层析柱分离得到化合物1;
2)氩气保护下,将化合物1与无水四氢呋喃混合,在-78℃下,往反应体系中缓慢滴加正丁基锂,搅拌0.5~1.5小时,移至室温搅拌1~2小时,再放置在-78℃下,加入三甲基氯化锡,室温下反应过夜,停止反应,反应混合物倒入冰水中,萃取,旋干有机溶剂,析出黄色晶体,重结晶得到化合物2;
3)氮气保护下,将化合物2与2’-溴-二(2,5-二烷基-3,6-呋喃基-2-吡咯并吡咯二酮)加入到无水甲苯中,再加入pd(pph3)4(四(三苯基膦)钯),110~120℃下反应40~50小时,冷却至室温,沉析,过滤,过硅胶柱,得到化合物ⅰ;
其中,2-异辛基噻吩的结构如下式所示:
化合物1的结构如式(1)所示:
化合物2的结构如式(2)所示:
2’-溴-二(2,5-二烷基-3,6-呋喃基-2-吡咯并吡咯二酮)的结构式如下式所示:
本发明目标化合物(ⅰ)的合成路线如下:
i)n-buli,thf,sncl2·2h2o,hcl,reflux,6h;ii)n-buli,thf,sn(ch3)3cl,-78℃,overnight;iii)pd(pph3)4,toluene,115℃,48h.
在本发明中,优选的,步骤1)中所述溴代烷烃为溴代正辛烷、溴代异辛烷或溴代十二烷;2-异辛基噻吩、苯并二呋喃-4,8-二酮与sncl2·2h2o的摩尔比为2~3:1:7~9;硅胶层析柱的淋洗液为石油醚。
在本发明中,优选的,步骤2)中化合物1、正丁基锂与三甲基氯化锡的摩尔比为1:3~4:3.5~4;重结晶为在异丙醇中重结晶。
在本发明中,优选的,步骤3)中化合物2与2’-溴-二(2,5-二烷基-3,6-呋喃基-2-吡咯并吡咯二酮)的摩尔比为1:2~3,pd(pph3)4与2’-溴-二(2,5-二异辛基-3,6-呋喃基-2-吡咯并吡咯二酮)的质量比为5~10:100。
在本发明中,优选的,步骤3)中沉析为在甲醇中沉析;过硅胶柱的淋洗液为体积比1:1的正己烷/三氯甲烷混合液。
本发明提供的一种二维共轭bdf类有机小分子光伏材料是采用stille偶联的方法将bdf电子给体单元与dpp电子受体单元直接偶联而成。制备方法为:将含有噻吩共轭侧链的苯并[1,2-b;3,4-b]二呋喃(bdf)单元,通过stille偶联的方法,将bdf单元通过碳-碳单键与另一个芳香杂环相连接,得到二维共轭bdf类有机小分子。
本发明将二维共轭的概念应用到可溶液加工有机分子光伏材料的设计和合成中,合成了以2-异辛基噻吩取代的二维共轭苯并二呋喃为核、两端对称性连接dpp电子受体单元的可溶性两维共轭有机分子。它们在常见的有机溶剂(如二氯甲烷、三氯甲烷、四氢呋喃等)中有良好的溶解性,可以用溶液方法制备高质量的薄膜。同时,这些有机小分子光伏材料具有宽的可见光区吸收,合适的homo以及lumo能级和相对较窄的带隙。以此类有机分子为电子给体、pc61bm为电子受体制备了有机太阳能电池,其最高能量转换效率可达到3.7%,具有良好的光电转换效率。
因此,更进一步的,本发明还提供了所述的二维共轭苯并二呋喃类有机小分子光伏材料在太阳能电池中的应用。
在本发明中,优选的,所述二维共轭苯并二呋喃类有机小分子光伏材料用作太阳能电池电子给体材料。
本发明用上述二维共轭苯并二呋喃类有机小分子光伏材料为电子给体材料,应用于有机太阳能电池,其制备方法如下:
将本发明的二维共轭bdf类有机小分子光伏材料与电子受体(pc61bm)混合,加入三氯甲烷,使混合物溶解即可,涂覆在经pedot:pss修饰后的导电玻璃上制备出一层导电薄膜,然后在薄膜上制备金属电极。
本发明提供的二维共轭bdf类有机小分子光伏材料具有宽的吸收光谱和合适的电化学能级,并用核磁共振谱、质谱和元素分析的方法表征了各步合成产物的分子结构。用紫外-可见吸收光谱研究了bdf类有机小分子材料的光学性能。用循环伏安法研究了bdf类有机小分子材料的电化学性能。并以其作为电子给体做成了太阳能电池器件,获得了良好的光电转换效率。
与现有技术相比,本发明具有以下有益效果:
(1)本发明合成的路线简单,成本低,且合成方法具有普适性,可以较好的推广应用到其他的bdf类材料的合成。
(2)本发明二维共轭bdf类有机小分子材料具有大的共轭结构,相比较侧链为烷氧链bdf类有机分子,有望获得更宽的紫外-可见吸收光谱和载流子迁移率。
(3)对比二维共轭bdt类有机小分子,本发明的二维共轭bdf类有机小分子具有较低的homo能级,对氧的稳定性高,有利于制备性能更加稳定的太阳能电池器件。
(4)本发明用二维共轭bdf类有机小分子光伏材料为电子给体材料,应用于有机小分子太阳能电池获得了较好的能量转换效率(pce=3.7%),具有良好的应用前景。
附图说明
图1为本发明二维共轭bdf类有机小分子光伏材料的光学性能图;
图2为本发明二维共轭bdf类有机小分子光伏材料的电化学性能图;
图3为本发明二维共轭bdf类有机小分子光伏材料的光电转换效率图;
图4为本发明二维共轭bdf类有机小分子光伏材料的外量子转换效率图;
图5为本发明二维共轭bdf类有机小分子光伏材料活性层的形貌分析;其中c图为高度图,d图为相图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
本发明二维共轭bdf类有机小分子光伏材料的合成路线如下所示:
i)n-buli,thf,sncl2·2h2o,hcl,reflux,6h;ii)n-buli,thf,sn(ch3)3cl,-78℃,overnight;iii)pd(pph3)4,toluene,115℃,48h.
实施例14,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二异辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(m1)的制备
具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(3.92mg,20mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至50℃反应回流搅拌1.5小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。50℃再反应1.5小时,冷却至室温后,将sncl2·2h2o(14.4mg,64mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应1.5小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.83g,产率:19%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加2.0ml正丁基锂(4.8mmol,2.4mol/l),完毕后继续搅拌1小时,移至室温搅拌1小时,再放置在-78℃下,一次性加入5.5ml三甲基氯化锡(5.5mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.64g,产率:54%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m1的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二异辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.2mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(10mg),115℃下搅拌反应48小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m1(216mg,产率71%);所述化合物m1中r基团如下:
化合物m1的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,6h),1.53-1.27(m,48h),0.97-0.85(m,36h).
tof-ms:m/z=1528.
anal.calcdforc94h118n4o10s2(%):c,73.88;h,7.78;n,3.67.found(%):c,73.89;h,7.91;n,3.66.
实施例24,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二异辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(m1)的制备
具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(3.14mg,16mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至45℃反应回流搅拌1小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。45℃再反应1小时,冷却至室温后,将sncl2·2h2o(12.6mg,56mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应1小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.80g,产率:18%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加1.75ml正丁基锂(4.2mmol,2.4mol/l),完毕后继续搅拌0.5小时,移至室温搅拌1小时,再放置在-78℃下,一次性加入4.9ml三甲基氯化锡(4.9mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.62g,产率:52%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m1的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二异辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.25mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(16.25mg),110℃下搅拌反应50小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m1(212mg,产率70%);所述化合物m1中r基团如下:
化合物m1的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,6h),1.53-1.27(m,48h),0.97-0.85(m,36h).
tof-ms:m/z=1528.
anal.calcdforc94h118n4o10s2(%):c,73.88;h,7.78;n,3.67.found(%):c,73.89;h,7.91;n,3.66.
实施例34,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二异辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(m1)的制备
具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(4.70mg,24mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至55℃反应回流搅拌2小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。55℃再反应2小时,冷却至室温后,将sncl2·2h2o(16.2mg,72mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应2小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.82g,产率:18.7%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加2.3ml正丁基锂(5.6mmol,2.4mol/l),完毕后继续搅拌1.5小时,移至室温搅拌2小时,再放置在-78℃下,一次性加入5.6ml三甲基氯化锡(5.6mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.60g,产率:51%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m1的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二异辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.3mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(9.75mg),120℃下搅拌反应50小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m1(214mg,产率70%);所述化合物m1中r基团如下:
化合物m1的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,6h),1.53-1.27(m,48h),0.97-0.85(m,36h).
tof-ms:m/z=1528.
anal.calcdforc94h118n4o10s2(%):c,73.88;h,7.78;n,3.67.found(%):c,73.89;h,7.91;n,3.66.
实施例44,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(m2)的制备
化合物m2的合成方法与实施例1中化合物m1的合成方法相同,溴代烷烃采用溴代正辛烷,具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(3.92mg,20mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至50℃反应回流搅拌1.5小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。50℃再反应1.5小时,冷却至室温后,将sncl2·2h2o(14.4mg,64mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应1.5小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.83g,产率:19%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加2.0ml正丁基锂(4.8mmol,2.4mol/l),完毕后继续搅拌1小时,移至室温搅拌1小时,再放置在-78℃下,一次性加入5.5ml三甲基氯化锡(5.5mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.64g,产率:54%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m2的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.2mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(10mg),115℃下搅拌反应48小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m2(265mg,产率87%);所述化合物m2中r基团如下:
化合物m2的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,6h),1.53-1.27(m,60h),0.97-0.85(m,24h).
tof-ms:m/z=1528.
anal.calcdforc94h118n4o10s2(%):c,73.88;h,7.78;n,3.67.found(%):c,73.86;h,7.77;n,3.69.
实施例54,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(m2)的制备
化合物m2的合成方法与实施例2中化合物m1的合成方法相同,溴代烷烃采用溴代正辛烷,具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(3.14mg,16mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至45℃反应回流搅拌1小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。45℃再反应1小时,冷却至室温后,将sncl2·2h2o(12.6mg,56mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应1小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.80g,产率:18%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加1.75ml正丁基锂(4.2mmol,2.4mol/l),完毕后继续搅拌0.5小时,移至室温搅拌1小时,再放置在-78℃下,一次性加入4.9ml三甲基氯化锡(4.9mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.62g,产率:52%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m2的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.25mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(16.25mg),110℃下搅拌反应50小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m2(257mg,产率85%);所述化合物m2中r基团如下:
化合物m2的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,6h),1.53-1.27(m,60h),0.97-0.85(m,24h).
tof-ms:m/z=1528.
anal.calcdforc94h118n4o10s2(%):c,73.88;h,7.78;n,3.67.found(%):c,73.86;h,7.77;n,3.69.
实施例64,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(m2)的制备
化合物m2的合成方法与实施例3中化合物m1的合成方法相同,溴代烷烃采用溴代正辛烷,具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(4.70mg,24mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至55℃反应回流搅拌2小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。55℃再反应2小时,冷却至室温后,将sncl2·2h2o(16.2mg,72mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应2小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.82g,产率:18.7%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加2.3ml正丁基锂(5.6mmol,2.4mol/l),完毕后继续搅拌1.5小时,移至室温搅拌2小时,再放置在-78℃下,一次性加入5.6ml三甲基氯化锡(5.6mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.60g,产率:51%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m2的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.3mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(9.75mg),120℃下搅拌反应50小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m2(251mg,产率82%);所述化合物m2中r基团如下:
化合物m2的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,6h),1.53-1.27(m,60h),0.97-0.85(m,24h).
tof-ms:m/z=1528.
anal.calcdforc94h118n4o10s2(%):c,73.88;h,7.78;n,3.67.found(%):c,73.86;h,7.77;n,3.69.
实施例74,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二十二烷基-3,6-呋喃基-2-吡咯并吡咯二酮)(m3)的制备
化合物m3的合成方法与实施例1中化合物m1的合成方法相同,溴代烷烃采用溴代正十二烷,具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(3.92mg,20mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至50℃反应回流搅拌1.5小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。50℃再反应1.5小时,冷却至室温后,将sncl2·2h2o(14.4mg,64mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应1.5小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.83g,产率:19%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加2.0ml正丁基锂(4.8mmol,2.4mol/l),完毕后继续搅拌1小时,移至室温搅拌1小时,再放置在-78℃下,一次性加入5.5ml三甲基氯化锡(5.5mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.64g,产率:54%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m3的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二十二烷基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.2mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(10mg),115℃下搅拌反应48小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m3(283mg,产率81%);所述化合物m3中r基团如下:
化合物m3的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,10h),1.53-1.27(m,88h),0.97-0.85(m,24h).
tof-ms:m/z=1753.
anal.calcdforc110h150n4o10s2(%):c,75.39;h,8.63;n,3.20.found(%):c,75.36;h,8.61;n,3.23.
实施例84,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二十二烷基-3,6-呋喃基-2-吡咯并吡咯二酮)(m3)的制备
化合物m3的合成方法与实施例2中化合物m1的合成方法相同,溴代烷烃采用溴代正十二烷,具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(3.14mg,16mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至45℃反应回流搅拌1小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。45℃再反应1小时,冷却至室温后,将sncl2·2h2o(12.6mg,56mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应1小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.80g,产率:18%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加1.75ml正丁基锂(4.2mmol,2.4mol/l),完毕后继续搅拌0.5小时,移至室温搅拌1小时,再放置在-78℃下,一次性加入4.9ml三甲基氯化锡(4.9mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.62g,产率:52%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m3的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二十二烷基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.25mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(16.25mg),110℃下搅拌反应50小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m3(280mg,产率80%);所述化合物m3中r基团如下:
化合物m3的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,10h),1.53-1.27(m,88h),0.97-0.85(m,24h).
tof-ms:m/z=1753.
anal.calcdforc110h150n4o10s2(%):c,75.39;h,8.63;n,3.20.found(%):c,75.36;h,8.61;n,3.23.
实施例94,8-二异辛基噻吩基-苯并(1,2-b;4,5-b′)-二呋喃-2,6-二(2,5-二十二烷基-3,6-呋喃基-2-吡咯并吡咯二酮)(m3)的制备
化合物m3的合成方法与实施例3中化合物m1的合成方法相同,溴代烷烃采用溴代正十二烷,具体步骤如下:
①化合物1的合成
氩气保护下,将5ml无水四氢呋喃注入到2-异辛基噻吩(4.70mg,24mmol,购买于苏州纳凯科技有限公司)中,0℃下逐滴滴加9.2ml正丁基锂,将体系升至55℃反应回流搅拌2小时,苯并二呋喃(1.5mg,8mmol)加入到反应体系中。55℃再反应2小时,冷却至室温后,将sncl2·2h2o(16.2mg,72mmol)溶解到25.6ml10%的盐酸溶液滴加至上述反应液中,继续反应2小时后将混合物倒入水中,用二氯甲烷萃取,无水硫酸镁干燥有机相,过滤,旋干溶剂,用石油醚作为淋洗液经硅胶层析柱分离得到产物为黄色粘稠状液体化合物1(0.82g,产率:18.7%)。
化合物1的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=546.
1hnmr(400mhz,cdcl3,ppm):7.77(d,2h),7.68(d,2h),7.37(d,2h),6.89(d,2h),2.85(d,4h),1.70(m,2h),1.463-1.25(br,16h),0.95-0.91(m,12h).
anal.calcdforc34h42o2s2(%):c,74.68;h,7.74;o,5.85.found(%):c,74.66;h,7.75;o,5.87.
②化合物2的合成
氩气保护下,化合物1(0.75g,1.4mmol)与30ml无水四氢呋喃混合在100ml三口烧瓶中,放置在-78℃下,往反应体系中缓慢滴加2.3ml正丁基锂(5.6mmol,2.4mol/l),完毕后继续搅拌1.5小时,移至室温搅拌2小时,再放置在-78℃下,一次性加入5.6ml三甲基氯化锡(5.6mmol,1mol/l),反应体系移至室温下,反应过夜,停止反应,反应混合物倒入100ml冰水中,二氯甲烷萃取,水洗有机相3次,合并有机相用无水硫酸镁干燥,旋干多余的有机溶剂,慢慢析出黄色晶体,粗产物用异丙醇重结晶得到浅黄色针状晶体化合物2(0.60g,产率:51%)。
化合物2的核磁共振谱、质谱和元素分析如下所示:
tof-ms:m/z=872.
1hnmr(400mhz,cdcl3,ppm):7.72(d,2h),7.50(s,2h),6.90(d,2h),2.88(d,4h),1.74(m,2h),1.54-1.33(br,16h),0.95(m,12h),0.47(s,18h).
anal.calcdforc40h58o2s2sn2(%):c,55.07;h,6.70;o,3.67.found(%):c,55.09;h,6.69;o,3.68.
③化合物m3的合成
氩气保护下,将化合物2(0.1mmol)和2-溴-2,6-二(2,5-二异辛基-3,6-呋喃基-2-吡咯并吡咯二酮)(0.3mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(9.75mg),120℃下搅拌反应50小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物过硅胶柱(淋洗液为正己烷:三氯甲烷=1:1(v/v)),得到深蓝色固体m3(273mg,产率78%);所述化合物m3中r基团如下:
化合物m3的核磁共振谱、质谱和元素分析如下所示:
1hnmr(400mhz,cdcl3,ppm):8.91(s,2h),8.66(s,2h),7.61(s,2h),7.41(d,4h),7.33(s,2h),7.24(s,2h),7.07(s,2h),4.02-3.95(m,8h),2.94(d,4h),1.84-1.77(m,10h),1.53-1.27(m,88h),0.97-0.85(m,24h).
tof-ms:m/z=1753.
anal.calcdforc110h150n4o10s2(%):c,75.39;h,8.63;n,3.20.found(%):c,75.36;h,8.61;n,3.23.
实施例10有机小分子太阳能电池的制备
本发明以化合物m1、m2或m3作为工作介质,制备有机小分子太阳能电池的方法是:将化合物m1、m2或m3与pc61bm混合,加入三氯甲烷溶解,通过旋涂的方式在ito导电玻璃上制备出一层导电薄膜,然后通过真空蒸镀的方式制备金属电极。
具体步骤为:2mg的化合物m1与2mg的pc61bm(富勒烯)混合,加入0.2ml三氯甲烷溶解,通过旋涂方式在经pedot:pss修饰过的导电玻璃上制备出一层约120nm厚的薄膜,110℃下热退火15分钟,然后通过真空蒸镀的方式用铝/氟化锂在光伏活性层上制备金属电极。其器件性能表现为:
短路电流=9.5ma/cm2;开路电压=0.81v;填充因子=47.9%;
模拟太阳光(a.m.1.5,100mw/cm2)下的能量转换效率=3.7%。
实施例11有机小分子太阳能电池的制备
2mg的化合物m2与2mg的pc61bm(富勒烯)混合,加入0.2ml三氯甲烷溶解,通过旋涂方式在经pedot:pss修饰过的导电玻璃上制备出一层约120nm厚的薄膜,110℃下热退火15分钟,然后通过真空蒸镀的方式用铝/氟化锂在光伏活性层上制备金属电极。其器件性能表现为:
短路电流=10.2;开路电压=0.81;填充因子=42.8%;
模拟太阳光(a.m.1.5,100mw/cm2)下的能量转换效率=3.5%。
实施例12有机小分子太阳能电池的制备
2mg的化合物m3与2mg的pc61bm(富勒烯)混合,加入0.2ml三氯甲烷溶解,通过旋涂方式在经pedot:pss修饰过的导电玻璃上制备出一层约120nm厚的薄膜,110℃下热退火15分钟,然后通过真空蒸镀的方式用铝/氟化锂在光伏活性层上制备金属电极。其器件性能表现为:
短路电流=10.3;开路电压=0.81;填充因子=42.7%;
模拟太阳光(a.m.1.5,100mw/cm2)下的能量转换效率=3.6%。
实施例13
以化合物m1为例,对其进行光谱分析、电化学性能分析、光伏性能分析以及形貌分析。
①化合物m1的光学性能
化合物m1在三氯甲烷溶液和成膜状态下的吸收光谱如图1所示,在实施例10所制备的薄膜状态下,在薄膜状态下,化合物m1在300~770nm范围内对光有明显吸收,光学帯隙为1.61ev,说明化合物m1是窄帯隙光伏材料,可以吸收更多的太阳光,获得高的短路电流。较窄的能隙主要归因于苯并二呋喃引入到a-π-d-π-a分子中,形成了电荷转移态,从而降低带隙,达到更宽的吸光范围。这类二维共轭bdf类有机小分子光伏材料在太阳能电池的制备中有着广阔的应用前景。
②化合物m1的电化学性能
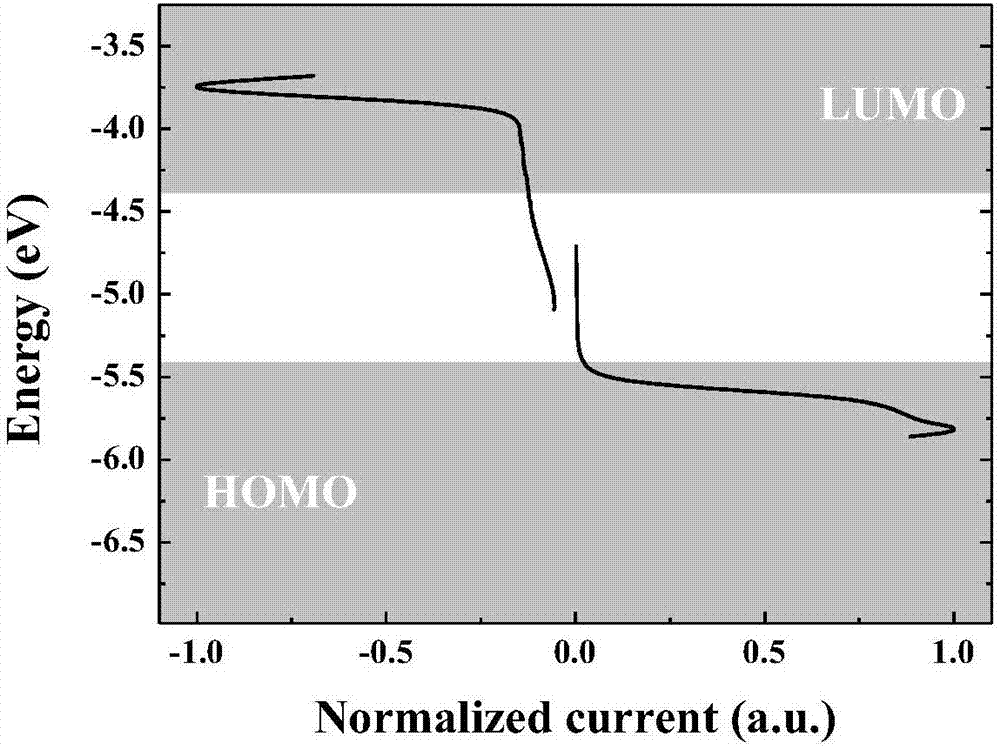
在电化学中,循环伏安法通常被用来测定物质的电化学能级,图2是化合物m1在0.1mol/l的bu4nbf4/ch2cl2溶液中测得的循环伏安曲线,我们可以从氧化曲线部分看出化合物m1有较低的homo能级(5.82ev),从还原曲线部分可以得到化合物m1的lumo能级为3.75ev,电化学能隙为2.07ev,参见表1。低的homo能级表明化合物m1有良好的空气稳定性,非常适合制备长使用寿命的太阳能电池器件。
表1化合物m1的光学与电化学结果
③化合物m1的光伏性能分析
化合物m1的光伏性能如图3所示,表明化合物m1具有良好的光伏性能。如化合物m1与pc61bm共混时,经过110℃热退火处理15分钟后(制备方法参见实施例10),短路电流=9.5ma/cm2;开路电压=0.81v;填充因子=47.9%;模拟太阳光(a.m.1.5,100mw/cm2)下的能量转换效率=3.7%,参见表2。
我们相信太阳能电池的转换效率可以通过器件条件的优化得到进一步提升。化合物m1的eqe曲线如图4所示,从图4中我们可以看出化合物m1具有较宽的光谱响应和较高的eqe效率值。
表2化合物m1的光伏性能结果
④化合物m1的形貌分析
光伏活性层的形貌是决定能量转换效率高低的关键因素。采用原子力显微镜测试了化合物m1与pc61bm共混膜的形貌(制备方法参见实施例10),如图5所示,结果表明光伏活性层具有很好的纳米级相分离,化合物m1与pc61bm受体间形成了互穿网络结构,有利于电荷的分离与收集,获得较高的光电流和填充因子。
由实施例1-13可知,本发明合成的路线简单,成本低,且合成方法具有普适性,可以较好的推广应用到其他的bdf类材料的合成;本发明二维共轭bdf类有机小分子材料具有大的共轭结构,相比较侧链为烷氧链bdf类有机分子,有望获得更宽的紫外-可见吸收光谱和载流子迁移率;对比二维共轭bdt类有机小分子,本发明的二维共轭bdf类有机小分子具有较低的homo能级,对氧的稳定性高,有利于制备性能更加稳定的太阳能电池器件;本发明用二维共轭bdf类有机小分子光伏材料为电子给体材料,应用于有机小分子太阳能电池获得了较好的能量转换效率(pce=3.7%),具有良好的应用前景。
综上所述,本发明将二维共轭的概念应用到可溶液加工有机分子光伏材料的设计和合成中,合成了以2-异辛基噻吩取代的二维共轭苯并二呋喃为核、两端对称性连接dpp电子受体单元的可溶性两维共轭有机分子。它们在常见的有机溶剂(如二氯甲烷、三氯甲烷、四氢呋喃等)中有良好的溶解性,可以用溶液方法制备高质量的薄膜。同时,这些有机小分子光伏材料具有宽的可见光区吸收,合适的homo以及lumo能级和相对较窄的带隙。以此类有机分子为电子给体、pc61bm为电子受体制备了有机太阳能电池,其最高能量转换效率可达到3.7%,具有良好的光电转换效率。
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种具有抗氧化活性的芳基苯并呋喃类化合物及其制备方法和应用与流程
- 一种含苯并双环酮与乙氧磺隆的除草组合物及其应用的制造方法与工艺
- 一种6‑氯呋喃[3,2‑B]吡啶的合成方法与流程
- 一类苯并吡喃类化合物及其应用的制造方法与工艺
- 一种以二苯并环庚烯为核心的化合物及其在有机电致发光器件上的应用的制造方法与工艺
- 一种含苯并双环酮与乙草胺的除草组合物及其应用的制造方法与工艺
- 一种含苯并双环酮与噁草酮的除草组合物及其应用的制造方法与工艺
- 分解二噁英前体的催化剂筛选系统及其使用方法与流程
- 一种无卤热固性树脂组合物以及含有它的预浸料、层压板和印制电路板的制造方法与工艺
- 一种以二联二苯并五元杂环为骨架的有机化合物及其在OLED上的应用的制造方法与工艺