一种能同时检测和鉴别口蹄疫和水泡性口炎的检测试剂盒及引物和探针的制作方法
本发明涉及一种可同时检测和鉴别口蹄疫病毒(fmdv)、新泽西水泡性口炎病毒(vsv-nj)和印第安型水泡性口炎病毒(vsv-ind)的一步法多重荧光rt-pcr检测试剂盒及引物和探针,可实现一次采样,一次分析,同时检测和区分3种病毒的目的,属于检验检疫领域。
背景技术:
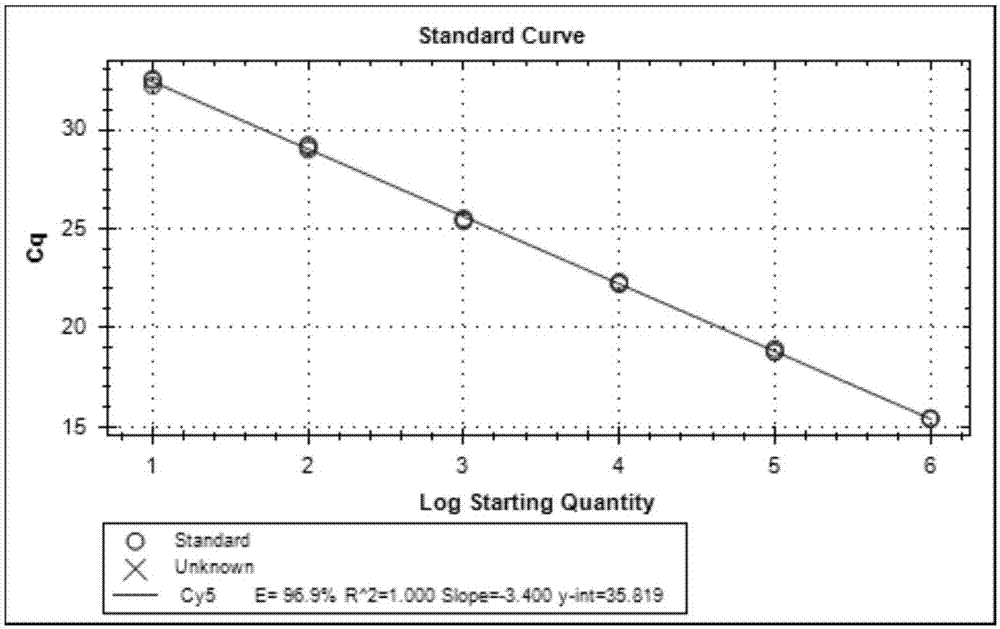
:口蹄疫病毒(fmdv)和水泡性口炎病毒(vsv)是引起牛、羊、猪等多种动物感染的病毒性疾病,临床特征均为口腔粘膜、乳头皮肤及蹄冠部皮肤出现水泡及糜烂,会混合感染,临床症状相似,鉴别诊断困难,是危害养殖业最为严重的几种病原。口蹄疫和水泡性口炎被世界动物卫生组织(oie)规定为多种动物感染的、跨界传播病原,也是我国动物及动物产品国际贸易中重要的检疫对象。目前,针对上述几种病原建立了多种分子检测技术,如pcr和荧光pcr技术等,在这些疫病的诊断和防控中发挥了重要作用。但目前所建立的方法多是针对一种病原的单目标检测,在实际检测中需要重复多次,才能完成检测不同病原的目的,检测工作量大且时间长,不能满足大批量动物检疫快速通关的实际需要。且难以实现实际样品中大量存在的混合感染以及症状相似疫病的鉴别诊断。在建立单目标病原检测技术的同时,各国兽医机构也相继研制了可同时检测多种病毒的多重pcr,但传统pcr技术灵敏度低、结果不易判定等缺点限制了其在多重检测中的应用。本研究利用荧光pcr技术在核酸检测方面具有的特异、敏感等特性,建立了fmdv、vsv-nj、vsv-ind三种病毒一步法多重荧光rt-pcr检测和鉴别方法并组装成试剂盒,可以实现一次采样,一次分析,可同时检测和区分3种重要病毒的目的,不仅减少了检测的工作量和成本,且能在最短的时间内完成疫病的检测,为疾病防治赢得时间。技术实现要素:本发明的第一个目的是提供特异性强、灵敏度高的同时检测和鉴别口蹄疫病毒(fmdv)、新泽西型水泡性口炎病毒(vsv-nj)和印第安纳型水泡性口炎病毒(vsv-ind)的多重荧光rt-pcr引物和探针。本发明的另一个目的是提供快速、准确、使用方便的同时检测和鉴别口蹄疫病毒(fmdv)、新泽西型水泡性口炎病毒(vsv-nj)和印第安纳型水泡性口炎病毒(vsv-ind)的一步法多重荧光rt-pcr检测试剂盒。为实现上述目的,本发明采用以下技术方案:在序列比对分析的基础上,针对口蹄疫病毒3d基因、新泽西型水泡性口炎病毒l基因和印第安纳型水泡性口炎病毒l基因,分别设计并筛选出能覆盖大部分分离株(特别是口蹄疫的引物和探针能够实现7个血清型通用检测),又适合多重检测并能进行鉴别的引物和探针(序列见表1)。口蹄疫病毒(fmdv)各血清型通用检测引物对由2条正向引物、3条反向引物和2条探针组成,新泽西型水泡性口炎病毒(vsv-nj)引物对由2条正向引物、1条反向引物和1条探针组成,印第安纳型水泡性口炎病毒(vsv-ind)引物对由1条正向引物、1条反向引物和1条探针组成,多重反应体系中引物混合物是这10条引物组成的混合物,探针是这4条探针组成的混合物,经过一步法多重荧光rt-pcr反应,可以实现三种病原的同时检测和鉴别。表1口蹄疫病毒和水泡性口炎病毒(包括新泽西型和印第安纳型)的一步法多重荧光rt-pcr检测引物和探针注:胞嘧啶(c)、鸟嘌呤(g)、腺嘌呤(a)、胸腺嘧啶(t)。简并碱基w代表a或t。探针5‘端标记有发光集团,探针3‘端标记有淬灭基团。我们采用多重荧光pcr技术建立了同时检测和鉴别口蹄疫病毒和水泡性口炎病毒(包括新泽西型和印第安纳型)的检测方法并组装了试剂盒。检测和鉴别口蹄疫病毒、新泽西型水泡性口炎病毒和印第安纳型水泡性口炎病毒的一步法多重荧光rt-pcr检测试剂盒,包括上述多重荧光rt-pcr检测引物和探针。进一步地,该试剂盒还包括完成多重荧光rt-pcr反应所需的材料和试剂,例如,反应缓冲液、酶、阳性对照、阴性对照等。在本发明的一个具体实施方式中,所述反应液为multiplexrt-pcr反应缓冲液;所述酶为multiplex酶;所述阴性对照为无核酸灭菌水;所述阳性对照分别为口蹄疫病毒(fmdv)3d基因、新泽西型水泡性口炎病毒(vsv-nj)l基因、印第安纳型水泡性口炎病毒(vsv-ind)l基因的体外反转录crna。本发明还提供了一种检测和鉴别口蹄疫病毒、新泽西型水泡性口炎病毒、印第安纳型水泡性口炎病毒的一步法多重荧光rt-pcr检测方法,包括如下步骤:(1)提取病毒总核酸;(2)配制rt-pcr反应体系,其中,所述反应体系中包含上述的多重荧光rt-pcr引物和探针;(3)进行一步法多重荧光rt-pcr反应;(4)结果判定;①质控标准:阳性对照均有s形扩增曲线,ct值大约在20左右,阴性对照无扩增信号。满足此条件,视为此次试验有效。②结果判断:有扩增曲线,且ct值在30以下的判定为阳性;有扩增曲线,但30<ct值<35的,属于疑似区间,需要重新确认;没有扩增曲线或者ct值大于35的,判定为阴性。本发明的优点是:1)多重性:可同时检测并区分口蹄疫病毒、新泽西型水泡性口炎病毒和印第安纳型水泡性口炎病毒,节约了检测时间和成本,有利于疫病特别是混合感染的及时确诊。2)灵敏:此多重荧光rt-pcr体系可以同时检测三种病原,其特异性与单个荧光rt-pcr相当。3)特异:设计引物和探针时充分考虑了病原之间可能存在的干扰,经过筛选保证了引物和探针的特异性和排他性。3)涵盖性和通用性好:本发明中设计的引物和探针都分别针对口蹄疫病毒和水泡性口炎病毒最保守的基因设计,对于每个病毒,其引物和探针都是多条,而且包含了简并引物,基本上覆盖了genebank中现有该种病毒的所有序列。口蹄疫病毒检测引物和探针包含了口蹄疫病毒的7个血清型,可以实现通用检测,水泡性口炎病毒则可以对新泽西型和印第安纳型2个血清型进行鉴别和区分。可以实现每种病毒不同亚型或血清型之间的通用检测。4)简便、易自动化:所有引物和探针的设计都是从可以进行多重检测考虑,不管是dna或rna病毒,都可以使用该一步法程序,省却了反转录过程,省时省力。附图说明图1:fmdv单荧光rt-pcr标准曲线。图2:vsv-nj单荧光rt-pcr标准曲线。图3:vsv-ind单荧光rt-pcr标准曲线。图4:fmdv,vsv-nj和vsv-ind多重荧光rt-pcr标准曲线。图5:fmdv单荧光rt-pcr与多重荧光rt-pcr的比较。图6:vsv-nj单荧光rt-pcr与多重荧光rt-pcr的比较。图7:vsv-ind单荧光rt-pcr与多重荧光rt-pcr的比较。具体实施方式为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。下述实施例中所用方法如无特别说明均为常规方法,所用的试验材料,如无特殊说明,均为常规生化试剂供应商购买得到。实施例1试剂盒的组成和使用1.试剂盒的配制组成表2试剂盒的组成其中2×multiplexrt-pcr缓冲液和multiplex酶购自ab公司产品path-idtmmultiplexone-steprt-pcrkit。引物混合物包括fmdv的2条正向引物、3条反向引物,vsv-nj的2条正向引物、1条反向引物以及vsv-ind的1条正向引物和1条反向引物,引物序列如表1,混合引物的工作浓度为400nm,引物委托大连宝生物公司合成。fmdv探针混合物包括fmdv的2条探针、vsv-nj和vsv-ind分别有1条探针,探针序列如表1,浓度分别为200nm,探针委托大连宝生物公司合成。阴性对照为无核酸灭菌水。fmdv阳性对照为口蹄疫病毒(fmdv)3d基因的体外反转录crna;vsv-nj阳性对照为新泽西型水泡性口炎病毒(vsv-nj)l基因的体外反转录crna;vsv-ind阳性对照为印第安纳型水泡性口炎病毒(vsv-ind)l基因的体外反转录crna。口蹄疫病毒(fmdv)3d基因体外转录rna的制备:回收o型口蹄疫病毒3d基因的rt-pcr扩增产物,长度1410bp,与pgem-t载体(购自promega公司)进行连接,转化jm109感受态细胞,碱裂解法提取质粒dna,经pcr和酶切鉴定后获得阳性重组质粒,命名为pgem-fmdv-3d。以纯化的质粒为模板,将质粒线性化之后,用promega公司的ribomaxtmlargescalernaproductionsystem-t7试剂盒进行体外转录;将体外转录产物用dnase除去其中的dna模板后经trizol提取后进行测定后,即得到口蹄疫病毒3d基因的体外转录rna,命名为fmdv-3d-crna;口蹄疫病毒3d基因序列如序列表中seqidno:15所示。新泽西型水泡性口炎病毒(vsv-nj)l基因体外转录rna的制备:回收新泽西型水泡性口炎病毒l基因的rt-pcr扩增产物,长度为500bp,与pgem-t载体(购自promega公司)进行连接,转化jm109感受态细胞,碱裂解法提取质粒dna,经pcr和酶切鉴定后获得阳性重组质粒,命名为pgem-vsv-nj-l。以纯化的质粒为模板,将质粒线性化之后,用promega公司的ribomaxtmlargescalernaproductionsystem-t7试剂盒进行体外转录;将体外转录产物用dnase除去其中的dna模板后经trizol提取后进行测定后,即得到新泽西型水泡性口炎病毒l基因的体外转录rna,命名为vsv-nj-l-crna;新泽西型水泡性口炎病毒l基因序列如序列表中seqidno:16所示。印第安纳型水泡性口炎病毒(vsv-ind)l基因体外转录rna的制备:回收印第安纳型水泡性口炎病毒l基因的rt-pcr扩增产物,长度为500bp,与pgem-t载体(购自promega公司)进行连接,转化jm109感受态细胞,碱裂解法提取质粒dna,经pcr和酶切鉴定后获得阳性重组质粒,命名为pgem-vsv-ind-l。以纯化的质粒为模板,将质粒线性化之后,用promega公司的ribomaxtmlargescalernaproductionsystem-t7试剂盒进行体外转录;将体外转录产物用dnase除去其中的dna模板后经trizol提取后进行测定后,即得到印第安纳型水泡性口炎病毒l基因的体外转录rna,命名为vsv-ind-l-crna;印第安纳型水泡性口炎病毒l基因序列如序列表中seqidno:17所示。2.试剂盒的使用方法1)病毒总核酸(rna/dna)的提取病毒核酸的提取采用病毒基因组dna/rna提取试剂盒(tianampvirusdna/rnakit),步骤如下:carrierrna溶液的配制:(1)carrierrna储存液:向装有310μgcarrierrna冻干粉的管子中加入310μlrnase-freeddh2o,将carrierrna彻底溶解,得到终浓度为1μg/μl的溶液,并分装、置于-20℃储存。(2)carrierrna工作液:根据样品的数量计算所需缓冲液gb和carrierrna溶液的体积(计算公式如下),将缓冲液gb与carrierrna溶液颠倒混匀,即得到carrierrna工作液;为避免溶液出现起泡现象,请勿使用涡旋振荡。计算公式:n×0.22ml=ymlyml×28μl/ml=zμl式中n=同时提取的样品个数,y=需要加入缓冲液gb的体积,z=需要加入carrierrna溶液的体积。操作步骤:(1)用移液器将20μlproteinasek加入一个干净的1.5ml离心管中。(2)向离心管中加入200μl血浆/血清/淋巴液或25mg磨碎的组织(样品需平衡至室温),如果样本体积小于200μl,可加入0.9%nacl溶液补充。(3)加入200μlcarrierrna工作液,盖上管盖,涡旋振荡15sec混匀。(4)56℃孵育15min,简短离心以收集附着在管壁及管盖的液体。(5)加入250μl无水乙醇,涡旋振荡15sec,彻底混匀,在室温(15-25℃)放置5min。(6)简短离心,以收集附着在管壁及管盖的液体。(7)将离心管中的溶液和絮状沉淀全部转移至rnase-free吸附柱cr2(吸附柱放在收集管中),盖上管盖,8,000rpm(~6,000×g)离心1min,弃废液,将吸附柱放回收集管中。(8)小心打开吸附柱盖子,加入500μl溶液gd(使用前请先检查是否已加入无水乙醇),盖上管盖,8,000rpm(~6,000×g)离心1min,弃废液,将吸附柱放回收集管。(9)小心打开吸附柱盖子,加入600μl溶液pw(使用前请先检查是否已加入无水乙醇),盖上管盖,静置2min,8,000rpm(~6,000×g)离心1min,弃废液,将吸附柱放回收集管。(10)重复步骤(9)。(11)小心打开吸附柱盖子,加入500μl无水乙醇,盖上管盖,8,000rpm(~6,000×g)离心1min,弃废液。(12)将吸附柱放回收集管中,12,000rpm(~13,400×g)离心3min,使吸附膜完全变干,弃废液。(13)将吸附柱放入一个新的rnase-free离心管(1.5ml)中,小心打开吸附柱的盖子,室温放置3min,使吸附膜完全变干。向吸附膜的中间部位悬空滴加20-150μlrnase-freeddh2o,盖上盖子,室温放置5min。(14)12,000rpm(~13,400×g)离心1min,收集到的即为病毒总核酸(dna或rna)。2)荧光rt-pcr检测分别取检测样品、阳阴性对照,按照下表3配制反应体系:表3一步法多重荧光rt-pcr反应体系:总体积20ul将混合液充分混合后,最后加入模板,简短离心,按照下列反应程序,进行一步法荧光rt-pcr反应,见表4:表4多重荧光rt-pcr反应程序3)结果描述及判定①质控标准:阳性对照均有s形扩增曲线,ct值大约在20左右,阴性对照无扩增信号。满足此条件,视为此次试验有效。②结果判断:有扩增曲线,且ct值在30以下的判定为阳性;有扩增曲线,但30<ct值<35的,属于疑似区间,需要重新确认;没有扩增曲线或者ct值大于35的,判定为阴性。实施例2、试剂盒的敏感性试验1、材料口蹄疫病毒、水泡性口炎病毒均由本实验室保存。2、方法1)阳性标准品的制备如实施例1所述的方法。2)标准品定量测定取制备好的体外转录crna用无rna酶的灭菌水分别作200倍稀释,用紫外分光仪测定其260nm和280nm的吸光度值(od260和od280),计算待测样品的浓度与纯度。纯rna:1.7<od260/od280<2.0(<1.7时表明有蛋白质或酚污染;>2.0时表明可能有异硫氰酸残存)。rna样品的浓度(μg/μl):od260×稀释倍数×40/1000,并按以下公式计算拷贝数(copies/μl):标准曲线绘制:将fmdv体外标准品进行10倍梯度稀释后进行荧光rt-pcr,用模板浓度倒数与对应的荧光ct值做浓度标准曲线,pcr扩增效率e值、相关系数r2值和曲线斜率slope值都落在可接受范围内,说明扩增效率良好。见图1。将vsv-nj体外标准品进行10倍梯度稀释后进行荧光rt-pcr,用模板浓度倒数与对应的荧光ct值做浓度标准曲线,pcr扩增效率e值、相关系数r2值和曲线斜率slope值都落在可接受范围内,说明扩增效率良好。见图2。将vsv-ind体外标准品进行10倍梯度稀释后进行荧光rt-pcr,用模板浓度倒数与对应的荧光ct值做浓度标准曲线,pcr扩增效率e值、相关系数r2值和曲线斜率slope值都落在可接受范围内,说明扩增效率良好。见图3。将fmdv、vsv-nj和vsv-ind体外标准品等量混合后,再进行10倍梯度稀释,进行多重荧光rt-pcr,用模板浓度倒数与对应的荧光ct值做浓度标准曲线,pcr扩增效率e值、相关系数r2值和曲线斜率slope值都落在可接受范围内,说明多重pcr之间没有互相干扰,扩增效率良好。见图4。3)一步法多重荧光rt-pcr方法检测极限的确定将上述定量的rna溶液调整为浓度大致相当,每种各取10μl,充分混匀后,制成阳性标准品。将该标准品10倍梯度稀释后,按最佳条件进行荧光rt-pcr检测,最高稀释倍数所能检测出的ct值所对应的的浓度即为最低检测限。3、结果1)rna溶液拷贝数测定结果将制备好的体外转录rna,分别用紫外分光仪测定其260nm和280nm的吸光度值并推算出拷贝数,详见下表5。表5rna纯度及含量测定2)多重荧光rt-pcr方法检测限的确定利用建立的多重荧光rt-pcr检测方法,对10倍系列稀释的阳性标准品进行检测,结果该方法可稳定检测到的最高ct值为35,所对应的的标准品浓度达到1-10拷贝数/反应。实施例3、试剂盒的特异性试验1材料本试验中所用到的病毒如表6。表6特异性试验研究过程中应用到的病毒和核酸病毒来源口蹄疫病毒(fmdv)本实验室保存印第安纳型水泡性口炎病毒(vsv-ind)本实验室保存新泽西型水泡性口炎病毒(vsv-nj)本实验室保存牛地方流行性白血病病毒(bvdv)本实验室保存伪狂犬病毒本实验室保存蓝舌病病毒(btv)本实验室保存传染性胃肠炎病毒(tgev)本实验室保存2、方法2.1分别用口蹄疫病毒、新泽西型水泡性口炎病毒和印第安纳型口蹄疫病毒的引物和探针对表格中的其他6种病毒核酸进行荧光rt-pcr检测,以验证引物和探针的特异性。2.2利用建立的多重荧光rt-pcr检测方法对表格中的7种病毒进行检测,验证多重荧光rt-pcr方法的特异性。2.3进行单荧光rt-pcr与多重荧光rt-pcr的比较。3、结果3.1每种病毒的引物和探针只能从自己的病毒核酸中扩增出曲线,其他病毒模板的扩增均为阴性,表明所设计的引物和探针特异性良好。3.2利用建立的多重荧光rt-pcr方法对表格6中的病毒进行检测,结果口蹄疫病毒、新泽西型水泡性口炎病毒、印第安纳型水泡性口炎病毒有扩增曲线,其它病毒均无特异性的扩增信号,表明所建立的方法特异性良好。表7特异性检测结果3.3将fmdv、vsv-nj和vsv-ind体外标准品等量混合后,再进行10倍梯度稀释,分别进行多重荧光rt-pcr和fmdv单荧光pcr,将相同模板浓度对应的荧光ct值进行比较,求解回归方程,二者之间相关系数r2值达到了0.9995,说明单荧光rt-pcr和多重荧光rt-pcr之间符合性良好,多重荧光rt-pcr没有产生干扰,没有影响扩增效率。见图5。将fmdv、vsv-nj和vsv-ind体外标准品等量混合后,再进行10倍梯度稀释,分别进行多重荧光rt-pcr和vsv-nj单荧光pcr,将相同模板浓度对应的荧光ct值进行比较,求解回归方程,二者之间相关系数r2值达到了0.9998,说明单荧光rt-pcr和多重荧光rt-pcr之间符合性良好,多重荧光rt-pcr没有产生干扰,没有影响扩增效率。见图6。将fmdv、vsv-nj和vsv-ind体外标准品等量混合后,再进行10倍梯度稀释,分别进行多重荧光rt-pcr和vsv-ind单荧光pcr,将相同模板浓度对应的荧光ct值进行比较,求解回归方程,二者之间相关系数r2值达到了0.9994,说明单荧光rt-pcr和多重荧光rt-pcr之间符合性良好,多重荧光rt-pcr没有产生干扰,没有影响扩增效率。见图7。实施例4:试剂盒对临床样品检测的实验报告1、材料实验室收集的已知fmdv阳性样品23份、vsv-nj阳性样品2份、vsv-ind阳性样品3份、bvdv阳性样品10份、tgev阳性样品13份及其他未知样品35份。2、方法对上述样品进行多重荧光rt-pcr检测,用实际样品验证方法的敏感性和特异性。3、结果临床样品的检测结果如表8。由表8可知,23份已知fmdv阳性样品、已知的2份vsv-nj阳性样品及3份vsv-ind阳性样品的检测均为阳性,符合率100%。而从已知的10份bvdv阳性样品中检测出1份fmdv阳性,从已知的13份tgev阳性样品中检测到2份fmdv阳性,这说明原来只检测bvdv和tgev的样品实际上也存在fmdv的混合感染;另外,随机选取了35份临床样品进行筛查,检测到1份fmdv阳性。这表明该多重荧光rt-pcr方法可以发现原来靠单一荧光rt-pcr没有进行筛查的非目标病原,检出了混合感染,避免了漏检。表8临床样品的检测结果显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。sequencelisting<110>北京出入境检验检疫局检验检疫技术中心<120>一种能同时检测和鉴别口蹄疫和水泡性口炎的检测试剂盒及引物和探针<130><160>17<170>patentinversion3.3<210>1<211>24<212>dna<213>人工合成引物<400>1actgggttttacaaacctgtgatg24<210>2<211>25<212>dna<213>人工合成引物<400>2ctgggttttataaacctgtgatggc25<210>3<211>21<212>dna<213>人工合成引物<400>3ccacggagatcaacttctcct21<210>4<211>22<212>dna<213>人工合成引物<400>4tgccacagagatcaacttctcc22<210>5<211>22<212>dna<213>人工合成引物<400>5ccacggaaatcaacttctcctg22<210>6<211>19<212>dna<213>人工合成探针<400>6tctcctttgcacgccgtgg19<210>7<211>21<212>dna<213>人工合成探针<400>7tcctctcctttgcacgtcgtg21<210>8<211>21<212>dna<213>人工合成引物<400>8gctctttatgcatgaccctgc21<210>9<211>22<212>dna<213>人工合成引物<400>9tgctttttatgcatgacccwgc22<210>10<211>20<212>dna<213>人工合成引物<400>10cgagacaacgccataccaca20<210>11<211>24<212>dna<213>人工合成探针<400>11ctggtttgcacaccagaacattca24<210>12<211>22<212>dna<213>人工合成引物<400>12tgatgatgcatgatccwgctct22<210>13<211>21<212>dna<213>人工合成引物<400>13acacwcctccaatggaagggt21<210>14<211>21<212>dna<213>人工合成探针<400>14accgggcttgcacagttctac21<210>15<211>1410<212>dna<213>口蹄疫病毒3d基因序列<400>15gggttgatcgttgacaccagagatgtggaggaacgcgtccacgtgatgcgcaaaaccaag60ctcgcgcccaccgtggcacacggtgtgttcaaccctgaattcgggcctgctgctctgtcc120aacaaggacccgcgcctgaaagaaggggtcgtccttgacgacgtcattttctcgaaacac180aagggagatacaaggatgtctgaggaagacaaagcgctgttccggcgctgtgctgccgac240tacgcgtcgcgcctacacagcgtgctagggacggcaaacgccccactgagtgtatacgaa300gccatcaaaggcgtcgacggacttgacgccatggagccagacaccgcacccggtctcccc360tgggctctccagggaaaacgccgaggtgccctgatcgacttcgaaaacggtactgtcggg420cccgaggttgaagcagcactcaagctcatggaaagccgtgggtacaaattcgtctgccaa480acctttctgaaagacgaaattcggccgctagagaaggtgcgcgccggcaagacgcgcatt540gtcgacgttttgcctgtagaacacattctctataccagaatgatgattggtagattctgt600gctcagatgcactcaaacaacggaccgcaaattggctcagcggtcggttgtaaccctgac660gttgattggcaaagatttggcacacatttcgctcagtacaagaacgtgtgggatgtggac720tactcagccttcgatgcaaaccactgcagcgatgcgatgaacatcatgttcgaagaggtg780ttccgcacggagtttgggttccacccgaatgccgagtggattctgaagactctggttaac840acggagcacgcttacgagaacaagcgcatcactgtggaaggtgggatgccgtccggttgt900tccgcaacaagtatcatcaacacaattttgaacaacatctacgtgctctacgctctgcgt960aggcactatgagggagttgagctggacacctacaccatgatctcctatggagacgacatc1020gtggtggcaagtgactacgacctggactttgaggctctcaagccccacttcaagtccctc1080ggtcagaccatcactccagccgacaaaagcgacaaaggttttgttcttggtcactccata1140actgatgtcactttcctcaaaagacacttccacatggactacggaactgggttttacaaa1200cctgtgatggcctcgaagaccctcgaggctatcctctcctttgcacgccgtgggaccata1260caggagaagttgatctccgtggcaggactcgccgtccactccggacctgacgagtaccgg1320cgtctctttgagcctttccaaggtctcttcgagattccaagctacagatcactttacctg1380cgatgggtgaacgccgtgtgcggtaatcac1410<210>16<211>500<212>dna<213>新泽西型水泡性口炎病毒l基因序列<400>16gcgagtgacatgtgttacaaatgatcaaattccgacatgtgccaatttgatgtcttcagt60ctctaccaacgcattaactgttgctcattttgcagaaaaccccataaacgcaatgattca120atataattattttgggacctttgctcgattattgctctttatgcatgaccctgcaataag180acattctctgtatacagtccaggaaaagatacctggtttgcacaccagaacattcaaata240tgctgtgttatatctagatccttcaatcggaggggtgtgtggtatggcgttgtctcgatt300cttaatcagagcatttccagatccagtaacagagagcctttcattctggaaatttattta360tgaacatgcctctgagcctcatcttaaaaagatggctgtaatgtttggggaccctccaat420tgccaaattcagaatagagcatatcaataagttattagaggaccccacctctttaaacat480ctcaatggggatgagccctg500<210>17<211>500<212>dna<213>印第安纳型水泡性口炎病毒l基因序列<400>17aattatggaaaaataccgattttccgtggagtgattagagggttagagaccaagagatgg60tcacgagtgacttgtgtcaccaatgaccaaatacccacttgtgctaatataatgagctca120gtttccacaaatgctctcaccgtagctcattttgctgagaacccaatcaatgccatgata180cagtacaattattttgggacatttgctagactcttgttgatgatgcatgatcctgctctt240cgtcaatcattgtatgaagttcaagataagataccgggcttgcacagttctactttcaaa300tacgccatgttgtatttggacccttccattggaggagtgtcgggcatgtctttgtccagg360tttttgattagagccttcccagatcccgtaacagaaagtctctcattctggagattcatc420catgtacatgctcgaagtgagcatctgaaggagatgagtgcagtatttggaaaccccgag480atagccaagtttcgaataac500当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1