二噻吩并*酰二亚胺衍生物、其中间体、制备方法和应用与流程
本发明涉及一种二噻吩并
背景技术:
有机半导体材料是有机电子器件发展的基础,有机场效应晶体管(ofet)和聚合物太阳能电池(opv)等有机光电器件的快速发展迫切需要高迁移率,高稳定性和易加工的有机光电材料。因此,设计合成性能优良的有机半导体材料具有重要的意义。
经过几十年的研究,有机场效应晶体管的发展已经初具规模,很多基于柔性基底的柔性逻辑电路,柔性显示器已经得以实现。但是对于场效应材料来说,目前仍然存在一些问题:可溶液加工的n-型低聚物和高聚物半导体的发展却相对滞后,高电子迁移率、空气稳定并具有良好加工性的n-型低聚物和高聚物材料尤为短缺(gao,x.etal.j.mater.chem.c,2014,2,3099)。然而,高电子迁移率、空气稳定并具有良好加工性的n-型低聚物和高聚物材料对于实现溶液法大面积制备逻辑门电路和发展全有机的聚合物太阳能电池具有至关重要的作用(anthony,j.e.;etal.adv.mater.2010,22,3876)。
对于n-型低聚物和高聚物半导体材料的发展,最重要的是发展新型π缺电子受体单元,缺电子的受体单元能够调控前线轨道能级,通过拉低聚合物的lumo能级来保证电子的注入,这对构筑d-a型聚合物至关重要(johnr.reynolds,chem.mater.,2016,28,1286-1297.)。但是现有的用来构建n-型低聚物和聚合物的缺电子受体单元仍然集中于萘酰亚胺和苝酰亚胺(gao,x.etal.j.mater.chem.c,2014,2,3099)。因此探索合成新型具有较低lumo能级的聚合受体单元并合成分子量较大的低聚物或高聚物成为发展新型n-型半导体材料的关键。综上所述,本领域迫切需要开发具有良好的器件性能的新型π缺电子受体单元。
技术实现要素:
本发明所要解决的技术问题是为了克服现有技术中用来构建n-型低聚物和聚合物的缺电子受体单元仍然集中于萘酰亚胺和苝酰亚胺等缺陷,而提供了一种二噻吩并
本发明提供了一种如式(a)所示的二噻吩并
rx为h、氰基、卤素、取代或未取代的c6-c30芳基、取代或未取代的c1-c30杂芳基或如式(b)所示的基团;
ry为h、氰基、卤素、取代或未取代的c6-c30芳基、取代或未取代的c1-c30杂芳基或如式(c)所示的基团;
如式(b)所示的基团结构为:
如式(c)所示的基团结构为:
x、y、x1、x2、x3、x4、x5、y1、y2、y3、y4和y5独立地为h、氰基、卤素、取代或未取代的c6-c30芳基、或取代或未取代的c1-c30杂芳基;
rx、ry、x、y、x1、x2、x3、x4、x5、y1、y2、y3、y4和y5中,所述的取代的c1-c30杂芳基中的杂原子选自n、o和s中的一个或多个(优选1-6,更优选1-3),当为多个时,杂原子的种类相同或不同;
rx、ry、x、y、x1、x2、x3、x4、x5、y1、y2、y3、y4和y5中,所述的取代的c6-c30芳基或所述的取代的c1-c30杂芳基中的取代基为下列基团中的一个或多个(优选1-6个,更优选1-5个),当取代基为多个时,所述的取代基相同或不同:卤素或三氟甲基;
ra、rb、ra01、ra02、ra03、ra04、rb01、rb02、rb03和rb04独立地为h、取代或未取代的c1-c48烷基、取代或未取代的c2-c48烯基、或取代或未取代的c3-c24环烷基;所述的取代的c1-c48烷基、取代的c2-c48烯基或取代的c3-c24环烷基中的取代基选自下列基团中的一个或多个,当取代基为多个时(优选1-6个,更优选1-5个),所述的取代基相同或不同:氰基、卤素、c1-c20烷基或c1-c20烷氧基;
n和n1独立地为0-1000的整数;
r1和r2独立地为空、
r1和r2中,所述的取代的c6-c30亚芳基或所述的取代的c1-c30亚杂芳基中的取代基选自下列基团中的一个或多个,当取代基为多个时(优选1-6个,更优选1-5个),所述的取代基相同或不同:
在本发明一优选实施方式中,当所述的取代的c1-c30亚杂芳基中的取代基为c1-c20烷氧基时,c1-c20烷氧基位于c1-c30亚杂芳基中的碳原子上。
在本发明一优选实施方案中,当rx和ry独立地为h、卤素、取代或未取代的c6-c30的芳基、或取代或未取代的c1-c30的杂芳基时,rx与x相同,ry与y相同。
在本发明一优选实施方案中,当rx为如式(b)或如式(c)所示的基团时,x、x1、x2、x3、x4和x5相同;y、y1、y2、y3、y4和y5相同。
rx、ry、x、y、x1、x2、x3、x4、x5、y1、y2、y3、y4和y5中,所述的取代的c6-c30的芳基或所述的取代的c1-c30的杂芳基中的取代基为下列基团中的一个或多个,当取代基为多个时,所述的取代基相同或不同:f、cl、br、i或三氟甲基。
rx、ry、x、y、x1、x2、x3、x4、x5、y1、y2、y3、y4和y5中,所述的卤素优选f、cl、br或i。
rx、ry、x、y、x1、x2、x3、x4、x5、y1、y2、y3、y4和y5中,所述的取代或未取代的c6-c30的芳基优选取代或未取代的c6-c14的芳基。所述的取代或未取代的c6-c14的芳基优选取代或未取代的苯基(例如
rx、ry、x、y、x1、x2、x3、x4、x5、y1、y2、y3、y4和y5中,所述的取代或未取代的c1-c30的杂芳基优选取代或未取代的c2-c10的杂芳基。所述的取代或未取代的c2-c10的杂芳基优选取代或未取代的噻吩基(例如
ra、rb、ra01、ra02、ra03、ra04、rb01、rb02、rb03和rb04中,所述的取代或未取代的c1-c48烷基优选2-癸基十四烷基。
n和n1优选0-500、0-300、0-100、0-50或0-30的整数。
r1和r2独立地为空或选自下列基团,或选自2-3个下列基团偶联
每个r6x独立地为氢、c1-c20的烷基或c1-c20的烷氧基;当r6x与羰基氧基连接时,r6x为c1-c20的烷基;上述各基团中,当存在两个以上r6x时,其相同或不同;
每个z独立地为o、s、se或te,优选s;每个z1独立地为s、se或te,优选s。
如式(a)所示的二噻吩并
rx、ry、x和y优选为h;
或者rx和x优选为氰基;ry和y优选为h;
或者rx、ry、x和y优选为氰基;
或者rx和x优选为i;ry和y优选为h;
或者rx和x优选为h;ry和y优选为br;
或者rx和x优选为i;ry和y优选为br。
如式(a)所示的二噻吩并
p1中,数均分子量mn为24305;pdi为1.64;p2中,数均分子量mn为65775,pdi为3.13。测试方法详情:eluent(洗脱液):tcbstabilisedwith0.0125%(0.0125%tcb稳定型);bhtflowrate(流速):1.00ml/min;columnset(设置纵列):3xplgelolexis300×7.5mm;columnsetlength(设置纵列长度):0mm;detector(检测器):ri;temperature(温度):150℃。
本发明还提供了一种如式(a)所示的二噻吩并
ry、y、ra和rb的定义均同前所述。
优选ry为h。
所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选甲苯、二甲苯和氯仿中的一种或多种。所述的溶剂的用量可不作具体限定,只要不影响反应的进行,即可。所述的路易斯酸可为本领域此类反应常规的路易斯酸,优选二氯化铂。所述的路易斯酸的用量可不作具体限定,只要不影响反应进行,即可。所述的聚合反应的温度可为本领域此类反应常规的温度,优选60-110℃。所述的聚合反应的进程可按照本领域常规的检测方法进行监测,所述的聚合反应的时间优选1-24小时。所述的聚合反应优选在空气或气体(例如氮气或惰性气体)保护下进行。
本发明还提供了一种如式(a)所示的二噻吩并
ry、y、ra和rb的定义均同前所述。
优选ry为h。
所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选甲苯、二甲苯和氯仿中的一种或多种。所述的溶剂的用量可不作具体限定,只要不影响反应的进行,即可。所述的紫外光可为本领域常规的紫外光灯产生的紫外光,优选500w紫外高压汞灯产生的紫外光。所述的反应的温度可为本领域此类反应常规的温度,优选0-50℃。所述的反应的进程可按照本领域常规的检测方法进行监测,所述的反应的时间优选0.5-6小时。所述的反应优选在空气或气体(例如氮气或惰性气体)保护下进行。所述的反应还可环氧异丙烷(其用量优选为化合物(a1)的2-10倍当量)的作用下进行。
本发明还提供了一种如式(a)所示的二噻吩并
其中,rx、xa和ya独立地为h、氰基、卤素、取代或未取代的c6-c30的芳基、或取代或未取代的c1-c30的杂芳基;如式(a)所示的二噻吩并
rm为
所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选甲苯、二甲苯、氯苯、二氯苯、四氢呋喃、二氧六环、二甲氧基乙烷、n,n-二甲基甲酰胺和n,n-二甲基乙酰胺中的一种或多种。所述的溶剂的用量可不作具体限定,只要不影响反应的进行,即可。所述的聚合反应的温度可为本领域此类反应常规的温度,优选60℃-150℃。所述的聚合反应的进程可按照本领域常规的检测方法进行监测。所述的聚合反应优选在气体(例如氮气或惰性气体)保护下进行。化合物(a2)和rm-r1-rm的摩尔比优选1:0.98-1.02。所述的聚合反应优选在钯催化剂的作用下进行,所述的钯催化剂优选pd2(dba)3、pd(pph3)4、pdcl2(pph3)2和pd(aco)2中的一种或多种。所述的聚合反应优选在配体的存在下进行,所述的配体优选p(o-tol)3、p(t-bu)3或其他有机磷配体。当所述的聚合反应在钯催化剂和配体的作用下进行时,化合物(a2)和钯催化剂的摩尔比优选1:0.03-0.1;化合物(a2)和配体的摩尔比优选1:0.03-0.1。
rm-r1-rm优选
本发明还提供了一种如式(a)所示的二噻吩并
其中,ry、xa和ya独立地为h、氰基、卤素、取代或未取代的c6-c30的芳基、或取代或未取代的c1-c30的杂芳基;如式(a)所示的二噻吩并
rn为
所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选甲苯、二甲苯、氯苯、二氯苯、四氢呋喃、二氧六环、二甲氧基乙烷、n,n-二甲基甲酰胺和n,n-二甲基乙酰胺中的一种或多种。所述的溶剂的用量可不作具体限定,只要不影响反应的进行,即可。所述的聚合反应的温度可为本领域此类反应常规的温度,优选60℃-150℃。所述的聚合反应的进程可按照本领域常规的检测方法进行监测。所述的聚合反应优选在气体(例如氮气或惰性气体)保护下进行。化合物(a2)和rn-r2-rn的摩尔比优选1:0.98-1.02。所述的聚合反应优选在钯催化剂的作用下进行,所述的钯催化剂优选pd2(dba)3、pd(pph3)4、pdcl2(pph3)2和pd(aco)2中的一种或多种。所述的聚合反应优选在配体的存在下进行,所述的配体优选p(o-tol)3、p(t-bu)3或其他有机磷配体。当所述的聚合反应在钯催化剂和配体的作用下进行时,化合物(a2)和钯催化剂的摩尔比优选1:0.03-0.1;化合物(a2)和配体的摩尔比优选1:0.03-0.1。
rn-r2-rn优选
在本发明一优选实施方式中,所述的化合物a1的制备方法,其包括下列步骤:惰性有机溶剂中,在碱的作用下,将化合物(b10)进行如下所示的反应,制得所述的化合物(a1);
其中,ry、y、ra和rb的定义均同前所述。
所述的化合物(a1)的制备方法中,所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选四氢呋喃、甲醇和氯仿中的一种或多种。所述的溶剂的用量可不作具体限定,只要不影响反应的进行,即可。所述的反应的温度可为本领域此类反应常规的温度优选25-60℃。所述的反应的进程可按照本领域常规的检测方法进行监测所述的反应的时间优选1-24小时。所述的反应优选在空气或气体(例如氮气或惰性气体)保护下进行。
在本发明一优选实施方式中,所述的化合物(b10)的制备方法,其包括下列步骤:惰性有机溶剂中,将化合物(b9)和化合物(b7)进行如下所示的偶联反应,制得所述的化合物(b10);
其中,ry、y、ra和rb的定义均同前所述;rt为
所述的化合物(b10)的制备方法中,所述反应在水和惰性溶剂中进行,惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选四氢呋喃和/或甲苯。所述的溶剂的用量可不作具体限定,只要不影响反应的进行,即可。化合物(b9)和化合物(b7)的用量可为本领域此类反应常规的用量,二者摩尔比优选1:1-1:10,更优选1:2-1:3。所述的反应的温度可为本领域此类反应常规的温度,优选60-110℃(例如100℃)。所述的反应的进程可按照本领域常规的检测方法进行监测,所述的反应的时间优选6-24小时。所述的反应优选在惰性气体(例如氮气或氩气气体)保护下进行。所述反应所用的催化剂优选在钯催化剂的作用下进行,所述的钯催化剂优选pd2(dba)3、pd(pph3)4、pdcl2(pph3)2和pd(aco)2中的一种或多种。所述的反应优选在碱的存在下进行,所述的碱优选碳酸钾、乙酸钾和碳酸铯中的一种或多种。当所述的反应咋碱的存在下进行时,化合物(b9)与碱的摩尔比优选1:1-1:2;当所述的反应在钯催化剂的作用下进行时,化合物(b9)和钯催化剂的摩尔比优选1:0.03-0.1。
本发明中,如式(a)所示的化合物的制备方法中涉及的化学反应和条件还可参照有机合成领域此类反应常规的方法和条件。此外,如式(a)所示的化合物的制备方法还可参照上述相关方法,进一步通过对其外周位置进行修饰而获得本发明的其他如式(a)所示的目标化合物。具体地:
在本发明的一种优选实施方案中,化合物(ai)的制备方法包括下列步骤:惰性有机溶剂中,将化合物(a01)和液溴进行如下所示的反应,制得化合物(ai);
其中ra和rb的定义均如前所述。
化合物(ai)的制备方法中,所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选卤代烃类溶剂和/或芳烃类溶剂,更优选二氯甲烷、三氯甲烷、四氯甲烷和甲苯中的一种或多种。所述的惰性有机溶剂的用量可不作具体限定,只要不影响反应进行即可。
化合物(ai)的制备方法中,化合物(a01)与液溴的用量关系可不作具体限定,只要不影响反应进行,即可,二者的摩尔比优选1:2-1:20。
化合物(ai)的制备方法中,所述反应的温度可为本领域此类反应常规的温度,优选30-60℃。
化合物(ai)的制备方法中,所述反应的进行可按照本领域常规的检测方法进行监测,所述反应的反应时间优选2-24h。
优选地,所述的方法制得粗品产物后,通过硅胶柱层析提纯,展开剂为二氯甲烷、氯仿或二氯甲烷/石油醚或氯仿/石油醚混合液。
在本发明的一种优选实施方案中,化合物(aii)的制备方法包括下列步骤:在惰性有机溶剂中,将化合物(a01)与cucn进行如下所示的反应,得到化合物(aii);
其中ra和rb的定义均如前所述。
化合物(aii)的制备方法中,所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选酰胺类溶剂和/或芳烃类溶剂,更优选甲苯和/或n,n-二甲基甲酰胺。所述的惰性有机溶剂的用量可不作具体限定,只要不影响反应进行,即可。
化合物(aii)的制备方法中,所述的化合物(a01)与cucn的用量关系可不作具体限定,只要不影响反应进行即可,二者摩尔比优选1:2-1:10。
化合物(aii)的制备方法中,所述反应的温度为80-120℃。
化合物(aii)的制备方法中,所述反应的时间为2-24h。
优选地,所述的方法制得粗品产物后,通过硅胶柱层析提纯,展开剂为二氯甲烷、氯仿或二氯甲烷/石油醚或氯仿/石油醚混合液。
在本发明的一种优选实施方案中,化合物(aiii)的制备方法包括下列步骤:在惰性有机溶剂中,在钯催化剂和配体的作用下,将化合物(ai)与cucn进行如下所示的反应,制得化合物(aiii);
其中ra和rb的定义均如前所述。
化合物(aiii)的制备方法中,化合物(aii)的制备方法中,所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选酰胺类溶剂和/或芳烃类溶剂,更优选甲苯和/或n,n-二甲基甲酰胺。所述的惰性有机溶剂的用量可不作具体限定,只要不影响反应进行,即可。
化合物(aiii)的制备方法中,所述的钯催化剂可为本领域此类反应常规的钯催化剂,优选pd2(dba)3。所述的配体可为本领域此类反应常规的配体,优选dppf。所述的化合物(ai)与cucn的摩尔比优选1:2-1:10。所述的化合物(ai)与钯催化剂的摩尔比优选1:0.05-1:0.1。所述的钯催化剂与配体的摩尔比优选0.05:0.1-0.1:0.2。
化合物(aiii)的制备方法中,所述反应的温度优选80-160℃。
化合物(aiii)的制备方法中,所述反应的时间优选8-24h。
化合物(aiii)的制备方法中,所述反应优选在气体(优选氮气或惰性气体)保护的条件下进行。
优选地,所述的方法制得产物后,通过硅胶柱层析提纯,展开剂为二氯甲烷、氯仿或二氯甲烷/石油醚或氯仿/石油醚混合液。
在本发明一优选实施方式中,化合物(aiv)的制备方法,其包括下列步骤:惰性有机溶剂中,将化合物(a01)和rn-r2-rn进行如下所述的聚合反应,制得化合物(aiv);
其中,rx为如式(b)所示的基团;如式(b)所示的基团、r2、ra和rb的定义均同前所述;
rn为
化合物(aiv)的制备方法中,所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选芳烃类溶剂,卤代芳烃类溶剂、醚类溶剂和酰胺类溶剂中的一种或多种,更优选甲苯、氯苯、四氢呋喃和n,n-二甲基甲酰胺中的一种或多种。
化合物(aiv)的制备方法中,所述反应的温度可为本领域常规的温度,优选60℃~150℃。
化合物(aiv)的制备方法中,所述的rn-r2-rn优选
化合物(aiv)的制备方法中,所述反应优选在钯催化剂存在下进行。所述的钯催化剂可为本领域此类反应常规的钯催化剂,优选pd2(dba)3、pd(pph3)4、pdcl2(pph3)2和pd(aco)2中的一种或多种。
化合物(aiv)的制备方法中,所述反应优选在配体存在下进行。所述的配体可为本领域此类反应常规的配体,优选p(o-tol)3和/或p(t-bu)3。
化合物(aiv)的制备方法中,当所述的反应在钯催化剂和配体存在下进行时,所述的化合物(a01)和锡试剂的用量为本领域此类反应的常规用量,二者摩尔比优选1∶0.98~1.02。所述的钯催化剂的用量为本领域此类反应的常规用量,优选为化合物(a01)摩尔量的1%~10%(例如3%)。所述的配体可为本领域此类反应常规的用量,优选为化合物(a01)摩尔量的1%~10%(例如3%)。
化合物(aiv)的制备方法中,所述反应优选在气体(优选氮气或惰性气体)保护的条件下进行。
在本发明一优选实施方案中,化合物(av)的制备方法,其包括下列步骤:惰性有机溶剂中,将化合物(a01)和rm-r1-rm进行如下所述的聚合反应,制得化合物(av);
其中,ry为如式(b)所示的基团;r1、ra和rb的定义均同前所述;
rm为
化合物(av)的制备方法中,所述的惰性有机溶剂可为本领域此类反应常规的惰性有机溶剂,优选芳烃类溶剂,卤代芳烃类溶剂、醚类溶剂和酰胺类溶剂中的一种或多种,更优选甲苯、氯苯、四氢呋喃和n,n-二甲基甲酰胺中的一种或多种。
化合物(av)的制备方法中,所述反应的温度可为本领域常规的温度,优选60℃~150℃。
化合物(av)的制备方法中,所述的rm-r1-rm优选
化合物(av)的制备方法中,所述反应优选在钯催化剂存在下进行。所述的钯催化剂可为本领域此类反应常规的钯催化剂,优选pd2(dba)3、pd(pph3)4、pdcl2(pph3)2和pd(aco)2中的一种或多种。
化合物(av)的制备方法中,所述反应优选在配体存在下进行。所述的配体可为本领域此类反应常规的配体,优选p(o-tol)3和/或p(t-bu)3。
化合物(av)的制备方法中,当所述的反应在钯催化剂和配体存在下进行时,所述的化合物(a01)和锡试剂的用量为本领域此类反应的常规用量,二者摩尔比优选1∶0.98~1.02。所述的钯催化剂的用量为本领域此类反应的常规用量,优选为化合物(a01)摩尔量的1%~10%(例如3%)。所述的配体可为本领域此类反应常规的用量,优选为化合物(a01)摩尔量的1%~10%(例如3%)。
化合物(av)的制备方法中,所述反应优选在气体(优选氮气或惰性气体)保护的条件下进行。
本发明还提供了一种如式(a1)所示的化合物:
ry、y、ra和rb的定义均同前所述。
本发明还提供了如前所述的如式(a)所示的二噻吩并
如本文所用,术语“c1-c48烷基”指具有1-48个碳原子的直链或支链烷基。所述的c1-c48烷基优选c1-c30烷基;更优选c1-c20烷基。本发明中,所述的c1-c20烷基意指包括1-20个碳原子的支链和直链的饱和脂族烃基,优选1-10个碳原子,更优选1-8个碳原子;如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、戊基、己基、庚基、辛基、壬基、癸基、4,4-二甲基戊基、2,2,4-三甲基戊基、十一烷基、十二烷基,及它们的各种异构体等。
如本文所用,术语“c2-c48烯基”是指含有指定数目碳原子和至少一个碳碳双键的直链、支链或者环状非芳香烃基。优选存在一个碳碳双键,并且可以存在高达四个非芳香碳碳双键。由此,“c2-c48烯基”是指具有2-48个碳原子的烯基;包括乙烯基、丙烯基、丁烯基、2-甲基丁烯基和环己烯基。
术语“c3-c24环烷基”指全碳单环或多环基团,其中每个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子体系。优选3-20个碳所形成的1-3个环的环烷基,更优选3-10个碳,例如:环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环癸烷和环十二烷基、环己烯基。
如本文所用,术语“c1-c20的烷氧基”表示通过氧桥连接的具有所述碳原子数目的环状或者非环状烷基。所述的c1-c20的烷氧基优选c1-c10的烷氧基;更优选c1-c4的烷氧基;如甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基或叔丁氧基。
如本文所用,术语“c6-c30的亚芳基”指任何稳定的具有6-30个碳原子的在各环中可高达7个原子的单环、双环或者多环(三环、四环、五环、六环、七环等)失去两个氢原子形成的基团,其中各环中的碳原子均为sp2杂环;如亚苯基、亚萘基、亚四氢萘基、亚2,3-二氢化茚基、亚联苯基、亚菲基、亚蒽基或者亚苊基(acenaphthyl)。术语“c6-c30的亚芳基”中,若环中有sp3杂化的碳原子,其需要通过连接羰
如本文所用,术语“c1-c30的亚杂芳基”指具有1-30个碳原子的各环中可高达7个原子的稳定单环、二环或者多环(三环、四环、五环、六环、七环等)环失去两个氢原子形成的基团,其中至少一个环含有1-4个选自n、o、s和si的杂原子;如亚吡啶基、亚噻吩基,或类似基团。在此定义范围内的亚杂芳基中的杂芳环包括但不限于:吖啶、咔唑、噌啉、咔啉、喹喔啉、咪唑、吡唑、吡咯、吲哚、二氢吲哚、苯并三唑、苯并咪唑、呋喃、噻吩、异噻唑、苯并噻吩、二氢苯并噻吩、苯并呋喃、异苯并呋喃、苯并噁唑、苯并呋咱、苯并吡唑、喹啉、异氮杂茚、异喹啉、噁唑、噁二唑、异噁唑、吲哚、吡嗪、吡啶并吡啶、四唑并吡啶、哒嗪、吡啶、萘嘧啶、嘧啶、吡咯、四唑、噻二唑、噻唑、噻吩、三唑、喹唑啉、四氢喹啉、二氢苯并咪唑、二氢苯并呋喃、二氢苯并噁唑、二氢喹啉。
术语“卤素”指氟、氯、溴、碘。
如本文所用,术语“聚合物”包括二聚物、低聚物和高聚物等所有单体聚合的情况。
如本文所用,术语“均聚”指的是由一种单体进行的聚合反应,如乙二酰已二胺单体进行的聚合。术语“均聚物”指由一种单体聚合而成的聚合物,如聚已二酰已二胺(尼龙66)。特别地,本发明中的聚合(聚合反应)包括加聚(反应)和缩聚(反应)。
如本文所用,术语“共聚”指的是由两种或两种以上的单体进行的聚合反应,如苯酚和甲醛单体进行的聚合。术语“共聚物”指由两种或两种以上的单体聚合而成的聚合物,如酚醛树脂。特别地,本发明中的聚合(聚合反应)包括加聚(反应)和缩聚(反应)。
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明中,室温是指10-40℃。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明的基于1,2,5,6-萘酰亚胺(1,2,5,6-ndi)的新型π分子骨架二噻吩并[3,2-a:3’,2’-j][5,6,11,12]
附图说明
图1为化合物1a、2a、3a在二氯甲烷中的紫外吸收光谱和荧光发射光谱图。
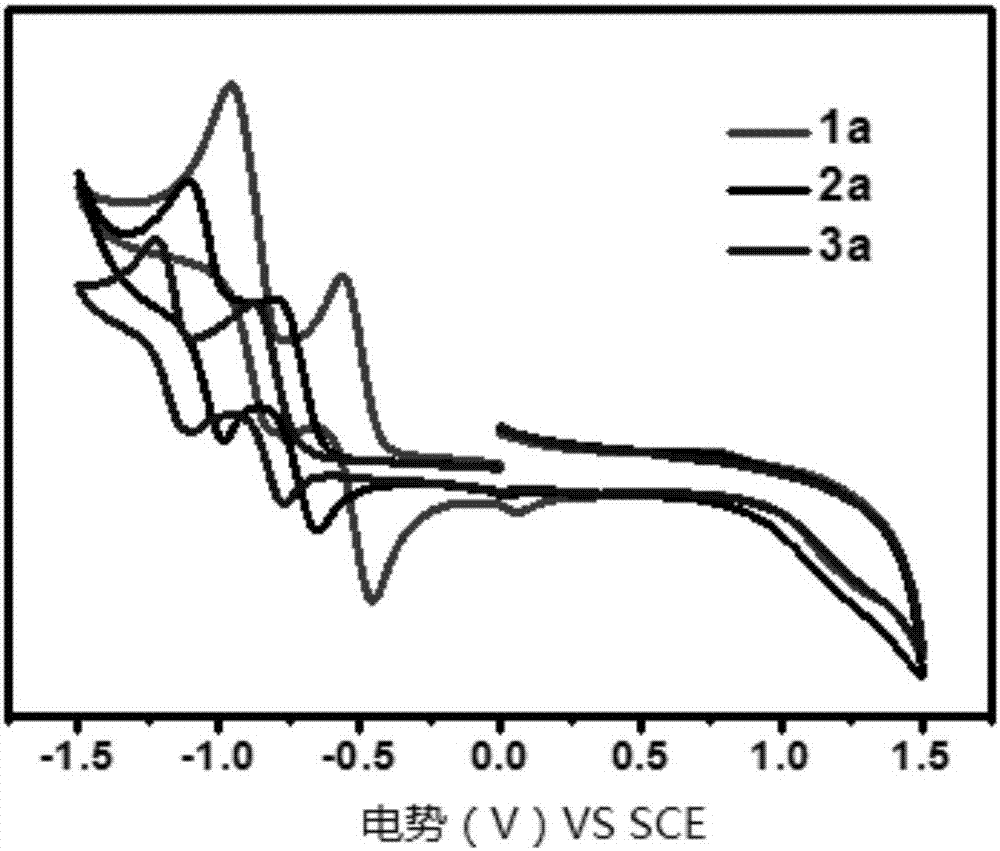
图2为化合物1a、2a、3a在二氯甲烷中的循环伏安曲线图。
图3为化合物3a的ofet器件的输出曲线图。
图4为化合物3a的ofet器件的转移曲线图。
图5为聚合物p1在二氯甲烷溶液和薄膜的吸收光谱图。
图6为聚合物p1在二氯甲烷中的循环伏安曲线图。
图7为聚合物p2在氯苯溶液和薄膜下的吸收光谱图。
图8为聚合物p2薄膜的循环伏安曲线图。
图9为聚合物p1的ofet器件的输出曲线图。
图10为聚合物p1的ofet器件的转移曲线图。
图11为聚合物p2的转移曲线图。
图12为聚合物p2的转移曲线图。
图13为ofet器件的结构示意图。
图3、图4、图9-12中“vds(v)”、“vd(v)”为“源漏电压(伏特)”、“ids(μa)”为“源漏电流(微安)”、“id(a)”为“源漏电流(安)”、“ids1/2(μa1/2)”为“源漏电流(微安)平方根”、“id1/2(a1/2)”为“源漏电流(安)平方根”、“vgs(v)”为“栅极电压(伏特)”。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
下述实施例中,具体操作中未提及温度的,均在室温(10℃-40℃)条件下进行。mn为数均分子量。
实施例1
取原料1a1(80mg,0.07mmol)和二氯化铂(40mg,0.14mmol)于100ml三口烧瓶中,真空脱气30min,氮气保护下加入10ml无水甲苯,100℃下反应2h,冷却至室温,除去反应溶剂,加入30ml二氯甲烷,用(3×50ml)水洗涤,无水硫酸镁干燥,过滤后减压除去二氯甲烷,以石油醚/二氯甲烷=2:1柱层析得红色固体1a20mg,产率25%,mp:28-30℃。
核磁共振氢谱:1hnmr(400mhz,cdcl3)9.23-9.25(d,j=5.6hz,2h),8.61-8.64(d,j=9.0hz,2h),8.19(d,j=9.0hz,2h),7.75-7.76(d,j=5.6hz,2h),3.66-3.68(d,j=7.1hz,4h),1.95(br,2h),1.22(m,80h),0.85(m,12h).核磁共振碳谱13cnmr(100mhz,cdcl3)δ(ppm)168.4,168.3,142.4,133.7,130.5,130.4,129.6,129.0,127.3,126.8,126.6,123.6,122.5,43.2,37.2,32.0,31.7,30.2,29.8,29.5,26.5,22.8,14.3.高分辨质谱hrms(maldi-ft)calcdfor(计算值)[c74h106n2o4s2]+1150.7589,实测found:1150.7606(m)+.
实施例2
将原料6a6(100mg,0.086mmol)、i2(108mg,0.43mmol)和环氧丙烷(0.06ml,0.86mmol)溶于60ml甲苯中,光照条件下(紫外光照)反应3h,减压除去溶剂甲苯,粗产品经硅胶柱(300-400目)层析(石油醚:二氯甲烷=3:1)得到红色固体6a(87mg,72%);mp:120-123℃.
核磁共振氢谱1hnmr(400mhz,cdcl3)δ(ppm)9.40-9.42(d,j=5.5hz,2h),9.02(s,2h),7.80-7.81(d,j=5.5hz,2h),3.63-3.64(d,j=7.0hz,4h),1.84(br,2h),1.20(br,80h),0.85-0.86(m,12h).核磁共振碳谱13cnmr(100mhz,cdcl3)δ167.6,167.5,148.7,135.8,132.5,131.1,130.1,128.2,127.3,127.0,121.9,90.3,43.5,37.2,32.1,32.0,31.7,30.2,29.8,29.5,26.5,22.8,14.2.高分辨质谱hrms(maldi-ft)计算值calcdfor[c74h105o4n2i2s2]+1403.5600,实测found:1403.5639(m+1)+.元素分析anal.calcd.forc74h104o4n2i2s2:c63.32;h7.47;n2.00.found:c63.33;h7.46;n1.99.
实施例3
氮气条件下将化合物6a(100mg,0.07mmol)及cucn(25mg,0.28mmol)加入无水dmf(20ml)中。160℃下反应10h,待反应冷却至室温,加入30ml氨水。分离有机相,减压除去溶剂,粗产品经硅胶柱(300-400目)层析(石油醚:二氯甲烷=2:1)得红色固体2a产率60%。mp:113-114℃.
核磁共振氢谱1hnmr(400mhz,cdcl3)δ9.35-9.36(d,j=5.6hz,2h),9.14(s,2h),7.91-7.93(d,j=5.6hz,2h),3.765-3.76(d,j=6.8hz,4h),1.99(br,2h),1.27(br,80h),0.85-0.87(m,12h).核磁共振碳谱13cnmr(100mhz,cdcl3)δ167.6,167.5,142.7,134.8,132.2,130.8,130.0,129.6,129.4,128.6,124.6,116.8,108.1,43.6,37.3,32.0,31.8,30.2,29.8,29.5,26.5,22.8,14.2.质谱ms(maldi-tof)m/z:1201.8(m+h)+.元素分析anal.calcd.for[c76h104o4n4i2s2]:c75.95;h8.72;n4.66.实测found:c75.94;h8.80;n4.66.
实施例4
将化合物6a(188mg,0.134mmol)溶于30ml二氯甲烷溶液中,冰水浴下将液溴通过恒压滴液漏斗缓慢加入反应液中。室温下搅拌10h,加入nahco3水溶液(25ml)中和反应,分离有机相,减压除去溶剂,粗产品通过硅胶(300-400目)柱层析(石油醚:二氯甲烷=2:1),得红色固体7a(144mg,69%)。mp:152-153℃。
核磁共振氢谱1hnmr(400mhz,cdcl3)δ9.10(s,2h),8.69(s,2h),4.43-4.42(d,j=8hz,4h),3.00(br,2h),2.42(br,80h),2.13-2.14(m,12h).核磁共振碳谱13cnmr(100mhz,cdcl3)δ167.2,166.9,149.9,135.4,133.8,132.5,129.7,127.9,127.1,120.6,116.9,88.4,43.7,37.0,32.1,32.0,31.6,30.1,29.8,29.5,26.4,22.8,14.3.质谱ms(maldi-tof)m/z:1559.5(m+h)+.元素分析anal.calcd.for[c74h102o4n2br2i2s2]:c56.93;h6.58;n1.79.实测found:c57.33;h6.61;n1.77.
实施例5
氮气保护下将化合物7a(40mg,0.027mmol)、cucn(15mg,0.154mmol),pd2(dba)3(2.5mg,10%mmol)和1,1'-双二苯基磷二茂铁(3.0mg,20%mmol)加入20ml甲苯溶剂中。120℃下反应16h,冷却至室温加入20ml氨水。减压下除去溶剂。粗产品通过硅胶(300-400目)柱层析(石油醚:二氯甲烷=1:1),得红色固体3a(21mg,64%)。mp:218-219℃。
核磁共振氢谱1hnmr(400mhz,cdcl3)δ10.04(s,2h),9.33(s,2h),3.79-3.81(d,j=7.2hz,4h),1.98(br,2h),1.25-1.27(br,80h),0.85-0.86(m,24h).核磁共振碳谱13cnmr(100mhz,cdcl3)δ167.2,167.0,144.7,140.3,135.5,132.8,130.8,130.5,130.2,129.9,125.3,115.6,113.4,112.3,107.8,44.0,37.3,32.0,31.7,30.2,29.8,29.5,26.4,22.8,14.2.质谱ms(maldi-tof)m/z:1251.8(m+h)+.元素分析anal.calcd.for[c78h102n6o4s2]:c74.84;h8.21;n6.71.实测found:c74.72;h8.40;n6.95.
实施例6
取原料6a(192.7mg,0.137mmol),2,2’-联二噻吩的双三甲基锡试剂(66.5mg,0.134mmol),pd2(dba)3(3mg),p(o-tol)3(4mg)真空脱气30min,加入20ml无水甲苯,110℃反应36h,溶液变粘稠状,加入1ml稀释盐酸终止反应,将反应液滴入200ml甲醇中,过滤,索氏提取器提取,二氯甲烷相得到灰黑色聚合物p1140mg,产率78%。mn:24305,pdi:1.64.元素分析anal.calcd.for[c82h110n2o4s4]:c74.84%,h8.43%,n2.13%;实测c74.51%,h8.50%,n1.76%.p1中,数均分子量mn为24305;pdi为1.64。
实施例7
取原料8a(107mg,0.081mmol),2,2’-联二噻吩的双三甲基锡试剂(40mg,0.081mmol),pd2(dba)3(3mg),p(o-tol)3(4mg)真空脱气30min,加入5ml无水甲苯,110℃反应10min,溶液变粘稠状,加入1ml稀释盐酸终止反应,将反应液滴入200ml甲醇中,过滤,索氏提取器提取,二氯苯相得到灰黑色聚合物p286mg,产率78%。mn:65775,pdi:3.13。元素分析anal.calcd.for[c82h110n2o4s4]:c74.84%,h8.43%,n2.13%;实测c74.11%,h8.13%,n1.96%.p2中,数均分子量mn为65775,pdi为3.13。
实施例8
取原料1a(130mg,0.11mmol)于100ml圆底烧瓶中,加入20ml二氯甲烷,冰水浴下搅拌至全部溶解,缓慢滴加液溴,升温至40℃反应3小时,加入亚硫酸钠水溶液萃取,柱层析得到红色固体8a(118mg,产率82%)核磁共振氢谱1hnmr(400mhz,cdcl3)δ9.25(s,2h),8.54-8.57(d,j=8.8,2h),7.97-7.99(d,j=8.8,2h)3.64-3.66(d,j=7.2hz,4h),1.94(br,2h),1.22-1.26(br,80h),0.85-0.86(m,24h).核磁共振碳谱13cnmr(100mhz,cdcl3)δ167.96,167.92,143.51,133.54,131.56,130.24,129.49,127.40,126.75,122.12,121.25,115.81,43.14,37.09,31.96,31.95,31.58,30.11,29.71,29.69,29.39,26.35,22.72,14.15.
实施例9
取化合物b91(325mg,0.29mmol),化合物b71(264mg,0.86mmol)和四三苯基膦钯(20mg5%)于100mlschlenk中,真空脱气30min,加入thf10ml,乙酸钾水溶液5ml,氮气鼓泡30min,加热至100℃反应10小时.冷却至室温,除去反应溶剂,加入30ml二氯甲烷,用(3×50ml)水洗涤,无水硫酸镁干燥,过滤后减压除去二氯甲烷,以石油醚/二氯甲烷=3:1,柱层析得黄色固体165mg,产率44%。1hnmr(400mhz,cdcl3)δ9.67(s,2h),7.33(d,j=5.2hz,2h),7.29(d,j=5.2hz,2h),3.58(d,j=7.2hz,4h),1.90(s,2h),1.23(m,80h),0.87(m,12h),0.09(s,18h).13cnmr(100mhz,cdcl3)δ168.88,167.88,140.40,134.07,132.31,130.68,129.97,128.56,125.70,122.59,102.29,97.05,77.42,76.94,42.93,37.43,32.16,31.83,30.27,29.88,29.59,26.64,22.93,14.35,-0.08.hr-ms(maldi/dhb)caledforc80h122n2o4s2si21294.8385,found:1295.8504(m+1)+。
实施例10
取化合物b101(400mg,0.31mmol)和碳酸钾(254mg,1.86mmol)于100ml圆底烧瓶,加入20ml四氢呋喃,10ml甲醇室温下反应30min,减压除去反应溶剂,以石油醚/二氯甲烷=2:1柱层析得黄色固体260mg,产率73%.1hnmr(400mhz,cdcl3)δ9.59(s,2h),7.38(d,j=5.2hz,2h),7.28(d,j=5.2hz,2h),3.61(d,j=7.2hz,4h),3.29(s,2h),1.90(s,2h),1.26(m,80h),0.87(m,12h).13cnmr(100mhz,cdcl3)δ168.96,167.76,140.97,133.75,132.18,130.73,130.19,129.61,128.73,126.34,121.48,84.28,77.58,77.26,76.94,76.58,42.82,37.38,32.15,31.78,30.26,29.87,29.57,26.59,22.91,14.34.hr-ms(maldi/dhb)calcdforc74h106n2o4s21150.7594,found:1151.7711(m+1)+.
紫外吸收光谱和电化学性质
紫外吸收光谱在u-3900光谱仪上进行,小分子样品及聚合物p1在二氯甲烷溶液中测定(摩尔浓度为1×10-6m),聚合物p2在薄膜状态下的乙腈溶液中测定扫描范围为800-200nm,化合物的光学带隙由以下公式计算得到:
egapopt=1240nm/λonset(1)
循环伏安法测试在计算机控制的chi610d电化学分析仪上进行,采用传统的三电极测试体系,铂电极为工作电极,饱和甘汞电极(sce)作为参比电极,铂丝作为对电极,样品溶于新蒸的二氯甲烷(摩尔浓度为1×10-3m),bu4npf6(0.1m)作为支持电解质,扫描速度为50mv/s,以饱和甘汞为参比,饱和甘汞能级相对于真空能级的为-5.1ev,材料的lumo能级可以由以下能级的公式计算得到:
elumo=-(eonset,red-e1/2(fc/fc+)+5.1)(ev)(2)
胺烷基链大小对溶液吸收和电化学性质影响不大,因此我们测试了2-癸基十四烷基链取代的衍生物在二氯甲烷中以及薄膜状态下的吸收。化合物1a在二氯甲烷溶液中的最大吸收为484nm,薄膜态下最大吸收红移5nm,由溶液中的边际吸收测得化合物1a的能隙为2.26ev;化合物2a在二氯甲烷溶液中的最大吸收478nm,薄膜态下的最大吸收红移了39nm,由溶液中的边际吸收测得化合物2a的能隙为2.31ev;化合物3a在二氯甲烷溶液中的最大吸收461nm,薄膜态下最大吸收红移了41nm,由溶液中的边际吸收测得化合物3a的能隙为2.41ev。
聚合物p1在二氯甲烷中得最大吸收为608nm,薄膜中的最大吸收较溶液中红移了16nm,由边际吸收计算的能隙为1.77ev;聚合物p2在溶液及薄膜中的最大吸收为均639nm,有边际吸收计算的能隙为1.6ev。
图1为化合物1a、2a、3a在二氯甲烷中的紫外吸收光谱和荧光发射光谱图。由图可以看出,随着氰化数目的增加吸收明显蓝移,两个氰基取代最大吸收蓝移值为6nm,四个氰基取代最大吸收蓝移29nm,说明随着氰基数的增加化合物的能隙减小。
图2为化合物1a、2a、3a在二氯甲烷中的循环伏安曲线图。由图可以看出,化合物1a,2a,3a在负相均显示了两组半可逆氧化还原峰,随着氰基数的增加,第一氧化还原峰向负相移动,说明增加氰基可以降低lumo能级,表现为更强的化学稳定性。
图3为化合物3a的ofet器件的输出曲线图。
图4为化合物3a的ofet器件的转移曲线图。
图5为聚合物p1在二氯甲烷溶液和薄膜的吸收光谱图。由图可以看出聚合物p1在350-700nm之间均具有较好的吸收强度,显示了很好的吸光性,且在薄膜状态下,聚合物的吸收显示出了略微的红移,说明聚合物在薄膜态中呈现有序堆积的形式。
图6为聚合物p1在二氯甲烷中的循环伏安曲线图。由图可以看出聚合物p1在负相呈现两组不可逆氧化还原峰,显示了聚合物具有一定的得电子能力,具有成为电子传输型场效应晶体管活性层的潜质。
图7为聚合物p2在氯苯溶液和薄膜下的吸收光谱图。图7中,p2-sol是指聚合物p2在氯苯溶液中,p2-film是指聚合物p2在薄膜下。由图可以看出,聚合物p2在溶液态下的最大吸收峰为650nm,且在薄膜态时吸收并未红移,说明聚合物p2在薄膜态下呈现无序的堆积形式。
图8为聚合物p2薄膜的循环伏安曲线图。由图可以看出聚合物p2在负相呈现两组不可逆氧化还原峰,显示了聚合物具有一定的得电子能力,具有成为电子传输型场效应晶体管活性层的潜质。
以二茂铁为内标通过第一氧化还原起始电位可以计算出化合物1a,2a,3a的lumo能级分别为-4.02ev,-4.32ev,-4.54ev。
化合物1a,2a,3a和聚合物p1,p2作为半导体活性层制备有机薄膜场效应晶体管
ofet器件的制备方法为:将化合物1a或2a或3a或聚合物p1配制成5-20mg/ml的氯仿溶液或者将聚合物p2配成5-20mg/ml的氯苯溶液,在ots修饰的sio2/si基底上(高掺杂的硅衬底作为栅极,热氧化二氧化硅绝缘层的厚度为450nm,电容为10nfcm-2)甩上一层约20-100nm厚度的有机半导体薄膜,在有机薄膜的上面利用掩模板真空蒸镀金或银源漏电极,从而制得底栅顶接触结构的ofet器件,器件的半导体沟道长度为31μm,沟道宽度为273μm。ofet的电性能用keithley4200半导体测试仪在氮气手套箱中室温下测到。其中,化合物3a的ofet器件采用金源漏电极,其薄膜采用氮气手套箱中160℃下退火;聚合物p1采用金作为源漏电极,采用氮气手套箱中200℃退火。实验结果见表1和2,以及图9-13。
图9为聚合物p1的ofet器件的输出曲线图。
图10为聚合物p1的ofet器件的转移曲线图。
图11为聚合物p2的转移曲线图。
图12为聚合物p2的转移曲线图。
图13为ofet器件的结构示意图。
表1化合物2a、3a的ofet器件的电性能表征数据
表2聚合物p1的ofet器件的电性能表征数据
- 还没有人留言评论。精彩留言会获得点赞!