影响水稻开花期和粒型的烯醇化酶基因OsENO2‑2及其应用的制作方法
本发明属于植物基因工程领域。具体涉及影响水稻开花期和粒型的烯醇化酶基因OsENO2-2的分离克隆、功能验证和应用。
背景技术:
水稻作为重要的粮食作物一直被人们所重视。开花期作为重要的农艺性状与产量有着密切的联系,很多开花期调控基因直接或间接地影响水稻株高、穗数、一次枝梗数及二次枝梗数等农艺性状。因为较长的生育期往往伴随着更高的株高和更多的分蘖,所以在作物产量的研究中,经常把长生育期和高产联系在一起。
开花时间的调控是水稻产量的一个关键影响因素,其中日照长短是影响水稻开花的一个重要因素。大部分的水稻品种都是以光照时间13.5小时/黑暗条件下10.5h为长短日照的临界日照长度,日照长度少于13.5小时则属于短日照,短日照能够促进水稻开花(Florigen in rice:complex gene network for florigen transcription,florigen activation complex,and multiple functions.Current opinion inplant biology,2013)。Heading date1(Hd1)是水稻中与拟南芥的CONSTANS(CO)同源的基因,它在调控水稻开花的过程中有着双重作用,在短日照条件下促进开花而在长日照条件下抑制水稻开花(Hd1,a major photoperiod sensitivity quantitative trait locus in rice,is closely related to the Arabidopsis flowering time gene CONSTANS.The Plant cell,2000)。Heading date 3a(Hd3a)是水稻中与拟南芥基因FLOWERING LOCUS T(FT)同源的基因(Hd3a protein is a mobileflowering signal in rice.Science,2007)。Hd1在短日照条件下促进Hd3a的表达,但是在长日照条件下,Hd1是由光敏色素B转换为Hd3a的阻抑物(The molecular basis of diversity in the photoperiodic flowering responses of Arabidopsis and rice.Plant physiology,2004)。同时Hd1的表达受到Oryza sativa GIGANTEA(OsGI)的调控,后者是水稻开花节律钟中的关键基因(Adaptation of photoperiodic control pathways produces short-day flowering in rice.Nature,2003)。另外一方面,水稻中存在不依赖Hd1的光诱导途径。Early heading date1(Ehd1)是受短日照促进开花因子OsMADS51促进表达的一个B型反应调节子,它可以促进Hd3a、RFT1(另外一个水稻中的FT同源基因)和OsMADS14的表达,主要是短日照开花调控的正调控因子(OsMADS51is a short-day flowering promoter that functions upstream of Ehd1,OsMADS14,and Hd3a.Plant physiology,2007)。而在长日照条件下Ehd1则被Ehd2/OsId1/RID1(Rice Indeterminate1)以及OsMADS50正调控,被Ghd7(Grain number,plant height and heading date7)负调控(Florigen in rice:complex gene network for florigen transcription,florigen activation complex,and multiple functions.Current opinion in plant biology,2013),Ehd1促进Hd3a和RFT1的表达,从而促进MADS14和MADS15的表达,进而促进水稻开花(A gene network for long-day flowering activates RFT1encoding a mobile flowering signal in rice.Development,2009)。Ehd1和Ghd7的表达可以通过对日照时间的微调控来调控Hd3a和RFT1的转录(Florigen in rice:complex gene network for florigen transcription,florigen activation complex,and multiple functions.Current opinion in plant biology,2013)。总的来说,水稻光周期调控的主要路径目前研究得比较清楚,但是其中一些关键基因的调控机制研究目前并不完善。
水稻种子的胚乳占精米的90%以上,是水稻直接被食用的部分,也是水稻籽粒大小的决定性因素,胚乳的发育直接影响着水稻的产量和品质。所以研究与水稻胚乳发育相关的基因在实际生产上也有很重要的意义。
目前的研究发现水稻淀粉合成的主要场所是淀粉体和叶绿体,光合作用提供其合成原料。水稻籽粒中淀粉的生物合成是一个非常复杂的生物化学过程。叶片光合作用后的产物首先以蔗糖的形式运输到淀粉合成的主要器官胚乳细胞,转化为1-磷酸葡萄糖(G-1-P)后进入造粉体体内,分别在ADP-葡萄糖焦磷酸化酶、淀粉合成酶、淀粉分支酶、淀粉脱支酶的作用下形成直链淀粉和支链淀粉(Progress in Key Enzymes of Starch Synthesis in Rice.Chinese Agricultural Science Bulletin,2009)。ADP-葡萄糖焦磷酸化酶(AGPase)是淀粉合成途径中很重要的酶,超表达或者反义抑制此酶会分别使淀粉的含量增加或者减少(One of two different ADP-glucose Pyrophosphorylase Genes from Potato responds strongly to elevated levels of sucrose.Molecular Genetic Genet,1990)。水稻中含有两个编码AGPase大亚基的基因和4个编码AGPase小亚基基因,这些基因在淀粉合成的不同时期发挥着作用。淀粉合成酶分为两种,分别是游离于造粉体基质中的可溶性淀粉合成酶(SSS)和与淀粉结合存在的结合态淀粉合成酶(GBSS)。水稻中总共有5种淀粉合成酶,分别是GBSS、SSSⅠ、SSSⅡ、SSSⅢ和SSSⅣ。研究发现结合态的淀粉合成酶主要负责直链淀粉的合成。例如,Wx基因编码的GBSSⅠ是调控直链淀粉合成的关键(水稻蜡质基因分子特性的研究.植物生理学报,1991)。除此之外,淀粉分支酶和脱支酶也会影响淀粉的发育(Progress in Key Enzymes of Starch Synthesis in Rice.Chinese Agricultural Science Bulletin,2009)。总之,淀粉的合成过程受到多种酶的调控。
水稻中烯醇化酶基因OsENO2-2目前为止还未见有相关研究报道。
技术实现要素:
为了解决现有技术中存在的问题,本研究组通过对水稻中烯醇化酶基因OsENO2-2的克隆以及相关功能研究,发现该基因对水稻开花时间有调控作用,并且对水稻种子的大小也有调控作用,揭示了该基因在水稻产量方面具有一定的研究和应用价值。
本发明的第一方面,提供一种影响水稻开花期和粒型的烯醇化酶基因OsENO2-2,该基因的cDNA的核苷酸序列如SEQ ID NO.1所示。
应理解,考虑到密码子的简并性以及不同物种密码子的偏爱性,本领域技术人员可以根据需要使用适合特定物种表达的密码子而得到基因OsENO2-2的cDNA的核苷酸序列。
进一步地,本发明提供一种包括上述cDNA多核苷酸的正义序列或反义序列或其片段的克隆载体或表达载体、含有所述载体的宿主细胞、含有所述核苷酸序列或其片段的转化的植物细胞和转基因植物。
本发明的第二方面,提供基因OsENO2-2在水稻选育中的应用,所述水稻选育为长日照条件下延长水稻开花时间、增加水稻粒型,从而提高产量。
本发明的第三方面,提供一种影响水稻开花期和粒型的烯醇化酶基因OsENO2-2转基因植株的检测试剂盒,通过实时荧光定量PCR,以待检转基因水稻cDNA为模板,利用所述引物对扩增,检测OsENO2-2基因的表达量,所述引物对为:
OsENO2-2-QF:5’-GGCCAAGATGCCACAAATGT-3’(SEQ ID NO.2)
OsENO2-2-QR:5’-TTGCCTGTGTAGCCAGCCTTA-3’(SEQ ID NO.3)
Actin-QF:5’-TGTATGCCAGTGGTCGTACCA-3’(SEQ ID NO.4)
Actin-QR:5’-CCAGCAAGGTCGAGACGAA-3’(SEQ ID NO.5)
若转基因植株OsENO2-2基因的表达量与对照中花11相比显著升高,则说明是转基因阳性植株。
实现本发明的技术如下:
申请人克隆得到水稻烯醇化酶基因OsENO2-2,其cDNA的核苷酸序列如SEQ NO:1所示。将该基因的完整编码序列(Coding sequence)构建到超表达载体PU1301(见图1),获得转化载体pU1301-OsENO2-2后直接转入水稻,转基因植株在长日照条件下开花时间推迟(见图2),种子变大(见图3)。在转基因植株中检测开花相关基因发现,转基因植株中部分开花相关基因表达量较野生型变化显著(见图4),同时检测转基因植株胚乳中淀粉合成相关基因也发现较野生型有显著变化(见图5)。表明本发明的烯醇化酶基因OsENO2-2可以通过调控水稻开花相关基因以及淀粉合成相关基因来调控水稻开花时期和水稻种子的大小。
本发明通过研究水稻烯醇化酶基因OsENO2-2的超表达植株具有开花时间推迟、种子变大的表型,进而阐明此基因对水稻开花时间以及淀粉发育的影响。这对水稻产量和品质的研究有着重要的指导意义,为水稻品质改良和新品种的选育提供新的方法。
附图说明
图1为本发明构建的超量表达载体PU1301示意图;
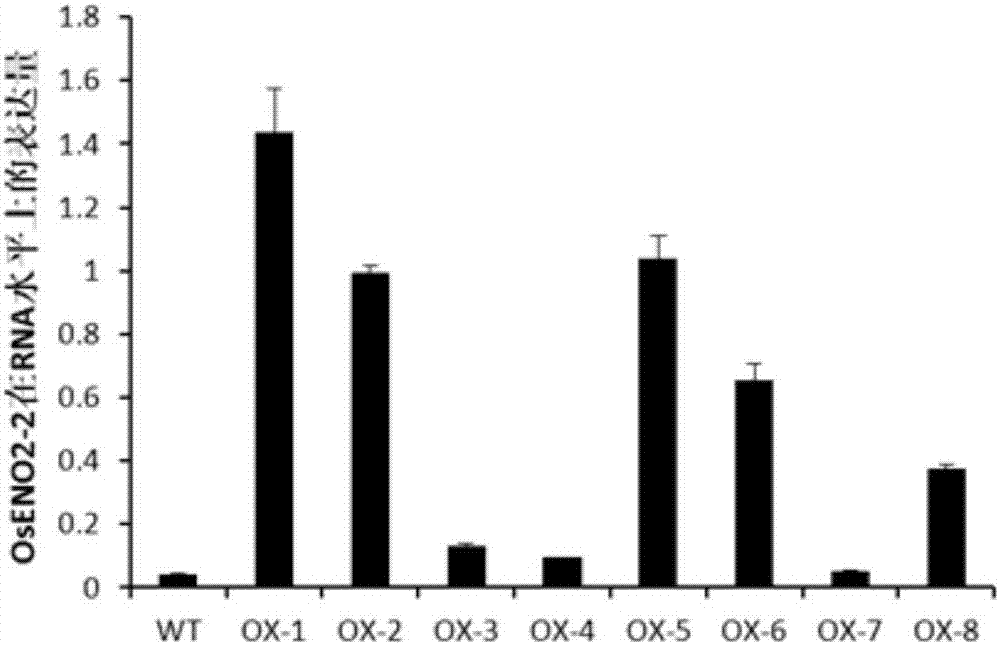
图2为OsENO2-2基因在超表达转基因植株中的表达量检测图,
WT为中花11阴性对照,OX-1,OX-2,OX-3,OX-4,OX-5,OX-6,OX-8为转基因阳性植株,OX-7为转基因阴性植株;
图3为OsENO2-2基因超表达转基因植株与野生型植株的开花时间表型及统计学分析示意图,
WT代表阴性对照;OX代表抑制转基因阳性植株;**代表P-Value值小于0.01;
图4为转基因植株与野生型植株及获得性突变体在持续光照14小时的条件下生长35天后检测开花相关基因的表达,
WT代表阴性对照;OX代表抑制转基因阳性植株;
图4A表示RFT1在两种材料中的表达量;图4B表示RID1在两种材料中的表达量;图4C表示Hd1在两种材料中的表达量;图4D表示Hd3a在两种材料中的表达量;图4E表示Ehd1在两种材料中的表达量;图4F表示OsGI在两种材料中的表达量;图4G表示Ghd7在两种材料中的表达量;
图5为OsENO2-2基因超表达转基因植株与野生型植株种子形态,
WT代表阴性对照;OX代表超表达转基因阳性植株;
图6为OsENO2-2超表达转基因植株与野生型植株胚乳中淀粉合成相关基因表达量检测,
WT代表阴性对照;OX代表抑制转基因阳性植株。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。若未特别指明,下述实施例所用的技术手段为本领域技术人员所熟知的常规手段;所用的实验方法均为常规方法,并可按照已描述的重组技术(参见J.萨姆布鲁克,EF弗里奇,T曼尼阿蒂斯著,黄培堂,王嘉玺等译,分子克隆实验指南(第三版),北京,科学出版社,2002版)完成;所用的材料、试剂等,均可从商业途径得到。
【实施例1】OsENO2-2基因全长cDNA的扩增
对本发明所需要的基因OsENO2-2(基因登录号LOC_Os06g04510.2),主要通过RT-PCR方法(参见:J.萨姆布鲁克,EF弗里奇,T曼尼阿蒂斯著,黄培堂,王嘉玺等译,分子克隆实验指南(第三版),北京,科学出版社,2002版)进行扩增,得到OsENO2-2基因全长序列。具体操作如下:
1)抽提来自水稻品种中花11的幼苗叶片的RNA,RNA抽提用试剂是Invitrogen公司的Trizol抽提试剂盒(具体操作步骤见该试剂盒的说明书);
2)RT-PCR中反转录合成cDNA第一链的步骤如下:
①配制混合液1:总RNA 4μg,DNaseI 2U,10×DNaseI buffer 1μl,加DEPC(焦碳酸二乙酯,RNA酶的强烈抑制剂)处理水(0.01%DEPC)到10μl,混匀后将混合液1在37℃放置20分钟以除去DNA;
②20分钟后将混合液1置于65℃水浴中温浴10分钟以去除DNAse I活性,然后置于冰上5分钟;
③向混合液1中加入1μl 500μg/ml的oligo(dT);
④将在冰上冷却的混合液1立即置于65℃水浴中温浴10分钟,以彻底使RNA变性,然后置于冰上5分钟;
⑤配制混合液2:混合液1 10μl,5×first strand buffer 4μl,0.1M DTT(巯基乙醇)2μl,10mM dNTP mixture 1.5μl,DEPC处理水0.5μl,反转录酶2μl,混匀后将混合液2置于42℃水浴锅内温浴1.5小时;
⑥反应结束后将混合液2置于90℃干浴3分钟;
⑦-20℃保存反应最终产物。
上述反应中用到的试剂全部购自Invitrogen公司。
3)然后根据RGAP数据库(http://rice.plantbiology.msu.edu/)公布的OsENO2-2基因的全长cDNA序列,设计引物PCR扩增片段。PCR用到的体系为20μl,具体配法为:cDNA第一链模板1μl,10×PCR buffer 2μl,10mM dNTP 1.6μl,2.5mM Mg2+1.5μl,正向引物和反向引物各0.4μl,LATaq酶0.2μl,加水至20μl(所用到的PCR buffer、dNTP、Mg2+、LATaq酶等均购自宝生物工程大连有限公司)。PCR反应条件如下:①94℃4分钟,②94℃30秒,③60℃30秒,④72℃60秒,⑤从②-④循环35次,⑥72℃7分钟,⑦4℃保存。扩增出全长序列。
用来克隆OsENO2-2全长的引物如下所示:
OsENO2-2-F(正向引物):
5’---GGGGGTACCATGGTTCAACAGCTTGATGGAA---3’
OsENO2-2-R(反向引物):
5’---GGGGGTACCTTAGTACGGCTCCACAGGGG---3’
4)将扩增出的全长连接到T/A克隆载体pGEMT-vector(购自普洛麦格(北京)生物技术有限公司,即美国Promega公司)上用T7和SP6引物测序验证。最终得到的OsENO2-2基因的全长cDNA序列如序列表SEQ ID NO:1中第1-1062位所示。
【实施例2】超表达载体PU1301-OsENO2-2的构建
具体步骤如下:
1)将带有OsENO2-2片段(如序列表SEQ ID NO:1中第1-1062位所示)的T/A克隆用KpnI单酶切,回收目标条带,与KpnI单酶切的表达载体质粒PU1301(见图1)连接,pU1301是在国际上常用的植物遗传转化载体pCAMBIA1301(Sun等,2004,Xa26,a gene conferring resistance to Xanthomonas oryzae pv.oryzae in rice,encoding a LRR receptor kinase-like protein.Plant Journal.37:517-527)基础上改造的,是携带具有组成型和超量表达特征的玉米泛素启动子的农杆菌介导的遗传转化载体。pCAMBIA1301载体由澳大利亚CAMBIA实验室(Center for the Application of Molecular Biology to International Agriculture)惠赠。内切酶KpnI和连接所使用的T4连接酶均购自宝生物工程大连有限公司,用法及用量按照该公司提供的产品说明书。
2)连接产物通过电转化的方法(电转化仪为eppendorf公司产品,所用电压为1800v,操作方法见仪器说明书)导入大肠杆菌DH10B(购自普洛麦格(北京)生物技术有限公司,即美国Promega公司),在含有250ppm卡那霉素(购自罗氏生物公司产品)的LA(LA配方参见J.萨姆布鲁克,EF弗里奇,T曼尼阿蒂斯著,黄培堂,王嘉玺等译,分子克隆实验指南(第三版),科学出版社,2002版)LA抗性培养基上涂皿培养。
3)将LA抗性培养基上长出的单菌落在超净工作台接种于灭菌的10ml离心管,管内预先加入3ml含250ppm卡那霉素的LB抗性培养基,然后在37℃摇床上培养16-18小时。按照(《分子克隆实验指南》,J.萨姆布鲁克和D.W.拉塞尔著,黄培堂等译,科学出版社,2002)所述的方法抽提质粒,用KpnI单酶切和PCR检测,根据插入片段的大小获得阳性的超表达质粒载体将其命名为PU1301-OsENO2-2。
4)把步骤3)的超表达载体PU1301-OsENO2-2通过电转化的方法(参考文献和使用的电压参数按照本实施例步骤2)的方法进行)导入农杆菌EHA105(购自澳大利亚CAMBIA实验室)菌株中,将转化后的菌株命名为T-OsENO2-2。
【实施例3】双元Ti质粒载体的转化及转基因植株阳性和表达量检测:
具体步骤如下:
1)将T-OsENO2-2向水稻受体品种“中花11”(中国农业科学院作物科学研究所)转化,转化方法参照Hiei等人报道的方法(Hiei等,Efficient transformation of rice(Oryza sativa L.)mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA.Plant J,1994,6:271-282)进行。所获得的T0代转基因植株命名为OsENO2-2-n,其中n=1,2,3…代表转基因的不同家系。
2)取T0代转化植株叶片抽提总DNA,DNA抽提方法为CTAB法(Zhang等,genetic diversity and differentiation of indica an japonica rice detected by RFLP analysis,1992,Theor Appl Genet,83,495-499)。然后用PCR方法对T0代转化植株用潮霉素引物进行阳性检测。潮霉素引物的序列如下:Hn-F5'-agaagaagatgttggcgacct-3',Hn-R 5'-gtcctgcgggtaaatagctg-3'(上海生工生物工程技术有限公司合成)。PCR反应总体积为20μl,具体配法是:模板100ng,10xPCR buffer 2μl,10mM dNTP 1.6μl,2.5mM Mg2+1.5μl,左、右引物(Hn-F和Hn-R)各0.4μl,TAQ酶0.2μl加去离子水到20μl(所用到的PCR buffer、dNTP、Mg2+、rTAQ酶等均购自宝生物工程大连有限公司)。PCR反应条件如下:①94℃4分钟,②94℃30秒,③56℃30秒,④72℃2.5分钟,⑤从②-④循环32次,⑥72℃7分钟,⑦4℃保存。PCR产物在1%的琼脂糖凝胶上电泳检测。因为潮霉素基因为转化载体所特有,这样能扩增出潮霉素基因特异带的转基因植株即为阳性植株。对T0代阳性植株收种子(T1代),为T1代的大田种植和性状调查做准备。
3)为了检测超表达植株中的目标基因的表达量,申请人采用Real-time PCR的方法对转基因T0代植株进行了表达分析。实验所用的总RNA来自分蘖期的水稻叶片,RNA抽提用的试剂是采用Invitrogen公司的Trizol抽提试剂盒(具体操作步骤见该试剂盒说明书);按照实施例1的方法进行反转录,得到产物后用实时荧光定量PCR的方法检测OsENO2-2的表达量。试剂购自宝生物工程大连有限公司,反应体系参见说明书。PCR仪为美国ABI公司的7500,PCR参数为95℃预变性10秒,进入循环后95℃变性5秒,60℃退火延伸40秒,45个循环。Real-time-PCR所用引物序列为:
OsENO2-2-QF:5’-GGCCAAGATGCCACAAATGT-3’
OsENO2-2-QR:5’-TTGCCTGTGTAGCCAGCCTTA-3’
Actin-QF:5’-TGTATGCCAGTGGTCGTACCA-3’
Actin-QR:5’-CCAGCAAGGTCGAGACGAA-3’
最终得到的T0代转基因植株中OsENO2-2表达结果见图2。OX-1到OX-8为最终得到的8个转基因家系,其中OX-7为转基因阴性植株,Realtime-PCR结果显示在转基因材料中,OsENO2-2的表达与野生型中花11相比,上升倍数低的如OX-4较野生型上升了约3倍,上升倍数高的如OX-1上升了约35倍左右,多数家系上升至少15倍,说明超表达效果很好。
在本实施例中,获得转基因植株的方法采用农杆菌介导的遗传转化方法(文献参见:Hiei et al.,Efficient transformation of rice(Oryza sativa L.)mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA.Plant J,1994,6:271-282)报道的主要步骤,培养基以及使用的试剂主要参照华中农业大学授权专利(专利号ZL200710053552.9,发明的名称:水稻广亲和基因S5的分离克隆及应用;专利公开日:2008年6月18日;公开号:CN101200725;专利授权日:2010年04月21日),本发明实施例的步骤与上述文献的不同之处在于:愈伤组织洗涤和选择培养(抗性筛选)方法。本发明该阶段的操作步骤是:
(1)用无菌水洗涤水稻愈伤组织至看不见农杆菌。
(2)将愈伤组织浸泡在含400mg/L羧苄青霉素(CN)的无菌水中30分钟。
(3)将该愈伤组织转移至灭菌好的滤纸上,使该愈伤组织不带水。
(4)转移愈伤组织至选择培养基上选择2-3次,每次2周(第一次潮霉素的浓度为400毫克/升,第二次及以后潮霉素的浓度为250毫克/升)。
最终本发明总共获得独立转基因水稻超表达材料T0代8株。
【实施例4】转基因植株开花性状调查和开花相关基因的表达分析
1)将本发明T0代阳性植株(即OsENO2-2基因表达量上升的植株)收种子(T1代)种入大田进行表型鉴定。结果发现转基因阳性植株均有不同程度的表型,具体表现为开花期推迟表型(图3),统计T1代1,2,3,7四个家系各20株以及中花11(ZH11)对照20株,四个家系分别与中花11(ZH11)对照进行单因素数据显著性分析,结果如图3,其中OX-1,OX-2,OX-3,OX-7代表转基因不同家系,*代表差异显著,P<0.05;**代表差极异显著,P<0.01。具体见图3。
2)为了验证OsENO2-2长日照条件下调控水稻开花时间,我们将转基因植株和野生型植株在长日照14小时的条件下在光照培养箱中处理35天后,每四小时取一次样,取样部位为植株最顶端3片叶子,抽提叶片RNA,反转录产物检测开花相关基因的表达量。实验所用的总RNA来自所取的叶片,RNA抽提用试剂是Invitrogen公司的Trizol抽提试剂盒(具体操作步骤见试剂盒说明书);按照实施例1的方法进行反转录,得到产物后用实时荧光定量PCR的方法检测开花相关基因的表达量。试剂购自宝生物工程大连有限公司,反应体系参见说明书。PCR仪为美国ABI公司的7500,PCR参数为95℃预变性10秒,进入循环后95℃变性5秒,60℃退火延伸40秒,45个循环。
表达结果见图4所示,其中RFT1在超表达转基因阳性植株中表达量显著降低,RID1,Hd3a、Ehd1、Hd1、OsGI、Ghd7表达量在野生型和超表达材料中基本没有变化。实验结果表明开花途径上的重要基因RFT1受到OsENO2-2的调控,OsENO2-2在调控水稻开花过程中有着重要的作用。
Real-time PCR所用引物序列如下所示:
RFT1QF 5’-TGGTGTTCGTGCTGTTCCA-3’,
RFT1QR 5’-TTGTAGAGCTCGGCGAAGTTC-3’;
RID1QF 5’-CGACGACAATAGCTCGATCGC-3’,
RID1QR 5’-GTGCATGGTCACGGAGCCTT-3’;
Hd3a QF 5’-GCTCACTATCATCATCCAGCATG-3’,
Hd3a QR 5’-CCTTGCTCAGCTATTTAATTGCATAA-3’;
Hd1QF 5’-TCAG CAACAGCATATCT TTCTCATCA-3’,
Hd1QR 5’-TCTGGAATTTGGCTATACTATCACC-3’;
Ehd1QF 5’-GGATGCAAGGAAATCATGGA-3’,
Ehd1QR 5’-AATCCCATCGGAAATCTTGG-3’;
OsGI QF 5’-TGGAGAAAGGTTGTGGATGC-3’,
OsGI QR 5’-GATAGACGGCACTTCAGCAGAT-3’;
Ghd7QF 5’-AAATCCGGTACGCGTCCAG-3’,
Ghd7QR 5’-GACATAGGTGGATGGCGGTG-3’;
ActinQF 5’-TGTATGCCAGTGGTCGTACCA-3’,
ActinQR 5’-CCAGCAAGGTCGAGACGAA-3’。
其中RFT1QF、RFT1QR是用于RFT1基因定量PCR检测的引物;RID1QF、RID1QR是用于RID1基因定量PCR检测的引物;Hd3a QF、Hd3a QR是用于Hd3a基因定量PCR检测的引物;Hd1QF、Hd1QR是用于Hd1基因定量PCR检测的引物;Ehd1QF、Ehd1QR是用于Ehd1基因定量PCR检测的引物;OsGIQF、OsGI QR是用于OsGI基因定量PCR检测的引物;Ghd7QF、Ghd7QR是用于Ghd7基因定量PCR检测的引物;Actin QF、Actin QR是用于Actin基因定量PCR检测的引物。
【实施例5】转基因植株种子性状调查和淀粉合成基因的表达分析
收取T2代超表达阳性植株以及野生型植株种子时发现,超表达植株种子和野生型种子各取30粒时,超表达植株种子明显大于野生型植株种子(图5),在野生型对照中花11和OsENO2-2超表达植株的雌配子授粉3天之后,取授粉3天的籽粒,按照实施例1中抽提RNA的方法抽提RNA,并反转录得到cDNA,按照实施例3中Realtime-PCR的方法检测淀粉合成基因的表达量。检测结果见图6,OsSSI、OsSSIIa、OsSSIIc、OsSSIIIa在超表达植株中表达量显著增高,其他基因表达量在两种材料中变化不明显。实验结果表明,OsENO2-2可以通过调控部分淀粉合成相关基因来调控水稻种子的大小。
Real-time PCR所用引物序列如下:
OsSSI-QF:5’-GGGCCTTCATGGATCAACC-3’
OsSSI-QR:5’-CCGCTTCAAGCATCCTCATC-3’
OsSSIIa-QF:5’-GCTTCCGGTTTGTGTGTTCA-3’,
OsSSIIa-QR:5’-CTTAATACTCCCTCAACTCCACCAT-3’
OsSSIIb-QF:5’-TAGGAGCAACGGTGGAAGTGA-3’
OsSSIIb-QR:5’-GTGAACGTGAGTACGTGACCAAT-3’
OsSSIIc-QF:5’-GACCGAAATGCCTTTTTCTCG-3’
OsSSIIc-QR:5’-GGGCTTGGAGCCTCTCCTTA-3’
OsSSIIIa-QF:5’-GCCTGCCCTGGACTACATTG-3’
OsSSIIIa-QR:5’-GCAAACATATGTACACGGTTCTGG-3’
OsSSIIIb-QF:5’-ATTCCGCTCGCAAGAACTGA-3’
OsSSIIIb-QR:5’-CAACCGCAGGATAACGGAAA-3’
OsSSIVa-QF:5’-GGGAGCGGCTCAAACATAAA-3’
OsSSIVa-QR:5’-CCGTGCACTGACTGCAAAAT-3’
OsSSIVb-QF:5’-ATGCAGGAAGCCGAGATGTT-3’
OsSSIVb-QR:5’-ACGACAATGGGTGCCAAGAT-3’。
其中OsSSI-QF、OsSSI-QR是用于OsSSI基因定量PCR检测的引物;OsSSIIa-QF、OsSSIIa-QR是用于OsSSIIa基因定量PCR检测的引物;OsSSIIb-QF、OsSSIIb-QR是用于OsSSIIb基因定量PCR检测的引物;OsSSIIc-QF、OsSSIIc-QR是用于OsSSIIc基因定量PCR检测的引物;OsSSIIIa-QF、OsSSIIIa-QR是用于OsSSIIIa基因定量PCR检测的引物;OsSSIIIb-QF、OsSSIIIb-QR是用于OsSSIIIb基因定量PCR检测的引物;OsSSIVa-QF、OsSSIVa-QR是用于OsSSIVa基因定量PCR检测的引物;OsSSIVb-QF、OsSSIVb-QR是用于OsSSIVa基因定量PCR检测的引物。
SEQUENCE LISTING
<110> 江汉大学
<120> 影响水稻开花期和粒型的烯醇化酶基因OsENO2-2及其应用
<160> 39
<170> PatentIn version 3.3
<210> 1
<211> 1062
<212> DNA
<213> 水稻
<400> 1
atggttcaac agcttgatgg aacctccaac aactggggct ggtgcaaaca aaagcttgga 60
gcaaatgcta ttcttgctgt ttcacttgct gtgtgcaaag caggagccat ggtgaagaag 120
attccccttt accagcacat tgcaaatctt gctggaaaca agactctcgt gctgcctgta 180
cccgctttca atgtgatcaa tggaggatcc catgctggaa acaaacttgc catgcaggag 240
ttcatgatcc tccctactgg tgcatcctct ttcaaggagg ccatgaagat gggagttgag 300
gtgtaccacc acttgaagag tataatcaag aaaaagtatg gccaagatgc cacaaatgtg 360
ggggatgaag gtggctttgc tcctaacatt caggaaaaca aagagggcct cgaactgttg 420
aaggccgcaa tagctaaggc tggctacaca ggcaaagtgg tcataggaat ggatgttgca 480
gcttctgaat tttacagtga aaaggacaag acttacgatc ttaacttcaa ggaggataac 540
aacgacggtt cacacaaaat ttcaggtgac agcctgaaag atgtgtacaa gtcctttgtt 600
tctgagtacc ctattgtgtc gatcgaagat ccattcgatc aggatgactg ggctacctat 660
gccaagctta ctgatgagat tggacagcaa gtgcagattg ttggggatga ccttcttgtt 720
actaatccca caagggttgc caaggcaatt agtgaaaaga cttgcaatgc tcttctcttg 780
aaggtgaatc aaataggctc agttactgag agcattgagg ctgttagaat gtccaagcgt 840
gctggatggg gagtgatggc aagccatagg agtggtgaga cagaggatac cttcattgct 900
gacctctcag ttggtctgtc tacgggtcaa attaagacag gagctccctg tcggtcagag 960
cgtctggcta aatacaacca gctgctcagg atagaagaag agctgggcga tgctgcagtt 1020
tacgctggag aaaaattcag agcccctgtg gagccgtact aa 1062
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
ggccaagatg ccacaaatgt 20
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<400> 3
ttgcctgtgt agccagcctt a 21
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<400> 4
tgtatgccag tggtcgtacc a 21
<210> 5
<211> 19
<212> DNA
<213> 人工序列
<400> 5
ccagcaaggt cgagacgaa 19
<210> 6
<211> 31
<212> DNA
<213> 人工序列
<400> 6
gggggtacca tggttcaaca gcttgatgga a 31
<210> 7
<211> 29
<212> DNA
<213> 人工序列
<400> 7
gggggtacct tagtacggct ccacagggg 29
<210> 8
<211> 21
<212> DNA
<213> 人工序列
<400> 8
agaagaagat gttggcgacc t 21
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<400> 9
gtcctgcggg taaatagctg 20
<210> 10
<211> 19
<212> DNA
<213> 人工序列
<400> 10
tggtgttcgt gctgttcca 19
<210> 11
<211> 21
<212> DNA
<213> 人工序列
<400> 11
ttgtagagct cggcgaagtt c 21
<210> 12
<211> 21
<212> DNA
<213> 人工序列
<400> 12
cgacgacaat agctcgatcg c 21
<210> 13
<211> 20
<212> DNA
<213> 人工序列
<400> 13
gtgcatggtc acggagcctt 20
<210> 14
<211> 23
<212> DNA
<213> 人工序列
<400> 14
gctcactatc atcatccagc atg 23
<210> 15
<211> 26
<212> DNA
<213> 人工序列
<400> 15
ccttgctcag ctatttaatt gcataa 26
<210> 16
<211> 26
<212> DNA
<213> 人工序列
<400> 16
tcagcaacag catatctttc tcatca 26
<210> 17
<211> 25
<212> DNA
<213> 人工序列
<400> 17
tctggaattt ggctatacta tcacc 25
<210> 18
<211> 20
<212> DNA
<213> 人工序列
<400> 18
ggatgcaagg aaatcatgga 20
<210> 19
<211> 20
<212> DNA
<213> 人工序列
<400> 19
aatcccatcg gaaatcttgg 20
<210> 20
<211> 20
<212> DNA
<213> 人工序列
<400> 20
tggagaaagg ttgtggatgc 20
<210> 21
<211> 22
<212> DNA
<213> 人工序列
<400> 21
gatagacggc acttcagcag at 22
<210> 22
<211> 19
<212> DNA
<213> 人工序列
<400> 22
aaatccggta cgcgtccag 19
<210> 23
<211> 20
<212> DNA
<213> 人工序列
<400> 23
gacataggtg gatggcggtg 20
<210> 24
<211> 19
<212> DNA
<213> 人工序列
<400> 24
gggccttcat ggatcaacc 19
<210> 25
<211> 20
<212> DNA
<213> 人工序列
<400> 25
ccgcttcaag catcctcatc 20
<210> 26
<211> 20
<212> DNA
<213> 人工序列
<400> 26
gcttccggtt tgtgtgttca 20
<210> 27
<211> 25
<212> DNA
<213> 人工序列
<400> 27
cttaatactc cctcaactcc accat 25
<210> 28
<211> 21
<212> DNA
<213> 人工序列
<400> 28
taggagcaac ggtggaagtg a 21
<210> 29
<211> 23
<212> DNA
<213> 人工序列
<400> 29
gtgaacgtga gtacgtgacc aat 23
<210> 30
<211> 21
<212> DNA
<213> 人工序列
<400> 30
gaccgaaatg cctttttctc g 21
<210> 31
<211> 20
<212> DNA
<213> 人工序列
<400> 31
gggcttggag cctctcctta 20
<210> 32
<211> 20
<212> DNA
<213> 人工序列
<400> 32
gcctgccctg gactacattg 20
<210> 33
<211> 24
<212> DNA
<213> 人工序列
<400> 33
gcaaacatat gtacacggtt ctgg 24
<210> 34
<211> 20
<212> DNA
<213> 人工序列
<400> 34
attccgctcg caagaactga 20
<210> 35
<211> 20
<212> DNA
<213> 人工序列
<400> 35
caaccgcagg ataacggaaa 20
<210> 36
<211> 20
<212> DNA
<213> 人工序列
<400> 36
gggagcggct caaacataaa 20
<210> 37
<211> 20
<212> DNA
<213> 人工序列
<400> 37
ccgtgcactg actgcaaaat 20
<210> 38
<211> 20
<212> DNA
<213> 人工序列
<400> 38
atgcaggaag ccgagatgtt 20
<210> 39
<211> 20
<212> DNA
<213> 人工序列
<400> 39
acgacaatgg gtgccaagat 20
- 还没有人留言评论。精彩留言会获得点赞!