五种猪腹泻病毒多重实时荧光定量PCR快速诊断试剂盒及应用的制作方法
本发明属于病毒核酸检测领域,具体涉及一种5种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒,可在同一个反应管内同时检测猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)、猪传染性胃肠炎病毒(transmissiblegastroenteritisvirus,tgev)、猪轮状病毒a型(porcinegrouparotaviruses,gar)、猪轮状病毒c型(porcinegroupcrotaviruses,gcr)、猪圆环病毒2型(porcinecircovirus2,pcv2)五种猪腹泻病毒,适用于临床及科研中对五种猪腹泻病毒的快速定量检测。
背景技术:
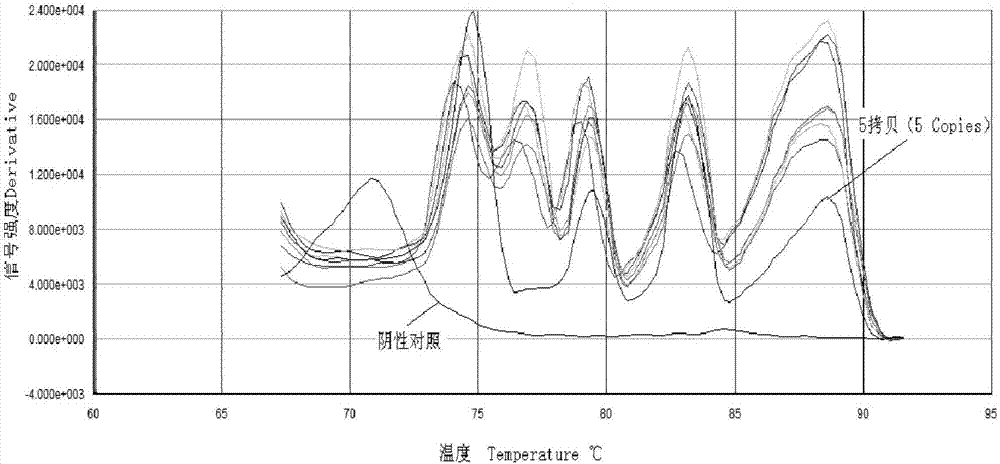
:近年来全球猪腹泻病频发,发病规模大,导致的经济损失惨重(chaeetal,2000,sunetal,2012)。2010来我国各地发生流行性腹泻,以爆发式的发展席卷我国10多个南方省份,100%的出生不久仔猪感染率直接导致100多万的仔猪死亡。病毒感染是猪腹泻主要病因。pedv、tgev、gar、gcr和pcv2被认为是猪病毒性腹泻的几个主要病原体。猪流行性腹泻(porcineepidemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)引起猪的一种以呕吐、腹泻和脱水为主要特征的肠道传染病。该病以7日龄以内仔猪发病为主,病程短、传播迅速、仔猪死亡率极高,可达100%。1978年,比利时和英国首次报道pedv疫情,1984年,我国证实该病的存在。在2010-2012年中国不同地区均有pedv大暴发的报道,造成哺乳仔猪大量死亡,严重影响了我国养猪业的健康发展。猪传染性胃肠炎病毒(tgev)属冠状病毒科、冠状病毒属,基因组为单股正链不分节段的rna,全长28.5kb。对小肠造成损伤,产生消化和吸收不良,最终导致腹泻和脱水,引起哺乳仔猪死亡。该病毒感染率高,造成的仔猪死亡率高。轮状病毒(rv)属于呼肠病毒科家族,无包膜,基因组是一条的11分段的双链rna(estesandcohen,1989)。rv是引起包括人类以及其他动物腹泻的重要因素,目前轮状病毒以vp6基因分成6型,a、b、c、e和h组(gar、gbr、gcr、ger和ghr)都已经在猪上检测出。gar在1975年首次报道,一直被认为是猪腹泻的一个主要病原。gcr在1979年首次被检测出,很难进行细胞培养。gcr能引起严重胃肠感染且易造成散发性传播或大爆发。一般gar被认为是引起猪腹泻的首因,而gbr、gcr的作用没那么大。douglasmarthaler等应用rt-pcr检测7508份猪腹泻样品的研究发现gar的阳性率为62%,gcr感染率也很高(53%),gcr主要感染1-20天仔猪,gar主要感染21天以上仔猪。认为应该同时检测gar和gcr。猪圆环病毒2型(pcv2)属圆环病毒科圆环病毒属,近年新报道猪病毒,是能在哺乳动物细胞自主复制最小单链环状dna病毒,包含4个开放阅读框(orf):orf1-4(murphy,1995)。猪圆环病毒相关疾病(pcvad)症状之一是引发肠炎。pcv2可以由单独感染或者混合感染引发肠炎。pcv2对猪有很强感染力,各年龄都可感染,而且侵害猪的免疫系统产生免疫抑制和其它病原微生物继发感染。目前,传统诊断方法难以检测不同病毒感染,单一的病毒诊断费时费力,特别是当前猪腹泻混合感染的现象严重,这些都使得检测更需要一个准确有效的方法来区分不同病毒。猪病毒分子诊断已经有很多的报道,包括多重普通pcr方法,但未见针对这5种主要猪腹泻病毒的多重诊断技术方法。而且现有的多重普通pcr灵敏度都在104-103copies左右。这种灵敏度不能满足低拷贝病毒量的早期检测。普通pcr检测以其简单高效等优点被广泛使用,多重pcr在减少工作量的基础上,一次加样检测多种病毒也能大大减小实验加样带来的污染。本实验在保证实验特异性和重复性的基础上探索建立一套针对这五种病毒的多重普通pcr检测方法,提高猪腹泻病毒检测灵敏度。常规的病原学和血清学检测很难将这些疾病同时加以区别鉴定,同时又存在操作繁琐、费时费力、敏感度低等缺陷,尤其是多种病原感染时,难以有效进行早期检测,容易产生误判错判。而多重实时荧光定量pcr技术可以一次同时检测多种病原体,并具有高特异性和敏感性、检测时间短、检测成本低等优点,是一种较为理想的检测方法。因此,开发出一种同时特异检测多种猪腹泻病毒感染的多重实时荧光定量rt-pcr快速诊断试剂盒,有助于提升病毒检测水平,在腹泻疾病诊断和防治及食品安全等方面具有重要的应用前景。技术实现要素:本发明要解决的技术问题是提供一种五种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒及其应用。为了解决上述技术问题,本发明提供一种五种猪病毒多重实时荧光定量pcr快速诊断试剂盒,包括如下5对病毒特异性引物:pedv-f:ggcggatactggaatgagcaa,pedv-r:ggtcggcgtgaggtcctgtt;tgev-f:atggtgttaggtgattattttcc,tgev-r:aatacaatgctttaagattttcca;gar-f:tgaagtgaggaccaggctaa,gar-r:acgaaatcacacccttacttg;gcr-f:tgttgcatccgtgaagagaatggt,gcr-r:gcattagcccctacgcaagc;pcv2-f:atccgaaggtgcgggaga;pcv2-r:tgacgtatccaaggaggcg。作为本发明的五种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒的改进:所述试剂盒包括:a)、荧光定量pcr反应液,b)、阳性对照品,c)、阴性对照品,d)、引物(5对病毒特异性引物),e)、定量pcr标准品。作为本发明的五种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒的进一步改进:所述定量pcr标准品由以下5种标准品组成:pedv标准品、tgev标准品、gar标准品、gcr标准品、pcv2标准品。上述五种病毒标准品序列如下:所述pedv标准品序列为(103bp):ggatactggaatgagcaaattcgctggcgcatgcgccgtggtgagcgaattgaacaaccttccaattggcatttctactacctcggaacaggacctcacgccgacc。tgev标准品序列为(105bp):tggtgttaggtgattattttcctactgtacaaccttggtttaattgcattcgcaatgatagtaatgacctttatgttacactggaaaatcttaaagcattgtatt。gar标准品序列为(97bp):ttaagtgaggactaggctaactacctggtatccgatcttaaccaacatgtagctatgtcaagtcaatcagactctacaagtaagggtatgat-ttcat。gcr标准品序列为(121bp):cgtccgtgaagagaatggtgatgtagataagctagagatctaatcaatctctatgcggactgcacatcatgtagcatgattcacgaatgggtttagtccatgcttgcgtaggggtaaatgc。pcv2标准品序列为(162bp):atccgaaggtgcgggagaggcgggtgttgaagatgccatttttccttctccagcggtaacggtggcgggggtggacgagccaggggcggcggcggaggatctggccaagatggctgcgggggcggtgtcttcttctccggtaacgcctccttggatacgtca。作为本发明的五种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒的进一步改进:所述荧光定量pcr反应液包含mastermix、荧光染料(20×evagreen)。作为本发明的五种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒的进一步改进:所述阳性对照品含tgev、gar、gcr、pedv和pcv2五种病毒的阳性质粒混合品(每种病毒浓度约为300ng/μl);所述阴性对照品为:灭菌后焦碳酸二乙酯处理水(depc-h2o)。作为本发明的五种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒的进一步改进:每种病毒特异性引物的上下游引物同管包装。作为本发明的五种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒的进一步改进:所述试剂盒避光保存于-20℃,应尽量减少反复冻融。本发明还同时提供了上述任一所述的试剂盒在多重实时荧光定量检测五种猪腹泻病毒感染中的用途。作为本发明的用途的改进:五种猪腹泻病毒为猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒(tgev)、猪轮状病毒a型(gar)、猪轮状病毒c型(gcr)、猪圆环病毒2型(pcv2)。作为本发明的用途的进一步改进,tm值范围为:tgev为74.4~75℃、gar为76.6~77.2℃、gcr为79~79.7℃、pedv为82.9~83.5℃、和pcv2为86.9~87.7℃。本发明的诊断试剂盒,能用于检测检测。表1、本发明所设计的多重实时荧光定量pcr引物引物名称序列(5′→3′)pedv-fggcggatactggaatgagcaapedv-rggtcggcgtgaggtcctgtttgev-fatggtgttaggtgattattttcctgev-raatacaatgctttaagattttccagar-ftgaagtgaggaccaggctaagar-racgaaatcacacccttacttggcr-ftgttgcatccgtgaagagaatggtgcr-rgcattagcccctacgcaagcpcv2-fatccgaaggtgcgggagapcv2-rtgacgtatccaaggaggcg本发明试剂盒的使用方法具体可如下:每次检测根据具体使用情况设立阴性对照和阳性对照;标准品用无菌双蒸水稀释为5.0×102~5.0×108copies/μl。rna/dna病毒样品提取:根据产品使用说明书,用病毒rna/dna抽提试剂盒minibestviralrna/dnaextractionkitver.4.0(takara)从细胞株、新鲜或冷冻的样本提取病毒核酸。反转录反应:在无rnase的0.2mlpcr管中依次加入上一步骤制备的总rna/dna模板1μl,使用takararnapcrkit(amv)ver.3.0进行rt-pcr反应,其中10×rtpcrbuffer1μl,25mmmgcl22μl,10mmdntpmixture1μl,40u/μlrnaseinhibitor0.25μl,5u/μlamvrtasexl0.5μl,random9mers0.5μl,rnasefreedh2o至总体积为10μl,待反转录反应结束后,所得反应液即为cdna/dna模板。核酸的检测:取1μl已抽提的待测样品核酸cdna/dna为模板进行多重荧光pcr反应,15μl的mastermix,20×evagreen1μl,10μmtgev、gar、gcr、pedv和pcv2上下游引物分别为0.5μl、0.5μl、0.15μl、0.15μl、0.4μl,加ddh2o至反应体系总体积为20μl;荧光pcr扩增程序为:95℃变性5min,接下来40个循环程序为95℃变性20s,55℃退火30s,72℃延伸30s,溶解曲线程序为:95℃15s,60℃1min,95℃15s,60℃开始收集荧光信号。程序成功运行完后从结果中得到溶解曲线及对应的tm值。标准曲线制作:分别取tgev、gar、gcr、pedv和pcv2重组质粒系列标准品5×102~5×107copies/μl进行实时定量荧光pcr反应,反应体系:1μl标准品模板,15μl的mastermix,20×evagreen1μl,10μmtgev、gar、gcr、pedv和pcv2上下游引物分别为0.5μl、0.5μl、0.15μl、0.15μl、0.4μl,加ddh2o至反应体系总体积为20μl。反应参数为:95℃5min;95℃变性20s,55℃退火30min,72℃延伸30s,40个循环。扩增完成后,以ct值为纵坐标,log10x(x为标准品系列浓度)为横坐标,ct值与log10x呈线性关系,制作标准曲线。荧光定量结果报告:1)、通过tgev、gar、gcr、pedv和pcv2的扩增产物在熔解曲线中对应的峰值高低及有无来判定检测样品。如果其中tgev、gar、gcr、pedv和pcv2相应扩增产物产生特异熔解峰,即出现对应的tm值(通过多次试验统计学方法所得tgev为74.4~75℃、gar为76.6~77.2℃、gcr为79~79.7℃、pedv为82.9~83.5℃和pcv2为86.9~87.7℃),则检测结果对应于该种病毒为阳性,即待测样品携带相应病毒,反之,则阴性没有携带相应病毒。2)、如果检测结果为阳性,根据所获得的标准曲线及待测样品ct值,计算待测标本病毒(copies/μl)。本发明的优点:运用实时荧光定量pcr技术,采用tgev、gar、gcr、pedv和pcv2五种腹泻病毒的特异性引物,开发研制一种基于溶解曲线分析的多重实时荧光定量pcr快速诊断五种猪腹泻病毒试剂盒。该发明通过一个pcr反应可以从样本中同时检测tgev、gar、gcr、pedv和pcv2单个或混合感染,比传统的普通pcr方法灵敏、更简便、省时和快捷,并且能够对待检测的病毒进行实时准确定量,且比单重荧光定量pcr方法更省时,节约成本。本发明提供的试剂盒可灵敏区分不同腹泻病毒感染,为腹泻病毒感染的检测提供快速简便的工具,从而为实现腹泻临床早期诊断和及时制定治疗方案、减少死亡率及后遗症成为可能。附图说明下面结合附图对本发明的具体实施方式作进一步详细说明。图1为五种腹泻病毒特异性熔解峰图(dissociationcurve);图1中,从左至右依次为:tgev、gar、gcr、pedv和pcv2。图2为检测灵敏度的熔解曲线图(dissociationcurve);图2中,每种熔解曲线中从上到下依次为5×108~5×100copies/μl重组质粒标准品;阴性对照如图2中的标注所述。图3为含五种猪病毒(tgev、gar、gcr、pedv和pcv2)阳性样品混合进行五重实时荧光定量pcr检测实例图;从左到右熔解峰依次为tgev、gar、gcr、pedv和pcv2。图4为tgev、pedv和pcv2阳性样本的检测结果图。图5为tgev和pcv2阳性样本的检测结果图。图6为gar和gcr阳性样本的检测结果图。图7为pedv标准曲线(standardcurve)。具体实施方式下面结合具体实施例对本发明作进一步说明,但本发明的保护范围并不仅限于此。实施例1、质粒标准品制备第一步:引物合成将本发明所设计的5种病毒引物序列(见表1)在中国上海生工生物公司技术服务公司合成引物,合成量为每引物3od。第二步:病毒总dna/rna提取将含有tgev、gar、gcr、pedv和pcv2的阳性样品各100ul置于1.5ml离心管中,根据产品使用说明书,用病毒rna/dna抽提试剂盒minibestviralrna/dnaextractionkitver.4.0(takara)提取,得到病毒rna/dna。第三步:反转录合成cdna反转录反应:在无rnase的0.2mlpcr管中依次加入上一步骤制备的总rna/dna模板2μl,根据takaraonesteprnapcrkit(amv)(codeno.rr024a)的操作说明书,进行rt-pcr反应,待反转录反应结束后,所得反应液即为cdna/dna模板。第四步:普通pcr扩增pcr反应体系(总反应体积25ul):10×pcrbuffer2.5μl,25mmmgcl22μl,2.5mμdntp1μl,taqdnapolymerase1u,以第三步中合成cdna/dna为模板(1μl),第一步中合成的五种病毒引物中的一种(浓度10μm,0.5μl),加ddh2o至反应体系总体积为25μl;分别进行pcr扩增。反应在bio-rads1000pcr扩增仪进行,反应参数为:95℃3min;94℃30s,56℃30s,72℃30s,30个循环,72℃5min。第五步:质粒标准品制备将第四步获得的扩增产物进行琼脂糖凝胶电泳,按照dnagelextractionkit操作方法回收目的片段,将回收产物连接到pmd18-t载体上,通过大肠杆菌dh5α感受态转化,挑取其中白色单菌落进行鉴定,重组质粒序列委托上海生工生物公司进行序列测定。利用plasmidminiprepkit提取测序正确的重组质粒dna,利用nanodrop2000定量重组质粒为4.8×1011copies/ul、2.6×1011copies/ul、1.8×1012copies/ul、6.7×1012copies/ul和3.2×1012copies/ul分别对应于tgev、gar、gcr、pedv和pcv2,以无菌双蒸水将重组质粒按照5.0×107~5.0×100copies/ul10倍梯度稀释制备质粒标准品。实施例2、本发明检测五种病毒特异性实验第一步:引物合成将本发明所设计的5种病毒引物序列(见表1)在中国上海生工生物公司技术服务公司合成引物,合成量为每引物3od。第二步:单个病毒在多重体系中的特异性检测按照evagreen多重实时荧光定量pcr反应体系配制5份相同的反应液(即,15μl的mastermix,20×evagreen1μl,10μmtgev、gar、gcr、pedv和pcv2上下游引物分别为0.5μl、0.5μl、0.15μl、0.15μl、0.4μl),分别单独加入1μl的1.0×106copies/μl的tgev、gar、gcr、pedv和pcv2的质粒标准品,加ddh2o至反应体系总体积为20μl;反应在abi7300荧光定量仪上进行,反应参数为:95℃5min;95℃变性20s,55℃退火30s,72℃延伸30s,40个循环。熔解曲线程序为95℃15s,60℃1min,95℃15s;同时进行pbov、ppv、prrsv、csfv、pedv和prv每种病毒的多重实时荧光定量pcr特异性检测试验。60℃开始收集荧光信号。特异性试验结果显示:在多重反应体系下分别单独加入tgev、gar、gcr、pedv和pcv2的质粒标准品进行实时荧光定量pcr反应,每种病毒的扩增片段在其相应目的片段tm值位置都有特异的目的熔解峰产生(参见图1),可见本发明中构建的evagreen多重实时荧光定量pcr反应体系特异性较好。tgev、gar、gcr、pedv和pcv2的tm范围是通过检测50份阳性样品确定的tm值,再用统计学方法计算出平均数和标准偏差,所得tm值范围tgev为74.4~75℃、gar为76.6~77.2℃、gcr为79~79.7℃、pedv为82.9~83.5℃、和pcv2为86.9~87.7℃。实施例3、本发明检测五种病毒稳定性实验第一步:引物合成同实施例1中第一步。将tgev、gar、gcr、pedv和pcv2,分别进行如下操作:每种病毒取6份1.0×106copies/μl的质粒标准品和2份阴性对照品(depc-h20),分别进行批内、批间重复试验。批内重复试验是将3份样品在同一次实时荧光中重复3次;批间重复试验是在3次不同时间的试验中(间隔3天)进行实时荧光定量pcr试验。所述实时荧光定量pcr反应体系和反应程序同上述实施例2的步骤第二步所示。5种病毒的批间、批内重复试验的变异系数cv值均小于4%,本发明检测过程中具有良好的稳定性。实施例4、本发明检测五种病毒敏感性实验第一步:引物合成同实施例1中第一步。第二步:敏感性检测以10倍系列稀释的tgev、gar、gcr、pedv和pcv2质粒标准品(5.0×108~5.0×100copies/μl)做为模板,每个稀释度设立3个重复,分别进行实时荧光定量pcr和普通pcr检测敏感度,比较敏感性。所述实时荧光定量pcr反应体系和反应程序同上述实施例2的步骤第二步所示;普通pcr反应体系为:10×pcrbuffer2.5μl,25mmmgcl22μl,2.5mμdntp1μl,taqdnapolymerase1u,加水至25μl,反应程序为:95℃3min;94℃30s,56℃30s,72℃30s,40个循环,72℃5min,取5μl扩增产物进行1.5%的琼脂糖电泳检测。试验结果表明,本发明可检测出5~50copies/μl的病毒量(图2),具体为:gcr的最低检出量为5copies,gar为50copies,tgev为5copies,pedv为5copies,pcv2为5copies。而常规pcr只能检测到5.0×102~5.0×103copies/μl的病毒量,具体为:gcr的最低检出量为5×103copies,gar为5×103copies,tgev为5×103copies,pedv为5×103copies,pcv2为5×102copies。由此可见本发明检测病毒的敏感性高于常规pcr约100-1000倍。实施例5、本发明对五种猪病毒多重实时荧光pcr检测实例第一步:引物合成同实施例1中第一步。第二步:病毒总dna/rna提取将含有tgev、gar、gcr、pedv、pcv2的5种已知阳性样品(猪粪)各取100μl混合置于1.5ml离心管中,根据产品使用说明书,用病毒rna/dna抽提试剂盒minibestviralrna/dnaextractionkitver.4.0(takara)提取,得到各病毒总rna/dna。第三步:反转录合成cdna反转录反应:在无rnase的0.2mlpcr管中加入上一步骤制备的总rna/dna模板2μl,进行rt-pcr反应,其中10×rtpcrbuffer1μl,25mmmgcl22μl,10mmdntpmixture1μl,40u/μlrnaseinhibitor0.25μl,5u/μlamvrtasexl0.5μl,random9mers0.5μl,rnasefreedh2o至总体积为10μl,待反转录反应结束后,所得反应液即为cdna/dna模板。第四步:多重荧光定量pcr扩增多重荧光定量pcr反应体系:15μl的mastermix,20×evagreen1μl,10μmtgev、gar、gcr、pedv和pcv2上下游引物分别为0.5μl、0.5μl、0.15μl、0.15μl、0.4μl,上述步骤所得的模板1μl,加ddh2o至反应体系总体积为20μl;同时设一阳性对照和一阴性对照(depc-h2o)。反应在abi7300荧光定量仪上进行,反应参数为:95℃5min;95℃变性20s,55℃退火30s,72℃延伸30s,40个循环。熔解曲线程序为95℃15s,60℃1min,95℃15s。60℃开始收集荧光信号。第五步:检测结果判定根据abi7300荧光定量pcr仪所自动生成的熔解曲线图,来分析扩增结果。备注说明:各病毒扩增产物tm值范围tgev为74.4~75℃、gar为76.6~77.2℃、gcr为79~79.7℃、pedv为82.9~83.5℃、和pcv2为86.9~87.7℃。结果显示:本发明能很好地同时通过pcr扩增出对应五种病毒扩增产物,并通过熔解曲线峰不同,将五种产物明显区分开来,阴性对照只有一个较小非特异熔解峰,不影响结果判断。本实施例的试验结果见图3。图3中:左到右依次为tgev、gar、gcr、pedv和pcv2。根据图3,我们可得以下结论:五种病毒可同时通过一次多重实时荧光pcr反应,扩增出各自相应目的产物,并能在熔解曲线上,通过溶解峰tm的不同,将各种病毒有效区分开来,试验结果与阳性对照品产生的熔解曲线很吻合,而阴性对照熔解曲线上没有熔解峰,可以很直观通过熔解曲线来判定试验结果,证明所检测五种病毒正是tgev、gar、gcr、pedv和pcv2。实施例6、本发明检测临床样品五种猪腹泻病毒试验及对临床检测阳性样品中病毒进行准确定量第一步:引物合成同实施例1中第一步。第二步:样本采集临床样本共计75份,其中在浙江地区采集粪便59份,组织病料16份。第三步:总dna/rna小量抽提根据产品使用说明书,用病毒rna/dna抽提试剂盒minibestviralrna/dnaextractionkitver.4.0(takara)从新鲜或冷冻的第二步中采集的样本中提取病毒核酸。第四步:反转录合成cdna/dna:同实施例5中第三步。第五步:普通pcr检测和多重荧光定量pcr1、普通pcr检测:pcr反应体系(总反应体积25μl):10×pcrbuffer2.5μl,25mmmgcl22μl,2.5mμdntp1μl,taqdna聚合酶1u,以第四步中合成cdna/dna(约100ng)为模板,0.5μl第一步中合成的病毒引物(浓度10μm),加ddh2o至反应体系总体积为25μl。反应在bio-rads1000pcr扩增仪进行,反应参数为:95℃3min;94℃30s,56℃30s,72℃30s,40个循环,72℃5min。2、多重荧光定量pcr过程同实施例5中第四步;第六步:结果检测普通pcr结果通过琼脂糖凝胶电泳进行检测;多重荧光定量pcr结果检测同实施例5中第五步。普通pcr法检测与本发明检测结果如下:普通pcr检测出pedv27份,本发明检测出39份;普通pcr检测出pcv224份,本发明检测出32份阳性;普通pcr检测出rvc10份,本发明检测出17份阳性;普通pcr检测出rva1份,本发明检测出3份阳性;普通pcr检测出tgev5份,本发明检测出8份阳性;其中,本发明检测出pcv2、tgev和pedv混合感染1份,普通pcr检测出pcv2、tgev和pedv混合感染0份;本发明检测出pcv2和pedv混合感染11份,普通pcr检测出pcv2和pedv混合感染7份;本发明检测出tgev和pcv2混合感染2份,普通pcr检测出tgev和pcv2混合感染0份;本发明检测出rva与rvc混合感染1份,普通pcr检测出rva与rvc混合感染0份。部分检测结果如图4-6。验证实验:按照本行业所公认的检测精度最好的单重实时荧光定量pcr法对上述75份样品进行复查,所得结果完全同本发明。本发明检测效果明显好于普通pcr检测效果,可以减少假阴性的发生,同时一次实验可以检测出病毒混合感染,减少二次pcr验证及不需要pcr扩增后续处理,大大节约时间,提高工作效率。第七步:对阳性检测结果进行准确定量分别取tgev、gar、gcr、pedv和pcv2重组质粒系列标准品(5×102~5×107copies/μl)以及待测样品cdna/dna进行实时定量荧光pcr反应,反应体系:1μl标准品模板或待测样品cdna/dna,10×pcrbuffer5μl,25mmmgcl25μl,2.5mμdntp4μl,20×evagreen2.5μl,taqdna聚合酶2.5u,tgev、gar、gcr、pedv和pcv2上下游引物终浓度在反应体系中各为0.26、0.12、0.14、0.13、0.05及0.13μm,加ddh2o至反应体系总体积为50μl。反应参数为:95℃5min;95℃15s,60℃1min,40个循环,扩增完成后,以ct值为纵坐标,logco为横坐标,制作标准曲线。图7为pedv定量标准曲线。根据所获得的标准曲线及待测样品ct值,计算待测标本病毒copies/μl。通过结果分析得出所采集样本中tgev、gar、gcr、pedv和pcv2五种病毒的总dna/cdna的大都在101~104copies/μl之间,而在普通pcr检测呈阴性通过本发明检测结果为阳性的样本,其对应拷贝数值在102copies/μl以下。对比例1、将gar对应的引物改成如下引物对:上游引物gar-f:actaggctaactacctggtat,下游引物gar-r:tacccttacttgtagagtctg。其余等同于实施例4。试验结果为,对tgev、gar、gcr、pedv和pcv2五种病毒的最低检出量分别为50、50、50、5和5copies。对比例2、将pedv对应的引物改成如下引物对:上游引物pedv-f:gatactggaatgagcaaattc,下游引物pedv-r:tcggcgtgaggtcctgttcc。其余等同于实施例4。试验结果为,对tgev、gar、gcr、pedv和pcv2五种病毒的最低检出量分别为5、50、50、50和50copies。对比例3、将tgev对应的引物改成如下引物对:上游引物tgev-f:tgttaggtgattattttcctact,下游引物tgev-r:aatgctttaagattttccagtgtaa。其余等同于实施例4。试验结果为,对tgev、gar、gcr、pedv和pcv2五种病毒的最低检出量分别为500、500、50、50和50copies。最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。<110>浙江理工大学<120>五种猪腹泻病毒多重实时荧光定量pcr快速诊断试剂盒及应用<160>10<210>1<211>21<212>dna<213>人工序列<220><223>引物pedv-f<400>1ggcggatactggaatgagcaa21<210>2<211>20<212>dna<213>人工序列<220><223>引物pedv-r<400>2ggtcggcgtgaggtcctgtt20<210>3<211>23<212>dna<213>人工序列<220><223>引物tgev-f<400>3atggtgttaggtgattattttcc23<210>4<211>24<212>dna<213>人工序列<220><223>引物tgev-r<400>4aatacaatgctttaagattttcca24<210>5<211>20<212>dna<213>人工序列<220><223>引物gar-f<400>5tgaagtgaggaccaggctaa20<210>6<211>21<212>dna<213>人工序列<220><223>引物gar-r<400>6acgaaatcacacccttacttg21<210>7<211>24<212>dna<213>人工序列<220><223>引物gcr-f<400>7tgttgcatccgtgaagagaatggt24<210>8<211>20<212>dna<213>人工序列<220><223>引物gcr-r<400>8gcattagcccctacgcaagc20<210>9<211>18<212>dna<213>人工序列<220><223>引物pcv2-f<400>9atccgaaggtgcgggaga18<210>10<211>19<212>dna<213>人工序列<220><223>引物pcv2-r<400>10tgacgtatccaaggaggcg19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种C型EV71病毒的TaqMan荧光实时定量PCR检测方法
- 一种鲤春病毒血症病毒的荧光定量pcr检测方法
- 一种利用实时荧光pcr检测偏肺病毒的方法和组合物的制作方法
- 一种病毒三重荧光定量rt-pcr检测方法及其试剂盒的制作方法
- 一种麻疹病毒一步实时荧光定量rt-pcr试剂盒的制作方法
- 一种用于检测日本乙型脑炎病毒的荧光rt-pcr试剂盒的制作方法
- 尼帕病毒和猪瘟病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 尼帕病毒和猪繁殖与呼吸综合症病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 用于辛德比斯病毒荧光rt-pcr检测的引物和lna探针及其试剂盒的制作方法
- 鸭痘病毒的实时荧光pcr检测方法及检测用引物和探针的制作方法
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种燕麦花叶病毒的实时荧光RT‑PCR检测方法、引物和探针及试剂盒与流程
- 一种检测羊边界病毒的实时荧光定量RT‑PCR试剂盒及应用的制造方法与工艺
- 检测口蹄疫病毒的荧光定量PCR试剂盒及系统的制造方法与工艺
- 五种猪腹泻病毒多重实时荧光定量PCR快速诊断试剂盒及应用的制造方法与工艺
- Sweepoviruses病毒实时荧光定量PCR检测的通用引物、探针及其检测方法与流程
- 一种鹅星状病毒实时荧光定量PCR检测的引物和探针的制作方法与工艺
- 一种葡萄斑点病毒荧光定量PCR检测的专用引物和方法与流程
- 一种樱桃病毒A荧光定量PCR检测的专用引物和方法与流程
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 检测禽呼肠孤病毒的通用PCR引物及其检测试剂盒的制作方法与工艺
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种用于绝对定量检测猪繁殖与呼吸综合征病毒的ddPCR方法、引物及其应用和试剂盒与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺
- 一种基于荧光定量PCR鉴定啮齿类螺杆菌的引物、试剂盒及鉴定方法与流程
- 一种检测包含潜伏期结核感染的试剂盒及其引物对和探针的制造方法与工艺
- 用于甜瓜果实基因PCR表达分析的内参基因及该内参基因的稳定性验证方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺