一种可生物降解膜及其制备方法和应用与流程
本发明属于医用生物材料技术领域,涉及一种可生物降解膜及其制备方法和应用,这种可生物降解薄膜能与组织紧密贴附,用于防治组织渗漏、手术后组织粘连以及作为载体在组织局部释放药物。
背景技术:
在组织损伤和外科手术后的愈合过程中,患者的创面常常会发生组织间粘连,尤其是在腹部、脊柱及屈指肌腱等处。据统计,普通腹部外科手术后,腹部粘连发生率在67%至93%之间,开放妇科盆腔手术后,粘连发病率高达97%。腹部手术性粘连可导致严重的临床并发症,如肠梗阻、腹腔和盆腔疼痛、不育症等,增加再次手术的困难以及发生进一步并发症的潜在危险。造成粘连的原因很复杂,可归述如下:创面出血;伤口表面的暴露;局部缺血;异物存留;细菌感染。所以,出现创伤面,尤其是手术后的创面及时实施防粘连处置,是治疗和顺利痊愈的重要环节。
使用物理隔离膜是目前临床预防粘连最有效的方法,例如,聚乳酸膜已经被多国药品监管机构批准在临床使用,用于预防肌腱、腹盆腔、脊柱手术后的粘连。一项关于聚dl-乳酸可吸收医用膜应用于腹部手术预防粘连的临床研究发现,比较术后肠鸣恢复时间、排气时间等临床体征,实验组术后效果较好(马富平,石明:聚_dl_乳酸医用膜应用于腹部手术预防粘连的临床观察”,《中国医学工程》2012,no.20,p68-69)。另一项研究也采用聚dl-乳酸可吸收医用膜进行其预防术后粘连的疗效观察,结果显示观察组腹腔粘连情况较对照组更轻微(罗一明,李志红:“聚乳酸防粘连膜预防术后粘连的疗效观察”,《中国实用医药》2012,no.7,p95-96.)。此外,临床研究也证明聚dl-乳酸可吸收医用膜在脊柱外科手术中有防粘连效果(钟喜红,吴伟:“聚-dl-乳酸防粘连膜应用于脊柱外科手术51例”,《中国医疗前沿》2012,no.7,p55)。
虽然有多项研究显示聚乳酸膜临床上有较好的防粘连效果,但这种膜不能粘附在组织表面,需要用手术线将膜与周围组织缝合,进行体内固定,临床使用不方便。
为了克服聚乳酸膜等防粘连隔离产品与组织贴附差的不足,本发明涉及一种与组织紧密贴附的生物材料薄膜,它可生物降解,能够有效地防治组织内容物渗漏和组织粘连,而且可以作为药物载体,在组织局部释放药物。
除以上提及的聚乳酸可吸收医用膜,作为止血、防粘连材料,目前有报道和使用的,还有止血海绵、止血粉剂、半流体/凝胶材料等,制备方法是使成膜材料在水溶液中经充分交联反应后,通过相应的工艺制成所需材料产品,例如将交联产物经喷雾干燥成粉剂,交联产物液体经注模和冷冻干燥后压片成止血膜,等等,可以参看中国专利申请cn201410216904.8。
虽然从临床防粘连处置考虑,隔离膜相对比较容易使用,但隔离膜与创面组织的良好贴附性(避免操作中错位)、良好的隔离性能(力学性能)和使用便利性都是必须考虑的条件。本案申请人曾为了解决隔离膜与创面组织的良好贴附性,在其专利cn200610095787.x中公开一种生物偶联材料,是一种胶原蛋白水解物与碳二亚胺发生不完全偶联反应的产物,具有流动性和粘附性,通过调节原料浓度和反应温度,可以控制偶连反应的速度和进程,该不完全偶联产物被涂敷于创面继续偶联同时实现与组织的粘附,达到防粘连和渗出的目的。相比于固态膜,这种未完全偶联的流动态材料虽然更利于临床操作时涂覆于手术部位,但需要在使用前临时制备,无论是反应时机还是临床使用,对操作者的要求高,操作技术会影响隔离膜的性质和隔离效果,例如膜的粘附性和强度,而调整原料及浓度,对于最终成膜的力学强度与体内降解时间也会有冲突,另一方面,这种流动态材料不能很好满足载药需求。
再一方面,目前用于组织创面的止血防粘连材料,无论是粉剂、海绵还是薄膜,其制备过程中,交联剂、发泡剂、增塑剂等添加剂是不可少的,为了降低由于这些添加剂的使用引入的潜在风险,需要在反应完成后除去多余的添加剂,为了将这些小分子物从已经形成的高分子膜分离,通常需要采用透析处理,增加了制备和产品的成本。
技术实现要素:
针对目前临床上防粘连材料的现状,本发明提供一种可生物降解膜,可以直接与组织有效贴附,并且具有力学性能优良、弯曲容易以及载药效果好的优点。
本发明还提供了上述可生物降解膜的制备方法,原料成膜操作简单,使用的添加剂只需水洗去除,无需透析处理,不仅操作简单,而且利于保证膜特性稳定。
本发明提供了一种可生物降解膜,该可生物降解膜的制备方法包括将成膜原料制成的流动相置于干燥的平底容器中,经凝固并成膜,使膜的质量为0.1-15毫克/平方厘米;所述成膜原料包括含羟基、氨基和/或羧基的生物相容性大分子材料。
本发明的生物可降解薄膜材料中,成膜原料选择含羟基、氨基和/或羧基的生物相容性大分子材料,具体实施过程中所述成膜原料可以选自明胶、胶原蛋白、纤维蛋白、蚕丝蛋白、白蛋白(albumin)、球蛋白(globulin)、透明质酸、甲壳素、壳聚糖、纤维素、多聚赖氨酸、多聚精氨酸、多聚谷氨酸、多聚天冬氨酸、海藻酸、淀粉、脱乙酰透明质酸、羧甲基壳聚糖、羧甲基淀粉、羧甲基纤维素、聚半乳糖醛酸、右旋糖酐、琼脂或卡拉胶及其衍生物。本领域技术人员可以基于自身的基础知识进行选择,例如,含羧基的大分子可以有多聚谷氨酸、多聚天冬氨酸、透明质酸、海藻酸、羧甲基淀粉、羧甲基纤维素、多聚半乳糖醛酸或它们的衍生物等等;含氨基的大分子可以有多聚赖氨酸、多聚精氨酸、壳聚糖及其衍生物等等;而同时含羧基和氨基的生物相容性大分子则可以明胶、胶原蛋白、纤维蛋白、蚕丝蛋白、白蛋白(albumin)、球蛋白(globulin)、脱乙酰透明质酸、羧甲基壳聚糖及其衍生物等等。制造生物材料膜时,成膜原料可以单独或混合使用,但应至少有一种生物大分子可以部分或全部溶于水及水溶液。这些成膜原料一般是膜干重的1-100%。
本发明的可生物降解膜,形成原料(也称成膜体系)除成膜原料外,还可以包括必要的偶联剂和/或偶联引发剂,所以其制备方法可以包括,将成膜原料制成的流动相置于干燥的平底容器中,在其凝固后或凝固过程中加入偶联剂和/或偶联引发剂以发生偶联反应,经水洗涤和干燥后剥离取出,得到所述的薄膜产品。申请人的研究发现,在偶联剂或/和偶联引发剂的作用下,原料中生物可降解大分子之间更利于产生共价键偶联,从而提高了生物膜材料的力学性能,使材料成为有一定的力学强度的支架,隔离潜在粘连的组织,同时共价偶联也增加了支架中天然生物大分子在体内的稳定性,保证材料支架能在相当一段时间内起组织隔离作用。
本发明的具体实施方案中,所述偶联剂可以包括京尼平、原花色素或醛类化合物(更好是二醛化合物)等;所述偶联引发剂则主要包括碳二亚胺等。偶联剂的应用能够使生物可降解大分子上相隔较远的化学基团偶联,它们不仅参与偶联反应,并且成为偶联产物的一部分。例如京尼平和原花色素是可生物降解、低细胞毒性的天然分子,它能够与成膜材料分子中的氨基形成杂环结构的交联桥。偶联剂可以单独或混合使用,例如,用于在成膜体系中,京尼平的浓度是0.01%-10%,原花色素的浓度是0.01%-10%,戊二醛(或其它二醛化合物)的浓度则可以是0.001%-5%。
本发明中使用的化学偶联引发剂可以是碳二亚胺类偶联引发剂,从作用机理上,它促进生物可降解大分子上相隔较近的羧基和氨基在温和条件下进行化学偶联,但自身不会成为最终偶联产物的一部分。碳二亚胺的化学结构中含有能促进羧基和氨基形成化学键的r1-n=c=n-r2基团,其中的r1和r2为烷基、环烷基、芳烷基或它们的取代物,包括但不限于1-烷基-3-(3-二甲氨丙基)碳二亚胺(其中的烷基含1-10个碳原子)、n,n'-二异丙基碳二亚胺、二环己基碳二亚胺、1-乙基-3-(3-(三甲基铵)丙基)碳二亚胺、碘化[1-环己基-3-(3-三甲氨丙基)碳二亚胺]、环己基-β-(n-甲基吗啉基)乙基碳二亚胺对-甲苯磺酸酯、1-(3-二甲氨丙基)-3-乙基碳二亚胺甲碘化物、1,6-亚己基双(乙基碳二亚胺)、对-亚苯双(乙基碳二亚胺)等。使用较多的碳二亚胺可以是1-乙基-3-(3-二甲基氨丙基)碳二亚胺(edc)或其盐酸盐,成膜体系中碳二亚胺浓度一般为0.01-10%。偶联引发剂可以单独或与偶联剂混合使用。
为了进一步提升例如碳二亚胺等偶联引发剂促使羧基与氨基偶合的效力,形成偶联度更大的生物偶联材料,本发明还可使用偶联引发增效剂,例如n-羟基琥珀酰亚胺(nhs,n-hydroxysuccinimide)或n-羟基硫代琥珀酰亚胺(sulfo-nhs,n-hydroxysulfosuccinimide)等,其他的辅剂有1-羟基苯并三唑(hobt)、3-羟基-1,2,3-苯并三嗪-4(3h)-酮(hoobt)和/或1-羟基-7-偶氮苯并三氮唑(hoat),成膜体系中这些偶连引发增效剂浓度可以是0-10%。
除了使用偶联剂或/和偶联引发剂促进共价键形成而加强薄膜的力学性能、延长薄膜的生物降解时间以及薄膜与组织的贴附性能,本发明也可以通过加入金属离子调节上述膜性能的实现,这些离子包括二价和三价的金属离子,如钙离子、锌离子、铁离子等,通常以可溶性盐的形式加入。
申请人的研究发现,成膜体系包含了偶联剂和/或偶联引发剂时,对成膜原料的种类进行适当选择,更利于获得与组织贴附性能和力学性能得以提升的生物膜材料。例如,所述成膜原料可以选自:同时含有羧基和氨基的生物相容性大分子材料、同时含有羧基和氨基的大分子材料与仅含有羧基或氨基的大分子材料的混合物(例如明胶与海藻酸钠的混合物)、或,仅含有羧基的大分子材料与仅含有氨基的大分子材料的混合物(例如壳聚糖与羧甲基纤维素钠的混合物);且进一步包括纤维素、羧甲基纤维素、淀粉或羧甲基淀粉。
本发明的可生物降解膜可以是流动态的成膜原料(例如前述的明胶、胶原蛋白、透明质酸等等)直接凝固形成的膜材料,制备方法可以是将成膜原料的流动相置于干燥的平底容器中,使之凝固成膜,干燥后将膜剥离取出即可;也可以是采用包括成膜原料与偶联剂和/或偶联引发剂的成膜体系制造得到的膜材料,此时的制备方法可以是先将成膜原料的流动相置于干燥的平底容器中,待其成凝固态后或凝固过程中加入偶联剂和/或偶联引发剂溶液,进行偶联后,倒掉溶液,再用水将多余的偶联剂和/或偶联引发剂清洗除去,干燥后将膜剥离取出即可。
为了促进膜的形成、调节膜的力学性能和降解速度,成膜体系中可以加入生物可降解辅料,如淀粉、纤维素、甲壳素、右旋糖酐、卡拉胶、琼脂糖等天然大分子及其衍生物,还包括生物可降解的合成高分子,如聚乙醇酸(pga)、聚乳酸、聚乙醇酸和乳酸共聚物(plga)、聚乙二醇(peg)、聚乙二醇与聚乳酸的共聚物等,这些辅助原料占膜干重的1-90%。辅料是以水溶液、悬浊液或干粉的形式使用,悬浊液和干粉原料包括纳米颗粒材料。
本发明的制备方法对于成膜过程的操作没有很严格的要求,例如,在室温或环境温度下静置成膜即可,而薄膜的干燥也可在环境温度或室温下自然干燥或气流干燥。可以使用水、稀酸溶液、盐溶液等配制成膜原料流动相或成膜体系流动相,例如,使用去离子水、稀盐酸溶液、磷酸钠溶液、ems缓冲生理盐水等。
加入偶联剂和/或偶联引发剂,引发偶联反应,一般静置即可。在薄膜的制备时,偶联反应时间可以为0.1-24小时,偶联后用蒸馏水洗涤至少1次,去除多余偶联剂和/或偶联引发剂。
本发明提供了一种采用上述任一方法制备得到的可生物降解薄膜材料,申请人的研究发现,即使仅使用上述的成膜原料控制适当的单位质量直接凝固形成的膜,例如明胶膜,依然能够与创面组织有效贴合粘附,发挥防粘连和止血功效,并且具有力学性能优良、弯曲容易的优点。当需要联合用药,可以很方便地将相应的药物置于薄膜表面或整体,此时薄膜材料同时承担了药物载体的角色,利于药物在治疗面释放。例如可加入抗生素(如丝裂霉素c、羟基喜树碱等)、抗炎药(如醋氯酚酸、双氯芬酸钠、地塞米松等)、抗氧化剂(如维生素c、维生素e、褪黑激素、亚甲基蓝等)等来防治细菌感染和炎症,加入钙离子、凝血因子、维生素k等提高材料的止血功能,加入磷脂、滑蛋白(lubricin)等防治手术后粘连,同时也可加入生物因子控制创伤愈合过程。
本发明提供的采用上述任一方法制备得到的可生物降解薄膜材料,在制膜过程中也可以使用偶联剂和/或偶联引发剂,但规定了偶联剂和/或偶联引发剂为延迟引入,即偶联剂和/或偶联引发剂是在成膜原料的流动相已经呈现凝固态时加入成膜体系,得到的薄膜材料在临床上无论是与创面组织的贴合粘附效果,或是承载药物控释效果及使用安全性,都会更加理想。这些临床表现应该可以从成膜及偶联反应的微观机理得到印证。
可以理解,制膜时偶联剂和/或偶联引发剂的延迟引入,减少了分子内偶联,利于提升薄膜在应用中与组织的结合(偶连剂还起到促进薄膜与所接触组织的共价键合);与常规做法将偶联剂和/或偶联引发剂与成膜原料先行混配,使其共同成膜的处理不同,偶联剂和/或偶联引发剂延迟引入,在凝固条件下,首先是成膜原料大分子之间运动范围限制在有限的空间,限制了分子间的距离,相互作用增强,偶联过程中可以减少分子内偶联,增加分子间偶联,即,化学偶联剂或/和偶联引发剂的延迟引入会使引导大分子间的偶联,使制备的材料具有独特的分子结构和性能;而且在已经凝固的材料中形成化学活性位点,这些位点不仅可以与生物材料膜贴附的组织形成化学键,也提供了与小分子物、生长因子等药物结合的活性位点,实现对药物进行可控释放,而且利于避免药物(例如生长因子)因自身偶联而降低和失去药物的活性;再一方面,偶联剂和/或偶联引发剂延迟引入,作用于已经呈凝固态的成膜体系表面,多余试剂可通过倾倒、洗涤高效地除去,无需使用低效率的透析法,不仅提高了制备效率,降低了操作难度和成本,也提高了材料的生物安全性。
本发明的具体实施方案中,从薄膜与创面组织的有效粘附效果、薄膜使用中的耐弯曲性以及薄膜力学性能等,要求该薄膜的质量为0.1-15毫克/平方厘米,最好为1-10毫克/平方厘米,对于成份确定的薄膜,膜的单位面积质量对应了一定的膜厚度,可以根据临床应用的具体需要,制成三角形、方形、长方形、矩形、圆形、椭圆形等多种形状,以及不同尺寸的薄膜,不需二次加工处理以供直接使用。
本发明还提供了上述可生物降解膜在制备用于防止组织渗漏膜、手术后防粘连膜和局部用药载体中的应用。实验效果显示,本发明的生物材料薄膜能够紧密贴附与组织表面,贴附源于材料中亲水原料与组织表面形成氢键和/或离子键等非共价键化学作用,也可以通过生物材料薄膜与其贴附组织间形成的共价键加强贴附,防止气体、体液以及组织内容物的渗漏,而且也防止材料在使用时的移动。本发明的可生物降解膜在临床应用中能有效防止组织渗漏以及腹部、心血管、脊柱、腱部、妇科盆腔等处的粘连,并且可以作为药物载体用于医疗中。
附图简述
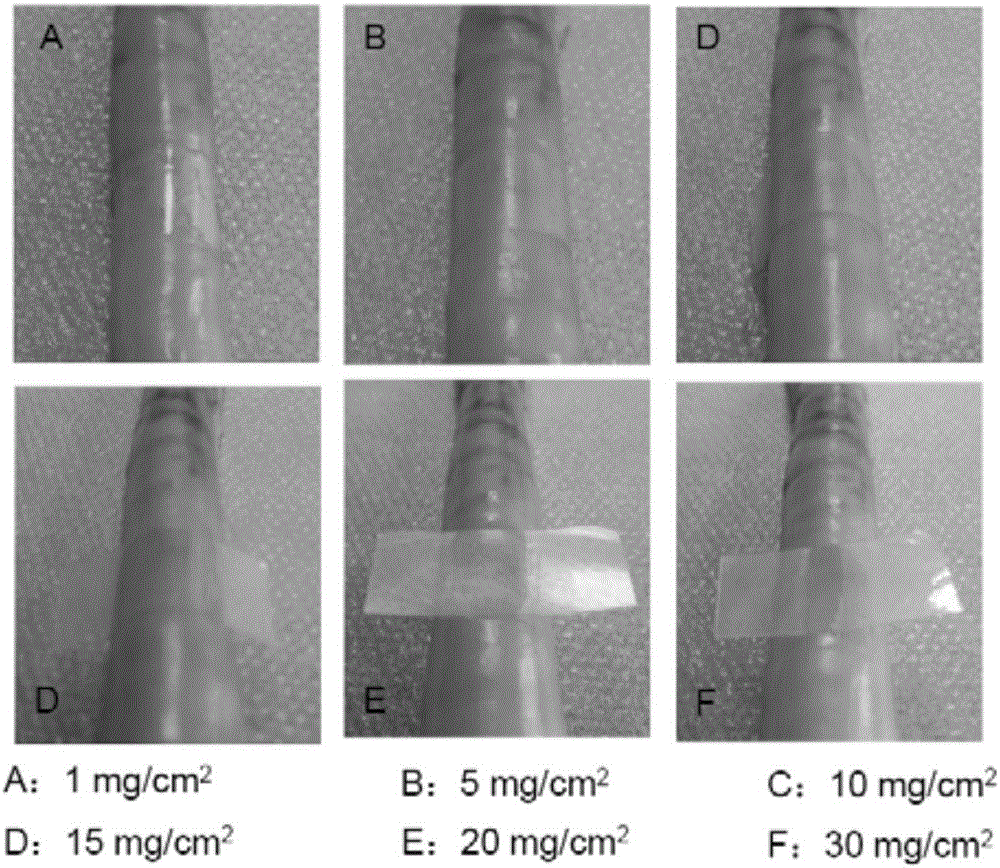
图1显示不同厚度(单位面积质量)的明胶膜与组织的贴附性能比较。
图中将1x2cm明胶膜(单位面积质量为1、5、10、15、20和30mg/cm2)按压在狗小肠3秒,然后观察膜与组织的贴附。
图2是二种不同成膜方法(偶联剂在制膜时加入或在成膜后加入)得到的薄膜样品的拉力位移曲线图。
图中,膜1代表化学偶联发生在成膜原料凝固成膜同时得到的薄膜样品的拉力位移曲线,膜2代表成膜原料先行凝固成膜后再进行化学偶联得到的薄膜样品的拉力位移曲线。
具体实施方式
以下通过具体实施例和实验例进一步阐述本发明方案的实施以及其技术性效果的实现,但不能用于限制本发明的可实施范围。
除另有说明外,本发明中所涉及的份数和百分比均按重量计。
i.生物材料制备实施例
以下实施例用于说明本发明薄膜的制备方法,但材料组成、原料量和应用并非限定于这些实施例。
所有原料均来自商购品。
实施例1
100毫克明胶溶解于10毫升50℃去离子水中,倒入底面尺寸5cmx8cm的聚四氟乙烯制成的方形水平槽中,室温水平放置凝固,自然晾干,视需要用蒸馏水洗涤,晾干后小心将明胶膜从聚四氟乙烯槽中剥离,膜单位面积质量大约2.5mg/cm2。
实施例2
100毫克明胶和10毫克透明质酸钠溶解于10毫升50℃去离子水中,倒入5cmx8cm用聚四氟乙烯制成的方形水平槽中,室温水平放置凝固,自然晾干,视需要用蒸馏水洗涤,晾干后小心将膜从聚四氟乙烯槽中剥离,膜单位面积质量大约2.75mg/cm2。
实施例3
100毫克明胶和10毫克羧甲基纤维素钠溶解于10毫升50℃去离子水中,倒入5cmx8cm用聚四氟乙烯制成的方形水平槽中,室温水平放置,自然晾干,视需要用蒸馏水洗涤,晾干后小心将膜从聚四氟乙烯槽中剥离,膜单位面积质量大约2.75mg/cm2。
实施例4
2克壳聚糖(脱乙酰度为80%,mw200,000)置于100ml稀盐酸溶液中,搅拌24小时,酸度值维持在ph3.0,过滤除去不溶物,配成2%壳聚糖溶液。100毫克明胶溶解于8毫升50℃去离子水中,再加入2毫升上述2%壳聚糖溶液,混匀后倒入5cmx8cm用聚四氟乙烯制成的方形水平槽中,室温水平放置凝固,自然晾干,小心将凝胶膜从聚四氟乙烯槽中剥离,膜单位面积质量大约3.5mg/cm2。
实施例5
5毫升2%蚕丝蛋白溶液和5毫升2%壳聚糖溶液倒入5cmx8cm用聚四氟乙烯制成的方形水平槽中,混匀,室温水平放置,自然晾至凝固,然后用磷酸钠水溶液洗涤一次,蒸馏水洗涤二次,晾干,小心将凝胶膜从聚四氟乙烯槽中剥离,膜单位面积质量大约5mg/cm2。
实施例6
100毫克明胶在50℃溶解于10毫升去离子水中,倒入5cmx8cm用聚四氟乙烯制成的方形水平槽中,晾至完全凝固,再加入2毫升1%edc,让溶液均匀铺于膜上,室温放置3小时,倒出多余溶液,然后用蒸馏水洗涤三次,晾干,小心将凝胶膜从聚四氟乙烯槽剥离,膜单位面积质量大约3mg/cm2。
实施例7
100毫克明胶和10毫克海藻酸钠在50℃溶解于10毫升去离子水中,倒入5cmx8cm用聚四氟乙烯制成的方形水平槽中,室温放置完全凝固后,加入1毫升1%edc,让溶液均匀铺于膜上,室温放置3小时,倒出多余溶液,用蒸馏水洗涤三次,室温下将凝胶膜晾干,再从聚四氟乙烯槽小心剥离,膜单位面积质量大约3mg/cm2。
实施例8
100毫克明胶在50℃溶解于10毫升含去离子水中,加入50毫克羟丙基甲基纤维素粉末,混合均匀,倒入5cmx8cm用聚四氟乙烯制成的方形水平槽中,室温放置凝固后,加入2毫升1%edc,让溶液均匀铺于膜上,室温放置3小时,倒出多余溶液,用蒸馏水洗涤三次,室温下将凝胶膜晾干,再从聚四氟乙烯槽小心剥离,膜单位面积质量大约4.25mg/cm2。
实施例9
5毫升2%壳聚糖溶液与5毫升含50毫克羟乙基淀粉的1%羧甲基纤维素钠水溶液混合均匀,再倒入5cmx8cm用聚四氟乙烯制成的方形水平槽中,室温放置完全凝固后,加入1毫升1%edc,让溶液均匀铺于膜上。室温放置3小时,倒出多余溶液,用蒸馏水洗涤三次,自然晾干,小心将凝胶膜从聚四氟乙烯槽小心剥离,膜单位面积质量大约5.25mg/cm2。
实施例10
100毫克明胶在50℃溶解于10毫升去离子水中,倒入5cm×8cm用聚四氟乙烯制成的方形水平槽中,室温放置至完全凝固,加入2毫升1%edc/1%nhs溶液,让溶液均匀铺于膜上,室温放置3小时,倒出多余溶液,用蒸馏水洗涤三次,室温放置晾干,再从聚四氟乙烯槽小心剥离下凝胶膜,膜单位面积质量大约3.5mg/cm2。
实施例11
200毫克明胶在50℃溶解于10毫升去离子水中,倒入5cm×8cm用聚四氟乙烯制成的方形水平槽中,室温放置凝固,加入2毫升0.1%戊二醛,让溶液均匀铺于膜上,室温放置过夜,倒出溶液,用蒸馏水洗涤三次,然后将凝胶晾干,再从聚四氟乙烯槽小心剥离,膜单位面积质量大约5mg/cm2。
实施例12
100毫克壳聚糖(脱乙酰度为80%,mw200,000)加入到10毫升稀盐酸水溶液中,搅拌24小时,酸度值维持在ph3.0,倒入5cm×8cm用聚四氟乙烯制成的方形水平槽中,室温放置凝固,用磷酸钠水溶液洗涤三次,再加入2毫升0.2%戊二醛,让溶液均匀铺于膜上,室温放置过夜,倒出多余溶液,用蒸馏水洗涤三次,然后将凝胶晾干,再从聚四氟乙烯槽小心剥离,膜单位面积质量大约2.6mg/cm2。
实施例13
100毫克明胶在50℃溶解于5毫升去离子水中,加入50毫克羟乙基淀粉,混匀,再与5毫升2%的壳聚糖溶液混合,倒入5cm×8cm用聚四氟乙烯制成的方形水平槽中,室温放置凝固,加入2毫升0.1%戊二醛,让溶液均匀铺于膜上,室温放置过夜,倒出多余溶液,用蒸馏水洗涤三次,然后将凝胶晾干,再从聚四氟乙烯槽小心剥离,膜单位面积质量大约6.3mg/cm2。
实施例14
100毫克明胶在50℃溶解于10毫升去离子水中,倒入5cm×8cm用聚四氟乙烯制成的方形水平槽中,室温放置完全凝固,加入2毫升2%edc/1%京尼平溶液,让溶液均匀铺于膜上,室温放置过夜,倒出多余溶液,用蒸馏水洗涤三次,室温放置将凝胶晾干,再从聚四氟乙烯槽小心剥离,膜单位面积质量大约3.5mg/cm2。
实施例15
100毫克明胶在50℃溶解于10毫升去离子水中,倒入5cm×8cm用聚四氟乙烯制成的方形水平槽中,室温放置完全凝固后,加入2毫升0.5%edc/0.1%戊二醛溶液,让溶液均匀铺于膜上,室温放置过夜,倒出多余溶液,用蒸馏水洗涤三次,然后将凝胶晾干,再从聚四氟乙烯槽小心剥离,膜单位面积质量大约2.8mg/cm2。
按照以上任意实施例的方法调整原料用量,尝试使最终成膜的质量低于0.9mg/cm2,但难以剥离得到完整的凝胶膜。
ii.膜厚度与组织贴附性关系的实施例
按照实施例1方法,调整明胶使用量制备单位面积重量为1、5、10、15、20、30mg/cm2的明胶膜,它们具有不同厚度。
取长度15cm狗小肠,其内放入一段塑料棒,将小肠撑圆,然后分别将不同厚度的明胶膜,取尺寸1cmx2cm,按压包裹在狗小肠上3秒,观察贴附情况。
结果:厚度为1、5和10mg/cm2的明胶膜a、b、c按压3秒就能够紧密地贴附于小肠表面,厚度为15mg/cm2的明胶膜d仅能够部分贴附于小肠表面,按压时间增加至15秒,才能将该厚度的膜紧密贴附于小肠表面,厚度为20和30mg/cm2的明胶膜e和f,即使增加按压时间,也难以通过按压紧密地贴附于小肠表面(参考图1)。
iii.生物材料膜制备方法与其力学性能实施例
取300毫克明胶和30毫克羧甲基纤维素,混合,在50℃溶解于15毫升水。
取2个底面积为5cm×8cm用聚四氟乙烯制成的方形水平槽,其中一个水平槽中倒入6毫升上述制备的明胶和羧甲基纤维素混合液,立即再加入4毫升0.9%edc/0.45%nhs溶液,迅速混匀槽中溶液,室温晾干,得到膜1;另一水平槽中同样倒入6毫升上述制备的明胶和羧甲基纤维素混合液和4毫升水,混匀,在水平槽中铺展,室温晾至材料完全凝固,加入4毫升0.9%edc/0.45%nhs溶液,让溶液均匀铺于膜上,室温晾干,倒出多余溶液,用蒸馏水洗涤三次,然后将凝胶晾干,再从聚四氟乙烯槽剥离,得到膜2。
将二种制备方法获得的膜切成相同大小的哑铃形状,最窄处3.3毫米,放于力学拉伸机上拉伸,绘制拉力与位移的关系曲线于图2,测量二种制备方法做出膜的力学性质。测量发现化学偶联发生在成膜时的膜1,形成膜的断裂强度远小于成膜后再进行化学偶联的膜2,而且刚度(曲线上升期间的斜率)也表现出同样的趋势。
同样的方法对前述实施例的薄膜进行力学性能测试,对照组依然是组成相同但化学偶联发生在制膜时的薄膜,也得到相同的结果。
iv.组织粘附及止血效果实施例
将10只新西兰兔随机分至对照组和生物材料组,每组5只,用戊巴比妥钠麻醉,在无菌条件下沿腹中线开腹,暴露肝脏,在肝表面造成1cmx1cm面积大小的组织损伤,对照组用消毒海绵止血,生物材料组将上述生物材料制备实施例6制备的明胶薄膜(3cmx3cm)敷压伤口,记录止血时间,测量出血量,完成记录和测量后,缝合伤口,动物自由饮水进食,观察动物存活情况。
对照组止血时间为526±78秒,生物材料组止血时间205±56秒;对照组出血量是1.83±0.86毫升,生物材料组出血量1.49±0.62毫升。
术后2周,动物存活完好,开腹观察,伤口恢复良好。
本实验证明生物材料薄膜能够粘附于组织表面,起到止血作用,而且生物相容性好,在体内能够被降解。
生物材料组还可以采用实施例4制备的薄膜,同样的操作处理,止血时间和出血量均有所降低。
v.防治粘连效果实施例
以狗为动物实验模型,实验动物狗体重20公斤。
将狗右前爪第二和第五指的屈肌腱在前掌处完全切断,手术缝合。作为对照组的第二指屈肌腱缝合后,不做任何处理;而试验组的第五指屈肌腱缝合后,用上述生物材料制备实施例10制备的明胶薄膜(3cmx1cm)包裹。完成肌腱缝合和处理后,逐层缝合腱鞘和皮肤。
术后三周解刨实验爪,观察肌腱粘连程度,发现试验组的第五指,明胶薄膜能够有效地防止屈肌腱与周围组织粘连,对照组的第二指有组织粘连情况出现。
- 还没有人留言评论。精彩留言会获得点赞!