一种制备育性减低植物的方法与流程
本申请是申请日为2012年11月14日的中国专利申请201280006361.6“一种制备育性减低植物的方法”的分案申请。本发明涉及生物
技术领域:
,尤其涉及一种制备育性减低植物的方法。
背景技术:
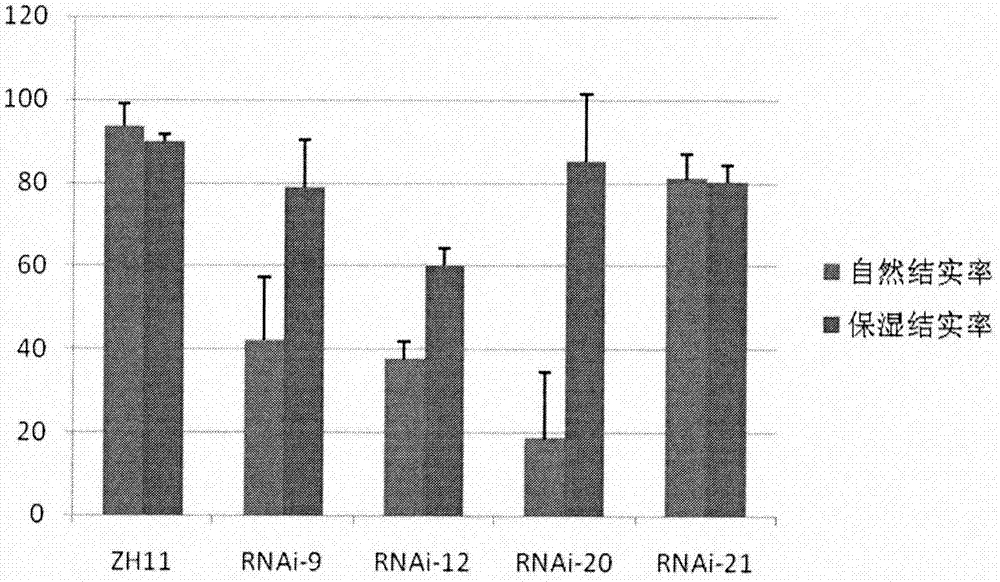
:植物雄性不育是一个与农业生产密切相关的植物学性状,是植物在发育过程中基因型表达与环境相互作用的结果。植株本身的雄性不育就可以在免去人工去雄的情况下作为遗传工具用于开发利用作物杂种优势,进行轮回选择,回交等育种研究。利用植物的雄性不育性培育各种雄性不育系,再借助遗传工程大量生产杂交种子,从而使许多作物特别是自花传粉作物的杂种优势得以在生产上利用,为大规模生产杂交种子提供了可能性。水稻是我国重要的粮食作物,水稻杂种优势和杂交育种方式的发现与常规育种相比增产20%以上,给水稻生产带来了巨大的贡献,在发现环境敏感的核不育水稻材料后,袁隆平院士又提出了两系选育法,使得水稻杂交育种策略更加简便,各方面的品质也得到了提高,产量又能提高5-10%。农垦58s是最早发现的光周期调节育型的雄性不育材料,它和它转育的粳稻和籼稻光敏不育系在一定温度范围可被长日照诱导不育,短日照诱导可育。由于同时又受到温度的影响,它们又被称为光温敏不育系。人们通过基因定位发现一个非编码的前体rna调节了光温敏不育。但夏季异常低温(<23度)会使得制种失败,因此光温敏不育材料的应用受到了一定的影响。植物生长发育除了收到光照和温度的影响外,湿度也是一个重要的环境因素,虽然湿度和水稻雄性不育的关系国内外都没有任何报道。但早在1993年拟南芥的研究中人们早就发现一类湿度相关的雄性不育的突变体pop1,它是由于突变体花粉表面含油层(tryphine)缺少长链脂肪酸和蜡质而使得花粉不能从柱头上吸水,从而导致授粉失败和不育(但突变体从相对环境湿度70%的环境移入相对湿度为90%的高湿箱,育性得到了恢复preussetal.,genedev.19937:947-985)。技术实现要素:本发明的一个目的是提供一种rna干扰载体。本发明提供的rna干扰载体,为将序列表中的序列1所示的dna分子插入ph7gwiwg2(ii)中得到的载体。上述rna干扰载体为将序列表中的序列1所示的dna分子通过同源重组插入ph7gwiwg2(ii)中得到的载体;具体为将序列表中的序列1所示的dna分子通过同源重组正向插入和反向插入ph7gwiwg2(ii)中得到的载体。上述rna干扰载体按照如下方法制备:1)将序列表中序列1所示的dna分子与pdonr221载体进行bp反应,得到中间载体;2)将所述中间载体与ph7gwiwg2(ii)载体进行lr反应,得到rna干扰载体。上述序列表中序列1所示的dna分子具体通过如下方法制备:以水稻的cdna为模板,用引物对a进行pcr扩增,得到pcr产物即为序列表中序列1所示的dna分子。所述引物对a由序列表中序列3所示的单链dna和序列4组成的单链dna组成。含有上述的rna干扰载体的重组菌或转基因细胞系也是本发明保护的范围。上述的rna干扰载体、上述的重组菌或转基因细胞系在培育水稻不育系或降低水稻育性的应用也是本发明保护的范围。本发明的第二个目的是提供一种培育转基因植物的方法。本发明提供的方法,为将上述的rna干扰载体导入目的植物,得到转基因植物;所述转基因植物为如下1)或2):1)不育转基因植物或2)所述转基因植物的育性低于所述目的植物;所述目的植物具体为单子叶植物;所述单子叶植物进一步具体为水稻。由上述的方法得到的转基因植物也是本发明保护的范围;所述转基因植物为不育转基因植物或育性减低的转基因植物;所述植物具体为单子叶植物;所述单子叶植物进一步具体为水稻。上述育性减低的转基因植物为转基因植物的育性低于目的植物的转基因植物。本发明的第三个目的是提供一种将目的植物培育为不育突变体或育性降低突变体的方法。本发明提供的方法,包括如下步骤:1)诱变目的植物种子和设计用于特异扩增目的植物中的三萜合酶编码基因的引物对b及标记荧光标记物的引物对b;所述诱变目的植物种子为用叠氮化钠诱变多粒目的植物种子,得到诱变种子;所述设计用于特异扩增目的植物中的三萜合酶编码基因的引物对b为根据所述目的植物中的三萜合酶编码基因设计用于特异扩增的引物对b,所述标记荧光标记物的引物对b中的每条引物标记不同荧光标记物,所述不同荧光标记物的波长不同;2)将所述诱变种子培养,得到第一代突变m1代群体;将所述第一代突变m1代群体自交,得到第二代突变m2代群体;3)提取第二代突变m2代群体中单株的基因组dna;将n个m2代单株的基因组dna混合得到一个dna池;n为2-8;4)以每个所述dna池为模板,用所述引物对b和所述标记荧光标记物的引物对b共同作为引物进行扩增,得到pcr产物;5)将所述pcr产物经核酸内切酶celi酶切,得到dna池对应酶切产物;6)电泳检测每一个所述dna池对应酶切产物,若所述dna池对应酶切产物在不同荧光标记物对应的波长下均产生亮点,则所述dna池对应的n个m2代单株中有或候选有育性降低突变体或者不育突变体;若所述dna池对应酶切产物在不同荧光标记物对应的波长下没有均产生亮点,则所述dna池对应的n个m2代单株中没有或候选没有育性降低突变体或者不育突变体;所述育性降低突变体为育性低于所述目的植物的植株。上述方法中,在所述步骤6)后还包括如下步骤:将有或候选有育性降低突变体或者不育突变体的n个m2代m2代单株的基因组dna分别与所述目的植物的基因组dna混合作为模板,重复步骤4)-5),得到m2代单株对应的酶切产物;电泳检测每一个所述m2代单株m2代单株对应的酶切产物,若所述m2代单株对应的酶切产物在不同荧光标记物对应波长下均产生亮点,则所述m2代单株为或候选为不育突变体或育性降低突变体;若所述m2代单株对应的酶切产物在不同荧光标记物对应波长下没有均产生亮点,则所述m2代单株不为或候选不为不育突变体或育性降低突变体。上述方法中,步骤1)中,所述叠氮化钠诱变多粒目的植物种子为将所述多粒目的植物种子浸泡在浓度为2mm的叠氮化钠水溶液中6h;室温浸泡即可。所述三萜合酶的氨基酸序列为序列表中的序列2;所述不同荧光标记物为波长为682nm的荧光标记物dy-682和波长为782nm的荧光标记物dy-782;所述三萜合酶编码基因的核苷酸序列具体为序列表中的序列5;所述引物对b为如下1)-3)中的任意一种:1)由序列表中序列6所示的单链dna分子和序列表中序列7所示的单链dna分子组成;2)由序列表中序列8所示的单链dna分子和序列表中序列9所示的单链dna分子组成;3)由序列表中序列10所示的单链dna分子和序列表中序列11所示的单链dna分子组成;所述目的植物为单子叶植物;所述单子叶植物为单子叶禾本科植物;所述单子叶禾本科植物具体为水稻。上述育性降低突变体为育性低于目的植物的突变体,在具体实施例中,目的植物具体为水稻,育性降低突变体具体为育性低于水稻的突变体。由上述的方法制备的不育突变体或育性降低突变体也是本发明保护的范围。上述育性降低突变体,其保藏号为cgmccno.6150。上述的转基因植物或上述的不育突变体或育性降低突变体在杂交制种中的应用也是本发明保护的范围。上述育性降低突变体为育性低于目的植物的突变体,所述目的植物为单子叶植物;所述单子叶植物为单子叶禾本科植物;所述单子叶禾本科植物具体为水稻;在具体实施例中,育性降低突变体具体为育性低于水稻的突变体。本发明的第四个目的是提供一种获得不育突变体或育性降低突变体的方法。本发明提供的方法,为沉默或失活目的植物中的三萜合酶编码基因,得到不育突变体或育性降低突变体;所述育性降低突变体为育性低于所述目的植物的植株。上述方法中,所述目的植物为单子叶植物或双子叶植物;所述单子叶植物具体为单子叶禾本科植物;所述单子叶禾本科植物为水稻、小麦、大麦、高粱或玉米;所述水稻的三萜合酶的氨基酸序列为序列表中的序列2;所述水稻的三萜合酶编码基因的核苷酸序列为序列表中的序列5;所述小麦的三萜合酶的氨基酸序列为序列表中的序列15;所述小麦的三萜合酶编码基因的核苷酸序列为序列表中的序列14;所述大麦的三萜合酶的氨基酸序列为序列表中的序列17;所述大麦的三萜合酶编码基因的核苷酸序列为序列表中的序列16;所述高粱的三萜合酶的氨基酸序列为序列表中的序列18;所述高粱的三萜合酶编码基因的核苷酸序列为序列表中的序列19;所述玉米的三萜合酶的氨基酸序列为序列表中的序列20;所述玉米的三萜合酶编码基因的核苷酸序列为序列表中的序列21。上述沉默或失活目的植物中的三萜合酶编码基因的方式具体可以采用rna干扰目的植物中三萜合酶编码基因表达或点突变目的植物中三萜合酶编码基因;上述方法中,所述沉默或失活水稻中的三萜合酶编码基因为如下1)-3)中至少一种:1)将所述水稻中的三萜合酶编码基因的第764核苷酸残基g突变为a;2)将所述水稻中的三萜合酶编码基因的第809核苷酸残基g突变为a;3)将所述水稻中的三萜合酶编码基因的第1431核苷酸残基g突变为a。本发明的第五个目的是提供一种恢复或提高出发植物育性的方法。本发明提供的方法,包括如下步骤:在出发植物的开花期,保持植物花序生长湿度为80-100%;所述出发植物为不育突变体或育性降低突变体。上述方法中,所述不育突变体或育性降低突变体为上述的转基因植物或上述的不育突变体或育性降低突变体。上述方法中,所述保持植物花序生长湿度的时间为1周;所述保持植物花序生长湿度的方法为将所述出发植物的整个花序包裹;所述包裹具体采用塑料袋套在整个花序上或保鲜膜覆盖整个花序。上述筛选的育性降低突变体p34e8为ososc8突变株(即为突变体s6),已于2012年05月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏号为cgmccno.6150,分类命名为水稻oryzasativa。本本发明的实验证明,本发明提供了多种制备不育系或者育性降低株系的方法;包括rna干扰或者tilling(targetinginducedlocallesionsingenomes)技术筛选;这些方法均是针对沉默三萜合酶编码基因表达实现的;本发明还提供了恢复或提高育性的方法。用本发明的方法制备得到的不育系为水稻杂种优势和杂交育种奠定了基础。除非特别指出或是单独定义,本文所使用的科学和技术术语具有本发明所属领域技术人员共知的、无歧义的相同含义。另外,本文所述的材料、方法以及实施案例本意在于说明和阐述而非限制或限定。附图说明图1为rnai株系蛋白的westernblot检测结果。图2为rnai株系的自然结实率和保湿处理后结实率统计结果。图3为检测到的突变体的电泳图。图4为野生型(wt)和突变体(p34e8)的花序(a、b)、小花(c、d,bars=0.5cm)、碘-碘化钾染色(e、f,bars=100μm)和alexander染色(g、h,bars=100μm)。图5为野生型(wt)和突变体(p34e8)花粉在培养液中的萌发情况,bars=100μm。图6为不同时间野生型(wt)和突变体(p34e8)花粉在柱头上的粘附、萌发情况,bars=100μm。图7为野生型(wt)和突变体(p34e8)正反交后花粉在柱头上的粘附、萌发情况,bars=100μm。图8为野生型(wt)、突变体(p34e8)及保湿处理后纯合突变体花序结实情况,bars=2cm。图9为大麦和小麦中同源基因的片段的扩增。图10为禾本科作物中ososc8的同源蛋白序列的比对和可能有效的突变位点。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中的定量试验均重复三次,结果取平均值或平均值±标准差。水稻中三萜合酶ososc8蛋白的氨基酸序列为序列表中的序列2;编码该蛋白的基因的核苷酸序列为序列表中的序列5。实施例1、rna干扰制备育性降低的转基因水稻一、ososc8的rna干扰载体的获得1、gateway中间载体pdonr221/osc8-1的获得根据ososc8的基因序列涉及引物如下:引物对采用invitrogen公司gateway技术,在正义链引物5′端加入attb1序列,反义链引物5′端加入attb2序列。引物对1:sense:5′-aaaaagcaggctggctgcacggatagagtt-3′(序列3)antisense:5′-agaaagctgggtgcctgtatggctgagaaa-3′(序列4)提取水稻中花11(orazysatival.sspjaponica;记载在zhong-hairenetal.,2005,aricequantitativetraitlocusforsalttoleranceencodesasodiumtransporter.naturegenetics37,1141-1146;公众可从中国科学院植物研究所获得)总rna,反转录得到cdna。以上述得到的cdna为模板,用引物对1进行pcr扩增,得到大小为200bp左右的片段1;经过测序,片段1的核苷酸序列为序列表中的序列1;引物对1各2pmol,pcrmix(genestara112-01)10ul,cdna2ul,加水至20ul,pcr程序94℃3分钟,30次循环(94℃30秒,55℃30秒,72℃30秒),72℃,10分钟。将得到的片段1等摩尔与pdonr221载体(invitrogen12535-037)混合,在25度下保温1小时,即进行bp反应(invitrogen11789-020)生成入门载体,热击转化大肠杆菌dh5α,涂布在饱含50mg/l卡那霉素的lb平板上,培养过夜得到转化子(简单原理:由于原质粒pdonr221包含一段致死基因ccdb,其转化子不能成活,只有将ccdb基因替换为外源片段的菌落才能生长)。bp反应程序:25℃孵育1h后,加入1μl蛋白酶k,混匀后37℃孵育10min。将转化子进行菌落pcr,用引物对1进行pcr扩增,将能够得到200bppcr产物条带的单菌落保存为阳性克隆。取阳性克隆的质粒,送去测序,结果为阳性克隆的质粒为将序列表中的序列1插入pdonr221载体中得到的载体,命名为pdonr/osc8-1。2、gateway终端载体ph7gwiwgii-osc8-1的获得(即ososc8rnai干扰载体)将上述1得到的载体pdonr/osc8-1与ph7gwiwg2(ii)(dammeetal.,somaticcytokinesisandpollenmaturationinarabidopsisdependontplate,whichhasdomainssimilartocoatproteins.plantcell,2006,18:3502-3518,公众可从中国科学院植物研究所获得)进行等摩尔混合,在25度保温1小时,即进行lr反应(invitrigen11791-020),混合物热击转化大肠杆菌dh5α,涂布到含有100mg/l的壮观霉素平板上,37度培养过夜,分别得到转化子(原理同bp反应)。lr反应程序:25℃孵育1h后,加入2μl蛋白酶k,混匀后37℃孵育10min。提取转化子中单个菌落的质粒,送去测序,结果为转化子单克隆中包含的质粒命名为ph7gwiwgii-osc8-1,其包括正向插入ph7gwiwg2(ii)载体的序列表中的序列1所示的dna分子和反向插入ph7gwiwg2(ii)载体的序列表中的序列1所示的dna分子,为rna干扰载体。二、ososc8的rna干扰载体获得育性降低的转基因植物1、重组农杆菌的获得将由上述一得到的rna干扰载体ph7gwiwgii-osc8-1在1800v电击转化农杆菌(agrobacteriumtumefaciens)eha105(klpierseta.,1996,agrobacteriumtumefaciens-mediatedtransformationofyeast.pnasfebruary20,vol.93no.41613-1618;公众可从中国科学院植物研究所获得),得到转化子。28℃培养两天后挑取转化子单克隆,摇菌后pcr鉴定(用引物对1扩增),得到200bp片段为阳性克隆,命名为eha105/ph7gwiwgii-osc8-1,15%甘油-80℃保菌。2、rna干扰转基因植物的获得1)水稻愈伤培养a)在超净台放入灭菌ddh2o、70%乙醇、1%升汞及容量为100ml的灭菌三角瓶,然后关上玻璃窗,紫外灭菌30min后开启,b)将水稻中花11(以下也称为野生型水稻)种子倒入灭菌三角瓶中,用灭菌ddh2o清洗种子3次,除去种子表面的杂质及漂浮的种子。c)倒掉ddh2o,用70%乙醇对种子消毒8min,不时地摇晃,使其充分消毒。d)倒掉70%乙醇,用1%升汞灭菌8min,用量不宜过多,没过种子表面即可。e)倒掉1%升汞,用灭菌ddh2o冲洗种子4遍,然后加入适量灭菌ddh2o(液面高于种子表面1cm),封上封口膜,浸泡12h。f)在无菌条件下切下水稻种子的成熟胚,接种于诱导培养基nb2上,25℃暗培养3-4周。g)将成熟胚上长出的愈伤块切下,转入继代培养基nb1上,25℃暗培养2周。h)将状态好的愈伤块切成绿豆大小的愈伤块,转至nb1培养基上,25℃暗培养4天。2)农杆菌制备及转化a)将eha105/ph7gwiwgii-osc8-1以1∶100的比例接种于yeb+rif+spe液体培养基(即含有25mg/l利福平及100mg/l壮观霉素的yeb培养基,请提供各抗生素的浓度)中,28℃230rpm培养23h。b)再将培养好的菌液以1∶50接种于yeb+rif+spe液体培养基中,28℃230rpm培养至od600达到0.5,无菌条件下收集菌液至50ml灭菌离心管中,4000g离心5min收集菌体,倒掉上清液。c)用50mlaam-as培养基在100ml灭菌三角瓶中重悬收集的农杆菌菌体,在摇床中振荡45min,使菌体均匀地分散在培养基中。d)将预培养4天的上述1)得到的愈伤块浸没于重悬的菌液中,侵染5-10min,偶尔摇一下三角瓶。e)弃菌液,将愈伤块倒在无菌滤纸上,吸干菌液后转移至共培养培养基nb2c上(预先在培养基表面垫一层大小合适无菌滤纸),25℃暗培养4天,得到共培养4天后的愈伤块。3)、阳性愈伤筛选及再生a)将上述2)中共培养4天后的愈伤块小心转移到含有潮霉素(20mg/l)和特美汀(225mg/l)抗生素的nb1培养基上,25℃暗培养2周,筛选阳性转化子。b)弃掉第一次筛选过程中长菌的愈伤块,剩下的转入含有潮霉素(20mg/l)和特美汀(180mg/l)抗生素的nb1培养基上,25℃暗培养2周,进行第二次筛选。c)弃掉第二次筛选过程中长菌的愈伤块,剩下的转入含有潮霉素(50mg/l)和特美汀(180mg/l)抗生素的nb1培养基上,25℃暗培养2周,进行第三次筛选。d)待愈伤块长至0.5-0.8cm大时,在荧光显微镜下进行镜检,挑选带有绿色荧光的愈伤块,转移至再生培养基dr1中,暗培养1周后再在光照下培养(光照温度23度、强度5000lux、周期白天12h/晚上12h)1周。e)将再生出小苗或愈伤块一起转移至再生培养基dr2中,光照培养(同上)2周。f)当再生苗长至8cm左右时,将苗移出,移至草碳土中,28℃玻璃温室中培养,得到30株t0代rna干扰转基因水稻。采用同样的方法将pdonr221和ph7gwiwg2(ii)混合进行lr反应,得到rna干扰空载体;再将rna干扰空载体通过农杆菌转入野生型水稻中,得到转空载体水稻rnai-ck-3。上述所用部分培养基配方如下表1-4:表1为培养基配方成分nb1(1l)nb2(1l)nb2c(1l)n6大量(10×)100ml100ml100mlfe盐(100×)10ml10ml10ml肌醇(100×)10ml10ml10mlb5有机(100×)10ml10ml10mlb5微量(1000×)1ml1ml1ml2,4-d(1mg/ml)0.52ml2mll-glutamine0.5g0.5g0.5gl-proline0.5g0.5g0.5gch(酸水解酪蛋白)0.3g0.3g0.3g蔗糖30g30g30g葡萄糖10gas(50mg/ml)2ml调节ph值5.85.85.2表2为aam-as培养基3、rna干扰转基因水稻的westernblot检测待上述2得到的t0代rna干扰转基因水稻孕穗时,取液泡化时期的幼穗,提取蛋白,westernblot检测(抗体为ososc8蛋白的多抗;将ososc8蛋白免疫兔得到的兔血清;也可以为上海艾比玛特定制的ososc8蛋白的单克隆抗体。)ososc8蛋白含量。结果如图1所示,其中,zh11为野生型水稻,编号为rnai-9、rnai-12、rnai-20、rnai-21的为t0代rna干扰转基因水稻,rnai-ck-3为转空载体水稻;可以看出,转基因水稻rnai-9、rnai-12和rnai-20的ososc8的表达明显降低,而对照组rnai-ck-3和野生型水稻中的ososc8表达相当。说明编号为rnai-9、rnai-12、rnai-20、rnai-21为阳性t0代rna干扰转基因水稻,为通过rna干扰沉默了水稻中ososc8基因表达得到的突变体。4、rna干扰转基因水稻结实率统计自然结实:将经过上述3鉴定的编号为rnai-9、rnai-12、rnai-20、rnai-21的t0代rna干扰转基因水稻种植于18℃/25℃(黑夜/白天),自然光照的玻璃温室中。生长条件:温度18℃/30℃(黑夜/白天),湿度30%-50%,自然光照。待t0代rna干扰转基因水稻开花4周后统计每个穗上的结实率,以转空载体水稻rnai-ck-3和野生型水稻zh11为对照;每个转基因植物统计5穗,结果取平均值±标准差。结实率=饱满粒占总粒数(饱满粒数+空粒数)的百分比;结果如图2,自然结实条件下,野生型水稻zh11、编号为rnai-9、rnai-12、rnai-20、rnai-21的t0代rna干扰转基因水稻的结实率分别为93.5±5.3%、42.1±15.3%、37.9±3.9%、18.6±16.1、81.1±6.1%。转空载体水稻rnai-ck-3和野生型水稻无显著差异。可见t0代rna干扰转基因水稻的自然结实率下降至40%以下,其中rnai-20的下降至20%以下,而野生型水稻的自然结实率在80%以上。说明通过rna干扰了水稻中ososc8基因表达得到的t0代rna干扰转基因水稻,与野生型水稻相比育性降低;筛选更多的转基因植物,可以获得不育的转基因水稻。实施例2、利用tilling技术筛选获得育性减低突变体一、利用tilling技术筛选育性减低突变体1、诱变目的植物种子和用于特异扩增目的植物中的三萜合酶编码基因的引物对的设计1)诱变目的植物种子2mm叠氮化钠水溶液在室温25℃浸泡处理2万粒中花11号水稻种子6小时,得到诱变种子。2)引物设计根据水稻三萜合酶编码基因ososc8设计用于特异扩增该基因的引物对,序列分别为:引物对2:正向引物ososc8t1f:gaggtcaagtcgtcttctgcaatta(序列6);反向引物ososc8t1r:atttgtctgcgctctgcacatg(序列7);引物对3:正向引物ososc8t13f:gcttaaaggtaaatttcaggcttcc(序列8);反向引物ososc8t13r:cgatcagaatcaattaaacccagac(序列9);引物对4:正向引物ososc8t17f:tcatccttagattaattagccgaca(序列10);反向引物ososc8t17r:cataaggatctcataaaatcgacca(序列11);上述每个引物对中的不同引物标记不同波长的荧光标记物;不同波长的荧光标记物为波长为682nm的荧光染料dy-682(eurofinsdnacampusebersberg,germany)和波长为782nm的荧光染料dy-782(eurofinsdnacampusebersberg,germany)。所有正向引物标记用dy-682荧光标记5’末端(dy-682),而所有反向引物用dy-782荧光标记5’末端(dy-782)。2、培养将上述得到的诱变种子清水冲洗,大田种植培养,得到第一代突变m1代群体;将第一代突变m1代群体自交,得到第二代突变m2代群体;第二代突变m2代群体自交,收获保存m3代突变群体种子。3、dna提取及基因池的构建收第二代突变m2代群体的种子,每个m2代突变群体株系随机种植12株,提取第二代突变m2代群体中单株的基因组dna;-20度保存备用。将4个m2代单株的基因组dna混合(等质量混合)得到一个dna池;检测及定量dna浓度,并将dna浓度均一化。4、pcr扩增以上述每一个dna池为模板,分别用引物对2、3、4进行pcr扩增,得到3种pcr扩增产物;pcr扩增的程序与体系如下:表7pcr体系母液1个反应10ul(体系)×104dntp(2.5mm)0.8μl83.2μl10×buffer1μl104μl带荧光标记的正向引物(10μm)0.096μl9.984μl不带标记的正向引物(10μm)0.064μl6.656μl带荧光标记反向引物(10μm)0.128μl13.312μl不带标记的反向引物(10μm)0.032μl3.328μlextaq0.1μl10.4μldd水5.78μl601.12μldna2μlpcr运行完后避光放在冰上。5、酶切将上述4得到的每一个dna池的每一种pcr产物用celi酶切,得到酶切产物;酶切体系如下表8所示:表8celi酶切体系母液1个反应15ul(体系)×104pcrproducts9ulceli0.1ul10.4ul10×celibuffer1.5ul156uldd水4.45ul462.8ul酶切的程序:45℃酶切15min.6、电泳检测1)电泳将上述经过5得到的各个dna池的每一种pcr产物对应的酶切产物均回收后电泳,每一个泳道的样品为一个dna池的每一种pcr产物对应的酶切产物:回收:15ul酶切样品+20ul水+5ul0.225medta+60ul异丙醇,盖上硅胶盖,上下颠倒30下,然后室温避光15min后,3000转4℃离心30min。离心停止后,倒掉上清,然后把96孔板倒扣在纸上,3000转4℃瞬时离心10s。在96孔板中的沉淀中加入100ul75%的酒精,盖上硅胶盖,上下颠倒30下,3000转4℃离心20min。重复2步。把样品板放在通风厨中凉2min,彻底没有酒精味后用5ulloadingbuffer溶解沉淀,然后在振荡器上振荡5s,瞬时离心10s。85℃变性10min。电泳:20ml6%的胶(商品胶)100ulap(-20℃)25ultemed(4℃)迅速混匀85℃变性样品10min后发放在冰上10min。表9电泳的条件pre-runrunvolts(v)15001500current(ma)4040power(w)4040time10min3hrtemperature(℃)4545在预电泳的10min时间内,把0.45ul样品迅速的点在100孔的纸梳子上,在被吸干净tbe的梳子孔中加入1ml1%的ficoll,把点好样品的梳子迅速插入孔中。运行li-cor4300。运行时间根据扩增片段的长短而不同运行3hr。2)数据分析将上述电泳结果的图片用adobephotoshop8.0处理,把模式从16位通道改成8位通道,旋转图片,把图片设置成宽20cm,高27cm,并取消限定比率。然后调整亮度及对比度,最后用jpeg保存。用gelbuddy分析,在682nm和782nm下观察。电泳检测每个dna池对应酶切产物,确定育性降低突变体或者不育突变体:若所述dna池对应酶切产物在不同荧光标记物对应的波长下均产生亮点,则所述dna池对应的n个m2代单株中有或候选有育性降低突变体或者不育突变体;若所述dna池对应酶切产物在不同荧光标记物对应的波长下没有均产生亮点,则所述dna池对应的n个m2代单株中没有或候选没有育性降低突变体或者不育突变体;所述育性降低突变体为育性低于所述目的植物的植株。上述方法可以直接判断三萜合酶编码基因是否产生点突变:若所述dna池对应酶切产物在不同荧光标记物对应的波长下均产生亮点,则所述dna池中三萜合酶编码基因产生或候选产生点突变;若所述dna池对应酶切产物在不同荧光标记物对应的波长下没有均产生亮点,则所述dna池中三萜合酶编码基因未产生或候选未产生点突变。部分结果如图3所示,左边图片是dy-682的结果,右边图片是dy-782的结果,箭头所指的是突变体,箭头1所指一个突变体,箭头2所指另外一个突变体;可以看出,在dy682和dy782下,有两个泳道对应的dna池对应酶切产物均产生亮点,说明这两个dna池分别对应的4个m2代单株中有不育突变体或育性降低突变体。为了进一步确定具体哪个单株为突变体;将上述鉴定有不育突变体或育性降低突变体的任一dna池对应的4个m2单株的基因组dna分别均与野生型水稻基因组dna(等质量混合)作为模板;重复步骤4-5,得到m2代单株对应的酶切产物;回收m2代单株对应的酶切产物电泳,每一个泳道的样品为每个m2单株的基因组dna的每个pcr产物对应的酶切产物;每个泳道对应一个m2单株的基因组dna;若所述m2代单株对应的酶切产物在不同荧光标记物对应波长下均产生亮点,则所述m2代单株为或候选为不育突变体或育性降低突变体;若所述m2代单株对应的酶切产物在不同荧光标记物对应波长下没有均产生亮点,则所述m2代单株不为或候选不为不育突变体或育性降低突变体。同时确定该泳道为哪对特异扩增引物对的pcr产物的酶切产物(根据亮点所在泳道为哪对特异扩增引物对扩增的pcr产物的酶切产物,确定对应的特异扩增产物),以其作为后面的验证引物。共筛选出3个m2代单株育性降低突变体:p34e8、4928和1708,同时也是三萜合酶编码基因ososc8突变体,并同时筛选该突变体对应的特异扩增引物对如下:引物对2用于筛选p34e8、4928,引物对3用于筛选1708。二、验证tilling技术筛选育性减低系1、分子验证三萜合酶编码基因点突变将上述筛选出3个m2单株育性降低突变体:p34e8、4928和1708,提取rna,反转录得到cdna为模板,用引物对1进行pcr扩增,测序pcr产物,结果筛选出3个突变体p34e8、4928和1708的突变位点如下表10所示:表10为每个突变体突变的位置及引起氨基酸变化的情况突变体编号核苷酸变化氨基酸变化p34e8g764aw255-4928g809ag270e1708g1431ar477k上述表中的氨基酸和核苷酸的位点为在野生型水稻的ososc8的蛋白(氨基酸序列为序列2)和基因(核苷酸序列为序列5)对应的序列的位置。p34e8为将序列表中的序列2自n’末端第255的氨基酸残基trp突变为终止密码子;将序列表中的序列5自5’末端第764的g突变为a;4928为将序列表中的序列2自n’末端第270的氨基酸残基gly突变为glu;将序列表中的序列5自5’末端第809的g突变为a;1708为将序列表中的序列2自n’末端第477的氨基酸残基gly突变为lys;将序列表中的序列5自5’末端第1431的g突变为a;上述筛选的突变体p34e8为ososc8突变株,已于2012年05月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏号为cgmccno.6150,分类命名为水稻oryzasativa。2、tilling筛选不育系的表型鉴定以下实验采用3个育性降低突变体p34e8、4928和1708的m3代种子。1)、突变体的结实率统计(1)将上述一得到的3个育性降低突变体p34e8、4928和1708的种子分别种植于18℃/25℃(黑夜/白天),自然光照的玻璃温室中;生长条件:温度18℃/30℃(黑夜/白天),湿度30%-50%,自然光照。(2)水稻开花2周后即能观察出小花的结实率;统计5个穗,实验重复三次,结果取平均值±标准差。以野生型水稻为对照。结果野生型水稻结实率为94.81%±1.34%,突变体p34e8结实率仅为1.85%±0.49%,突变体4928和突变体1708的结实率分别为4.38%±0.24%和3.87%±0.36%;说明筛选得到的突变体p34e8、4928和1708,与野生型水稻相比育性降低。2)突变体的育性表型鉴定将上述一得到的育性降低的突变体p34e8(s6)种子种植于18℃/25℃(黑夜/白天),自然光照的玻璃温室中。生长条件:温度18℃/30℃(黑夜/白天),湿度30%-50%,自然光照。(1)分蘖在营养生长期间(播种后50-70天)对突变体p34e8和野生型水稻进行观察,二者都生长正常,均具3-5个分蘖,突变体p34e8未表现出异常性状。(2)花器官播种14周后突变体p34e8(s6)和野生型水稻开始抽穗开花,突变体p34e8和野生型在花序性状、小花形态、花器官数量及大小方面进行观察。结果为突变体p34e8(s6)具有正常的圆锥形花序及长圆形小花,小花具有一套完整的花器官:1枚外稃、1枚内稃、6枚雄蕊、1枚雌蕊(具二裂羽毛状柱头)、2枚浆片,花器官大小发育正常(见图4中a、b、c、d),与野生型相比无改变。将突变体p34e8(s6)和野生型水稻花粉进行碘-碘化钾染色(碘化钾3g,1g碘,稀释至300ml)。5分钟后于显微镜下观察(显微镜型号:olympusbx51)。染色结果表明:突变体与野生型花粉都遇碘变蓝黑色,表明其淀粉积累正常(见图4中e、f)。将突变体p34e8(s6)及野生型花粉进行alexander染色(参考alexandermp.,1969,staintechnol,44:117-122).染色液先配制成50倍的母液:无水乙醇10ml,1%孔雀石绿(95%乙醇配制)1ml,苯酚5g,水合氯醛5g,1%酸性品红水溶液5ml,1%橙黄g水溶液0.5ml,冰醋酸2ml,甘油25ml,蒸馏水定容至100ml,在棕色瓶中保存,用前稀释,母液∶蒸馏水=3∶47(v∶v))。染色方法同碘-碘化钾染色。染色结果表明:突变体与野生型花粉都被染成紫红色,表明其花粉是有活力的(见图4中g、h)。突变体p34e8(s6)及野生型水稻花粉进行体外萌发检测其活力,具体为花粉在如下培养液中培养,培养液的成分:20%蔗糖,10%peg4000,40mg/l硼酸,3mmol/l硝酸钙,3mg/l维生素b1。检测方法:在载玻片上滴2-3滴培养液,取小花刚张开即将散粉时的花药于培养液中,用尖头镊子把花药夹碎,夹出大块的花药壁,盖盖玻片,放至铺有湿润纱布(保湿)的大培养皿中,30℃培养箱中培养,30分钟后观察。观察结果表明:野生型水稻花粉萌发率最高可达82.8%,突变体p34e8(s6)花粉萌发率最高可达80%,由此可知突变体花粉在体外萌发实验中活力良好(见图5)。(3)花粉粒粘附柱头的能力突变体p34e8(s6)及野生型花粉进行体内萌发检测其在柱头上的活力。胼胝质是β-1、3-葡聚糖,通常分布于高等植物的筛管、新形成的细胞壁、花粉粒以及花粉管中,将其用水溶性苯胺蓝染色后,在紫外光激发下,可发出黄至黄绿色的荧光。因此,把授粉后经苯胺蓝染色的子房放到荧光显微镜下观察,可看到花粉在柱头上萌发、花粉管发育的状态,以及胼胝质在柱头表面的沉积状况等,进而判断花粉与柱头是否亲和。方法(参考endometal.,2009,plantcellphysiol,50:1911-1922):取授粉后不同时间的水稻小花,固定于卡诺固定液(无水乙醇∶冰醋酸=3∶1(v∶v))中,固定液体积至少为所取材料的10倍,固定30min-2h(不超过24h,否则组织变脆),经95%乙醇5min、70%乙醇5min、蒸馏水5min处理,目的洗去冰醋酸,然后用1nnaoh60℃软化处理30min,把软化后的材料用蒸馏水冲洗三次(除去大部分氢氧化钠,此时材料很脆,小心操作),每次5min,冲洗后滴加0.1%水溶性苯胺蓝染液(anilineblue,国药集团化学试剂有限公司,用0.1m磷酸钾水溶液配制),染液浸没材料即可,避光染色1h左右,在载玻片上滴一滴50%甘油,用镊子取出染色后的小花,分离出柱头,大致摆正二裂羽毛状柱头的方向,盖上盖玻片,轻轻敲压使花柱展开(不要太用力),uv荧光显微镜(显微镜型号:olympusbx51)下观察。观察结果见图6所示,表明授粉后5min时野生型即有部分花粉粒粘附,随时间延长粘附花粉粒增多,20min时花粉管已经开始延伸,至60min时已有花粉管进入胚珠,但与之相对应的时间内,突变体皆表现出花粉粒很少或不粘附柱头的情况,进一步证明突变体p34e8(s6)的育性降低是由于花粉粘附柱头的能力降低或者花粉粒不粘附柱头引起的。为验证突变体p34e8(s6)花粉粒不粘附柱头的情况是由花粉粒本身引起,还是由柱头变化引起,将突变体p34e8(s6)与野生型进行杂交:取未开裂的野生型花药授粉于突变体柱头,以及取未开裂的突变体花药授粉于野生型柱头,于授粉后20min及60min后取柱头经卡诺固定液固定、苯胺蓝染色后检测花粉在柱头上的粘附及萌发情况。检测结果见图7,表明野生型花粉能够在纯合突变体柱头上粘附、萌发并进入胚珠,而突变体花粉不能够粘附野生型柱头,这说明突变体花粉不能够粘附柱头是由花粉本身引起的,与柱头无关。上述实验进一步证明突变体p34e8(s6)与野生型水稻相比,育性下降,且育性降低是由于花粉粘附柱头能力降低或者花粉粒不粘附柱头引起的。采用同样的方法鉴定突变体4928和1708采用上述方法鉴定,结果与突变体p34e8(s6)无显著差异,育性均比野生型水稻降低,且育性降低是由于花粉粒不粘附柱头引起的。上述结果表明突变三萜合酶编码基因可以导致水稻育性降低,因此,利用tilling筛选方法可以用来获得育性降低水稻,甚至于获得不育水稻。实施例3、恢复育性或者提高育性以下实验采用育性降低突变体p34e8的m3代种子。保湿处理:将上述由实施例1得到的rnai-9、rnai-12、rnai-20、rnai-21的t0代rna干扰转基因水稻和由实施例2得到的突变体p34e8(s6)播种;在水稻开花期(播种后第80天-第100天为开花期),保持水稻花序生长湿度为80-100%,一周后恢复自然湿度(自然湿度40-60%);具体保持水稻花序生长湿度的方法如下:对水稻整个花序用塑料袋(规格:长×宽=27cm×15cm)套在整个花序上,塑料袋开口处用曲别针别住,或者用保鲜膜覆盖整个花序,因为保鲜膜容易贴在一起,不需要用曲别针别住。水稻花序开花顺序从上往下开,整个花序开花期约1周,等整个花序开完花后,要及时去掉包裹的塑料袋或者保鲜膜,因为包裹时会聚集很多水汽,湿度过大对后期结实影响不好。统计5个穗结实率,实验重复三次,结果取平均值±标准差。以野生型水稻zh11(wt)为对照。野生型水稻zh11、由实施例1得到的rnai-9、rnai-12、rnai-20、rnai-21的t0代rna干扰转基因水稻在保湿处理后的保湿结实率见图2所示,野生型水稻zh11、由实施例1得到的rnai-9、rnai-12、rnai-20、rnai-21的t0代rna干扰转基因水稻在保湿处理后的保湿结实率分别为89.9±1.8%,78.9±11.3%,60.2±3.9%,85.2±16.18%,80.3±3.9%;而未经保湿处理的rnai-9、rnai-12、rnai-20、rnai-21的结实率仅为42.1±15.3%、37.9±3.9%、18.6±16.1、81.1±6.1%。突变体p34e8(s6)在保湿处理后结实表型见图8所示,图中可以看出,突变体p34e8经保湿处理后结实大大提高。统计结实率,突变体p34e8经保湿处理后结实率可达76.25%±3.88%,而未经保湿处理的突变体p34e8结实率仅为1.85%±0.49%。表明,保持水稻花序生长湿度处理可以恢复育性或者提高育性。实施例4、育性减低突变体p34e8(s6)在育种中的应用以下实验采用育性降低突变体4928、p34e8(s6)的m3代种子。制备杂交水稻种子:将由实施例2得到的育性减低突变体4928、p34e8分别和野生型水稻中花11和水稻9311(junyu,songnianhu,junwang,ganeka-shuwong,....jianwang,lihuangzhu,longpingyuan,huanmingyang.adraftsequenceoftherice(oryzasativassp.indica)genome.science.296:79-92,2002;公众可从中国科学院植物研究所获得)进行杂交水稻制种配组,每组包含30棵突变体植株,和间隔种植的适量野生型植株,用于提供花粉,并设3个重复。同时,育性减低突变体4928和p34e8(s6)分别单独分组种植自交,每组30棵,也设3个重复,作为对照组。在扬花期2012.8.20-2012.9.1期间进行人工赶粉,具体方法为:用大约2米长的竹竿轻轻拍打野生型水稻花序5-10次,使得花粉向突变体花序散去,每天11点和1点各一次,对照组不做处理。成熟期后每个杂交后和自交后的株系分别选取30棵植株,每棵植株收集1个主穗,统计结实率。结果如表11所示:表11结实率9311中花114928p34e8492828.89±3.42%31.81±2.79%7.45±1.38-p34e822.32±1.71%31.34±1.86%-12.84±1.66可以看出,突变体4928和p34e8(s6)田间的自交结实率为7.45和12.84,杂交结实率为22.32%-31.81%,估计制种亩产量大约在200-300斤,表明突变体可以用于杂交水稻育种。实施例5、来源于其他植物的与ososc8同源基因及功能推测一、克隆同源基因1)taosc1(来源小麦)和hvosc1(来源大麦)的获得根据六倍体小麦est序列,设计引物:5’端引物:5`-atgtggaagctcaagatcgc-3`(序列12);3’端引物:5`-ttagccagagcaaagtactaat-3`(序列13)。以中国春小麦(triticumaestivuml.贾继增,张正斌,k.devos,m.d.gale.小麦21条染色体rflp作图位点遗传多样性分析.中国科学(c辑:生命科学).2001(01);公众可从中国科学院植物研究所获得)和大麦varda(hordeumvulgarel.qix,niksre,stamp,lindhoutp.1998.identificationofqtlsforpartialresistancetoleafrust(pucciniahordei)inbarley.theorapplgenet,96:1205-1215;公众可从中国科学院植物研究所获得)花总rna为模板,在上述引物对的引导下,rt-pcr扩增cdna序列,反应结束后,对pcr产物进行0.8%琼脂糖凝胶电泳检测,检测结果如图9所示(左边为dna标准分子量1kblader,泳道ta为小麦的rt-pcr产物,泳道hv1和hv为大麦的rt-pcr产物,得到分子量为2-3kb之间的条带,与预期结果相符。将小麦的rt-pcr产物和大麦的rt-pcr产物均送去测序,结果如下:小麦的rt-pcr产物的基因命名为taosc1,其具有序列表中序列14的核苷酸序列,由2280个碱基组成;其开放阅读框(orf)为自5’端第1-2280位碱基,该基因编码的蛋白为taosc1,该蛋白的氨基酸序列为序列表中的序列15所示。与ososc8进行同源性比较,核苷酸和氨基酸序列的相似性分别为84.32%和85.18%。大麦的rt-pcr产物的基因命名hvosc1,其具有序列表中序列16的核苷酸序列,由2280个碱基组成;其开放阅读框(orf)为自5’端第1-2280位碱基,该基因编码的蛋白为hvosc1,该蛋白的氨基酸序列为序列表中的序列17所示;与ososc8进行同源性比较,核苷酸和氨基酸序列的相似性分别为81.58%和81.35%。2)来源于高粱(sorghumbicolorl.)srosc1和来源于玉米(zeamayl.)zmosc1由于ososc8的同源基因在单子叶禾本科植物中的功能可能非常保守,根据高粱(sorghumbicolorl.)和玉米(zeamayl.)的全基因组序列信息(http://phyto5.phytozome.net/),获得同源基因srosc1和zmosc1的推测的编码序列。来源于高粱(sorghumbicolorl.)srosc1蛋白的氨基酸序列为序列表中的序列18,该蛋白的编码基因为序列表中的序列19;来源于玉米(zeamayl.)zmosc1蛋白的氨基酸序列为序列表中的序列20,该蛋白的编码基因为序列表中的序列21。可人工合成获得上述编码基因。二、功能推测将上述获得taosc1(来源小麦)、hvosc1(来源大麦)、srosc1蛋白(来源于高粱)和zmosc1蛋白(来源于玉米)进行比较,结果如图10所示;红色箭头依次是p34e8、4928和1708突变位点,高粱、玉米、小麦和大麦在这些位点的突变可能导致类似的可恢复的不育表型;可以看出该方法可以应用在高粱、玉米、小麦和大麦的杂交育种中。因此证明ososc8的同源基因在单子叶禾本科植物中的功能非常保守。因此,根据前面实施例中对来源于水稻的ososc8研究,可以推测出其他与其同源性高的taosc1(来源小麦)、hvosc1(来源大麦)、srosc1蛋白(来源于高粱)和zmosc1蛋白(来源于玉米)的基因沉默也可以实现获得不育系。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1