一种新的鉴定向日葵对菌核病抗性水平的方法与流程
本发明建立一种在向日葵茎秆上接种核盘菌,鉴定向日葵品种抗(耐)菌核病的方法,用于筛选不同向日葵品种对菌核病的抗性(耐)水平。
背景技术:
向日葵是世界上的四大油料作物之一,在我国的种植面积达100万hm2左右,总产量为192.8万吨,仅次于油菜和大豆。然而,近年来由于轮作倒茬困难,使得向日葵病害发生面积不断扩大,发生危害程度也不断增加。向日葵菌核病是由核盘菌(sclerotiniasclerotiorum(lib.)debary)引起的一种真菌病害,该病菌是一种寄主范围十分广泛的植物病原真菌,能够侵染向日葵、油菜、大豆、花生、菜豆、胡萝卜、拟南芥等400多种植物。目前,向日葵菌核病已成为制约我国向日葵产业发展的主要病害之一。向日葵菌核病又称白腐病、烂盘病。这种病害在向日葵主产区里每年发病率在50%左右,严重时可达80%以上,对向日葵的产量和品质影响很大。主要表现为立枯型和烂盘型。立枯型:自幼苗开始到花盘形成前都能发生。幼苗期发病主要在茎基部,绕茎形成水浸状病斑,潮湿时长出白色絮状菌丝,干燥后病部收缩变细,茎内形成黑色菌核,植株呈立枯状枯死。成株期发病也以茎基部为主,呈现出淡褐色的湿润状病斑,逐渐扩大到整个植株的茎部,后期病斑干枯呈灰白色,边缘呈褐色,表皮破裂,由于茎内输导组织遭受破坏,影响养分的运输,叶片开始由下向上逐渐变黄、枯萎而脱落,最后造成整个植株枯死。烂盘型:这种病症在谢花期以后最重,当花盘受害时,在其背面出现水浸状病斑,花托呈褐色且软化。遇多雨天气,病斑迅速扩大,可穿透花盘,由背面转向正面,长出一种白色菌丝,造成花盘腐烂,使籽粒不能成熟,严重时可造成籽仁腐烂或籽粒自行脱落
筛选耐/抗菌核病的育种材料是控制菌核病发生的重要的农业措施,室内鉴定不同向日葵品种对菌核病抗性水平是向日葵育种的前提。目前,室内鉴定向日葵品种对菌核病抗性水平的主要方法为离体叶片接种法,方法相对单一。而田间向日葵菌核病多为根腐型、茎腐型和盘腐型,因此需要建立一种新的向日葵抗(耐)菌核病的方法。
申请号201110397710.9的中国专利公开了一种鉴定向日葵品种对菌核病抗性水平的鉴定方法,包括如下步骤:将活化好的核盘菌菌株接种在minum培养基上(简称m培养基),黑暗培养.然后用接菌针挑取单个菌丝琼脂块,准确接种在向日葵叶片主叶脉的两侧,置于20-25℃自然光下保湿培养,用十字交叉法量取病斑直径大小以鉴定向日葵的抗性水平,所述的m培养基含有naoh、dl-苹果酸、nh4no3、mgso4、琼脂粉。本发明的方法利用m-培养基培养核盘菌接种向日葵叶片,能够区分不同向日葵品种的抗性,为向日葵新品种的选育和抗病育种奠定基础。
现有技术中的缺陷为:菌核病一般在田间有三种症状类型,即茎基腐,茎腐和盘腐。而在叶片上形成叶腐型症状很少见。因此,传统的叶片接种法与田间向日葵核菌病致病后的表征存在差异,不能真是的反应致病水平,利用叶片接种进行鉴定得到的结果与实际结果会存在差异,不能鉴定得到最优质的具有的菌核病抗性向日葵。此外,叶片接种法将菌株接种在叶片上极易形成腐烂,不利于病斑的测量,造成鉴定结果不准确。
技术实现要素:
为了克服现有技术中的缺陷,本发明提供了一种新的鉴定向日葵对菌核病抗性水平的方法,包括以下步骤:
步骤一:核盘菌菌株活化,
步骤二:接种基质的准备,
步骤三:将步骤一得到核盘菌菌株接种于步骤二得到的接种基质上,
步骤四:鉴定向日葵对菌核病抗性水平,
所述接种为茎杆接种法,在步骤二中准备向日葵茎杆作为步骤三中核盘菌接种的基质。
接种基质选用向日葵茎秆具有以下技术效果:
1)菌核病一般在田间有三种症状类型,即茎基腐,茎腐和盘腐,而在叶片上形成叶腐型症状很少见。接种茎杆得出的结果更接近田间向日葵的致病症状,使鉴定结果更加准确。
2)茎秆与叶片的细胞组成存在很大差异,作为核菌病的接种基质,其提供的水分、营养成分以及作为基质的物理结构存在差异,因此接种后,菌株的培养情况也不同。因此,使用茎秆作为接种基质与接种叶片相比,能够使在实验室的培养更加接近田间的培养环境,使得到的病斑更加接近田间情况,是鉴定的结果更加准确。
3)茎秆接种病原菌后,病菌形成的病斑会纵向扩展形成梭形病斑,易于测量病斑大小,而接种在叶片上极易形成腐烂,不利于病斑的测量。因此,茎杆接种不仅接近于田间发病症状,而且还易于观察和测量,鉴定的结果更准确。
优选的是,步骤二中截取6片真叶的向日葵茎杆用于接种核盘菌菌株。6片真叶的向日葵茎杆更适于核菌病菌株的接种和培养,培养后的病斑更易于观察和测量。
上述任一项中优选的是,截取向日葵茎秆,冲洗干净,用湿润的棉花包裹向日葵茎杆两端,置于灭菌的培养皿中备用。
上述任一项中优选的是,所述截取向日葵茎秆为向日葵幼苗长到6片真叶时,自茎基部向上截取6cm的向日葵茎杆。这一区域的向日葵茎杆更适于核菌病菌株的接种和培养,培养后的病斑更易于观察和测量。
上述任一项中优选的是,步骤一菌株活化包括以下步骤:将保存的核盘菌菌株在pda培养基进行活化,然后打取新鲜菌饼接种到mm培养基上,待用。
上述任一项中优选的是,所述pda培养基包括马铃薯200g、葡萄糖20g、琼脂粉13g,蒸馏水定容至1000ml。
上述任一项中优选的是,保存的核盘菌菌株在pda培养基进行活化的时间为2天。
上述任一项中优选的是,从pda上打取的新鲜菌饼在mm培养基上的培养时间为5天。
上述任一项中优选的是,所述mm培养基包括naoh1g,dl-malicacid3g,nh4no32g,mgso4·7h2o0.1g,bacto-agar39g,蒸馏水定容至1000ml,ph调节至4.7-4.8,121℃高压灭菌25min后无菌操作台上倒置平板备用。其中,dl-malicacid为dl-苹果酸,bacto-agar为细菌琼脂粉。本发明所使用的生物及化学试剂除特殊说明均为现有的可购买的商业产品。
上述任一项中优选的是,步骤三接种包括以下步骤:将mm培养基上长好的核盘菌菌落边缘用打孔器打取菌饼,接种到备好的向日葵茎杆上,空白的mm培养基做对照,进行培养。
上述任一项中优选的是,所述菌柄直径为4mm。
上述任一项中优选的是,培养条件为置于22℃自然光下培养。
上述任一项中优选的是,培养时间为84h。
上述任一项中优选的是,所述mm培养基按照以下方法配置:naoh1g,dl-malicacid3g,nh4no32g,mgso4·7h2o0.1g,bacto-agar39g,蒸馏水定容至1000ml,ph调节至4.7-4.8,121℃高压灭菌25min后无菌操作台上倒置平板备用。其中,dl-malicacid为dl-苹果酸,bacto-agar为细菌琼脂粉。本发明所使用的生物及化学试剂除特殊说明均为现有的可购买的商业产品。
上述任一项中优选的是,步骤四中通过测量茎杆上的病斑大小鉴定向日葵对菌核病抗性水平。
本发明的一优选实施例中提供一种新的鉴定向日葵对菌核病抗性水平的方法,即茎杆接种法,该方法包括以下步骤:
步骤一:菌株活化,将保存的核盘菌菌株在pda培养基进行活化,2d后打取新鲜菌饼接种到mm培养基上,培养5d后,待用。
步骤二:向日葵茎杆准备,向日葵幼苗长到6片真叶时,自茎基部向上截取6cm的向日葵茎杆,冲洗干净,用湿润的棉花包裹向日葵茎杆两端,置于灭菌的培养皿中备用。
步骤三:接种。将mm培养基上长好的核盘菌菌落边缘用打孔器打取直径4mm的菌饼,接种到备好的向日葵茎杆上,空白的mm培养基做对照,置于22℃自然光下培养,84h后测量茎杆上的病斑大小。
核盘菌(sclerotiniasclerotiorum)是一种危害作物和蔬菜的世界性的重要的植物病原菌。核盘菌可以广泛地侵染很多单子叶和双子叶植物。目前对菌核病的防治主要依靠化学农药,然而化学防治不仅成本高、污染环境,而且防效也不理想;同时,食品的安全性也受到严重影响。本发明所使用的核盘菌x-8菌株于2009年7月采自内蒙古巴彦淖尔市五原县向日葵试验田中,经分离纯化及鉴定后于4℃保存于内蒙古农业大学分子植物病理实验室中。本发明所使用的核盘菌x-8菌株为现有技术中的常用菌株,已在多篇学术报道中公开,在此不进行过多描述(如《向日葵菌核病病原菌遗传多样性及致病力分化的研究》,王玉杰,2011等)。
本发明的有益技术效果在于:提供的一种新的筛选向日葵抗(耐)菌核病的方法。将活化好的核盘菌菌株经mm培养基培养后接种的向日葵茎杆上,通过茎杆病斑长度确定不同向日葵品种对菌核病的抗性水平,且该方法对照常用的离体叶片接种法有很好的一致性,可作为新的室内鉴定向日葵对菌核病抗性水平的方法。
附图说明
图1为本发明优选实施例的鉴定向日葵对菌核病抗性水平的茎杆接种法与离体叶片法鉴定不同向日葵品种抗性水平的比较
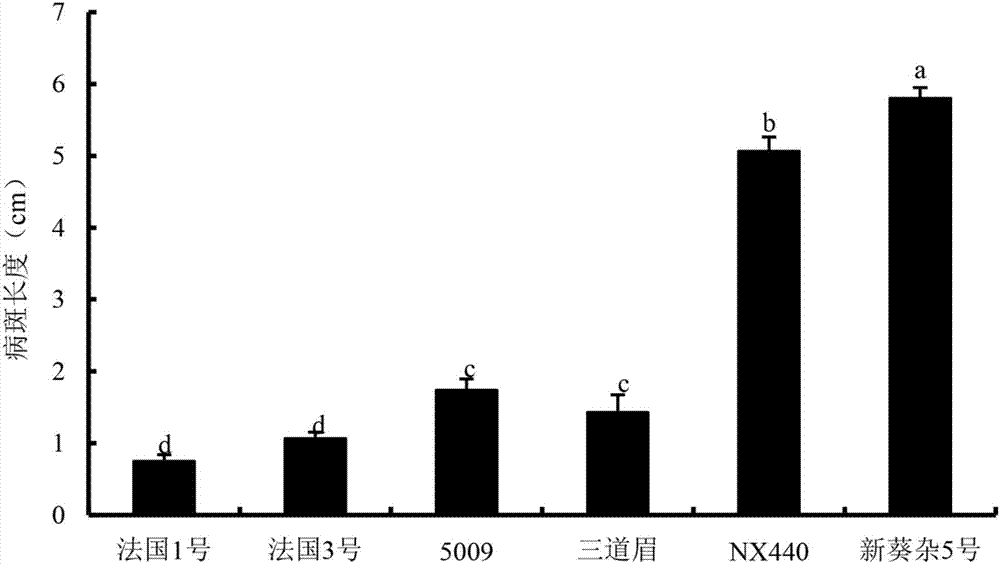
图2为本发明优选实施例的鉴定向日葵对菌核病抗性水平的茎杆接种法病斑大小统计图
图3为本发明优选实施例的鉴定向日葵对菌核病抗性水平的对照组叶片接种法病斑大小统计图
具体实施方式:
为了更好的说明本发明的实施步骤,以下结合附图及实施例,对本发明进行进一步的详细说明。应当理解,所举实施例仅用于解释本发明,并不用于限定发明,凡不背离本发明构思的改变或替代均在本发明保护范围之内。
供试向日葵:法国1号、法国3号、nx440、三道眉、5009、新葵杂5号。其中法国1号在田间鉴定为高抗菌核病品种,新葵杂5号为高感品种。将不同品种的向日葵种子播种到装有高温灭菌土的营养钵中,置于温室中进行发芽,生长4周左右待用。本实施例所选用的向日葵仅用于说明本发明的操作方法及技术效果,但本发明并不局限于本实施例所述的向日葵菌株,本发明所提供的方法适用于现有技术中的已知的向日葵品种,可用于鉴定农家种以及从农家种中单株选出的一些向日葵品种的抗性水平,也可用于鉴定杂交向日葵品种的抗性水平,既适用于我过向日葵品系对核菌病抗性水平的鉴定,也适用于具有不同遗传背景的国外向日葵品系对核菌病抗性水平的鉴定。
菌株活化:将保存的核盘菌菌株x-8的菌核置于pda平板进行活化,2d后打取新鲜菌饼,接种于mm培养基上,待菌核萌发形成的菌丝长到培养皿的3/4时,用打孔器在菌落边缘打取直径4mm的菌丝块,待用。本实施例以核盘菌菌株x-8为例,对本发明的鉴定方法进行说明。但本发明并不局限于本实施例所使用的核盘菌菌株x-8,现有技术中,能够使向日葵感染菌核病的核盘菌菌株均适用于本发明。核盘菌x-8菌株于2009年7月采自内蒙古巴彦淖尔市五原县向日葵试验田中,经分离纯化鉴定后于4℃保存于内蒙古农业大学分子植物病理实验室中。核盘菌x-8菌株为现有技术中的菌株,该菌株已用于本实验室的多项研究,并发表了相关专利和文章,其表型及遗传特征在此不进行赘述。
向日葵离体叶片的准备:用75%酒精棉擦拭搪瓷盘(长30cm×宽20cm×高5cm)盘底,并在底部铺2层灭菌的吸水纸,倒入适量无菌水使得吸水纸刚好完全湿润。取长至6片真叶的向日葵叶片,冲洗干净后用吸水纸吸干叶片的多余水分,然后将叶片背面朝上均匀放于搪瓷盘内。
向日葵茎秆准备:取长至6片真叶的向日葵植株,自茎基部向上截取6cm的向日葵茎秆,冲洗干净后,用湿润的棉花包裹向日葵茎杆的两端,置于灭菌的培养皿中备用。
核盘菌接种:用接菌针挑取单个菌丝块,准确接种在离体叶片主叶脉的两侧,菌丝面朝上;同时将菌丝块接种在茎杆上,以没有生长核盘菌的培养基块做接种对照。每个向日葵品种接种5个叶片和5个茎秆,每个叶片和茎秆上接种1个菌丝块,以没有接菌的琼脂块作为接种对照。最后用保鲜塑料膜封住瓷盘,置于22℃自然光下培养。定时观察发病情况并拍照,测量病斑的直径(叶片上)和长度(茎杆上)。
两种接种方法均能使不同向日葵品种叶片和茎杆发病(图1和图2)。离体叶片接种48h后,茎秆接种法接种84h后统计病斑大小和长度。对于离体叶片接种法,法国1号和3号呈现高抗水平,nx440和新葵杂5号呈现高感水平,ld5009和三道眉抗性介于上述两组抗性水平中间。而茎秆接种法结果也有和离体叶片接种法相似的鉴定结果,但是,从不同品种茎杆上病斑长度值来看,nx440和新葵杂5号和抗性组法国1号和3号病斑大小相差更大一些,同时,ld5009和三道眉在茎杆接种法鉴定结果中比离体叶片接种法的鉴定结果更趋向于抗病品种组中。因此,我们认为茎秆接种方法能够更准确的鉴定出向日葵不同品种抗(耐)菌核病的水平。
与现有技术中,叶片接种的鉴定方法相比(专利cn201110397710-室内鉴定向日葵品种对菌核病抗性水平的方法是本实验室在2011年申请的一项专利,其技术方案为利用叶片接种的鉴定方法),本发明使用茎秆接种具有显著的技术效果,进一步提高了对于向日葵对核菌病抗性水平鉴定的准确性,并且该方法在培养、测量等方面也具有显著的进步。
本发明的有益技术效果和显著进步主要表现在:
1)现有技术中,叶片接种方法(专利cn201110397710)主要利用mm培养基接种向日葵叶片来评价向日葵的抗性水平,该专利为本实验室的在先专利,并且通过实验证明,利用该方法主要检测了一些农家种以及从农家种中单株选出的一些向日葵品种的抗性水平。实验表明,该方法能够评价农家种以及从农家种中单株选出的不同向日葵品种的抗性水平,但是对于杂交品种,该方法并没有很好的效果。然而,随着时间的推移,杂交种取代了农家种在向日葵市场中的位置。杂交种主要以从美国,澳大利亚等地进口为主。这些杂交种亲本来源于国外,遗传背景不同于我们的农家种,因此利用叶片接种法鉴定发现杂交种对菌核病均呈现感病,甚至高感水平。本发明所提供的鉴定方法既适用于鉴定农家种以及从农家种中单株选出的一些向日葵品种的抗性水平,也适用于鉴定杂交品种的向日葵品种的抗性水平,适用于遗传背景不同于我国农家种的国外品种的向日葵。
2)本发明提供的鉴定方法克服了现有技术中以叶片接种的方法进行鉴定很难区分品种的抗性(耐病性)水平的差异的技术问题。现有技术的这一缺陷主要是由于叶片接种后发病速度非常快,过夜就会导致所有的叶片全部腐烂,因此不能够测量病斑的大小,评价品种的抗性水平。基于这一问题,本发明提供了茎杆接种的鉴定方法。茎秆与叶片的细胞组成存在很大差异,作为核菌病的接种基质,其提供的水分、营养成分以及作为基质的物理结构存在差异,因此接种后,菌株的培养情况也不同。由于茎杆的纤维化程度高,接种后腐烂程度低,因此能够通过在茎杆上病斑的扩展速度来评价不同品种的抗菌核病的水平,从而也避免了叶片接种带来的难于区分品种抗性水平差异的问题。因此,使用茎秆作为接种基质与接种叶片相比,能够使在实验室的培养更加接近田间的培养环境,使得到的病斑更加接近田间情况,是鉴定的结果更加准确。
3)茎秆接种病原菌后,病菌形成的病斑会纵向扩展形成梭形病斑,易于测量病斑大小,由于易于观察和测量,鉴定的结果更准确。
4)菌核病一般在田间有三种症状类型,即茎基腐,茎腐和盘腐,而在叶片上形成叶腐型症状很少见。茎杆接种更能代表菌核病田间发病的主要症状类型(茎基腐型),利用本发明提供的茎杆接种方法评价向日葵品种抗菌核病水平相比叶片接种会更准确。
说明:本发明按照表一的划分标准来评价品种的抗菌核病水平(王玉杰,高凤竹,曹雄,徐昌国,周洪友,景岚、赵君(2010)."向日葵品种资源对菌核病抗性室内鉴定."中国油料作物学报(04):540-545.)。
表一:向日葵品种对菌核病抗性水平的划分标准
如表一所示,以接种菌核病菌株后,经培养所形成的病斑大小作为评判抗菌核病水平的标准。当形成的菌斑直径x为ocm时,向日葵为免疫品种;当形成的菌斑直径0.0<x≤0.5cm时,向日葵为高抗品种;当形成的菌斑直径0.5<x≤1.0时,向日葵为耐病品种;当形成的菌斑直径x>1.0时,向日葵为高感品种。本评价方法为现有技术中的常用方法,具体接种培养及测量方法在此不进行赘述。
- 还没有人留言评论。精彩留言会获得点赞!