一种菲并咪唑小分子Fe3+荧光探针及其合成方法与流程
本发明涉及一种fe3+荧光探针及其合成方法。
背景技术:
铁是人体中最重要的微量元素之一,无论在重要性上还是在数量上都居于首位。人体内铁缺乏会引起多种疾病,但是过量的铁也会存在潜在的危害,因此对铁离子的检测具有非常重要的意义。近年来,越来越多科研工作者开始了对铁离子荧光探针的研究工作。李波等人报道了罗丹明b类衍生物在酸性环境下对三价铁离子的识别性能[有机化学,2015,35,2629-2635]研究发现fe3+可以选择性增强罗丹明b类衍生物的荧光。2016年,在《化学试剂》公开的文章《铁离子荧光探针的合成及光谱性能》中报道了在中性环境下罗丹明衍生物对三价铁离子的识别性能。2011年在《传感器和执行器b:化学》(sensorsandactuatorsb:chemical)的160期的1106-1111页公开的文章《通过双模的键合方式形成的多功能识别cu2+和fe3+的荧光探针》(multifunctionalfluorescentprobeselectiveforcu(ii)andfe(iii)withdual-modeofbindingapproach)和2015年《无机化学欧洲学报》(eurjic)311-317页公开的文章《一种简单的萘胺荧光探针在混合水溶液中选择性识别hgii、feii和feiii:生物细胞及逻辑门方面的应用》(asimplefluorescentprobederivedfromnaphthylamineforselectivedetectionofhgii,feiiandfeiiiionsinmixedaqueousmedia:applicationsinlivingcellsandlogicgates)都是关于铁离子识别的技术,这两篇文章中,主体化合物除了可以识别铁离子外,还对二价铜离子及二价铁离子具有识别性能。
根据目前文献报道的对于铁离子荧光探针的研究,主要存在以下两个缺陷:
1.主体化合物只能在酸性或者中性的环境下对铁离子具有识别性能,也就是说在碱性环境下识别具有局限性;
2.主体化合物不仅对铁离子有识别性能,也可以对其他金属离子进行识别,所以说,识别不具有专一性。
技术实现要素:
本发明是要解决现有的fe3+荧光探针仅适于酸性及中性的识别环境、其他金属对铁离子的识别有干扰的技术问题,而提供一种菲并咪唑小分子fe3+荧光探针及其合成与使用方法。菲并咪唑小分子fe3+荧光探针及其合成方法。
本发明的菲并咪唑小分子fe3+荧光探针的结构式为:
上述的菲并咪唑小分子fe3+荧光探针的合成方法,按以下步骤进行:
一、中间体化合物i的合成:
将菲醌、间硝基苯甲醛和乙酸铵按照1:(1.4~1.6):(1.8~2.1)的摩尔比加入到反应器中,再加入冰乙酸作为溶剂,升温至80~110℃并搅拌6~10h后,反应停止,冷却至室温,向反应器中加入水,再用氢氧化钠溶液调ph值至8~10,抽滤,得到黄色固体,烘干后,再用乙酸乙酯重结晶,再抽滤、烘干,得到中间体化合物i;
二、中间体化合物ii的合成:
称取中间体化合物i、雷尼镍和质量百分浓度为78~83%的水合肼溶液,其中中间体化合物i的物质的量与雷尼镍的质量的比为1mmol:(0.15~0.2)g,中间体化合物i的物质的量与质量百分浓度为78~83%的水合肼溶液的体积的比为1mmol:(3~5)ml;先将中间体化合物i和雷尼镍加入到反应器中,再加入乙醇作为溶剂,通入氮气保护,在搅拌条件下,滴加质量百分浓度为80%的水合肼溶液,滴加完毕后,升温至60~80℃,反应6~9h,冷却至室温,抽滤,用乙酸乙酯洗涤,旋转蒸发去除滤液,得到中间体化合物ii;
三、fe3+荧光探针的合成:
按照中间体化合物ii与5-硝基水杨醛的摩尔比为1:(1~3)的比例称取中间体化合物ii和5-硝基水杨醛,加入到反应器中,再加入酸性介质为溶剂,常温搅拌反应2~4h,反应结束后,向反应体系中加入水淬灭反应,再用氢氧化钠溶液调ph值至8~10,析出固体,然后进行抽滤,滤饼并水洗至中性,干燥后,得到菲并咪唑小分子fe3+荧光探针。
本发明的合成过程可用下面的式子表示:
本发明提供了一种在水相体系中,ph值为3~12的范围内,具有高选择性、响应灵敏且不受其他金属离子干扰的菲并咪唑小分子fe3+荧光探针。该荧光探针能选择识别fe3+,不受k+、ba2+、ca2+、na2+、mg2+、zn2+、cr3+、cd2+、ni2+、co2+、pb2+、cu2+、ag+、al3+和hg2+等其他离子的干扰,而且响应时间仅为10min,用于fe3+的检验,方便快速。这个小分子探针合成步骤简单,后处理容易,产率较高。
附图说明
图1是试验1制备的菲并咪唑小分子fe3+荧光探针对不同金属离子的紫外吸收光谱图;
图2是试验1制备的菲并咪唑小分子fe3+荧光探针对不同金属离子的荧光发射光谱图;
图3是试验1制备的菲并咪唑小分子fe3+荧光探针在其他金属离子存在的情况下,fe3+荧光探针的荧光发射光谱图
图4是试验1制备的菲并咪唑小分子fe3+荧光探针在不同的铁离子的浓度时的荧光发射光谱图;
图5是试验1制备的菲并咪唑小分子fe3+荧光探针在不同的ph条件下的荧光发射强度图;
图6是试验1制备的菲并咪唑小分子fe3+荧光探针在不同络合时间时的荧光发射强度图。
具体实施方式
具体实施方式一:本实施方式的菲并咪唑小分子fe3+荧光探针的结构式为:
具体实施方式二:具体实施方式一所述的菲并咪唑小分子fe3+荧光探针的合成方法,按以下步骤进行:
一、中间体化合物i的合成:
将菲醌、间硝基苯甲醛和乙酸铵按照1:(1.4~1.6):(1.8~2.1)的摩尔比加入到反应器中,再加入冰乙酸作为溶剂,升温至80~110℃并搅拌6~10h后,反应停止,冷却至室温,向反应器中加入水,再用氢氧化钠溶液调ph值至8~10,抽滤,得到黄色固体,烘干后,再用乙酸乙酯重结晶,再抽滤、烘干,得到中间体化合物i;
二、中间体化合物ii的合成:
称取中间体化合物i、雷尼镍和质量百分浓度为78~83%的水合肼溶液,其中中间体化合物i的物质的量与雷尼镍的质量的比为1mmol:(0.15~0.2)g,中间体化合物i的物质的量与质量百分浓度为78~83%的水合肼溶液的体积的比为1mmol:(3~5)ml;先将中间体化合物i和雷尼镍加入到反应器中,再加入乙醇作为溶剂,通入氮气保护,在搅拌条件下,滴加质量百分浓度为80%的水合肼溶液,滴加完毕后,升温至60~80℃,反应6~9h,冷却至室温,抽滤,用乙酸乙酯洗涤,旋转蒸发去除滤液,得到中间体化合物ii;
三、fe3+荧光探针的合成:
按照中间体化合物ii与5-硝基水杨醛的摩尔比为1:(1~3)的比例称取中间体化合物ii和5-硝基水杨醛,加入到反应器中,再加入酸性介质为溶剂,常温搅拌反应2~4h,反应结束后,向反应体系中加入水淬灭反应,再用氢氧化钠溶液调ph值至8~10,析出固体,然后进行抽滤,滤饼并水洗至中性,干燥后,得到菲并咪唑小分子fe3+荧光探针。
具体实施方式三:本实施方式与具体实施方式二不同的是步骤一中的反应温度为100℃,反应时间为10h。其它与具体实施方式二相同。
具体实施方式四:本实施方式与具体实施方式二或三不同的是步骤一中的ph值为9。其它与具体实施方式二或三相同。
具体实施方式五:本实施方式与具体实施方式二至四之一不同的是步骤一中氢氧化钠溶液的质量百分浓度为8%~12%。其它与具体实施方式二至四之一相同。
具体实施方式六:本实施方式与具体实施方式二至五之一不同的是步骤二中反应温度为95℃,反应时间为8h。其它与具体实施方式二至五之一相同。
具体实施方式七:本实施方式与具体实施方式二至六之一不同的是步骤三中中间体化合物ii与5-硝基水杨醛的摩尔比为1:2。其它与具体实施方式二至六之一相同。
具体实施方式八:本实施方式与具体实施方式二至七之一不同的是步骤三中所述的酸性介质为冰乙酸、质量百分浓度为65%~68%的浓硝酸、质量百分浓度为36~37%的浓盐酸或苯甲酸。其它与具体实施方式二至七之一相同。
具体实施方式九:本实施方式与具体实施方式二至八之一不同的是步骤三中常温搅拌反应3h。其它与具体实施方式二至八之一相同。
具体实施方式十:本实施方式与具体实施方式二至九之一不同的是步骤三中氢氧化钠溶液的质量百分浓度为8%~12%。其它与具体实施方式二至九之一相同。
具体实施方式十一:本实施方式与具体实施方式二至十之一不同的是步骤三中ph值为9;其它与具体实施方式二至十之一相同。
用以下实例验证本发明的有益效果:
试验1:本试验的菲并咪唑小分子fe3+荧光探针的合成方法,按以下步骤进行:
一、中间体化合物i的合成:
称取菲醌5.0mmol、间硝基苯甲醛7.5mmol、乙酸铵10.0mmol加入到100ml的三口瓶中,并向其中加入40ml的冰乙酸作为溶剂,升温至110℃,并不断搅拌,在反应过程中,用tlc跟踪检测(展开剂为乙酸乙酯和石油醚,v(乙酸乙酯):v(石油醚)=3:7),反应进行8h后,反应基本完全,停止反应,冷却至室温,在三口瓶内加入50ml水,并置于200ml的烧杯中,用质量百分浓度为10%的氢氧化钠溶液调ph值至9,抽滤,得到黄色固体,在100℃的烘箱中烘5h;烘干后,再溶于30ml的乙酸乙酯中,加热至沸腾回流搅拌2h后,冷却至室温,有大量固体析出,抽滤、烘干,得到中间体化合物i;
本步骤得到的中间体化合物i的产率为94%,熔点:271~273℃。用红外光谱、核磁氢谱和核磁碳谱表征该中间体化合物i,得到的结果如下:
ir(kbr,cm–1):3607,1676,1593,1531,1455,1347,754,740.1hnmr(600mhz,dmso):δ(ppm)13.826(s,1h),9.158(t,j=7.20hz,1h),8.879(d,j=7.80hz,2h),8.763-8.745(m,1h),8.583(d,j=7.20hz,2h),8.338-8.319(m,1h),7.897(t,j=7.80hz,1h),7.767(t,j=7.20hz,2h),7.687-7.660(m,2h),7.135(d,j=7.80hz,1h).13cnmr(150mhz,dmso):δ(ppm)148.36,146.71,135.34,132.06,131.79,131.16,130.58,129.24,129.03,127.23,127.09,126.69,125.71,125.39,124.35,124.10,123.71,123.45,121.98,121.83,120.16.
从表征结果知该中间体化合物i的结构式为
二、中间体化合物ii的合成:
在50ml的三口烧瓶中加入2.0mmol中间体化合物i、0.35g雷尼镍和30ml的乙醇溶剂,在通入2分钟氮气后,搅拌,并用恒压滴液漏斗慢慢滴加7.5ml质量百分浓度为80%的水合肼溶液,滴加完毕后,升温至80℃回流反应6h后,用tlc跟踪检测(展开剂为v乙酸乙酯:v石油醚=3:7),反应基本完全,冷却至室温后,抽滤,用乙酸乙酯洗涤五次,旋转蒸发滤液,得到灰色固体;干燥后再用乙酸乙酯重结晶,加热至沸腾回流搅拌2h后,冷却至室温,有大量固体析出,抽滤、干燥,中间体化合物ii。本步骤得到的中间体化合物ii的产率为73%,熔点:197~198℃;
用红外光谱、核磁氢谱和核磁碳谱进行表征,得到的结果如下:
ir(kbr,cm–1):3435,3362,1608,1595,1461,761,723.1hnmr(600mhz,dmso):δ(ppm)13.336(s,1h),8.854(d,j=7.20hz,2h),8.580(d,j=7.80hz,2h),7.732(t,j=7.20hz,2h),7.629(t,j=7.80hz,2h),7.570(s,1h),7.449(d,j=7.20hz,1h),7.240(t,j=7.80hz,1h),6.705(d,j=7.20hz,1h),5.351(s,2h).13cnmr(150mhz,dmso):δ(ppm)149.92,149.03,136.74,130.86,129.19,127.43,127.35,127.30,126.99,126.96,126.89,125.04,124.88,123.93,123.61,122.39,121.88,121.68,114.94,113.74,111.52.
从表征结果知该中间体化合物ii的结构式为
三、fe3+荧光探针的合成:
依次向三口瓶中加入0.46g(1.5mmol)中间体化合物ii、0.25g(1.5mmol)5-硝基水杨醛,再将25ml的冰乙酸加入三口瓶中作为溶剂,常温搅拌反应2h,反应结束后,向反应体系中加入水淬灭反应,再置于200ml的烧杯中,用质量百分浓度为10%的氢氧化钠溶液调ph值至9,然后进行抽滤,滤饼水洗至中性,烘干。烘干后,得到菲并咪唑小分子fe3+荧光探针。本步骤中,菲并咪唑小分子fe3+荧光探针的产率为91%。
菲并咪唑小分子fe3+荧光探针的熔点为>300℃。
用红外光谱及核磁共振谱进行表征,得到的结果如下:
ir(kbr,cm–1):3435,3060,1617,1595,1566,1493,1450,1277,759.1hnmr(600mhz,dmso):δ(ppm)14.229(s,1h),13.555(s,1h),9.328(s,1h),8.875(d,j=9.6hz,2h),8.792(d,j=7.20hz,1h),8.617(d,j=7.20hz,1h),8.562(d,j=7.80hz,1h),8.371(s,1h),8.324-8.301(m,2h),7.787-7.662(m,5h),7.617(dd,j1=6.40hz,j2=6.20hz,1h),7.197(d,j=9hz,1h).13cnmr(150mhz,dmso):δ(ppm)170.81,166.96,162.31,148.82,148.13,139.85,135.93,132.17,131.18,130.79,129.83,129.05,128.63,128.19,127.64,125.90,125.65,124.93,124.33,122.45,121.99,119.94,119.43,118.76.
从以上的表征结果可知,菲并咪唑小分子fe3+荧光探针的结构式为:
将本试验制备的菲并咪唑小分子fe3+荧光探针进行光谱性能测试,步骤如下:
一、储备液的配置
将菲并咪唑小分子fe3+荧光探针以n,n-二甲基甲酰胺(dmf)为溶剂配制成浓度为1.0×10–4mol/l的主体储备液,备用;
将金属硝酸盐、氯化盐配制成浓度为0.1mol/l的金属离子储备液,备用;
hepes缓冲溶液:用n-2-羟乙基哌嗪-n’-2-乙磺酸0.60g放入250ml的容量瓶中,用蒸馏水定容,配成0.01mol/l的溶液,摇匀,静止3个小时后,用氢氧化钠溶液调ph值,配成ph值为7.4~12的缓冲溶液,用硝酸溶液调ph值,配成ph值为3~6的缓冲溶液。摇匀,备用。
二、光谱性能测试
向10.0ml的容量瓶中加入浓度为1.0×10–4mol/l的主体储备液1ml,再加入浓度为0.1mol/l的待测金属离子,用浓度为0.01mol/l、ph=7.4的hepes缓冲溶液定容。此时,主体与fe3+摩尔浓度比为1:50。恒温1h后,分别进行紫外吸收光谱和荧光发射光谱的测试。
先考察菲并咪唑小分子荧光探针对金属离子的选择性识别,选用的溶剂为体积比是1:1的dmf/hepes的混合溶液(其中,hepes缓冲溶液的浓度为0.01mol/l,ph=7.4),配制成浓度为1.0×10-5mol/l的主体溶液,再向主体化合物中分别加入浓度为0.10mol/l的k+、ba2+、ca2+、na+、mg2+、zn2+、cr3+、fe3+、cd2+、ni2+、co2+、pb2+、cu2+、ag+、al3+和hg2+金属离子,并分别测定紫外吸收光谱,结果如图1所示,图中以l表示主体化合物菲并咪唑小分子fe3+荧光探针。从图1中可知,加入不同的金属离子后,可以看出k+、ba2+、ca2+、na+、mg2+、zn2+、cr3+、cd2+、cu2+、ni2+、co2+、pb2+、hg2+、ag+和al3+与主体的紫外吸收光谱曲线形状及吸光度类似。加入fe3+后,在紫外吸收波谱中,波长为425nm处的吸光度明显增强,强度大约为主体化合物l的2倍。因此,从紫外吸收光谱图中可以初步推测,主体化合物对fe3+具有选择识别特性。
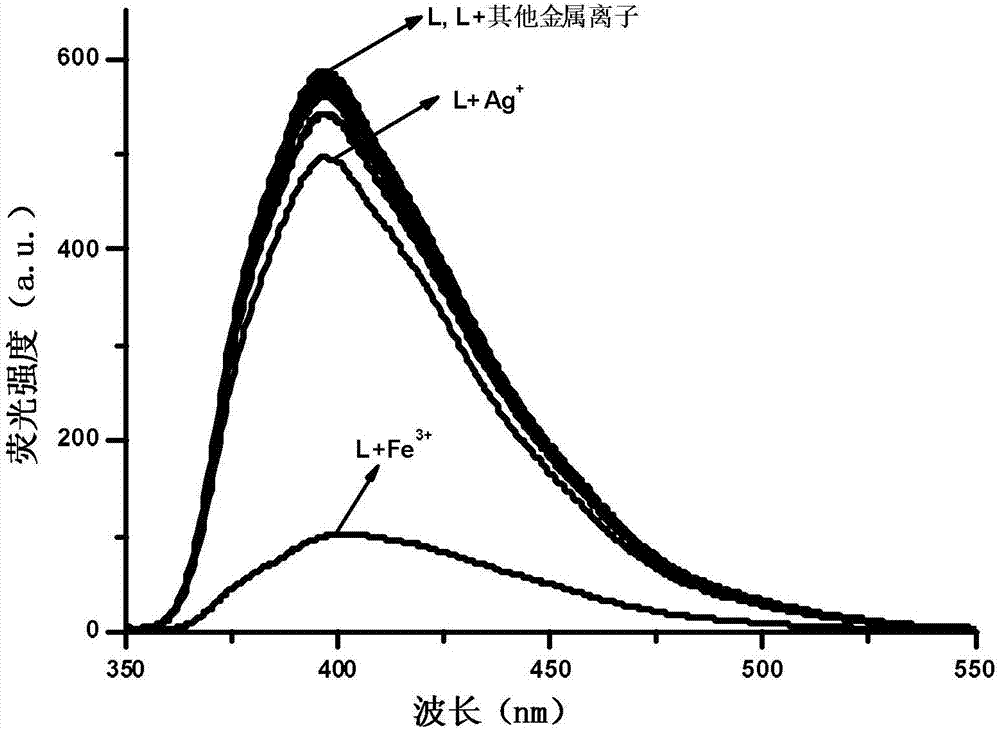
继续进一步验证本试验制备的菲并咪唑小分子荧光探针对fe3+具有选择性识别的特性,在激发波长为325nm,激发狭缝宽度为10的情况下,对其进行荧光发射光谱的测试,得到的荧光发射光谱强度,结果如图2所示。从图2中可知,主体的荧光发射波长为400nm,荧光强度为600a.u.左右。加入不同金属离子后,可以看出k+、ba2+、ca2+、na+、mg2+、zn2+、cd2+、ni2+、co2+、cr3+、pb2+、hg2+、ag+、al3+和cu2+与对主体的荧光强度影响不大,强度均在600a.u.左右。而加入fe3+后,荧光强度明显灭至150a.u.左右,淬灭到原来的强度的1/4。因此,从荧光发射光谱可以确定,主体化合物对fe3+具有选择识别特性。
为了进一步验证本试验制备的菲并咪唑小分子荧光探针对fe3+具有选择性识别的特性。以体积比是1:1的dmf/hepes的混合溶液(其中,hepes缓冲溶液的浓度为0.01mol/l,ph=7.4)为溶剂,配制浓度为1.0×10-5mol/l的主体溶液,在主体溶液中分别加入浓度为5.0×10–4mol/l的k+、ba2+、ca2+、na+、mg2+、zn2+、cr3+、cd2+、ni2+、co2+、pb2+、cu2+、ag+、al3+和hg2+金属离子溶液。充分混合后静置5min,再分别加入1.0×10-5mol/l的fe3+后混合均匀。此时,主体化合物/金属离子/fe3+三者的摩尔浓度比为1:50:50。恒温1h后,在激发波长为325nm,激发狭缝宽度为10.0nm的情况下,对其进行荧光发射光谱的测试。得到的荧光发射光谱强度结果如图3所示。在其他金属离子(k+、ba2+、ca2+、na+、mg2+、zn2+、cr3+、cd2+、ni2+、co2+、pb2+、cu2+、ag+、al3+和hg2+)存在的情况下,fe3+与其他金属离子共存时,主体化合物与铁离子识别的荧光强度并不受其他金属离子的影响。也就是说,其他金属离子的存在并不干扰主体化合物对fe3+识别。因此,图3即可以证明主体化合物对fe3+具有选择识别特性。又可以说明其他金属离子对主体化合物识别fe3+无影响。
为了考查fe3+浓度对fe3+荧光探针荧光强度的影响,以体积比是1:1的dmf/hepes的混合溶液(其中,hepes缓冲溶液的浓度为0.01mol/l,ph=7.4)为溶剂,配制主体化合物溶液,在主体化合物溶液中逐渐增加铁离子的浓度(金属离子浓度为主体浓度的0至100当量),并对其进行荧光发射光谱的测试。测试结果如图4所示,从图4可以看出,随着fe3+浓度的增加,荧光强度逐渐减小。至80当量时,灭至最小值50a.u.左右。再继续增加fe3+的浓度时,荧光强度基本不再改变。
在不同的溶液ph(3~12)值下,考察了ph值对主体化合物识别fe3+荧光发射光谱的变化情况。荧光强度随ph的变化情况如图5所示。从图5中可以看出:主体化合物的荧光强度随着ph的改变变化不大,无论是在酸性、中性还是在碱性的条件下,主体的荧光强度都在600a.u.左右。当向主体溶液(1.0×10-5mol/l)中加入fe3+(5.0×10-4mol/l)后,考察ph为3~12之间主体化合物对fe3+识别的荧光变化情况。结果发现,在此ph值范围内,fe3+都可以使主体化合物的荧光发生灭,且荧光强度基本保持不变。也就是说,ph值的变化对主体的荧光强度及主体识别fe3+的荧光强度几乎无影响。这一研究结果说明该主体化合物与fe3+的荧光识别可以在不同的ph值下实现。
此外,主体化合物对fe3+识别的荧光相应时间很短。在ph为7.4的条件下,向浓度为1.0×10-5mol/l的主体化合物中加入浓度为5.0×10-4mol/lfe3+,混合均匀。10min后测定其荧光发射光谱,并且每隔10min测试一次,测试结果如图6所示。从图6可以看出,在测定的时间内,主体化合物具有稳定的荧光强度,这说明了本专利中的主体化合物在水溶液中具有稳定的荧光发射。10min时测定主体化合物与fe3+的荧光,荧光强度已经发生明显的灭。20、30、40、50min时,荧光强度与10min是相差不大。这说明,主体化合物在水溶液中可以实现对fe3+的快速识别,并保持灭的后荧光的稳定性。这个结果在主体化合物的实际应用中具有重要的意义。
本试验制备菲并咪唑小分子fe3+荧光探针,通过以上试验说明在以体积比是1:1的dmf/h2o的混合溶液(hepes缓冲溶液的浓度为0.01mol/l,ph=7.4)为溶剂的体系中,该主体化合物对fe3+有选择性识别的作用,且响应灵敏度突出。而对其他金属离子无识别特性,且与其他金属离子共存时,不干扰该化合物识别fe3+。即使改变溶液ph的环境,也可以实现对fe3+的荧光识别。
试验2:本试验与试验1不同的是试验1的步骤三用以下的操作代替:依次向三口瓶中加入中间体化合物ii0.46g(1.5mmol)、5-硝基水杨醛0.42g(2.5mmol)和20ml的质量百分浓度为65~68%的浓硝酸作为溶剂,常温搅拌反应2.5h,反应结束后,向反应体系中加入水淬灭反应,并置于200ml的烧杯中,用10%氢氧化钠溶液调ph值至9,然后进行抽滤,滤饼水洗至中性,烘干。烘干后得到菲并咪唑小分子fe3+荧光探针。本试验得到的菲并咪唑小分子fe3+荧光探针的结构式为:
试验3:本试验与试验1不同的是试验1的步骤三用以下的操作代替:依次向三口瓶中加入中间体化合物ii0.46g(1.5mmol)、5-硝基水杨醛0.50g(3.0mmol)和20ml的苯甲酸作为溶剂,常温搅拌反应3h,反应结束后,向反应体系中加入水淬灭反应,并置于200ml的烧杯中,用10%氢氧化钠溶液调ph值至9,然后进行抽滤,滤饼水洗至中性,烘干。烘干后得到菲并咪唑小分子fe3+荧光探针。本试验得到的菲并咪唑小分子fe3+荧光探针的结构式为:
试验4:本试验与试验1不同的是试验1的步骤三用以下的操作代替:依次向三口瓶中加入中间体化合物ii0.46g(1.5mmol)、5-硝基水杨醛0.75g(4.5mmol)和15ml的37%的浓盐酸作为溶剂,常温搅拌反应4h,反应结束后,向反应体系中加入水淬灭反应,并置于200ml的烧杯中,用10%氢氧化钠溶液调ph值至9,然后进行抽滤,滤饼水洗至中性,烘干,烘干后得到菲并咪唑小分子fe3+荧光探针。本试验得到的菲并咪唑小分子fe3+荧光探针的结构式为:
- 还没有人留言评论。精彩留言会获得点赞!