一种检测整合HIV-1病毒基因组的核酸扩增荧光定量方法及其应用与流程
本发明涉及诊断领域,具体涉及一种检测整合HIV-1病毒基因组的核酸扩增荧光定量方法及其应用。
背景技术:
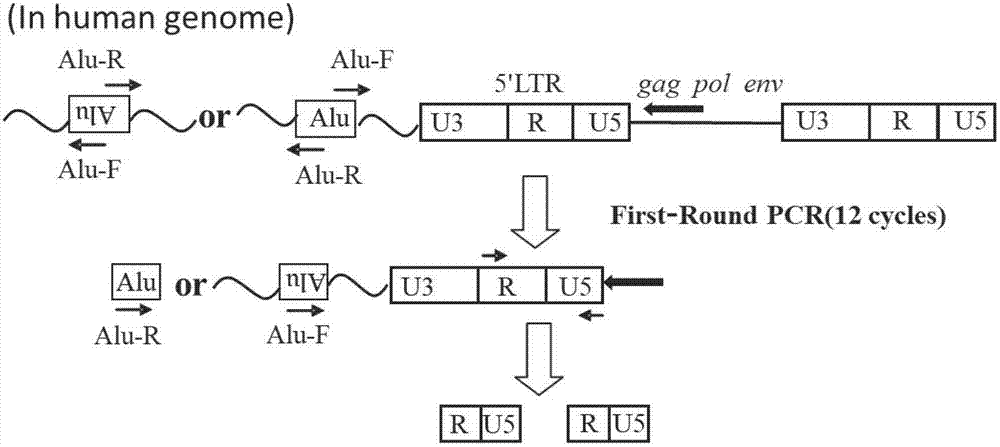
:艾滋病是由人类免疫缺陷病毒1型(HumanImmunodeficiencyVirus1,HIV-1)感染引起的一种重大威胁人类生命安全的传染病,据世界卫生组织的最新统计,自发现到2014年底已造成3900多万人死亡,目前世界上艾滋病毒感染者仍有3700万。要遏制与防治艾滋病首要前提是快速、高效的诊断和检测。目前检测HIV的方法有100多种,总体来说分为血清学诊断和病毒学诊断。血清学检测是早期HIV诊断的主要方法,通过检测HIV的抗体间接地诊断HIV感染。酶联免疫法作为诊断艾滋病的一个主要手段目前已经普遍用于临床、急诊、血液筛查等各个领域。但是抗体通常是在感染后3~8周才能够被检测出来,因此酶联免疫方法本身决定了其是一种间接滞后的检测方法,原因是检测的目标是人体内产生的抗体而不是病原体本身。HIV感染的病毒学诊断技术常用方法为共培养法、p24抗原检测和病毒核酸检测,即用正常人外周血液分离单个核细胞,加PHA和IL-2刺激并培养后,加入病人外周血单核细胞(PMBC)进行艾滋病的诊断。该方法必须要有一定数量的感染细胞存在才能培养和分离出病毒来,因而敏感性差、操作时间长、操作复杂、必须在特定的P3实验室中才能进行,且费用较高,不适用于临床。另外,p24抗原检测能够在病毒开始复制后检测到血液中的可溶性p24抗原,但易出现假阳性。因此,阳性结果必须经中和试验确认,该结果才可作为HIV感染的辅助诊断依据。HIV-1p24抗原检测阴性,只表明在本试验中无反应,不能排除HIV感染。近年来核酸分子检测技术在检验医学和临床研究中显示出强大的优势,相比较酶联免疫诊断技术具有灵敏度高、特异性强、诊断快速等优点。近些来,病毒核酸分子检测通常是通过检测HIVRNA水平来反映病毒载量,具有很高的灵敏度,使用实时荧光聚合酶链反应(Real-timePCR)技术,能够在HIV感染的前两周检测到病毒核酸。该方法已成为一种通用艾滋病临床检测方法,大大提高了艾滋病的检测准确性,促进了疾病的早期诊断,可极大缩短“窗口期”。在遏制与防治艾滋病过程中,对高危人群的诊断是“防艾”的关键环节,而核酸诊断试剂在确诊艾滋病病毒携带者的过程中发挥了重要作用,目前,已经成为艾滋病确诊的金标准试剂。近年来全面的高效抗反转录病毒治疗HAART(highlyactiveanti-retroviraltherapy)可降低艾滋病的发病率和死亡率,使感染者血浆中HIV-1RNA降至常规方法检测不到的水平,只有用敏感度更高的方法才可检测到病毒基因和低水平的病毒复制,这使的HIVRNA检测也表现出极大的局限性。但不能检测出HIVRNA并不能说明体内病毒已被清除,主要是因为HIV在感染者体内建立起病毒“储藏库”(Reservoir),包括活性的和潜伏的。当患者体内的HIV病毒载量水平低于检测下限时,体内主要的为潜伏性病毒“储藏库”,存在于静息的中枢记忆CD4+T淋巴细胞中。此时,通过HIV-1DNA定量可大概获得患者体内的病毒储藏库水平。然而,病毒感染细胞内的HIV-1DNA存在形式是多样的,包括线性非整合的、1-LTR环状的、2-LTR环状的和整合的,其中整合的HIV-1DNA只占总DNA的很少一部分(可到1/25),更为重要的是整合的HIV病毒基因组才是具有高转录活性的,是病毒储藏库的主要存在形式,一旦停药,病毒会从储藏库中迅速反弹,而目前较多的文献报道仅仅是利用real-timePCR的方法来定量HIV-1总DNA并以此来判定病毒储藏库的含量,所以是不准确的的。因此,研究开发出一种能准确定量检测整合HIV-1病毒基因组的方法及其试剂盒是目前亟待解决的新课题。技术实现要素:本发明为了克服现有技术的上述不足,提供了一种真正能检测整合HIV-1病毒基因组的核酸扩增荧光定量方法,该方法能区分开整合和非整合的HIV病毒基因组,从而特异性检测前病毒并具有极高的灵敏度(5-10拷贝/μl),为准确评估HAART治疗效果提供了技术保证。本发明的另一目的是提供一种一种检测整合HIV-1病毒基因组的核酸扩增荧光定量方法的应用。为了实现上述目的,本发明是通过以下技术方案实现的:一种检测整合HIV-1病毒基因组的核酸扩增荧光定量方法,所述方法对整合HIV的定量包括如下步骤:1)在HIV病毒序列高保守Gag区设计并合成PCR扩增引物和TaqMan探针,以梯度稀释的已知拷贝数的质粒DNA为模板,建立实时绝对定量HIV总DNA的方法;2)制备用于整合HIV基因组的标准品并采用步骤1)的方法定量;3)梯度稀释整合HIV的标准品,经巢式荧光定量PCR建立HIV整合标准曲线;4)同时准备HIV整合标准品和待测样品,设立无Alu引物的待测样品为参照样品,经与步骤3)同样的巢式荧光定量PCR操作,与标准曲线比对并读出待测样品的绝对拷贝数,待测样品整合HIV前病毒的拷贝数等于有Alu引物样品与无Alu引物的参照样品的拷贝数之差。进一步地,所述步骤1)中在HIV病毒序列高保守Gag区设计的PCR扩增的上游引物序列为:5'–tgggaccacaggctacactaga–3'(SEQIDNO.1),PCR扩增的下游引物序列为:5'–cagccaaaactcttgctttatgg–3'(SEQIDNO.2);TaqMan探针序列为:5'–tgatgacagcatgccagggagtgg-3'(SEQIDNO.3),探针5'端标记为FAM荧光发生基团,3'端标记为MGBNFQ荧光淬灭基团。进一步地,所述步骤1)的PCR扩增的最佳反应温度和时间为:95℃5min,1个循环;最后94℃10s,60℃30s,40个循环采集荧光信号。进一步地,中制备并定量用于整合HIV基因组的标准品的具体方法为:构建囊膜gp120缺陷的HIVNL4-3质粒并与水泡性口炎病毒(VSV-G)囊膜质粒共转染包装假病毒,以此假病毒感染人表皮T细胞系H9,经体外传代20代后,提取细胞总DNA并制备用于整合HIV基因组的标准品,然后采用步骤1)的方法进行定量。进一步地,所述用于整合HIV基因组的标准品的浓度线性范围调整为101-106拷贝数/μl,DNA浓度为106拷贝数/μl的标准品经10倍连续稀释同时加入未感染细胞的DNA,使每个浓度的HIV整合定量标准品中的细胞DNA浓度都与106拷贝数/μl对应的标准品中DNA浓度相同。进一步地,所述步骤3)中巢式荧光定量PCR的具体方法为:梯度稀释整合HIV的标准品,分别选定人类基因组中的Alu序列和HIV病毒序列高保守gag区作为目标扩增区,利用ABIPrimerexpression3.0设计并合成互相作为PCR扩增的锚定引物,进行第一轮PCR预扩增;选定5’LTR保守区域,设计一对引物和与之匹配的TaqMan探针,分别以第一轮预扩增后的标准品和扩增产物作为第二轮荧光定量PCR的标准品和待测样品,进行第二轮荧光定量PCR,建立HIV整合标准曲线。进一步地,所述第一轮PCR预扩增使用高保真的大片段扩增的热启动TaqDNA聚合酶。进一步地,所述第一轮PCR预扩增的下游引物序列为5'-tcacacaacagacgggcacacac-3'(SEQIDNO.4),第一轮PCR预扩增的上游引物序列为5'-tgctgggattacaggcgtgag-3'(SEQIDNO.5)和5'-cgagaccatcctggctaacacg-3'(SEQIDNO.6)。进一步地,所述第一轮PCR预扩增的最佳反应温度和时间为:942min,1个循环;94℃30s,50℃30s,68℃16min,12个循环;72℃5min终止。进一步地,所述第二轮荧光定量PCR扩增的下游引物序列为5'-ctggctaattagggaacccactg-3'(SEQIDNO.7),第二轮荧光定量PCR扩增的上游引物序列为:5'-ggactaaacggatctgagggatctc-3'(SEQIDNO.8);TaqMan探针序列为5'-ttaccagagtcacacaacagacgggca-3'(SEQIDNO.9),探针5'端标记为FAM荧光发生基团,3'端标记为MGBNFQ荧光淬灭基团。进一步地,所述第二轮荧光定量PCR扩增的最佳反应温度和时间为:95℃5min,1个循环;94℃10s,60℃30s,40个循环采集荧光信号。本发明还提供了一种检测整合HIV-1病毒基因组的核酸扩增荧光定量方法的应用所述方法应用于临床上评估HAART治疗效果。本发明最后提供了一种检测整合HIV-1病毒基因组的核酸扩增荧光定量方法的应用,所述方法应用于制备临床上检测整合HIV-1病毒基因组的检测试剂盒。本发明的有益效果在于:1.引物和探针基因型覆盖率高、保守性高、特异性强。经测试表明本发明能够覆盖HIV-1的多个基因型。2.该方法建立的HIV整合标准品能完全包含待测样品中所有相近的整合位点,使定量结果更准确。3.考虑到Alu序列的正反向,本发明采用双引物设计确保最近的Alu作为锚定引物捕获所有的整合位点,选用高保真超长片段的TaqDNA聚合酶同时,12个循环的预扩增保证各样本信号的线性放大,提高检测结果的可靠性。4.该方法通过建立HIV整合标准曲线和设置无Alu引物参照样品区分开整合和非整合的HIV病毒基因组,从而特异性检测HIV前病毒。5.该方法具有极高的灵敏度(5-10拷贝数/μl),为准确评估HAART治疗效果和精确定量HIV病人体内的病毒储藏库提供了技术保证。附图说明图1为由质粒标准品梯度稀释后制备定量总HIV-1DNA的标准曲线;图2为巢式荧光定量PCR检测整合HIV前病毒的流程图;图3为HIV整合标准品梯度稀释后经巢式荧光定量PCR制备的扩增曲线;图4为HIV整合标准品梯度稀释后经巢式荧光定量PCR制备的标准曲线;图5为整合酶抑制剂Raltegravir(50nM)处理的情况下,用本发明的检测方法检测到的HIV-1总DNA和整合的HIV-1DNA被抑制结果对比图;图6为巢式荧光定量PCR用于定量外周血单核细胞(PBMC)中的整合的HIV-1DNA和总HIV-1DNA结果对比图;图7为巢式荧光定量PCR用于定量HIV感染病人大脑中的整合的HIV-1DNA和总HIV-1DNA结果对比图。具体实施方式展示一下实例来具体说明本发明的某些实施例,且不应解释为限制本发明的范围。对本发明公开的内容可以同时从材料、方法和反应条件进行改进,所有这些改进,均应落入本发明的的精神和范围之内。实施例1:检测整合HIV-1病毒基因组的核酸扩增荧光定量方法的建立本发明的检测整合HIV-1病毒基因组的核酸扩增荧光定量方法分为4步:1)在HIV病毒序列高保守Gag区设计并合成PCR扩增引物和TaqMan探针,以梯度稀释的已知拷贝数的质粒DNA为模板,建立实时绝对定量HIV总DNA的方法;2)制备用于整合HIV基因组的标准品并采用步骤1)的方法定量;3)梯度稀释整合HIV的标准品,经巢式荧光定量PCR建立HIV整合标准曲线;4)同时准备HIV整合标准品和待测样品,以无Alu引物的待测样品为参照样品,经与步骤3)同样的巢式荧光定量PCR操作,与标准曲线比对并读出待测样品的绝对拷贝数,待测样品整合HIV前病毒的拷贝数等于有Alu引物样品与无Alu引物的参照样品的拷贝数之差。1.质粒标准品梯度稀释后制备定量HIV-1总DNA的标准曲线1)工作标准品的配制选取HIVNL4-3作为模板,以引物SEQIDNO.1SEQIDNO.2来扩增HIV-1目的基因(85bp)并连接到pGEM-T载体中,并按如下公式计算质粒拷贝数:质粒拷贝数=(质粒浓度×质粒体积/质粒相对分子质量)×6.02×1023。10倍梯度稀释已知浓度的质粒标准品使其线性浓度范围为101拷贝/μl~106拷贝/μl。2)荧光定量PCR反应液的配制总反应体系为25μl:充分混匀并瞬时离心后准备上机。说明:2xABImaster购自美国应用生物系统公司(ABI),引物及探针委托赛默飞生物科技有限公司合成。3)荧光定量PCR反应程序及标准曲线的制备本发明中扩增反应使用ABI7500实时荧光定量PCR仪器(美国应用生物系统公司),扩增程序如下:以ABI7500为例,设置如表1:表1PCR扩增程序检测通道选择:荧光通道选择FAM。以质粒标准品拷贝数的对数为横坐标,Ct值为纵坐标,绘制标准曲线(如图1所示)。荧光定量PCR反应显示,PCR循环数与质粒标准品的拷贝数间存在线性关系,当标准品浓度在1×101~1×106拷贝/μl时,扩增曲线呈梯度分布。得到标准曲线Y=-3.25log(X)+38.09,测定值基本都在一条直线上,与相应的Ct值具有良好的相关性(相关系数R2=0.999953)图.1。2.建立巢式荧光定量PCR产生的扩增曲线和标准曲线本发明的巢式荧光定量PCR方法对整合HIV的定量分两步(如图2所示):①考虑到HIV病毒整合到宿主细胞基因组后的结构特点,我们分别在在HIV病毒基因组序列高保守Gag区和人体基因组的Alu重复序列上分别设计下游和上游锚定引物,利用该对引物能跨越HIV病毒整合位点上下游侧翼序列的特点,经预扩增12个循环后能特异性捕获整合的HIV基因组序列(含5’LTR部分)并能线性放大扩增子拷贝数,极大地提高了定量的特异性和灵敏度;②在预扩增PCR包含的HIV的5’LTR区域,设计一对引物和与之匹配的TaqMan探针,分别以第一轮扩增后的标准品和扩增产物作为第二轮荧光定量PCR的标准品和待测样品,进行第二轮荧光定量PCR。与标准曲线比对并读出待测样品的绝对拷贝数。待测样品整合HIV前病毒的拷贝数等于有Alu引物样品与无Alu引物的参照样品的拷贝数之差。1)12轮循环预扩增a.10倍梯度稀释已知浓度的HIV整合标准品使其线性浓度范围为101拷贝/μl-106拷贝/μl。预扩增反应体系为25μl:充分混匀并瞬时离心后准备上机EppendorfMastercyclerPCR仪运行,扩增程序如下:表2预扩增反应扩增程序说明:PCRSuperMixHighFidelity为高保真超长片段的TaqDNA聚合酶。2)第二轮荧光定量PCR扩增将第一轮预扩增后的标准品和扩增产物瞬时离心后作为第二轮荧光定量PCR的标准品和待测样品。荧光定量PCR反应液的配制如下(反应体系为25μl):充分混匀并瞬时离心后准备上机。3)巢式荧光定量PCR制备扩增曲线和标准曲线产生本发明中扩增反应使用ABI7500实时荧光定量PCR仪器(美国应用生物系统公司),扩增程序如下:以ABI7500为例,设置如表3:表3PCR扩增程序检测通道选择:荧光通道选择FAM。向ABI7500分析软件中输入预扩增时加入的HIV整合标准品拷贝数可获得各标准品管的实时扩增曲线(如图3所示),进一步以预扩增时加入的HIV整合标准品拷贝数的对数值为横坐标,Ct值为纵坐标,绘制标准曲线(如图4所示)。荧光定量PCR的实时扩增曲线中PCR循环数与HIV整合标准品的拷贝数间存在线性关系,10X稀释的标准品的Ct值严格的反应3.3个循环的差异,且当标准品浓度在1×101~1×106拷贝/μl时,扩增曲线呈梯度分布。数据线性回归分析后得到标准曲线Y=-3.28log(X)+37.8,测定值基本都在一条直线上,与相应的Ct值具有良好的相关性(相关系数R2=0.999),充分说明了该方法较高的灵敏度、特异性和稳定性。在重复性实验中,变异系数(CV)均<2%,误差小,提示该检测方法具有良好的稳定性。检测待测样品中整合HIV-1病毒基因组时,同时准备HIV整合标准品和待测样品,以无Alu引物的待测样品为参照样品,进行上述的巢式荧光定量PCR操作,待测样品和参照样品均与巢式荧光定量PCR制备的标准曲线比对并读出待测样品和参照样品的绝对拷贝数,待测样品整合HIV前病毒的拷贝数等于有Alu引物样品与无Alu引物的参照样品的拷贝数之差。实施例2:巢式荧光定量PCR在检测HIV整合前病毒的有效性验证1.实验设计在HIV感染的样品中,各种形式的病毒DNA都是共存的,为了验证该方法的特异性,实验采集健康人的全血并分离外周血淋巴细胞(PBLs),分别用逆转录酶抑制剂Abacavir(150μM)和整合酶抑制剂Raltegravir(50nM)处理两个小时后,以MOI=3感染细胞并孵育2小时后,以PBS洗两次,放入CO2培养箱继续培养48小时,离心收集并洗涤细胞。再使用QIAGEN公司的TIANampGenomicDNAKit进行DNA提取,具体操作见说明书。按照实施例1的步骤和方法进行整合HIV前病毒的定量,扩增曲线反映出样品的平行扩增管中有Alu引物管和无Alu引物管的Ct值最大可相差6以上,说明该方法在设计上的有效性。2.本发明中两种方法定量结果分析表明,Abacavir(150μM)处理样本中HIV-1DNA和整合的HIV-1DNA分别被抑制99.9%和100%,这与文献中报道Abacavir(150μM)能完全抑制逆转录酶的活力是一致的。逆转录是HIV-1生命周期的关键,是HIV-1整合的前提条件。然而,Raltegravir(50nM)处理样本中HIV-1DNA和整合的HIV-1DNA分别被抑制66%和99.83%,分别如图5(A)和图5(B)所示,也验证了文献报道的机制,其只能抑制整合这一步并不能阻止HIV-1病毒RNA逆转录成cDNA,也间接说明了整合DNA占总HIV-1DNA的三分之一。以上结果充分说明该方法的准确性和有效性。说明:所有待测样品都会设置一管无Alu引物的平行扩增管作为参照样品。实施例3:HIV-1感染者的血液样本中HIV整合前病毒定量检测1.样本的处理(在BSL-2+级实验室进行)经医院伦理委员会通过和病人签订知情同意书之后,14例HIV-1感染者的血液样本被采集。外周血单个核细胞(peripheralbloodmononuclearcells,PBMC)的分离:14例HIV感染者均抽取10mlEDTA抗凝静脉血,标本采集按照《全国艾滋病检测技术规范》,在采血后4h内以淋巴细胞分离液(Ficoll)分离获到PBMC,再使用QIAGEN公司的TIANampGenomicDNAKit进行DNA提取,具体操作见说明书。2.巢式荧光定量PCR检测血液样本中HIV整合前病毒按照本发明的技术方案中步骤1)的方法定量待测样品中HIV总DNA,按照实施例1的步骤和方法定量整合HIV前病毒,定量整合HIV前病毒时所有待测样品均会设置一管无Alu引物的平行扩增管作为参照样品。检测结果如图6(A)和图6(B)所示。其中图6(A)表示外周血细胞总HIV-1DNA的拷贝数,图6(B)表示整合的HIV-1DNA的拷贝数,结果分析表明外周血细胞总HIV-1DNA的拷贝数是整合的HIV-1DNA的拷贝数的9倍,说明用总HIV-1DNA的拷贝数来代替整合的HIV-1DNA的拷贝数作为参考来评估病人体内病毒“储藏库”是不准确的,同时也突出了建立巢式荧光定量PCR来准确定量整合的前病毒拷贝数的重要性和必要性,也是判断评估临床治疗效果和病人是否被治愈的最有效方法。实施例4:HIV-1感染者的脑部组织样本中HIV整合前病毒定量检测1.样本的处理(在BSL-2+级实验室进行)经医院伦理委员会通过后,获得14例HIV-1感染者的脑部组织样本,切取1mg左右灰质或白质放入200μlTrizol(Invitrogen)中充分研磨后,转移100μl研磨混合物到900μlDNAzol中,充分吹打后加入500μl无水乙醇,14000rpm离心15分钟,用1ml75%无水乙醇洗两次,加入8mM的NaOH,4℃过夜后用1MHEPES缓冲液调节pH=8.5后置于-80℃低温保存。2.巢式荧光定量PCR在检测HIV-1感染者的脑部组织样本中HIV整合前病毒按照本发明的技术方案中步骤1)的方法定量待测样品中HIV总DNA,按照实施例1的步骤和方法定量整合HIV前病毒,定量整合HIV前病毒时所有待测样品均会设置一管无Alu引物的平行扩增管作为参照样品。检测数据如表4和图7所示。表4HIV-1感染者的脑组织中检测的整合HIVDNA和HIV总DNA样品totalDNA拷贝数IntegratedDNA拷贝数Total/INT531g73.5315.004.90500g306817.675271.5158.20537w107882.668707.8712.40537g405229.3026838.8215.10017w84744.22683.10124.10017g187315.7310058.2118.60070w192800.119006.7321.40070g85250.4727336.293.10013g9400.64888.0010.59509w352.569.7036.30509g329.3614.0023.53133w3429.26191.5717.90133g140.9546.543.00103w59517.6114168.144.20根据以上数据计算出脑组织样本中总HIV-1DNA的拷贝数与整合的HIV-1DNA的拷贝数的比值的平均值为25,即脑组织样本中总HIV-1DNA的拷贝数是整合的HIV-1DNA的拷贝数的25倍,检测结果表明在脑组织细胞中HIV-1DNA主要是以非整合的形式存在,如果用总HIV-1DNA的拷贝数来代替整合的HIV-1DNA的拷贝数作为参考来评估病人体内病毒‘储藏库’是不准确的。结果分析更凸显了建立巢式荧光定量PCR来准确定量整合的前病毒拷贝数的重要性和必要性,除了可以用来判断脑部是否被感染和用药后的治疗效果,也可以确定HIV-1是否在大脑中建立病毒储藏库并在进一步研究储藏库与HIV-1诱导神经损伤的相互关系中发挥重要作用。序列表<110>武汉科技大学<120>一种检测整合HIV-1病毒基因组的核酸扩增荧光定量方法及其应用<160>9<170>SIPOSequenceListing1.0<210>1<211>22<212>DNA<213>人工序列(ArtificialSequence)<400>1tgggaccacaggctacactaga22<210>2<211>23<212>DNA<213>人工序列(ArtificialSequence)<400>2cagccaaaactcttgctttatgg23<210>3<211>24<212>DNA<213>人工序列(ArtificialSequence)<400>3tgatgacagcatgccagggagtgg24<210>4<211>23<212>DNA<213>人工序列(ArtificialSequence)<400>4tcacacaacagacgggcacacac23<210>5<211>21<212>DNA<213>人工序列(ArtificialSequence)<400>5tgctgggattacaggcgtgag21<210>6<211>22<212>DNA<213>人工序列(ArtificialSequence)<400>6cgagaccatcctggctaacacg22<210>7<211>23<212>DNA<213>人工序列(ArtificialSequence)<400>7ctggctaattagggaacccactg23<210>8<211>25<212>DNA<213>人工序列(ArtificialSequence)<400>8ggactaaacggatctgagggatctc25<210>9<211>27<212>DNA<213>人工序列(ArtificialSequence)<400>9ttaccagagtcacacaacagacgggca27当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种禽传染性支气管炎病毒S1基因与禽IL-18基因共表达DNA疫苗pIRES-S1/IL18的制作方法
- 抑制流感病毒复制的宿主相关基因及其筛选方法和应用的制作方法
- 抗h5n1来源的血凝素蛋白的单克隆抗体及其应用的制作方法
- 用于诊断流感a病毒的h5和n1基因的存在的寡核苷酸,其用途,检测方法和试剂盒的制作方法
- 编码h5亚型禽流感病毒血凝素蛋白的基因及其应用的制作方法
- 一种禽流感病毒非结构蛋白基因ns1及其制备方法与应用的制作方法
- 编码禽流感血凝素的基因及其植物表达载体和应用的制作方法
- 一种h9n2亚型禽流感病毒三个基因的多重逆转录扩增方法
- 抑制流感病毒相关基因的siRNA及其应用的制作方法
- 牛副流感病毒的合成基因的制作方法