一种高效聚合蛋白质的方法与流程
本发明属于生物医药领域,涉及一种快速聚合蛋白质的方法。
背景技术:
许多天然蛋白质由于分子量过小不容易被机体吸收,通过聚合或者修饰手段增大其分子量或分子半径后,在保留其原有一些生物特性之外也可形成新的性质,如胶体渗透压降低、半衰期增长等,可应用于生物医药领域。
目前蛋白质聚合使其分子量增大主要应用于血红蛋白氧载体领域,通过多醛基分子将蛋白质表面的氨基通过希夫氏碱反应将蛋白质交联起来增大其分子量。聚合方法通常是在蛋白质溶液中直接加入戊多醛、氧化棉子糖等多醛基分子使蛋白质聚合,最终形成由未聚合蛋白质和不同聚合度的蛋白质混合的一种蛋白质混合物。由于这种方法中仍有大量未聚合的蛋白质,一般需要在聚合过程完成后再用其它的方法予以去除。去除过程较为繁琐,时间较长。
另外一种聚合蛋白质的方法,是将蛋白质吸附在离子交联树脂上,然后装填在层析柱上,加入戊多醛使蛋白质交联,用还原剂将希夫氏碱还原后,将聚合的蛋白质洗脱下来。该方法聚合的混合物中仍含有大量的未聚合的蛋白质,仍需要后续的纯化步骤将未聚合的蛋白质去除。
技术实现要素:
为了克服上述方法的缺点,本发明提出一种高效聚合蛋白质的方法,可极大的降低聚合蛋白质混合物中未聚合蛋白质的比例,无需后续的去除未聚合蛋白质的步骤,聚合反应时间短,聚合过程简便。
本发明的原理是:
本发明首先利用固相吸附蛋白,然后加入预反应的多醛进行聚合反应。蛋白经过被固相吸附,使得体系之中的蛋白分子彼此之间的空间距离不同,彼此距离近的蛋白分子发生聚合,而空间距离较远的分子则不会聚合,这就使得所得的产物分子量并不会特别大。同时经过与二醇的预反应将多醛中的一部分醛基进行了保护,在聚合反应进行的过程中不断有醛基脱保护参与到聚合反应中,这使得聚合反应更加均一。聚合完成后,加入还原剂将希夫氏碱的双键还原成稳定的单键,洗涤去除其他反应物和反应产物,得到聚合蛋白。所得的聚合血红蛋白与传统工艺制备的血红蛋白分子相比,由于反应时间短更容易洗脱,分子量均一且产物中不含有单体分子,省去了传统工艺中最后一步分离或截留的步骤,极大的节省了生产成本。
本发明的方案如下:
该高效聚合蛋白质的方法,包括以下步骤:首先将固相吸附介质与蛋白质混合,所述固相吸附介质为阴离子交换树脂或阳离子交换树脂;待蛋白质被吸附于固相吸附介质上后,洗涤去除未吸附于固相吸附介质上的蛋白质;然后加入多醛基分子将蛋白质进行聚合;聚合完成后,加入还原剂将希夫氏碱的双键还原成稳定的单键,洗涤去除其他反应物,得到聚合蛋白。
基于以上方案,本发明进一步对各个具体步骤作了如下优化:
在固相吸附介质与蛋白质混合前,先进行:
步骤1)对固相吸附介质进行预处理:
在固相吸附介质加入所述多醛基分子(该环节采用的“多醛基分子”与后面的聚合反应环节加入的“多醛基分子”为同一物质),多醛基分子与固相吸附介质上可能的与醛基能够起反应的基团进行反应;然后加入所述还原剂(该环节采用的“还原剂”与后面的聚合反应环节加入的“还原剂”为同一物质)继续反应,对还原生成的产物以及多余的多醛基分子离心并弃掉上清,用缓冲液重复洗涤至干净;
步骤2)多醛基分子的预处理:
将多醛基分子溶液与多醇羟基分子溶液按照摩尔比为1:40-1:100的比例进行混合,加入酸进行催化,使溶液ph为4-7,反应温度为0—40℃。
上述多醛分子可以是戊二醛、丙二醛等;多醇羟基分子可以是乙二醇、丙三醇等。
上述步骤1)中,加入的多醛基分子的浓度为0.01m-0.5m;固相吸附介质与多醛基分子溶液的体积比为1:2-1:30;还原剂加入的量为多醛基分子溶液体积的1.5倍至50倍;反应0.5小时以上;步骤2)中,加入的酸为硫酸、盐酸或磷酸,反应时间为40min以上。
上述固相吸附介质与蛋白质混合进行吸附具体为:
步骤3)吸附:将浓度为10-40mg/ml蛋白质ph调至高于或低于其等电点0.5-3个单位,然后加入离子交换树脂中进行吸附,蛋白质ph高于其等电点则选用阴离子交换树脂,蛋白质ph低于其等电点则选用阳离子交换树脂;待吸附完成后,离心去上清,重复洗涤3次以上。
上述加入多醛基分子将蛋白质进行聚合具体为:
步骤4)聚合:加入预处理多醛基分子进行聚合反应;按照多醛基分子与固相吸附介质的体积比为1:15至1:50添加,反应温度为0-40℃,反应时间1h以上;对于多余多醛基分子,加入多醛基分子体积比为1:1.5-1:20的所述还原剂终止反应,还原剂的浓度为30%-90%;再用缓冲液重复洗涤3次以上,去除去多余还原剂。
在步骤4)之后,还进行步骤5)洗脱:用固相吸附介质体积1.5-45倍的0.5m以上的nacl将聚合后的蛋白洗脱下来并收集。
上述还原剂为硼氢化钠或二甲基胺硼烷。
本发明具有以下优点:
1、聚合效率高,可极大的降低聚合蛋白质混合物中未聚合蛋白质的比例,无需后续的去除未聚合蛋白质的步骤。
2、固相介质可重复使用,吸附蛋白质的效率不会明显降低。
3、聚合反应时间短,聚合过程简便。
附图说明
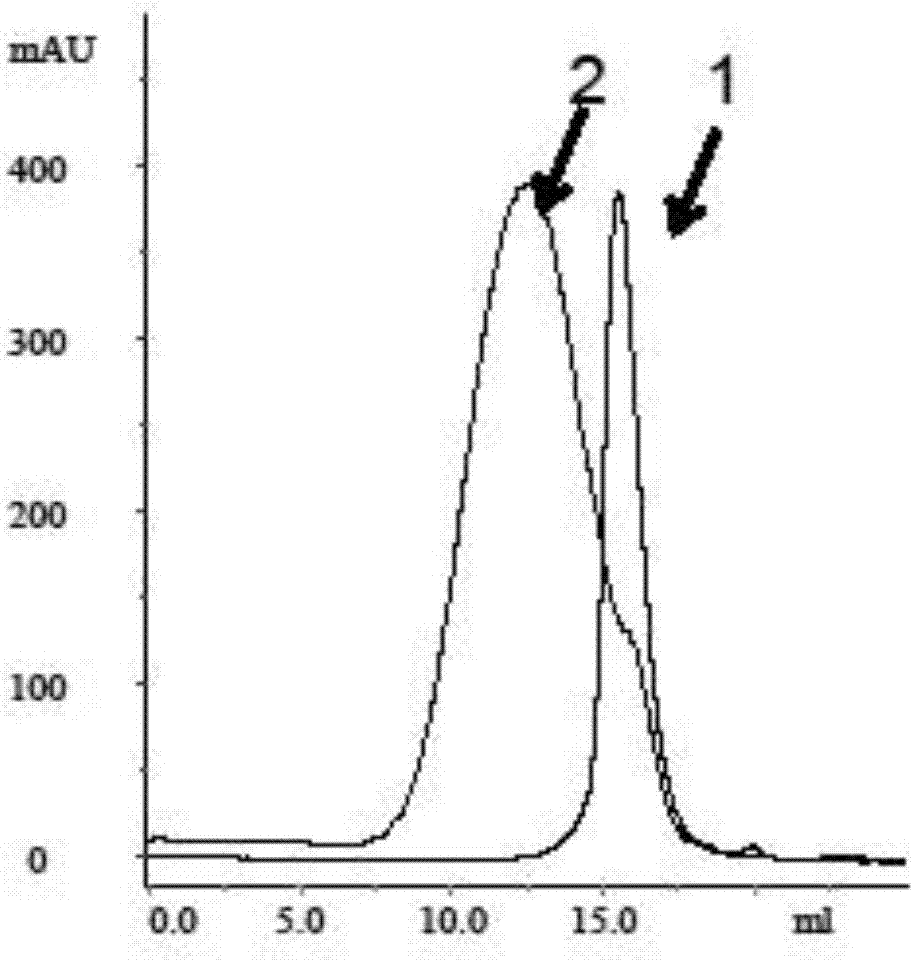
图1为实施例1的聚合后的蛋白质凝胶过滤分析图谱,其中:1-未聚合的蛋白质,2-聚合后的蛋白质。
图2为实施例2的聚合后的蛋白质凝胶过滤分析图谱,其中:1-未聚合的蛋白质,2-聚合后的蛋白质。
具体实施方式
本发明的实现步骤具体如下:
1、固相介质的预处理:在固相介质加入多醛基分子,多醛基分子与固相介质上可能的与醛基能够起反应的基团进行反应,还原生成的产物以及多余的多醛基分子,离心并弃掉上清,用缓冲液重复洗涤至干净。该步骤的好处在于在后面的聚合反应中可以避免加入的多醛基分子将蛋白质交联于固相介质上,使得固相介质的吸附蛋白位点减少;经过预处理的固相介质多次使用吸附位点基本保持不变。
固相介质可以是阴离子交换树脂和阳离子交换树脂。
多醛基分子的浓度为0.01m-0.5m。
介质与多醛基分子溶液的体积比为1:2-1:30。
反应0.5小时以上。
还原剂加入的量为多醛基分子溶液体积的1.5倍至50倍。
还原剂可以是硼氢化钠、二甲基胺硼烷等。
2、多醛基分子的预处理:将多醛基分子和多醇羟基分子进行混合,加入酸进行催化,使溶液ph为4-7,反应温度为0—40℃,反应时间为40min以上。
多醛基分子溶液和多醇羟基分子溶液按照摩尔比为1:40-1:100的比例混合;
加入酸可以是硫酸、盐酸、磷酸等。
3、吸附:将浓度为10-40mg/ml蛋白质ph调至高于或低于其等电点0.5-3个单位,然后加入至离子交换树脂中进行吸附,蛋白质ph高于其等电点时选用阴离子交换树脂,蛋白质ph低于其等电点时选用阳离子交换树脂,待吸附完成后,离心去上清,重复洗涤3次以上。
4、聚合:加入预处理多醛基分子进行聚合反应;按照多醛与介质的体积比为1:15-1:50添加,反应温度为0-40℃,反应时间1h以上,多余多醛,加入多醛体积比为1:1.5-1:20的还原剂终止反应,还原剂的浓度为30%-90%;用缓冲液重复洗涤3次以上,去除去多余还原剂。
5、洗脱:最终用介质体积1.5倍至45倍的0.5m以上的nacl将聚合后的蛋白洗脱下来并收集。
下面结合实施例来进一步描述本发明。
实施例1用阴离子交换树脂制备聚合蛋白
(1)介质的预处理:取10mldeae琼脂糖(阴离子交换树脂)中加入20ml0.02m的戊二醛,与固相介质上可能的与醛基能够起反应的基团进行反应,反应1小时,加入20ml0.8m的硼氢化钠,还原生成的产物以及多余的戊二醛,1000r/min离心并弃掉上清,用缓冲液重复洗涤5次。并对未反应的多醛进行终止,用15mm的磷酸盐缓冲液洗去体系中多醛及还原剂,并将固相介质的ph调至9。
(2)多醛基分子的预处理:将戊二醛和丙三醇按照摩尔比为1:40的比例混合,混合后体积为15ml,加入10微升1.5m盐酸进行催化,使溶液ph为6,反应温度为40℃,反应时间为50min。
(3)蛋白质的吸附:将浓度为25mg/ml的血红蛋白ph调至8.0,然后取15ml加入至离子交换树脂中进行吸附,待吸附完成后,离心去上清,重复洗涤5次。
(4)聚合:加入15ml经过预处理的多醛进行聚合反应。反应温度为40℃,反应时间1h。用缓冲液洗去未反应的戊二醛,再加入0.5ml硼氢化钠终止反应,然后用15mm的磷酸盐缓冲液洗去多余还原剂。
(5)洗脱:用与介质体积比为30ml的0.5mnacl将聚合后的血红蛋白洗脱下来并收集。
从图1中可以看出,未聚合的小分子含量极少,聚合反应效率较高。
实施例2用阳离子交换树脂制备蛋白
(1)介质的预处理:取10mlh型阳离子交换树脂中加入20ml0.05m的丙二醛,与固相介质上可能的与醛基能够起反应的基团进行反应,反应0.5小时,加入20ml的0.5m二甲氨基硼烷,还原生成的产物以及多余的丙二醛,1000r/min离心并弃掉上清,用15mmhepes缓冲液重复洗涤5次。并对未反应的多醛进行终止,用缓冲液洗去体系中其他残留,并将固相介质的ph调至6。
(2)多醛基分子的预处理:将丙二醛和乙二醇按照摩尔比为1:60的比例混合,终体积为15ml,加入10微升1.5m硫酸进行催化,使溶液ph为5.5,反应温度为4℃,反应时间为80min。.
(3)蛋白质的吸附:将浓度30mg/ml的牛血清白蛋白ph调至6.5,然后取15ml加入至阳离子交换树脂中进行吸附,待吸附完成后,离心去上清,重复洗涤3次。
(4)聚合:加入15ml经过预处理的多醛进行聚合反应。反应温度为4℃,反应时间1.5小时。用缓冲液洗去未反应的多醛,再加入0.5m二甲氨基硼烷终止反应,然后用15mmhepes缓冲液洗去多余还原剂。
(5)洗脱:最终用40ml1mnacl将聚合后的蛋白洗脱下来并收集。
从图2中可以看出,未聚合的单体含量没有出现明显的峰,单体含量极少聚合效率较高。
- 还没有人留言评论。精彩留言会获得点赞!